La diabetes mellitus tipo 2 (DM2) es una de las enfermedades con mayor impacto sociosanitario, dadas su elevada prevalencia, sus complicaciones crónicas y la alta mortalidad que comporta1. Los pacientes con DM2 tienen un incremento de 3-4 veces en la morbimortalidad cardiovascular, que es la principal causa de muerte. Las repercusiones de las complicaciones microvasculares (retinopatía, nefropatía y neuropatía) y del pie diabético afectan notablemente a la calidad de vida de estos pacientes y suponen un elevado coste para el sistema sanitario. El control de la diabetes mellitus ha demostrado ser capaz de reducir la incidencia de las complicaciones microvasculares en las personas con DM22-5. En cuanto a la prevención de las complicaciones macrovasculares, es aún debatible la influencia del control estricto de la glucemia sobre la morbilidad y mortalidad cardiovasculares, aunque estudios como el DIGAMI muestran que el estricto control glucémico postinfarto disminuye la mortalidad cardiovascular a largo plazo. El tratamiento de la hiperglucemia se contempla como parte del abordaje integral del conjunto de factores de riesgo que presentan estos pacientes como, por ejemplo, la hipertensión arterial, el tabaquismo o la dislipemia. Así, en el estudio de Steno se ha demostrado definitivamente que un abordaje multifactorial del conjunto de factores de riesgo cardiovascular presentes en el diabético tipo 2 es capaz de reducir la aparición de complicaciones microvasculares y de la enfermedad cardiovascular (en un 50% aproximadamente)4.
Objetivos del tratamiento
Los objetivos del tratamiento de los pacientes afectados de DM2 van más allá de la simple normalización de la glucemia e incluyen:
1.Desaparición de los síntomas derivados de la hiperglucemia.
2.Evitar las descompensaciones agudas de la enfermedad.
3.Evitar o retrasar la aparición o progresión de las compli-caciones crónicas: a) microangiopáticas (retinopatía, nefropatía y neuropatía diabéticas), y b) macroangiopáticas (cardiopatía isquémica, enfermedad cerebrovascular y arteriopatía periférica).
4. Disminuir la tasa de mortalidad.
5. Mantener una buena calidad de vida.
Los objetivos terapéuticos deben ser más estrictos en los pacientes más jovenes, ya que tienen más posibilidades de desarrollar cualquiera de las complicaciones diabéticas. En pacientes ancianos (mayores de 75 años) o con una esperanza de vida muy limitada no es necesario, o incluso puede ser peligroso, un control glucémico estricto, por lo que debe evitarse el sobretratamiento.
Criterios de control
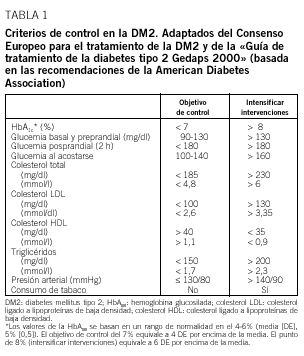
La hemoglobina glucosilada (HbA1c) constituye el mejor parámetro de control glucémico, ya que se correlaciona con la aparición de complicaciones micro y macrovasculares a largo plazo y porque proporciona información sobre el grado de control en los 2-4 meses previos. En estudios epidemiológicos se ha observado que a partir de valores superiores a 8% aumentan las complicaciones micro y macrovasculares. En estudios de intervención como el UKPDS2 y el Steno4, los beneficios en los grupos de tratamiento intensivo se obtuvieron con valores de HbA1c medios próximos al 7%. A la luz de dichos estudios, tanto el Consenso Europeo para el tratamiento de la DM25 como las recomendaciones de la American Diabetes Association (ADA)6 proponen unos criterios de HbA1c basados en el intervalo de normalidad utilizado en el estudio DCCT (4-6%; media [DE] 5 [0,5]%). Sin embargo, mientras que el Consenso Europeo considera buen control una HbA1c inferior al 6,5% y aceptable una HbA1c inferior al 7,5%, la ADA considera como objetivo terapéutico una HbA1c inferior al 7%5. En nuestro país, la Guía del GEDAPS propone como objetivo una HbA1c inferior al 7% e intensificar las medidas terapéuticas cuando la HbA1cc es superior al 8%, y establece como indicador de resultados intermedios el porcentaje de pacientes con HbA1c inferior al 8% (media + 6 DE)7 (tabla 1).
Actualmente se da tanta importancia a la normalización de los parámetros glucémicos como a la del resto de los factores de riesgo cardiovascular: presión arterial, lípidos, índice de masa corporal y abandono del hábito tabáquico6-8. La presencia de diabetes mellitus comporta un riesgo elevado de enfermedad cardiovascular, hasta el punto de que se ha comparado con el que representa la presencia de enfermedad cardiovascular previa. Ello indica que los objetivos de control de los factores de riesgo en las personas con DM2 han de ser estrictos y que una intervención, aunque sea modesta, sobre todos y cada uno de ellos será preferible a una de gran intensidad sobre sólo algunos de ellos.
Bases para el tratamiento
En la fisiopatología de la DM2 intervienen varias alteraciones que contribuyen en mayor o menor grado a la disfunción metabólica que provoca la hiperglucemia. Los distintos tratamientos farmacológicos inciden más o menos específicamente en algunas de estas alteraciones. Aunque no son absolutamente independientes unas de otras, pueden desglosarse en las dos siguientes causas:
1. Resistencia a la insulina: defectos en la sensibilidad a la insulina en el tejido muscular (predominio de la hiperglucemia posprandial) y del hígado (predominio de la hiperglucemia en ayunas). Suele acompañarse de un fenotipo obeso/sobrepeso.
2. Defectos de secreción de insulina: falta del pico de secreción temprana y déficit de secreción global de insulina. Habitualmente se traduce en un fenotipo de normopeso-delgadez.
Si los fármacos disponibles para el tratamiento de la DM2 inciden en la corrección de alteraciones distintas, parece lógico y plausible que su combinación pueda ser eficaz.
Abordaje terapéutico
A diferencia de lo que ocurre en el tratamiento de la diabetes mellitus tipo 1, que se basa universalmente en la combinación de insulina, dieta y ejercicio físico, el de la DM2 es muy variable en función de las características del paciente y del estadio evolutivo de la enfermedad. El tratamiento de un paciente con DM2 va desde la abstención del uso de fármacos (tratamiento únicamente dietético y ejercicio físico) a la utilización de los diferentes tipos de fármacos orales o bien la administración de insulina, todos ellos solos o en diferentes combinaciones. Por tanto, es fundamental reconsiderar periódicamente la efectividad del tratamiento. Los cambios estarán motivados por diversos aspectos de la evolución de la enfermedad, como son el estado ponderal (obesidad o normopeso), grado de resistencia a la insulina, grado de déficit de secreción de insulina, grado de control metabólico y la cifra de HbA1c, predominio de la hiperglucemia en ayunas o bien en estadio posprandial, así como de la existencia de las distintas complicaciones crónicas u otros procesos concomitantes (insuficiencia renal, cardíaca o hepática).
Aunque siempre se debe individualizar el tratamiento, el esquema terapéutico general propuesto por diferentes guías terapéuticas6-8 es básicamente el siguiente:
1.El tratamiento inicial ante un paciente al que se le diagnostica la enfermedad y que no presenta criterios de insulinización inmediata consiste en una dieta adecuada a su estado ponderal (hipocalórica en caso de sobrepeso y normocalórica en caso de normopeso) y una pauta de ejercicio físico adecuada.
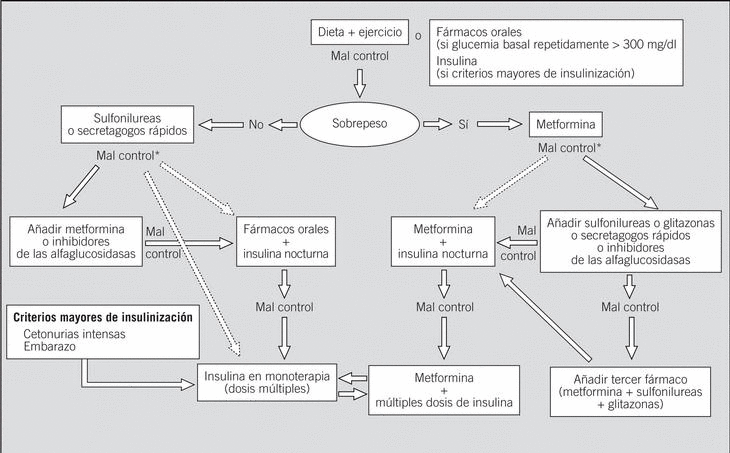
2. Cuando a pesar de estas medidas, tras un tiempo prudencial, no se consigue un control adecuado, la tendencia actual es iniciar un tratamiento farmacológico de forma relativamente temprana. Si el paciente presenta sobrepeso u obesidad y no existen contraindicaciones, la metformina es el fármaco de elección, ya que tiene claras ventajas sobre el resto de los fármacos orales al inhibir la producción hepática de glucosa, mejorar la sensibilidad a la insulina y no comportar aumento de peso. Si el control no es adecuado, puede asociarse una sulfonilurea (SU), una glitazona, un secretagogo de acción rápida o un inhibidor de las alfaglucosidasas. En el paciente con normopeso, si el tratamiento dietético fracasa, se recomienda instaurar un fármaco que estimule la secreción de insulina (secretagogos). En este caso son de elección las SU por su mayor experiencia de uso, pero también cabe considerar los secretagogos de acción rápida. Si el control no es adecuado, puede asociarse a la SU otro fármaco como la metformina, los inhibidores de las alfaglucosidasas o las glitazonas.
3.Por último, si fracasa el tratamiento con fármacos hipoglucemiantes, solos o combinados, debe pasarse al tratamiento con insulina sola o asociada a fármacos orales.
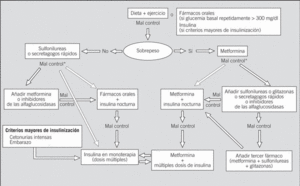
En la figura 1 se presenta el algoritmo de tratamiento.
Fig. 1. Algoritmo de tratamiento de la diabetes tipo 2. *Valorar una u otra opción en función del grado de hiperglucemia y de las características individuales de cada caso.
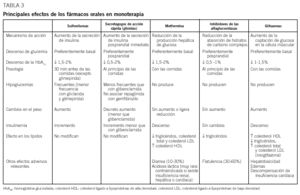
Tratamiento con fármacos orales en monoterapia
El tratamiento inicial en la DM2 consiste en establecer un plan de alimentación y actividad física adecuados que permita controlar las cifras de glucemia. Estas medidas, a la larga, son insuficientes en la mayoría de los pacientes, por lo que tras aproximadamente 3 o 6 meses sin conseguir un control metabólico aceptable, y en ausencia de criterios de insulinización, se debe instaurar tratamiento con un fármaco oral. Los cambios en el tratamiento, basados en los valores de HbA1c, deben ser tempranos para prevenir las complicaciones o retrasar su progresión si ya están presentes6-11.
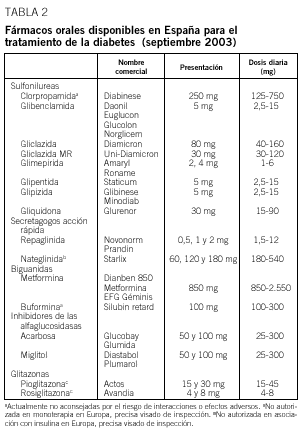
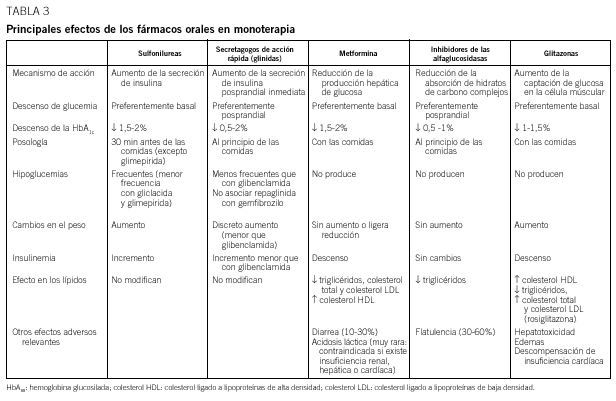
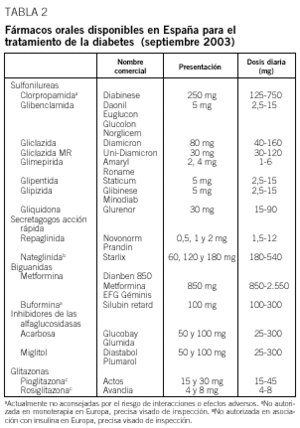
Debe considerarse siempre la necesidad de insulinización cuando el paciente presenta síntomas hiperglucémicos graves junto a una glucemia basal mayor de 300 mg/dl. Con cierta frecuencia, tras un cierto tiempo y una vez conseguido un control aceptable, se puede suspender la insulina y reemplazarla por un fármaco oral, ya que al mejorar el control se reduce la glucotoxicidad de la hiperglucemia y mejora la sensibilidad a la insulina. Se considera necesaria una insulinización transitoria cuando aparecen enfermedades intercurrentes graves (infecciones), cirugía mayor, en la fase aguda de un infarto de miocardio y durante el embarazo y la lactancia. En la tabla 2 se relacionan los fármacos orales disponibles en nuestro país y en la tabla 3, las características principales de cada uno de los grupos de fármacos orales disponibles.
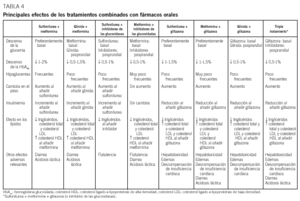
Tratamiento combinado con fármacos orales
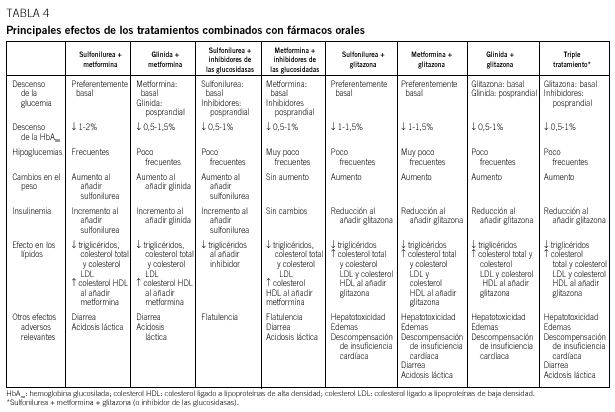
Cuando se inicia el tratamiento farmacológico en monoterapia, hasta un 30% de los pacientes responden de manera insuficiente. Este fenómeno, conocido como «fracaso primario» y atribuido al principio únicamente a las SU, se ha descrito también con el resto de fármacos orales y tiene relación con el grado de hiperglucemia9. En la mayoría de los casos, sin embargo, se puede conseguir un control aceptable que puede durar varios años, tras los cuales se observa un progresivo empeoramiento del control metabólico independientemente del fármaco utilizado. Este fenómeno, conocido como «fracaso secundario», es debido a la pérdida progresiva de la secreción de insulina, forma parte de la evolución natural de la DM2 y está determinado genéticamente. Se estima que hasta un 10% de pacientes/año dejan de responder a la monoterapia. En el estudio UKPDS, al cabo de 9 años del tratamiento en monoterapia (SU, metformina e insulina), menos del 25% de los pacientes presentaban valores de HbA1c inferior al 7%12. Para mejorar el control glucémico en esta situación, actualmente todas las guías de tratamiento proponen añadir un segundo fármaco oral6-11. En algunos casos podría considerarse la posibilidad de utilizar insulina sola o asociada a un fármaco oral, pero la menor aceptación del tratamiento insulínico por parte de los pacientes probablemente condiciona esta posibilidad (fig. 1). La justificación del tratamiento combinado se basa no sólo en el fracaso de la monoterapia a largo plazo, sino en el hecho, avalado por diferentes estudios, de que es factible aprovechar el efecto sinérgico de los diferentes mecanismos de acción de los fármacos9-11. El tratamiento combinado permite, además, utilizar menores dosis de los fármacos, lo que puede reducir la frecuencia o gravedad de los efectos adversos (generalmente dependientes de la dosis), con una efectividad superior. En la tabla 4 se presentan resumidas las ventajas e inconvenientes de las diferentes pautas de tratamiento combinado. Aunque todos los fármacos podrían actúar sinérgicamente, no se recomienda en general la asociación de una SU con una glinida, ya que el modo de acción de inicio y fin rápido de las glinidas sobre el receptor de la célula queda anulado por la acción mantenida de la SU. Tampoco se dispone de experiencias publicadas con la asociación de glinidas e inhibidores de las alfaglucosidasas. Dado que ambos fármacos actúan sobre la fase posprandial, no parece recomendable su asociación.
Sulfonilurea-metformina
Constituye la asociación con más experiencia de uso y la que es potencialmente más beneficiosa ya que incide en los 2 principales mecanismos fisiopatológicos de la DM2: la insulindeficiencia (SU) y la insulinorresistencia (metformina). La adición de metformina a pacientes tratados con SU disminuye la glucemia basal en un 25-30% y la HbA1c en 1,5-2 puntos sin aumentar significativamente el número de hipoglucemias9,10. También se ha observado una disminución entre el 10 y el 15% del colesterol total, colesterol unido a lipoproteínas de baja densidad y triglicéridos y un aumento de colesterol unido a lipoproteínas de alta densidad.
En el estudio de DeFronzo et al13, 422 pacientes con un control deficiente con glibenclamida fueron asignados a placebo o metformina durante 29 semanas. En el grupo de placebo la HbA1c aumentó en 0,2 puntos, mientras que en el de metformina se redujo en 1,7 puntos, por lo que el beneficio de la adición de metformina fue de 1,9 puntos13. Por su parte, el estudio de Hermann et al14 estableció que la mejora en la HbA1c es independiente del fármaco con que se inicie el tratamiento. Así, 144 pacientes tratados únicamente con dieta fueron aleatorizados a empezar por glibenclamida, metformina o la asociación de ambas14. Al cabo de 6 meses, los descensos de la HbA1c fueron del 2,3% para los que empezaron por metformina, del 2,0% para los que empezaron por glibenclamida y del 2,2% para los que empezaron con ambas a la vez. Todos los pacientes consiguieron valores de HbA1c inferiores al 7%. Sin embargo, los beneficios atribuibles a la adición de uno u otro fármaco respecto a la monoterapia fueron menores que los obtenidos por DeFronzo et al: un 1% para la glibenclamida y un 0,9% para la metformina14. Aunque la mayor parte de los estudios se han realizado con glibenclamida, cabe esperar mejoras similares con otras SU, y probablemente con menores efectos adversos. Por ejemplo, en el estudio de Charpentier et al15, en el que 372 pacientes fueron asignados a seguir con metformina, cambiar a glimepirida o a la adición de glimepirida durante 5 meses, esta última comportó una reducción adicional de 0,8 puntos de HbA1c15. Recientemente se ha hecho hincapié en el inicio del tratamiento con 2 fármacos a dosis bajas. De hecho, en numerosos países se halla disponible ya una presentación de 2,5 mg de glibenclamida y 500 mg de metformina, con la intención de iniciar el tratamiento combinado desde el principio, habiéndose mostrado igual o más eficaz pero con menos efectos adversos que la monoterapia14,16.
Mortalidad relacionada con la asociación de sulfonilureametformina. En el estudio UKPDS se probó esta asociación mediante la asignación aleatoria a tratamiento durante 3 años con metformina en un subgrupo de pacientes con mal control a pesar de dosis plenas de SU (clorporpramida o glibenclamida)3. Se observó un aumento significativo de la mortalidad relacionada con la diabetes (riesgo relativo = 1,96; p = 0,0039) frente al grupo que recibió placebo, lo que ponía en cuestión la seguridad de esta combinación4. Los autores atribuyeron este hecho al azar, ya que, además del pequeño número de eventos y el corto tiempo de seguimiento (3 años), ambos grupos presentaron una mortalidad menor que la esperada en comparación con el total de la cohorte del estudio. De hecho, aunque la mortalidad fue mayor en los pacientes tratados con la combinación, el número total de acontecimientos cardiovasculares fue similar. El metaanálisis de todos los pacientes tratados con la combinación en el UKPDS muestra una reducción no significativa de la mortalidad relacionada con la diabetes del 5% (p = 0,78)3. Para contribuir a la polémica, un estudio observacional retrospectivo sueco observó un incremento de la mortalidad total (odds ratio [OR] = 1,63) y coronaria (OR = 1,73) en 169 pacientes tratados con la asociación frente a 741 que recibían sólo SU17. Sin embargo, tal como reconocen los propios autores, el hecho de que el tiempo de evolución y la gravedad de la diabetes fueron mayores en los tratados con la combinación resta validez a este hallazgo17. Recientemente se ha publicado un estudio epidemiológico observacional canadiense con un tamaño muestral y tiempo de seguimiento mayores (5,1 años de seguimiento medio) en el que se comparan la mortalidad cardiovascular y total desde el momento que los pacientes iniciaban el tratamiento con SU (n = 3.033), metformina (n = 1.150) o la combinación de ambas (n = 4.683). Las OR en el grupo tratado con metformina y SU respecto a los tratados con SU en monoterapia fueron de 0,66 (mortalidad total) y 0,64 (mortalidad cardiovascular)18. Actualmente, a pesar de estas controversias, se acepta que esta asociación es segura y de elección cuando fracasa cualquiera de los 2 fármacos en monoterapia6-11.
Sulfonilurea-inhibidor de las alfaglucosidasas
La adición de un inhibidor de las alfaglucosidasas (acarbosa o miglitol) a una SU contribuye a controlar la glucemia posprandial y disminuye la HbA1c del 0,5 al 1% sin que se observen cambios en las concentraciones de insulina ni aumento de las hipoglucemias20-23. Podría ser de utilidad cuando existe contraindicación a otros fármacos orales (metformina o glitazonas), pero se debe tener en cuenta que sus resultados son inferiores a los de la asociación de SU con metformina y su coste es mayor.
Existe mayor experiencia con la acarbosa que con el miglitol. La acarbosa se utilizó en el estudio UKPDS en combinación (añadida al tratamiento que ya tomaba el paciente) durante 3 años19. En el grupo que estaba siendo tratado con SU se observó una reducción significativa de 0,5 puntos de la HbA1c en los pacientes que al finalizar el período seguían tomando acarbosa, aunque fue menor, y sin significación estadística, en el análisis por intención de tratar (0,2 puntos)19. En el estudio de Chiasson et al20, se obtuvo una reducción de 0,9 puntos en los 103 pacientes tratados con SU que fueron asignados a acarbosa o placebo durante un año20. Disponemos de 2 estudios comparativos de la asociación de SU con metformina o acarbosa en los que ésta no fue superior a metformina22,23. En cuanto al miglitol, en el estudio de Johnston et al, realizado en 192 pacientes, la asociación con SU durante 14 semanas comportó una reducción de 0,8 puntos en la HbA1c24.
Debe tenerse en cuenta el riesgo de hipoglucemia, que debe tratarse con glucosa pura (ya que la sacarosa, azúcar común, es un disacárido), así como los frecuentes efectos secundarios gastrointestinales.
Metformina-inhibidor de las alfaglucosidasas
Podría ser de utilidad cuando existe contraindicación a otros fármacos orales (glitazonas o SU), pero teniendo en cuenta que sus resultados son inferiores a los de la asociación de SU con metformina y su coste es mayor. Además, cabe considerar el riesgo de que se potencien sus efectos secundarios. En cuanto al riesgo de interacciones, aunque se ha descrito la interferencia en la biodisponibilidad de la metformina, no parece tener relevancia clínica.
Existe bastante experiencia con la asociación de metformina con acarbosa y menos con miglitol. En el ensayo con acarbosa del estudio UKPDS se observó a los 3 años una reducción no significativa de 0,7 puntos en los pacientes tratados con metformina que, al finalizar el período de estudio seguían tomando acarbosa y de 0,3 en el análisis por intención de tratar19.
Se han observado reducciones similares de la HbA1c con acarbosa en los estudios de Chiasson et al20 (0,8 puntos) y de Rosenstock et al (0,65 puntos)25. En este último los efectos adversos no aumentaron y no sobrepasaron el 30%. No se observaron cambios en las concentraciones de insulina, en el perfil lipídico ni en el peso. El reciente estudio de Phillips et al mostró una reducción similar en la HbA1c (0,7 puntos), pero los efectos adversos fueron de un 28% en el grupo que recibió placebo frente a un 57,5% en el grupo de tratamiento combinado con acarbosa26.
En cuanto a la adición de miglitol en pacientes tratados con metformina, disponemos de 2 estudios: el de Chiasson et al27, de 36 semanas de duración y que incluyó a 318 pacientes, en el que la reducción de la HbA1c fue de 0,5 puntos, y el de Van Gaal et al28 con 152 pacientes y una duración de 32 semanas, en que la reducción fue de 0,4 puntos.
Metformina-glinida
La adición de repaglinida o nateglinida a pacientes tratados con metformina podría ser equiparable a la asociación de SU y metformina, aunque, dada su reciente introducción, se dispone de menos ensayos clínicos y su coste es mayor. La menor frecuencia de hipoglucemias graves observadas en pacientes tratados con nateglinida o repaglinida en comparación con glibenclamida haría preferible esta asociación a la de SU y metformina en pacientes con riesgo de hipoglucemia (ancianos, por ejemplo) y en pacientes en los que predominan las hiperglucemias posprandiales o no pueden seguir patrones alimentarios regulares8, aunque no hay estudios comparativos.
En el estudio de Moses et al29, la adición de 4 mg de repaglinida en las 3 comidas en pacientes tratados con metformina comportó una reducción adicional de la HbA1c de 1,1 puntos respecto al grupo de placebo, un incremento de peso de 2,4 kg y que un 33% de ellos presentaran alguna hipoglucemia, aunque sólo en 2 pacientes la glucemia capilar fue menor de 50 mg/dl29. En 2 estudios realizados con 120 mg de nateglinida en las 3 comidas durante 6 meses las reducciones observadas fueron menores: en el de Horton et al30 la reducción adicional de la HbA1c respecto a metformina en monoterapia fue de 0,6 puntos30, la misma reducción obtenida por Marre et al31 con respecto a placebo. En este último aparecieron hipoglucemias en un 16% (frente al 4% con placebo) y un incremento de peso no significativo de 0,9 kg (0,1 kg con placebo)31.
Finalmente, un reciente estudio comparativo entre ambas asociaciones (repaglinida o nateglinida con metformina durante 16 semanas) ha confirmado los resultados de los estudios anteriores: la reducción al añadir 360 mg/día de nateglinida fue de 0,7 puntos, mientras que con 5 mg/día de repaglinida fue de 1,3, sin que se observaran diferencias significativas en cuanto a insulinemia, aumento de peso o incidencia de hipoglucemias32.
Metformina-glitazona
La adición de glitazonas en pacientes tratados con metformina se asocia a una reducción de la glucemia, la HbA1c y las concentraciones de insulina, así como de otros componentes del síndrome metabólico: reducción de la presión arterial, triglicéridos, ácidos grasos libres, albuminuria y otros factores relacionados con la aterosclerosis. En el estudio de Fonseca et al33, la adición de 8 mg de rosiglitazona durante 26 semanas a 384 pacientes tratados con metformina disminuyó la HbA1c en 1,2 puntos y comportó un aumento de 2,9 kg respecto a placebo. Con un diseño similar, en el estudio de Einhorn et al34 se añadieron 30 mg de pioglitazona durante 16 semanas a 328 pacientes y se obtuvo una reducción de 0,8 puntos en la HbA1c y un aumento de 2,4 kg respecto a placebo.
Debe tenerse en cuenta el incremento de peso que se ha observado y que es inherente al mecanismo de acción de estos fármacos. Por el potencial riesgo de toxicidad hepática (se retiró troglitazona por toxicidad hepática grave), debe vigilarse cada 2 meses la función hepática durante el primer año de tratamiento. Están contraindicadas en caso de hepatopatía de cualquier tipo o insuficiencia cardíaca.
Son más eficaces en pacientes obesos en los que predomina la resistencia a la insulina, en los que también está indicada la metformina, por lo que su asociación con esta última podría considerarse de elección. Sin embargo, no disponemos de estudios comparativos con respecto a la asociación de SU y metformina que demuestren su superioridad a corto o largo plazo y, por tanto, constituye una alternativa cuando la SU está contraindicada o no se tolera8.
Sulfonilurea-glitazona
Esta combinación puede ser una opción cuando no se tolera o está contraindicada la metformina. Las glitazonas mejoran la resistencia a la insulina aumentando la captación de glucosa en el tejido muscular.
En 2 estudios recientes la adición de una glitazona se mostró eficaz en pacientes tratados con una SU. La adición de 4 mg de rosiglitazona durante 26 semanas a 574 pacientes en el estudio de Wolffenbuttel et al redujo la HbA1c en 1 punto e incrementó el peso en 2,7 kg respecto a placebo35. En el estudio de Kipnes36, et al, el tratamiento con 30 mg de pioglitazona durante 16 semanas en 560 pacientes, redujo la HbA1c en 1,3 puntos e incrementó el peso en 2,4 kg respecto a placebo. No disponemos de estudios comparativos frente a la asociación de SU y metformina que demuestren la superioridad de esta asociación a corto o largo plazo y, por tanto, constituye una alternativa cuando la metformina está contraindicada o no se tolera8.
Glinida-glitazona
Se trata de una asociación potencialmente útil aunque con escasa experiencia en la bibliografía y que no ha sido todavía formalmente autorizada. Sería equivalente a la de SU con glitazona, pero aportando la ventaja de su acción sobre la glucemia posprandial y el menor riesgo de hipoglucemias. En 2 estudios recientes con una glinida y una glitazona se han observado reducciones adicionales de la HbA1c similares a las obtenidas al añadir una glinida a metformina. En el estudio Raskin et al37 se comparó troglitazona (200-600 mg/día) con repaglinida (1-4 mg) antes de las comidas o la combinación de ambas durante 22 semanas en 256 pacientes. La reducción de la HbA1c atribuible a la adición de repaglinida (respecto a la monoterapia) fue de 1,3, y de 0,9 para troglitazona38. El peso se incrementó en los 3 grupos entre 1 y 2 kg37. En el estudio de Fonseca et al38 el tratamiento con 120 mg de nateglinida antes de las comidas, añadida durante 24 semanas a 402 pacientes tratados con rosiglitazona, redujo la HbA1c en 0,8 puntos y hubo un incremento de peso de 2,1 kg respecto a placebo38. Se necesitan estudios comparativos con la asociación de SU y metformina para valorar las ventajas que pueden aportar estas asociaciones ya que, por tratarse de fármacos recientes, su coste es mucho más elevado. Serían una opción cuando existe contraindicación a SU y metformina (p. ej., alergia o hipoglucemias frecuentes con SU y al mismo tiempo contraindicación o intolerancia digestiva con metformina).
Tratamiento combinado con 3 fármacos orales
El Consenso Europeo, así como varios autores, consideran la posibilidad de utilizar 3 fármacos orales cuando con 29,10 el control es insuficiente, aunque el triple tratamiento no está explícitamente autorizado en la Unión Europea. Aunque sea efectiva la adición de un tercer fármaco (inhibidor de las alfaglucosidasas o glitazona), podría ser una alternativa a la insulina. Así se ha demostrado en el estudio de Schwartz et al39, que incluyó a 188 pacientes obesos asignados durante 24 semanas a triple tratamiento (SU o repaglinida + metformina + glitazona) o la combinación de metformina con insulina nocturna; se obtuvo una reducción de la HbA1c similar (2 puntos) pero con un coste diario menor al tratamiento con insulina (3,2 frente a 10,4 dólares/día) y sin diferencias en el incremento de peso. Así pues, el tratamiento triple podría ser una alternativa a la insulinización cuando existen dificultades o el paciente no la acepta de ninguna manera6,9,11. Sin embargo, debe tenerse en cuenta que el cumplimiento disminuye cuando aumenta el número de fármacos y tomas: el tratamiento triple podría suponer, según los fármacos elegidos, hasta 9 comprimidos diarios. En estos casos, los fármacos de dosis única, como la glimepirida, la gliclacida o las glitazonas, serían seguramente preferibles a los fármacos que requieren 3 tomas diarias (secretagogos rápidos e inhibidores de las alfaglucosidasas).
Existen pocos ensayos aleatorizados que evalúen la efectividad del tratamiento triple, aunque cabe esperar una reducción adicional similar a la observada con la adición de cualquiera de los fármacos. En el estudio de Yale et al40 se añadió troglitazona o placebo durante 6 meses en 200 pacientes tratados con metformina y SU; la adición de troglitazona comportó una reducción frente al grupo de placebo de 1,4 puntos en la HbA1c y un incremento de peso de 2,4 kg a los 6 meses40. En el estudio de Standl et al41 se añadió miglitol o placebo a 154 pacientes tratados con glibenclamida y metformina y se observó un descenso de la HbA1c de 0,55 a las 24 semanas en los pacientes que aún tomaban miglitol. Sin embargo, el análisis por intención de tratar mostró un descenso no significativo de sólo 0,35 puntos, sin que se observaran cambios en el peso41. Con un nivel de evidencia menor, un pequeño ensayo sin grupo de control asignado a placebo en el que se añadió rosiglitazona a dosis de 4 u 8 mg a 38 pacientes tratados con glimepirida y metformina, obtuvo reducciones de 1,1 y 1,4 puntos en la HbA1c42, resultados acordes con los ensayos en que se añade una glitazona a otros fármacos orales.
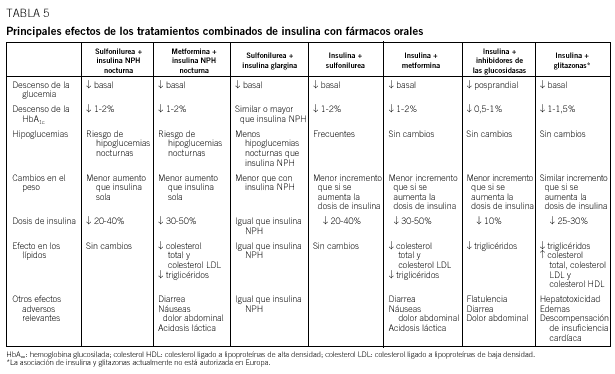
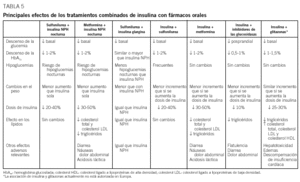
Tratamiento combinado con insulina y fármacos orales
Insulina y sulfonilureas
Hasta la década de los noventa se habían realizado únicamente estudios para evaluar la eficacia de la combinación de insulina y SU, pero con pocos pacientes y de corta duración. En los últimos 10 años, tanto el conocimiento más exacto de la fisiopatología de la DM2 como la realización de ensayos clínicos metodológicamente mucho más estrictos con SU y con otros fármacos orales han permitido valorar adecuadamente los beneficios de esta asociación43-49.
Adición de sulfonilureas a pacientes tratados con insulina. En un extenso metaanálisis realizado en 1991 sobre los datos de 22 trabajos publicados en los 12 años previos43, los autores concluyen que el tratamiento combinado de insulina más SU mejora ligeramente el control metabólico, utilizando menor dosis de insulina al compararla con la utilización únicamente de ésta. Otro metaanálisis más reciente, publicado en 199644, estudia únicamente los ensayos clínicos realizados con un método riguroso (aleatorizados, placebo-control, población homogénea) seleccionando 16 publicaciones que incluían a 351 pacientes, y concluye que la adición de SU a pacientes tratados con insulina puede ser apropiada, dado que disminuye significativamente la glucemia basal (45 mg/dl) y la HbA1c (1,1%) con una dosis menor de insulina (12 U), sin cambios significativos en el peso corporal.
Adición de insulina a pacientes tratados con sulfonilureas. Probablemente la experiencia más interesante fue la publicada por Yki-Jarvinen et al en 199245 al evaluar diferentes formas de combinar fármacos orales e insulina. El estudio comparó, en 153 pacientes con DM2 y mal control previo con fármacos orales, 5 grupos: SU más insulina matutina, SU más insulina a las 21.00 h, insulina en mezcla de rápida y NPH antes de desayuno y cena, insulina NPH a las 21.00 h y rápida antes de las comidas y, por último, el mantenimiento del tratamiento sólo con SU. Se realizó un seguimiento de 3 meses. La HbA1c descendió de forma similar en todos los grupos, significativamente respecto al grupo control. Los resultados demostraron que el grupo que recibía SU más insulina a las 21 h consiguió un control metabólico similar al de 2 o 3 inyecciones de insulina, pero induciendo un menor aumento de peso, y fue superior a la pauta con insulina en dosis única por la mañana. Además, los valores de insulinemia fueron menores en este grupo. Sin embargo, debe tenerse en cuenta que, en este estudio, un 64% de los pacientes sin obesidad y un 86% de los obesos también recibían tratamiento con metformina, que no fue suspendida. Dado que el incremento ponderal es el inconveniente fundamental de la insulinización en la DM2, esta combinación (SU más insulina en monodosis nocturna) consigue atenuar este problema. Sin embargo, el seguimiento a los 12 meses de estos pacientes mostró un empeoramiento de la HbA1c sólo en los pacientes obesos, ya que requirieron mayores cantidades de insulina con el consiguiente incremento de peso46.
A partir del estudio clínico más importante realizado en el ámbito de la DM2, el UKPDS, Wright et al49 han evaluado la eficacia de esta asociación. En los pacientes tratados únicamente con SU que tienen mal control metabólico, la combinación de SU más insulina en dosis única por la noche consigue un control metabólico mejor que insulina sola (mediana de HbA1c durante el ensayo, el 6,6 frente al 7,1%), con menores requerimientos de insulina (0,24 frente a 0,3 UI/kg/día) y con menor riesgo de hipoglucemias graves (el 1,6 frente al 3,4%), diferencias todas ellas significativas49.
En cuanto a la SU de más reciente comercialización, la glimepirida, Riddle et al48 estudiaron, en 208 pacientes con DM2 y fracaso secundario a hipoglucemiantes orales, la eficacia de insulina en monoterapia frente a la asociación de 16 mg de glimepirida con una mezcla de insulina de NPH y rápida (30%) antes de cenar durante 24 semanas. Los pacientes tratados con la asociación obtuvieron un control glucémico similar, evaluado mediante glucemia basal y HbA1c, con descenso de HbA1c del 2,1% en ambos grupos, pero alcanzado más rápidamente, con menor dosis de insulina (49 frente a 78 U/día) y menos abandonos48.
Insulina y metformina
Actualmente se considera el tratamiento combinado de elección6-8. Dado que la metformina mejora la sensibilidad a la insulina, su combinación con esta hormona administrada exógenamente, en una enfermedad en que coexisten alteraciones tanto en la secreción como en la sensibilidad a la insulina, parece idónea. Y, en efecto, los estudios actuales realizados en este sentido así lo demuestran50-55.
Adición de insulina a pacientes tratados con metformina.En un ensayo sobre 96 pacientes con DM2 y mal control con SU, Yki-Jarvinen et al50 comparan la eficacia de la insulina nocturna combinada con metformina, con glibenclamida (SU), con metformina más glibenclamida, con placebo o con una pauta de 2 dosis de insulina. El estudio concluye que la combinación de insulina nocturna (bedtime) junto con metformina evita el aumento de peso que se observa con otras combinaciones (0,9 kg en el grupo insulina más metformina frente a 3,6 kg en el grupo insulina más sulfonilureas y 4,6 kg en el grupo insulina en 2 dosis), e incluso es mejor que las otras pautas con respecto al control glucémico o a la aparición de hipoglucemias. En otro ensayo, los mismos autores demuestran que este efecto beneficioso de la asociación de insulina con metformina se debe a una disminución tanto en la dosis de insulina exógena como en el aporte energético dietético exógeno51. Como ya se ha comentado en el apartado de fármacos orales, el reciente ensayo de Schwartz et al39, en el que se compara el tratamiento combinado metformina-insulina frente al tratamiento oral triple, ha demostrado que ambas modalidades son igualmente efectivas en el descenso de la HbA1c (2%), si bien la combinación metformina-insulina es más coste-efectiva y se acompaña de menos efectos secundarios o abandonos.
Adición de metformina a pacientes tratados con insulina.Otra situación diferente para plantear los beneficios de esta combinación es la de pacientes con DM2 ya insulinizados pero con un control metabólico deficiente. En el ensayo de Avilés-Santa et al52, en 43 pacientes, la asociación de insulina y metformina, comparada con insulina y placebo durante 24 semanas, consiguió un mejor valor de HbA1c (reducción de 2,5 frente a 1,6 puntos), menor dosis de insulina (reducción de 4,5 U frente a incremento de 22,8 U) y también menor aumento de peso (0,5 frente a 3,2 kg). En nuestro entorno, un estudio abierto aleatorizado53 demostró que la adición de metformina al tratamiento previo con insulina consigue una mejoría en los valores de HbA1c (el 7,7 fren te al 9,6%), con peso estable (en relación al aumento de peso en el grupo tratado sólo con aumento de dosis de insulina).
En el reciente ensayo clínico controlado de Wulffelé et al55 durante 16 semanas, la adición de metformina frente a placebo en 390 sujetos con DM2 que seguían tratamiento intensivo con insulina consiguió un mejor valor de HbA1c (el 6,9 frente al 7,6%), menor dosis de insulina, menor aumento de peso (0,4 frente a 1,2 kg) con riesgo similar de hipoglucemias55. Por tanto, el tratamiento combinado de insulina y metformina es también eficaz en programas de insulinoterapia intensiva.
A partir de todo lo anterior, actualmente se contempla esta asociación como alternativa a la insulinización convencional y, de hecho, todas las guías de práctica clínica así lo reconocen en sus últimas actualizaciones6-8. Es más, cuando un paciente está recibiendo 2 o más fármacos orales, se recomienda mantener únicamente metformina y suspender el resto8.
Insulina e inhibidores de las alfaglucosidasas
Los inhibidores de las alfaglucosidasas intestinales disminuyen la absorción de hidratos de carbono, por lo que atenúan la hiperglucemia posprandial. La asociación de estos fármacos con insulina se ha postulado como un mecanismo para disminuir los requerimientos de insulina y controlar perfiles glucémicos en pacientes en los que predominen elevaciones importantes de la glucemia en el período posprandial56-58. En el estudio de Coniff et al57 en 145 pacientes con DM2 y mal control metabólico en tratamiento con insulina, la asociación de acarbosa (en comparación con placebo) disminuyó la glucemia posprandial y la media de HbA1c en 0,69 puntos, apareciendo los efectos secundarios gastrointestinales característicos del fármaco. El uso de miglitol en el estudio de Mitrakou et al58 proporcionó resultados y efectos adversos similares. Es evidente que cualquier disminución de HbA1c es beneficiosa, pero este beneficio es escaso y se debe ponderar en relación con los efectos secundarios y el coste económico.
Insulina y glitazonas
El mecanismo de acción de las glitazonas incide en la sensibilidad periférica a la insulina, por lo que su combinación con insulina se perfila como muy útil en situaciones de resistencia a esta hormona, como ocurre en la DM2. Las situaciones más idóneas para esta combinación son similares a aquellas en que está indicada la metformina pero, a diferencia de la combinación con metformina, se acompaña de aumento de peso. Los efectos secundarios más importantes se centran en retención hidrosalina e insuficiencia cardíaca. Las alteraciones hepáticas que motivaron la retirada del fármaco inicial de este grupo, la troglitazona, prácticamente no se han detectado con las glitazonas actualmente comercializadas: rosiglitazona y pioglitazona.
La eficacia de la rosiglitazona combinada con insulina se evaluó en el ensayo clínico de Raskin et al59, en 319 pacientes con DM2 tratados con insulina que mantenían mal control metabólico. La adición de 4 y 8 mg de rosiglitazona durante 26 semanas consiguió un descenso de la HbA1c del 0,6 y el 1,2%, una reducción media de la dosis de insulina del 5,6 y el 12%, sin observarse cambios en la relación entre el colesterol total y el ligado a lipoproteínas de alta densidad, ni en la de éste y el colesterol ligado a lipoproteínas de baja densidad ni efectos secundarios graves. El grupo tratado activamente tuvo una mayor incidencia de aumento de peso (+4 kg en el grupo tratado con 4 mg de rosiglitazona, +5,3 kg en el grupo tratado con 8 mg y +0,8 kg en el grupo placebo). En el grupo tratado con rosiglitazona la aparición de edemas, calificados por los investigadores de leves o moderados, fue más frecuente que en el grupo control (el 13,1 y el 16,2 frente al 4,7%). Se observó insuficiencia cardíaca en un paciente de cada grupo59.
En el caso de la pioglitazona, su eficacia se valoró en 566 pacientes con DM2 tratados con insulina y con mal control metabólico (HbA1c > 8%) en el estudio de Rosenstock et al60, comparando la adición de 15 mg, 30 mg de pioglitazona o placebo en un ensayo controlado multicéntrico, a doble ciego, durante 16 semanas. Los grupos tratados con pioglitazona mostraron un descenso significativamente mayor de HbA1c (un 1,0 y un 1,3%) y de glucemia basal (34 y 48 mg/dl) así como un aumento significativo de colesterol ligado a lipoproteínas de alta densidad (del 7,1 al 9,3%) y disminución de triglicéridos en relación con el grupo placebo y con el estudio basal. Por otra parte, el grupo tratado tuvo mayor incidencia de aumento de peso (+2,3 kg en el grupo tratado con 15 mg de pioglitazona, +3,7 kg en el grupo tratado con 30 mg, y 0,04 kg en el grupo placebo), edemas e hipoglucemia (un 8 y un 15% en los tratados con pioglitazona frente a un 5% en el grupo placebo).
La comparación del tratamiento combinado de insulina y metformina en relación con la combinación de insulina y glitazonas se ha realizado utilizando el primer fármaco de este grupo, la troglitazona, actualmente ya retirada del mercado. El ensayo clínico de Strowig et al61 en 88 pacientes con DM2 demostró que la adición de troglitazona, en comparación con la adición de metformina o el aumento de dosis de insulina, consiguió una mayor disminución de HbA1c (2,1 frente a 1,7 y 1,7), de los requerimientos de insulina (12 U frente a +4UI y +55 UI/día) y de los triglicéridos. En cambio, el grupo tratado con insulina y metformina tuvo menor aumento de peso (+0,5 frente a 4,4, y 4,5 kg) y menos hipoglucemias que los otros 2 grupos.
Actualmente se considera que, aunque no existe una contraindicación absoluta, debe evitarse en pacientes con insuficiencia cardíaca (clases III-IV de la New York Heart Association), por el riesgo de descompensación atribuible a la retención hidrosalina observada con las glitazonas. La asociación de insulina y glitazonas por el momento no está autorizada en la Unión Europea, aunque sí en EE.UU.
Análogos de insulina y fármacos orales
Sobre la base de la eficacia demostrada de la combinación terapéutica de insulina y fármacos orales, la reciente aparición de los análogos de la insulina ha motivado la investigación clínica sobre las ventajas de utilizarlos en combinación. La mayoría de los ensayos clínicos de tratamiento combinado se habían realizado con insulina NPH, probablemente por ser la insulina más utilizada en la DM2 y por su perfil de acción prolongada. No obstante, sus características farmacocinéticas plantean algunos inconvenientes, básicamente porque su pico de acción máxima se produce a las 4-6 h de la inyección, y en monodosis nocturna este pico coincide con la fase del sueño. Además, la duración de acción puede no llegar a cubrir adecuadamente la fase matutina de hiperglucemia. Teniendo en cuenta lo anterior, los análogos de insulina retardados podrían ser especialmente útiles en combinación62-65.
La insulina glargina es un análogo de la insulina humana de acción prolongada que posee un perfil de acción de 24 h sin picos de acción pronunciados, de eficacia claramente demostrada tanto en la diabetes tipo 1 como en la DM2.
El estudio de Yki-Jarvinen et al62 de 2000, un ensayo clínico aleatorizado con 426 pacientes con DM2 y mal control metabólico previo con fármacos orales, comparó la adición de insulina glargina frente a NPH. Ambos grupos mejoraron de forma similar el grado de control metabólico, pero los pacientes tratados con insulina glargina sufrieron menos hipoglucemias nocturnas (un 24 frente a un 9,9%).
Un reciente ensayo clínico aleatorizado multicéntrico realizado por Fritsche et al63 ha investigado la eficacia, en 695 pacientes con DM2 tratados previamente con hipoglucemiantes orales, del tratamiento combinado de 3 mg de glimepirida diarios con 3 pautas de insulina distintas: insulina glargina matutina, insulina glargina nocturna e insulina NPH. Tras 24 semanas de seguimiento, los pacientes tratados con glimepirida e insulina glargina matutina mostraron un mayor descenso de HbA1c que los tratados con insulina glargina nocturna o insulina NPH nocturna (un 1,24, un 0,96 y un 0,84%, respectivamente). Las hipoglucemias nocturnas fueron menos frecuentes en el grupo tratado con insulina glargina matutina (17%) que en los que la recibieron nocturna (23%) y éstos a su vez experimentaron una menor frecuencia de hipoglucemias que los tratados con insulina NPH (38%). Según estos resultados, la insulina glargina inyectada por la mañana produce un mejor control metabólico con menos hipoglucemias nocturnas63. Así pues, en el tratamiento combinado con fármacos orales e insulina glargina, podría ser preferible inyectar el análogo por la mañana, aunque se necesitan más estudios que lo confirmen.
El tratamiento combinado con insulina glargina frente a insulina NPH se ha comparado asimismo en un ensayo clínico más amplio, multicéntrico, aleatorizado y abierto, de 570 sujetos, incluyendo tanto a pacientes tratados previamente con fármacos orales como con insulina64. Una vez más, la frecuencia de hipoglucemias nocturnas fue menor en el grupo de tratamiento combinado con insulina glargina que con insulina NPH (el 12 frente al 24%). Ambos grupos mejoraron de forma similar el grado de control metabólico. Sin embargo, en los pacientes con sobrepeso (índice de masa corporal superior a 28), el grupo tratado con insulina glargina mostró una reducción significativamente mayor de la HbA1c (un 0,42 frente a un 0,11%). Por tanto, en el tratamiento combinado de fármacos orales e insulina en la DM2 la insulina glargina es tanto o más efectiva que la insulina NPH, con la ventaja de producir menos hipoglucemias nocturnas.
Los efectos de las diferentes combinaciones de fármacos orales e insulina se resumen en la tabla 5.
Conclusiones
En el paciente con DM2 se ha demostrado que un buen control glucémico y del resto de los factores de riesgo consigue reducir la presencia de complicaciones crónicas y disminuye la morbimortalidad cardiovascular. El tratamiento del paciente con DM2 debe contemplar un abordaje global prestando especial interés no sólo al control de la hiperglucemia sino también de las cifras de presión arterial y lípidos y la ausencia de tabaquismo.
La DM2 es una enfermedad en la que intervienen distintos mecanismos fisiopatológicos que pueden variar en importancia, según el momento evolutivo de la enfermedad. En la actualidad existen distintos grupos de fármacos (orales e insulinas) cuyo mecanismo de acción se basa en las diferentes alteraciones fisiopatogénicas responsables de la enfermedad.
Estudios prospectivos de largo seguimiento han demostrado que en muchas ocasiones, para alcanzar los objetivos de control metabólico deseados, será necesario asociar varios fármacos. Cuando esto sucede, estas asociaciones deben basarse en las características individuales del paciente, los objetivos de control y los mecanismos patogénicos presuntamente implicados. Numerosos estudios han demostrado la eficacia de distintas pautas de tratamiento combinado.
El manuscrito ha sido revisado por los Dres. Fernando Álvarez Guisasola, Javier Diez Espino, José Luis Martín Manzano y Dantés Tórtola Graner de la Sociedad Española de Medicina Familiar y Comunitaria, y por los Dres. Domingo Acosta Delgado, Manuel Aguilar Diosdado, José Luis Herrera Pombo y Luis Felipe Pallardo, de la Sociedad Española de Diabetes.