La diabetes y la aterosclerosis están claramente relacionadas. Se calcula que entre un 75 y un 80% de las muertes relacionadas con la diabetes son atribuibles a las complicaciones macrovasculares ateroscleróticas. Los diabéticos tipo 2 presentan entre 2 y 4 veces más incidencia de infarto agudo de miocardio y accidente cerebrovascular que los no diabéticos, y el riesgo de infarto agudo de miocardio en el diabético es comparable al de un paciente no diabético que ya ha sufrido uno. El aumento de la aterogenicidad y el riesgo trombótico en la diabetes se han atribuido clásicamente a factores como dislipemia, hiperglucemia, aumento de factores de coagulación e hiperagregabilidad plaquetaria. Actualmente se sabe que la aterosclerosis es un proceso inflamatorio de la pared arterial1 y que en la diabetes existe un estado inflamatorio que puede contribuir a la aterogénesis.
La proteína C reactiva (PCR), marcador prototipo de inflamación, es un buen predictor del riesgo cardiovascular2. Los diabéticos tipo 2 presentan un estado de inflamación subclínica y valores aumentados de PCR respecto a los de la población sana3, lo que podría explicar la mayor mortalidad cardiovascular que presentan.
Existen evidencias de que las estatinas, además de su acción hipolipemiante, tienen efectos pleiotrópicos4, entre los que destaca su actividad antiinflamatoria. Varios estudios demuestran una disminución de parámetros inflamatorios como la PCR5-7 y establecen una relación entre resultados cardiovasculares favorables y disminución de la PCR, que es independiente del descenso de los valores de colesterol unido a lipoproteínas de baja densidad (colesterol LDL).
El objetivo de este estudio ha sido valorar los valores de PCR en un grupo de diabéticos tipo 2 no fumadores con dislipemia y su relación con varios factores metabólicos y de riesgo cardiovascular, antes y a los 6 meses de instaurar tratamiento con 20 mg de atorvastatina.
Pacientes y método
Se ha realizado un estudio observacional, descriptivo y prospectivo, con un seguimiento de 6 meses. Se seleccionó a 30 pacientes no fumadores con diabetes mellitus tipo 2 y dislipemia que, tras realizar dieta durante 6 meses, presentaron valores de colesterol LDL mayores de 3,38 mmol/l y de PCR superiores a 5 mg/l (límite inferior detectado por nuestro laboratorio). Los pacientes fueron remitidos a las consultas externas de Endocrinología del Hospital Universitario Morales Meseguer de Murcia en el año 2002. Se excluyó a los pacientes con tratamiento farmacológico hipolipemiante previo y los que presentaran cualquier enfermedad inflamatoria, infecciosa o neoplásica aguda o crónica intercurrente.
Se recogieron los siguientes datos clínicos: sexo, edad, años de evolución de la diabetes, hipertensión arterial, presencia de complicaciones macrovasculares y microvasculares de la diabetes y tratamiento farmacológico.
Se efectuó a los pacientes un examen físico general, además de una determinación analítica basal para valorar los valores de glucosa, colesterol total, colesterol unido a lipoproteínas de alta densidad (colesterol HDL), colesterol LDL, triglicéridos, hemoglobina glucosilada A1c, PCR, fibrinógeno y microalbuminuria en orina de 24 h. La glucosa, el colesterol total, el coleterol HDL y los triglicéridos se determinaron por un método enzimático. El colesterol LDL se calculó a partir de la fórmula de Friedewald. La PCR se cuantificó por un método inmunoturbidimétrico activado con polietilenglicol utilizando reactivos de Bayer Diagnostics adaptados al analizador Advia 1650 del mismo fabricante. La microalbuminuria se midió por un método inmunoturbidimétrico. Para la determinación de hemoglobina glucosilada A1C se utilizó un proce-dimiento de cromatografía en fase líquida de alta resolución automatizada. Se determinó el fibrinógeno derivado utilizando reactivos de Instrumentation Laboratory adaptados al analizador automático ACL Futura Plus del mismo fabricante.
Se eligió como opción terapéutica para la dislipemia atorvastatina a dosis de 20 mg/día, sin modificar el resto del tratamiento farmacológico, durante los 6 meses del estudio. Al finalizar este período, se reevaluó a los pacientes y se repitieron el examen físico general y la valoración analítica.
Análisis estadístico
Las variables cuantitativas se expresan como media (desviación estándar) y las cualitativas como porcentajes. Para la comparación de variables cuantitativas en su determinación basal y a los 6 meses se utilizó el test no paramétrico de comparación de medias para muestras relacionadas (test de Wilcoxon). Para la comparación de proporciones, se utilizó la prueba de la *2 y el test exacto de Fisher. Los análisis de las correlaciones se realizaron con el coeficiente de correlación rho de Spearman.
Todas las comparaciones se realizaron a 2 colas, considerándose un valor significativo si p era inferior a 0,05.
Los datos se analizaron con el paquete estadístico SPSS/PC, versión 10.0 para Windows.
Resultados
De los 30 pacientes diabéticos que participaron en el estudio, 19 (63,3%) eran mujeres y 11 (36,7%) varones, con una edad media de 60,7 años (extremos: 42-75 años) y un tiempo medio de evolución de la diabetes de 8,3 años (extremos: 1-25 años). El índice de masa corporal (IMC) basal medio fue de 33 kg/m2 (extremos: 25-52 kg/m2). El 90% eran hipertensos. Presentaban complicaciones microvasculares el 50% y macrovasculares el 16,7%.
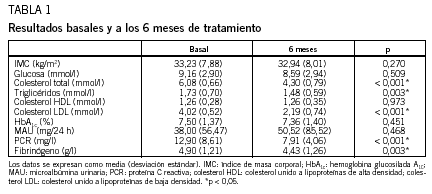
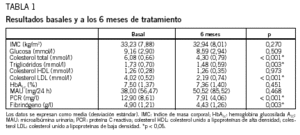
Al inicio del estudio, los pacientes tenían un control metabólico estable, con unos valores medios de hemoglobina glucosilada A1c del 7,5%, colesterol total de 6,08 mmol/l, triglicéridos de 1,73 mmol/l y colesterol LDL de 4,02 mmol/l. Los valores medios de PCR fueron de 12,9 mg/l y los de fibrinógeno de 4,9 g/l. A los 6 meses de instaurado el tratamiento con atorvastatina, los valores medios de hemoglobina glucosilada A1c fueron del 7,36%, los de colesterol total de 4,29 mmol/l, los de triglicéridos de 1,48 mmol/l, los de colesterol LDL de 2,18 mmol/l, los de PCR de 7,91 mg/l y los de fibrinógeno de 4,43 g/l. La disminución de las cifras de colesterol total (p < 0,001), triglicéridos (p = 0,003), colesterol LDL (p < 0,001), PCR (p < 0,001) y fibrinógeno (p = 0,003) tenían significación estadística. No hubo diferencias significativas entre el IMC basal y a los 6 meses. Los resultados se muestran en la tabla 1.
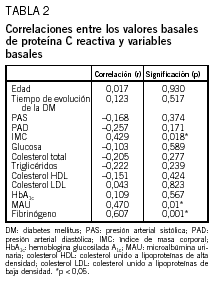
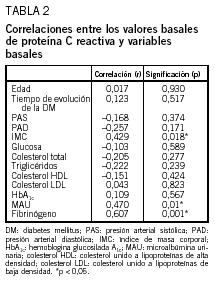
Se comprobó que existía correlación entre la PCR y el IMC basal (r = 0,429; p = 0,018), PCR y microalbuminuria basal (r = 0,470; p = 0,01) y PCR y fibrinógeno basal (r = 0,607; p = 0,001). Sin embargo, no se obtuvo correlación significativa entre PCR basal y glucemia, hemoglobina glucosilada A1c, colesterol, triglicéridos, colesterol HDL y colesterol LDL basales, existencia de complicaciones macrovasculares o microvasculares, edad, sexo, años de evolución de la diabetes, resto del tratamiento farmacológico y cifras de presión arterial (tabla 2).
En 27 de los 30 pacientes (90%) la PCR disminuyó, siendo el descenso medio de 5,70 (5,33) mg/l. En estos pacientes se demostró correlación entre la disminución de la PCR y la glucemia a los 6 meses (r = 0,45; p = 0,019) y la hemoglobina glucosilada A1c a los 6 meses (r = 0,42; p = 0,032), pero no se comprobó correlación significativa entre la disminución de la PCR y los valores de colesterol total, triglicéridos, colesterol HDL, colesterol LDL, fibrinógeno y microalbuminuria a los 6 meses.
La disminución de la PCR no se relacionaba con la edad, el sexo, los años de evolución de la enfermedad, las complicaciones macrovasculares y microvasculares, la hipertensión arterial y el resto del tratamiento.
Discusión
En los últimos años se han publicado numerosos estudios que indican que las estatinas, y en concreto la atorvastatina, podrían influir en la disminución de los episodios cardiovasculares, no sólo a través de sus acciones sobre los lípidos, sino a través de mecanismos no lipídicos, tales como la modificación de la respuesta inflamatoria subendotelial. Nuestros resultados corroboran los de otros investigadores5-7: el descenso que hemos observado de la PCR es similar al descrito en trabajos realizados con atorvastatina en diabéticos tipo 26,7 y superior al de estudios realizados con simvastatina y pravastatina en población general5. Estas diferencias, aunque se puedan atribuir a la distinta actividad antiinflamatoria de cada estatina y al posible efecto dependiente de la dosis, también se pueden explicar porque la acción antiinflamatoria sea superior en diabéticos tipo 2 que en el resto, debido a que las estatinas pueden mejorar la sensibilidad a la insulina en estos pacientes y un estado de resistencia a la insulina es proinflamatorio.
Existen resultados contradictorios sobre el efecto de las estatinas y los valores de fibrinógeno8,9. En nuestros pacientes hemos comprobado una disminución de los valores de fibrinógeno tras el tratamiento con atorvastatina. El fibrinógeno, considerado tradicionalmente un factor hemostático, es también un marcador inflamatorio y, por este motivo, la disminución del fibrinógeno con el uso de estatinas9 y la relación entre estos 2 marcadores inflamatorios, PCR y fibrinógeno10, resulta coherente. La correlación entre PCR e IMC10 refleja la importancia del tejido adiposo como fuente de valores circulantes de interleucina 6, principal citocina mediadora de la síntesis hepática de la PCR. Es importante destacar el papel que desempeña el tejido adiposo y, por tanto, la obesidad, en el mantenimiento de un estado de inflamación crónico, que es determinante en la regulación del proceso aterogénico y la resistencia a la insulina. La microalbuminuria se considera hoy un marcador de riesgo cardiovascular y, por tanto, se puede esperar una relación entre ésta y la PCR.
No hemos encontrado relación entre la presencia de complicaciones macrovasculares y los valores de PCR, posiblemente por el pequeño porcentaje (16,7%) de pacientes con dichas complicaciones. Haber seleccionado a diabéticos tipo 2 con dislipemia que no siguieron tratamiento con estatinas ha podido ser un sesgo que justifique la baja prevalencia de acontecimientos cardiovasculares previos.
Del total de los diabéticos, un 90% (27/30) presentó un descenso de los valores de PCR tras el tratamiento con atorvastatina. En este subgrupo encontramos una correlación entre la disminución de la PCR y la glucemia y la hemoglobina glucosilada A1c a los 6 meses. Este interesante hallazgo se puede explicar por la mejora de la sensibilidad a la insulina que producen las estatinas3 y, aunque nuestro trabajo no tenía como objetivo estudiar la insulinorresistencia, es de esperar que exista en un grupo de diabéticos tipo 2 que presentan un IMC medio de 33 kg/m2.
En definitiva, los resultados de nuestro estudio demuestran que, tras el tratamiento con atorvastatina, disminuyen los valores de PCR en un grupo de diabéticos tipo 2 con dislipemia y que este efecto no está relacionado de manera significativa con los cambios inducidos por la atorvastatina en el patrón lipídico.