Se revisan los efectos beneficiosos y los problemas relacionados con los fármacos hipoglucemiantes tradicionales y se analizan los nuevos medicamentos de esta clase relacionados con el efecto incretina: análogos del péptido similar al glucagón tipo 1 e inhibidores de las dipeptidil peptidasas tipo 4. Ambos producen, de forma dependiente de la glucosa, una reducción de la glucemia, no se relacionan con la hipoglucemia y no aumentan el peso. Otro nuevo grupo son los inhibidores del cotransportador sodio-glucosa tipo 2, que disminuyen la glucemia con bajo riesgo de hipoglucemia y con discreta pérdida de peso. Los efectos beneficiosos a largo plazo y la prevención cardiovascular no están demostrados.
Disponemos cada vez de más y mejores fármacos. Por otra parte, el tratamiento farmacológico hipoglucemiante debe ser personalizado, considerando los valores de hemoglobina glucosilada, el riesgo-beneficio, el riesgo de hipoglucemia, los cambios en el peso y el estado cardiovascular, entre otros factores.
No tenemos el hipoglucemiante ideal y no debemos olvidar que, junto al control de la hiperglucemia, el tratamiento precoz e intensivo de la dislipidemia y de la hipertensión es fundamental en la prevención cardiovascular del paciente con diabetes tipo 2.
The benefits and problems associated with traditional hypoglycemic drugs, such as failure of beta cells, hypoglycemia and weight gain, that lead to a worsening of diabetes, are reviewed. New hypoglycemic drugs with incretin effect (glucagon-like peptide-1 agonists and dipeptidyl peptidase 4 inhibitors), achieve, in a glucose dependent manner, an glycosylated hemoglobin reduction without hypoglycemia or increase in body weight. Recently, another group of oral hypoglycemic drugs, sodium-glucose cotransporter type 2 inhibitors, have demonstrated efficacy in diabetes control by inhibiting renal glucose reabsorption. However, long-term effects and cardiovascular prevention remain to be demonstrated.
We have more and better drugs nowadays. Hypoglycemic treatment should be customized (glycosylated hemoglobin levels, risk-benefit, risk of hypoglycemia, weight changes, cardiovascular risk), with a combination of drugs being necessary in most cases.
However, we do not have yet an ideal hypoglycemic drug. Moreover we must remember that an early and intensive treatment of dyslipidemia and hypertension is essential for the prevention of cardiovascular disease in patients with type 2 diabetes.
La diabetes mellitus tipo 2 (DM2) es una compleja alteración metabólica caracterizada por una combinación de resistencia a la insulina y alteración en la secreción de la misma. Ambos mecanismos tienen una base genética múltiple (asociación de diferentes polimorfismos)1,2 y un componente ambiental (obesidad abdominal, sedentarismo, etc.)3,4. Además, diversas alteraciones hormonales, como la reducción de hormonas con acción incretina, el aumento de la secreción de glucagón y otras, participan en el desarrollo de la diabetes.
La importancia de la DM2 está relacionada con su elevada prevalencia. En España está alrededor del 14%5, y por su asociación con la enfermedad cardiovascular, la DM2 es considerada como una situación de alto riesgo cardiovascular6.
Tratamiento de la diabetes mellitus tipo 2El tratamiento de la DM2 es muy complejo, como lo es la fisiopatología de la enfermedad. Se considera necesaria la intervención simultánea, precoz e intensa sobre la hiperglucemia y todos los factores de riesgo cardiovascular: dislipidemia, hipertensión y tabaco. Los cambios en el estilo de vida (modificaciones dietéticas y aumento del ejercicio físico) son muy importantes para mejorar todas las alteraciones relacionadas, como la hiperglucemia, la dislipidemia, la hipertensión y el riesgo cardiovascular.
Tratamiento de la hiperglucemiaLa pérdida de peso, con dieta hipocalórica, baja en grasas saturadas, hidratos de carbono simples de fácil absorción y sal, y con aumento del ejercicio físico, tiene una gran importancia en el control y evolución de la hiperglucemia, pero para su adecuado control es necesaria la administración de fármacos hipoglucemiantes.
Los fármacos hipoglucemiantes actúan por diferentes mecanismos, que permiten agruparlos y establecer grupos terapéuticos. Estos grupos, y los fármacos hipoglucemiantes que los componen, se citan en la tabla 1.
Principales grupos farmacológicos en el tratamiento de la diabetes tipo 2, clasificados por el mecanismo de acción
| Insulinosensibilizadores: aumentan la sensibilidad a la insulina y facilitan su acción periférica, disminuyen la resistencia a la insulina y la producción hepática de insulina |
| Biguanidas (metformina). Acción fundamentalmente en el hígado |
| Glitazonas (pioglitazona). Acción fundamentalmente periférica |
| Insulinosecretagogos: estimulan la secreción de insulina por las células β |
| Sulfonilureas (acetoxamida, clorpropamida, tolbutamida, tolazamida, glibenclamida, gliburida, gliclazida, glimepirida, glipizida, gliquidona, glisentida) |
| Metiglinidas (repaglinida, nateglinida) |
| Potenciadores del efecto incretina |
| Agonistas del receptor de GLP-1 (exenatida, liraglutida, lixasenatide, etc.) |
| Inhibidores de la dipeptidasa iv o gliptinas (sitagliptina, vildagliptina, saxagliptina, linagliptina, alogliptina, etc.) |
| Inhibidores de las alfaglucosidasas intestinales |
| Acarbosa, miglitol |
| Inhibidores de los transportadores sodio-glucosa tipo 2 |
| Dapaglifocina, otros |
| Insulina |
GLP-1: glucagon-like peptide-1 («péptido similar al glucagón tipo 1»).
Todas las sociedades científicas consideran adecuado el tratamiento escalonado: 1) cambios en el estilo de vida (cambios en la dieta, ejercicio físico, educación diabetológica, abstención de fumar) asociados a monoterapia oral con metformina u otros fármacos según las características del paciente; 2) combinaciones de antidiabéticos orales (ADO) o análogos del glucagon-like peptide-1 (GLP-1, «péptido similar al glucagón tipo 1»), con asociación de 2 o 3 fármacos; 3) combinación de insulina basal con ADO o GLP-1, y 4) múltiples dosis de insulina o, en casos resistentes con obesidad mórbida, cirugía metabólica.
Principales problemas relacionados con los fármacos hipoglucemiantesEl tratamiento hipoglucemiante no solo es complejo, sino que puede relacionarse con una serie de efectos perjudiciales, como son:
- 1.
Disminución del número y función de las células β pancreáticas. El fracaso progresivo de las células β con disminución de la masa celular e hipoinsulinismo se observa en el curso evolutivo de la DM2. Se relaciona con múltiples factores, independientes del tipo de tratamiento utilizado, como son: la existencia de polimorfismos relacionados con la disfunción de la célula β y masa celular7; la lipotoxicidad por aumento plasmático de los ácidos grasos libres y su depósito intracelular, relacionada con la resistencia a la insulina8; la disminución de hormonas con efecto incretina9; la glucotoxicidad, que también interviene en el deterioro progresivo de las células β10. Pero hay datos que hacen sospechar que algunos tratamientos pueden retrasar la pérdida de masa de células β, mientras que otros la aceleran y sería un efecto perjudicial e indeseable del tratamiento hipoglucemiante.
- 2.
El segundo problema relacionado con el tratamiento hipoglucemiante es la provocación de hipoglucemias, que en personas con diabetes e importante deterioro vascular pueden provocar episodios isquémicos en diferentes territorios y un aumento de la mortalidad11,12.
- 3.
El aumento de peso inducido por algunos fármacos puede agravar la obesidad, la resistencia a la insulina, la hiperglucemia y la evolución de la enfermedad diabética.
Como hemos visto, existen muchos fármacos para el control de la hiperglucemia en la DM2. Sin embargo, no tenemos el fármaco ideal, que sería aquel capaz de normalizar la glucemia (o la hemoglobina glucosilada [HbA1c]) sin efectos secundarios como hipoglucemias y aumento de peso, disminuir la morbimortalidad cardiovascular y mantener la integridad y el normal funcionamiento de las células del islote.
Principales beneficios y problemas relacionados con los fármacos hipoglucemiantes tradicionalesEn general, los fármacos utilizados en el tratamiento de la DM2 tienen un efecto hipoglucemiante similar, que es variable dependiendo de los valores glucémicos o de HbA1c previos al inicio del tratamiento.
Entre los fármacos hipoglucemiantes tradicionales, tenemos:
Metformina. Disminuye el peso, tiene bajo riesgo de hipoglucemias y demostró, en un pequeño subgrupo de pacientes obesos en el UKPDS, una reducción de la mortalidad cardiovascular. Es un fármaco seguro, aunque en algunos casos puede producir efectos digestivos indeseables y, por ello, intolerancia. Ha sido considerado el medicamento adecuado para iniciar el tratamiento en todos los pacientes; sin embargo, su beneficio cardiovascular aún debe ser demostrado13.
Grupo de secretagogos (sulfonilureas y metiglinidas). Las sulfonilureas aumentan la liberación de insulina por unión al receptor SUR1 de las células β pancreáticas, pueden producir hipoglucemias graves y aumento de peso. También aumentan la incidencia de hipoglucemia cuando se utilizan en combinación con otros hipoglucemiantes14. Además, se unen al receptor SUR2A de los cardiomiocitos y al SUR2B de la pared vascular, y pueden inhibir el precondicionamiento isquémico, mecanismo endógeno de protección cardiaca durante episodios isquémicos15.
Glitazonas (pioglitazona). Actúan disminuyendo la resistencia a la insulina, tienen un efecto hipoglucemiante de lenta instauración, mejoran el perfil lipídico, no inducen hipoglucemia y disminuyen la incidencia de enfermedad cardiovascular, como fue observado en el estudio PROactive16. Como efectos secundarios, producen edemas, por lo que están contraindicadas en la insuficiencia cardiaca grado iii/iv, así como aumento de peso, aunque puede evitarse con un tratamiento dietético adecuado e intensivo17. Se han descrito fracturas distales en mujeres posmenopáusicas y la posibilidad de asociarse a cáncer de vejiga urinaria, aunque existen estudios contradictorios sobre la posible asociación con cáncer vesical18,19.
Inhibidores de la alfaglucosidasa (acarbosa y miglitol). Inhiben las enzimas que degradan los hidratos de carbono en el intestino y reducen fundamentalmente la glucemia posprandial, por lo que tienen un efecto hipoglucemiante poco potente. Los efectos secundarios por intolerancia digestiva son frecuentes, como flatulencia, meteorismo y diarreas20.
El tratamiento con insulina está fundamentado en las alteraciones fisiopatológicas de la DM2, como son la secreción defectuosa y retrasada de insulina, junto a la insulinorresistencia y la disminución progresiva de la masa de células β con hipoinsulinismo. Tiene una acción hipoglucemiante superior al resto de grupos, con la posibilidad de inducir hipoglucemias y de aumentar el peso. En qué momento de la evolución es necesario el tratamiento sustitutivo con insulina es difícil de establecer. Clásicamente se ha indicado cuando fallan los tratamientos orales o si la HbA1c está muy elevada. Recientemente, un estudio realizado con insulina basal (Estudio ORIGIN)21 en sujetos con diabetes de corta evolución ha demostrado un buen control de la HbA1c durante 7 años, sin complicaciones graves. Ello ha planteado las ventajas del tratamiento precoz de insulina basal sola o asociada a otros fármacos como metformina.
Nuevos grupos farmacológicosFármacos con acción incretinaEl concepto del sistema hormonal con acción incretina es antiguo, las primeras descripciones del sistema incretina relacionadas con la diabetes datan de los años de la década de 197022. Se refiere a las hormonas gastrointestinales gastric inhibitory polypeptide (GIP, «polipéptido inhibidor gástrico») y GLP-1, que se estimulan y liberan en el intestino tras la ingesta y tienen una serie de efectos antidiabéticos por su acción sobre los islotes pancreáticos y otros tejidos.
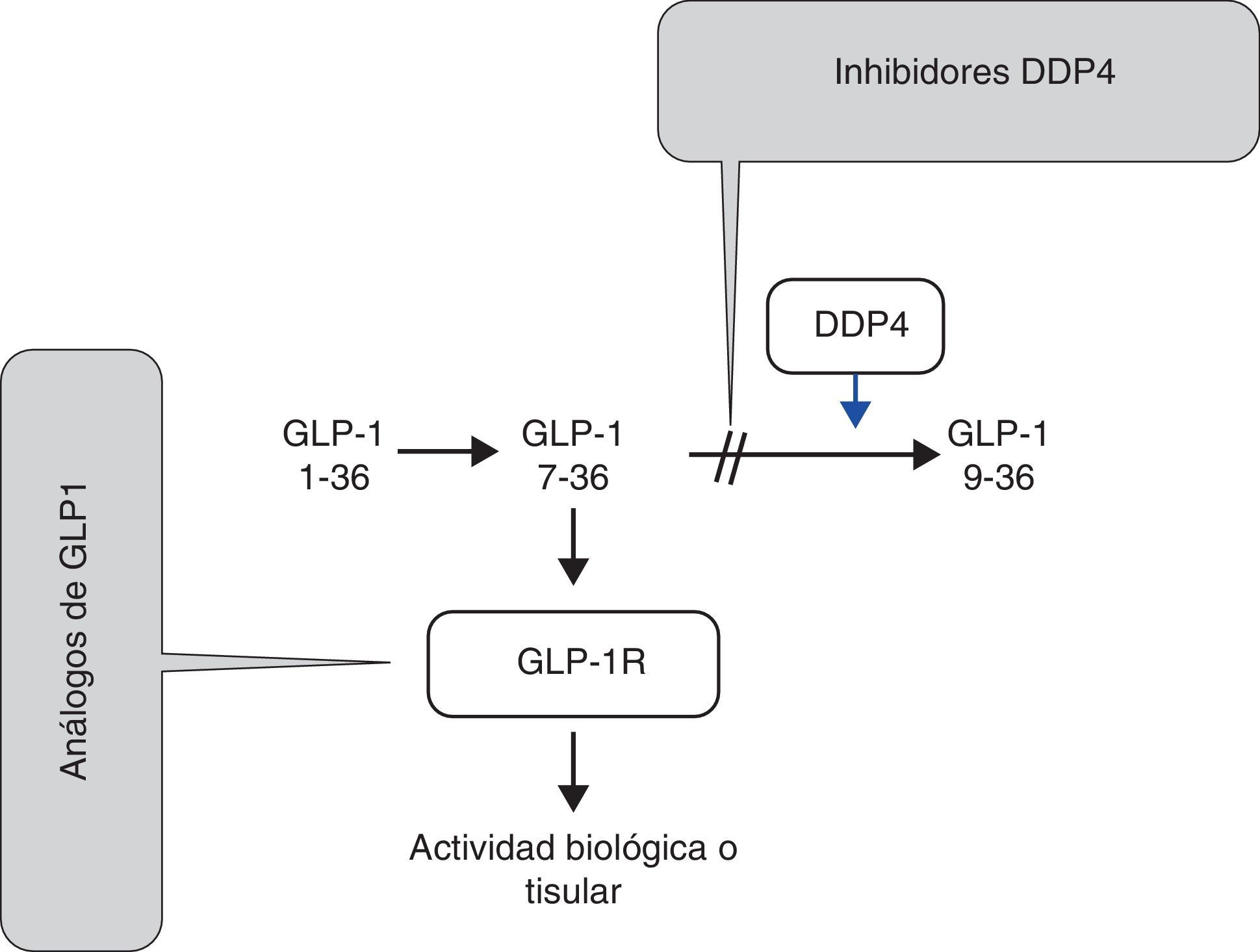
El GLP-1 se une al receptor específico GLP-1R y produce su actividad biológica en diferentes tejidos. La acción de GLP-1 es corta y limitada por la acción de las dipeptidil peptidasas tipo 4 (DPP4), que trasforman la forma activa de GLP-1 (7-36) en la forma inactiva GLP-1 (9-36), lo que ocurre en menos de 2min (fig. 1). Sobre estos mecanismos fisiológicos se puede actuar y obtener un beneficio terapéutico, bien estimulando el GLP-1R con los llamados análogos de GLP-1, bien inhibiendo la degradación del GLP-1 endógeno a la forma inactiva con los inhibidores de las DPP4 (iDPP4)23.
Metabolismo del péptido similar al glucagón tipo 1 y mecanismo de acción de los fármacos con acción incretina.
DDP4: dipeptidil peptidasa tipo 4, enzima responsable del paso de glucagon-like peptide-1 («péptido similar al glucagón tipo 1») activo (7-36) a GLP-1 inactivo (9-36); GLP-1 (1-36): péptido original con 36 aminoácidos; GLP-1 (7-36): péptido con los aminoácidos 7 a 36 que se une al receptor; GLP-1 (9-36): péptido con los aminoácidos 9 a 36, modificado por la enzima DDP4 y no activo sobre receptor de GLP-1 (GLP-1R).
Los inhibidores de DDP4 inhiben la acción enzimática (DDP4) disminuyendo la degradación de GLP-1 y, por ello, aumentando la acción del GLP-1 de origen endógeno.
Los análogos de GLP-1 actúan sobre GLP-1R, produciendo las acciones GLP-1.
La acción biológica del GLP-1 se realiza en numerosos territorios, como consecuencia de la amplia distribución de los receptores GLP-1R en el organismo24,25:
1. En los islotes pancreáticos aumenta la síntesis y secreción de insulina de forma dependiente de la glucosa. En estudios en animales se ha observado que aumenta la proliferación de las células β pancreáticas y disminuye su apoptosis, incrementando o preservando la masa celular β. Disminuye la secreción de glucagón por acción sobre las células α. Estos mecanismos se relacionan con un aumento de la sensibilidad periférica a la insulina, con un incremento de la captación y almacenamiento de glucosa en el tejido muscular y en el graso; en el hígado, además, disminuye la producción de glucosa.
2. En el sistema nervioso central tiene acciones neuroprotectoras y disminuye el apetito, lo que se acompaña de una reducción moderada del peso corporal.
3. Retrasa el vaciamiento gástrico.
4. Tiene acciones protectoras en el sistema cardiovascular, acciones directas con aumento del efecto inotrópico y de la captación de glucosa por los cardiomiocitos, mejorando el precondicionamiento isquémico.
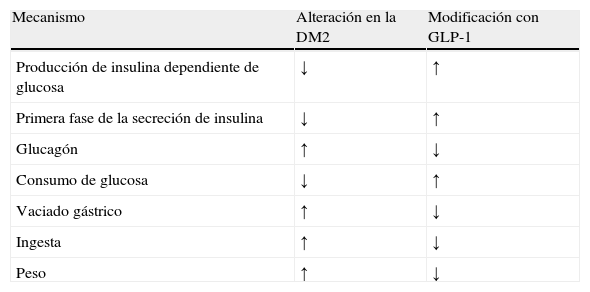
La infusión de GLP-1 corrige las principales alteraciones encontradas en la mayoría de los sujetos con DM2 (tabla 2).
Principales alteraciones en la diabetes tipo 2 y su modificación con la infusión de péptido similar al glucagón tipo 1
| Mecanismo | Alteración en la DM2 | Modificación con GLP-1 |
| Producción de insulina dependiente de glucosa | ↓ | ↑ |
| Primera fase de la secreción de insulina | ↓ | ↑ |
| Glucagón | ↑ | ↓ |
| Consumo de glucosa | ↓ | ↑ |
| Vaciado gástrico | ↑ | ↓ |
| Ingesta | ↑ | ↓ |
| Peso | ↑ | ↓ |
DM2: diabetes mellitus tipo 2; GLP-1: glucagon-like peptide-1 («péptido similar al glucagón tipo 1»).
Son fármacos con acción GLP-1, estimulan los GLP-1R y son resistentes a la acción de la DPP-4. Actualmente disponemos en el mercado de 2 análogos de GLP-1: exenatida, de administración subcutánea cada 12h, de la que existe una forma retardada de administración semanal aún no comercializada en España, y liraglutida, de administración subcutánea diaria. Ambas han demostrado un efecto reductor de la HbA1c de 0,8 a 2 puntos (la cuantía de esta reducción depende de las cifras previas al tratamiento) y una pérdida de peso entre 2 y 4kg26,27. Un reciente metaanálisis no encontró diferencias significativas en la reducción de HbA1c entre exenatida semanal y liraglutida, lo que demuestra que estos análogos de GLP-1 tienen efectos hipoglucemiantes similares y equivalentes a los encontrados tras la administración de una dosis diaria de insulina glargina28. Se pueden asociar con otros fármacos hipoglucemiantes, incluyendo insulina de acción lenta o prolongada. La asociación con insulina de acción prolongada potencia el efecto hipoglucemiante y reduce la dosis de insulina previamente utilizada, consiguiendo objetivos de HbA1c en un 60% de los sujetos tratados29.
Hay evidencias de su efecto protector cardiovascular, con aumento de la función y de la utilización de glucosa por las células cardiacas. En estudios experimentales han demostrado reducción del tamaño del infarto de miocardio y un aumento del número de cardiomiocitos30. En el sistema vascular producen vasodilatación, con disminución de la presión arterial sistólica (entre 2 y 6mmHg) y diastólica (2-3mmHg)31,32. Se ha observado una ligera mejoría en el perfil lipídico, con disminución de los valores plasmáticos de colesterol unido a lipoproteínas de baja densidad y triglicéridos, y aumento del colesterol unido a lipoproteínas de alta densidad33.
Por sus efectos hipoglucemiantes, no acompañados de aumento significativo de hipoglucemias, pérdida moderada (pero significativa) de peso corporal y con la posibilidad de favorables efectos cardiovasculares y protección del islote, son un grupo muy interesante en el tratamiento de la DM2. Sin embargo, no todo es positivo. Son fármacos con algunos efectos secundarios, siendo los más frecuentes náuseas, diarreas y reacciones locales en el lugar de inyección. Se ha descrito una posible relación con pancreatitis que debe ser objeto de estudio, por lo que se sugiere precaución con su uso en pacientes diabéticos con uno o más factores de riesgo para la pancreatitis. Tienen un elevado precio y no hay aún estudios que demuestren beneficio cardiovascular, con reducción de episodios cardiovasculares y de mortalidad, estudios actualmente en desarrollo. El futuro lugar de este grupo dependerá de la demostración de mayor seguridad y eficacia sobre variables cardiovasculares en los ensayos en curso.
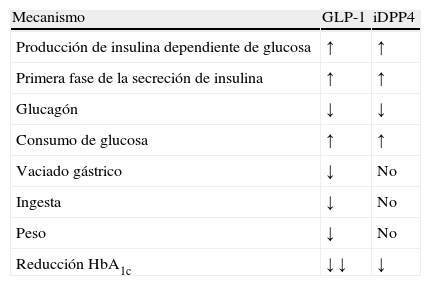
Inhibidores de dipeptidil peptidasas tipo 4Los iDPP4 son fármacos de administración por vía oral que aumentan la disponibilidad y acción del GLP-1 endógeno. Tras una comida, y de forma dependiente de la glucosa, incrementan la secreción de insulina e inhiben la liberación de glucagón34. No tienen efecto sobre el vaciamiento gástrico y no hay disminución de la ingesta ni pérdida significativa de peso. Las principales diferencias con los análogos de GLP-1 se muestran en la tabla 3.
Principales diferencias de los fármacos con acción incretina
| Mecanismo | GLP-1 | iDPP4 |
| Producción de insulina dependiente de glucosa | ↑ | ↑ |
| Primera fase de la secreción de insulina | ↑ | ↑ |
| Glucagón | ↓ | ↓ |
| Consumo de glucosa | ↑ | ↑ |
| Vaciado gástrico | ↓ | No |
| Ingesta | ↓ | No |
| Peso | ↓ | No |
| Reducción HbA1c | ↓ ↓ | ↓ |
GLP-1: glucagon-like peptide-1 («péptido similar al glucagón tipo 1»); HbA1c: hemoglobina glucosilada; iDPP4: inhibidores de las dipeptidil peptidasas tipo 4.
Los iDPP4 reducen la glucemia basal y posprandial y los valores de HbA1c en cuantía similar a la metformina, las sulfonilureas y la pioglitazona, con una reducción media de 0,6 a 1,2% en comparación con placebo, dependiendo de la HbA1c previa al tratamiento35,36.
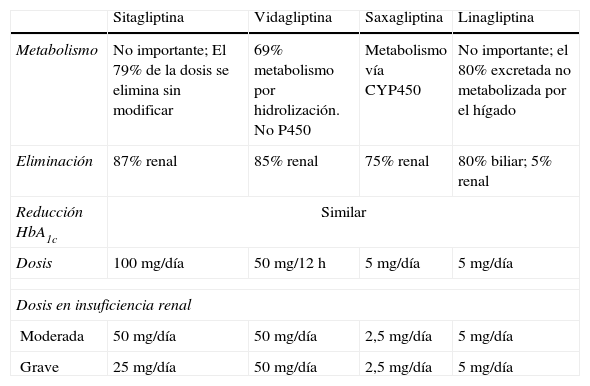
Entre los diferentes iDPP4 comercializados (sitagliptina, vildagliptina, saxagliptina, linagliptina) hay diferencias en la dosis, la selectividad, el metabolismo, la eficacia, y los efectos adversos (tabla 4). Pueden utilizarse en monoterapia o en combinación con otros hipoglucemiantes y con insulina.
Inhibidores de las dipeptidil peptidasas tipo 4
| Sitagliptina | Vidagliptina | Saxagliptina | Linagliptina | |
| Metabolismo | No importante; El 79% de la dosis se elimina sin modificar | 69% metabolismo por hidrolización. No P450 | Metabolismo vía CYP450 | No importante; el 80% excretada no metabolizada por el hígado |
| Eliminación | 87% renal | 85% renal | 75% renal | 80% biliar; 5% renal |
| Reducción HbA1c | Similar | |||
| Dosis | 100mg/día | 50mg/12h | 5mg/día | 5mg/día |
| Dosis en insuficiencia renal | ||||
| Moderada | 50mg/día | 50mg/día | 2,5mg/día | 5mg/día |
| Grave | 25mg/día | 50mg/día | 2,5mg/día | 5mg/día |
DPP4: dipeptidil peptidasas tipo 4; HbA1c: hemoglobina glucosilada.
Un metaanálisis de diferentes ensayos ha demostrado que estos agentes son bien tolerados37; en general, la incidencia de efectos secundarios es similar a la aparecida en el grupo placebo.
Podemos definirlos como un grupo con efecto hipoglucemiante similar al de los fármacos clásicos, bien tolerados, que no producen hipoglucemia ni aumento de peso, por lo que a priori son un grupo muy aceptado. Tienen el inconveniente del alto precio y, como el grupo anterior, faltan los estudios, que están realizándose, para demostrar sus posibles beneficios cardiovasculares.
Inhibidores del cotransportador sodio-glucosa tipo 2Los inhibidores del sodium-glucose cotransporter-2 (SGLT2, «cotransportador sodio-glucosa tipo 2»), o iSGLT2, son un nuevo grupo de hipoglucemiantes que actúan inhibiendo el SGLT2 en el túbulo proximal renal, independientemente de la acción de la insulina. No están actualmente comercializados en España.
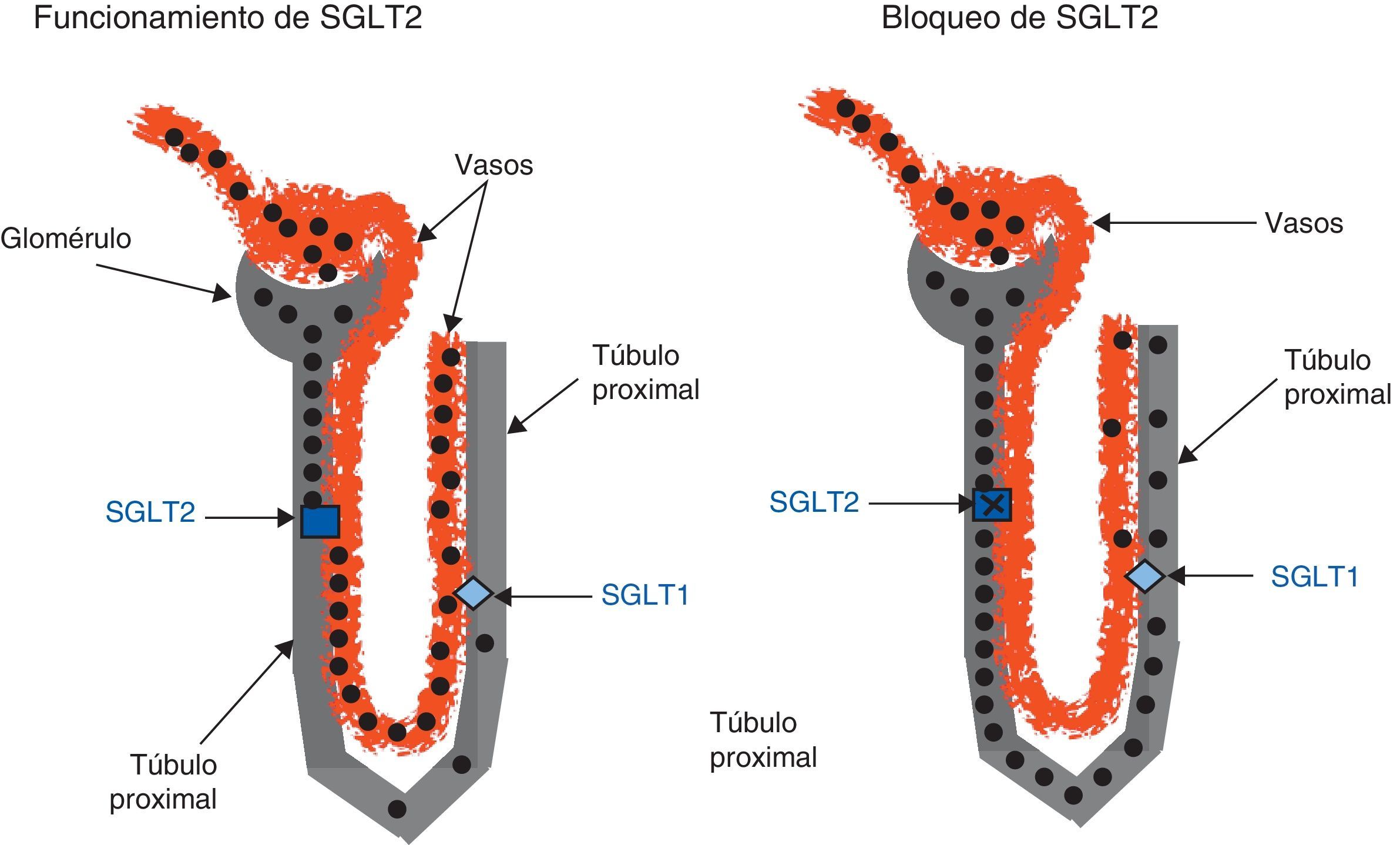
El riñón participa en la homeostasis de la glucosa fundamentalmente con la producción de esta (gluconeogénesis), que en situación de ayuno puede representar un 25% de la producción total de glucosa y con la reabsorción tubular de la glucosa filtrada en el glomérulo38. Diariamente se filtran por los glomérulos unos 180l, y en un sujeto con unos valores normales de glucemia, aproximadamente 180g de glucosa, cantidad que se reabsorbe totalmente en su mayor parte a través de SGLT2, transportador de baja afinidad y alta capacidad ubicado en el segmento S1 del túbulo proximal. El resto de la glucosa filtrada (10%) se reabsorbe en los segmentos S2 y S3 del túbulo proximal por un receptor de baja capacidad y alta afinidad el SGLT1 (fig. 2), responsable también de la absorción de glucosa en el intestino39,40.
Cotransportadores sodio-glucosa en el túbulo renal y acción de los inhibidores del cotransportador sodio-glucosa tipo 2.
Mecanismo de funcionamiento de:
SGLT2: sodium-glucose cotransporter-2 («cotransportador sodio-glucosa tipo 2»).
SGLT1: sodium-glucose cotransporter-1 («cotransportador sodio-glucosa tipo 1»).
El esquema de la izquierda representa la filtración glomerular de glucosa (círculos negros) y su reabsorción en el túbulo proximal por SGLT2 y una pequeña cantidad en el túbulo distal por los SGLT1, no apareciendo glucosa en los segmentos distales, por lo que no hay glucosa en la orina.
El esquema de la derecha representa la acción de inhibir SGLT2, con lo que la glucosa no es reabsorbida en el túbulo proximal por SGLT2, solo se reabsorbe una pequeña cantidad por SGLT1 y llega a los segmentos distales una gran proporción (círculos negros) y, por ello, a la orina.
La inhibición de SGLT2 aumenta la excreción renal de glucosa y, secundariamente, disminuye los valores plasmáticos de esta, con bajo riesgo de hipoglucemia. Por la pérdida de glucosa por la orina, calorías no utilizadas, puede inducir pérdida de peso. En estudios de fase iii hubo una reducción moderada de la HbA1c de 0,5-0,9% y una pérdida de peso de 0,5-3kg, dependiendo de los sujetos estudiados41. Puede ser utilizada sola o en combinación con otros hipoglucemiantes, incluyendo insulina42.
Varios iSGLT2 están en proceso de desarrollo, incluyendo dapagliflozina (ya aprobada y pendiente de comercialización), canagliflozina, ASP1941, LX4211 y BI10773.
Dapagliflozina reduce las concentraciones plasmáticas de glucosa en situación de ayuno y posprandial, la HbA1c y el peso corporal, con bajo riesgo de hipoglucemia. Se metaboliza en el hígado por la vía de la glucorinización y no interacciona con el sistema enzimático CYP.
Ha demostrado ser bien tolerada; como efectos secundarios pueden considerarse la poliuria y la sed. No se recomienda en pacientes con insuficiencia renal moderada (FG<60ml/min/1,73m2) ni en los que tengan una alteración importante de la función hepática. Se ha descrito un aumento de las infecciones del tracto urinario y genital, que puede llegar al 4,8% de los tratados con dapagliflozina comparado con un 0,9% en el grupo control, más frecuente en mujeres que en varones. No hay experiencia a largo plazo sobre beneficios generales y cardiovasculares.
Futuros tratamientosSe están investigando nuevas moléculas; entre otras, tenemos43:
- 1.
Estimulantes de la célula β pancreática por mecanismo diferente al de las incretinas, como la activación de la glucocinasa, que aumenta la producción de ATP, cerrando los canales potasio-ATP e induciendo la secreción de insulina. Están en desarrollo varios activadores de la glucocinasa como piragliatina, compuesto 14, R1511, AZD1656, AZD6370, y otros44. Los activadores de la glucocinasa, en animales diabéticos, aumentan las concentraciones de insulina y disminuyen la glucemia, pero se asocian a aumento de los triglicéridos por mecanismos intrahepáticos e incremento del riesgo de hipoglucemia45.
- 2.
Fármacos dirigidos a corregir la disfunción de las células pancreáticas α y β. Se están desarrollando péptidos híbridos con parte de la secuencia de agonistas del GLP-1R y parte del glucagón, que se unen y bloquean el receptor de este, sin activarlo46. Entre los péptidos de este grupo están diaminopurina dioxolano pegilado y oxintomodulina47. Este grupo busca los efectos de los análogos de GLP-1 con bloqueo del receptor de glucagón; aumenta las concentraciones plasmáticas de glucagón, aunque aparentemente sin asociarse a efectos secundarios. En estudios en animales y humanos tienen efecto hipoglucemiante, junto a disminución de la ingesta y pérdida de peso48.
La DM2 es una situación patológica muy prevalente y en rápido crecimiento, con un elevado riesgo cardiovascular, responsable del 70-80% de las muertes en estos pacientes.
El tratamiento farmacológico hipoglucemiante con fármacos ya establecidos desde hace años (metformina, sulfonilureas, meglitinidas, PPAR-γ agonistas [pioglitazona], inhibidores de la alfaglucosidasa e insulina) utilizados en monoterapia o asociación tienen algunos efectos indeseables que limitan sus efectos beneficiosos.
Nuevos tratamientos han aparecido o están en fase de investigación con el intento de cubrir las deficiencias de los regímenes clásicos. Los basados en el efecto incretina (análogos de GLP-1 e iDPP-4) parecen tener teóricas ventajas, un efecto hipoglucemiante comparable al de los anteriores tratamientos, más potente el GLP-1 que los iDPP4, con escaso riesgo de hipoglucemias, sin aumento de peso y disminución con los análogos de GLP-1. Pero si los tratamientos basados en el efecto incretina pueden prevenir la progresión de la enfermedad no está claro. También falta por demostrar su efecto beneficioso en la prevención de la enfermedad cardiovascular. El GLP-1 tiene la desventaja de la vía de administración, pero nuevas presentaciones de acción prolongada pueden mejorar este aspecto, la calidad de vida y la cumplimentación. Otra cuestión a considerar es su elevado precio. También faltan datos de seguridad a largo plazo.
Los que se fundamentan en la inhibición del SGLT2 son el último grupo introducido. Como el anterior, disminuye la HbA1c y el peso, con bajo riesgo de hipoglucemias. Son bien tolerados, aunque tienen algunos efectos secundarios, como poliuria, sed y aumento de las infecciones urinarias. Obviamente faltan datos sobre enfermedad cardiovascular, tolerancia y efectos secundarios a largo plazo.
El tratamiento de la DM2 se basa en cambios en el estilo de vida (dieta y ejercicio) y corrección de los factores de riesgo cardiovascular. El tratamiento hipoglucemiante ideal aún no existe, aunque cada vez tenemos más y mejores armas terapéuticas. La metformina sigue siendo la primera línea del tratamiento farmacológico por su eficacia, seguridad y pocos efectos secundarios a largo plazo, y por sus probables efectos beneficiosos cardiovasculares. El tratamiento farmacológico hipoglucemiante debe ser personalizado, teniendo en cuenta diversos puntos: potencial hipoglucémico (valor de disminución de HbA1c necesario para llegar a objetivos), equilibrio riesgo-beneficio, riesgo de hipoglucemia y cambios en el peso. La asociación, necesaria en la mayoría de los casos, debe hacerse con los fármacos más adecuados para cada sujeto, basados en los aspectos anteriormente mencionados.
Los nuevos fármacos ya comercializados y basados en el efecto incretina tienen un interesante papel en muchos casos, ya que corrigen los defectos fisiopatológicos de la DM2, tienen una potencia hipoglucemiante similar a la de los tratamientos ya establecidos de segunda línea y tienen efectos beneficiosos modestos en términos de pérdida o no ganancia de peso y no asociación con hipoglucemia. Como hemos comentado, hacen falta ensayos a largo plazo para determinar los posibles beneficios que los diferencien de los tratamientos clásicos y, fundamentalmente, la protección cardiovascular.
Finalmente, tenemos que recordar que hay evidencias que indican que la reducción del riesgo de enfermedad cardiovascular requiere una intervención multifactorial con objetivos en el control de la dislipidemia, la hipertensión y la hiperglucemia.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.