La diabetes mellitus tipo 2 (DM2) constituye un problema epidémico emergente, con incrementos constantes de prevalencia documentados en los últimos años1,2. Las sucesivas estimaciones realizadas en España confirman dicha tendencia: mientras que hace tan sólo unos años se comunicaron cifras en torno al 6,5%3, los últimos estudios indican valores relevantes superiores al 10%4, con un coste anual promedio por paciente de 1.300 e5. Esta enfermedad se asocia a una importante morbilidad debido a sus compli-caciones a largo plazo. A pesar de las sólidas evidencias que demuestran la eficacia del adecuado control de la glucemia6,7 y de otros factores de riesgo8 en la prevención de dichas complicaciones, estudios de cohortes realizados recientemente en España revelan resultados terapéuticos poco óptimos, ya que aproximadamente el 25% de los pacientes presenta cifras de glucemia superiores a los valores objetivo9 y el 50% tiene un control inadecuado de los factores de riesgo cardiovascular10.
El rasgo clínico más característico de este trastorno metabólico es la alteración de la homeostasis de la glucosa, que se asocia al déficit de producción de insulina en el páncreas y a la resistencia a la insulina en los tejidos periféricos, principalmente el músculo estriado, hígado y tejido adiposo11. Asimismo, los pacientes muestran una constelación de otras alteraciones metabólicas, de las cuales las más características son la obesidad central, la dislipemia y la hipertensión, que se asocian a un exceso de riesgo de enfermedad aterosclerótica de grandes vasos12. A la coexistencia de todas estas circunstancias clínicas desfavorables en un paciente se la ha denominado síndrome metabólico13. La hipótesis más aceptada para describir la fisiopatología de este síndrome es la resistencia a insulina14. En presencia de resistencia a la insulina, existe un desequilibrio del metabolismo energético, con acumulación de lípidos en la estroma de varios órganos y la producción de adipocinas, excesiva glucogenia hepática y aumento de la concentración plasmática de ácidos grasos libres, en un trasfondo inflamatorio, alteraciones todas ellas que, a la postre, agravan el síndrome y contribuyen a reducir la sensibilidad a la insulina14,15.
La pioglitazona pertenece al grupo de las tiazolidinedionas, ligandos farmacológicos de los factores de transcripción nuclear-receptores de la activación de peroxisomas gamma. La activación de dichos receptores influye en la expresión de determinados genes que regulan el metabolismo de los hidratos de carbono y lípidos, lo que da lugar al incremento de la captación de glucosa mediada por insulina en el músculo estriado y a la reducción de la glucogenia hepática y la lipólisis en los adipocitos16. Además de mejorar el control glucémico, el tratamiento con pioglitazona se ha asociado a efectos favorables sobre otros factores de riesgo cardiovascular, principalmente hipertrigliceridemia y reducción del colesterol unido a lipoproteínas de alta densidad (cHDL)17,18, que son característicos de los estados de resistencia a la insulina.
La pioglitazona ha demostrado ser eficaz para reducir la hiperglucemia y mejorar el perfil lipídico de pacientes con DM2 en ensayos clínicos aleatorizados17,19,20. En la práctica clínica habitual también se han documentado mejoras del control glucémico21 y de parámetros tanto glucémicos como lipídicos22 con la pioglitazona en el contexto de estudios observacionales, si bien el último de ellos no incluyó un grupo control. El presente artículo presenta los resultados obtenidos a los 6 meses de seguimiento en un estudio de cohortes controlado, cuyo objetivo era evaluar la efectividad de la pioglitazona, en combinación con sulfonilureas o metformina, para mejorar los parámetros lipídicos relacionados con el síndrome metabólico (cHDL y triglicéridos) en pacientes con DM2, en condiciones de práctica clínica habitual. Como objetivos secundarios, se evaluaron los efectos sobre otros parámetros del perfil lipídico y sobre el control glucémico de estos pacientes. Esta información puede ser de utilidad para los profesionales clínicos, puesto que complementa y contrasta los resultados de los ensayos clínicos experimentales y de los estudios observacionales antes mencionados.
Pacientes y método
Población del estudio
Se incluyó a varones y mujeres mayores de edad con diagnóstico de DM2 documentado en la historia clínica a quienes, según el criterio de su médico habitual, se indicó tratamiento combinado con 2 antidiabéticos orales debido a un control glucémico deficiente con el tratamiento anterior. Se excluyó a aquellos con contraindicación para la utilización de los fármacos estudiados (insuficiencia cardíaca o hepática en el caso de pioglitazona y cetoacidosis o insuficiencia renal, hepática o cardíaca en el caso de metformina y sulfonilureas) o en quienes se indicase tratamiento con insulina.
Diseño del estudio
Se trata de un estudio de cohortes prospectivo, multicéntrico, abierto y controlado, de un año de seguimiento, en el que participaron 192 endocrinólogos o internistas de 141 consultas especializadas. En el presente artículo se exponen los resultados obtenidos en el seguimiento de 6 meses. Se invitó a participar en el estudio a especialistas de toda España, de modo que la muestra fuese lo más representativa posible. No obstante, no se establecieron cuotas geográficas para la selección de los centros, por lo que la distribución final de éstos no fue necesariamente proporcional a la población censada en cada región. Se definieron 3 cohortes de pacientes en función del tratamiento combinado con antidiabéticos orales que se les prescribió: a) pioglitazona más sulfonilureas (Pio+SU); b) pioglitazona más metformina (Pio+Met), y c) sulfonilureas más metformina (SU+Met). Cada médico recogió los datos en bloques de 9 pacientes, 3 en cada una de las cohortes. El reclutamiento se realizó siguiendo un estricto orden cronológico en función de la decisión terapéutica tomada a priori por el especialista correspondiente de comenzar tratamiento con una de las 3 combinaciones de fármacos evaluadas. Sin embargo, para que los tamaños de las cohortes fuesen similares, se pidió a los investigadores que no incluyesen a pacientes en un nuevo bloque hasta completar el anterior. La recogida de datos se realizó en el contexto de la práctica clínica habitual. En ningún caso se modificó el tratamiento de un paciente con motivo de su inclusión en el estudio. La dosis de los fármacos antidiabéticos orales se dejó a criterio del médico, si bien se aconsejó respetar las recomendaciones de las respectivas fichas técnicas (de 15 a 30 mg/día en el caso de pioglitazona).
El estudio se efectuó en la observancia de la normativa legal aplicable a la realización de estudios observacionales postautorización en España y fue autorizado, con anterioridad a su ejecución, por los comités éticos de investigación clínica acreditados de las comunidades autónomas concernidas. Todos los pacientes otorgaron su consentimiento informado para la recogida y el análisis de datos de carácter personal de sus historias clínicas.
Evaluaciones de efectividad y tolerabilidad
En la evaluación inicial se recogieron datos demográficos (edad, sexo y edad en el momento del diagnóstico de diabetes) y clínicos (peso, estatura, presión arterial, tabaquismo, presencia o antecedentes de complicaciones microvasculares o macrovasculares y tratamiento previo con antidiabéticos orales, agentes antilipémicos o antihipertensivos). Se completó la descripción de las cohortes en el momento basal con el cálculo del índice de masa corporal (IMC) y la clasificación de los pacientes según las categorías propuestas por la Sociedad Española para el Estudio de la Obesidad (SEEDO)23 y los criterios diagnósticos de síndrome metabólico propuestos por el National Cholesterol Education Program Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (NCEP-ATP-III)12. Como el perímetro abdominal no se recoge de forma sistemática en consulta, se introdujo una ligera modificación en los criterios NCEP-ATP-III, estableciendo que presentaban obesidad abdominal los pacientes con un IMC igual o mayor de 3524.
La efectividad del tratamiento se evaluó a través de los cambios observados en un conjunto de parámetros bioquímicos en sangre en 2 momentos diferentes: en los 30 días anteriores a la modificación del tratamiento antidiabético oral (momento basal) y al cabo de 6 (±1) meses contados a partir de la primera determinación. Se consideraron los siguientes parámetros: concentraciones plasmáticas de cHDL, de colesterol unido a lipoproteínas de baja densidad (cLDL) y de colesterol total; triglicéridos; proporción de hemoglobina glucosilada (HbA1c); glucosa plasmática en ayunas (GPA); alanina-aminotransferasa y creatinina. Las determinaciones se efectuaron en laboratorios locales según sus prácticas habituales de trabajo. Con el fin de ajustar las diferencias entre los respectivos intervalos de normalidad, los resultados se estandarizaron a los intervalos de referencia del laboratorio que más determinaciones realizó para el estudio. Para ello se efectuó una interpolación aritmética de la posición relativa de cada valor dentro del intervalo local al correspondiente intervalo del laboratorio de referencia para cada parámetro. Además, se calcularon 2 variables derivadas: a) el cociente entre las concentraciones plasmáticas de colesterol total y cHDL para identificar a los pacientes con exceso de riesgo de enfermedad coronaria según Wilson et al25 (> 5,3 en varones y > 4,6 en mujeres), y b) el logaritmo decimal del cociente entre las concentraciones plasmáticas de triglicéridos y cHDL (índice de aterogenicidad del plasma, relacionado con el tamaño de las partículas de cLDL y la proporción de colesterol esterificado26). Por último, se evaluó el cumplimiento de los valores objetivo de glucosa y lípidos plasmáticos propuestos por el European Diabetes Policy Group27 (EDPG) mediante el cálculo de las proporciones de pacientes en cada uno de los niveles de riesgo para cada uno de los parámetros de laboratorio. Se registraron, asimismo, todas las modificaciones en los tratamientos hipolipemiantes y antihipertensivos concomitantes que se realizaron durante el seguimiento.
Se registraron y codificaron los acontecimientos adversos ocurridos durante el seguimiento empleando la versión 3.3 del Medical Dictionary for Regulatory Activities (MedDRA). La información recogida incluyó datos específicos para cada evento (fecha de presentación, intensidad, gravedad, desenlace, tratamiento y relación con la medicación en estudio evaluada por el médico). Se recogió de forma específica la aparición de episodios hipoglucémicos. En el control de los 6 meses se determinaron nuevamente las constantes vitales (peso y presión arterial).
Análisis estadístico
Todos los análisis se realizaron sobre datos observados. La seguridad se evaluó empleando los datos disponibles de todos los pacientes incluidos en el estudio, pero se excluyó de los análisis de efectividad a los que no iniciaron tratamiento con alguna de las combinaciones evaluadas. Como la proporción de pacientes que abandonaron el estudio prematuramente fue pequeña y no había controles intermedios entre la visita basal y el control de los 6 meses, no se emplearon técnicas de imputación para los valores perdidos. Todas las inferencias se realizaron con un nivel de significación del 5%.
Las características basales se describieron mediante análisis exploratorio de datos, con medidas basadas en momentos, intervalos y ordenaciones o mediante frecuencias absolutas y relativas, según procediese. Entre ellas se incluyó la proporción de pacientes con síndrome metabólico. Se emplearon análisis de la variancia de un factor o pruebas de la x2, según procediera, para comparar los datos de las 3 cohortes del estudio entre sí.
Para comparar los cambios entre los momentos basal y final de los valores estandarizados de los parámetros bioquímicos determinados y las correspondientes variables derivadas entre las cohortes, se emplearon modelos de análisis de la covariancia (ANCOVA), utilizando la cohorte correspondiente como factor y los respectivos valores basales como covariables con el fin de ajustar por eventuales diferencias basales entre los grupos. En los casos en que se consideró conveniente realizar comparaciones 2 a 2 entre las cohortes del estudio se emplearon pruebas de Tuckey post hoc ajustadas por multiplicidad. Se consideró que respondían al tratamiento los pacientes que presentaron una reducción de la GPA igual o mayor de 30 mg/dl, así como una reducción de la HbA1c mayor del 0,6% o un valor absoluto igual o inferior al 7% a los 6 meses28. Las proporciones de pacientes con respuesta al tratamiento se compararon entre las cohortes mediante pruebas de la x2. Se emplearon también pruebas de la x2 de Mantel-Haenszel para comparar las distribuciones de frecuencias de pacientes en cada uno de los niveles de riesgo establecidos por la EDPG entre el momento basal y la evaluación de los 6 meses. Los cambios intracohorte de dichas frecuencias se analizaron con pruebas de McNemar.
Se calcularon y compararon entre cohortes las frecuencias de pacientes con acontecimientos adversos relacionados y con episodios hipoglucémicos, y en cada categoría de la SEEDO según su IMC, mediante pruebas de la x2 o exactas de Fisher.
Se calculó un tamaño muestral de 2.190 pacientes a distribuir entre 3 cohortes para disponer de una potencia estadística del 90% con el fin de detectar una diferencia de al menos 2 mg/dl entre 2 medias de cHDL, asumiendo una desviación estándar común de 9,12 mg/dl19,20,29 con una prueba de la t bilateral en un nivel de significación de 0,05.
Resultados
Distribución de los pacientes y características basales
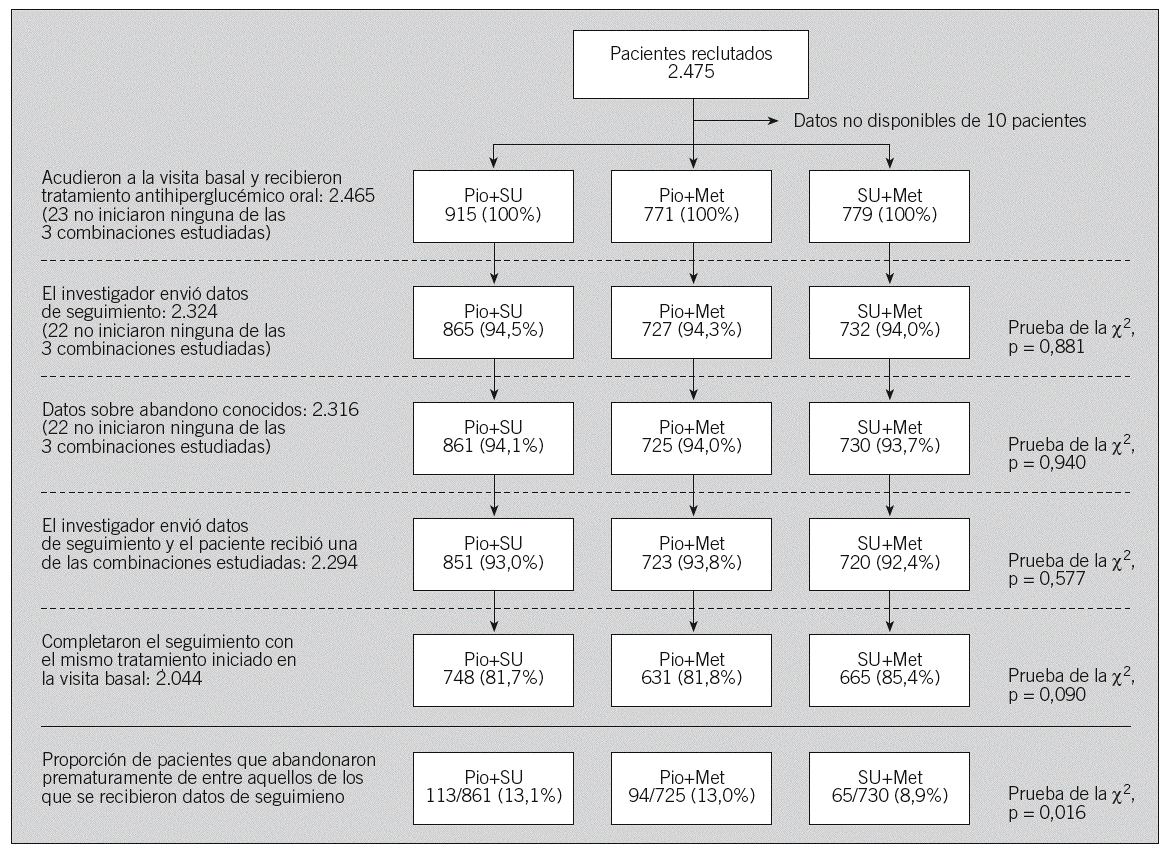
La distribución de los pacientes se presenta con detalle en la figura 1. Entre noviembre de 2001 y enero de 2002 se incluyó a un total de 2.475 pacientes (firma del consentimiento informado), cifra que corresponde a una media de 12,9 (1,3 bloques de 9) pacientes por investigador, si bien no se obtuvo ningún dato adicional de 10 de ellos. De los restantes 2.465, 23 no iniciaron tratamiento con ninguna de las combinaciones evaluadas. Se recibieron datos de seguimiento de 2.324, que constituyeron el grupo para los análisis de seguridad, aunque sólo se recibieron datos completos sobre si habían abandonado o no el estudio y sobre los parámetros de efectividad de 2.316. De ellos, se excluyó a otros 22 de los análisis de efectividad, que se hicieron sobre 2.294 pacientes (un 92,7% de la muestra), por estar entre los que no habían iniciado tratamiento con ninguna de las 3 combinaciones del estudio. La distribución de los pacientes con datos de seguimiento conocidos fue similar entre las cohortes (fig. 1).
Fig. 1. Distribución de los pacientes y poblaciones utilizadas en los análisis. Met: metformina; Pio: pioglitazona; SU: sulfonilureas.
De los 2.316 pacientes de quienes se recibieron datos de seguimiento completos, 272 (11,7%) abandonaron el estudio prematuramente. Esta proporción fue ligera pero significativamente superior en la cohorte SU+Met (prueba de la x2, p = 0,016). Las causas más comunes de abandono fueron, por orden de frecuencia, la pérdida de seguimiento (n = 86; 31,7%), la falta de eficacia (n = 78; 28,8%) y la retirada del consentimiento (n = 40; 14,8%). La distribución de los motivos de abandono entre las cohortes presentó algunas variaciones: la pérdida de seguimiento fue más frecuente en la cohorte de SU+Met que en las de pioglitazona; lo contrario sucedió con la retirada del consentimiento.
En la tabla 1 se presentan detalladamente las características basales de los pacientes incluidos en los análisis de efectividad. Los valores medios de GPA, HbA1c y colesterol total se encontraban por encima de los umbrales de riesgo microvascular y macrovascular significativo establecidos por el EDPG. Los valores séricos de triglicéridos, colesterol total, GPA y HbA1c, así como la prevalencia de síndrome metabólico, fueron en general superiores en las cohortes formadas por combinaciones de pioglitazona.
Únicamente el 14,3% de los pacientes que comenzaron el tratamiento en una de esas cohortes lo hizo con una dosis inicial de 15 mg/día. De éstos, un quinto (20,9%) la había incrementado a 30 mg/día al cabo de los 6 meses. Las sulfonilureas más frecuentes (> 10% de los pacientes) fueron glimepirida (27,8%), glibenclamida (19,9%) y gliclacida (15,7%); las dosis medianas de estos fármacos (4; 15, y 240 mg/día, respectivamente) fueron similares en todas las cohortes y no presentaron variaciones al cabo de los 6 meses. El 62,9% de los pacientes recibió metformina (cohortes Pio+Met y SU+Met). La dosis mediana fue de 1.700 mg/día y no varió durante el estudio.
Control de la lipemia y la glucemia
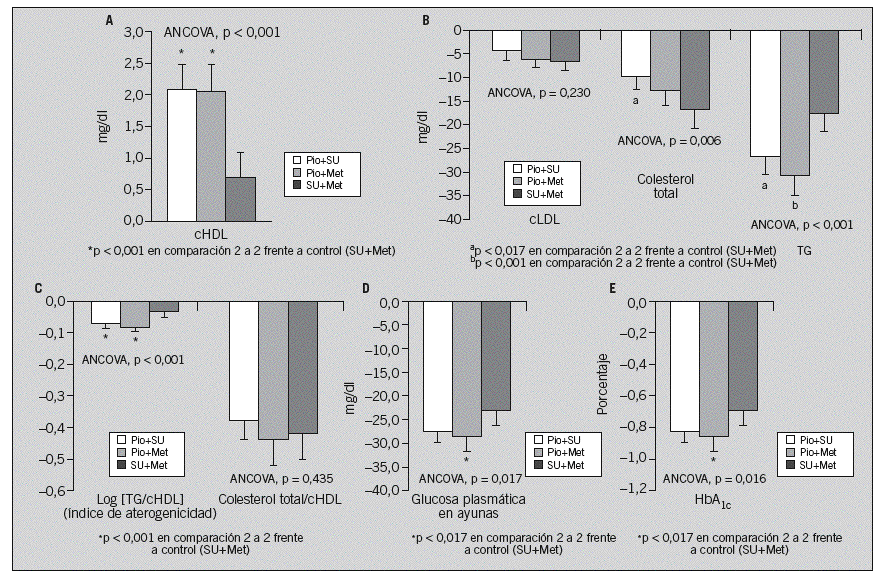
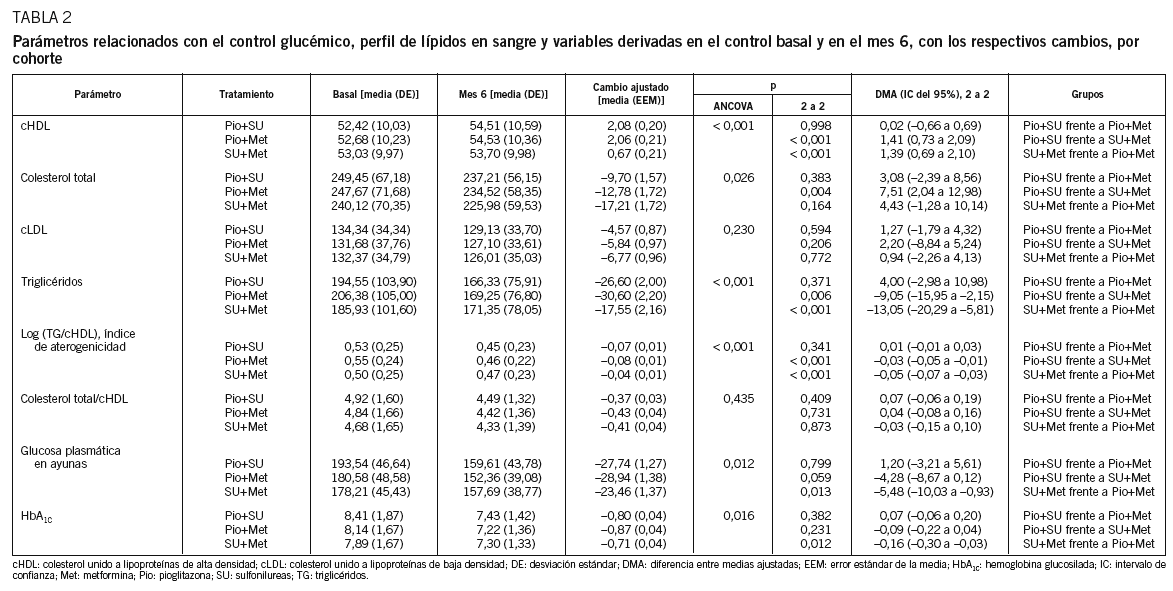
Los cambios que experimentaron los parámetros relacionados con el control de la lipemia y la glucemia entre el momento basal y el control a los 6 meses se describen en la tabla 2 y se ilustran en la figura 2. La concentración de cHDL aumentó en todas las cohortes (tabla 2 y fig. 2A), si bien el incremento fue significativamente mayor en los pacientes tratados con cualquier combinación de pioglitazona que en los tratados con SU+Met. Lo mismo ocurrió con la reducción de triglicéridos (tabla 2 y fig. 2B). Aunque numéricamente mayores en la cohorte control que con las combinaciones de pioglitazona, los descensos de la concentración de cLDL fueron similares en todas las cohortes (tabla 2; fig. 2). La concentración de colesterol total descendió en todas las cohortes (tabla 2 y fig. 2B), aunque más en los pacientes tratados con SU+Met que en los tratados con las combinaciones de pioglitazona, alcanzando significación estadística las diferencias entre las cohortes Pio+SU y SU+Met. Por último, el índice de aterogenicidad del plasma descendió en todas las cohortes (tabla 2 y fig. 2C), aunque significativamente más en los pacientes tratados con las combinaciones de pioglitazona que en los tratados con SU+Met.
Fig. 2. Cambios desde el control basal hasta el mes 6 en los parámetros bioquímicos estandarizados y en las variables derivadas, por cohorte. cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; HbA1C: hemoglobina glucosilada; Met: metformina; Pio: pioglitazona; SU: sulfonilureas; TG: triglicéridos. Las barras indican las medias ajustadas (por mínimos cuadrados) de los cambios intracohorte, con sus respectivos intervalos de confianza del 95% (patillas). Los valores de p indicados corresponden a los contrastes entre las 3 cohortes, y son estadísticamente significativos los inferiores a 0,05. *,a,bDiferencias significativas corregidas 2 a 2 entre la cohorte indicada y la cohorte control (SU+Met).
Más de un tercio de los pacientes (37,9%) recibieron fármacos hipolipemiantes durante los 6 meses de seguimiento (un 35,6, un 38,0 y un 40,4% en las cohortes de Pio+SU, Pio+Met y SU+Met, respectivamente). Con la excepción de los valores de cHDL, los cambios en los demás parámetros lipídicos fueron mayores entre los pacientes que recibieron dichos fármacos que entre los que no, con independencia de su cohorte de tratamiento (datos no incluidos).
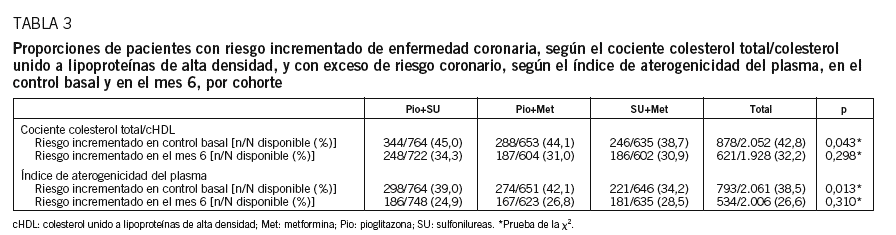
La proporción de pacientes con exceso de riesgo coronario, determinado por los valores críticos de los parámetros derivados (cociente colesterol total/cHDL e índice de aterogenicidad del plasma), descendió en toda la muestra. Los descensos de ambos parámetros fueron mayores en las cohortes de pioglitazona que en la cohorte control (tabla 3).
Los parámetros relacionados con el control glucémico mejoraron en todas las cohortes (tabla 2 y figs. 2D y 2E), si bien esta mejoría fue mayor en los pacientes tratados con las combinaciones de pioglitazona que en los tratados con SU+Met, alcanzando significación estadística las diferencias entre las cohortes Pio+Met y SU+Met. Cerca de dos tercios (el 64,9% de los pacientes) cumplieron los criterios glucémicos de respuesta en el mes 6. Por cohortes, estas proporciones fueron del 69,9, el 66,8 y el 56,9% con Pio+SU, Pio+Met y SU+Met, respectivamente, siendo significativamente mayores con las combinaciones de pioglitazona que en la cohorte control (prueba de la x2, p < 0,001 y p = 0,001, respectivamente).
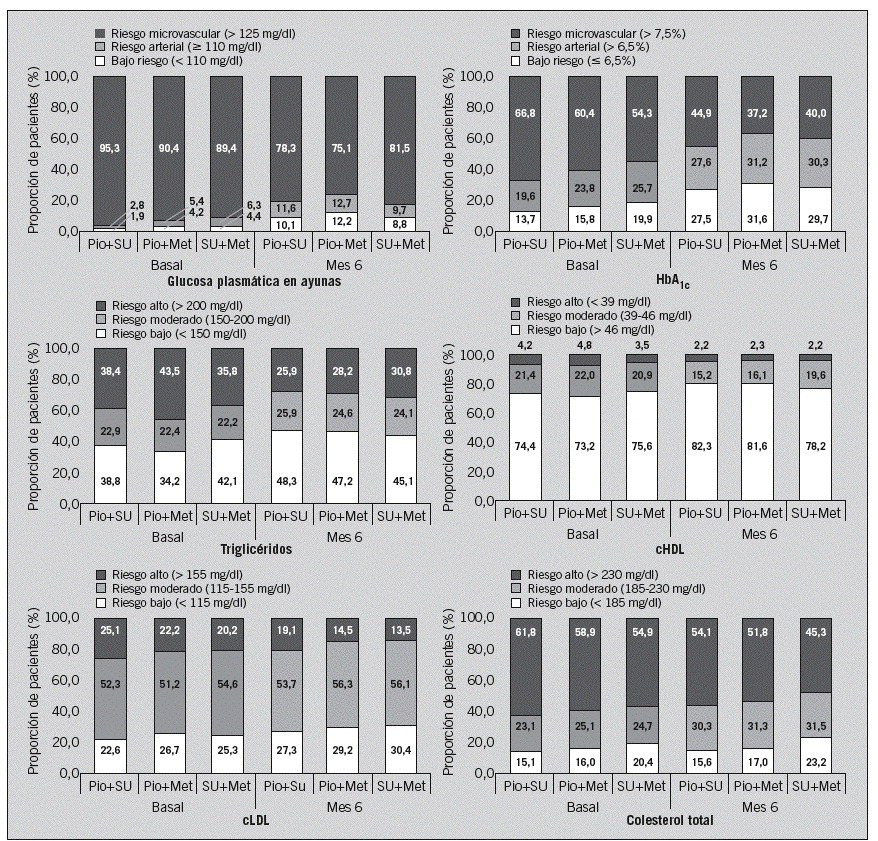
En la figura 3 se presenta la distribución de los pacientes atendiendo a los valores críticos de control glucémico y lipídico establecidos por el EDPG tanto en el momento basal como en el mes 6. La proporción de pacientes en niveles bajos de riesgo según los parámetros correspondientes al control lipémico, y en especial los relacionados con el síndrome metabólico (triglicéridos y cHDL), aumentó más con las combinaciones de pioglitazona que en la cohorte control. Por el contrario, la proporción de pacientes en riesgo debido a los valores del cLDL descendió más en la cohorte SU+Met. Las proporciones de pacientes en niveles de riesgo bajo atendiendo a los valores de GPA y HbA1C aumentaron en todas las cohortes (en la figura 3 se detallan los cambios dentro de cada cohorte).
Fig. 3. Distribución de los pacientes entre los niveles de riesgo cardiovascular, según los valores de glucosa y lípidos en sangre propuestos por el European Diabetes Policy Group, en el control basal y en el mes 6 por cohorte. cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; HbA1C: hemoglobina glucosilada; Met: metformina; Pio: pioglitazona; SU: sulfonilureas. El tamaño total de la muestra es de 2.294 pacientes: 851 en la cohorte de Pio+SU; 723 en la de Pio+Met, y 720 en la de SU+Met. Las proporciones se han calculado respecto al total de pacientes disponible en cada momento para el parámetro correspondiente, que en algunos casos fue inferior al total de pacientes incluidos en cada cohorte.
Presión arterial
Se produjeron descensos de la presión arterial en todas las cohortes, si bien fueron mayores en las cohortes de pioglitazona. La media (error estándar) del cambio de la presión arterial sistólica fue de 2,5 (0,5), 3,5 (0,5) y 1,7 (0,5) mmHg, y de la presión arterial diastólica de 1,8 (0,3), 1,4 (0,3) y 1,3 (0,3), en las cohortes Pio+SU, Pio+Met y SU+Met, respectivamente. La comparación de cohortes 2 a 2 reveló diferencias significativas entre las de Pio+Met y SU+Met en el caso de la presión sistólica. Al observar por separado los cambios en los pacientes con (n = 902) y sin medicación antihipertensiva concomitante (n = 1.392), se aprecia que los cambios acontecidos en la muestra completa se deben a los presentados por los primeros, mientras que son prácticamente inexistentes entre los segundos (datos no incluidos).
Análisis de la tolerabilidad
El 7,4% de los pacientes presentó al menos un acontecimiento adverso entre el control basal y el de los 6 meses. La distribución de los acontecimientos adversos entre las cohortes fue homogénea (prueba de la x2, p = 0,216). Ninguno de ellos fue grave. Por sistema orgánico, los más frecuentes (observados en al menos el 1% de los pacientes) fueron los clasificados como trastornos generales (un 1,6% de los pacientes), entre los que figuraban los casos de edema, seguidos de los trastornos gastrointestinales (1,5%). Hubo más casos de edema en las cohortes de pioglitazona (un 1,8% de los pacientes de cada una de las cohortes Pio+SU y Pio+Met) que en la cohorte SU+Met (0,3%). Sólo se comunicó un caso de colelitiasis en un paciente de la cohorte Pio+Met. No se registró ningún otro acontecimiento adverso del sistema hepatobiliar.
Los episodios hipoglucémicos se analizaron por separado y ocurrieron en el 8,2% de los pacientes. Su frecuencia fue significativamente menor (prueba de la x2, p = 0,005) en la cohorte Pio+Met (5,5%) que en las otras 2 (un 9,2% en Pio+SU y un 9,7% en SU+Met). Los episodios hipoglucémicos graves fueron infrecuentes (un 0,4% de los pacientes) y se distribuyeron de forma homogénea entre las cohortes.
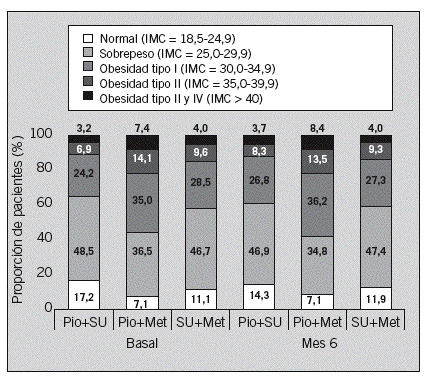
El peso corporal varió de forma dispar entre las cohortes, con aumentos en lae el control basal y el mes 6 fueron: +1,0 kg con Pio+SU; +0,4 kg con Pio+Met, y 0,3 kg con SU+Met. Las diferencias entre cohortes alcanzaron la significación estadística, encontrándose también diferencias en los contrastes 2 a 2 realizados posteriormente (valores de p ajustados de los contrastes post hoc < 0,001; 0,023, y 0,036 para los contrastes entre Pio+SU y SU+Met; Pio+Met y SU+Met, y Pio+SU y Pio+Met, respectivamente). La evolución del IMC fue, no obstante, similar entre cohortes, con ligeros aumentos en las cohortes de pioglitazona y descensos en la cohorte control. Las medias ajustadas del cambio entre el control basal y el mes 6 fueron: +0,4 con Pio+SU; +0,1 con Pio+Met, y 0,1 con SU+Met. En consecuencia, la proporción de pacientes con obesidad aumentó ligeramente en ambas cohortes de pioglitazona, a expensas de la de pacientes con peso normal, mientras que en la cohorte control apenas se apreciaron variaciones (fig. 4).
Fig. 4. Distribución del índice de masa corporal (IMC), según las categorías propuestas por la Sociedad Española para el Estudio de la Obesidad (SEEDO), en el control basal y en el mes 6, por cohorte. Met: metformina; Pio: pioglitazona; SU: sulfonilureas. El tamaño total de la muestra es de 2.294 pacientes: 851 en la cohorte de Pio+SU; 723 en la de Pio+Met, y 720 en la de SU+Met. Las proporciones se han calculado respecto al total de pacientes disponible en cada momento para el parámetro correspondiente, que en algunos casos fue inferior al total de pacientes incluidos en cada cohorte.
Discusión
En el presente estudio observacional, realizado en condiciones de práctica clínica habitual, el tratamiento combinado por vía oral con pioglitazona y una sulfonilurea o metformina se asoció, comparado con la combinación oral ampliamente utilizada de sulfonilureas y metformina, a una mejoría significativa de los parámetros relativos al control de la lipemia que guardan relación con la resistencia a la insulina y el riesgo cardiovascular (triglicéridos, cHDL, cociente colesterol total/cHDL e índice de aterogenicidad del plasma) en pacientes con DM2. Asimismo, en comparación con la cohorte control, los pacientes tratados con las combinaciones de pioglitazona presentaron un control más satisfactorio de la glucemia y un beneficio clínico adicional en términos de reducción de la presión arterial cuando recibían además medicación antihipertensiva. No obstante, el grupo Pio+SU presentó ligeros aumentos del peso y del IMC, en contraste con el descenso observado entre los que recibieron SU+Met.
Se ha demostrado que la pioglitazona y en general las tiazolidinedionas es beneficiosa por revertir el proceso aterosclerótico de distintas formas más allá de su efecto sobre la captación de glucosa30,31. Esta información se ha confirmado recientemente en humanos32,33. Sin embargo, aún no se dispone de una demostración directa de los beneficios clínicos de dichos efectos no glucémicos. A excepción del UKPDS, en el que se demostró una reducción de ictus y mortalidad por cualquier causa con metformina7, y del estudio PROactive, en el que la adición de pioglitazona al tratamiento de pacientes con DM2 y alto riesgo de complicaciones microvasculares se asoció a una reducción del 16% del evento combinado de muerte, ictus e infarto agudo de miocardio no fatal en comparación con placebo34, se dispone de pocas evidencias acerca de los beneficios clínicos que a largo plazo tienen los antidiabéticos orales en la enfermedad macrovascular.
En la actualidad existen pocas dudas acerca del potencial antiaterógeno del cHDL o de los efectos sinérgicos entre la hipertrigliceridemia y otros factores de riesgo lipídicos en el riesgo de enfermedad cardiovascular, así como del beneficio, en términos de reducción de la morbimortalidad cardiovascular, que se asocia al tratamiento con fármacos que actúan específicamente sobre estas dianas bioquímicas35-40. Por otra parte, la numérica, que no estadística, menor reducción del cLDL observada con pioglitazona, en comparación con el tratamiento control, en el presente estudio puede responder al incremento de la concentración de partículas de LDL grandes y ligeras, a expensas de las densas y pequeñas41, como indicaría la reducción del índice de aterogenicidad del plasma26. De hecho, se ha comunicado que la pioglitazona y la troglitazona (pero no la rosiglitazona) son eficaces para mejorar la calidad de las partículas de LDL42. La calidad, más que la cantidad, de las partículas de LDL se ha asociado con el exceso de riego cardiovascular que presentan los pacientes diabéticos con respecto a los no diabéticos43.
La prevalencia de síndrome metabólico, definido según los criterios del NCEP-ATP-III, fue elevada (49,3%) en el presente estudio, a pesar de que probablemente se subestimó al no disponer del perímetro abdominal de los pacientes. Este dato corrobora otros hallazgos anteriores10,44 y apoya la validez de la conceptualización de la resistencia a la insulina como un síndrome complejo por el que algunos pacientes reciben la etiqueta diagnóstica de DM2. Desde esta perspectiva, el tratamiento de esta enfermedad debe entenderse como una intervención sobre la constelación de factores de riesgo que incluye este fenotipo clínico.
El aumento de peso es un efecto conocido de las tiazolidinedionas. Se han comunicado incrementos de entre 2 y 4 kg, que se estabilizan aproximadamente al cabo de los 6 meses de tratamiento45. Dicho efecto se ha atribuido al aumento del depósito en el tejido adiposo subcutáneo como consecuencia del aumento de la lipogenia. Los aumentos de peso que se observaron con la pioglitazona en el presente estudio fueron modestos, especialmente cuando se administró combinada con metformina. Esto apoya la atractiva idea de que la combinación con metformina puede reducir el potencial de las tiazolidinedionas de aumentar el peso corporal45.
El presente estudio tiene limitaciones obvias por la asignación no aleatoria de los tratamientos a los pacientes. La presencia de sesgos de asignación puede implicar, por tanto, que haya factores de confusión que afecten a las estimaciones de los efectos46. No obstante, las características basales de los pacientes fueron comparables entre las cohortes, a excepción de la edad y la prevalencia del síndrome metabólico. En general, los pacientes de la cohorte Pio+Met eran más jóvenes y presentaron más factores de riesgo cardiovascular que los de las otras 2. Debido a que estas diferencias apuntan a un peor estado clínico, tanto podrían haberse sobrestimado como subestimado los efectos en esta cohorte, puesto que las mejorías han de ser necesariamente mayores que en las otras 2, al mismo tiempo que pueden estar sujetas a un mayor fenómeno de regresión a la media que explicase la mayor magnitud de los cambios entre los momentos basal y final. Debido a la gran complejidad de los fenómenos metabólicos que subyacen a las manifestaciones clínicas de la DM2, también es posible que parte de las diferencias observadas entre las cohortes se deban a otras variables no recogidas en el estudio. Sin embargo, dado el amplio conjunto de datos sociodemográficos y clínicos obtenidos (siempre dentro de los límites que impone un diseño observacional), así como la congruencia de los resultados en el sentido de haber observado cambios coherentes en todas las variables secundarias, es improbable la existencia de sesgos asociados a variables no recogidas. Por otro lado, no se dispone de datos sobre marcadores de inflamación, cuya mejora puede asociarse a un mayor descenso del riesgo cardiovascular, si bien otros estudios han demostrado recientemente un efecto directo sobre estos marcadores45. En nuestro trabajo no se estimó oportuna su determinación con el fin de no interferir en la práctica clínica habitual. Otra limitación digna de mención se refiere a la potencia estadística del estudio para detectar diferencias entre las cohortes. Éste se diseñó y dimensionó originalmente para comparar los cambios observados en la concentración de lipoproteínas entre cohortes; por consiguiente, las restantes inferencias deben considerarse exploratorias. Como el tamaño de la muestra es grande, la significación clínica y la estadística pueden no ir parejas y la primera ha de juzgarse en virtud de la magnitud de los efectos. Por último, como ya se ha indicado en el apartado de «Análisis estadístico», no se emplearon técnicas para imputar los valores perdidos. Esto imposibilita la realización de análisis de sensibilidad para valorar si los datos de los pacientes que abandonaron por motivos relacionados con los tratamientos evaluados podrían afectar a las conclusiones. Esto último es improbable porque la proporción de abandonos fue baja y en la mayoría de los casos la razón no pudo vincularse explícitamente con el tratamiento por ser pérdidas de seguimiento.
En conclusión, la principal aportación de este trabajo estriba en haber evidenciado, en condiciones de práctica clínica habitual, efectos tanto glucémicos como no glucémicos de la pioglitazona en una muestra grande y heterogénea de pacientes con DM2. En este sentido, complementa los hallazgos de los ensayos clínicos de registro y consolida los datos sobre su efectividad clínica obtenidos en los estudios observacionales realizados hasta ahora. Aunque no se trata de un estudio de resultados clínicos, la eventual relevancia clínica de los efectos observados ha podido estimarse mediante las tablas de predicción de riesgo del EDPG, revelando un mayor beneficio en las cohortes de pioglitazona que en la cohorte control.
Médicos que han participado en el estudio (por orden alfabético)
Alberto García Valdés (Hospital Militar del Aire, Madrid), Alberto Gilsanz Peral (Hospital La Fe, Comunidad Valenciana), Alfonso Arranz Martín (Hospital Nuestra Señora de Sonsoles, Castilla y León), Alfonso Calañas Continente (Hospital Reina Sofía, Hospital General, Andalucía), Alfonso Gentil Baldrich (Hospital Universitario Virgen Macarena, Andalucía), Alfonso González-Cruz Cervellera (Hospital General Universitario de Valencia, Comunidad Valenciana), Alfonso Pumar López (Centro Periférico de Especialidades Virgen de Los Reyes, Andalucía), Alfredo Luis Michan Doña (Hospital Jerez de la Frontera, Andalucía), Alicia Picón Martínez (Ambulatorio Bola Azul, Andalucía), Alicia Serraclara Pla (Ambulatorio de Villaverde Cruce, Madrid), Amparo Marco Martínez (Hospital Virgen de la Salud, Castilla-La Mancha), Amparo Segura Galindo (Ambulatorio Peña Pietra, Madrid), Andreu Nubiola Calonge (Hospital Espíritu Santo, Cataluña), Ángel González Amieva (Hospital Valle de los Pedroches, Andalucía), Antonio Acosta Socorro (Hospital General de Gran Canaria Dr. Negrín, Canarias), Antonio Becerra Fernández (Centro de Especialidades San Blas, Madrid), Antonio Campayo Ibáñez (Hospital de Onteniente, Comunidad Valenciana), Antonio Espino Montoro (Hospital de la Merced, Andalucía), Antonio Fernández Moyano (Hospital San Sebastián, Andalucía), Antonio Hernández López, Cristina Lamas Oliveira (Complejo Hospital General de Albacete, Castilla-La Mancha), Antonio López-Guzmán Guzmán (Hospital Nuestra Señora de Sonsoles, Castilla y León), Antonio Miguel Hernández Martínez (Hospital Virgen de la Arrixaca, Murcia), Antonio Picó Alfonso (Hospital General de Alicante, Comunidad Valenciana), Antonio Pozuelo González (Hospital 12 de Octubre, Madrid), Antonio Robles Iniesta (Hospital General de Requena, Comunidad Valenciana), Antonio Vicente Casanova (Hospital Clínico Universitario de Valencia, Comunidad Valenciana), Aurelia Villar Bonet (Hospital Universitario y Clínico de Valladolid, Castilla y León), Azucena Rodríguez Robles (Hospital Nuestra Señora de Alarcos, Castilla-La Mancha), Basilio Moreno Esteban (Hospital Gregorio Marañón, Madrid), Benito Blanco Samper (Hospital Nuestra Señora del Prado, Castilla-La Mancha), Blas Gil Extremera (Hospital Clínico San Cecilio, Andalucía), Braulio León Villaverde (Hospital Virgen de Las Nieves, Andalucía), Cándido Rodríguez Vázquez (Hospital Provincial de Badajoz, Extremadura), Carlos de Gorospe Pérez-Jáuregui (consulta privada, Madrid), Carlos Jericó Alba (Hospital del Mar de Barcelona, Cataluña), Carlos Lobón Cerviá (Centro de Especialidades Delicias, Castilla y León), Carlos Sánchez Juan (Hospital de Sagunto, Comunidad Valenciana), Carmelo Gómez Aparicio (Hospital Virgen de la Luz, Castilla-La Mancha), Carmen de Miguel Canalejas (consulta de endocrinología y nutrición, Madrid), Carmen Fajardo Montañana (Hospital de la Ribera, Comunidad Valenciana), Carmen Tusón Rovira (Hospital de Cabueñes, Asturias), Ceferino Martínez Faedo (Hospital Álvarez Buylla, Asturias), Concepción Blanco Carrera (Hospital Príncipe de Asturias, Madrid), Concepción Valerón Martel (Ambulatorio Casa del Mar, Canarias), Cristina Hernández Herrero (Hospital Universitario Virgen Macarena, Andalucía), Daniel Antonio de Luis Román (Hospital Universitario Río Hortega, Castilla y León), Daniel Cepero García (Hospital Torrecárdenas, Andalucía), David Lorente Garces (consulta privada, Comunidad Valenciana), Diego Bellido Guerrero (Hospital Naval del Ferrol, Galicia), Diego Godoy Rocati (Hospital General Universitario de Valencia, Comunidad Valenciana), Diego Gómez Reyes (consulta privada, Madrid), Diego Miragaya García (Hospital La Línea, Andalucía), Eduardo Faure Nogueras (Hospital Clínico de Zaragoza Lozano Blesa, Aragón), Eduardo Guerrero Martínez (Hospital Río Carrión, Castilla y León), Enric Ballestar Mas (Hospital de Mataró, Cataluña), Enrique Castro Martínez (Hospital Nuestra Señora de la Montaña, Extremadura), Enrique Costilla Martín (Hospital General Universitario de Guadalajara, Castilla-La Mancha), Enrique González Sarmiento (Hospital Universitario y Clínico de Valladolid, Castilla y León), Enrique Hernández Alonso (Hospital Naval del Mediterráneo, Murcia), Enrique Rodilla Sala (Hospital de Sagunto, Comunidad Valenciana), Felipe Molina Molina (Hospital Ciudad de Jaén, Andalucía), Fernando Ferrón Vidán (Hospital del Conxo, Galicia), Fernando Losada Viñau (Centro Periférico de Especialidades Virgen de los Reyes, Andalucía), Ferran Rius Riu (Hospital Arnau de Vilanova, Cataluña), Florentino Casal Álvarez (Hospital de Cabueñes, Asturias), Francisco Javier Ampudia Blasco (Hospital Clínico Universitario de Valencia, Comunidad Valenciana), Francisco Javier del Cañizo Gómez (Centro de Especialidades Montes de Barbanza, Madrid), Francisco Javier del Cazo Cativiela (Hospital García Orcoyen, Navarra), Francisco Javier Maravall Royo (Hospital Arnau de Vilanova, Cataluña), Francisco Javier Novoa Mogollón (Hospital Insular, Canarias), Francisco José Pérez Blanco (Hospital Clínico Universitario San Cecilio, Andalucía), Francisco José Pomares Gómez (Hospital Clínico de San Juan, Comunidad Valenciana), Gabriel Macanás Botia (Hospital Nuestra Señora del Rosell, Murcia), Ginés Gascón Ramón (Hospital La Plana, Comunidad Valenciana), Gloria Cervello Donderis (consulta privada, Comunidad Valenciana), Gonzalo Piédrola Maroto (Hospital Virgen de las Nieves, Andalucía), Ignacio García Puente (Hospital General de Gran Canaria Dr. Negrín, Canarias), Ignacio Martín Suárez (Hospital Juan Ramón Jiménez, Andalucía), Ignacio Martínez Usó (Centro de Especialidades de Sueca, Comunidad Valenciana), Ignacio Ramos Casamayor (Hospital Vega Baja, Comunidad Valenciana), Iraida Gómez-Lobo González (Ambulatorio de Orcasitas, Madrid), Isaac Levy Mizrahi (Hospital Clínic i Provincial de Barcelona, Cataluña), Isidoro Carmona de Torres (Clínica Sagrado Corazón, Andalucía), Jacinto Fernández Pardo (Hospital General Universitario, Murcia), Jaime Binimelis Vidal (Clínica Juaneda. Consulta privada, Baleares), Javier Espiga Alzola (Fundació Hospital de Mollet, País Vasco), Javier Izaguirre Anduaga (Hospital de la Princesa, Madrid), Javier Peñafiel Martínez (Hospital Torrecárdenas, Andalucía), Javier Rivera Guzmán (Hospital Provincial de Córdoba, Andalucía), Javier Santamaría Sandi (Hospital de Cruces, Baracaldo, País Vasco), Jesús Lorente Campos (Hospital Militar San Carlos, Andalucía), Jesús Mayos Pérez (Fundació Sanitària d'Igualada, Cataluña), Jesús Yanini Viana (consulta privada, Comunidad Valenciana), Joaquín Martí Colomer (Hospital Francesc de Borja, Comunidad Valenciana), Joaquín Pechuan Asensio (consulta particular, Andalucía), Joaquín Serrano Gotarredona (Hospital Verge dels Lliris, Comunidad Valenciana), Jordi Anglada Barceló (Hospital Mutua de Terrassa, Cataluña), Jordi Mesa Manteca (Hospital Vall d'Hebron, Cataluña), Jorge Portillo Martín (Ambulatorio de Especialidades Jaime I, Comunidad Valenciana), Jorge R. García Pérez (Instituto Social de la Marina, Casa del Mar, Andalucía), Jorge Reverter Calatayud (Hospital Germans Trias i Pujol, Cataluña), Jorge Sales Sanz (Hospital Vega Baja, Comunidad Valenciana), José Antonio Rubio García (Hospital Príncipe de Asturias, Madrid), José Aurelio Fernández Álvarez (Hospital Costa Burela, Galicia), José Contreras Gilbert (Hospital Universitario Virgen Macarena, Andalucía), José Francisco López Martínez (Hospital Rafael Méndez, Murcia), José Luis Griera Borrás (Hospital Universitario Virgen Macarena, Andalucía), José Luis Pinzón Martín (Hospital Universitario Virgen de la Victoria, Andalucía), José Manuel Badenas Sierra (consulta privada, Madrid), José Manuel García-Almeida (Hospital Clínico de Málaga, Andalucía), José Manuel Miralles García (Hospital Universitario de Salamanca, Castilla y León), José Manuel Querol Ribelles (Hospital Lluís Alcanyís, Comunidad Valenciana), José Manuel Quesada Gómez (Hospital Provincial de Córdoba, Andalucía), José Manuel Ruiz Palomar (Centro de Especialidades San Blas, Comunidad Valenciana), José Miguel Braza Ramos (Instituto Social de la Marina, Casa del Mar, Andalucía), José Ramón Calabuig Alborch (Hospital La Fe, Comunidad Valenciana), José Ramón Domínguez Escribano (Hospital Clínico de San Juan, Comunidad Valenciana), José Sabán Ruiz (Hospital Ramón y Cajal, Madrid), José Villar Ortiz (Hospital Virgen del Rocío de Sevilla, Andalucía), José Zurro Hernández (Hospital Universitario y Clínico de Valladolid, Castilla y León), Josefina García Reinoso (Hospital Arnau de Vilanova, Comunidad Valenciana), Juan Ángel Hernández Bayo (Hospital General de La Palma, Canarias), Juan Antonio Arazola Pérez (consulta privada, Andalucía), Juan Antonio García Arnés (Complejo Hospitalario Carlos Haya, Andalucía), Juan Salmerón de Diego (Hospital Gregorio Marañón, Madrid), Julio Nájera Mortes (consulta privada, Comunidad Valenciana), Julio Ruiz de Gordejuela (Hospital Bajo Deba, País Vasco), Livio Héctor Peña Guillermo (Centro de Especialidades Monteoliveti, Comunidad Valenciana), Luis Ciprés Casasnovas (Hospital General de Teruel Obispo Polanco, Aragón), Luis Enríquez Acosta (Hospital San Pedro de Alcántara, Extremadura), Luis Escobar Jiménez (consulta privada, Andalucía), Luis Fernando Vences Benito (Centro de Especialidades San Fermín, Comunidad Valenciana), Luis Francisco Santiago Peña (Hospital Virgen de la Concha, Castilla y León), Luis García Pascual (Hospital Mutua de Terrassa, Cataluña), Luis Miguel Álvarez Aragón (Hospital de Osuna, Andalucía), Luis Montenegro Rodríguez (consulta privada, Andalucía), Luis Morcillo Herrera (Hospital Universitario de Canarias, La Laguna, Canarias), Luis Teigell García (Hospital Gregorio Marañón, Madrid), M. Ángeles Bueno Cascón (Clínica Granada Salud, Adeslas, Andalucía), M. Ausencia Tomé Martínez de Rituerto (Hospital del Conxo, Galicia), M. Beatriz Flández González (Hospital de Getafe, Madrid), M. Concepción Terroba Larumbe (Hospital Universitario Río Hortega, Castilla y León), M. del Pilar Lamela Estévez (Ambulatorio Hermanos Miralles, Madrid), M. Jesús Chinchetru Ranedo (Hospital Txagorritxu, País Vasco), M. José Picón César (Hospital Clínico Málaga, Andalucía), M. José Salas Romero (consulta privada, Andalucía), M. Natividad Moreira Andrés (Ambulatorio de Villaverde Cruce, Madrid), M. Teresa García Ingelmo (Hospital Ciudad de Coria, Extremadura), Manuel Álvarez Fernández (consulta privada, Asturias), Manuel Blanco Suárez (Clínica Sagrado Corazón, Andalucía), Manuel Calero Fresneda (Hospital Universitario Puerto Real, Andalucía), Manuel Cornejo Barrera (Hospital Jerez de la Frontera, Andalucía), Manuel León de Lope (Hospital Juan Ramón Jiménez, Andalucía), Manuel Muñoz Rodríguez (Hospital de León, Castilla y León), Manuel Muñoz Torres (Hospital Clínico San Cecilio, Andalucía), Mariano Villa Bautista (Hospital de Móstoles, Madrid), Marta Fernández Fernández (Hospital del Bierzo, Castilla y León), Martín López de la Torre Casares (Hospital Virgen de las Nieves, Andalucía), Mercè Bergua Llop (Ambulatorio Prat de la Riba, Cataluña), Mercedes Pascual Díaz (Hospital J.M. Morales Meseguer, Murcia), Mercedes Rodríguez del Palacio Fernández (consulta privada, Canarias), Mercedes Tolosa Torrens (consulta privada, Comunidad Valenciana), Miguel Aguirre Sánchez-Covisa (Hospital Nuestra Señora de Alarcos, Castilla-La Mancha), Miguel Ángel Mangas Cruz (Centro Periférico de Especialidades Virgen de los Reyes, Andalucía), Miguel Ángel Martínez Olmos (Hospital Meixoeiro, Galicia), Miguel Ángel Rico Corral (Hospital Universitario Virgen Macarena, Andalucía), Miguel Civera Andrés (Hospital de Xàtiva y Onteniente, Comunidad Valenciana), Mónica Lorenzo Solar (Hospital del Conxo, Galicia), Nieves Carretero Rodrigo (Hospital de la Cruz Roja, Madrid), Nuria Valdés Gallego (Instituto Social de la Marina, Asturias), Orosia Bandrés Nivela (Hospital Comarcal de Calatayud, Aragón), Pablo Fernández Catalina (Hospital Montecelo, Galicia), Pedro Montoro Marín (Centro de Especialidades El Carmen, Murcia), Pedro Valdivielso Felices (Hospital Clínico de Málaga, Andalucía), Petra de Diego Poza (Hospital Nuestra Señora del Prado, Castilla-La Mancha), Rafael Marín Lama (Hospital Provincial de Córdoba, Andalucía), Ramón Albero Gamboa (Hospital Miguel Servet, Aragón), Ramón Arteaga Fuentes (Hospital de Galdakao, País Vasco), Raquel Mateo Lobo (Hospital Santa Bárbara, Castilla-La Mancha), Ricard Torras Rodergas (Hospital General de Catalunya, Cataluña), Ricardo Chamorro Prado (Hospital Nuestra Señora de Alarcos, Castilla-La Mancha), Rigoberto Corrales Cruz (CAP Tarragonès, Cataluña), Rosa Burgos Peláez (Clínica Quirón, Cataluña), Rosa Cámara Gómez (Hospital La Fe, Comunidad Valenciana), Rosa Villar Vicente (Hospital Gutiérrez Ortega, Castilla-La Mancha), Rosario de la Pedraja Murgoitio (Hospital de Sierrallana, Cantabria), Santiago Tofé Povedano (Hospital Son Dureta, Baleares), Teresa Muros de Fuentes (Hospital Virgen de las Nieves, Andalucía), Vicente Campos Alborg (Hospital Universitario La Fe, Comunidad Valenciana), Víctor García-Hierro González-Regueral (Hospital Virgen del Puerto de Plasencia, Extremadura), Víctor Manuel Andia Melero (Hospital Nuestra Señora de Sonsoles, Castilla y León), Virginia Muñoz Leira (Hospital Provincial de Pontevedra, Galicia)