Evaluar objetivamente los efectos de los suplementos de probióticos sobre el control glucémico y el metabolismo de los lípidos en pacientes con diabetes mellitus tipo 2 (DM2).
Material y métodosEnsayos controlados aleatorizados (ECA) con respecto a los probióticos o simbióticos para el tratamiento de la DM2, recogidos a través de la recuperación de 5 bases de datos, desde su creación hasta el mes de marzo de 2016. Tras el estudio y la selección, la evaluación de la calidad y la extracción de datos fueron realizadas por 2 autores independientes, utilizándose el software STATA para realizar el análisis estadístico. El nivel de evidencia se evaluó mediante la aplicación del sistema GRADE.
ResultadosFueron 12 ECA, en los que se incluyó a 770 participantes. Los resultados del metaanálisis reflejaron que los probióticos podrían reducir significativamente la glucosa en sangre en ayunas en −11,27mg/dl (IC 95% −21,76 a −0,79; p<0,001) y la concentración de insulina sérica en −2,36μU/ml (IC 95% −4,01 a −0,72; p=0,005), aunque el valor de HbA1c no mostró una reducción significativa (−0,19%; IC 95% −0,49 a 0,12; p=0,23). El probiótico podría reducir significativamente el HOMA-IR de los pacientes con DM2 (−1,05; IC 95% −1,52 a −0,59; p<0,001). Sin embargo, el efecto sobre QUICKI fue insignificante (0,00; IC 95% −0,00 a 0,01; p=0,27). Los resultados confirmaron el efecto de disminución significativa de los probióticos en el colesterol total (−8,49mg/dl; IC 95% −15,24 a −1,73; p=0,014) y en los triglicéridos (TG; −23,66mg/dl; IC 95% −40,26 a −7,05; p<0,001), así como el efecto de elevación del c-HDL (3,92mg/dl; IC 95% 2,14 a 5,7; p<0,01). Sin embargo, no se produjo ningún cambio significativo en el c-LDL (−0,84mg/dl; IC 95% −5,84 a 4,17; p=0,75). Se realizó un análisis de subgrupos para los 2 resultados (concentración de insulina en suero y TG), cuya heterogeneidad fue demasiado alta. Los resultados mostraron que multitud de probióticos tuvieron un mayor efecto de reducción de la concentración de insulina en suero (−3,32μU/ml; IC 95% −5,89 a −0,75; p=0,001) y TG (−25,94mg/dl; IC 95% −65,33 a 13,44; p<0,001). Además, también evidenciaron que solo la duración del tratamiento no inferior a 8 semanas podría reducir significativamente TG en un −24,47mg/dl (IC 95% −40,15 a −8,78; p=0,001). La duración del tratamiento inferior a 8 semanas no produjo una reducción significativa de los TG (−4,31mg/dl; IC 95% −37,69 a 29,06; p=0,8). Finalmente, según el sistema GRADE, todas las evidencias fueron de nivel moderado y bajo.
ConclusiónComo tipo de bioterapéutica potencial para el tratamiento de la DM2, los probióticos pueden mejorar el control de la glucosa y el metabolismo lipídico.
To objectively evaluate the effects of probiotics supplement on glycemic control and lipid metabolism in patients with type 2 diabetes mellitus (T2DM).
Material and methodsThe randomized controlled trials (RCTs) with regard to the probiotics or synbiotics for the treatment of T2DM were collected through retrieving 5 databases from their establishment to March 2016. After study selection, quality assessment and data extraction were performed by 2 authors independently; and STATA software was used for statistical analysis. The level of evidence was evaluated by applying the GRADE system.
ResultsTwelve RCTs involving 770 participants were enrolled. The results of the meta-analysis showed that probiotics could significantly reduce fasting blood glucose by −11.27mg/dL (95% CI −21.76 to −0.79; P<.001) and serum insulin concentration by −2.36μU/mL (95% CI −4.01 to −0.72; P=.005), but with no significant reduction on HbA1c (−0.19%; 95% CI −0.49 to 0.12; P=.23). Probiotics could significantly reduce HOMA-IR of T2DM patients (−1.05; 95% CI −1.52 to −0.59; P<.001). Nevertheless, the effect on QUICKI was negligible (0.00; 95% CI −0.00 to 0.01; P=.27). Results also confirmed the significant lowering effect of probiotics on total cholesterol (−8.49mg/dL; 95% CI −15.24 to −1.73; P=.014) and triglycerides (TG; −23.66mg/dL; 95% CI −40.26 to −7.05; P<.001), as well as the elevating effect on HDL-c (3.92mg/dL; 95% CI 2.14 to5.7; P<.01). However, there was no significant change on LDL-c (−0.84mg/dL; 95% CI −5.84 to 4.17; P=.75). Subgroup analysis was conducted for 2 outcomes, that is, serum insulin concentration and TG, whose heterogeneity was too high. The results showed multiple species of probiotics had stronger reduction effect on serum insulin concentration (−3.32μU/mL; 95% CI −5.89 to−0.75; P=.001) and TG (−25.94mg/dL; 95% CI −65.33 to 13.44; P<.001). In addition, it also suggested that only the duration of treatment for≥8 weeks could significantly reduce TG by −24.47mg/dL (95% CI −40.15 to −8.78; P=.001). The duration of treatment for<8 weeks didn’t result in significant reduction on TG (−4.31mg/dL; 95% CI −37.69 to 29.06; P=.8). Finally, all the evidences were at moderate and low levels according to the GRADE system.
ConclusionAs a kind of the potential biotherapeutics in the management of T2DM, probiotics can improve glucose control and lipid metabolism.
La diabetes mellitus tipo 2 (DM2) se caracteriza por una alta concentración de glucosa en sangre, una deficiencia relativa de insulina y resistencia a la misma, junto con múltiples complicaciones sistémicas. Constituye una de las enfermedades crónicas más prevalentes a nivel mundial, afectando a 415 millones de adultos, y se estima que sobrepasará los 600 millones en el año 2040, de acuerdo con la International Diabetes Federation1. En 2012, Qin et al. reflejaron, a través de un metaestudio de asociación del genoma completo, que los pacientes con DM2 tenían un cierto grado de disbiosis de la flora intestinal2. Dicho estudio ha aportado evidencia acerca de que la acción de la flora intestinal, junto con los factores genéticos susceptibles, contribuye al desarrollo de DM2. Por tanto, cada vez se ha prestado más atención a la flora intestinal, que se ha convertido en una cuestión importante de investigación en las enfermedades metabólicas humanas.
Los probióticos se definen como aquellos microorganismos vivos presentes en los alimentos o la leche, que pueden mejorar la salud del huésped cuando se ingieren cantidades suficientes, a pesar de sus diferentes genes inherentes3. Sin embargo, existe un interés creciente sobre el suplemento de probióticos para el tratamiento de la DM2. Numerosos estudios animales han apuntado al hecho de que los probióticos pueden mejorar la sensibilidad a la insulina y la disfunción de las células β a través de la regulación de las vías clave de señalización y de la modulación de los genes implicados en el proceso de ubiquitinación4,5. Además, muchos estudios en ratas evidencian que los probióticos pueden ser capaces de prevenir el incremento del colesterol total (CT), los triglicéridos (TG) y el low density lipoproteins cholesterol (c-LDL, «colesterol unido a lipoproteínas de baja densidad»), aunque incrementan el nivel de high density lipoproteins cholesterol (c-HDL, «colesterol unido a lipoproteínas de alta densidad»)6,7. Los efectos beneficiosos sobre el perfil lipídico retrasan exitosamente la aparición de las complicaciones micro y macrovasculares de la DM2. Basándonos en dichos resultados, los probióticos pueden modificar la composición y la función de la flora intestinal para realizar el control de la glucosa en sangre y los parámetros relacionados con la diabetes en el futuro. Sin embargo, el limitado número de ensayos clínicos aleatorizados (ECA) controlados con respecto a la aplicación de probióticos en el tratamiento de los pacientes con DM2 puede conllevar resultados conflictivos; además, la heterogeneidad del diseño del estudio (tamaño de la muestra, duración de la intervención, dosis y cepas utilizadas) dificulta la comparación de los trabajos que investigan la eficacia de los probióticos en la DM2. Existe únicamente una revisión sistemática8 publicada cualitativamente que evalúa la función de los probióticos, y engloba todos los estudios en animales y diversos ECA. Este metaanálisis trata de considerar todos los ECA y aportar evidencia auténtica para evaluar la función de los probióticos, con diferentes duraciones y dosis, en la DM2.
Materiales y métodosDiseño de la revisión y estrategia de investigaciónSe reunieron los ECA relativos a los probióticos y los simbióticos para el tratamiento de la DM2 mediante la recolección de bases de datos tales como PubMed, Cochrane Central Register of Controlled Trials, Embase, ISI de bases de datos del conocimiento y Scopus, desde su establecimiento hasta el mes de marzo de 2016. Mientras tanto, también se buscaron manualmente las referencias a dichos ECA.
Por ejemplo, la estrategia de búsqueda utilizada al realizar la recuperación en PubMed fue la siguiente: (probióticos O simbióticos O lactobacilos O bifidobacterias O bacterias del ácido láctico O estreptococos O fermento de la leche) Y (diabetes mellitus tipo 2 O alteración de la glucosa en ayunas O alteración de la tolerancia a la glucosa O insulina sérica O control glucémico) Y (ensayo controlado aleatorizado O ensayo clínico controlado O aleatorizado O placebo O ensayos clínicos como cuestión O aleatoriamente O ensayo O grupos). Tres autores recuperaron los títulos y los resúmenes de manera independiente, leyendo los textos completos de los estudios cuando fue necesario para identificar los estudios relacionados.
Selección de los estudiosLos criterios de elegibilidad para la selección de los estudios fueron: ECA doble ciego en los que se comparara el consumo de probióticos y simbióticos (en forma de suplemento o alimento reforzado) con el consumo de placebos en los pacientes con DM2. A todos los participantes se les había diagnosticado claramente DM2, de acuerdo con los criterios internacionales. Los 2 grandes tipos de bacterias probióticas, que fueron también las más comúnmente utilizadas, fueron lactobacilos y bifidobacterias. Se incluyeron aquellos estudios que aplicaron el cosuplemento (por ejemplo, los simbióticos con contenido de trazas de insulina) en caso de que el grupo control no recibiera dicho cosuplemento. La duración de la intervención fue de 4 semanas al menos. Se excluyeron todos los estudios relativos a diabetes mellitus tipo 1, diabetes gestacional, prediabetes y otros diferentes a la DM2. Los resultados se valoraron como cambios de los parámetros del control de la glucosa y el perfil lipídico con respecto a los valores basales.
Evaluación de la calidadLa calidad metodológica de los ECA incluidos se evaluó utilizando la herramienta de la Cochrane Collaboration para riesgos de sesgo9. La evaluación se compuso de 7 aspectos: 1) generación de secuencia aleatoria; 2) asignación ciega; 3) ocultación de los accesos a los resultados; 4) ocultación del personal y los participantes del estudio; 5) datos de los resultados incompletos; 6) reporte selectivo de los resultados, y 7) otras fuentes de sesgo. Cada aspecto se clasificó en 3 niveles, a saber, alto riesgo, bajo riesgo y riesgo incierto.
La calidad de la evidencia de cada resultado fue evaluada utilizando el método Grades of Recommendation, Assessment, Development and Evaluation (GRADE). Existen 4 grados: alto, moderado, bajo y muy bajo.
Extracción de los datosLas características de los estudios fueron extraídas por 3 autores de manera independiente, resolviéndose cualquier incertidumbre mediante debate entre los mismos. Dichas características se extrajeron de los datos originales sobre las intervenciones, el tamaño de la muestra, el período de seguimiento, el contenido de probióticos, las dosis de probióticos (CFU internacional por día), los resultados primarios y los resultados secundarios. Para los estudios que contuvieron diversas dosis de probióticos se consideró cada dosis por separado, en la medida de lo posible.
Durante el proceso de extracción de datos, los niveles de fasting blood glucose (FBG, «glucosa en sangre en ayunas») se expresaron en mg/dl; los niveles de insulina séricos o plasmáticos se expresaron en μU/ml; los niveles de c-LDL, c-HDL, CT y TG se expresaron en mg/dl. Todos los resultados extraídos de los documentos originales se expresaron como media±desviación estándar (DE). Para las variables continuas, el cambio absoluto de la DE desde la base de referencia se calculó mediante el coeficiente de correlación r=0,5, según la recomendación del Manual Cochrane.
Análisis estadísticoSe utilizó el software STATA 11.0 (STATA MP) para el análisis estadístico. Los riesgos relativos, las diferencias medias ponderadas y los correspondientes intervalos de confianza del 95% (IC 95%) se calcularon en los diagramas de Forest. La heterogeneidad se calculó mediante la prueba Q de Cochrane y la prueba I2, con valores del 40, el 70 y el 100%, que representan la heterogeneidad baja, moderada y alta, respectivamente10. Los valores de p≥0,1 e I2≤40% evidenciaron que existía poca probabilidad de heterogeneidad, pudiendo utilizarse un modelo de efectos fijos; de otro modo, se usaría el modelo de efectos aleatorios. Por tanto, se exploraron las posibles fuentes de heterogeneidad mediante el análisis de sensibilidad y el análisis de subgrupo, basados en la duración de las intervenciones, los tipos de bacterias y las dosis de probióticos. Por último, los sesgos de las publicaciones se calcularon utilizando diagramas de Funnel y pruebas de Egger (estableciéndose el nivel de significación en p<0,1).
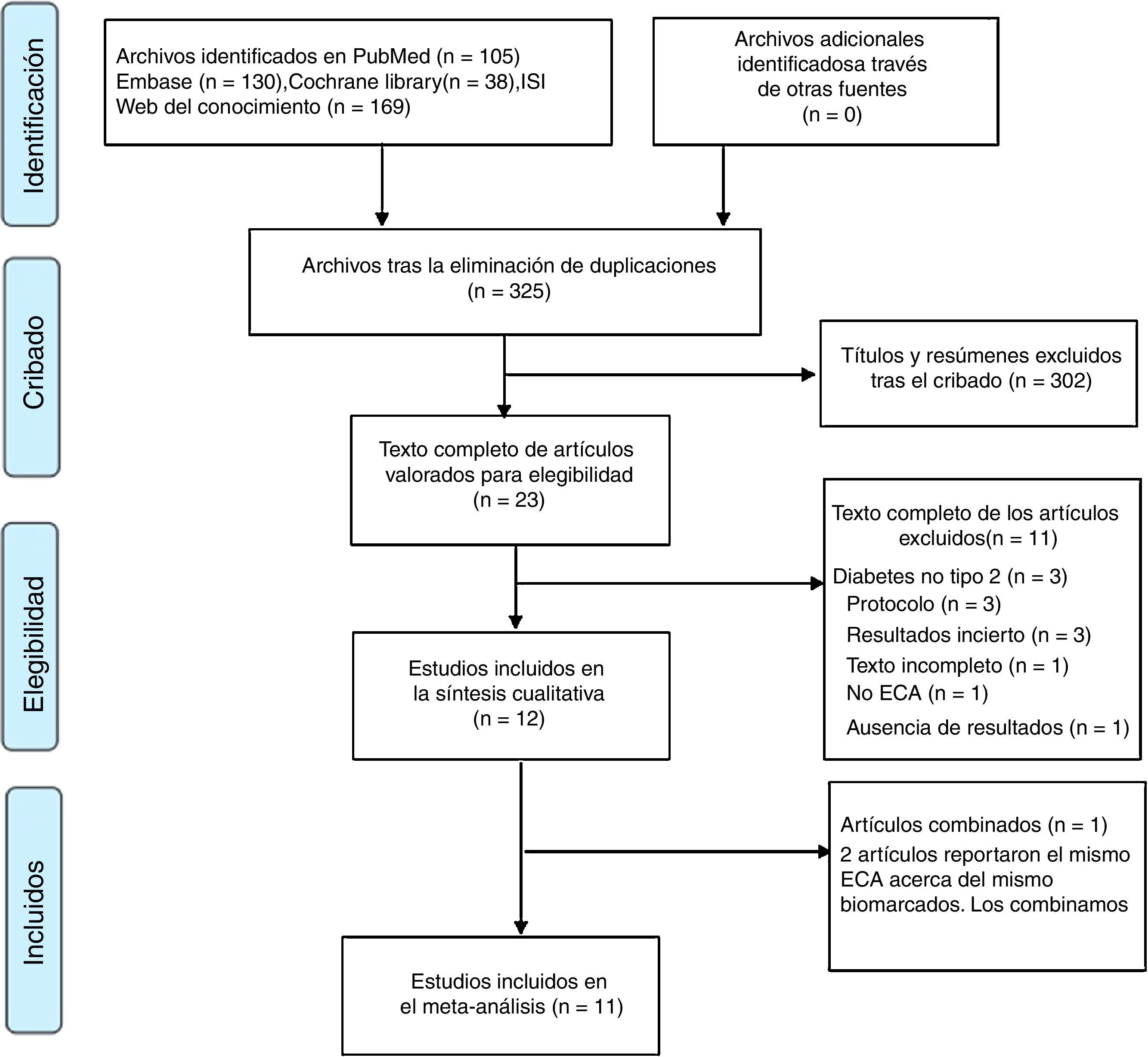
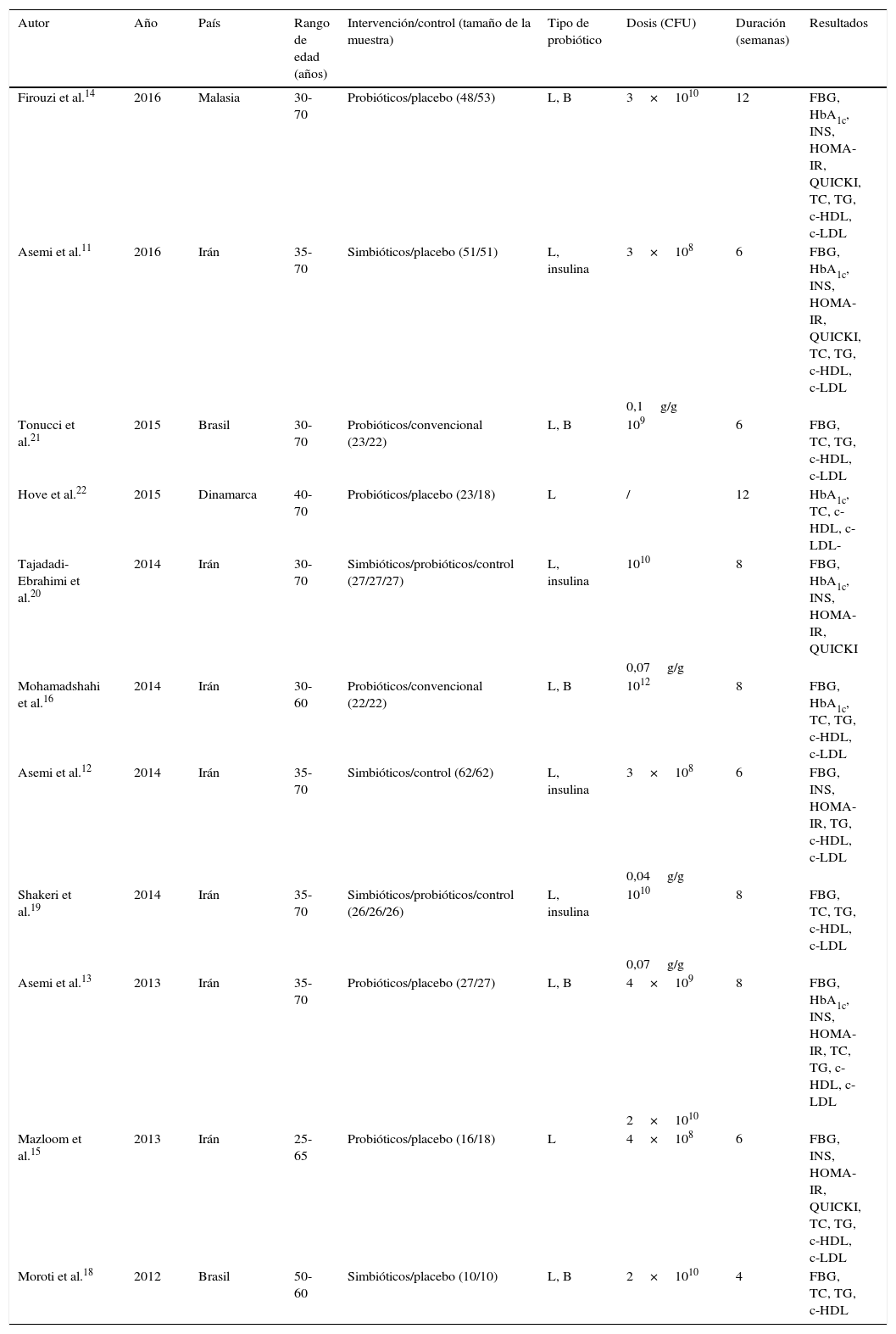
ResultadosResultados de la búsqueda y características de los estudios incluidosEl proceso de cribado del estudio se reflejó en un diagrama de flujo PRISMA (fig. 1), cuyos resultados mostraron que los 12 informes11–22 describieron 11 ECA que incluyeron a 760 participantes, mientras que 2 documentos16,17 reportaron los mismos ECA acerca de diferentes parámetros, por lo que fueron incorporados. Las características de los estudios incluidos se resumieron en la tabla 1. Siete de los estudios incluidos fueron a doble ciego, 2 fueron a ciego simple y 2 fueron inciertos, variando la duración entre 4 y 12 semanas, y la dosis diaria del suplemento de probióticos fue de 108 a 1010 CFU. Además, 5 de los estudios utilizaron la combinación de múltiples cepas, mientras que los otros 6 adoptaron una única especie de probióticos. A diferencia del grupo control, los sujetos de 3 estudios del grupo de intervención consumieron simbióticos (con contenido de probióticos y prebióticos). Únicamente 2 estudios diseñaron 3 grupos, a saber: probióticos, simbióticos y pan de control, que fueron analizados como 2 ensayos en este metaanálisis. Se incluyó a todos los participantes con rango de edad comprendido entre 30 y 70 años.
Características de los estudios incluidos
| Autor | Año | País | Rango de edad (años) | Intervención/control (tamaño de la muestra) | Tipo de probiótico | Dosis (CFU) | Duración (semanas) | Resultados |
|---|---|---|---|---|---|---|---|---|
| Firouzi et al.14 | 2016 | Malasia | 30-70 | Probióticos/placebo (48/53) | L, B | 3×1010 | 12 | FBG, HbA1c, INS, HOMA-IR, QUICKI, TC, TG, c-HDL, c-LDL |
| Asemi et al.11 | 2016 | Irán | 35-70 | Simbióticos/placebo (51/51) | L, insulina | 3×108 | 6 | FBG, HbA1c, INS, HOMA-IR, QUICKI, TC, TG, c-HDL, c-LDL |
| 0,1g/g | ||||||||
| Tonucci et al.21 | 2015 | Brasil | 30-70 | Probióticos/convencional (23/22) | L, B | 109 | 6 | FBG, TC, TG, c-HDL, c-LDL |
| Hove et al.22 | 2015 | Dinamarca | 40-70 | Probióticos/placebo (23/18) | L | / | 12 | HbA1c, TC, c-HDL, c-LDL- |
| Tajadadi-Ebrahimi et al.20 | 2014 | Irán | 30-70 | Simbióticos/probióticos/control (27/27/27) | L, insulina | 1010 | 8 | FBG, HbA1c, INS, HOMA-IR, QUICKI |
| 0,07g/g | ||||||||
| Mohamadshahi et al.16 | 2014 | Irán | 30-60 | Probióticos/convencional (22/22) | L, B | 1012 | 8 | FBG, HbA1c, TC, TG, c-HDL, c-LDL |
| Asemi et al.12 | 2014 | Irán | 35-70 | Simbióticos/control (62/62) | L, insulina | 3×108 | 6 | FBG, INS, HOMA-IR, TG, c-HDL, c-LDL |
| 0,04g/g | ||||||||
| Shakeri et al.19 | 2014 | Irán | 35-70 | Simbióticos/probióticos/control (26/26/26) | L, insulina | 1010 | 8 | FBG, TC, TG, c-HDL, c-LDL |
| 0,07g/g | ||||||||
| Asemi et al.13 | 2013 | Irán | 35-70 | Probióticos/placebo (27/27) | L, B | 4×109 | 8 | FBG, HbA1c, INS, HOMA-IR, TC, TG, c-HDL, c-LDL |
| 2×1010 | ||||||||
| Mazloom et al.15 | 2013 | Irán | 25-65 | Probióticos/placebo (16/18) | L | 4×108 | 6 | FBG, INS, HOMA-IR, QUICKI, TC, TG, c-HDL, c-LDL |
| Moroti et al.18 | 2012 | Brasil | 50-60 | Simbióticos/placebo (10/10) | L, B | 2×1010 | 4 | FBG, TC, TG, c-HDL |
B: bifidobacterias; CFU: colony-forming unit («unidad formadora de colonias»); c-HDL: high density lipoprotein cholesterol («colesterol unido a lipoproteínas de alta densidad»); c-LDL: low density lipoprotein cholesterol («colesterol unido a lipoproteínas de baja densidad»); CT: colesterol total; FBG: fasting blood glucose («glucosa en sangre en ayunas»); HbA1c: hemoglobina glucosilada; HOMA-IR: Homeostatic Model Assessment for Insulin Resistance («modelo homeostático para evaluar la resistencia a la insulina»); INS: insulina sérica; L: lactobacilos; QUICKI: Quantitative Insulin Sensitivity Check Index («Índice de Verificación de Sensibilidad a la Insulina»); TG: triglicéridos.
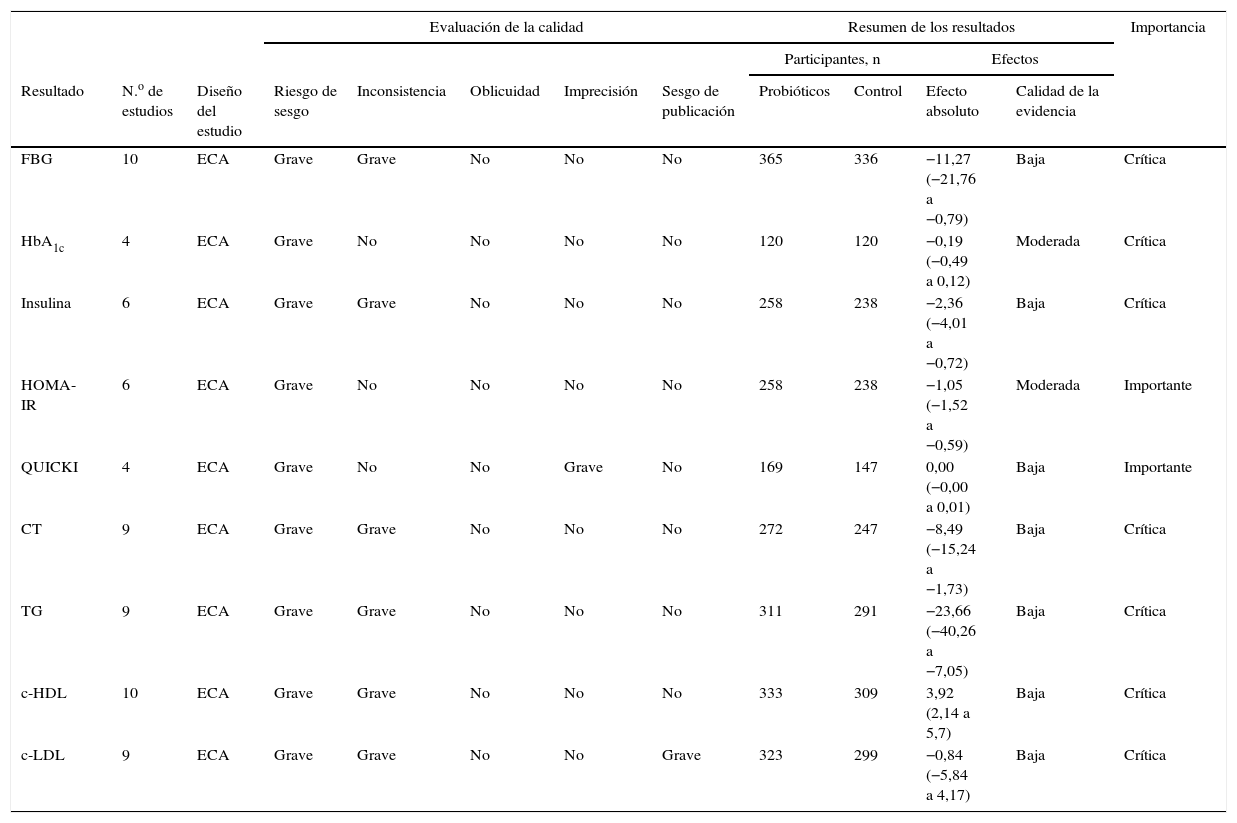
La evaluación del riesgo de sesgo de los estudios incluidos se reflejó en el Appendix B (tabla disponible en la versión online de este artículo). El resumen de todos los resultados incluidos, así como la evaluación GRADE, se reflejan en la tabla 2. Entre los 9 resultados, el nivel de evidencia de HbA1c y HOMA-IR fue moderado, y el resto, bajo.
Resumen y evaluación GRADE de los resultados
| Evaluación de la calidad | Resumen de los resultados | Importancia | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Participantes, n | Efectos | |||||||||||
| Resultado | N.o de estudios | Diseño del estudio | Riesgo de sesgo | Inconsistencia | Oblicuidad | Imprecisión | Sesgo de publicación | Probióticos | Control | Efecto absoluto | Calidad de la evidencia | |
| FBG | 10 | ECA | Grave | Grave | No | No | No | 365 | 336 | −11,27 (−21,76 a −0,79) | Baja | Crítica |
| HbA1c | 4 | ECA | Grave | No | No | No | No | 120 | 120 | −0,19 (−0,49 a 0,12) | Moderada | Crítica |
| Insulina | 6 | ECA | Grave | Grave | No | No | No | 258 | 238 | −2,36 (−4,01 a −0,72) | Baja | Crítica |
| HOMA-IR | 6 | ECA | Grave | No | No | No | No | 258 | 238 | −1,05 (−1,52 a −0,59) | Moderada | Importante |
| QUICKI | 4 | ECA | Grave | No | No | Grave | No | 169 | 147 | 0,00 (−0,00 a 0,01) | Baja | Importante |
| CT | 9 | ECA | Grave | Grave | No | No | No | 272 | 247 | −8,49 (−15,24 a −1,73) | Baja | Crítica |
| TG | 9 | ECA | Grave | Grave | No | No | No | 311 | 291 | −23,66 (−40,26 a −7,05) | Baja | Crítica |
| c-HDL | 10 | ECA | Grave | Grave | No | No | No | 333 | 309 | 3,92 (2,14 a 5,7) | Baja | Crítica |
| c-LDL | 9 | ECA | Grave | Grave | No | No | Grave | 323 | 299 | −0,84 (−5,84 a 4,17) | Baja | Crítica |
c-HDL: high density lipoprotein cholesterol («colesterol unido a lipoproteínas de alta densidad»); c-LDL: low density lipoprotein cholesterol («colesterol unido a lipoproteínas de baja densidad»); CT: colesterol total; ECA: ensayo controlado aleatorizado; FBG: fasting blood glucose («glucosa en sangre en ayunas»); HbA1c: hemoglobina glucosilada; HOMA-IR: Homeostatic Model Assessment for Insulin Resistance («modelo homeostático para evaluar la resistencia a la insulina»); QUICKI: Quantitative Insulin Sensitivity Check Index («Índice de Verificación de Sensibilidad a la Insulina»); TG: triglicéridos.
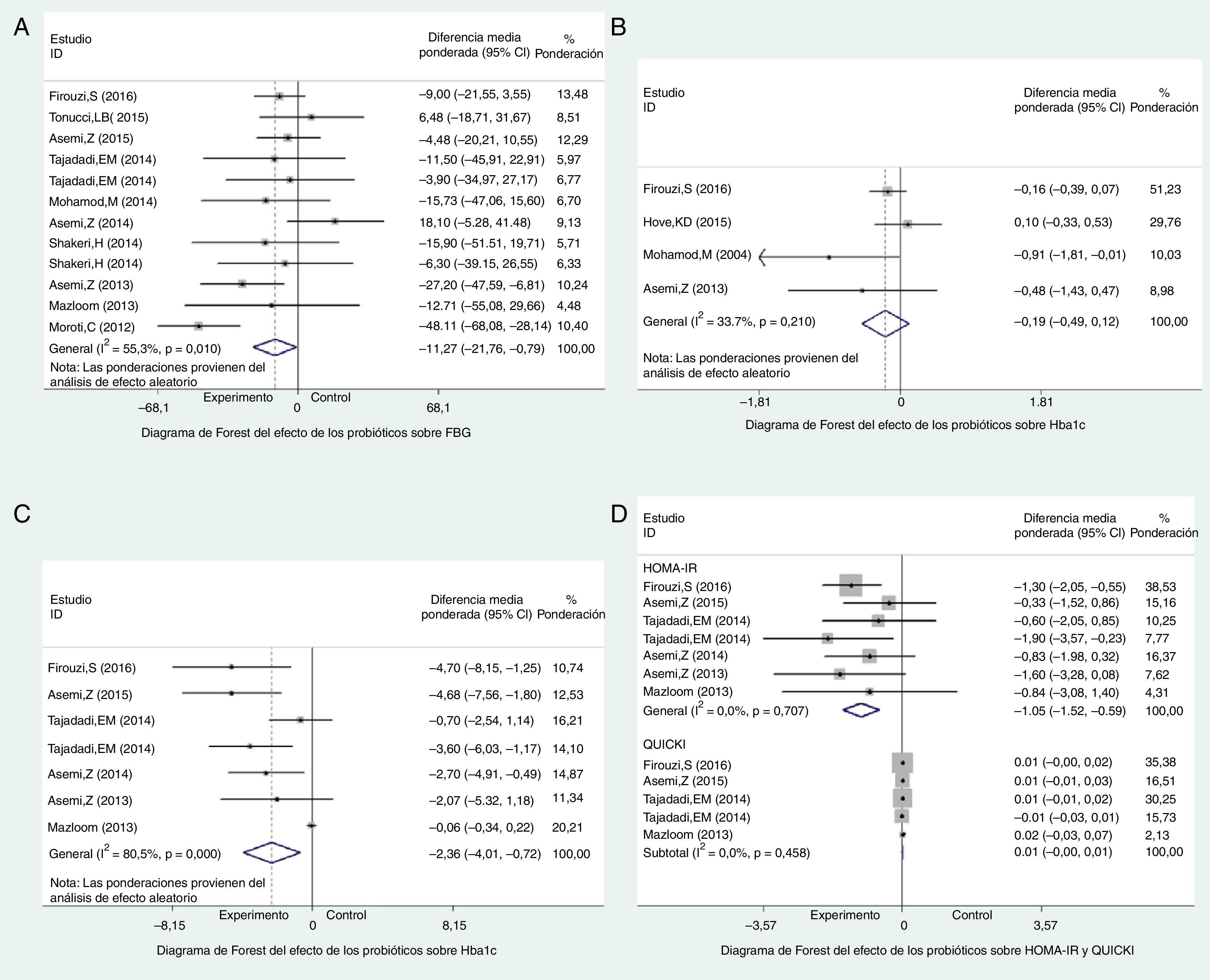
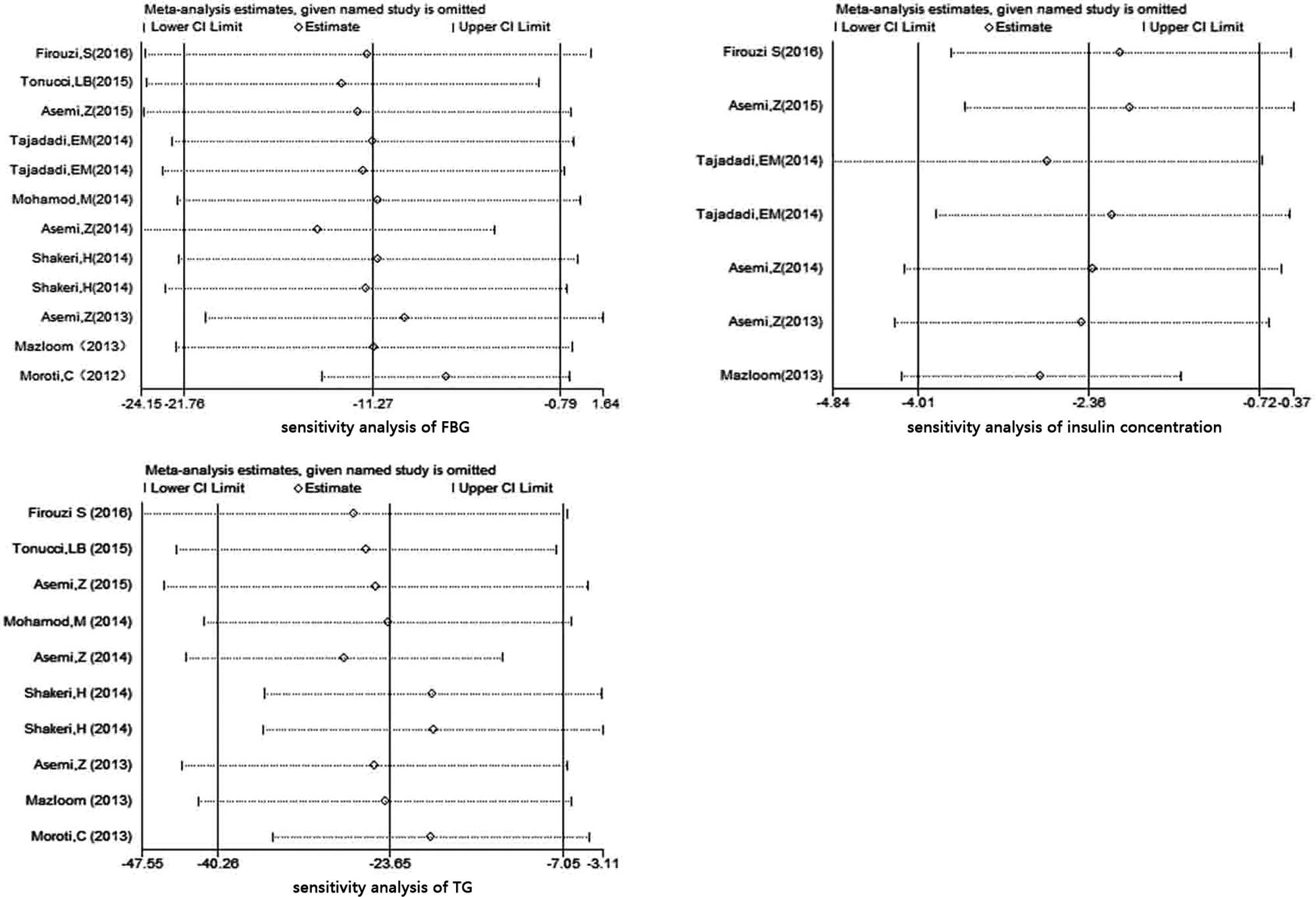
Diez ensayos11–21 reportaron los efectos de los probióticos sobre FBG, cuya heterogeneidad fue moderada, de acuerdo con la prueba I2 (I2=49%) y las pruebas Q de Cochrane (p=0,03). A continuación, se seleccionó preferiblemente el modelo de efectos aleatorios, cuyos resultados revelaron una reducción significativa de FBG en el grupo de probióticos (−11,27mg/dl, IC 95% −21,76 a −0,79, p=0,03) (fig. 2A). Se realizó el análisis de sensibilidad (figura disponible en la versión online de este artículo) a fin de explorar la fuente de heterogeneidad, encontrándose que la supresión del estudio de Moroti et al.18 representaba la heterogeneidad convertida (p=0,42; I2=1,8%). Además, los efectos de los probióticos sobre FBG permanecían a nivel significativo. Por tanto, han de atribuirse a dicho valor atípico los resultados de la poca solidez de dicho metaanálisis. Los gráficos de embudo y las pruebas de Egger revelaron ausencia de sesgo de publicación (p=0,897).
Hemoglobina glucosilada y concentración de insulina en sueroCuatro ensayos13,14,17,22 reportaron los efectos de los probióticos sobre HbA1c, y 6 ensayos11–15,20 reportaron los efectos sobre la concentración de insulina en suero.
No se produjo un descenso significativo de HbA1c en el grupo de probióticos (−0,19, IC 95% −0,49 a 0,12, p=0,23), con baja heterogeneidad (p=0,21, I2=34%) (fig. 2B). Pudo apreciarse un descenso significativo de la concentración de la insulina sérica en el grupo de probióticos (−2,36μU/ml, IC 95% −4,01 a −0,72, p=0,005). Sin embargo, se asoció a una elevada heterogeneidad (p<0,001, I2=81%) (fig. 2C). Los resultados del análisis de sensibilidad mostraron que la heterogeneidad descendió al 40% al eliminarse el estudio de Mazloom et al.15 (figura). Pero seguía existiendo heterogeneidad, lo que evidencia que existían otros factores que afectan a dichos resultados. Los resultados de la prueba de Egger (p=0,457 y p=0,11, respectivamente) indicaron que no existía sesgo de publicación en los 2 parámetros.
HOMA-IR y QUICKIEncontramos 6 ensayos11–15,20 donde se reportaban los efectos probióticos sobre HOMA-IR, y otros 4 ensayos11,14,15,20 que reportaban dichos efectos sobre QUICKI. Los resultados reflejaron que los probióticos podían reducir considerablemente HOMA-IR en los pacientes de DM2 (−1,05, IC 95% −1,52 a −0,59, p<0,001), sin heterogeneidad entre los estudios (p=0,71, I2=0%) (fig. 2D). Sin embargo, los probióticos no reflejaron efectos sobre QUICKI en comparación con el nivel basal (0,00, IC 95% −0,00 a 0,01, p=0,27) (fig. 2D). Los resultados de la prueba de Egger (p=0,903 y p=0,578, respectivamente) evidenciaron que no existía sesgo de publicación de los 2 parámetros.
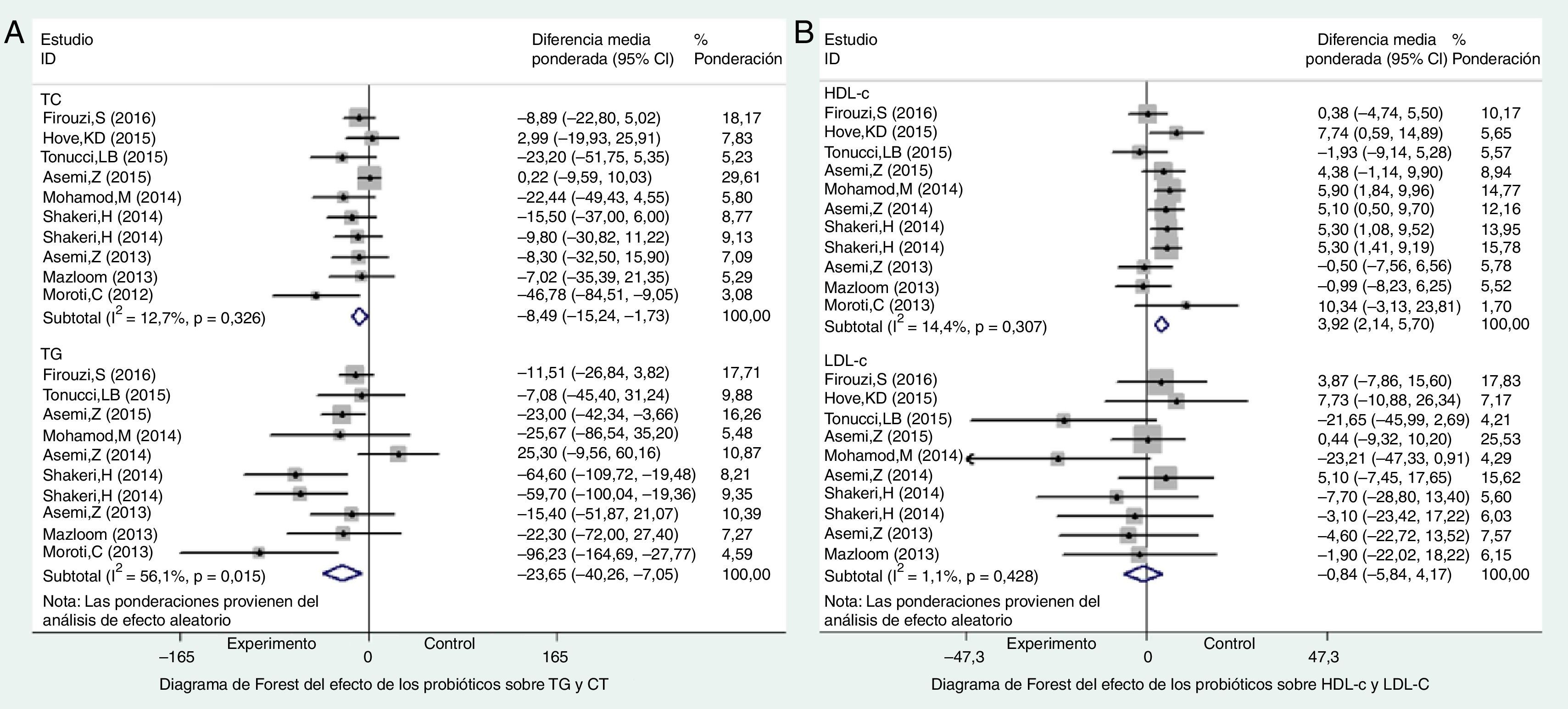
Perfil lipídico: metaanálisisColesterol total y triglicéridosEncontramos 9 ensayos11,13–16,18–22 que describían los efectos de los probióticos sobre CT, y 9 ensayos11–16,18–21 sobre TG. Como se reveló en los resultados, el grupo de probióticos presentó una reducción significativa en cuanto a CT sérico, basada en el modelo de efectos aleatorios (−8,49, IC 95% −15,24 a −1,73, p=0,014), con baja heterogeneidad (p=0,326, I2=13%) (fig. 3A). Además, también pudo observarse una reducción considerable de los TG séricos tras el suplemento de probióticos sobre la base del modelo de efectos aleatorios (−23,66, IC 95% −40,26 a −7,05, p<0,001) (fig. 3A), que se asoció a una heterogeneidad moderada (I2=56%, p=0,015), aunque no pudo encontrarse ningún estudio individual que hubiera originado la mayoría de la heterogeneidad por parte del análisis de sensibilidad (figura), lo que indicó la buena estabilidad del metaanálisis.
c-HDL y c-LDLEncontramos 10 ensayos11–16,18–22 que observaron los efectos de los probióticos sobre c-HDL y c-LDL séricos en los pacientes de DM2. En el metaanálisis se reflejó que los probióticos podrían incrementar notablemente el nivel de c-HDL sérico (3,92, IC 95% 2,14 a 5,7, p<0,01) (fig. 3B), pero que no mostraban efectos notables sobre el nivel de c-LDL sérico en relación con el grupo control (−0,84, IC 95% −5,84 a 4,17, p=0,75) (fig. 3B). Como pudo apreciarse en los resultados de las pruebas, la heterogeneidad entre los 2 resultados fue baja (p=0,31, I2=14% y p=0,43, I2=1%, respectivamente). Además, pudo observarse sesgo de publicación en los niveles de c-LDL (p=0,01), aunque no se observaron en cuanto a c-HDL (p=0,57) con arreglo a la prueba de Egger.
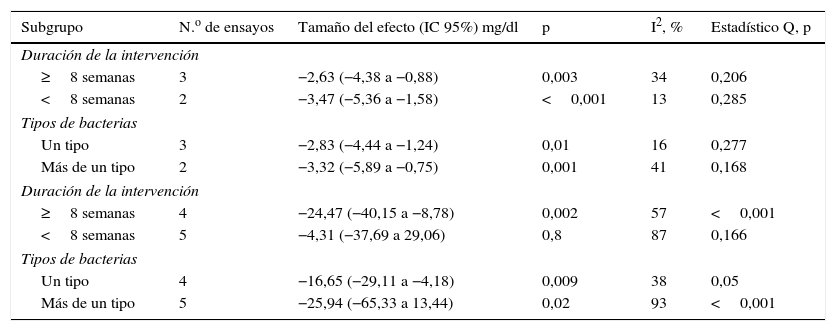
Análisis de subgruposSe siguió produciendo heterogeneidad entre 2 resultados: la concentración de insulina sérica y los TG séricos. Por tanto, se realizó el análisis de subgrupos sobre la base de la duración de la intervención y de los tipos de bacterias para explorar adicionalmente la fuente de la heterogeneidad. Los resultados se relacionaron en la tabla del Appendix B. La reducción de la insulina sérica fue superior al utilizarse múltiples cepas de bacterias (−3,32, IC 95% −5,89 a −0,75, p=0,001), según se refleja en la tabla 3. Además, la reducción del nivel de TG séricos pudo observarse únicamente cuando los probióticos se aplicaron durante≥8 semanas (−24,47, IC 95% −40,15 a −8,78, p=0,002), y cuando se utilizaron al mismo tiempo lactobacilos y bifidobacterias (−16,65, IC 95% −29,11 a −4,18, p=0,009) (tabla 3). Por tanto, se especuló que la fuente de heterogeneidad podría depender de los tipos de bacterias y de la duración de la administración.
Resultados del análisis de subgrupos
| Subgrupo | N.o de ensayos | Tamaño del efecto (IC 95%) mg/dl | p | I2, % | Estadístico Q, p |
|---|---|---|---|---|---|
| Duración de la intervención | |||||
| ≥8 semanas | 3 | −2,63 (−4,38 a −0,88) | 0,003 | 34 | 0,206 |
| <8 semanas | 2 | −3,47 (−5,36 a −1,58) | <0,001 | 13 | 0,285 |
| Tipos de bacterias | |||||
| Un tipo | 3 | −2,83 (−4,44 a −1,24) | 0,01 | 16 | 0,277 |
| Más de un tipo | 2 | −3,32 (−5,89 a −0,75) | 0,001 | 41 | 0,168 |
| Duración de la intervención | |||||
| ≥8 semanas | 4 | −24,47 (−40,15 a −8,78) | 0,002 | 57 | <0,001 |
| <8 semanas | 5 | −4,31 (−37,69 a 29,06) | 0,8 | 87 | 0,166 |
| Tipos de bacterias | |||||
| Un tipo | 4 | −16,65 (−29,11 a −4,18) | 0,009 | 38 | 0,05 |
| Más de un tipo | 5 | −25,94 (−65,33 a 13,44) | 0,02 | 93 | <0,001 |
Resultados del efecto de los probióticos sobre la concentración sérica, basados en el análisis de subgrupos
Resultados del efecto de los probióticos sobre los triglicéridos séricos, basados en el análisis de subgrupos
IC 95%: intervalo de confianza al 95%.
Muchos estudios previos han probado los efectos de los probióticos sobre el metabolismo de la glucosa en modelos de roedores y humanos, habiéndose reportado en algunos de ellos que el consumo de probióticos tiene una función sobre el descenso de FBG13,15,18–20 o HbA1c14,17; sin embargo, algunos estudios muestran que no tiene beneficio sobre FBG11,12,14,17,21 o HbA1c11,22. Los resultados de este metaanálisis indican que el suplemento de probióticos origina una reducción leve en la FBG, aunque un cambio inapreciable de la HbA1c, independientemente de la diferencia considerable en el diseño de su estudio, incluyendo la duración del tratamiento y la dosis diaria. Además, la heterogeneidad radica en el estudio de Moroti et al.18, cuyo tamaño de muestra es demasiado pequeño para poder evaluarlo. En cuanto a la HbA1c, que refleja los niveles de glucosa en sangre durante 120 días, en este estudio se considera que los efectos sobre HbA1c en los pacientes diabéticos podrían observarse durante un período de tratamiento de 3 meses. Sin embargo, dicho punto no podría satisfacerse en algunos de los estudios incluidos y, por tanto, se necesitarían más ECA, con un mejor diseño, para su futura investigación. En este metaanálisis puede observarse también el descenso notorio de HOMA-IR y de la concentración de insulina sérica en el grupo de probióticos, lo que significa que estos tienen grandes efectos sobre la mejora de la resistencia a la insulina y la tolerancia a la glucosa. Dichos resultados son consistentes con los de los experimentos en animales, que evidencian que los probióticos pueden demorar las alteraciones inducidas por STZ en la homeostasis de la glucosa, al mantener los niveles de insulina gracias a su protección frente a daños de las células β pancreáticas7. Como se apunta en los resultados del análisis de subgrupos (tabla 3), es mejor utilizar múltiples cepas de probióticos. Es bien sabido que la resistencia a la insulina es la base patológica de la DM2, ya que hace incrementar la concentración de insulina sérica, lo que origina diversas enfermedades tales como obesidad, hipertensión y enfermedades cardiovasculares23. Por tanto, los probióticos pueden utilizarse en el período prediabético para evitar incrementos de la insulina sérica, demorando, por tanto, el curso de la DM2 y la ocurrencia de complicaciones.
Por otro lado, se ha considerado la dislipidemia como un gran factor de riesgo de las enfermedades cardiovasculares en pacientes con DM2. De modo análogo a los resultados de FBG y HbA1c, existen controversias con respecto a los efectos de los probióticos sobre el metabolismo lipídico. Casi todos los estudios en animales evidencian que el uso de probióticos puede reducir el nivel de lípidos en suero, y solo 3 estudios en humanos16,18,19 mencionan la reducción de CT, 2 estudios11,12,18 evidencian la reducción de TG, 2 estudios12,22 muestran la reducción de c-HDL y 316,18,19, la reducción de c-LDL. Por tanto, nuestros resultados revelan que los probióticos tienen efectos positivos sobre los perfiles lipídicos y pueden reducir los niveles séricos de CT y TG, y también incrementar el nivel de c-HDL sérico. Como se refleja en el análisis de subgrupos (tabla 3), concluimos que la administración de una dosis moderada de una mezcla de probióticos durante un período de 8 semanas conduce a un mejor efecto sobre el tratamiento de los lípidos. Pero dicha conclusión podría verificarse adicionalmente con la realización de ECA con mayores tamaños de muestra.
En términos generales, existen 2 componentes de probióticos: los lactobacilos y las bifidobacterias. Los primeros incrementan el acetato cecal pero no afectan a la proteína que se fija a los lipopolisacáridos (LPS) circulantes, mientras que los últimos no incrementan el acetato pero pueden disminuir notablemente los depósitos adiposos y la expresión del gen TNF-α hepático24. Se cree que tienen impactos complementarios sobre los fenotipos asociados a MS de la flora bacteriana en modelos de ratones. Es posible que los pacientes con DM2 puedan beneficiarse de los probióticos a través de los mecanismos siguientes: en primer lugar, las cepas de Lactobacillus gasseri pueden eliminar el colesterol de los medios al fijarse a la superficie celular, lo que puede disminuir la absorción del colesterol e incrementar la producción de short chain fatty acids (SCFA, «ácidos grasos de cadena corta»)25. Otro estudio reflejó que los probióticos pueden disminuir la expresión de IL-6 e IL-8 a través de la producción de SCFA26. En segundo lugar, los probióticos modulan la expresión de los genes, codificando las proteínas de adherencia, tales como E-cadherina y β-catenina, para disminuir la expresión de la proteína cinasa (PKCδ) que regula positivamente la función de la barrera epitelial27. Cuando disminuye la permeabilidad de la mucosa intestinal, una gran cantidad de bacterias gramnegativas comienza a traslocarse a fin de incrementar el nivel de LPS plasmático4. A continuación, el receptor 4 tipo Toll, un miembro de la familia TLR activado mediante LPS, se produce en tejidos cuyo objetivo es la activación de la insulina. Además, los probióticos incrementan la fosforilación de la tirosina de las proteínas del sustrato receptor de insulina, originando una mejora de la activación de la señalización de la insulina28.
Inevitablemente existen ciertas limitaciones en este metaanálisis que requieren ser mejoradas en estudios futuros. En primer lugar, no se realiza ninguna comparación entre el grupo de los simbióticos y el de los probióticos en todos los ECA incluidos, por lo que no los hemos separado. Y en segundo lugar, y más importantemente, los participantes incluidos provienen principalmente de Irán, por lo que la limitación regional ha restringido la fiabilidad de los resultados.
ConclusiónEn este documento analizamos los efectos beneficiosos de los probióticos y, en especial, de los lactobacilos y las bifidobacterias, en el tratamiento de la diabetes. Como bioterapéutica potencial, los probióticos pueden mejorar el control de la glucosa y del metabolismo lipídico en condiciones de dosis completas y en un curso de tratamiento prolongado.
FinanciaciónEste trabajo fue financiado por el organismo National Natural Science Foundation de China (Beca N.o 81370872).
AutoríaYan-cheng Xu y Yi-meng Hu diseñaron el estudio; Yi-meng Hu, Yin Yuan y Feng Zhou realizaron la investigación; Yi-meng Hu y Yin Yuan analizaron los datos, y Yi-meng Hu redactó el documento.
Conflicto de interesesDeclaramos la ausencia de relaciones financieras y personales con otras personas y organizaciones que pudieran influir de manera inadecuada en nuestro trabajo, así como la no existencia de conflicto de intereses alguno.