El desarrollo de vacunas contra el virus SARS-CoV-2 (severe acute respiratory syndrome coronavirus-2), agente etiológico de la COVID-19 (coronavirus disease-19), constituye una importante herramienta epidemiológica para el control de la pandemia. Las personas con enfermedades autoinmunes sistémicas (EAS) tienen mayor riesgo de presentar formas graves y mayor mortalidad por COVID-191,2. Los factores de riesgo asociados a mayor gravedad son, por una parte, los mismos que en la población general, como la edad mayor de 65 años, el sexo masculino, la hipertensión arterial con comorbilidad cardíaca y la enfermedad pulmonar o renal crónica2. Por otra parte, existen factores inherentes a las EAS. En el estudio del registro internacional COVID-19 Global Rheumatology Alliance physician-reported registry, el mayor riesgo de mortalidad se asoció a la actividad moderada-alta, el uso de una dosis mayor de 10mg/día de prednisona, de sulfasalazina o de rituximab2.
La mayor morbimortalidad sitúa a las personas con EAS en los grupos prioritarios de pacientes que se beneficiarían de la vacunación contra la COVID-193. Hasta el momento se desconocen los datos relativos a su eficacia y efectos adversos ya que estos grupos de pacientes fueron excluidos de los estudios clínicos que condujeron a la aprobación de dichas vacunas. Sin embargo, la posición de diferentes sociedades científicas está a favor de ofrecer a los pacientes la vacunación contra COVID-193–6. Desde una perspectiva clínica, se plantean las siguientes preguntas para guiar las decisiones que se deben tomar:
- 1)
¿Qué tipo de vacunas contra COVID-19 están actualmente disponibles y cuál es su eficacia en pacientes con EAS?
- 2)
¿Pueden las vacunas contra COVID-19 desencadenar una EAS o provocar un brote de la enfermedad?
- 3)
¿Qué efectos adversos potenciales pueden producir las vacunas contra la COVID-19 en pacientes con EAS?
- 4)
¿Tienen mayor riesgo de desarrollar trombosis los pacientes con EAS que reciban vacunas sobre plataforma ADN con vector adenovirus?
- 5)
¿Cuál es el escenario clínico más apropiado para administrar la vacuna contra COVID-19 en un paciente con una EAS?
- 6)
¿Es necesario suspender el tratamiento inmunosupresor antes de la administración de la vacuna contra COVID-19?
- 1)
Tipo de vacunas contra COVID-19 actualmente disponibles y eficacia en pacientes con EAS.
- 1)
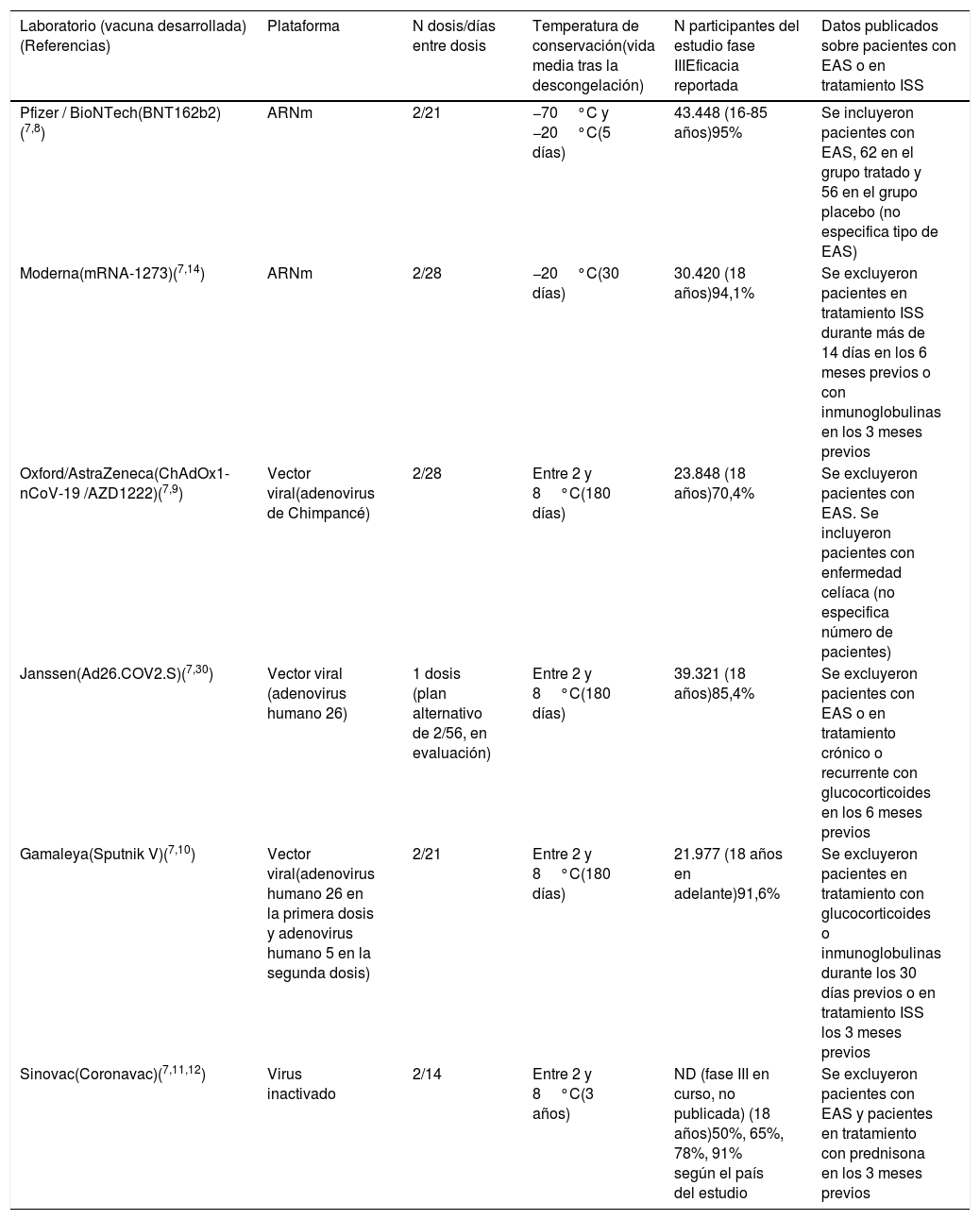
Existen cuatro plataformas diferentes de vacunas contra SARS-CoV-2 evaluadas en estudios clínicos en fase III: a) las basadas en ARN mensajero (ARNm); b) las que utilizan ADN mediante un vector viral; c) las que utilizan virus SARS-CoV-2 inactivados, y d) la cuarta plataforma, constituida por vacunas que utilizan nanopartículas proteicas recombinantes con adyuvantes7 (tabla 1).
Principales características de las vacunas contra la COVID-19
| Laboratorio (vacuna desarrollada)(Referencias) | Plataforma | N dosis/días entre dosis | Temperatura de conservación(vida media tras la descongelación) | N participantes del estudio fase IIIEficacia reportada | Datos publicados sobre pacientes con EAS o en tratamiento ISS |
|---|---|---|---|---|---|
| Pfizer / BioNTech(BNT162b2)(7,8) | ARNm | 2/21 | −70°C y −20°C(5 días) | 43.448 (16-85 años)95% | Se incluyeron pacientes con EAS, 62 en el grupo tratado y 56 en el grupo placebo (no especifica tipo de EAS) |
| Moderna(mRNA-1273)(7,14) | ARNm | 2/28 | −20°C(30 días) | 30.420 (18 años)94,1% | Se excluyeron pacientes en tratamiento ISS durante más de 14 días en los 6 meses previos o con inmunoglobulinas en los 3 meses previos |
| Oxford/AstraZeneca(ChAdOx1-nCoV-19 /AZD1222)(7,9) | Vector viral(adenovirus de Chimpancé) | 2/28 | Entre 2 y 8°C(180 días) | 23.848 (18 años)70,4% | Se excluyeron pacientes con EAS. Se incluyeron pacientes con enfermedad celíaca (no especifica número de pacientes) |
| Janssen(Ad26.COV2.S)(7,30) | Vector viral (adenovirus humano 26) | 1 dosis (plan alternativo de 2/56, en evaluación) | Entre 2 y 8°C(180 días) | 39.321 (18 años)85,4% | Se excluyeron pacientes con EAS o en tratamiento crónico o recurrente con glucocorticoides en los 6 meses previos |
| Gamaleya(Sputnik V)(7,10) | Vector viral(adenovirus humano 26 en la primera dosis y adenovirus humano 5 en la segunda dosis) | 2/21 | Entre 2 y 8°C(180 días) | 21.977 (18 años en adelante)91,6% | Se excluyeron pacientes en tratamiento con glucocorticoides o inmunoglobulinas durante los 30 días previos o en tratamiento ISS los 3 meses previos |
| Sinovac(Coronavac)(7,11,12) | Virus inactivado | 2/14 | Entre 2 y 8°C(3 años) | ND (fase III en curso, no publicada) (18 años)50%, 65%, 78%, 91% según el país del estudio | Se excluyeron pacientes con EAS y pacientes en tratamiento con prednisona en los 3 meses previos |
ARNm: ARN mensajero; EAS: enfermedad autoinmune sistémica; ISS: inmunosupresor; ND: no hay datos.
Las vacunas que utilizan como plataforma ARNm incluyen en su secuencia la proteína S (espiga o spike protein) del SARS-CoV-2 y una capa lipídica de nanopartículas como envoltorio protector del ARNm. Esta facilita su entrada al citoplasma celular y el inicio de la traducción del ARNm en la proteína viral, para posteriormente dar lugar a la respuesta inmune generadora de anticuerpos neutralizantes contra la proteína S. Esta estrategia es la utilizada por los laboratorios Pfizer-BioNTech y Moderna/National Institute of Allergy and Infectious Diseases7. Los estudios de la vacuna de Pfizer-BioNTech incluyeron individuos de 16 años o mayores y muy pocos pacientes con enfermedades reumáticas (62 en el grupo tratado y 56 en el grupo placebo), lo que representa solo el 0,3% de la muestra. Hasta el momento, no se han publicado datos específicos de este grupo de pacientes8.
Las vacunas que emplean ADN como plataforma utilizan adenovirus a los que se ha eliminado su capacidad replicativa y que de forma adicional se les insertó el ADN de la proteína S del SARS-CoV-2. Por tanto, se trata de una vacuna que introduce un adenovirus incompetente en su replicación, pero que permite la entrada al núcleo celular del ADN necesario para la síntesis de la proteína S, lo que genera la respuesta inmunitaria. Esta es la estrategia utilizada (con diferentes adenovirus) por los laboratorios University of Oxford/AstraZeneca (adenovirus de chimpancé), Gamaleya National Research Centre for Epidemiology and Microbiology (adenovirus humanos 5 y 26), CanSino Biological Inc/Beijing Institute of Biotechnology (adenovirus humano 5) y Janssen Pharmaceutical Companies (adenovirus humano 26)7. Los estudios de la vacuna de University of Oxford/AstraZeneca incluyeron pacientes de 18 años o mayores y excluyeron pacientes con EAS (excepto aquellos con enfermedad celíaca)9. En el estudio de la vacuna de Gamaleya se excluyeron pacientes en tratamiento con glucocorticoides o inmunoglobulinas o en tratamiento con inmunodepresores en los 3 meses previos a la administración de la vacuna10.
El tercer grupo lo constituyen las vacunas que utilizan como plataforma virus inactivados. Se utilizan partículas virales de SARS-CoV-2 inactivadas mediante métodos químicos, administradas junto con un excipiente (adyuvante) que potencia su inmunogenicidad. Con ello consigue una respuesta inmunitaria con producción de anticuerpos neutralizantes contra la proteína S y contra otros antígenos menos representados, considerados anticuerpos no neutralizantes. Esta es la estrategia utilizada por el laboratorio SinoVac (Coronavac), Biotech, del cual se han publicado los resultados de los estudios en fase I/II y el protocolo de la fase III. En este fueron incluidos personas de 18 años o mayores y se excluyeron pacientes con EAS, así como los que recibieron prednisona en los 3 meses previos a la administración de la vacuna7,11,12.
La cuarta plataforma de vacunas se construye en base a nanopartículas (subunidades) proteicas recombinantes asociadas a un adyuvante que potencia su respuesta inmune. Esta es la estrategia utilizada por el laboratorio Novavax, con datos publicados de los estudios de fase I/II (en curso la fase III)7,13.
En términos de eficacia, es decir, pacientes sin infección por SARS-CoV-2 después de completar el ciclo de vacunación, los porcentajes se sitúan en el 95% para la vacuna de Pfizer/BioNTech, 94,1% para la de Moderna, 91,6% en la de Gamaleya, 70,4% en la de Oxford/AstraZeneca, y Sinovac ha anunciado una eficacia variable del 50%, 65%, 78% y 91% según el país donde fue realizado el estudio, respectivamente7,14.
En cuanto a la efectividad en la producción de anticuerpos en personas sin EAS, las vacunas sobre plataformas de ARNm y vectores virales ADN aportan mecanismos de potenciación de la respuesta inmunitaria (innata y adquirida) mediante la activación de las vías intracelulares (como la del interferón y activación de toll-like receptor), efectos no observados con la administración de vacunas con virus inactivados. Si bien todas las estrategias de vacunas contra COVID-19 generan linfocitos memoria, los niveles de producción de anticuerpos logrados por vacunas con ARNm o vector viral ADN son (al menos 4 veces) más altos que los obtenidos por vacunas con virus inactivados.
Cabe destacar que no se conoce con exactitud cómo es la producción de anticuerpos frente al SARS-CoV-2 en pacientes con EAS tras la vacunación. De forma muy reciente se han publicado los primeros datos de la respuesta a las vacunas que utilizan como plataforma ARNm en pacientes con EAS15,16. En el primer estudio que incluyó 26 pacientes con diferentes enfermedades autoinmunes, la respuesta definida por la producción de anticuerpos IgG dirigidos contra la proteína S del SARS-CoV-2 y de anticuerpos neutralizantes se constató en todos los pacientes. Sin embargo, los títulos fueron significativamente más bajos en los pacientes que en controles sanos. Además, los autores no encontraron diferencias en la respuesta a las vacunas entre los pacientes tratados con agentes anti-TNF y aquellos que recibían fármacos modificadores de la enfermedad15. En el segundo estudio que incluyó 123 pacientes se detectó la generación de anticuerpos anti-SARS-CoV-2 en el 74%16. El tratamiento con micofenolato o rituximab se asoció a un mayor riesgo de no generar respuesta a la vacuna17.
- 2)
Potencial de las vacunas contra COVID-19 de desencadenar una EAS o provocar un brote de la enfermedad.
En el curso o inmediatamente después de la COVID-19 se han descrito la aparición de enfermedades autoinmunes (síndrome de Guillain-Barré, trombocitopenia inmune y síndrome antifosfolipídico, entre otras)18, así como la presencia de anticuerpos antinucleares, anticuerpos contra antígenos nucleares extraíbles, anticuerpos antimitocondriales, anticuerpos antifosfolipídicos y factor reumatoide18. A su vez, se ha demostrado reactividad cruzada entre los anticuerpos dirigidos contra la proteína S del SARS-CoV-2 y diferentes antígenos tisulares19. Esto plantea la hipótesis de que la proteína S del SARS-CoV-2 podría, por mimetismo molecular, desencadenar el desarrollo de una EAS.
De la misma manera que las vacunas con ARNm logran una respuesta inmunológica de mayor intensidad al activar vías citoplasmáticas adicionales, es factible que puedan activar una cascada de mecanismos inmunológicos que conduzcan a la activación aberrante de la respuesta inmune (innata o adquirida) e hipotéticamente inducir o activar una EAS. En este sentido, uno de los efectos adversos graves reportados en la vacuna de Moderna ha sido el desarrollo de artritis reumatoide en una de las personas del grupo tratado, único caso descrito en el estudio con 30.000 voluntarios incluidos20.
La no inclusión de pacientes con EAS en los estudios clínicos de las diferentes vacunas impide ofrecer evidencia científica al respecto. No obstante, los mecanismos de mimetismo molecular asociados a la presencia de la proteína S del SARS-CoV-2, así como la activación de vías aberrantes de la respuesta inmunitaria, dejarían abierta la puerta a mecanismos responsables de activación de una EAS como resultado de una vacunación contra COVID-19. Por tanto, existe un riesgo teórico de que la enfermedad autoinmune desarrolle un brote o empeoramiento tras la vacunación. Sin embargo, el beneficio de la protección frente a un cuadro grave que ofrece la vacuna contra COVID-19 sobrepasa el riesgo potencial de una recaída de la enfermedad3.
- 3)
Potenciales efectos adversos de las vacunas contra COVID-19 en pacientes con EAS.
Los efectos adversos más frecuentes (variables en frecuencia según el tipo de vacuna) son dolor en el sitio de punción, eritema, cefalea, parestesias orales transitorias, adinamia y adenomegalias. Con excepción del caso de artritis reumatoide reportado en los estudios de Moderna, en ningún caso se han descrito efectos adversos relacionados con la aparición de EAS o enfermedades autoinflamatorias8,13. A corto plazo se deben hacer públicos los primeros resultados del estudio de las vacunas en pacientes con EAS promovido por el «COVID-19 Global Rheumatology Alliance». En este momento, el estudio ha recogido datos de más de 2.600 pacientes con EAS que han recibido al menos una dosis de la vacuna21. Otro estudio similar es el «The VACOLUP study», promovido por el RESO (Centre de Référence des maladies auto-immunes systémiques rares Est Sud-Ouest) de Francia. En este caso, hay datos actualizados de 339 pacientes con lupus eritematoso sistémico. El 49% ha presentado algún efecto secundario tras la primera dosis (81% leve-moderado) y el 49% después de la segunda dosis (79% leve-moderado). Solo un 3% ha presentado un brote de la enfermedad y no se ha producido ningún caso de infección por SARS-CoV-2 en los pacientes vacunados22.
Además de los efectos adversos descritos en la población general, el potencial daño pulmonar relacionado con el uso de vacunas contra COVID-19 genera particular interés en pacientes con EAS, dada la alta prevalencia de enfermedad pulmonar intersticial difusa (EPID) en estos pacientes. El daño se produciría a través de un mecanismo conocido como lesión intensificada dependiente de anticuerpos (antibody-dependent enhancement [ADE]), en el que se produciría un incremento en la entrada y replicación celular del virus favorecido por la presencia de los anticuerpos inducidos por la vacuna. Una vez que el individuo vacunado se enfrenta a la infección para la cual fue inmunizado, la presencia de anticuerpos inducidos por la vacuna generaría una reacción antígeno-anticuerpo con formación de inmunocomplejos y daño tisular consecuente. Este tipo de daño produce la denominada enfermedad pulmonar intensificada por vacunas (vaccine antibodies enhanced respiratory disease [VAERD]), descrita durante el desarrollo de vacunas contra el virus sincitial respiratorio y en modelos más cercanos a la COVID-19, como son las vacunas contra SARS-CoV-1 y el síndrome respiratorio de Oriente Medio producido por el MERS-CoV (Middle East Respiratory Syndrome coronavirus)7,23.
Cabe destacar que el fenómeno de VAERD se relaciona tanto con vacunas con plataformas de ARNm, vectores de ADN, como con vacunas con virus inactivados. No obstante, el riesgo podría ser potencialmente mayor con vacunas con virus inactivados, ya que el paciente se expone a múltiples antígenos que conducen a la producción de anticuerpos no neutralizantes y/o a la síntesis de anticuerpos dirigidos contra la proteína S en conformaciones no neutralizantes. Esto incrementa la diversidad de dianas a reconocer y otorgaría una mayor capacidad de desarrollar fenómenos de ADE7,23.
- 4)
Riesgo de trombosis de los pacientes con EAS que reciben vacunas sobre plataforma ADN con vector adenovirus.
Desde febrero de 2021 se han descrito varios casos de trombosis venosa cerebral o trombosis de venas esplácnicas junto con trombocitopenia en personas que han recibido la vacuna Oxford/AstraZeneca24–26. Este cuadro de trombosis de localización atípica y trombocitopenia tras la administración de la vacuna ha recibido el nombre de vaccine-induced immune thrombotic thrombocytopenia (VITT). Su mecanismo patogénico es similar al de la trombocitopenia inducida por heparina (heparin induced thrombocytopenia [HIT]) que se caracteriza por la presencia de anticuerpos dirigidos contra el factor plaquetario 4 que desencadenan la activación plaquetaria (entre otros mecanismos), lo que da lugar a la trombosis junto con el descenso en el número de plaquetas24–26. La Agencia Europea de Medicamentos (European Medicines Agency [EMA]) ha informado sobre la plausibilidad de la relación entre la administración de esta vacuna y este efecto adverso sin haber podido identificar los factores de riesgo que predispongan a su aparición. De forma global, la EMA establece que el riesgo estimado de este efecto adverso es de 1 caso por cada 100.000 personas que han recibido la primera dosis de la vacuna Oxford/AstraZeneca27.
Los datos publicados a abril de 2021 recogen 39 pacientes que recibieron la vacuna de Oxford/AstraZeneca y ninguno de ellos presentaba un antecedente previo de una EAS, trombocitopenia ni trombosis24–26. En el estudio para descartar otras causas de trombosis y trombocitopenia, 2 casos presentaron anticuerpos antifosfolipídicos, uno de ellos con una enfermedad de von Willebrand y una mutación heterocigota del factor V de Leiden. El otro caso presentaba anticuerpos anticardiolipina. En la serie que incluyó 23 pacientes (la serie de mayor número), los anticuerpos antinucleares fueron negativos en todos ellos y el anticoagulante lúpico estuvo presente en 5 de los 10 casos en que se determinó. Los autores relacionan este hallazgo con el estado de coagulación intravascular diseminada que existía en esos pacientes24–26. De forma más reciente, se han descrito 6 casos de VITT relacionados con la vacuna de vector adenovirus de Janssen, y la EMA ha propuesto el mismo mecanismo patogénico28.
El desarrollo de estas trombosis tras la administración de ambas vacunas ha sido interpretado por las agencias reguladoras como un efecto adverso probablemente relacionado con las vacunas de vector adenovirus. Por otra parte, dado que ninguno de los casos presentó el antecedente previo de la existencia de una EAS, trombocitopenia ni trombosis, puede inferirse que no se dispone de evidencia que indique que este tipo de vacunas puedan representar un mayor riesgo trombótico en pacientes con EAS. No obstante, son necesarios más estudios de farmacovigilancia para reafirmar o refutar la existencia de este riesgo.
- 5)
Escenario clínico más apropiado para administrar la vacuna contra COVID-19.
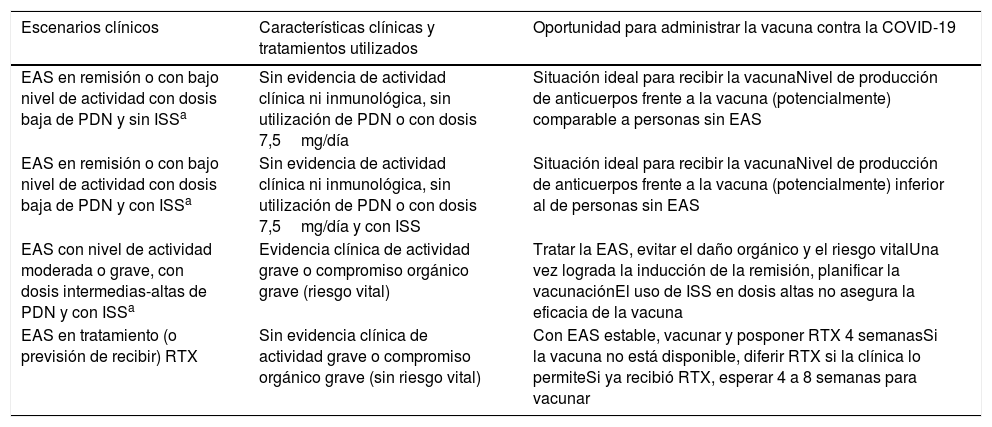
En la situación ideal, los pacientes con EAS deberían recibir cualquier vacuna durante la remisión o un período de baja actividad, o antes de recibir de forma planificada un tratamiento inmunosupresor, en particular un tratamiento de depleción de linfocitos B29. En relación con la oportunidad de vacunar y el tipo de tratamiento inmunosupresor en curso, la recomendación general es de no modificar el tratamiento de la EAS, ya que no existe evidencia al respecto5,6. Se podría dividir a los pacientes con EAS en cuatro escenarios de acuerdo con la situación clínica en la que se encuentren en el momento de ofrecer la vacuna (tabla 2):
- •
Paciente con enfermedad en remisión o bajo nivel de actividad, en tratamiento con dosis bajas de glucocorticoides y sin inmunosupresores. Este grupo se encuentra en la situación ideal, donde la enfermedad no presenta actividad y los niveles de glucocorticoides son bajos (≤7,5mg/día). Es el mejor escenario para administrar la vacuna y lograr niveles de anticuerpos comparables a las personas sin EAS.
- •
Paciente con enfermedad en remisión o bajo nivel de actividad, en tratamiento con dosis bajas de glucocorticoides, con inmunosupresores convencionales y/o tratamiento biológico o inhibidores de la Janus quinasa. En este grupo de pacientes los niveles de inmunosupresión podrían condicionar la menor producción de anticuerpos o menor desarrollo de linfocitos memoria. No obstante, esta condición no debe impedir realizar la vacunación, considerando el escenario de pandemia, donde los potenciales beneficios superan los posibles efectos adversos.
- •
Paciente con actividad moderada o grave, en tratamiento con dosis intermedias o altas de glucocorticoides, con inmunosupresores convencionales y/o tratamiento biológico o inhibidores de la Janus quinasa o en vistas a recibir alguno de estos tratamientos. En esta situación es razonable tratar primero la EAS y posponer la vacunación ya que habitualmente se utilizan dosis altas de inmunosupresores, lo que puede disminuir de forma significativa la producción de anticuerpos inducidos por las vacunas contra COVID-19. Además, los potenciales efectos adversos de la vacunación podrían superponerse al cuadro de actividad de la enfermedad, lo que podría dificultar la diferenciación de qué síntomas corresponden a una u otra causa3.
- •
Paciente en tratamiento (o con previsión de recibir) rituximab. La utilización de rituximab se asocia a una disminución global de inmunoglobulinas (en especial de isotipo IgG), así como a menores niveles de anticuerpos específicos tras la vacunación17,29. Frente a la utilización de rituximab como parte del tratamiento se debe considerar: 1) si clínicamente es posible y se tiene acceso a la vacuna, proceder a vacunar al paciente y diferir la administración del rituximab 4 semanas; 2) si el paciente ya recibió rituximab, una opción razonable sería vacunar contra COVID-19 después de 4 a 8 semanas de haberlo recibido; 3) si la vacuna aún no está disponible y clínicamente es seguro diferir el rituximab, se debería retrasar su administración o utilizar un plan de tratamiento alternativo; 4) si la vacuna aún no está disponible y no es seguro diferir 4 semanas la administración del rituximab, se debería administrar el mismo y ofrecer la vacuna cuando se tenga acceso a la misma6.
- 6)
Necesidad de suspensión del tratamiento inmunosupresor antes de la administración de la vacuna contra COVID-19.
- 6)
Escenarios clínicos de los pacientes con enfermedad autoinmune sistémica en el momento de la administración de la vacuna contra la COVID-19
| Escenarios clínicos | Características clínicas y tratamientos utilizados | Oportunidad para administrar la vacuna contra la COVID-19 |
|---|---|---|
| EAS en remisión o con bajo nivel de actividad con dosis baja de PDN y sin ISSa | Sin evidencia de actividad clínica ni inmunológica, sin utilización de PDN o con dosis 7,5mg/día | Situación ideal para recibir la vacunaNivel de producción de anticuerpos frente a la vacuna (potencialmente) comparable a personas sin EAS |
| EAS en remisión o con bajo nivel de actividad con dosis baja de PDN y con ISSa | Sin evidencia de actividad clínica ni inmunológica, sin utilización de PDN o con dosis 7,5mg/día y con ISS | Situación ideal para recibir la vacunaNivel de producción de anticuerpos frente a la vacuna (potencialmente) inferior al de personas sin EAS |
| EAS con nivel de actividad moderada o grave, con dosis intermedias-altas de PDN y con ISSa | Evidencia clínica de actividad grave o compromiso orgánico grave (riesgo vital) | Tratar la EAS, evitar el daño orgánico y el riesgo vitalUna vez lograda la inducción de la remisión, planificar la vacunaciónEl uso de ISS en dosis altas no asegura la eficacia de la vacuna |
| EAS en tratamiento (o previsión de recibir) RTX | Sin evidencia clínica de actividad grave o compromiso orgánico grave (sin riesgo vital) | Con EAS estable, vacunar y posponer RTX 4 semanasSi la vacuna no está disponible, diferir RTX si la clínica lo permiteSi ya recibió RTX, esperar 4 a 8 semanas para vacunar |
EAS: enfermedad autoinmune sistémica; PDN: prednisona; ISS: inmunosupresores; RTX rituximab.
No existe consenso en este punto. Las recomendaciones del Colegio Americano de Reumatología sugieren discontinuar el tratamiento con metotrexato, inhibidores de la Janus quinasa, abatacept y pulsos intravenosos de ciclofosfamida hasta una semana después de administrada cada dosis de la vacuna (siempre y cuando la enfermedad se encuentre estable y si es posible desde el punto de vista clínico)3. Esta recomendación se basa en los resultados de la respuesta inmunitaria frente a otras vacunas como la de la gripe o neumococo en pacientes con EAS en tratamiento inmunosupresor. Sin embargo, otras sociedades científicas abogan por la no suspensión del tratamiento a la hora de administrar la vacuna contra la COVID-195,6.
Variables a considerar en la toma de decisiones frente a la vacunación contra COVID-19Como concepto general, ninguna de las vacunas disponibles y aprobadas contra COVID-19 se basa en virus SARS-CoV-2 vivos atenuados, por lo que no están contraindicadas formalmente en pacientes con EAS. Puede inferirse que, en algunos casos, la respuesta frente a la vacuna será de menor intensidad y, por ende, la protección será menor. Esto remarca la necesidad de mantener las medidas físicas de protección, como el uso de mascarilla facial, la higiene de manos y el distanciamiento físico sostenido, ya que la vacunación no evita la infección, sino que evita formas graves de la misma y, por tanto, no exime al paciente de cumplir las medidas físicas preventivas. Del mismo modo, la vacunación contra COVID-19 de los convivientes de pacientes con EAS es una forma de disminuir los riesgos de infección3.
El acto de aconsejar la vacunación contra COVID-19 debe ser una decisión compartida entre el médico y el paciente, que debe evaluar si los efectos beneficiosos superan los riesgos potenciales de sufrir la infección. En los casos de pacientes con EAS que ya presentaron la COVID-19 de forma sintomática, parece razonable sugerir la misma pauta que para la población general y esperar 6 meses para administrar la vacuna.
Las sociedades científicas que se han posicionado en relación con este tema están de acuerdo en ofrecer la vacunación contra COVID-19 a todos los pacientes con EAS, con cualquiera de las plataformas de vacunación aprobadas por las agencias reguladoras de medicamentos y hacen énfasis en que los beneficios potenciales de evitar una forma grave de COVID-19 superan los riesgos de los potenciales efectos adversos3–6. Con toda esta información, en el momento de prescribir la vacunación contra la COVID-19 en pacientes con EAS, es importante tener en cuenta los siguientes factores que potencialmente pueden influir tanto en los niveles de protección como en el desarrollo de efectos adversos:
- 1)
El grado de actividad de la EAS y el tipo y la intensidad del tratamiento inmunodepresor utilizado en el momento de ofrecer la vacunación.
- 2)
Los pacientes con factores de riesgo asociados a COVID-19 grave se podrían beneficiar de la utilización de las vacunas sobre plataforma de ARNm o vector viral ADN, ya que ofrecen mecanismos intracelulares adicionales de potenciación de la respuesta inmune. Ello posibilitaría mayores títulos de anticuerpos, teniendo en cuenta que por la edad o por el tratamiento inmunosupresor podrían desarrollar una respuesta inmune menos intensa contra el SARS-CoV-2.
- 3)
Las vacunas de virus inactivados presentan, potencialmente, mayor riesgo de desarrollar daño pulmonar por VAERD, hecho a considerar en pacientes con EAS y comorbilidad respiratoria como la presencia de EPID. Ello podría ser un factor importante a la hora de optar por vacunas sobre plataforma ARNm o vector viral ADN, las cuales inducen la producción de anticuerpos neutralizantes de forma específica y tienen menor riesgo de inducir anticuerpos no neutralizantes (asociados a VAERD).
- 4)
Las vacunas sobre plataforma ARNm, vector viral ADN, en base a virus inactivado o nanopartículas de proteína recombinante, podrían ser opciones adecuadas en pacientes con EAS en remisión o con baja actividad, ausencia o baja dosis de inmunosupresores y ausencia de EPID.
- 5)
No existe hasta el momento evidencia científica suficiente que avale modificar el tratamiento de la EAS previo o posterior a la administración de la vacuna contra COVID-19.
- 6)
Una vez completado el esquema de vacunación de la opción elegida, dado que no es posible predecir el título de anticuerpos neutralizantes contra COVID-19 y determinar con certeza el nivel de protección que tendrá el paciente, se sugiere evaluar la magnitud de la respuesta adquirida tras la vacunación. Probablemente, futuros estudios permitan conocer si esto es posible, mediante la detección en suero (por técnicas de ELISA por ejemplo) de anticuerpos de isotipo IgG contra la proteína S de SARS-CoV-2 al cabo de 3 a 6 meses de administrada la vacuna.
- 7)
Por último y no menos importante, la vacunación contra COVID-19 en pacientes con EAS no los exime de mantener las medidas de protección física y social recomendadas, ya que son desconocidos los niveles de protección que ofrecerán las nuevas vacunas contra COVID-19 en pacientes con EAS.
Promover la vacunación contra la COVID-19 en pacientes con EAS es poner por delante el elevado riesgo de padecer una forma grave de la infección frente al potencial riesgo de efectos secundarios. Cabe tener en cuenta que estos efectos secundarios graves son muy raros. Sin embargo, debido a la escasez de evidencia específica, el paciente debe participar en la decisión de recibir la vacuna. En este proceso debe contar con el asesoramiento del médico responsable que le trasmitirá la relación beneficio-riesgo derivada de su enfermedad, del grado de actividad y del tipo de tratamiento de base. En cualquier caso, es muy importante que el paciente siga manteniendo las medidas generales que se han comprobado efectivas para impedir la propagación del virus, así como mantener el tratamiento de su EAS.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran que no presentan ningún conflicto de interés.