En este artículo se revisan los papeles perniciosos y beneficiosos de las fosfolipasas segregadas A2 (sPLA2). Aunque la sPLA2-II (inflamatoria) humana estuvo inicialmente implicada en la patogenia de la sepsis, del fallo multiorgánico y de otros síndromes relacionados, estudios recientes demuestran también su participación en los mecanismos de resistencia antiinfecciosa del huésped. Así, la sPLA2-II exhibe potentes actividades bactericidas frente a bacterias gramnegativas y grampositivas (en este caso, junto a otros factores inflamatorios). Curiosamente, la sPLA2-IIA no muestra actividad antivirus de la inmunodeficiencia humana (VIH) in vitro, mientras que varias sPLA2-IA aisladas de venenos de abejas y de serpientes sí lo hacen; es el caso de la crotoxina, una sPLA2-IA aislada del veneno de Crotalus durissus terrificus (sPLA2-Cdt). Los efectos anti-VIH in vitro de la sPLA2-Cdt (inhibición de Gag p24) podrían deberse a su capacidad para desestabilizar algunos receptores de anclaje (heparanos) y de penetración (colesterol) del VIH presentes en las células del huésped.
In this paper the authors update on the deletereous or beneficial roles of human and animal secretory phospholipases A2 (sPLA2). Although human sPLA2-IIA (inflammatory) was initially thought as a foe because its pathogenic implication in sepsis, multiorganic failure or other related syndromes, recent data indicates its role in in the antiinfectious host resistance. Thus, sPLA2-IIA exhibits potent bactericidal activities against gram-negative and gram-positive (in this case, together with other endogenous inflammtory factors) bacteria. Surprisingly, human sPLA-IIA does not show in vitro anti-human immunodeficiency virus (HIV) activity, whilst several sPLA2-IA isolated from bee and serpent venons do it: this is the case for crotoxin, a sPLA2-IA isolated from the venon of Crotalus durissus terrificus (sPLA2-Cdt). The mechanism for the in vitro anti-HIV activity of sPLA2-Cdt (inhibition of Gag p24) appears to be related to the ability of the drug to desestabilize ancorage (heparans) and fusion (cholesterol) receptors on HIV target cells.
Las fosfolipasas A2 (PLA2) son enzimas que catalizan la hidrólisis de ácidos grasos en la posición sn-2 de los fosfolípidos presentes en la membrana de las células1,2. Se han aislado tanto en diferentes células y tejidos de mamíferos como en venenos de serpientes y abejas3. En humanos se conocen 2 grandes familias de PLA2 (tabla 1), que difieren por su sitio de acción4: a) las intracelulares o citosólicas (cPLA2), también denominadas PLA2 grupo IV (PLA2-IV), que se definen por su elevado peso molecular (85 kDa) y por estar involucradas en el metabolismo intracelular del ácido araquidónico5; y b) las segregadas (sPLA2), que se caracterizan por su bajo peso molecular (14-18 kDa), por ser activas en el medio extracelular y por estar implicadas en la patogenia de diversos procesos inflamatorios/infecciosos y tumorales, así como en determinados mecanismos de regulación hormonal y en fenómenos de resistencia antibacteriana (tabla 1). Ellas, junto a las sPLA2 de venenos animales, son el motivo principal de esta revisión, esencialmente dirigida a mostrar sus aspectos positivos en los mecanismos de resistencia antibacteriana y antiviral, fundamentalmente frente al virus de la inmunodeficiencia humana (VIH).
En cualquier caso, es preciso decir de antemano que, a pesar de su diferente distribución tisular, cPLA2 y sPLA2 mantienen estrechas relaciones de convivencia regulatoria6 destinadas a mantener, en lo posible, la homeostasis ante situaciones de agresión inflamatoria. Por el mismo motivo, sin embargo, es lógico suponer que el descarrilamiento inflamatorio se acompaña también de alteraciones sustanciales en ambos tipos de PLA2.
Origen, clasificación, mecanismos de acción y funciones de las sPLA2
Como se ha dicho, las sPLA2 se encuentran tanto en tejidos de mamíferos como en algunos venenos de animales, fundamentalmente abejas y serpientes, donde catalizan la hidrólisis de glicerofosfolípidos de las membranas celulares y dan lugar a la liberación de ácidos grasos y de lisofosfolípidos7-12. Las sPLA2 se han clasificado en diferentes familias y grupos (tabla 1), de acuerdo con el número y la posición de los residuos de cisteína presentes en sus secuencias9,12. Todas las sPLA2 tienen una configuración similar y el mismo mecanismo catalítico de acción, si bien están dotadas de diferentes efectos farmacológicos7,8,12, lo que, como veremos, va a permitir otras tantas aplicaciones diagnósticas y/o terapéuticas. Por el momento, al menos 7 sPLA2 de mamíferos (IB, IIA, IIC, IID, V, X y XII) han sido clonadas y relacionadas con diversos hechos fisiológicos y/o procesos fisiopatológicos10-14.
En mamíferos se conocen 2 tipos de sPLA2 (tabla 1): la producida por el páncreas, llamada, por tanto, pancreática (sPLA2-IB), y la segregada por el tejido sinovial o inflamatoria (sPLA2-IIA). Las obtenidas de venenos de serpientes se han clasificado como sPLA2-IA, aunque, como se verá, algunas de ellas poseen mecanismos de acción similares a las sPLA-IIA. La sPLA2-II, que fue originalmente aislada del fluido sinovial de pacientes con artritis, está también implicada en la regulación de numerosos fenómenos biológicos, si bien ha sido su participación en procesos patológicos como la pancreatitis, el fallo orgánico múltiple, el shock séptico, el asma y la artritis reumatoide, entre otros, la que ha hecho de la sPLA2-II una enzima aparentemente considerada con más valor diagnóstico y pronóstico que terapéutico4,15,16.
A pesar de ello, y teniendo en cuenta la participación de las PLA2 en procesos considerados esenciales para la vida (tabla 1), tales como el desarrollo de los mamíferos, la función vascular, la fisiología renal, el parto, las respuestas inmunológicas frente a la infección y su participación en los mecanismos de curación de las heridas16, se entiende como se verá más adelante que algunas sPLA2 podrían desempeñar un importante papel terapéutico en diversas enfermedades tanto infecciosas como no infecciosas.
Mecanismos de acción: reactantes de fase aguda y receptores de sPLA2
En el caso de las cPLA2, baste decir ya que no son objeto de este estudio que recientes experiencias en ratones deficientes (knockout) en PLA2-IV han demostrado el importante papel que cumplen en el parto17,18, en el daño cerebral postisquémico18,19 y en el desarrollo de reacciones alérgicas17 (tabla 1). Teniendo en cuenta las estrechas relaciones de connivencia entre cPLA2 y sPLA26, tampoco es de extrañar, como veremos, la participación de las sPLA2 en estos procesos fisiológicos y fisiopatológicos.
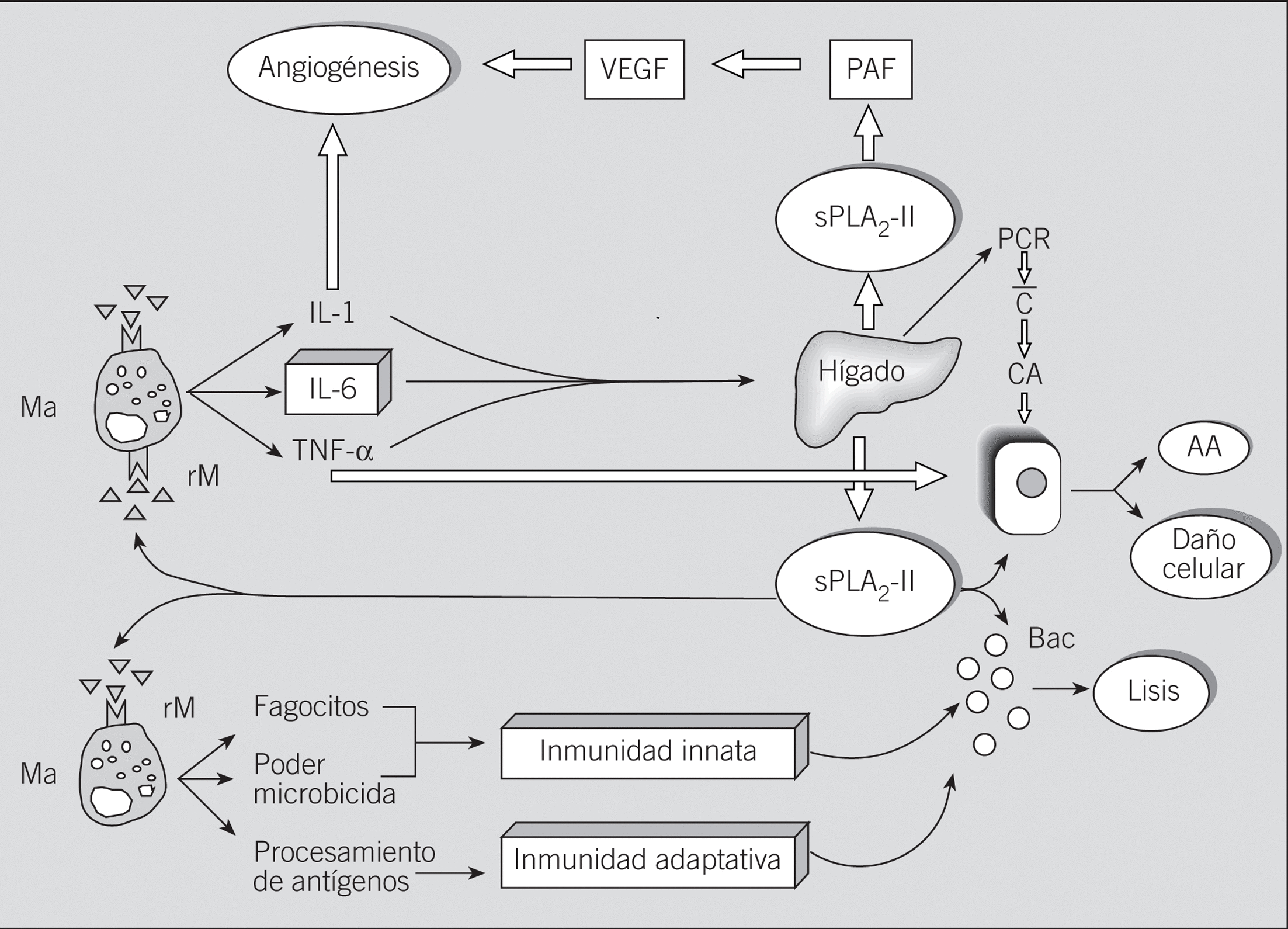
En lo que se refiere a las sPLA2-IIA, hoy se sabe que tanto en ratas con sepsis experimental provocada20 como en estudios in vitro con líneas celulares humanas de hepatoma21, así como tras algunas situaciones quirúrgicas en humanos22, las sPLA2-II de mamíferos se producen fundamentalmente en el hígado (fig. 1). Dado que esta producción hepática está controlada por diversas citocinas proinflamatorias interleucinas (IL) 1 y 6 y el factor de necrosis tumoral alfa (TNF-*), entre otras, las sPLA2-IIA se consideran actualmente proteínas (reactantes) de fase aguda21,22. En esta regulación de la producción intrahepática de las sPLA2-II hay que destacar que existe sinergismo entre IL-1 e IL-6 y entre IL-6 y TNF-*, pero no entre IL-1 y TNF-*21, lo que implica: a) que la IL-6 cumple un papel crucial en la inducción a la producción de sPLA2-II (fig. 1), y b) que su bloqueo podría ser de interés en el tratamiento del shock endotóxico y síndromes relacionados, así como en la prevención y/o tratamiento de otros procesos crónicos inflamatorios.
Fig. 1. Origen y funciones de las fosfolipasas A2 segregadas (sPLA2-IIA) de mamíferos. Su implicación en el daño tisular y en los mecanismos de resistencia antiinfecciosa. Ma: macrófagos; rM: receptor M (Manosa); IL: interleucina; TNF-*: factor de necrosis tumoral alfa; PAF: factor activador plaquetario; VEGF: factor de crecimiento endotelial vascular; PCR: proteína C reactiva; C: activación del sistema del complemento; CA: célula accesoria; AA: ácido araquidónico; Bac.: bacterias.
En relación con estos últimos acontecimientos, algunos de nosotros demostramos que la inflamación crónica que acontece tras la exposición repetida a la radiación ultravioleta (UV), en la que el binomio IL-6/s-PLA2-IIA desempeña un papel esencial23, podía mitigarse mediante el bloqueo terapéutico de IL-6 por un extracto del helecho Polypodium leucotomos24. Este bloqueo se manifestaba, entre otros hechos, por disminuciones in vivo de los mecanismos de neoangiogénesis y del número de mastocitos en la lesión inducida por la radiación ultravioleta24, así como por una menor incidencia de tumores cutáneos en los animales irradiados25. Hoy se sabe que las sPLA2-II desempeñan un papel importante en los mecanismos de inflamación y angiogénesis a través de la inducción del factor activador plaquetario, el cual facilita la producción del factor de crecimiento endotelial vascular26 (fig. 1).
Este suceso, a todas luces pernicioso en diversas enfermedades humanas relacionadas con una inflamación no desea da, como sucede en la mayoría de las enfermedades autoinmunitarias y en buena parte de los cánceres27, implica, por el contrario, la posible bondad del uso de las sPLA2-II en otros procesos relacionados con déficit en los mecanismos de neovascularización y/o de renovación tisular. De hecho, es sabido que los ácidos grasos liberados por las acciones de PLA2 son los responsables del matenimiento de la acidificación y de la integridad del estrato córneo cutáneo, lo que contribuye a mantener los mecanismos de defensa antimicrobianos en la piel28. Surge así, entonces, la eterna dicotomía sobre el ser y el estar que domina los principios de la homeostasis en biología27.
Además de su reconocida función enzimática, se sabe que algunas sPLA2 interaccionan con receptores específicos de membrana, que participan en sus actividades biológicas12. Hasta el momento se han identificado 2 tipos de receptores: N y M. Los receptores tipo N, que son profusamente expresados en el cerebro, pero que también están presentes en otros tejidos12,29-31, se unen con gran afinidad a diferentes sPLA2 de venenos, como es el caso del veneno de abeja30, lo que permitiría explicar sus acciones neurotóxicas. Los receptores de tipo M (180 kDa) se expresan en el pulmón, riñón e hígado, entre otros tejidos, y pertenecen a la superfamilia de lectinas tipo C12, que tienen un alto grado de homología con el receptor manosa expresado por los macrófagos32. Teniendo en cuenta que la unión a este receptor manosa provoca la activación fagocítica33 y la producción de citocinas inflamatorias34 en los macrófagos (fig. 1), algunos autores plantean35 que la activación de los macrófagos provocada tanto por sPLA2-IA de veneno de cobra (Naja mossambica mossambica) como por sPLA2-IIA humana se debe a su unión con estos receptores o receptores específicos tipo M, dejando abierta la posibilidad de que ambos fueran el mismo receptor, como así parece36.
En cualquier caso, la adición de ambas sPLA2 a cultivos de macrófagos pulmonares induce la producción de IL-6 y de ß-glucuronidasa sin provocar efectos tóxicos35. Dado el papel de la enzima lisosomal ß-glucuronidasa en la actividad bactericida y en los mecanismos de procesamiento antigénico de los macrófagos frente a patógenos intracelulares37 (fig. 1), se puede adelantar ya el posible papel de las sPLA2-II en los fenómenos de resistencia antimicrobiana y en los mecanismos de conexión entre la inmunidad innata y la adaptativa. Esta hipótesis se ve reforzada por el reconocido papel de la IL-6 en los mecanismos de activación linfocitaria B, que conducen a la síntesis de anticuerpos38. De la misma manera, teniendo en cuenta que la IL-6 induce la expresión y la producción de reactantes hepáticos de fase aguda38,39, incluida la propia sPLA2-II20-22, se entiende que se crea así un circuito de retroalimentación que permite mantener el proceso inflamatorio, al menos mientras persiste la agresión (sea o no infecciosa) al huésped (fig. 1).
Finalmente, el receptor M se ha implicado en gran parte de los efectos biológicos de las sPLA2, incluidos la emigración celular, la liberación de eicosanoides y el shock séptico40,41, habiéndose demostrado que este receptor es la diana fisiológica para los grupos IB y IIA de las sPLA2 en los mamíferos42. Todo ello indica que las acciones de las sPLA2-II no se deben a su mera acción catalítica sobre fosfolípidos de membrana y que, por tanto, existe una cierta especificidad en su comportamiento, especificidad que se define por la presencia de receptores adecuados en determinadas células. Con todo, aún más importante desde el punto de vista patogénico resulta el hecho de que la forma soluble de este receptor está involucrada en el aclaramiento plasmático de algunas sPLA2, lo que le hace comportarse como un potente inhibidor endógeno de éstas36. Surge así otra vez, por tanto, la dicotomía homeostática antes aludida, que no es sino un reflejo del comportamiento paradójico de cualquier molécula ante el defecto o el exceso.
sPLA2-II: ¿amigas o enemigas? Su papel en la resistencia antibacteriana
Según se ha dicho, para diversos autores las sPLA2-II son factores de mal pronóstico en la patogenia de algunos procesos inflamatorios y/o infecciosos4,15,16. El fundamento de esta idea reside en observaciones que demuestran que los valores séricos de sPLA2-II se encuentran aumentados en infecciones bacterianas43, en cuadros sépticos44-46 y en situaciones de fallo multiorgánico47. Sin embargo, nosotros pensamos, al igual que otros autores48, que estos hechos no parecen suficientes para explicar los papeles fisiológicos y fisiopatológicos de estas enzimas ante las infecciones.
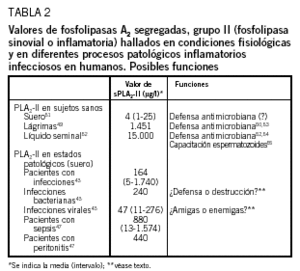
En lo que se refiere al papel fisiológico de las sPLA2-II, existen suficientes datos que demuestran la importancia biológica de estas enzimas en el mantenimiento de la homeostasis en diversos órganos, así como en la protección del huésped frente a las agresiones, fundamentalmente bacterianas, lo que hace plantear que las sPLA2-II son parte esencial en los mecanismos de inmunidad innata frente a determinados gérmenes patógenos48. Entre estos datos destacan los siguientes (tabla 2):
1. Gran parte de la actividad bactericida de las lágrimas se debe a su alto contenido en sPLA2-II49,50. De hecho, la concentración media de sPLA2 en las lágrimas (1.451 µg/l)49 es notablemente superior a la encontrada en el suero de sujetos sanos (4 µg/l)51, aunque definitivamente inferior a la presente en el líquido seminal (15.000 µg/l)52. Así pues, la presencia de sPLA2-II junto a otras proteínas antibacterianas como lisozima, lactoferrina, betalisinas, complemento e inmunoglobulina secretora53 parece asegurar la existencia de potentes mecanismos innatos de resistencia antiinfecciosa en el ojo.
2. Las sPLA2-II son producidas por las células epiteliales secretoras de la próstata y se encuentran, según se ha citado, en altas concentraciones en el líquido seminal52. De igual manera, las células del adenocarcinoma de próstata producen la enzima, pero no otros tumores del tracto genital masculino54. Esto viene a significar (tabla 2): a) su posible función microbicida en el líquido seminal, análoga a la descrita anteriormente para el ojo; b) que algunos tumores, los que expresan valores bajos de sPLA2-II, serían susceptibles de tratamiento con la enzima, y c) que la sPLA2-II no destruye los espermatozoides; todo lo contrario, las sPLA2-II desempeñan un papel primordial en los mecanismos destinados a su capacitación fecundadora55 (tabla 2).
3. Las PLA2 muestran importantes actividades catalíticas en fosfolípidos de membrana bacterianos, pero no ejercen efectos citotóxicos en macrófagos35, linfocitos T y células citolíticas56 o polimorfonucleares57, ni como hemos visto anteriormente en estructuras del ojo o del aparato genital masculino, lo que claramente apunta a la incapacidad de las sPLA 2-II para, en condiciones fisiológicas, agredir al yo (tabla 3). Redundando en este hecho sobre la ausencia de autoagresión provocado por las sPLA2, otros autores no hallan relación entre los valores de sPLA2-II y los acontecimientos adversos sistémicos que tienen lugar tras la administración de endotoxina a voluntarios sanos58. De esta manera, el estudio cinético en humanos tras la inoculación de lipopolisacárido bacteriano demuestra que las alteraciones de pulso, de la presión sanguínea, de la temperatura y de otros síntomas relacionados con la endotoxemia no están relacionados con los valores plasmáticos de sPLA2-II (tabla 3). Más aún, estos efectos sí están relacionados con la producción temprana de TNF-*. Igualmente, los valores de sPLA2-II alcanzan su cenit a las 24 h58, cuando los síntomas han desaparecido, lo que recuerda más a un proceso compensatorio que a una implicación patogénica directa.
4. Los ratones C57BL/6J, que son deficientes naturales en sPLA2-II, manifiestan una exquisita sensibilidad a la infección por Staphylococcus aureus, en tanto que los ratones a los que se ha incluido el gen de la sPLA2-II (transgénicos para sPLA2-II) ven incrementada su resistencia frente al mismo germen (tabla 3), así como la actividad catalítica de sPLA2-II en suero48. Curiosamente, estos animales transgénicos desarrollan un cuadro de alopecia, hiperplasia epidérmica e hiperplasia de los anejos cutáneos, aunque sin signos clínicos de inflamación60 (tabla 3). Desde el punto de vista clínico, resulta más importante que la inhibición en la producción de sPLA2-II a cargo de las células de determinados tumores aparece como la responsable de la predisposición de los enfermos con cáncer avanzado a las infecciones graves59 (tabla 3).
Además de éstas, otras situaciones patogénicas apuntan al papel positivo de las sPLA2-II en los mecanismos de resistencia antiinfecciosa del huésped, lo que permite pensar en un hipotético papel terapéutico de algunas PLA2. De esta manera, se sabe que los pacientes con infecciones graves (peritonitis y septicemia) muestran valores significativamente más elevados de sPLA2-II que los pacientes con cuadros inflamatorios sin infección (tabla 2), lo que, además de servir de método diagnóstico47, parece implicar que la secreción endógena de sPLA2-II resulta en un intento, algunas veces vano, por eliminar a los agentes infecciosos. Igualmente, en los pacientes con quemaduras extensas, los valores de PLA2 no aumentan sino cuando aparece la infección61. Este último hecho tiene especial importancia para explicar que el exceso en la producción endógena de sPLA2-II no se desencadena por motivos propios del huésped, sino por sustancias ajenas a éste que están presentes en los gérmenes agresores, posiblemente lipopolisacáridos bacterianos de membrana. En este sentido, hay que destacar la reconocida habilidad de los lipopolisacáridos para inducir la producción endógena de las citocinas proinflamatorias IL-1, IL-6 y TNF-*, entre otras62,63, las cuales, a su vez, provocarían la secreción hepática de sPLA2-II20-22, además de otros conocidos reactantes de fase aguda, como la proteí na C reactiva39 (fig. 1).
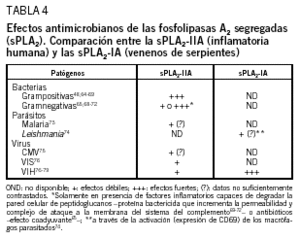
Este hipotético papel antimicrobiano de las sPLA2-II se ha confirmado en diferentes experiencias (tabla 4). Así, la sPLA2-II presente en los fluidos inflamatorios posee una potente actividad bactericida frente a bacterias grampositivas64, efecto que está relacionado con la capacidad de PLA2 para unirse a los sitios de crecimiento presentes en la membrana de las bacterias65. Igualmente, los mismos investigadores demuestran los efectos aditivos de sPLA2-II a los antibióticos betalactámicos utilizados a dosis subinhibitorias, lo que las implicaría como adyuvantes a los efectos de los antibióticos y posiblemente impediría la aparición de resistencias65. Otros autores redundan en este hecho al demostrar in vitro66 e in vivo48, el poder bactericida de la sPLA2-II frente a S. aureus, mientras que otros estudios demuestran la habilidad de diferentes sPLA2, fundamentalmente la sPLA2-II, para ejercer acciones líticas in vitro sobre Listeria monocytogenes, S. aureus y Escherichia coli67. Finalmente, una serie de elegantes experimentos en babuinos demuestran que el suero de los animales infectados con E. coli posee una importante actividad bactericida frente a S. aureus, Streptococcus pyogenes y E. coli encapsulado, y que esta acción se debe a la sPLA2-II. De hecho, esta actividad bactericida es bloqueada por anticuerpos monoclonales dirigidos contra la sPLA2-II humana y nuevamente resturada tras la adición de sPLA2-II68.
En resumen, algunas sPLA2-II participan activamente en el mantenimiento de la homeostasis de ciertos órganos, fundamentalmente a través de su implicación en los mecanismos de inmunidad innata antiinfecciosa. Sin embargo, es preciso aclarar que la actividad innata antiinfecciosa desplegada por las sPLA2-II no es universal y, por lo tanto, no está dirigida contra todos los gérmenes conocidos: bacterias, virus, hongos y parásitos (tabla 4). Incluso dentro de su actividad antibacteriana, las sPLA2-II muestran signos de cierta selectividad de actuación. Así, las acciones efectoras frente a bacterias grampositivas son ejercidas fundamental y directamente por las sPLA2-II, ya provenga ésta de fluidos inflamatorios intravasculares (suero)68 o extravasculares (líquido ascítico)64,69, si bien otros factores plasmáticos pueden potenciar sus acciones frente a este tipo de bacterias. Por el contrario, las sPLA2-II no tienen por sí solas efectos germicidas frente a bacterias gramnegativas (tabla 4). La falta de actividad de las sPLA2-II frente a bacterias gramnegativas y frente a algunos tipos de grampositivas se debe a su incapacidad para atravesar su pared celular, que está compuesta por una intrincada red laminar de peptidoglucanos que protege a los fosfolípidos de su membrana celular65. No obstante, si esta pared es destruida por otros factores plasmáticos del huésped, generados en el curso de la reacción inflamatoria frente a la infección, las sPLA2-II pueden realizar, incluso a concentraciones bajas, sus actividades germicidas frente a este tipo de bacterias65,68-70. Entre estos factores endógenos inflamatorios capaces de degradar la pared celular de las bacterias gramnegativas destacan (tabla 4) la proteína bactericida que incrementa la permeabilidad y el complejo de ataque a la membrana perteneciente al sistema del complemento69-72. Es interesante resaltar que estos mismos efectos bactericidas sobre bacterias gramnegativas y grampositivas pueden conseguirse cuando las sPLA2-II se utilizan como tratamiento adyuvante a ciertos antibióticos65, lo que sin duda abre la oportunidad a nuevas acciones terapéuticas antiinfecciosas.
Para finalizar, algunos autores han demostrado la participación de la sPLA2-II en infecciones por hongos65 y en enfermos de malaria73, lo que indica que estas enzimas también están implicadas en la patogenia o en la resistencia frente a determinadas infecciones fúngicas y parasitarias. Considerando que las sPLA2-II inducen la producción endógena de la enzima lisosomal ß-glucuronidasa en los macrófagos35, y que ésta es la causante de la degradación de algunos parásitos intracelulares37, se entiende la implicación de las sPLA2-II en los mecanismos de resistencia innata antiinfecciosa, así como su posible papel terapéutico en algunas infecciones provocadas por estos gérmenes (fig. 1).
Resumiendo este apartado de actividades antibacterianas, parece claro que algunas de las sPLA2 hasta ahora conocidas, ya sean de mamíferos (sPLA2-IIA) o de algunos venenos de animales (sPLA2-IA), cuyo comportamiento bactericida es análogo, parecen mostrar claros efectos germicidas sobre bacterias, hongos y parásitos. Mientras algunos de estos efectos parecen ser directamente mediados por las acciones catalíticas de estas sPLA2 sobre las membranas celulares de los agentes patógenos, otros parecen deberse a su unión a receptores específicos presentes en las membranas de las células diana. En cualquiera de los casos, la participación de mecanismos pertenecientes a la inmunidad innata parece tener un papel primordial.
sPLA2 y resistencia antiviral ¿un papel frente al VIH?
En lo que se refiere a las posibles actividades antivirales de las sPLA2-II, lo primero que hay que destacar es que, contrariamente a lo que sucede en pacientes con sepsis o en pacientes con infecciones bacterianas no sépticas, las sPLA2-II se encuentran muy poco elevadas en pacientes con infecciones virales, si bien sus valores en suero son superiores a los hallados en sujetos sanos43 (tabla 2), tal como sucede con el citomegalovirus humano75. Dados estos bajos valores séricos de sPLA2-II, parece entonces claro que, como hemos señalado algunos de nosotros, la mayoría de las infecciones virales crónicas se caracterizan en los huéspedes infectados por situaciones de silencio inflamatorio27 o por fenómenos de caos inmunológico inducido por los propios virus80,81, lo que los hace inaccesibles al conocimiento inmunológico y, por ende, a su destrucción por el mismo. Esto supone que, a pesar de que algunos productos (lisofosfatidilcolina) derivados de las acciones de las sPLA2-II de mamíferos puedan interferir in vitro con la replicación del virus de la inmunodeficiencia en simios y del VIH, a través de la inhibición de los procesos de fusión celular77,78, la insuficiente producción in vivo de sPLA2-II anula esta posibilidad de resistencia antiviral, aunque hace pensar en la participación de algunas sPLA2-II en estos mecanismos de defensa antiviral (tabla 4).
Sin embargo, las recientes observaciones sobre las actividades inhibidoras in vitro de ciertas sPLA2 obtenidas del veneno de animales sobre el VIH resultan especialmente llamativas (tabla 5). Así, algunos autores demuestran que solamente 4 de 11 sPLA2 analizadas parecen proteger a diversas líneas celulares humanas de la replicación del VIH-178. Curiosamente, las 4 sPLA2 activas frente al VIH-1 proceden de venenos de animales y pertenecen todas al grupo sPLA2-IA, sin que la porcina pancreática (grupo IB) y las humanas recombinantes pancreática (grupo IB) e inflamatorias (grupo IIA) manifiesten efectos anti-VIH78. Estas 4 sPLA2 son las obtenidas de veneno de abeja y de la cobra Naja mossambica mossambica, la taipoxina de la serpiente Oxyuranus scutellatus y la nigexina de la cobra Naja nigricollis. A estas 4 hay que añadir la crotoxina aislada de la serpiente Crotalus durissus terrificus (sPLA2-Cdt), cuya actividad anti-VIH ha analizado nuestro grupo79. De estos estudios se deduce una serie de hechos fundamentales para entender la actividad biológica de las sPLA2:
1. Como se ha dicho anteriormente para el caso de las infecciones bacterianas, las sPLA2 manifiestan una cierta selectividad en sus acciones y no todas las sPLA2 tienen, por tanto, actividad frente al VIH. Esta diversidad de actuación de las diferentes sPLA2 viene también definida por otro hecho clave: el estudio con anticuerpos monoclonales dirigidos frente a la sPLA2-II humana demuestra que no existen reacciones cruzadas con la sPLA2 pancreática humana ni con la sPLA2-Cdt82. Más aún, las sPLA2-II de mamíferos no interfieren con las actividades anti-VIH provocadas por las sPLA2 obtenidas de insectos y serpientes78. Esto confirma que la sPLA2-Cdt es única en sus actividades biológicas (tabla 5).
2. Aunque la cubierta del VIH está compuesta principalmente por glicerofosfolípidos83, principales sustratos, como se sabe, para las sPLA2, sus actividades anti-VIH no se deben a sus efectos catalíticos sobre los lípidos de la membrana del virus, y sí a su interacción sobre receptores específicos presentes en la membrana del VIH78. De hecho, algunas fosfolipasas sin actividad catalítica, como es el caso de la Ba IV obtenida del veneno de la serpiente Bothrops asper84, poseen débiles efectos anti-VIH78. Además, las acciones anti-VIH de las sPLA2-II no se deben a efectos citotóxicos sobre las células infectadas, como lo demuestran los estudios de viabilidad celular tras la incubación con las mismas78,79 (tabla 5).
De estos resultados se deduce que las sPLA2 con actividad anti-VIH utilizan receptores específicos para realizar sus efectos. De acuerdo con algunos autores, estos receptores parecen ser del tipo N78, los cuales, como ya se ha visto, se expresan en numerosos tejidos y células, incluidas las inmunológicas12,29-32. Sin embargo, existe otra serie de hechos que indican que los efectos anti-VIH ejercidos por algunas sPLA2 de venenos se deben a otros procesos diferentes de la unión a receptores N.
3. De esta manera, en lo que concierne al mecanismo íntimo de acción, algunos ensayos demuestran que las sPLA2-IA actúan después de la fusión del virus a las células del huésped, pero antes de la liberación del complejo de transcripción inversa viral77. Así, se sabe que las sPLA2 activas frente a VIH no interfieren con la unión CD4/gp120 ni con la formación de sincitios celulares, y que, a pesar de ello, se muestran como potentes inhibidores de la entrada del virus a las células78. Estos últimos efectos, evaluados mediante la detección intracitosólica de la proteína Gag p2478,85, son similares a los obtenidos con la quimiocina SDF-1, la cual bloquea la unión virus/célula tras interaccionar con el receptor CXCR486. En suma, los efectos anti-VIH de algunas sPLA2 parecen deberse a su capacidad para prevenir la disociación del CTI del virión en la membrana de las células infectadas, lo cual impide que este complejo alcance el núcleo celular. No obstante, se desconocen los acontecimientos que suceden desde que las sPLA2 se ligan al receptor N con el fin de impedir la disociación del CTI78.
Desde nuestro punto de vista, sin embargo, los efectos anti-VIH de las sPLA2 tienen mucho que ver con los procesos de fusión del virus a la membrana de la célula del huésped. En efecto, según se sabe (fig. 2), la infección por el VIH-1 se inicia por la interacción del complejo gp120/gp41 de la cubierta del virus con al menos 2 receptores de la célula huésped: el receptor CD487,88 y un miembro de la familia de receptores para quimiocinas89-92. Tras esta unión, el complejo gp120/gp41 sufre una serie de cambios conformacionales que conducen a la fusión de la membrana viral con la membrana de la célula huésped93-95. Una vez realizada la fusión, se produce la liberación del CTI, el cual emigra hasta el núcleo celular96 y aporta toda la información necesaria para iniciar la síntesis de ADN proviral tras su integración en el ADN del huésped97-100.
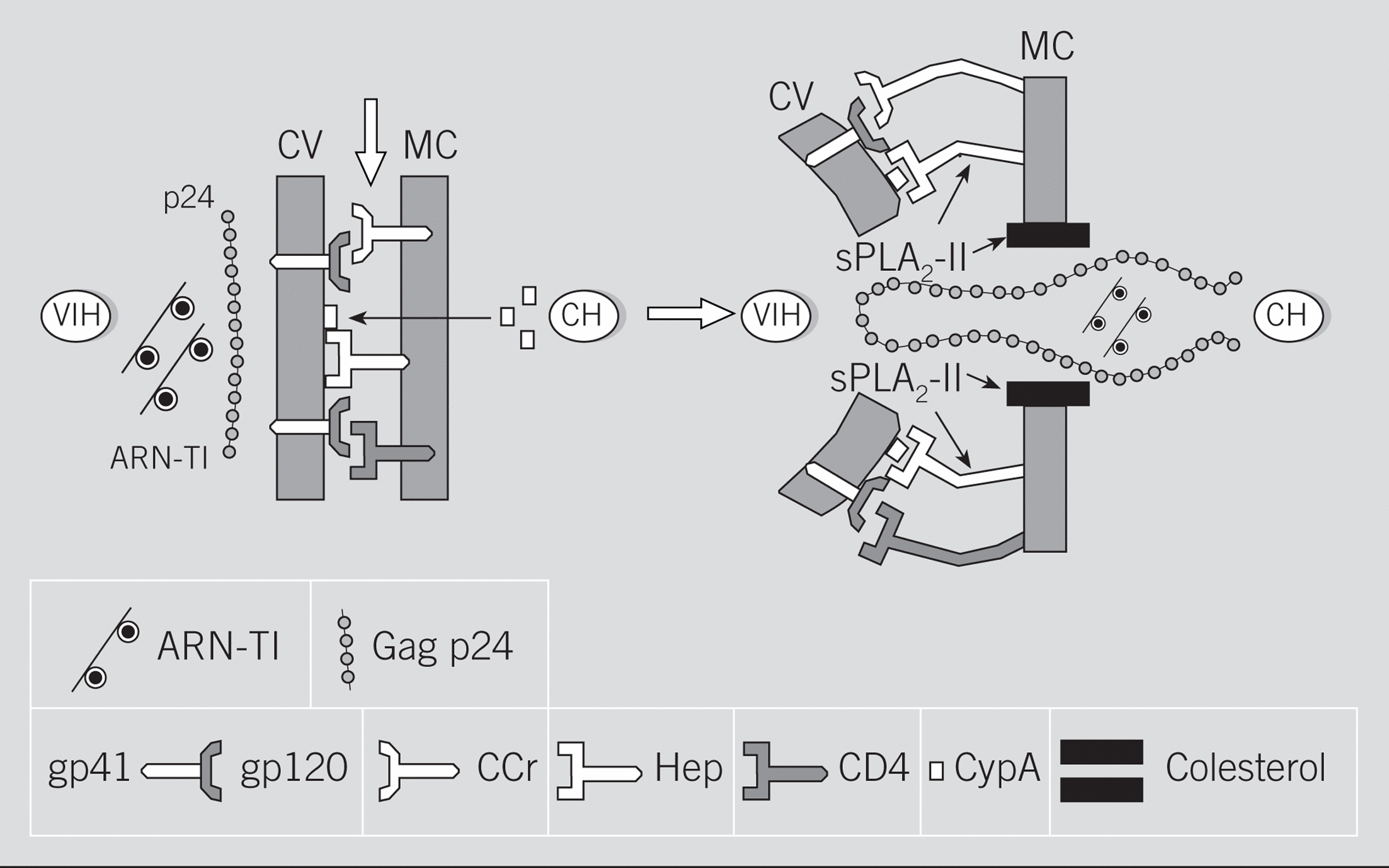
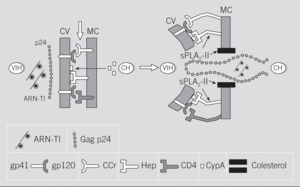
Fig. 2. Mecanismos implicados en los procesos de interacción y fusión entre el virus de la inmunodeficiencia humana (VIH) y la célula huésped (CH). Posibles efectos de la fosfolipasa A2 de Crotalus durissus terrificu s(sPLA2-Cdt). ARN: ácido ribonucleico; TI: transcriptasa inversa; p24: proteína Gag p24 del core; CV: cubierta del virión; MC: membrana celular; gp: glucoproteínas de la CV; CCr: receptor de quimiocinas; Hep: receptor heparanos; CD4: molécula CD4; CypA: ciclofilina A. Las flechas señalan los sitios de acción de las sPLA2.
Las bases moleculares del tropismo específico del VIH-1 residen en la habilidad de la gp120 para interaccionar con un receptor de la familia de quimiocinas89-95. Así, las cepas de VIH-1 que muestran tropismo por los macrófagos se replican en ellos y en células T CD4+ a través de la unión al receptor CCR5: son los denominados virus R5. Por el contrario, las cepas que muestran tropismo por linfocitos T se replican en linfocitos T CD4+ a través del receptor de quimiocinas CXCR4: son los virus X4. Normalmente, los virus R5 no inducen la formación de sincitios celulares, mientras que los virus X4 sí lo hacen96.
La importancia patogénica y terapéutica de los receptores para quimiocinas viene demostrada por suficientes datos, que evidencian cómo el uso de derivados de quimiocinas CC o CXC86,89,91,101 o de pequeñas moléculas que se unen a diferentes correceptores102,103 se comportan como inhibidores del VIH. A pesar de ello, el único tratamiento actualmente aceptado consiste en el uso de diferentes combinaciones de agentes antivirales que, eso sí, han conducido a importantes resultados clínicos104-106, aun a costa de efectos secundarios nada desdeñables.
Estos datos sobre los procesos de fusión celular, unidos a los proporcionados por los efectos secundarios provocados por los tratamientos antirretrovirales, permiten plantear los posibles mecanismos por los cuales algunas sPLA2 podrían ejercer sus acciones anti-VIH (fig. 2). En efecto, los nuevos avances sobre la fisiopatología de la infección por el VIH-1 han puesto en evidencia que, además de los receptores citados anteriormente, algunas sustancias, tales como el colesterol, funcionan como receptores para la proteína Gag p24 del virus107,108. De hecho, como se ha demostrado recientemente, la destrucción del colesterol de la membrana de la célula huésped por ciclodextrinas o por algunas estatinas evita la formación de sincitios celulares, así como la infección in vitro tanto por virus R4 como por virus R5107,108. Pues bien, teniendo en cuenta que las sPLA2 manifiestan una especial apetencia por el colesterol109, donde realizan funciones biológicas tan importantes como la ya citada capacitación de los espermatozoides55, se ha planteado que parte de la actividad anti-VIH que posee la sPLA2-Cdt podría deberse a su capacidad para alterar o bloquear estos receptores de colesterol79. El papel del colesterol en la infección por el VIH es evidente cuando se observa que los modernos tratamientos antirretrovirales se acompañan de sustanciales incrementos plasmáticos del colesterol y de los triglicéridos, no relacionados con la ingesta, en los pacientes eficazmente tratados110; es decir, en aquellos que remontan la cifra sanguínea de linfocitos CD4 y que disminuyen significativamente la carga viral110. Finalmente, otras 2 recientes revisiones de la bibliografía vuelven a incidir sobre el papel de los microdominios de membrana ricos en colesterol (lipid rafts) como puerta de entrada para el VIH111,112, así como para otros virus (gripe y sarampión), priones o toxinas (colérica)111.
Otro aspecto que se debe considerar en la infección por el VIH, así como en el hipotético papel que desempeñan las sPLA2, tiene que ver con la función desplegada por la ciclofilina A (CypA). En efecto, se sabe que la CypA una proteína isomerasa del huésped, cuando está presente en la cubierta del VIH-1, favorece su disociación del CTI, lo que le permite alcanzar el núcleo celular113,114. Más recientemente, otros autores demuestran que la CypA favorece la unión del VIH-1 a las células del huésped, gracias a su capacidad para fijarse a heparanos a través de dominios ricos en residuos básicos similares a los motivos que ligan la heparina (fig. 2); una vez producido este anclaje, tendría lugar la fusión gp120/CD4115-117. Teniendo en cuenta la especial apetencia de las sPLA2 por los heparanos118,119, se entiende que estas enzimas podrían interferir en la unión del VIH con la membrana de la célula del huésped (fig. 2).
Resumiendo este apartado, hay que resaltar que contrariamente a lo que ocurría con las actividades antibacterianas (tabla 4), y a pesar de la más que posible participación de las sPLA2-IIA en la patogenia de algunas enfermedades virales43,75, ninguna de las sPLA2-II de origen humano hasta ahora analizadas muestra actividades directas frente al VIH78. Por el contrario, determinadas sPLA2 aisladas de los venenos de animales, como las de las abejas, las serpientes Naja mossambica mossambica, Naja nigricollis, Bothrops asper78 y Crotalus durissus terrificus79, ejercen potentes actividades anti-VIH (tabla 5). Algunas de ellas, como sucede con la sPLA2-Cdt, poseen incluso efectos terapéuticos frente a tumores epiteliales humanos en los que se sospecha una posible etiología viral27,120,121, lo que, unido a su ausencia de reacciones cruzadas con otras sPLA282 y a su moderada toxicidad en humanos122, hace de esta PLA2 una promesa terapéutica en el campo antiinfeccioso. Según hemos señalado, los mecanismos por los cuales algunas sPLA2 de venenos animales se comportarían como inhibidores de la replicación del VIH se deberían a su capacidad para fijarse al colesterol y a heparanos de las membranas celulares del huésped, lo que impediría la fijación de la proteína Gag del virus VIH79 (fig. 2).
Conclusiones
Los hechos analizados en este artículo permiten plantear que: a) las sPLA2-II humanas cumplen un papel esencial en los mecanismos de resistencia endógena antibacteriana y que solamente el exceso en su producción y movilización sérica, provocado por un descarrilamiento inmunológico en el que están involucradas citocinas (IL-6 y TNF-*) y factores (complemento, proteína C reactiva) inflamatorios, provoca la aparición de enfermedades asociadas: las sPLA2 son, pues, amigas y enemigas dependiendo de su concentración plasmática; b) su elevada concentración, sin producción de daño tisular, en sitios aparentemente privilegiados (ojo y testículo) parece estar relacionada no solamente con fenómenos de resistencia antiinfecciosa, sino con procesos de mantenimiento y remodelación tisulares en estos órganos; la habilidad de la sPLA2-II para inducir fenómenos de angiogénesis así lo confirma26 (fig. 1); c) además de sus efectos catalíticos directos sobre las membranas celulares de los agentes patógenos, las sPLA2 humanas intervienen regulando determinados mecanismos pertenecientes a la inmunidad innata, tales como la activación de los macrófagos y de las células citolíticas123,124; d) algunas sPLA2 obtenidas de venenos de abejas y serpientes, entre ellas la sPLA2-Cdt, ejercen potentes efectos in vitro frente al VIH. Estos efectos no se deben a acciones catalíticas ni tóxicas sobre la cápsula del VIH, y sí al posible bloqueo de receptores de heparanos y de colesterol presentes en la célula huésped; e) además de sus acciones anti-VIH, la sPLA2-Cdt ejerce efectos inmunomoduladores que potencian la activación de células citolíticas y linfocitos T efectores56; y f) teniendo en cuenta el grado de toxicidad (leve a moderado) exhibido por la sPLA2-Cdt en humanos120-122, se entiende que esta fosfolipasa pudiera tener especiales indicaciones terapéuticas en el campo de las enfermedades infecciosas, fundamentalmente antivirales, y en el tratamiento de algunos tumores de posible etiología viral.
Finalmente, la importancia que pueden llegar a tener algunas sPLA2 de origen animal en la prevención y/o tratamiento antiinfeccioso viene demostrada por que la inserción en los mosquitos Anopheles del gen que codifica la PLA2 del veneno de abeja es capaz de reducir en un 87% la formación de oocistos de Plasmodium berghei e impedir la transmisión del parásito a ratones vírgenes125.