El valor de los polimorfismos PON1-Q192R, CYP2C19*2 y *17 en la identificación del paciente pobre respondedor a clopidogrel es controvertido. Evaluamos la relación de los polimorfismos señalados con la reactividad plaquetar y el pronóstico a medio plazo en pacientes con síndrome coronario agudo remitidos para cateterismo cardíaco.
Pacientes y métodoSe incluyeron prospectivamente 247 pacientes con síndrome coronario agudo. En todos se dispuso del genotipo (CYP2C19*2, CYP2C19*17, PON1-Q192R). Medimos la reactividad plaquetar con VerifyNow®. Se registraron episodios adversos intrahospitalarios (muerte, infarto periprocedimiento) y durante el seguimiento (muerte, infarto de miocardio, angina, accidente cerebrovascular, trombosis del stent).
ResultadosLos portadores de alelos *2 de CYP2C19 presentaron una mayor reactividad plaquetar residual (PRU, media [DE] de 252 [76] frente a 287 [74], p=0,002). Los portadores de alelos *17 de CYP2C19*17 o de alelos T(Q) de PON1-Q192R no presentaron una reactividad distinta (p>0,05). En un modelo multivariado para la predicción de pobre respuesta a clopidogrel, la contribución de CYP2C19*2 fue modesta (Wald=7,5; odds ratio [OR] para≥1 alelo *2=2.786, intervalo de confianza del 95% [IC 95%] 1.337-5.808). Fueron factores protectores independientes la hemoglobina basal (OR 0,666, IC 95% 0,555-0,801) y el uso concomitante de estatinas (OR 0,376, IC 95% 0,162-0,873). El índice de masa corporal fue un factor de riesgo (OR 1.074, IC 95% 1.005-1.148). Los polimorfismos estudiados no predijeron episodios adversos.
ConclusionesEl polimorfismo de CYP2C19*2 influyó en la respuesta a clopidogrel de forma modesta, pero no condicionó un pronóstico distinto en pacientes con síndrome coronario agudo. Los polimorfismos de PON1-Q192R y CYP2C19*17 no influyeron en la reactividad plaquetar ni el pronóstico.
Previous studies have shown that the metabolism of P2Y12 receptor blockers is influenced not only by CYP2C19*2 but also by PON1-Q192R alelles. We aimed to evaluate the impact of CYP2C19*2 and PON1-Q192R polymorphisms carriage in platelet reactivity and clinical outcome in patients with ischemic heart disease undergoing cardiac catheterization.
Patients and methodWe recruited prospectively patients with acute coronary syndrome undergoing cardiac catheterization (n=247). We evaluated the genotype (CYP2C19*2, CYP2C19*17, PON1-Q192R) with TaqMan® assay and platelet aggregometry in all patients. We assessed both in and out-of-hospital events (unstable angina, periprocedural and spontaneous myocardial infarction, myocardial infarction, all-cause death, stent thrombosis and stroke) during follow-up.
ResultsCarriers of CYP2C19*2 alleles showed a significant higher residual platelet reactivity (PRU, mean [SD], 252 [76] vs. 287 [74], P=.002). Carriers of PON1-Q192R CT(RQ) and TT(QQ) alleles and CYP2C19*17 did not present a different response to clopidogrel. In a multivariable setting for the prediction of platelet reactivity, the contribution of CYP2C19*2 was modest (Wald=7.5; odds ratio [OR] for≥1 alelle *2=2,786, 95% confidence interval [95% CI] 1,337-5,808). Independent predictors were baseline hemoglobin levels (g/dL, OR .666, 95% CI .555-.801) and the use of statins (OR .376, 95% CI .162-.873). Body mass index was a risk factor (OR 1,074, CI 95% 1,005-1,148). Studied polymorphisms did not predict an adverse outcome.
ConclusionsCYP2C19*2 polymorphism influenced moderately platelet reactivity but did not show an impact on clinical outcome in patients with acute coronary syndrome. Neither CYP2C19*17 nor PON1-Q192R polymorphisms showed an impact upon platelet reactivity or outcome.
Aproximadamente una de cada 4 prescripciones farmacológicas puede estar condicionada por polimorfismos genéticos1. Estas variantes genéticas pueden afectar a la seguridad y eficacia de los fármacos, sin embargo, su aplicación es actualmente limitada en la práctica diaria2. El clopidogrel es un fármaco extensamente estudiado desde el punto de vista farmacogenético y que experimenta una transformación en 2 pasos que tienen lugar en el hígado antes de ejercer una inhibición irreversible sobre el receptor plaquetario del adenosindifosfato (ADP) P2Y123. En esta biotransformación las isoenzimas del grupo P450, como la familia CYP2C19, desempeñan un papel principal4; la presencia de alelos de pérdida de función (*2) del CYP2C19 se asocia con una respuesta atenuada a clopidogrel4–8 y, contrariamente, la presencia de alelos de ganancia de función (*17) puede conllevar un mayor efecto del mismo9. Se ha sugerido que la paroxonasa 1 (PON-1) podría influir también en el metabolismo de clopidogrel10. Sin embargo, el problema de la variabilidad interindividual del efecto de clopidogrel es probablemente complejo, todavía incompleto y precisa de una mayor investigación. En esta línea, estudios indican que, en su conjunto, la dieta, la medicación concomitante, el tabaquismo, la ingesta de alcohol, la adherencia terapéutica, factores demográficos y una batería de polimorfismos genéticos (entre los que se incluyen a CYP2C19 y PON-1) solo justificarían una parte pequeña de dicha variabilidad interindividual8, lo que se ha cuantificado en un 18%11.
En un contexto pronóstico, si la medición de la elevada reactividad plaquetar a pesar de tratamiento con clopidogrel12–14 y/o la detección de polimorfismos implicados en el metabolismo de clopidogrel15–17 son útiles para predecir el futuro de nuestros pacientes sigue sin estar totalmente esclarecido, ya que los resultados de los estudios son contradictorios12–17.
En pacientes sometidos a intervencionismo coronario, estudios previos18,19 han descrito una asociación entre la elevada reactividad plaquetar y la aparición de infarto de miocardio (IM) periprocedimiento, a pesar de tratarse de un episodio multifactorial, como es sabido20. Se desconoce si la presencia de polimorfismos relacionados con el metabolismo de clopidogrel puede tener un valor a este respecto.
Nos propusimos, en nuestro estudio, definir el perfil del paciente pobre respondedor a clopidogrel, así como el valor comparativo de los polimorfismos PON1-Q192R, CYP2C19*2 y CYP2C19*17 respecto a variables clínicas, en pacientes con síndrome coronario agudo (SCA) remitidos para cateterismo cardíaco. Pretendimos, además, como objetivo adicional, estudiar las implicaciones en el pronóstico de los citados polimorfismos.
Pacientes y métodoPacientesDesde junio a diciembre de 2011 se reclutaron de forma prospectiva y consecutiva los pacientes con diagnóstico de SCA, definido como dolor torácico típico y elevación de marcadores de necrosis miocárdica o alteraciones de la onda T/segmento ST sugestivas de isquemia, y que estuvieran recibiendo clopidogrel≥4h desde la dosis de carga de 300 o 600mg. En los pacientes en los que no se constató que hubieran recibido dosis de carga de clopidogrel se exigió al menos 24h desde la primera dosis.
Los criterios de exclusión fueron la presencia de valvulopatías o miocardiopatías significativas (n=47), las enfermedades concomitantes con esperanza de vida<1 año (n=37), aquellos pacientes que no firmaron el consentimiento informado (n=10) y los que fueron tratados con inhibidores intravenosos del receptor iib-iiia de la plaqueta (n=57). El estudio fue aprobado por el Comité Ético local de nuestro centro y cumple con la Declaración de Helsinki de 1975 y sus actualizaciones posteriores.
Evaluación de la reactividad plaquetar con VerifyNow® (Accumetrics, San Diego, Estados Unidos)Se extrajeron 15cc de sangre periférica del introductor arterial antes del uso de anticoagulantes en la sala de hemodinámica. Se rellenaron 2 tubos de citrato sódico 3,2% (Vacuette®) y se esperó un tiempo entre 15 y 30min antes de la determinación, según las instrucciones del fabricante.
El analizador VerifyNow® obtuvo lo siguiente para cada paciente (no proporcionado al cardiólogo responsable):
- 1.
«Platelet reactivity units (PRU) base» (P2Y12 reactivity units): estimación de la reactividad plaquetar (basal) por agonistas del receptor de la trombina.
- 2.
«PRU»: reactividad plaquetar por agonistas del ADP.
- 3.
«Porcentaje de inhibición»: (PRU-PRUbase) /PRUbase×100.
Para la definición del paciente pobre respondedor se empleó el punto de corte especificado por el fabricante y avalado por expertos en documentos de consenso (235 PRU)21.
Extracción de ácido desoxirribonucleico y genotipadoObtuvimos muestras de sangre periférica del introductor arterial en tubos con EDTA y el ADN se extrajo mediante QIAamp® DNA Mini Kit y el extractor automático de ácidos nucleicos QiaCube® (Qiagen, Hilden, Alemania). Los alelos del CYP2C19*2 (rs4244285), *17 (rs12248560) y PON1-Q192R (rs662) se determinaron en todos los pacientes mediante discriminación alélica del correspondiente polimorfismo de nucleótido simple22 por medio de sondas Drug-Metabolizing TaqMan® y TaqMan® GTXpress Master Mix, aportados por Applied Biosystems (Foster City, CA, EE. UU.).
Análisis estadísticoEl análisis univariado se realizó mediante test t de Student o Mann-Whitney. Para variables categóricas se empleó el test ji al cuadrado. Se realizó un modelo de regresión logística binaria (método Backward Wald) para identificar aquellas variables predictoras de «pobre respuesta a clopidogrel» (PRU>235). Fueron covariables aquellas que hubieran demostrado asociación en el univariado (p<0,05) o en estudios previos. Se presenta la odds ratio (OR) y su intervalo de confianza del 95% (IC 95%). La calibración del modelo se calculó con Hosmer-Lemeshow, y la discriminación, con el estudio del estadístico C. Los IC fueron calculados mediante remuestreo (bootstrapping) con 2.000 replicaciones. La importancia de cada variable dentro del modelo multivariado se evaluó mediante el estadístico de Wald.
Para el análisis de supervivencia se empleó el método de Kaplan-Meier y el test de Mantel-Haenszel. El modelo de regresión de Cox (método introducir) se utilizó para estudiar los predictores de episodios adversos y evaluar la asociación ajustada entre los polimorfismos y un desenlace adverso. Se calculó la hazard ratio (HR) no ajustada considerando cada polimorfismo como variable independiente, y se consideró elegible (confusora) aquella/s variable/s que condicionaran una variación del HR≥20% respecto de la estimación univariada23. La/s variable/s que cumplieran este criterio se fueron incorporando al modelo. Se testaron interacciones de primer grado en modelos multivariables jerárquicos. Los IC fueron calculados mediante remuestreo (bootstrapping) con 2.000 replicaciones. La asunción de proporcionalidad de riesgos del modelo se comprobó mediante el test de residuos de Schöenfeld. Se empleó STATA® 11 (StataCorp. 2009, College Station TX, EE. UU.) y SPSS® v20.0 (IBM, Nueva York, EE. UU.).
Seguimiento intrahospitalario y extrahospitalarioSe registraron los siguientes episodios intrahospitalarios: IM periangioplastia coronaria percutánea (ACTP) y mortalidad hospitalaria. Con el propósito de este estudio definimos IM peri-ACTP como la elevación de troponina I y/o isoforma MB de la creatincinasa≥3veces respecto del nivel de referencia en nuestro medio si los valores eran normales previamente, o cualquier reelevación (si ya eran elevados) sobre los valores previos tras el procedimiento intervencionista20. Con esta finalidad, y como es práctica en nuestro centro, se determinaron la troponina I y la isoforma MB de la creatincinasa en 3 ocasiones dentro de las primeras 24h tras el procedimiento.
Durante el seguimiento la variable principal fue el combinado de angina inestable (que requiriera ingreso), IM no fatal, muerte por cualquier causa, accidente cerebrovascular (ACV) y trombosis de stent (confirmada angiográficamente). El seguimiento se realizó telefónicamente y a través de las visitas rutinarias en consultas externas. Se obtuvieron datos de seguimiento en la totalidad de los pacientes.
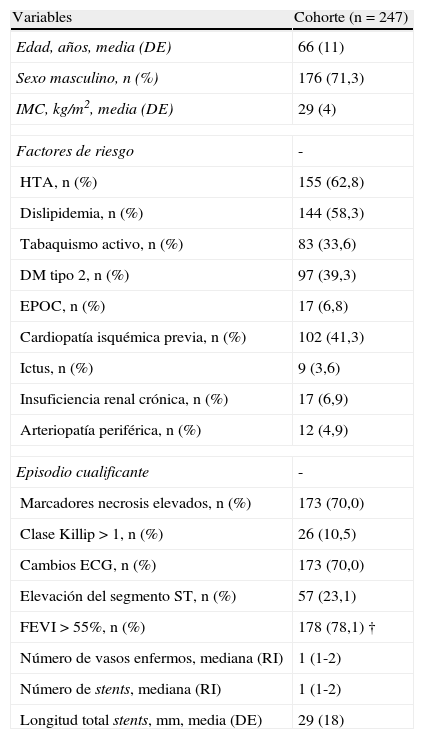
ResultadosCaracterísticas basales y pauta de clopidogrelEn la tabla 1 se presentan las características basales de los pacientes incluidos en el estudio. La edad media (DE) fue de 66 (11) años, siendo el 71,3% varones. En su gran mayoría se trató de pacientes con SCA sin elevación del segmento ST (176, 71,3%), y un 70,0% elevaron marcadores de necrosis miocárdica. El segundo diagnóstico más frecuente fue el de SCA con elevación persistente del ST (57, 23,1%). A los pacientes que se reclutaron en nuestro estudio se les suministró dosis de carga de clopidogrel en el 69,2% de los casos, siendo la dosis de 300mg la más frecuente (90,6%). La gran mayoría de los pacientes (92,7%) continuaron recibiendo 75mg de clopidogrel como mantenimiento (el resto continuaron con 150mg/día), siendo la mediana en días (intervalo de tiempo entre el inicio del tratamiento y la determinación de la reactividad plaquetar) de 5 (intervalo intercuartílico 2-10). De los pacientes que no recibieron dosis de carga de clopidogrel durante el día primero del ingreso, un 42,1% aseguraban ser tomadores de clopidogrel al menos durante el último mes. Para el resto de los pacientes a los que no se les suministró dosis de carga y no eran tomadores previos de clopidogrel (un mes), la mitad habían recibido clopidogrel al menos durante los 6 días previos a la determinación analítica (rango intercuartílico 3-9).
Características basales de la muestra (i)
| Variables | Cohorte (n=247) |
| Edad, años, media (DE) | 66 (11) |
| Sexo masculino, n (%) | 176 (71,3) |
| IMC, kg/m2, media (DE) | 29 (4) |
| Factores de riesgo | - |
| HTA, n (%) | 155 (62,8) |
| Dislipidemia, n (%) | 144 (58,3) |
| Tabaquismo activo, n (%) | 83 (33,6) |
| DM tipo 2, n (%) | 97 (39,3) |
| EPOC, n (%) | 17 (6,8) |
| Cardiopatía isquémica previa, n (%) | 102 (41,3) |
| Ictus, n (%) | 9 (3,6) |
| Insuficiencia renal crónica, n (%) | 17 (6,9) |
| Arteriopatía periférica, n (%) | 12 (4,9) |
| Episodio cualificante | - |
| Marcadores necrosis elevados, n (%) | 173 (70,0) |
| Clase Killip>1, n (%) | 26 (10,5) |
| Cambios ECG, n (%) | 173 (70,0) |
| Elevación del segmento ST, n (%) | 57 (23,1) |
| FEVI>55%, n (%) | 178 (78,1) † |
| Número de vasos enfermos, mediana (RI) | 1 (1-2) |
| Número de stents, mediana (RI) | 1 (1-2) |
| Longitud total stents, mm, media (DE) | 29 (18) |
DE: desviación estándar; DM: diabetes mellitus; ECG: electrocardiograma; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección ventricular izquierda; HTA: hipertensión arterial; IMC: índice de masa corporal; RI: rango intercuartílico.
Función sistólica del ventrículo izquierdo disponible en 228 (92,3%). Se consideró vaso «enfermo» aquel con≥1 lesión de≥70% de estenosis. Se presenta la media (desviación estándar) para variables continuas con distribución normal, mediana (rango intercuartílico, expresado como percentil 25-percentil 75) para cuantitativas discretas, y número bruto (porcentaje) para discretas dicotómicas.
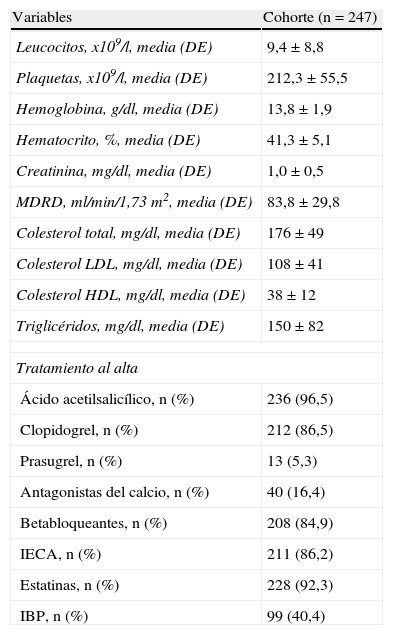
Un 98,8% de los pacientes estaban recibiendo ácido acetilsalicílico, siendo la dosis de 100mg/24h la más frecuente (64,2%). Ciento treinta y uno (53,0%) habían recibido dosis de carga de ácido acetilsalicílico, y un 40,5% eran tomadores crónicos (al menos durante el mes previo). A 91 (36,8%) pacientes se les suministraron concomitantemente inhibidores de la bomba de protones (IBP), siendo pantoprazol el más frecuentemente prescrito (67,0%). Un 75,0% tomaban inhibidores de la enzima conversiva de angiotensina y/o bloqueadores del receptor tipo 1 de la angiotensina ii, un 15,9% diuréticos, un 3,3% alfabloqueantes, un 72,2% betabloqueantes, un 32,7% nitratos, un 15,6% antagonistas del calcio y un 82,4% estatinas. El antagonista de los canales del calcio más prescrito fue amlodipino (77,1%), y la estatina más frecuente, atorvastatina (91,6%).
Tratamiento al alta. Recomendaciones para clopidogrel (tabla 2)Se prescribió clopidogrel en 212 (86,5%) pacientes, siendo la dosis de 75mg/24h la más frecuente (80,8%). Se recomendó clopidogrel durante un año en el 57,0%, indefinido en un 29,6% y un mes en un 4,7%; el resto, entre un mes y un año. Los demás medicamentos se prescribieron según consta en la tabla 2. El IBP más prescrito fue pantoprazol (56,2%), seguido de omeprazol (27,0%). Se empleó ranitidina en un 47,2%.
Características basales de la muestra (ii): variables de laboratorio y tratamiento al alta
| Variables | Cohorte (n=247) |
| Leucocitos, x109/l, media (DE) | 9,4±8,8 |
| Plaquetas, x109/l, media (DE) | 212,3±55,5 |
| Hemoglobina, g/dl, media (DE) | 13,8±1,9 |
| Hematocrito, %, media (DE) | 41,3±5,1 |
| Creatinina, mg/dl, media (DE) | 1,0±0,5 |
| MDRD, ml/min/1,73m2, media (DE) | 83,8±29,8 |
| Colesterol total, mg/dl, media (DE) | 176±49 |
| Colesterol LDL, mg/dl, media (DE) | 108±41 |
| Colesterol HDL, mg/dl, media (DE) | 38±12 |
| Triglicéridos, mg/dl, media (DE) | 150±82 |
| Tratamiento al alta | |
| Ácido acetilsalicílico, n (%) | 236 (96,5) |
| Clopidogrel, n (%) | 212 (86,5) |
| Prasugrel, n (%) | 13 (5,3) |
| Antagonistas del calcio, n (%) | 40 (16,4) |
| Betabloqueantes, n (%) | 208 (84,9) |
| IECA, n (%) | 211 (86,2) |
| Estatinas, n (%) | 228 (92,3) |
| IBP, n (%) | 99 (40,4) |
Colesterol HDL: colesterol unido a high density lipoproteins («lipoproteínas de alta densidad»); Colesterol LDL: colesterol unido a low density lipoproteins («lipoproteínas de baja densidad»); DE: desviación estándar; IBP: inhibidores de la bomba de protones; IECA: inhibidores de la enzima conversiva de angiotensina; MDRD: aclaramiento renal según la fórmula Modification of Diet in Renal Disease abreviada.
Se presenta la media (desviación estándar) para variables continuas y el número bruto (porcentaje) para discretas dicotómicas.
Las frecuencias del genotipo de CYP2C19 (rs4244285, rs12248560) y PON1 (rs662) estuvieron en su totalidad de acuerdo con la ley de equilibrio de Hardy-Weinberg (p=0,254, p=0,567, p=0,154) y fueron similares al HapMap-CEU24.
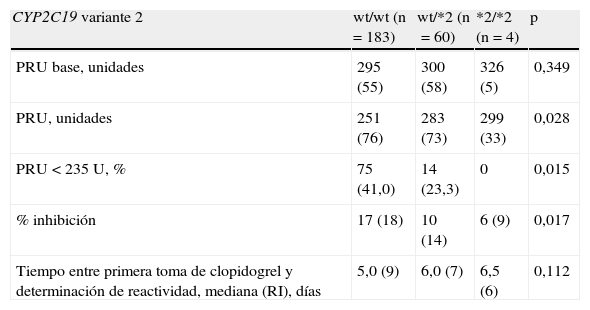
CYP2C19*2La tabla 3 muestra la distribución de frecuencias de los genotipos de la variante *2 y *17 del CYP2C19, así como del PON1RS662. Un 24,3% de los pacientes presentaban un solo alelo *2, mientras un 1,6% tenían los 2. Los pacientes portadores de≥1 alelo *2 presentaron valores de PRU significativamente mayores respecto a los sujetos con genotipo original (wild type, wt) y así el porcentaje de inhibición fue también significativamente menor. No se observó una diferente reactividad basal (PRU base) entre los 3 grupos.
Genotipo de CYP2C19*2, reactividad plaquetar y episodios adversos
| CYP2C19 variante 2 | wt/wt (n=183) | wt/*2 (n=60) | *2/*2 (n=4) | p |
| PRU base, unidades | 295 (55) | 300 (58) | 326 (5) | 0,349 |
| PRU, unidades | 251 (76) | 283 (73) | 299 (33) | 0,028 |
| PRU<235U, % | 75 (41,0) | 14 (23,3) | 0 | 0,015 |
| % inhibición | 17 (18) | 10 (14) | 6 (9) | 0,017 |
| Tiempo entre primera toma de clopidogrel y determinación de reactividad, mediana (RI), días | 5,0 (9) | 6,0 (7) | 6,5 (6) | 0,112 |
| CYP2C19 variante 17 | wt/wt (n=155) | wt/*17 (n=78) | *17/*17 (n=14) | p |
| PRU base, unidades | 295 (56) | 299 (54) | 310 (51) | 0,643 |
| PRU, unidades | 257 (77) | 262 (75) | 267 (80) | 0,798 |
| PRU<235U, % | 59 (38,1) | 26 (33,3) | 4 (28,6) | 0,650 |
| % inhibición | 16 (17) | 14 (18) | 17 (21) | 0,509 |
| Tiempo entre primera toma de clopidogrel y determinación de reactividad, mediana (RI), días | 6,0 (9) | 4,5 (8) | 4,0 (9) | 0,453 |
| PON1-Q192R | CC (RR) (n=35) | CT (RQ) (n=108) | TT (QQ) (n=104) | p |
| PRU base, unidades | 297 (52) | 297 (58) | 298 (55) | 0,997 |
| PRU, unidades | 273 (85) | 256 (78) | 258 (71) | 0,709 |
| PRU<235U, % | 11 (31,4) | 42 (38,9) | 36 (34,6) | 0,313 |
| % inhibición | 14 (18) | 16 (18) | 15 (17) | 0,692 |
| Tiempo entre primera toma de clopidogrel y determinación de reactividad, mediana (RI), días | 7,0 (8) | 5,0 (8) | 4,5 (9) | 0,133 |
PRU: platelet reactivity units; RI: rango intercuartílico (expresado como diferencia entre el percentil 75 y percentil 25); WT: wild-type.
Se presentan la media (desviación estándar) o el valor absoluto (porcentaje).
Un 31,6% de los pacientes presentaban un solo alelo de ganancia de función (el 5,7% tenían los 2). Los pacientes portadores de≥1 alelo *17 del CYP2C19 no presentaron una reactividad plaquetar a clopidogrel significativamente distinta respecto a los sujetos con genotipo original (PRU, media [DE] de 263 [75] frente a 259 [78], p=0,694; porcentaje de inhibición 14 [18] frente a 16 [17], p=0,530).
La distribución de las variantes de PON1-Q192 fue como sigue: TT(QQ) en el 42,1%, CT(RQ) en el 43,7% y CC(RR) en el 14,2%. Los pacientes con≥1 alelo de pérdida de función (T, aminoácido Q) no presentaron una diferente respuesta a clopidogrel frente a los portadores de CC(RR) (PRU, media [DE] de 259 [76] frente a 273 [85], p=0,321; porcentaje de inhibición 15 [17] frente a 14 [18], p=0,662).
Perfil del paciente con elevada reactividad plaquetar en tratamiento con clopidogrelIdentificamos como pobres respondedores a 158 (64,0%) pacientes con PRU>235U. En un contexto univariante y dicotomizando la respuesta plaquetar (PRU>235 U) encontramos que la edad (OR 1.044, IC 95% 1.019-1.069), la insuficiencia renal crónica previa (OR 4.563, IC 95% 1.019-20.435), la creatinina basal (OR 2.773, IC 95% 1.141-6.736) y el ser portador de≥1 alelo *2 del CYP2C19 (OR 2.480, IC 95% 1.280-4.807) fueron factores de riesgo para una elevada reactividad plaquetar. Fueron protectores el tabaquismo activo (OR 0,424, IC 95% 0,245-0,732), la hemoglobina (OR 0,667, IC 95% 0,565-0,767), el hematocrito (OR 0,863, IC 95% 0,810-0,919) y el aclaramiento renal estimado (ml/min/1,73m2, evaluado mediante la fórmula Modification of Diet in Renal Disease, OR 0,986, IC 95% 0,977-0,995). En un modelo multivariable que incluyó edad, sexo, índice de masa corporal (IMC), tabaquismo activo, insuficiencia renal crónica previa, hemoglobina basal, aclaramiento renal estimado, CYP2C19*2/*17/PON1Q192R y medicación concomitante (estatinas, antagonistas del calcio e IBP), resultaron predictores independientes de riesgo de pobre respuesta el IMC (OR 1.074, IC 95% 1.005-1.148) y el ser portador de≥1 alelo *2 del CYP2C19 (OR 2.786, IC 95% 1.337-5.808), mientras fueron protectores la hemoglobina basal elevada (OR 0,666, IC 95% 0,555-0,801) y el uso concomitante de estatinas (OR 0,376, IC 95% 0,162-0,873). El estadístico C del modelo fue de 0,754 (IC 95% 0,691-0,816) y el valor de p del test de Hosmer-Lemeshow de 0,516. Ni la presencia de≥1 alelo *17 de CYP2C19 (OR 1.332, IC 95% 0,699-2.539) ni la presencia de≥1 alelo *T del PON1-Q192R (OR 0,744, IC 95% 0,309-1.793) fueron predictores de pobre respuesta a clopidogrel en el modelo ajustado. En dicho modelo, el predictor más potente de PRU>235 fue la hemoglobina al ingreso (Wald=18,7), seguida de la presencia de alelos *2 del CYP2C19 (Wald=7,5), el uso concomitante de estatinas (Wald=5,2) y el IMC (Wald=4,4). Las 3 variables menos importantes fueron el uso concomitante de antagonistas del calcio (Wald=0,07), el uso concomitante de IBP (Wald=0,09) y el antecedente de insuficiencia renal crónica (Wald=0,3).
Influencia pronóstica de los polimorfismos CYP2C19*2/*17 y PON1-Q192REpisodios adversos intrahospitalariosRegistramos 2 muertes intrahospitalarias (0,8%). Del total de pacientes del estudio, 210 (85,0%) fueron sometidos a intervencionismo coronario, y en 187 de ellos (89,0%) se determinó la troponina I y la isoforma MB de la creatincinasa tras el mismo. Registramos un total de 32 (17,1%) IM peri-ACTP. Respecto de la ocurrencia de IM peri-ACTP, no observamos diferencias según el genotipo (OR ajustada para≥1 alelo *2 CYP2C19=1.638, IC 95% 0,704-3.807; OR ajustada para≥1 alelo *17 CYP2C19=1.872, IC 95% 0,708-3.430; OR para≥1 alelo T [Q] de PON1 [vs. CC]=2.079, IC 95% 0,509-6.884). Los factores que se asociaron (todos de riesgo) a la ocurrencia de IM peri-ACTP fueron la presencia de arteriopatía periférica, el número de lesiones tratadas y la longitud de los stents implantados (datos no mostrados).
Episodios adversos tras el altaEn los 245 pacientes que sobrevivieron al ingreso observamos durante el seguimiento un total de 37 episodios adversos (15,1%). Se registraron 16 anginas inestables, 5 reinfartos, 8 muertes por cualquier causa, 4 trombosis del stent y 4 ACV. La mediana de seguimiento fue de 12,7 meses (intervalo intercuartílico 10,7-15,8). La mediana de seguimiento para los pacientes sin episodios fue de 13,4 meses (intervalo intercuartílico 11,7-16,7) y para los pacientes con episodios fue de 6,7 (1,2-9,5) meses.
En un análisis de Kaplan-Meier, los pacientes portadores de≥1 alelo *2 de CYP2C19 presentaron 12 episodios (19,0%) frente a 25 (13,7%) los no portadores (log-rank, p=0,348). Los portadores de≥1 alelo *17 de CYP2C19 presentaron 18 episodios (19,8%) frente a 19 (12,3%) en los no portadores (log-rank, p=0,09). Los portadores de≥1 alelo T (Q) de PON1 presentaron 35 episodios (16,6%) frente a 2 (5.9%) en los no portadores (log-rank, p=0,114). En un contexto multivariante ajustado (edad, arteriopatía periférica y fracción de eyección ventricular izquierda) la presencia≥1 alelo *2 de CYP2C19 no se asoció significativamente con un peor pronóstico (HR ajustada=1.036, IC 95% 0,490-2.191). Análogo resultado se obtuvo para los portadores de uno o 2 alelos *17 (HR ajustada=1.525, IC 95% 0,777-2.995) o los portadores de alelos T (Q) de PON1 (HR ajustada=3.185, IC 95% 0,755-13.432). No encontramos factores modificadores del efecto tras el análisis de interacciones de primer grado en distintos modelos jerárquicos multivariados testados. Se analizaron los siguientes subgrupos (datos no mostrados): sujetos sometidos a cualquier intervencionismo coronario, pacientes sometidos a intervencionismo coronario con≥1 stent farmacoactivo, pacientes a los que se les recomienda clopidogrel indefinidamente o durante un año, subgrupo en función del tiempo entre el inicio de la toma de clopidogrel y la determinación de la reactividad plaquetar. Tampoco encontramos diferencias al restringir el seguimiento a los primeros 12 meses.
DiscusiónLos resultados de nuestro estudio muestran que, en pacientes con SCA: 1) la presencia de≥1 alelo *2 del CYP2C19 influye la respuesta plaquetar a clopidogrel, a diferencia del CYP2C19*17 y PON1-Q192R, que no lo hacen; 2) la importancia relativa de CYP2C19*2 como predictor de respuesta a clopidogrel es modesta comparativamente con variables puramente clínicas (hemoglobina, IMC o uso de estatinas); 3) la toma de IBP no influye en la reactividad plaquetar; 4) el uso concomitante de estatinas se presenta como un factor protector para una elevada reactividad plaquetar residual, y 5) finalmente, los polimorfismos *2/*17 del CYP2C19 y PON1-Q192R no supusieron una herramienta útil en la estratificación de los pacientes tras un ingreso por SCA.
Estos resultados complementan y expanden los recientemente publicados por Tello-Montoliu et al.25. Estos autores concluyeron análogamente que las variantes genéticas CYP2C19*2 y *17 influían en la reactividad plaquetar, pero no en el pronóstico, a 6 meses en una población similar a la nuestra. Sin embargo, en este estudio se evaluó la reactividad plaquetar en un subgrupo de 40 pacientes mediante transmisión óptica (Aggrecorder II) y a través de la determinación de la fosfoproteína estimulada por vasodilatadores. En contraste, nosotros estudiamos la reactividad plaquetar en todos los pacientes, realizamos la determinación adicional del polimorfismo PON1-Q192R y seguimos a nuestros pacientes a más largo plazo.
Algunos investigadores han descrito asociaciones entre la presencia de alelos *2 del CYP2C19 y episodios adversos5,7, pero esta relación no es consistente en todos los estudios15. Un metaanálisis reciente señaló que el riesgo asociado a CYP2C19*2 se focalizaba en la trombosis del stent, pero no en un mayor riesgo global de episodios adversos26. Además, se encontró una heterogeneidad estadística importante en virtud de la cual la asociación entre sucesos adversos y CYP2C19*2 era más evidente en estudios «pequeños» (n<500) –más potencialmente expuestos a sesgo de publicación– que en aquellos con mayor tamaño, en los cuales virtualmente no se halló asociación con el pronóstico adverso. En nuestro estudio –tal y como se ha señalado anteriormente– no encontramos asociación entre genotipo y pronóstico. En el estudio de Tello-Montoliu et al.25 se especuló que quizá la falta de asociación entre los polimorfismos de CYP2C19 y el pronóstico podía deberse al bajo riesgo de los pacientes, ya que solo un 50% fue sometido a intervencionismo coronario. Sin embargo, en nuestro estudio más del 80% de los pacientes fueron sometidos a intervencionismo y no observamos asociación con un pronóstico adverso. La importancia de la variante CYP2C19*17 es también controvertida; algunos estudios han descrito reducción de los episodios adversos en pacientes con IM tratados de modo invasivo27. Sin embargo, otros no encuentran relación ni con los sucesos trombóticos ni con los hemorrágicos28. En nuestra serie no hubo relación con un pronóstico distinto.
En nuestro estudio los pacientes con genotipos CT(RQ) o TT(QQ) (previamente descritos como de «reducción de la actividad de la paroxonasa»)10 del PON1-Q192R no presentaron una diferente respuesta a bloqueadores de ADP ni un pronóstico distinto. Estos hallazgos están en concordancia con un metaanálisis de reciente publicación28.
Los pacientes con anemia y mayor IMC fueron en nuestra serie aquellos expuestos a una superior reactividad plaquetar, lo cual es consecuente con lo publicado previamente29,30. Además, comprobamos que la contribución del CYP2C19*2 fue modesta (contribución absoluta al estadístico C del modelo final de regresión logística≈2,3%) en la detección de los pacientes con elevada reactividad plaquetar, respecto de un modelo clínico y también en consonancia con lo publicado30.
Finalmente, la prescripción concomitante de estatinas –atorvastatina fundamentalmente en nuestro estudio– se asoció a un efecto protector respecto de la ocurrencia de elevada reactividad plaquetaria residual. Este interesante hallazgo está en línea con algunos estudios31,32, pero en contra de otros33, sin que este debate haya sido del todo aclarado. Se ha especulado que puede ser dependiente del sistema de medida de la agregación34. Además, si un abordaje terapéutico guiado por estos sistemas es beneficioso ha sido recientemente puesto en entredicho35.
Futuros estudios encaminados a identificar nuevos genes relacionados con la farmacogenética de clopidogrel deberán integrar sin excepción factores clínicos fácilmente obtenibles de una simple historia clínica o análisis rutinario de laboratorio.
Limitaciones y fortalezasLas limitaciones fueron: 1) las propias de los estudios observacionales; así, la administración o no de la dosis de carga, la dosis de la misma o de mantenimiento de los antiagregantes no fueron uniformes, sino a discreción del médico al cargo; 2) el tamaño muestral vino determinado por el número máximo de sujetos que se pudieron reclutar en el intervalo de tiempo señalado; 3) no se dispuso de datos relativos a la cumplimentación terapéutica tras el alta, y 4) la prevalencia de pacientes con elevada reactividad residual fue elevada en nuestro estudio y esto probablemente se debe a la elección de 4h como tiempo mínimo para la determinación de la respuesta desde la dosis de carga. Como fortalezas, señalamos que es un estudio que evalúa hasta 3 polimorfismos de nucleótidos simples en una población homogénea de pacientes con SCA, y que no se produjeron pérdidas en el seguimiento.
ConclusionesEl polimorfismo de CYP2C19*2 influyó en la respuesta a clopidogrel, pero no condicionó un pronóstico distinto en pacientes con diagnóstico de SCA remitidos para cateterismo cardíaco. La variabilidad de la respuesta a clopidogrel explicada por CYP2C19*2 es modesta comparativamente con variables clínicas. Por su parte, los polimorfismos de CYP2C19*17 y PON1-Q192R no influyeron en la reactividad plaquetar ni el pronóstico.
FinanciaciónBeca Competitiva FFIS-Caja Murcia 10/006.
Conflicto de interesesLos autores declaramos no tener conflictos de intereses que afecten al manuscrito.
Se agradece especialmente la revisión y comentarios críticos del Dr. Roberto Elósua (Grupo de Epidemiología y Genética Cardiovascular, IMIM, Barcelona).
Agradecemos el trabajo del equipo de enfermería (A. Clemente, E. García, A. Velasco, C. Ruiz, M.J. Valverde, D. Yuste y L. Lozano) y la colaboración de los Dres. Giner, Cortés y Martín.