Los fármacos antidiabéticos tienen, además de su conocido efecto hipoglucemiante, diferentes efectos sobre el resto de los factores de riesgo cardiovascular asociados a diabetes mellitus. Recientemente se han incorporado al arsenal terapéutico de la diabetes mellitus de tipo 2 los agonistas del receptor del glucagon-like peptide-1 (AR-GLP-1, «péptido tipo 1 similar al glucagón»). El objetivo de este trabajo es resumir la evidencia disponible sobre el efecto de los AR-GLP-1 en diferentes factores de riesgo cardiovascular, mediado tanto por el efecto hipoglucemiante de los AR-GLP-1 como por su efecto sobre los demás factores de riesgo cardiovascular (control del peso, presión arterial, perfil lipídico y otros marcadores de riesgo cardiovascular). Además, se presenta la incipiente evidencia con respecto al impacto que el tratamiento con AR-GLP-1 pudiera tener en la reducción de los episodios cardiovasculares y los estudios que hay actualmente en marcha para abordar este aspecto.
Anti-diabetic drugs have, in addition to their well-known glucose lowering-effect, different effects in the rest of cardiovascular factors that are associated with diabetes mellitus. Glucagon-like peptide-1 (GLP-1) receptor agonists have recently been incorporated to the therapeutic arsenal of type 2 diabetes mellitus. The objective of this review is to summarize the available evidence on the effect of the GLP-1 receptor agonists on different cardiovascular risk factors, mediated by the effect of GLP-1 receptor agonists on the control of hyperglycaemia and the GLP-1 receptor agonists effect on other cardiovascular risk factors (weight control, blood pressure control, lipid profile and all other cardiovascular risk biomarkers). In addition, we present the emerging evidence with regards to the impact that GLP-1 receptor agonists therapy could have in the reduction of cardiovascular events and the currently ongoing studies addressing this issue.
La diabetes mellitus de tipo 2 se define clásicamente por un incremento de los valores plasmáticos de glucosa en sangre, que son causados por una resistencia a la acción de la insulina. Por motivos fisiopatológicos, dicha situación se asocia necesariamente a otros factores de riesgo cardiovascular, como son la obesidad, la hipertensión y la dislipidemia1. Esta asociación resulta en un incremento del riesgo de padecer episodios cardiovasculares en los pacientes diabéticos.
Por otro lado, la eficacia de los fármacos antidiabéticos se ha medido clásicamente por su efecto en el control glucémico, respecto al cual las diferencias entre diferentes grupos de fármacos son poco relevantes. Sin embargo, cualquier fármaco antidiabético tiene, además de los efectos hipoglucemiantes, diferentes efectos sobre el resto de los factores de riesgo cardiovascular, pudiendo mejorar o empeorar su control. Por tanto, muy probablemente sus características diferenciales con respecto a sus efectos sobre el riesgo cardiovascular radiquen en el efecto que producen los diferentes grupos de fármacos en cada uno de los factores de riesgo, que es diferente entre ellos, además de en su efecto hipoglucemiante, que está presente en todos y cada uno de ellos por definición. Estos pueden ser favorables, como por ejemplo la pérdida de peso o la disminución de las cifras de presión arterial, o deletéreos, como en el caso de las tiazolidinedionas y su conocido efecto de aumento de peso por retención líquida.
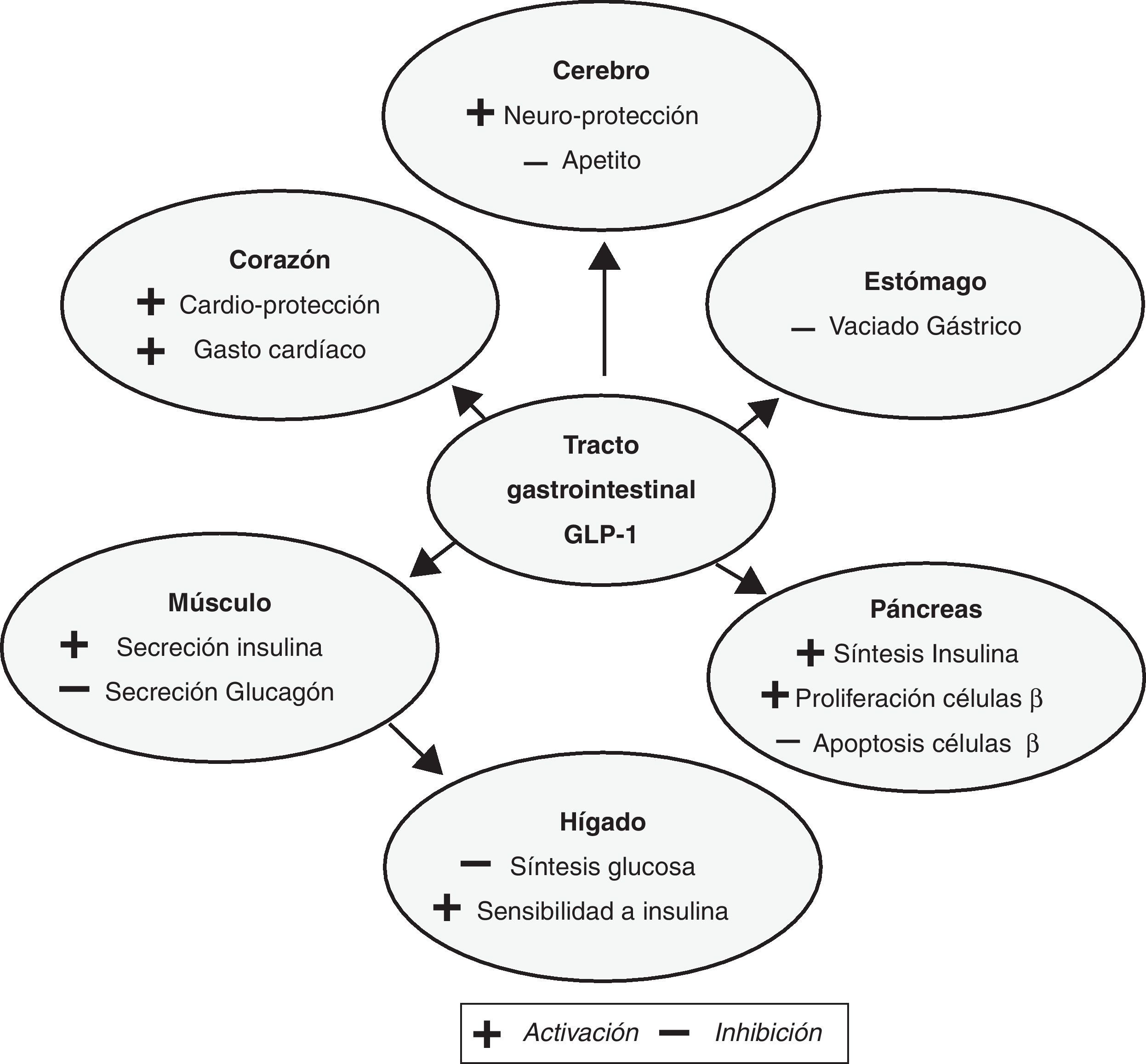
De entre todos los antidiabéticos, uno de los últimos en incorporarse al arsenal terapéutico han sido los llamados incretínicos. Dichos fármacos basan su efecto en el de las incretinas, que como es bien conocido son hormonas segregadas por las células enteroendocrinas del intestino en respuesta a la elevación de la glucosa después de la ingesta, estimulando la secreción de insulina e inhibiendo la secreción de glucagón. Se sabe, además, que este efecto está alterado en pacientes con diabetes mellitus2,3. El glucagon-like peptide-1 (GLP-1, «péptido tipo 1 similar al glucagón») es una incretina que posee diferentes efectos. Por un lado, actúa mediante la interacción con receptores específicos de membrana (receptor GLP-1), estimulando la secreción de insulina dependiente de la glucosa por parte de los islotes pancreáticos, ayudando a una mejor homeostasis de la glucosa y reduciendo la velocidad de absorción de los nutrientes. Por otro lado, activa vías neuronales específicas en el sistema nervioso central que tienen un efecto positivo sobre el apetito, reduciendo la ingesta e induciendo pérdida de peso3,4. La utilización de GLP-1 como fármaco tiene unos efectos terapéuticos limitados, ya que la enzima dipeptidil peptidasa-4 (DDP-4) lo degrada rápidamente tras su administración por infusión intravenosa. Para poder utilizar tratamientos basados en GLP-1 y compensar su corta vida media, se han desarrollado fármacos que consiguen aumentar los efectos de GLP-1 por medio de 2 estrategias: mediante la inhibición de la enzima DDP-4 (los llamados inhibidores de DDP-4) o mediante el desarrollo de fármacos que estimulen el receptor de GLP-1, ya sean derivados de GLP-1 nativo mediante la adición de un ácido graso como liraglutida, o bien fármacos desarrollados a partir de exendina, que es una sustancia similar en un 70% a GLP-1. En ambos casos su naturaleza química les permite ser resistentes a la enzima DDP-45,6. En dichos fármacos, la estimulación de la secreción de insulina y la inhibición de la secreción de glucagón dependen de la concentración de glucosa, lo cual les confiere un riesgo bajo de hipoglucemia7,8. Además, el hecho de que la diana terapéutica de los agonistas del receptor de GLP-1 (AR-GLP-1) se expresen no solo en los islotes del páncreas, sino también en tejido extrapancreático (riñón, pulmón, endotelio y determinadas localizaciones del sistema nervioso central y periférico), confiere a los AR-GLP-1 un valor añadido, mas allá del control glucémico, por su potencial beneficio mediado por su actividad extrapancreática (fig. 1)3,4.
Tanto el propio control glucémico proporcionado por los AR-GLP-1, como los efectos secundarios positivos asociados a los mismos, como son el riesgo bajo de hipoglucemia (que redunda en una mayor adherencia al tratamiento y un mejor control glucémico) o la reducción de peso, podrían mejorar el riesgo cardiovascular de los pacientes diabéticos9,10. El objetivo de este trabajo es resumir la evidencia proporcionada por estudios clínicos sobre el efecto de los AR-GLP-1 en cada uno de los factores de riesgo cardiovascular. Para ello revisaremos en primer lugar el papel de estos fármacos sobre el control de factores de riesgo cardiovascular mediado tanto por su efecto pancreático (control de la hiperglucemia) como por los extrapancreáticos (control del peso, presión arterial, el perfil lipídico y marcadores de riesgo cardiovascular). Finalmente revisaremos el impacto que el tratamiento con AR-GLP-1 pudiera tener en la reducción de los episodios cardiovasculares, la incipiente evidencia al respecto y los estudios actualmente en marcha para evaluar este aspecto.
Control de la hiperglucemiaEn el desarrollo clínico tanto de exenatida como de liraglutida quedó demostrada su capacidad para reducir la hemoglobina glucosilada (HbA1c)11,12, motivo por el cual fueron autorizados por la Agencia Europea del Medicamento en 2006 y en 2009, respectivamente13,14, para su utilización, en combinación con otros antidiabéticos, para el tratamiento de pacientes con diabetes mellitus tipo 2 que no alcancen un control glucémico adecuado con las dosis máximas toleradas de los antidiabéticos de primera línea (en términos generales, metformina, sulfonilureas y tiazolidindionas).
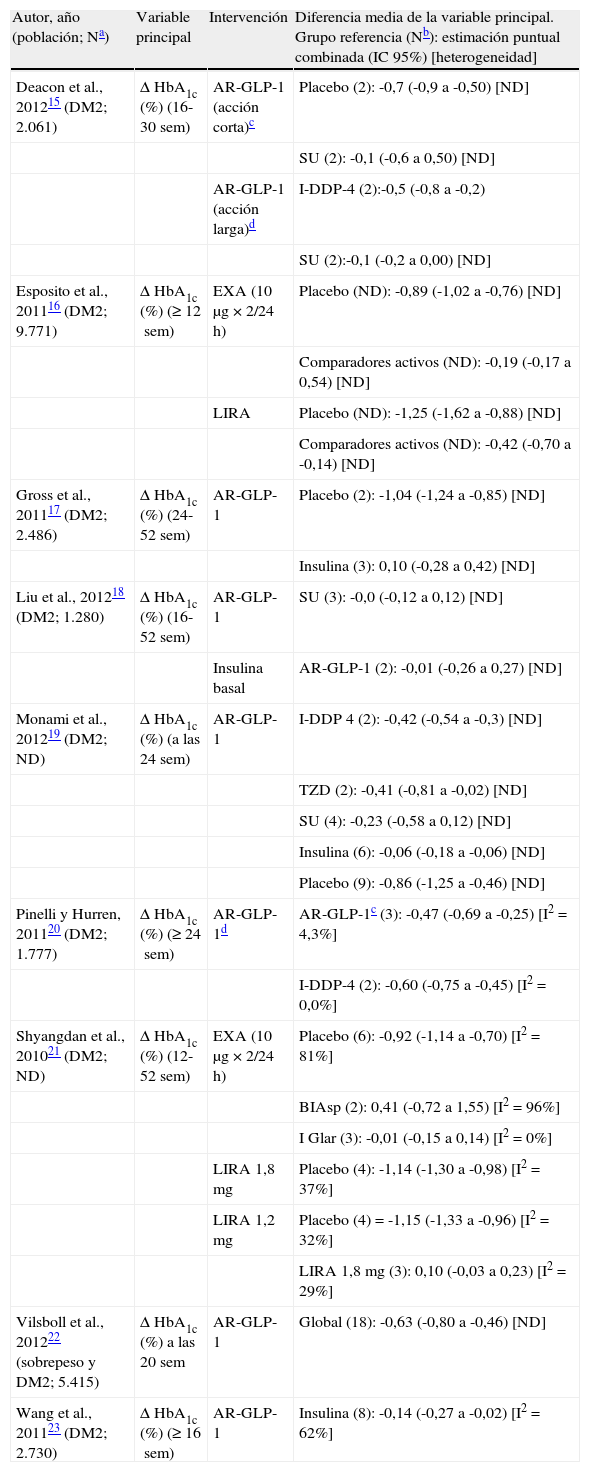
La evidencia proporcionada por los metaanálisis de los ensayos clínicos con los AR-GLP-115–23 pone de manifiesto que estos contribuyen a mejorar el control glucémico cuando se añaden a otros antidiabéticos (tabla 1). Cuando se comparan con el otro grupo de fármacos basado en el sistema de incretinas, los inhibidores de la DDP-4, los AR-GLP-1 se asocian a una mayor reducción de la HbA1c, tanto en los metaanálisis (tabla 1) como en los ensayos clínicos individuales21. Al comparar los diferentes AR-GLP-1 entre sí, se obtuvo un mayor control glucémico con liraglutida (dosis de 1,8mg una vez/24h) que con exenatida (10μg 2 veces/24h) (diferencia media del cambio de HbA1c=-0,33%, intervalo de confianza del 95% [IC 95%] -0,47 a -0,18)24. El control glucémico fue también superior con exenatida a dosis de 2mg una vez/semana, que con exenatida a dosis de 10μg 2 veces/24h (diferencia media del cambio de HbA1c=-0,40%, IC 95% -0,54 a -0,12)25 y similar entre las diferentes dosis de liraglutida (diferencia media del cambio de HbA1c=0,10%, IC 95% -0,03 a 0,23)21.
Metaanálisis de ensayos clínicos aleatorizados con agonistas del receptor de péptido tipo 1 similar al glucagón: resultados en la reducción de hemoglobina glucosilada
| Autor, año (población; Na) | Variable principal | Intervención | Diferencia media de la variable principal. Grupo referencia (Nb): estimación puntual combinada (IC 95%) [heterogeneidad] |
| Deacon et al., 201215 (DM2; 2.061) | Δ HbA1c (%) (16-30sem) | AR-GLP-1 (acción corta)c | Placebo (2): -0,7 (-0,9 a -0,50) [ND] |
| SU (2): -0,1 (-0,6 a 0,50) [ND] | |||
| AR-GLP-1 (acción larga)d | I-DDP-4 (2):-0,5 (-0,8 a -0,2) | ||
| SU (2):-0,1 (-0,2 a 0,00) [ND] | |||
| Esposito et al., 201116 (DM2; 9.771) | Δ HbA1c (%) (≥12sem) | EXA (10μg×2/24h) | Placebo (ND): -0,89 (-1,02 a -0,76) [ND] |
| Comparadores activos (ND): -0,19 (-0,17 a 0,54) [ND] | |||
| LIRA | Placebo (ND): -1,25 (-1,62 a -0,88) [ND] | ||
| Comparadores activos (ND): -0,42 (-0,70 a -0,14) [ND] | |||
| Gross et al., 201117 (DM2; 2.486) | Δ HbA1c (%) (24-52sem) | AR-GLP-1 | Placebo (2): -1,04 (-1,24 a -0,85) [ND] |
| Insulina (3): 0,10 (-0,28 a 0,42) [ND] | |||
| Liu et al., 201218 (DM2; 1.280) | Δ HbA1c (%) (16-52sem) | AR-GLP-1 | SU (3): -0,0 (-0,12 a 0,12) [ND] |
| Insulina basal | AR-GLP-1 (2): -0,01 (-0,26 a 0,27) [ND] | ||
| Monami et al., 201219 (DM2; ND) | Δ HbA1c (%) (a las 24sem) | AR-GLP-1 | I-DDP 4 (2): -0,42 (-0,54 a -0,3) [ND] |
| TZD (2): -0,41 (-0,81 a -0,02) [ND] | |||
| SU (4): -0,23 (-0,58 a 0,12) [ND] | |||
| Insulina (6): -0,06 (-0,18 a -0,06) [ND] | |||
| Placebo (9): -0,86 (-1,25 a -0,46) [ND] | |||
| Pinelli y Hurren, 201120 (DM2; 1.777) | Δ HbA1c (%) (≥24sem) | AR-GLP-1d | AR-GLP-1c (3): -0,47 (-0,69 a -0,25) [I2=4,3%] |
| I-DDP-4 (2): -0,60 (-0,75 a -0,45) [I2=0,0%] | |||
| Shyangdan et al., 201021 (DM2; ND) | Δ HbA1c (%) (12-52sem) | EXA (10μg×2/24h) | Placebo (6): -0,92 (-1,14 a -0,70) [I2=81%] |
| BIAsp (2): 0,41 (-0,72 a 1,55) [I2=96%] | |||
| I Glar (3): -0,01 (-0,15 a 0,14) [I2=0%] | |||
| LIRA 1,8mg | Placebo (4): -1,14 (-1,30 a -0,98) [I2=37%] | ||
| LIRA 1,2mg | Placebo (4)=-1,15 (-1,33 a -0,96) [I2=32%] | ||
| LIRA 1,8mg (3): 0,10 (-0,03 a 0,23) [I2=29%] | |||
| Vilsboll et al., 201222 (sobrepeso y DM2; 5.415) | Δ HbA1c (%) a las 20sem | AR-GLP-1 | Global (18): -0,63 (-0,80 a -0,46) [ND] |
| Wang et al., 201123 (DM2; 2.730) | Δ HbA1c (%) (≥16sem) | AR-GLP-1 | Insulina (8): -0,14 (-0,27 a -0,02) [I2=62%] |
Δ: cambio; AR-GLP-1: agonistas del receptor de péptido tipo 1 similar al glucagón; BIAsp: insulina aspart bifásica; DM2: diabetes mellitus tipo 2; EXA: exenatida; HbA1c: hemoglobina glucosilada; IC 95%: intervalo de confianza del 95%; I-DDP-4: inhibidores de la enzima dipeptidil peptidasa-4; IGlar: insulina glargina; IMC: índice de masa corporal; LIRA: liraglutida; ND: no disponible; SU: sulfonilureas; TZD: tiazolidinedionas.
En el análisis principal del trabajo de Liu et al.18, además de las comparaciones directas presentadas en la tabla 1, se realizaron comparaciones indirectas entre antidiabéticos que no habían sido directamente comparados en los ensayos clínicos identificados. Este análisis situó a los AR-GLP-1 en el tercer lugar en el ranking de antidiabéticos que obtienen una mayor reducción de la HbA1c, detrás de la insulina bifásica y la insulina basal18. En esta revisión se identificaron también ensayos clínicos individuales que no fueron objeto de metaanálisis, pero en los que se observó que los AR-GLP-1 reducían de forma significativa la HbA1c frente a placebo (diferencia media del cambio de HbA1c=-0,80%, IC 95% -0,98 a -0,63), frente a inhibidores de la DDP-4 (diferencia media del cambio de HbA1c=-0,55%, IC 95% -0,70 a -0,41) y tiazolidinedionas (diferencia media del cambio de HbA1c=-0,3%, IC 95% -0,6 a -0,1)18.
Así pues, y en términos generales, cuando se añaden al tratamiento antidiabético preexistente, los AR-GLP-1 reducen la HbA1c en un intervalo de 0,7 a 1,25% (tabla 1). Cuando se realizan comparaciones dentro del grupo de fármacos involucrados en el sistema incretina, se alcanza una mayor reducción de HbA1c con AR-GLP-1 que con inhibidores de la DDP-4. A su vez, los AR-GLP de acción prolongada (liraglutida 1,2 o 1,8mg una vez al día o exenatida 2mg una vez a la semana) proporcionan un mayor control glucémico que los AR-GLP-1 de acción corta (exenatida 10μg 2 veces al día).
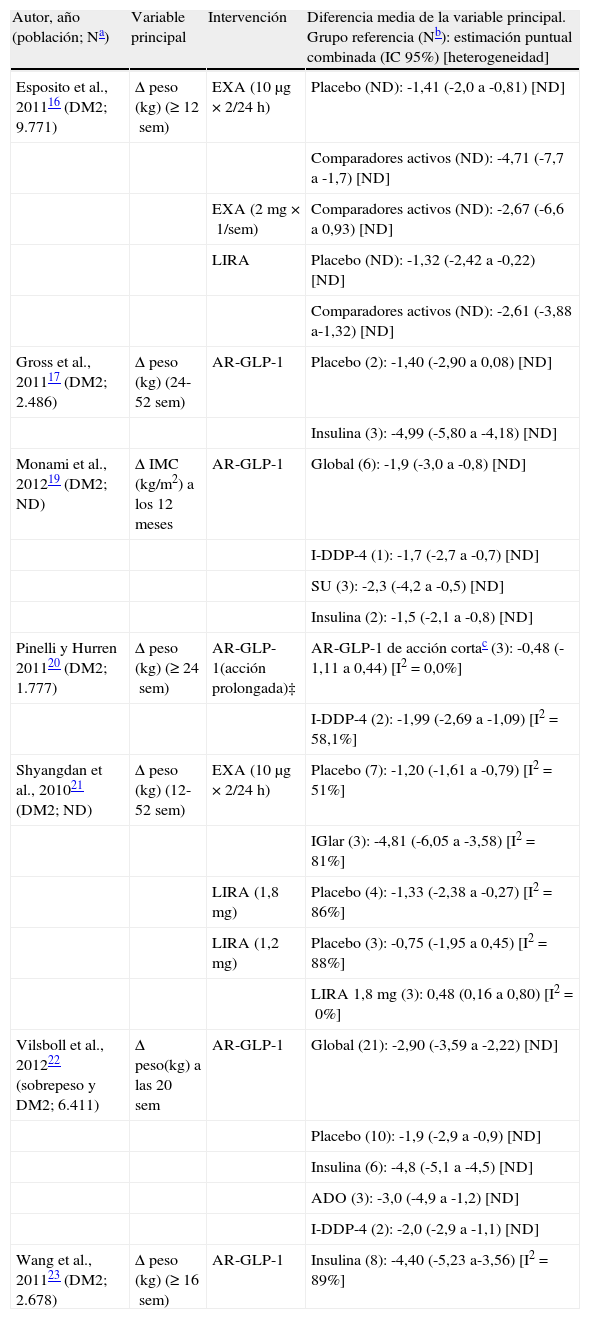
Reducción del pesoUno de los efectos no hipoglucemiantes más importantes de los fármacos AR-GLP-1 se da sobre el peso. En la tabla 2 se resumen los metaanálisis de los ensayos clínicos de liraglutida y exenatida en los cuales se recogió como objetivo secundario la magnitud de la reducción del peso o del índice de masa corporal y se pudieron combinar los resultados obtenidos al respecto16,17,19–22. Cabe resaltar el hecho de que la reducción de peso asociada a AR-GLP-1 podría alcanzar los 1,9kg frente a placebo (tabla 2). En comparación con los inhibidores de la DDP-4, los AR-GLP-1 consiguen una reducción del peso que podría llegar a los 3kg y, frente a insulinas, se alcanzarían diferencias de 5kg (tabla 2). No obstante, los resultados de estos metaanálisis hay que considerarlos con cautela, dado que la heterogeneidad entre estudios fue elevada en la mayor parte de ellos (I2>50%), seguramente por el hecho de que el peso se recogió como un objetivo secundario en estos ensayos clínicos.
Metaanálisis de ensayos clínicos aleatorizados con agonistas del receptor de péptido tipo 1 similar al glucagón: resultados sobre el peso
| Autor, año (población; Na) | Variable principal | Intervención | Diferencia media de la variable principal. Grupo referencia (Nb): estimación puntual combinada (IC 95%) [heterogeneidad] |
| Esposito et al., 201116 (DM2; 9.771) | Δ peso (kg) (≥12sem) | EXA (10μg×2/24h) | Placebo (ND): -1,41 (-2,0 a -0,81) [ND] |
| Comparadores activos (ND): -4,71 (-7,7 a -1,7) [ND] | |||
| EXA (2mg×1/sem) | Comparadores activos (ND): -2,67 (-6,6 a 0,93) [ND] | ||
| LIRA | Placebo (ND): -1,32 (-2,42 a -0,22) [ND] | ||
| Comparadores activos (ND): -2,61 (-3,88 a-1,32) [ND] | |||
| Gross et al., 201117 (DM2; 2.486) | Δ peso (kg) (24-52sem) | AR-GLP-1 | Placebo (2): -1,40 (-2,90 a 0,08) [ND] |
| Insulina (3): -4,99 (-5,80 a -4,18) [ND] | |||
| Monami et al., 201219 (DM2; ND) | Δ IMC (kg/m2) a los 12 meses | AR-GLP-1 | Global (6): -1,9 (-3,0 a -0,8) [ND] |
| I-DDP-4 (1): -1,7 (-2,7 a -0,7) [ND] | |||
| SU (3): -2,3 (-4,2 a -0,5) [ND] | |||
| Insulina (2): -1,5 (-2,1 a -0,8) [ND] | |||
| Pinelli y Hurren 201120 (DM2; 1.777) | Δ peso (kg) (≥24sem) | AR-GLP-1(acción prolongada)‡ | AR-GLP-1 de acción cortac (3): -0,48 (-1,11 a 0,44) [I2=0,0%] |
| I-DDP-4 (2): -1,99 (-2,69 a -1,09) [I2=58,1%] | |||
| Shyangdan et al., 201021 (DM2; ND) | Δ peso (kg) (12-52 sem) | EXA (10μg×2/24h) | Placebo (7): -1,20 (-1,61 a -0,79) [I2=51%] |
| IGlar (3): -4,81 (-6,05 a -3,58) [I2=81%] | |||
| LIRA (1,8mg) | Placebo (4): -1,33 (-2,38 a -0,27) [I2=86%] | ||
| LIRA (1,2mg) | Placebo (3): -0,75 (-1,95 a 0,45) [I2=88%] | ||
| LIRA 1,8mg (3): 0,48 (0,16 a 0,80) [I2=0%] | |||
| Vilsboll et al., 201222 (sobrepeso y DM2; 6.411) | Δ peso(kg) a las 20sem | AR-GLP-1 | Global (21): -2,90 (-3,59 a -2,22) [ND] |
| Placebo (10): -1,9 (-2,9 a -0,9) [ND] | |||
| Insulina (6): -4,8 (-5,1 a -4,5) [ND] | |||
| ADO (3): -3,0 (-4,9 a -1,2) [ND] | |||
| I-DDP-4 (2): -2,0 (-2,9 a -1,1) [ND] | |||
| Wang et al., 201123 (DM2; 2.678) | Δ peso (kg) (≥16sem) | AR-GLP-1 | Insulina (8): -4,40 (-5,23 a-3,56) [I2=89%] |
Δ: cambio; ADO: antidiabéticos orales; AR-GLP-1: agonistas del receptor de péptido tipo 1 similar al glucagón; DM2: diabetes mellitus tipo 2; EXA: exenatida; I-DDP-4: inhibidores de la enzima dipeptidil peptidasa-4; IGlar: insulina glargina; IMC: índice de masa coporal; LIRA: liraglutida; ND: no disponible; SU: sulfonilurea.
En la tabla 2 se representan las comparaciones directas con respecto a placebo y comparadores activos. Cuando se realizan comparaciones indirectas, se demuestra que los AR-GLP-1, seguidos de los inhibidores de la alfa-glucosidasa, se asocian a una mayor pérdida de peso17,18. Por el contrario, antidiabéticos como las sulfonilureas, glinidas, tiazolidinedionas, insulina basal e insulina bifásica se asocian a un incremento del peso17,18.
El mecanismo que explicaría la reducción del peso asociada a AR-GLP-1 no se conoce bien. Sin embargo, es conocido que GLP-1, a concentraciones bajas, tiene efectos en el metabolismo de la insulina y el glucagón, y a concentraciones más elevadas retrasa el vaciado gástrico y aumenta la sensación de saciedad10. Por tanto, en un principio se pensó que la reducción del peso producida por AR-GLP-1 podría estar relacionada con el retraso del vaciado gástrico y el aumento de la sensación de saciedad mediado por concentraciones elevadas de GLP-110. Según un trabajo reciente, parece ser que es la regulación de las señales del apetito en el cerebro, y no el vaciado gástrico, el principal mecanismo por el cual liraglutida reduce el peso26.
Existen datos suficientes que demuestran que los AR-GLP-1 proporcionan una mayor reducción de peso que otros antidiabéticos. De hecho, la mayoría de los antidiabéticos se asocian a un incremento de peso, excepto los inhibidores de la DDP-4 o la metformina, que tienen un efecto neutro sobre el mismo, no produciendo ninguna ganancia1. La reducción de peso observada con AR-GLP-1 frente al efecto neutro de los inhibidores de la DDP-4 podría explicarse por el hecho de que el aumento de valores de GLP-1 mediado por los inhibidores de la DDP-4 se obtiene de forma indirecta y, por tanto, no alcanza los niveles necesarios para conseguir activar los mecanismos relacionados con la reducción del peso10,27. Por otro lado, la pérdida de peso producida por los AR-GLP-1 parece ser independiente de las náuseas asociadas al tratamiento con estos y no parecen existir diferencias entre liraglutida y exenatida en cuanto a la reducción de peso21.
Presión arterial y frecuencia cardíacaAl igual que el peso, pero con menor frecuencia, las variaciones de la presión arterial se han recogido como objetivo secundario de los ensayos clínicos realizados con AR-GLP-1. Aquellos ensayos en los cuales se recogió esta información han sido objeto de un metaanálisis publicado recientemente, en el que se combinaron las variaciones en los valores de presión arterial de 12 ensayos clínicos realizados con AR-GLP-1 en pacientes con diabetes mellitus tipo 2 y sobrepeso22. Los resultados de este metaanálisis muestran que los AR-GLP-1 a dosis terapéuticas reducen de forma significativa la presión arterial sistólica (PAS) en comparación con los grupos de referencia, que incluían placebo, ningún tratamiento o comparadores activos (diferencia media del cambio de PAS a las 20 semanas [N=12 ensayos clínicos]: -3,57mmHg, IC 95% -5,49 a -1,66)22. Con respecto a la reducción de la presión arterial diastólica (PAD) obtenida con AR-GLP-1, aunque también resultó estadísticamente significativa en comparación con los grupos de referencia, fue más moderada (diferencia media del cambio de PAD a las 20 semanas [N=11 ensayos clínicos]: -1,38mmHg, IC 95%: -2,02 a -0,73)22. En concordancia con estos resultados, en todos menos en uno de los 28 ensayos clínicos incluidos en otra revisión sistemática, se observó una reducción de la PAS moderada con AR-GLP-1, mientras que en la mayoría de los ensayos clínicos identificados, las diferencias en la reducción de la PAD fueron no significativas21.
Cuando se comparan los fármacos incretínicos, se observa una reducción de la PAS significativa con los AR-GLP-1 de acción prolongada (liraglutida una vez al día o exenatida una vez a la semana) en comparación con AR-GLP-1 de acción corta (exenatida 10μg una vez al día) o inhibidores de la DDP-420,28.
Con respecto a la frecuencia cardíaca, aunque la evidencia es más escasa, parece que tanto exenatida (una vez a la semana) como liraglutida (una vez al día) la incrementan de forma muy moderada en un intervalo de 2 a 4lpm, en comparación con placebo o comparador activo29.
En resumen, los AR-GLP-1 reducen de forma significativa la PAS y podrían tener un efecto moderado sobre la frecuencia cardíaca. Como ocurre con los mecanismos implicados en la reducción del peso, aquellos implicados en la reducción de PAS y el incremento de la frecuencia cardíaca asociados a AR-GLP-1 no se han dilucidado completamente. Existen modelos animales que sugieren que la estimulación de los receptores de GLP-1 mediada por exenatida inhibe la modulación parasimpática del corazón, aumentando con ello la frecuencia cardíaca30.
Perfil lipídico y marcadores de riesgo cardiovascularLa evidencia clínica disponible acerca del impacto de AR-GLP-1 en el perfil lipídico procede de un limitado número de ensayos clínicos en los cuales se analizaron los parámetros lipídicos como objetivo secundario, y los datos son todavía más escasos en lo que se refiere al impacto sobre los marcadores de riesgo cardiovascular.
En un metaanálisis publicado recientemente de ensayos clínicos realizados con AR-GLP-1 en pacientes con diabetes mellitus tipo 2 y sobrepeso, los AR-GLP-1 se asociaron de forma significativa con una reducción de las concentraciones de colesterol total tras 20 semanas de tratamiento en comparación con los grupos de referencia (placebo, sin tratamiento o tratamiento activo) (diferencia media del cambio de colesterol [N=10 ensayos]: -0,10mmol, IC 95% -0,16 a -0,04)22.
En ensayos clínicos individuales de exenatida se observaron reducciones significativas de colesterol total y colesterol unido a lipoproteínas de baja densidad (colesterol LDL), en comparación con rosiglitazona (cambio de colesterol total, -0,13mmol/l con exenatida frente a +0,44mmol/l con rosiglitazona, p<0,001; cambio de colesterol LDL, -0,05mmol/l con exenatida frente a +0,33mmol/l con rosiglitazona, p=0,008)27. Los resultados combinados de los ensayos clínicos fase iii del desarrollo clínico de liraglutida ponen de manifiesto que esta reduce de forma significativa las concentraciones de colesterol total, colesterol LDL y triglicéridos respecto a basal31. En este metaanálisis, los triglicéridos fueron el único parámetro lipídico que se redujo de forma significativa en todos los grupos de referencia (rosiglitazona, glimepirida, insulina glargina, sitagliptina y exenatida), mientras que el colesterol total y el colesterol LDL solo aumentaron de forma significativa en el grupo de rosiglitazona31. Por otro lado, en este análisis combinado, liraglutida se asoció con una mayor reducción de las concentraciones de colesterol total y colesterol LDL que insulina glargina, glimepirida y rosiglitazona, y no se observaron diferencias frente a exenatida31.
Cuando se compara el perfil lipídico de los pacientes tratados con fármacos incretínicos (AR-GLP-1 o inhibidores DDP-4), se obtienen resultados más favorables cuando se utilizan AR-GLP-1 de acción prolongada (liraglutida una vez al día o exenatida 2mg una vez a la semana) que AR-GLP-1 de acción corta (exenatida 10μg una vez al día/24h) o inhibidores de la DDP-4, tanto en las concentraciones de colesterol, como colesterol LDL y triglicéridos20. Los cambios en las concentraciones de colesterol unido a lipoproteínas de alta densidad son menores y no se observan diferencias significativas entre los distintos fármacos basados en el sistema de incretinas20.
Con respecto a los marcadores de riesgo cardiovascular, liraglutida fue el único antidiabético con el que se obtuvo una reducción significativa con respecto a basal en los valores de los 3 marcadores de riesgo cardiovascular (plasminogen activator inhibitor-1 [PAI-1, «inhibidor del activador del plasminógeno»], brain natriuretic peptide [BNP, «péptido natriurético tipo B»] y proteína C reactiva ultrasensible [PCRus]) estudiados en análisis combinado de los ensayos clínicos fase iii de liraglutida31. La reducción de BNP y PCRus observada con liraglutida fue significativamente mayor que con glimepirida o insulina glargina31. En este metaanálisis también se analizó la reducción del perímetro de cintura, que fue significativamente mayor con liraglutida que con cualquier otro antidiabético, excepto cuando se comparó con exenatida, que resultó similar31. Además, los resultados de un subanálisis realizado con los datos recogidos en un ensayo clínico de liraglutida frente a placebo demuestran que liraglutida reduce de forma significativa los marcadores PAI-1 y BNP frente a placebo, mientras que las reducciones de PCRus fueron no significativas, pero dependientes de la dosis32.
Aunque los análisis disponibles hasta ahora son de naturaleza exploratoria, sugieren una posible asociación de los AR-GLP-1 con una mejoría del perfil lipídico en comparación con otros antidiabéticos, fundamentalmente en lo que se refiere a los valores de colesterol y colesterol LDL. Con respecto a la incipiente evidencia sobre el impacto de AR-GLP-1 sobre marcadores cardiovasculares, se ha observado una mejoría en los pacientes tratados con liraglutida en comparación con otros antidiabéticos y frente a placebo.
Episodios cardiovascularesDel mismo modo que se ha observado el efecto beneficioso de AR-GLP-1 sobre los factores de riesgo cardiovascular, se ha evaluado en análisis post hoc el riesgo de episodios cardiovasculares para comprobar hasta qué punto la mejoría en el perfil de riesgo cardiovascular observado en pacientes tratados con AR-GLP-1 se traduce en un beneficio en cuanto a la reducción de episodios cardiovasculares.
Con este propósito, se han realizado metaanálisis para estudiar el riesgo de los sucesos cardiovasculares mayores identificados de forma secundaria en los ensayos clínicos con liraglutida33 y exenatida34. La reducción del riesgo de episodios cardiovasculares mayores con liraglutida y exenatida, frente al grupo de referencia (placebo o antidiabéticos), fue similar para ambos fármacos (riesgo relativo [RR] con liraglutida 0,73, IC 95% 0,38 a 1,41; RR con exenatida 0,70, IC 95% 0,38 a 1,31)33,34. En ambos casos, el límite superior del intervalo de confianza está por debajo del umbral de seguridad cardiovascular (que es de 1,8), y sin embargo, está por encima del umbral definido para confirmar la hipótesis de no inferioridad (que es de 1,3). Estos márgenes son los establecidos por las autoridades regulatorias norteamericanas para cualquier nuevo fármaco antidiabético en fase de investigación35.
En otro metaanálisis realizado con 20 ensayos clínicos de AR-GLP-1 frente a placebo o comparadores activos, de al menos 12 semanas de duración, la exposición a AR-GLP-1 se asoció con una reducción de la posibilidad de episodios cardiovasculares frente al grupo de placebo (odds ratio [OR] 0,46, IC 95% 0,26 a 0,83), aunque no se apreció reducción frente al grupo de referencia global (placebo y antidiabéticos, conjuntamente) (OR 0,74, IC 95% 0,50 a 1,08) ni frente al grupo de antidiabéticos (OR 1,05, IC 95% 0,63 a 1,76)36.
Además de los análisis post hoc de los ensayos clínicos, se ha realizado un análisis retrospectivo para evaluar el riesgo de sucesos cardiovasculares en pacientes tratados con exenatida en condiciones de práctica clínica habitual. Para ello se identificó una cohorte de pacientes con diabetes mellitus tipo 2 tratados con exenatida (N=21.754) y una cohorte de referencia de pacientes con diabetes mellitus tipo 2 no tratados con exenatida (N=361.771). Exenatida se asoció con una reducción del riesgo de episodios cardiovasculares (hazard ratio 0,81, IC 95% 0,68 a 0,95)37.
Las limitaciones de los análisis disponibles hasta la fecha son claras. Por un lado, los metaanálisis se basan en ensayos clínicos cuyo objetivo principal era metabólico (control glucémico) y, por tanto, los episodios cardiovasculares se identificaron de forma secundaria a través del listado de efectos adversos comunicados en los ensayos. Por otro lado, el análisis observacional retrospectivo está limitado por la confusión residual de cualquier estudio realizado en el ámbito de la práctica clínica. Por tanto, los resultados obtenidos hasta la fecha, tanto de ensayos clínicos como de estudios observacionales, deben ser considerados con cautela. Con independencia de estas limitaciones, lo que sí sugieren estos análisis, junto con la evidencia sobre el papel de AR-GLP-1 en factores de riesgo cardiovascular comentada previamente, es la necesidad de evaluar si existe una reducción del riesgo de episodios cardiovasculares mayores con los AR-GLP-1. En esta línea se está trabajando actualmente y para ello se han puesto en marcha 2 ensayos clínicos con el objetivo de evaluar si liraglutida o exenatida reducen la incidencia de episodios cardiovasculares mayores a largo plazo (tabla 3)38,39. Así mismo, se han iniciado otros ensayos clínicos cuyo objetivo es evaluar ad hoc el impacto de los AR-GLP-1 sobre el control de factores de riesgo cardiovascular (tabla 3)40–43.
Ensayos clínicos actualmente en marcha para estudiar el impacto de los agonistas del receptor de péptido tipo 1 similar al glucagón en el riesgo cardiovascular
| Título/acrónimo/referencia | Diseño/N/intervención | Variable principal | |
| Episodios cardiovasculares | Exenatide Study of Cardiovascular Event Lowering Trial: A trial to evaluate cardiovascular outcomes after treatment with exenatide once weekly in patients with type 2 diabetes mellitus/EXSCEL/NCT01144338 | Fase III/9.500/EXA frente a placebo | Tiempo hasta primer episodio cardiovascular mayor |
| Liraglutide Effect and Action in Diabetes: Evaluation of Cardiovascular Outcome Results - A Long Term Evaluation/LEADER®/NCT01179048 | Fase III/9.341/LIRA frente a placebo | Tiempo hasta primer episodio cardiovascular mayor | |
| Factores de riesgo cardiovascular | Liraglutide Treatment to Patients With Severe Renal Insufficiency/NCT01394341 | Fase IV/40/LIRA | Factores de riesgo cardiovascular (lípidos y presión arterial) |
| A long-term trial to compare the effects of liraglutide and sulphonylurea (glimepiride) both in combination with metformin on clinical, endothelial and image markers of cardiovascular risk in patients with type 2 diabetes/ADELANTE/NCT01593137 | Fase IV/50/LIRA, MET, GLM | Niveles de células progenitoras endoteliales | |
| Liraglutide and Heart Failure in Type 2 Diabetes/NCT01425580 | Fase II/80/LIRA, MET, GLM | Función ventricular izquierda y reserva funcional en reposo y/o después del ejercicio (18sem) | |
| The effect of liraglutide on left ventricular function in chronic heart failure patients with and without type 2 diabetes mellitus/NCT01472640 | 24/LIRA, placebo | Cambio en la función ventricular izquierda a las 24sem |
EXA: exenatida; GLM: glimepirida; LIRA: liraglutida; MET: metformina.
Los AR-GLP-1 son similares a otros antidiabéticos en lo que se refiere al control glucémico cuando se añaden al tratamiento para la diabetes de primera elección. No obstante, sí parecen existir diferencias en cuanto al efecto de los AR-GLP-1 sobre el resto de factores de riesgo cardiovascular con respecto a otros antidiabéticos. Por tanto, en la elección del tratamiento para la diabetes debería tenerse en cuenta necesariamente el perfil de riesgo cardiovascular de cada paciente, y los beneficios que sobre la glucemia y sobre el resto de factores de riesgo tenga cada tratamiento, ya que ello nos permitirá un abordaje global de la diabetes que vaya más allá del simple control glucémico.
En este sentido, se ha demostrado que los AR-GLP-1 (liraglutida, exenatida) reducen el peso, a diferencia de otros antidiabéticos que lo aumentan, como la insulina, o el efecto neutro que tienen los inhibidores de la DDP-41. Además, los AR-GLP-1 se han asociado a una reducción de la PAS, el perfil lipídico y los valores de determinados marcadores de riesgo cardiovascular, en comparación con otros antidiabéticos. Todo ello hace de los AR-GLP-1 una opción a considerar para pacientes con problemas de sobrepeso, obesidad y riesgo cardiovascular añadido elevado.
Por otro lado, en las guías actuales de la American Diabetes Association se recomienda intensificar el tratamiento en pacientes seleccionados (es decir, aquellos con escasa comorbilidad y esperanza de vida elevada) con el objetivo de alcanzar un valor de HbA1c más restrictivo del establecido con anterioridad (<6,5 en lugar de<7%), siempre y cuando este objetivo no aumente el riesgo de hipoglucemias1. En este contexto, los AR-GLP-1 constituirían una buena opción de tratamiento de segunda línea, puesto que, por un lado, cuando se añaden al tratamiento de primera línea reducen la HbA1c en el mismo rango que otros antidiabéticos (de -0,9 a -1,1%)1, y por otro lado, su mecanismo de acción dependiente de la concentración de glucosa le confiere un riesgo bajo de hipoglucemias8.
Por las características de la evidencia clínica disponible hasta la fecha, la mayoría basada en análisis post hoc y comparaciones indirectas, los resultados obtenidos en la clínica sobre el papel de AR-GLP-1 en la reducción del riesgo cardiovascular tienen todavía un carácter exploratorio. Mientras continuamos a la espera de los resultados de los ensayos clínicos confirmatorios, y lejos de establecer recomendaciones, debe aconsejarse a los clínicos personalizar el tratamiento según el perfil de riesgo cardiovascular de cada paciente.
En resumen, los AR-GLP-1 tienen, además del efecto hipoglucemiante, para el cual están indicados en el tratamiento de la diabetes mellitus tipo 2, una serie de efectos no hipoglucemiantes mediados por su actividad extrapancreática que proporcionan una mejoría del perfil de riesgo cardiovascular de los pacientes con diabetes mellitus tipo 2. Habrá que esperar a disponer de los resultados de los ensayos clínicos actualmente en marcha para saber hasta qué punto la mejoría del perfil cardiovascular asociado a AR-GLP-1 se traduce en una disminución de los episodios cardiovasculares.
Conflicto de interesesEl autor es coordinador nacional del estudio Liraglutide Effect and Action in Diabetes. Evaluation of Cardiovascular Outcome Results (LEADER).
El autor ha contado con la ayuda de Teresa Hernando, de Cociente S.L., para la redacción de este manuscrito, ayuda que ha sido financiada por Novo Nordisk Pharma,S.A. Novo Nordisk Pharma,S.A. ha revisado la fidelidad de la información presentada en este manuscrito.