Se ha especulado que las estatinas pueden ser de utilidad en el tratamiento de pacientes con COVID-19, pero no existen evidencias clínicas sólidas. El objetivo de este trabajo es conocer su utilidad en una cohorte de gran tamaño de pacientes hospitalizados por COVID-19, así como si su retirada se asocia con un peor pronóstico.
Material y métodosEstudio retrospectivo observacional. Se incluyeron 2.191 pacientes hospitalizados con infección confirmada con SARS-CoV-2.
ResultadosLa edad media fue de 68,0 ± 17,8 años y fallecieron un total de 597 (27,3%) pacientes. Un total de 827 pacientes (37,7% de la muestra) estaban tratados previamente con estatinas. Aunque precisaron con mayor frecuencia de ingreso en camas de críticos, dicho grupo terapéutico no resultó un factor predictor independiente de muerte en el seguimiento [HR 0,95 (0,72-1,25)]. Un total de 371 pacientes (16,9%) recibió al menos una dosis de estatina durante el ingreso. A pesar de ser una población con un perfil clínico más desfavorable, tanto su uso [HR 1,03 (0,78-1,35)] como la suspensión durante el ingreso en pacientes que las recibían crónicamente [HR 1,01 (0,78-1,30)] presentaron un efecto neutro en la mortalidad. No obstante, el grupo con estatinas desarrolló con mayor frecuencia datos de citolisis hepática, rabdomiolisis y más eventos trombóticos y hemorrágicos.
ConclusionesEn nuestra muestra, las estatinas no se asociaron de forma independiente a una menor mortalidad en pacientes con COVID-19. En aquellos pacientes que tengan indicación de recibirlas por su patología previa es necesario monitorizar estrechamente sus potenciales efectos adversos durante el ingreso hospitalario.
Statins have been proposed as potentially useful agents for modulating the host response in COVID-19. However, solid evidence-based recommendations are still lacking. Our aim was to study the association between statin use and clinical outcomes in a large cohort of hospitalized patients with SARS-CoV-2 infection, as well as the specific consequences of chronic treatment withdrawal during hospital admission.
Material and methodsRetrospective observational study including 2191 hospitalized patients with confirmed SARS-CoV-2 infection.
ResultsMean age was 68.0±17.8 years and 597 (27.3%) patients died during follow-up. A total of 827 patients (37.7% of the whole sample), received chronic treatment with statins. Even though they underwent more frequent admissions in critical care units, chronic treatment with statins was not independently associated with all-cause mortality [HR 0.95 (0.72-1.25)]. During the whole hospital admission, 371 patients (16.9%) received at least one dose of statin. Although these patients had a significantly worse clinical profile, both treatment with statins during admission [HR 1.03 (0.78-1.35)] and withdrawal of chronic statin treatment [HR 1.01 (0.78-1.30)] showed a neutral effect in mortality. However, patients treated with statins presented more frequently hepatic cytolysis, rhabdomyolysis and thrombotic/hemorrhagic events.
ConclusionsIn this large cohort of hospitalized COVID-19 patients, statins were not independently associated with all-cause mortality during follow-up. Clinically relevant statin-associated adverse effects should be carefully monitored during hospital admission.
La pandemia por COVID-19ha causado más de tres millones de defunciones en la población mundial a lo largo del último año1 y numerosos autores2,3 han expuesto que los factores de riesgo y la enfermedad cardiovascular establecida constituyen factores de mal pronóstico. Es precisamente en estos pacientes en donde las guías terapéuticas4 recomiendan el empleo de estatinas a dosis altas por la mejoría pronóstica y excelente tolerabilidad demostrada en multitud de ensayos clínicos aleatorizados.
Además de mejorar el perfil lipídico, las estatinas actúan de forma multidimensional en lo que se conoce como efectos pleiotrópicos5. Destacan entre ellos el efecto antiinflamatorio, antioxidante, la endotelio-protección y la acción antitrombótica6. Algunas de estas acciones pleiotrópicas, especialmente las propiedades inmunomoduladoras7, podrían ser el fundamento teórico de su posible utilidad en pacientes con COVID-198. La idea es atractiva, especialmente si consideramos su buena tolerancia, disponibilidad y precio asequible, pero todavía no existen evidencias clínicas sólidas, basadas en ensayos clínicos adecuadamente diseñados, sobre su utilidad en infecciones por SARS-CoV-2.
El objetivo de este trabajo es analizar las implicaciones del tratamiento con estatinas en pacientes hospitalizados por COVID-19, así como valorar si su retirada en pacientes que las reciben de forma crónica se asocia con un peor pronóstico.
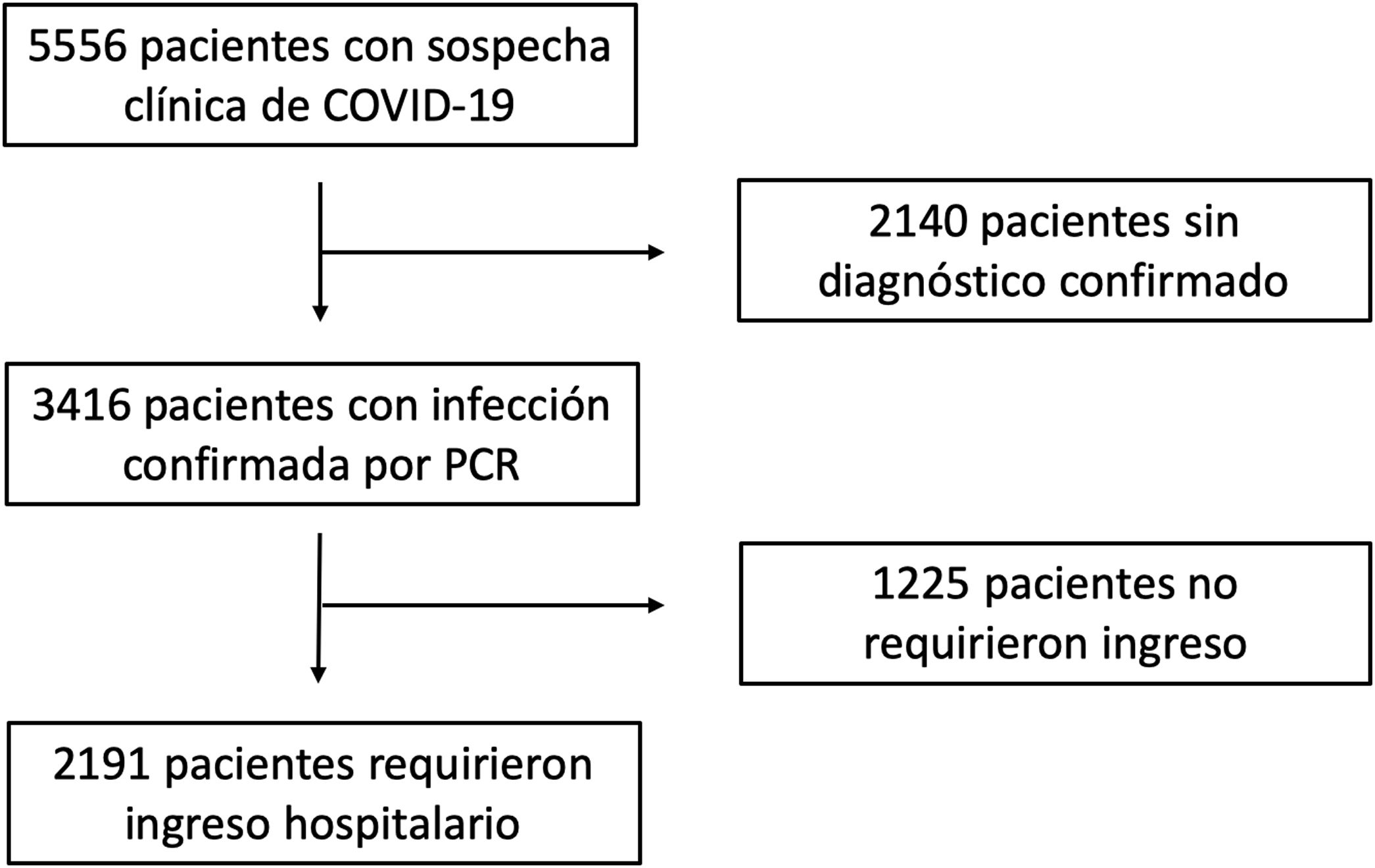
MétodosDiseño del estudio y pacientes incluidos: Se valoraron todos aquellos pacientes con sospecha clínica de COVID-19 atendidos en el servicio de urgencias de un hospital de tercer nivel desde el día 1 de marzo de 2020 hasta el 20 de abril de 2020. Sólo se incluyeron en el análisis aquellos pacientes con infección confirmada por SARS-CoV-2 mediante PCR obtenida de muestras nasofaríngeas, y que finalmente requirieran ingreso hospitalario. Este estudio fue aprobado por el Comité Ético de Investigación Clínica de nuestro centro. Con base en la legislación nacional para situaciones de alarma sanitaria, no se requirió cumplimentar un documento de consentimiento informado. Con el objetivo de evitar en la medida de lo posible un sesgo de selección en casos de enfermedad grave, la retirada de medicación se definió como la ausencia de administración de estatinas durante todo el ingreso hospitalario en aquellos pacientes que mantenían tratamiento crónico con fármacos de dicho grupo terapéutico. La administración intrahospitalaria de fármacos se comprobó analizando los registros centralizados del Servicio de Farmacia Hospitalaria de nuestro centro.
Datos analizados: Se recogió información epidemiológica, demográfica, clínica, analítica, así como el tratamiento y los resultados clínicos a partir de la historia clínica electrónica elaborada durante el ingreso índice y las sucesivas hospitalizaciones. Además, se analizaron los datos disponibles en el sistema Horus, que centraliza la información sanitaria de la Comunidad de Madrid procedente de toda la red de hospitales públicos y centros de atención primaria. Todos los datos fueron revisados detalladamente por un equipo de 13 cardiólogos. Se prestó especial atención a la identificación de las características cardiovasculares al ingreso y a los resultados clínicos.
Análisis estadístico: Las variables categóricas se presentan como recuentos y porcentajes, mientras que las variables continuas se describen como media ± desviación estándar o mediana (rango intercuartílico) en función de las características de la distribución. Las medias de las variables continuas se analizaron utilizando el test t de Student o el test de Mann-Whitney. La normalidad de las distribuciones se analizó utilizando la prueba de Shapiro-Wilk. Las variables categóricas se analizaron utilizando el test χ2 o el test exacto de Fisher. Se realizó un análisis de supervivencia utilizando técnicas de Kaplan-Meier y el test log-rank. La asociación del tratamiento crónico con estatinas y de su retirada con la mortalidad por cualquier causa en el seguimiento se analizó mediante técnicas de regresión de Cox uni y multivariables, seleccionando para ello potenciales variables confusoras que resultan clínicamente relevantes (edad, sexo, enfermedad cardiovascular previa, otras comorbilidades, situación clínica al ingreso y tratamiento recibido durante el mismo). Todos los datos se analizaron utilizando el paquete estadístico Stata v14.2 (StataCorp, College Station, TX, EE. UU.). Un valor bilateral de p < 0,05 se consideró estadísticamente significativo para todos los análisis.
ResultadosDurante el periodo de estudio, 2.191 pacientes hospitalizados con infección confirmada por SARS-CoV-2 cumplieron criterios de inclusión y fueron incluidos en el presente análisis (fig. 1). La edad media fue de 68,0 ± 17,8 años y 1.246 (56,9%) eran varones. Durante un seguimiento mediano de 57 (27-64) días fallecieron un total de 597 (27,3%) pacientes.
Pacientes hospitalizados por COVID-19 con y sin tratamiento crónico previo con estatinas.Se incorporaron en el análisis un total de 827 pacientes tratados previamente con estatinas (37,7% de los pacientes hospitalizados con PCR positiva para SARS-CoV-2). Las características basales de la población del estudio se muestran en la tabla 1. Los pacientes tratados previamente con estatinas presentaban una edad más avanzada (74,4± 12,4 vs. 64,1 ± 19,4; p < 0,001), un perfil de riesgo cardiovascular claramente más elevado y significativamente más antecedentes de enfermedad cardiovascular (enfermedad coronaria, cerebrovascular y arterial periférica). En consecuencia, recibían significativamente más tratamiento farmacológico antiplaquetario, anticoagulante y de prevención secundaria cardiovascular. Por lo que respecta a la prescripción de fármacos específicos para la COVID-19, existieron diferencias significativas a favor de una mayor utilización de glucocorticoides en el grupo tratado con estatinas.
Características basales, tratamiento cardiovascular, constantes vitales, datos analíticos y resultados clínicos de los pacientes con y sin tratamiento con estatinas previo al ingreso hospitalario por COVID-19
| Variable | Todos los pacientes (n = 2.191) | Sin tratamiento crónico con estatinas (n = 1.364) | Con tratamiento crónico con estatinas (n = 827) | Valor p |
|---|---|---|---|---|
| Características basales y comorbilidades | ||||
| Edad (años) | 68,0 ± 17,8 | 64,1 ± 19,4 | 74,4 ± 12,4 | < 0,001 |
| Varones (%) | 1.246 (56,9) | 734 (54,2) | 507 (61,3) | < 0,001 |
| Hipertensión (%) | 1.150 (52,5) | 567 (41,6) | 583 (70,5) | < 0,001 |
| Diabetes (%) | 486 (22,2) | 184 (13,5) | 302 (33,5) | < 0,001 |
| Dislipemia (%) | 942 (43,0) | 183 (13,4) | 759 (91,8) | < 0,001 |
| Tabaquismo (%) | 239 (10,9) | 120 (8,8) | 119 (14,4) | < 0,001 |
| Obesidad (%) | 347 (15,8) | 197 (14,4) | 150 (18,1) | 0,022 |
| Enfermedad arterial periférica (%) | 181 (8,3) | 35 (2,6) | 146 (17,7) | < 0,001 |
| Ictus isquémico (%) | 171 (7,8) | 66 (4,8) | 105 (12,7) | < 0,001 |
| Enfermedad coronaria (%) | 183 (8,4) | 26 (1,9) | 157 (19,0) | < 0,001 |
| Fibrilación/flutter auricular (%) | 250 (11,4) | 112 (8,2) | 138 (16,7) | < 0,001 |
| EPOC (%) | 217 (9,9) | 104 (7,6) | 113 (13,7) | < 0,001 |
| Enfermedad renal crónicaa (%) | 166 (7,6) | 70 (5,1) | 96 (11,6) | < 0,001 |
| Cáncer (%) | 255 (11,6) | 140 (10,3) | 115 (13,9) | 0,010 |
| Tratamiento cardiovascular previo al ingreso hospitalario | ||||
| Anticoagulación (%) | 283 (12,9) | 126 (9,2) | 157 (19,0) | < 0,001 |
| Antiagregantes (%) | 392 (17,9) | 123 (9,0) | 269 (32,5) | < 0,001 |
| IECA o ARA II (%) | 865 (39,5) | 385 (28,2) | 480 (58,0) | < 0,001 |
| Antialdosterónico (%) | 87 (4,0) | 31 (2,3) | 56 (6,8) | < 0,001 |
| Sacubitrilo/valsartán (%) | 12 (0,6) | 1 (0,1) | 11 (1,3) | < 0,001 |
| Beta-bloqueante (%) | 355 (16,2) | 129 (9,5) | 226 (27,3) | < 0,001 |
| Diurético (%) | 569 (26,0) | 263 (19,3) | 306 (37,0) | < 0,001 |
| iSGLT-2 (%) | 34 (1,6) | 8 (0,6) | 26 (3,4) | < 0,001 |
| Digoxina (%) | 21 (1,0) | 10 (0,7) | 11 (1,3) | 0,164 |
| Primera toma de constantes vitales | ||||
| PAS (mmHg) | 129,1 ± 21,7 | 128,4 ± 21,2 | 130,1 ± 22,3 | 0,091 |
| Frecuencia cardíaca (lpm) | 92,7 ± 19,6 | 94,8 ± 20,3 | 89,4 ± 18,0 | < 0,001 |
| Primera SpO2 (%) | 91,2 ± 6,5 | 91,8 ± 6,0 | 90,2 ± 7,1 | < 0,001 |
| Soporte de O2 en el momento de la primera saturación (%) | 265 (12,1%) | 146 (10,7%) | 119 (14,4%) | 0,012 |
| Primera radiografía torácica | ||||
| Sin neumonía (%)Neumonía unilateral (%)Neumonía bilateral (%) | 298 (13,8)438 (20,3)1.422 (65,9) | 176 (12,9)275 (20,2)889 (65,2) | 122 (14,8)163 (19,7)533 (64,5) | 0,506 |
| Datos analíticos | ||||
| Mediana TFG (mL/min/1.73 m2) | 74,2 ± 21,6 | 78,1 ± 19,2 | 68,0 ± 23,7 | < 0,001 |
| Mediana de hemoglobina (g/dL) | 13,3 ± 1,8 | 13,5 ± 1,8 | 13,1 ± 1,9 | < 0,001 |
| Valor máximo de ferritina (ng/dL) | 729 (338-1.427) | 707 (313-1421) | 762 (372-1453) | 0,010 |
| Valor máximo de Dímero D (ng/mL) | 1.170 (600-3.875) | 1.062 (553-3.330) | 1.560 (746-4.407) | < 0,001 |
| Valor máximo de Troponina (ng/L) | 8.0 (2.8-34.9) | 6.2 (2.5-39.7) | 12.6 (5.2-48.3) | < 0,001 |
| Valor máximo de NT-proBNP (pg/mL) | 1149 (287-4.831) | 874 (178-3651) | 1.722 (440-6254) | < 0,001 |
| Valor máximo de lactato (mmol/L) | 2,45 ± 1,16 | 2,54 ± 1,24 | 2,36 ± 1,06 | 0,239 |
| Valor máximo de AST (UI/l) | 50 (33-83) | 47 (29-74) | 60 (39-93) | 0,023 |
| Valor máximo de ALT (UI/L) | 44 (25-87) | 45 (25-91) | 42 (24-78) | 0,276 |
| Valor máximo de LDH (UI/L) | 372 (299-486) | 365 (294-475) | 383 (308-505) | 0,004 |
| Valor máximo de CPK (UI/L) | 113 (66-230) | 90 (50-186) | 122 (77-251) | < 0,001 |
| Valor más bajo de actividad de protrombina (%) | 79,4 ± 24,5 | 81,5 ± 23,8 | 75,9 ± 25,3 | < 0,001 |
| Valor máximo de fibrinógeno (mg/dL) | 862,5 ± 264,1 | 841,9 ± 269,6 | 896,3 ± 251,4 | < 0,001 |
| Valor máximo de PCR (mg/L) | 124,6 (58,0-214,4) | 117,1 (51,6-207,8) | 140,2 (69,7-223,9) | < 0,001 |
| Valor máximo de IL-6 (pg/mL) | 58,1 (17,9-373,0) | 50,7 (18,1-330,0) | 72,7 (17,6-373,0) | 0,040 |
| Tratamiento específico para COVID-19 | ||||
| Hidroxicloroquina (%) | 1.997 (91,2) | 1.236 (90,6) | 761 (92,0) | 0,262 |
| Lopinavir/ritonavir (%) | 307 (14,0) | 193 (14,2) | 114 (13,8) | 0,812 |
| Azitromicina (%) | 1.252 (57,1) | 783 (57,4) | 469 (56,7) | 0,750 |
| Tocilizumab (%) | 223 (10,2) | 133 (9,8) | 90 (10,9) | 0,396 |
| Glucocorticoides (%) | 435 (19,9) | 240 (17,6) | 195 (23,6) | < 0,001 |
| Resultados clínicos | ||||
| Insuficiencia cardíaca aguda (%) | 76 (3,5) | 34 (2,5) | 42 (5,1) | < 0,001 |
| Embolia pulmonar (%) | 73 (3,3) | 45 (3,3) | 28 (3,4) | 0,913 |
| Evento trombóticob (%) | 112 (5,1) | 63 (4,6) | 49 (5,9) | 0,178 |
| Cualquier sangrado (%) | 86 (3,9) | 49 (3,6) | 37 (4,5) | 0,294 |
| Hemorragia mayorc (%) | 22 (1,0) | 10 (0,7) | 12 (1,5) | 0,102 |
| Fibrilación/flutter auricular durante el ingreso (%) | 83 (3,8) | 31 (2,3) | 52 (6,3) | < 0,001 |
| Arritmias ventriculares durante el ingreso (%) | 11 (0,5) | 7 (0,5) | 4 (0,5) | 1.000 |
| Ingreso en cuidados críticos (%) | 177 (8,1) | 93 (6,8) | 84 (10,2) | 0,004 |
| Ventilación mecánica (%) | 169 (7,7) | 86 (6,4) | 83 (10,2) | < 0,001 |
| Muerte (%) | 597 (27,3) | 303 (22,2) | 294 (35,5) | < 0,001 |
EPOC: enfermedad pulmonar obstructiva crónica; IECA: inhibidor de la enzima convertidora de angiotensina, ARA II: antagonista de los receptores de angiotensina II; iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2; PAS: presión arterial sistólica; SpO2: saturación de oxígeno; O2: oxígeno; TFG: tasa de filtrado glomerular; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; AST: aspartato aminotransferasa; ALT: alanina aminotransferasa; CPK: creatincinasa; PCR: proteína C reactiva; IL-6 interleucina 6.
La forma de presentación en pacientes con estatinas fue ligeramente más grave, con una saturación inicial de oxígeno inferior (90,2±7,1% vs. 91,8±6,0%; p < 0,001), aunque con similar prevalencia de neumonía bilateral (64,5 vs. 65,2%; p = 0,506).
Con respecto a los valores de laboratorio, la cohorte tratada con estatinas presentó un menor filtrado glomerular (68,0±23,7 vs. 78,1±19,2 mL/min; p < 0,001) y menores valores de hemoglobina. Los marcadores inflamatorios (ferritina, fibrinógeno, proteína C reactiva e IL-6) así como los biomarcadores cardíacos de estrés y daño miocárdico (NT-proBNP, troponina) y el dímero D fueron significativamente superiores. Los parámetros analíticos que pueden relacionarse con efectos adversos de las estatinas también estuvieron significativamente más elevados en los pacientes tratados previamente con estos fármacos (AST, LDH, CPK y menor actividad de protrombina).
El grupo con estatinas tuvo un mayor número de episodios de insuficiencia cardíaca aguda (5,1 vs. 2,5%; p < 0,001) y de fibrilación auricular/flutter no existente previamente (6,3 vs. 2,3%; p < 0,001) e igual sumatorio de eventos trombóticos (definido como la suma de trombosis venosa profunda, embolia de pulmón, síndrome coronario agudo, ictus e isquemia arterial aguda de MMII) que la cohorte sin estatinas (5,9 vs. 4,6%; p = 0,178).
Los pacientes con estatinas precisaron con mayor frecuencia ingreso en camas de críticos (10,2 vs. 6,8%; p = 0,004) y ventilación mecánica, así como una mortalidad superior (35,5 vs. 22,2%; p < 0,001). No obstante, al ajustar este antecedente por otros potenciales confusores (tabla suplementaria 1), no resultó un factor predictor independiente de muerte en el seguimiento [HR 0,95 (0,72-1,25)].
Pacientes hospitalizados por COVID-19 con y sin tratamiento hospitalario con estatinasUn total de 371 pacientes (16,9%) recibió al menos una dosis de estatina (69,5% de ellos atorvastatina con dosis media de 38,6±23,5 mg y 34% con simvastatina con dosis media de 23,0 ± 12,2 mg). Un total de 13 pacientes (3,5%) recibieron a lo largo del ingreso de forma no simultánea ambos tipos de estatinas.
La edad media del grupo que recibió estatinas fue de 73,6±11,9 años. Los factores de riesgo cardiovasculares, la aterosclerosis sistémica, manifestada como cardiopatía isquémica crónica, accidente cerebrovascular isquémico o enfermedad arterial periférica, comorbilidades asociadas, marcadores inflamatorios, biomarcadores cardíacos, así como los tratamientos cardiovasculares y fármacos específicos para la COVID-19 fueron significativamente superiores a las de los pacientes con COVID-19 hospitalizados que no recibieron estatinas (tabla 2). Nuevamente los parámetros analíticos vinculados con efectos adversos potenciales de las estatinas también estuvieron significativamente más elevados (AST, LDH, CPK, menor actividad de protrombina).
Características basales, tratamiento cardiovascular, constantes vitales, datos analíticos y resultados clínicos de los pacientes de acuerdo con el tratamiento hospitalario por COVID-19 con y sin estatinas
| Variable | Todos los pacientes (n = 2.191) | Sin estatinas durante la hospitalización (n = 1820) | Tratamiento hospitalario con estatinas (n = 371) | Valor p |
|---|---|---|---|---|
| Características basales y comorbilidades | ||||
| Edad (años) | 68,0 ± 17,8 | 66,9 ± 18,5 | 73,6 ± 11,9 | < 0,001 |
| Varones (%) | 1.246 (56,9) | 1.016 (55,8) | 230 (62,0) | 0,029 |
| Hipertensión (%) | 150 (52,5) | 892 (49,0) | 258 (69,5) | < 0,001 |
| Diabetes (%) | 486 (22,2) | 360 (19,8) | 26 (34,0) | < 0,001 |
| Dislipemia (%) | 942 (43,0) | 620 (34,1) | 322 (86,8) | < 0,001 |
| Tabaquismo (%) | 239 (0,9) | 184 (10,1) | 55 (14,8) | 0,008 |
| Obesidad (%) | 347 (15,8) | 275 (15,1) | 72 (19,4) | 0,039 |
| Enfermedad arterial periférica (%) | 181 (8,3) | 114 (6,3) | 67 (18,1) | < 0,001 |
| Ictus isquémico (%) | 171 (7,8) | 131 (7,2) | 40 (10,8) | 0,017 |
| Enfermedad coronaria (%) | 183 (8,4) | 105 (5,8) | 78 (21,0) | < 0,001 |
| Fibrilación/flutter auricular (%) | 250 (11,4) | 184 (10,1) | 66 (17,8) | < 0,001 |
| EPOC (%) | 217 (9,9) | 168 (9,2) | 49 (13,2) | 0,019 |
| Enfermedad renal crónicaa (%) | 166 (7,6) | 127 (7,0) | 39 (10,5) | 0,019 |
| Cáncer (%) | 255 (11,6) | 212 (11,7) | 43 (11,6) | 0,975 |
| Tratamiento cardiovascular previo al ingreso hospitalario | ||||
| Anticoagulación (%) | 283 (12,9) | 202 (11,1) | 81 (21,8) | < 0,001 |
| Antiagregantes (%) | 392 (17,9) | 277 (15,2) | 115 (31,0) | < 0,001 |
| IECA o ARA II (%) | 865 (39,5) | 653 (35,9) | 212 (57,1) | < 0,001 |
| Antialdosterónico (%) | 87 (4,0) | 60 (3,3) | 27 (7,3) | < 0,001 |
| Sacubitrilo/valsartán (%) | 12 (0,6) | 6 (0,3) | 6 (1,6) | 0,008 |
| Beta-bloqueante (%) | 355 (16,2) | 245 (13,5) | 110 (29,7) | < 0,001 |
| Diurético (%) | 569 (26,0) | 420 (23,1) | 149 (40,2) | < 0,001 |
| iSGLT-2 (%) | 34 (1,6) | 22 (1,2) | 12 (3,2) | 0,004 |
| Digoxina (%) | 21 (1,0) | 15 (0,8) | 6 (1,6) | 0,153 |
| Estatinas (%) | 769 (35,1) | 456 (25,1) | 313 (84,4) | < 0,001 |
| Primera toma de constantes vitales | ||||
| PAS (mmHg) | 129,1 ± 21,7 | 128,8 ± 21,6 | 130,1 ± 22,1 | 0,327 |
| Frecuencia cardíaca (lpm) | 92,7 ± 19,6 | 93,5 ± 19,7 | 89,1 ± 18,5 | < 0,001 |
| Primera SpO2 (%) | 91,2 ± 6,5 | 91,4 ± 6,3 | 90,5 ± 7,4 | 0,019 |
| Soporte de O2 en el momento de la primera saturación (%) | 265 (12,1) | 204 (11,2) | 61 (16,4) | 0,007 |
| Primera radiografía torácica | ||||
| Sin neumonía (%)Neumonía unilateral (%)Neumonía bilateral (%) | 298 (13,8)438 (20,3)422 (65,9) | 240 (13,4)377 (21,1)173 (65,5) | 58 (15,8)61 (16,6)249 (67,7) | 0,108 |
| Datos analíticos | ||||
| Mediana TFG (mL/min/1,73 m2) | 74,2 ± 21,6 | 75,3 ± 21,2 | 69,4 ± 22,9 | < 0,001 |
| Mediana de hemoglobina (g/dL) | 13,3 ± 1,8 | 13,4 ± 1,8 | 12,9 ± 1,9 | < 0,001 |
| Valor máximo de ferritina (ng/dL) | 729 (338-1427) | 675 (310-1368) | 971 (508-1573) | 0,027 |
| Valor máximo de dímero D (ng/mL) | 1.170 (600-3875) | 1.084 (571-3337) | 1.912 (809-10400) | 0,011 |
| Valor máximo de Troponina (ng/L) | 8,0 (2,8-34,9) | 6,5 (2,5-24,3) | 20,4 (5,9-91,6) | 0,003 |
| Valor máximo de NT-proBNP (pg/mL) | 1.149 (287-4831) | 1.016 (249-4243) | 1.762 (499-7917) | 0,002 |
| Valor máximo de lactato (mmol/L) | 2,45 ± 1,16 | 2,54 ± 1,22 | 2,20 ± 0,9 | 0,066 |
| Valor máximo de AST (UI/L) | 50 (33-83) | 49 (32-81) | 54.4 (38-95) | < 0,001 |
| Valor máximo de ALT (UI/L) | 44 (25-87) | 40 (22-81) | 49 (31-93) | < 0,001 |
| Valor máximo de LDH (UI/L) | 372 (299-486) | 363 (294-475) | 407 (332-528) | < 0,001 |
| Valor máximo de CPK (UI/L) | 113 (66-230) | 110 (65-215) | 132 (69-342) | < 0,001 |
| Valor más bajo de actividad de protrombina (%) | 79,4 ± 24,5 | 80,5 ± 24,1 | 74,1 ± 6,1 | < 0,001 |
| Valor máximo de fibrinógeno (mg/dL) | 862,5 ± 264,1 | 852,4 ± 265,6 | 911,2 ± 251,3 | < 0,001 |
| Valor máximo de PCR (mg/L) | 124,6 (58,0-214,4) | 120,0 (54,2-209,1) | 149,3 (70,2-240,1) | < 0,001 |
| Valor máximo de IL-6 (pg/mL) | 58,1 (17,9-373,0) | 54,6 (17,7-326,0) | 69,9 (18,6-426,5) | 0,003 |
| Tratamiento específico para COVID-19 | ||||
| Hidroxicloroquina (%) | 1.997 (91,2) | 1.641 (90,2) | 356 (96,0) | < 0,001 |
| Lopinavir/ritonavir (%) | 307 (14,0) | 267 (14,7) | 40 (10,8) | 0,049 |
| Azitromicina (%) | 1.252 (57,1) | 1.021 (56,1) | 231 (62,3) | 0,029 |
| Tocilizumab (%) | 223 (10,2) | 174 (9,6) | 49 (13,2) | 0,034 |
| Glucocorticoides (%) | 435 (19,9) | 334 (18,4) | 101 (27,2) | < 0,001 |
| Resultados clínicos | ||||
| Insuficiencia cardíaca aguda (%) | 76 (3,5) | 62 (3,4) | 14 (3,8) | 0,725 |
| Embolia pulmonar (%) | 73 (3,3) | 52 (2,9) | 21 (5,7) | 0,006 |
| Evento trombóticob (%) | 112 (5,1) | 78 (4,3) | 34 (9,2) | < 0,001 |
| Cualquier sangrado (%) | 86 (3,9) | 62 (3,4) | 24 (6,5) | 0,004 |
| Hemorragia mayorc (%) | 22 (1,0) | 11 (0,6) | 11 (3,0) | < 0,001 |
| Fibrilación/flutter auricular durante el ingreso (%) | 83 (3,8) | 57 (3,1) | 26 (7,0) | < 0,001 |
| Arritmias ventriculares durante el ingreso (%) | 11 (0,5) | 9 (0,5) | 2 (0,5) | 0,500 |
| Ingreso en cuidados críticos (%) | 177 (8,1) | 122 (6,7) | 55 (14,8) | < 0,001 |
| Ventilación mecánica (%) | 169 (7,7) | 115 (6,3) | 54 (14,6) | < 0,001 |
| Muerte (%) | 597 (27,3) | 470 (25,8) | 127 (34,2) | 0,001 |
EPOC: enfermedad pulmonar obstructiva crónica; IECA: inhibidor de la enzima convertidora de angiotensina, ARA II: antagonista de los receptores de angiotensina II; iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2; PAS: presión arterial sistólica; SpO2: saturación de oxígeno; O2: oxígeno; TFG: tasa de filtrado glomerular; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; AST: aspartato aminotransferasa; ALT: alanina aminotransferasa; CPK: creatincinasa; PCR: proteína C reactiva; IL-6 interleucina 6.
Existió mayor tendencia a ingresar en unidad de críticos (14,8 vs. 6,7%; p < 0,001) y ventilación mecánica (14,6 vs. 6,3%; p < 0,001). Con respecto al análisis de la mortalidad en el grupo con infección COVID-19 y administración de estatinas, fue muy alta y significativamente superior a quienes no las recibieron (34,2 vs. 25,8%; p = 0,001).
Un análisis multivariable ajustado por todas las covariables relevantes (tabla suplementaria 2) mostró que el tratamiento con estatinas durante el ingreso no resultó un factor independiente de mortalidad [HR 1,03 (0,78-1,35)].
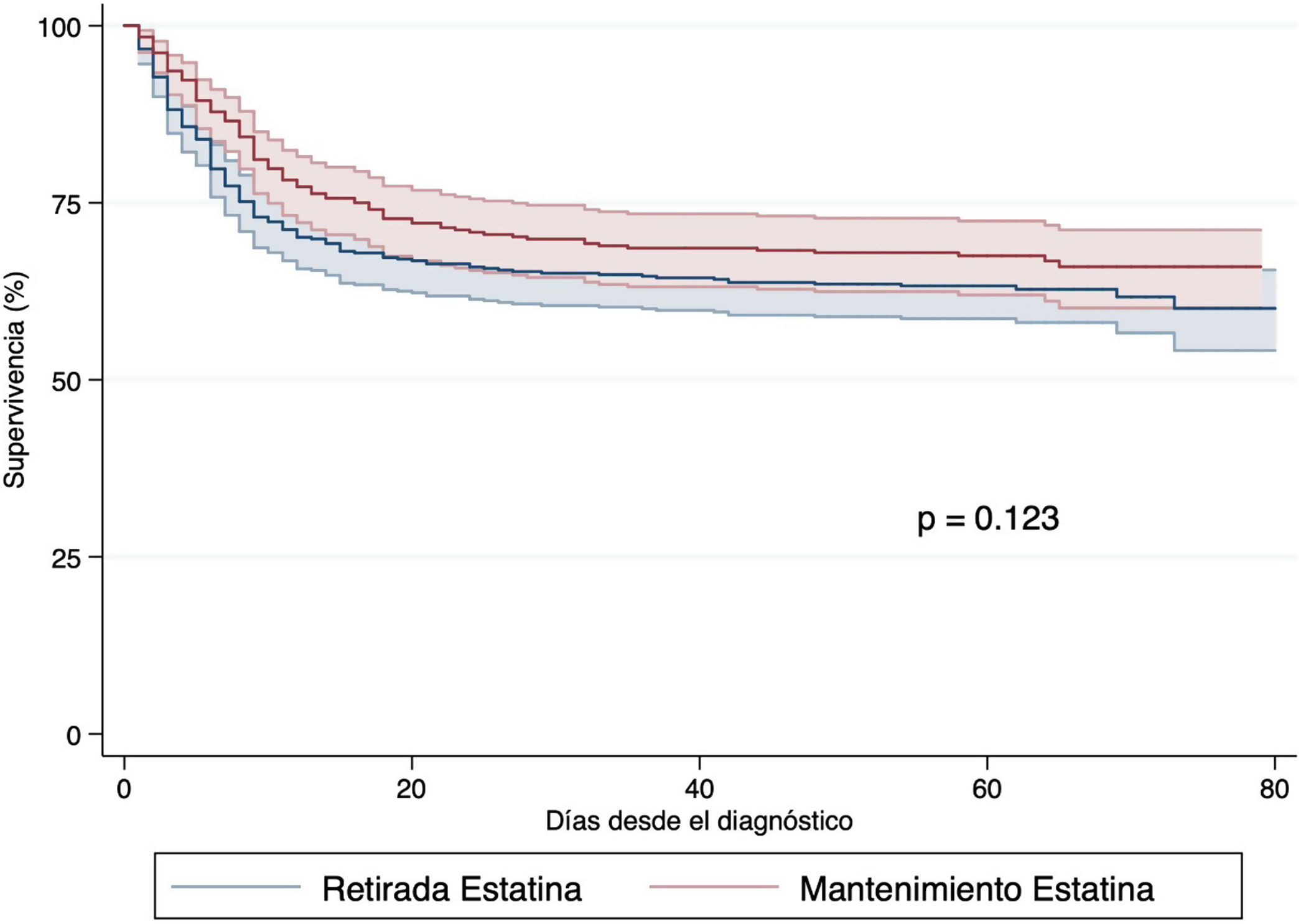
Impacto de la retirada de estatinas en pacientes con COVID-19Con respecto a la retirada de estatinas, un total de 456 (55,1%) pacientes previamente medicados con estos fármacos no las recibieron durante el ingreso. Las diferencias entre pacientes que discontinuaron y los que mantuvieron el tratamiento con estatinas se expone en la tabla 3. No existieron diferencias relevantes en cuanto a las características basales de los dos grupos. Las diferencias analíticas sí muestran diferencias significativas en parámetros vinculados con los efectos adversos de las estatinas (AST, ALT, LDH, CPK), en el grupo que las recibe durante el ingreso hospitalario. En los pacientes en los que se mantuvo el tratamiento con estatinas, ocurrieron más eventos trombóticos, incluida la embolia de pulmón y más hemorragias. Mayor tendencia asimismo a ingresar en unidad de críticos (14,8 vs. 6,4%; p < 0,001), pero sin diferencia en mortalidad (34,2 vs. 36,6%; p = 0,469). El análisis de supervivencia usando técnicas de Kaplan-Meier (p = 0,123, según el test log-rank, fig. 2) y regresión de Cox (tabla suplementaria 3), mostró que su interrupción no llevó asociada una mayor incidencia de mortalidad [HR 1,01 (0,78-1,30)].
Características basales, tratamiento cardiovascular, constantes vitales, datos analíticos y resultados clínicos de los pacientes de acuerdo a la retirada o no de las estatinas durante el ingreso hospitalario por COVID-19
| Variable | Todos los pacientes con tratamiento crónico con estatinas(n = 827) | Retirada hospitalaria de estatinas (n = 456) | Mantenimiento de estatinas en el ingreso (n = 371) | p |
|---|---|---|---|---|
| Características basales y comorbilidades | ||||
| Edad (años) | 74,4 ± 12,4 | 75,1 ± 12,7 | 73,6 ± 11,9 | 0,081 |
| Varones (%) | 507 (61,3) | 277 (60,8) | 230 (62,0) | 0,714 |
| Hipertensión (%) | 583 (70,5) | 325 (71,3) | 258 (69,5) | 0,560 |
| Diabetes (%) | 302 (36,5) | 176 (38,6) | 126 (34,0) | 0,119 |
| Dislipemia (%) | 759 (91,8) | 437 (95,8) | 322 (86,8) | < 0,001 |
| Tabaquismo (%) | 119 (14,4) | 64 (14,0) | 55 (14,8) | 0,748 |
| Obesidad (%) | 150 (18,1) | 78 (7,1) | 72 (19,4) | 0,393 |
| Enfermedad arterial periférica (%) | 146 (17,7) | 79 (17,3) | 67 (18,1) | 0,795 |
| Ictus isquémico (%) | 105 (12,7) | 65 (14,3) | 40 (10,8) | 0,136 |
| Enfermedad coronaria (%) | 157 (19,0) | 79 (17,3) | 78 (21,0) | 0,183 |
| Fibrilación/flutter auricular (%) | 138 (16,7) | 72 (15,8) | 66 (17,8) | 0,443 |
| EPOC (%) | 113 (13,7) | 64 (14,0) | 49 (13,2) | 0,730 |
| Enfermedad renal crónicaa (%) | 96 (11,6) | 57 (12,5) | 39 (10,5) | 0,375 |
| Cáncer (%) | 115 (13,9) | 72 (15,8) | 43 (11,6) | 0,083 |
| Tratamiento cardiovascular previo al ingreso hospitalario | ||||
| Anticoagulación (%) | 157 (19,0) | 76 (16,7) | 81 (21,8) | 0,056 |
| Antiagregantes (%) | 269 (32,5) | 154 (33,8) | 115 (31,0) | 0,397 |
| IECA o ARA II (%) | 480 (58,0) | 268 (58,8) | 212 (57,1) | 0,637 |
| Antialdosterónico (%) | 56 (6,8) | 29 (6,4) | 27 (7,3) | 0,601 |
| Sacubitrilo/valsartán (%) | 11 (1,3) | 5 (1,1) | 6 (1,6) | 0,555 |
| Beta-bloqueante (%) | 226 (27,3) | 116 (25,4) | 110 (29,7) | 0,177 |
| Diurético (%) | 306 (37,0) | 157 (34,4) | 149 (40,2) | 0,090 |
| iSGLT-2 (%) | 26 (3,1) | 14 (3,1) | 12 (3,2) | 0,893 |
| Digoxina (%) | 11 (1,3) | 5 (1,1) | 6 (1,6) | 0,555 |
| Primera toma de constantes vitales | ||||
| PAS (mmHg) | 130,1 ± 22,3 | 130,1 ± 22,5 | 130,1 ± 22,1 | 0,995 |
| Frecuencia cardíaca (lpm) | 89,4 ± 18,0 | 89,7 ± 17,6 | 89,1 ± 18,5 | 0,681 |
| Primera SpO2 (%) | 90,2 ± 7,1 | 90,0 ± 6,9 | 90,5 ± 7,4 | 0,293 |
| Soporte de O2 en el momento de la primera saturación (%) | 119 (14,4) | 58 (12,7) | 61 (16,4) | 0,154 |
| Primera radiografía torácica | ||||
| Sin neumonía (%)Neumonía unilateral (%)Neumonía bilateral (%) | 122 (14,8)163 (19,7)533 (64,5) | 64 (14,0)102 (22,4)284 (62,3) | 58 (15,6)61 (16,4)249 (67,1) | 0,094 |
| Datos analíticos | ||||
| Mediana TFG (mL/min/1,73 m2) | 68,0 ± 23,7 | 66,8 ± 24,3 | 69,4 ± 22,9 | 0,125 |
| Mediana de hemoglobina (g/dL) | 13,1 ± 1,9 | 13,3 ± 1,8 | 12,9 ± 1,9 | < 0,001 |
| Valor máximo de ferritina (ng/dL) | 816 (391-1.482) | 699 (311-1.297) | 971 (508-1.573) | < 0,001 |
| Valor máximo de Dímero D (ng/mL) | 1.629 (761-4.989) | 1.383 (682-4.030) | 1.912 (809-10.400) | 0,003 |
| Valor máximo de Troponina (ng/L) | 14,0 (5,3-59,5) | 8,6 (4,2-30,8) | 20,4 (5,9-91,6) | < 0,001 |
| Valor máximo de NT-proBNP (pg/mL) | 1.857 (513-6.984) | 1.952 (513-6.254) | 1.762 (499-7.917) | 0,991 |
| Valor máximo de lactato (mmol/L) | 2,36 ± 1,06 | 2,54 ± 1,20 | 2,20 ± 0,91 | 0,087 |
| Valor máximo de AST (UI/L) | 52 (35-87) | 49 (31-82) | 55 (38-95) | 0,002 |
| Valor máximo de ALT (UI/L) | 43 (24-79) | 40 (23-69) | 46 (28-88) | < 0,001 |
| Valor máximo de LDH (UI/L) | 386,5 (312,0-512,0) | 370,5 (302,5-492,9) | 406,5 (332,0-528,0) | 0,002 |
| Valor máximo de CPK (UI/L) | 122 (69-277) | 116 (69-229) | 132 (69-342) | 0,035 |
| Valor más bajo de actividad de protrombina (%) | 75,9 ± 25,3 | 77,5 ± 24,6 | 74,1 ± 26,1 | 0,062 |
| Valor máximo de fibrinógeno (mg/dL) | 896,3 ± 251,4 | 883,9 ± 251,1 | 911,2 ± 251,3 | 0,124 |
| Valor máximo de PCR (mg/L) | 145,3 (71,4-228,0) | 140,4 (71,6-219,1) | 149,3 (70,2-240,1) | 0,134 |
| Valor máximo de IL-6 (pg/mL) | 75,9 (18,6-409,5) | 79,6 (18,8-404,5) | 69,9 (18,6-426,5) | 0,119 |
| Tratamiento específico para COVID-19 | ||||
| Hidroxicloroquina (%) | 761 (92,0) | 405 (88,8) | 356 (96,0) | < 0,001 |
| Lopinavir/ritonavir (%) | 114 (13,8) | 74 (16,2) | 40 (10,8) | 0,024 |
| Azitromicina (%) | 469 (56,7) | 238 (52,2) | 231 (62,3) | 0,004 |
| Tocilizumab (%) | 90 (10,9) | 41 (9,0) | 49 (13,2) | 0,053 |
| Glucocorticoides (%) | 195 (23,6) | 94 (20,6) | 101 (27,2) | 0,026 |
| Resultados clínicos | ||||
| Insuficiencia cardíaca aguda (%) | 42 (5,1) | 28 (6,1) | 14 (3,8) | 0,123 |
| Embolia pulmonar (%) | 28 (3,4) | 7 (1,5) | 21 (5,7) | < 0,001 |
| Evento trombóticob (%) | 49 (5,9) | 15 (3,3) | 34 (9,2) | < 0,001 |
| Cualquier sangrado (%) | 37 (4,5) | 13 (2,9) | 24 (6,5) | 0,010 |
| Hemorragia mayorc (%) | 12 (1,5) | 1 (0,2) | 11 (3,0) | 0,002 |
| Fibrilación/flutter auricular durante el ingreso (%) | 52 (6,3) | 26 (5,7) | 26 (7,0) | 0,441 |
| Arritmias ventriculares durante el ingreso (%) | 4 (0,5) | 2 (0,4) | 2 (0,5) | 1.000 |
| Ingreso en cuidados críticos (%) | 84 (10,2) | 29 (6,4) | 55 (14,8) | < 0,001 |
| Ventilación mecánica (%) | 83 (10,0) | 29 (6,4) | 50 (14,6) | < 0,001 |
| Muerte (%) | 294 (35,6) | 167 (36,6) | 127 (34,2) | 0,469 |
EPOC: enfermedad pulmonar obstructiva crónica; IECA: inhibidor de la enzima convertidora de angiotensina, ARA II: antagonista de los receptores de angiotensina II; iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2; PAS: presión arterial sistólica; SpO2: saturación de oxígeno; O2: oxígeno; TFG: tasa de filtrado glomerular; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; AST: aspartato aminotransferasa; ALT: alanina aminotransferasa; CPK: creatincinasa; PCR: proteína C reactiva; IL-6 interleucina 6.
Análisis de supervivencia según la interrupción o no de estatinas durante el ingreso hospitalario por COVID-19 según el método de Kaplan-Meier en pacientes que tenían tratamiento crónico con dichos fármacos. La interrupción de las mismas no llevó asociada una mayor incidencia de mortalidad [HR 1,01 (0,78-1,30)].
Durante el periodo del estudio, excluyendo aquellos pacientes con cuadros de isquemia arterial aguda, 19 pacientes (0,9%) presentaron elevación de CPK 10 veces por encima del límite superior de la normalidad, que es el punto de corte clásico para definir la presencia de rabdomiolisis. La proporción de pacientes con dicha entidad fue significativamente mayor en el grupo de pacientes tratados con estatinas (1,9 vs. 0,66%, p < 0,020). Por otra parte, 282 pacientes (12,9%) presentaron elevación clínicamente relevante de AST (definida habitualmente como el aumento de dicho parámetro tres veces por encima del límite superior de la normalidad). De igual forma, dicho efecto adverso fue más prevalente en pacientes que recibieron estatinas durante el ingreso (17,8 vs. 11,9%, p < 0,002).
DiscusiónLa hipótesis de que las estatinas a través de sus efectos inmunomoduladores7–9 puedan contrarrestar los efectos deletéreos de la exacerbada respuesta inflamatoria conocida como tormenta de citoquinas10 que característicamente presentan los pacientes con COVID-19 con peor evolución clínica, es una idea sugerente, pero que no ha sido clínicamente demostrada en ensayos clínicos aleatorizados.
Esta respuesta inmune exagerada, que daña los órganos que inicialmente pretende proteger, es la principal causa del distrés respiratorio10 de estos pacientes y del daño en el sistema vascular11. Esta fisiopatología no es nueva y tiene muchas similitudes con la existente en otras infecciones bacterianas y víricas causantes de neumonía12.
Algunos estudios observacionales realizados en pacientes ingresados por neumonía y/o gripe, sugieren que el tratamiento con estatinas asocia un menor número de complicaciones cardiovasculares y reducción de la severidad de la enfermedad en comparación con los pacientes que no la tomaban9,13. Podríamos pensar que no hay razón de peso para imaginar que con la COVID-19 vaya a ser diferente, sin embargo, la situación no resulta totalmente análoga. De hecho, lo más característico y principal causa de muerte de los pacientes con COVID-19 es el grave distrés respiratorio que produce3. En un estudio aleatorizado que valoró el empleo de rosuvastatina por su potencial antiinflamatorio en pacientes con distrés respiratorio agudo, causado en su gran mayoría por una neumonía, se concluyó que no disminuía la mortalidad frente a placebo14.
En un metaanálisis15 que combinó los resultados de cuatro estudios observacionales sobre los efectos de las estatinas en pacientes con COVID-19, los autores concluyeron que pueden reducir el riesgo de mortalidad o complicaciones severas en un 30% y que su tolerabilidad es aceptable. Por otro lado, el registro SEMI-COVID de la Sociedad Española de Medicina Interna identificó que la continuación del tratamiento con estatinas se asoció con una menor mortalidad por todas las causas en comparación con aquellos cuya terapia se retiró durante la hospitalización tras la infección por SARS-CoV-216.
No obstante, es necesario considerar que a lo largo de la pandemia se han planteado varias alternativas terapéuticas a partir de los datos esperanzadores obtenidos en múltiples estudios observacionales17–19, posteriormente desmentidos en los correspondientes ensayos clínicos aleatorizados. Nuestro análisis introduce una nota discordante con los hallazgos previamente descritos, ya que el grupo tratado con estatinas, aunque presentó un mayor número de ingresos en camas de críticos y más necesidad de ventilación mecánica, al realizar un análisis multivariable ajustado por todos los potenciales confusores no presentó diferencias significativas en mortalidad [HR 1,03 (0,78-1,35), p = 0,850]. Dicho análisis apunta que el empleo de estatinas durante la fase aguda de la infección puede tener un efecto neutro en el objetivo clínico de muerte por cualquier causa.
Además, nuestros datos no muestran señales que orienten a que el uso de estatinas pueda redundar en una reducción de las complicaciones cardiovasculares de la infección por SARS-CoV-2. A pesar de que existen varios trabajos que han puesto de manifiesto la influencia del endotelio20 y de los fenómenos de inmunotrombosis en estos pacientes21–23, aquellos que recibieron estatinas (fármacos considerados endotelio-protectores) durante el ingreso presentaron más eventos trombóticos y hemorrágicos durante el curso de la enfermedad. Es probable que ello esté en relación con el hecho de que precisamente estos pacientes tienen enfermedad cardiovascular ateroesclerótica, cuyo primer estadio evolutivo es la disfunción endotelial. Resulta plausible que la arteriosclerosis constituya una situación de vulnerabilidad cardiovascular frente a la infección por SARS-CoV-2, que no resulte modificable por el hecho de recibir estatinas durante la fase aguda, a diferencia de los marcados beneficios observados en prevención secundaria en otros contextos clínicos24. No obstante, el reducido número de complicaciones arteriales trombóticas registrado durante el seguimiento limita la capacidad de obtener conclusiones definitivas.
En relación con lo anterior, los pacientes con estatinas presentaron niveles más elevados de marcadores inflamatorios, como PCR, ferritina, fibrinógeno o IL-6. Ello plantea la hipótesis de que el efecto antiinflamatorio de las estatinas pueda no ser lo suficientemente potente como para regular al menos parcialmente la tormenta de citoquinas de la COVID-19. Una situación análoga se produce en otras entidades caracterizadas principalmente por la inflamación, como la artritis reumatoide. En dicha enfermedad este grupo terapéutico disminuye modestamente los parámetros de inflamación7 y sin embargo no se consideran útiles para su tratamiento.
Las estatinas son fármacos bien tolerados y con escasos efectos adversos. De entre ellos, la miopatía constituye el más relevante a nivel clínico. La forma más leve de este trastorno es la mialgia sin elevación de creatincinasa (CPK), que no hemos podido valorar específicamente al solaparse con los síntomas propios del paciente con COVID-19 (en una cohorte de gran tamaño de pacientes con COVID-19 en nuestro medio, un 26,8% de pacientes refirieron síntomas sugestivos de mialgia al ingreso)25. En nuestra muestra, tanto la elevación significativa de transaminasas como la rabdomiolisis resultaron más frecuentes en pacientes tratados con estatinas.
En relación con lo anterior, la actividad de protrombina también se encontraba significativamente más reducida en este grupo de pacientes, lo que asociado a una mayor incidencia de eventos trombóticos y hemorrágicos genera la hipótesis de que dicho grupo terapéutico pueda incrementar la probabilidad de coagulopatía a lo largo del curso clínico de la enfermedad.
A lo largo de la pandemia, varias sociedades científicas26,27 han recomendado mantener el tratamiento con estatinas en aquellos pacientes que las estuvieran recibiendo a partir de una indicación clínicamente correcta. En este sentido, los resultados neutros de nuestro estudio son compatibles con esta recomendación, aunque no constituyen un sustento para comenzar el fármaco de novo con el objetivo de mejorar el pronóstico de la COVID-19, salvo en estudios de investigación específicamente diseñados para probar su eficacia. Por otra parte, el curso clínico incierto de la enfermedad, las interacciones con otros tratamientos y los indicios de potenciales efectos adversos de las estatinas en este contexto clínico aconsejan un uso prudente de este grupo terapéutico y una monitorización estrecha de las posibles complicaciones.
Se trata de un estudio retrospectivo observacional, con las limitaciones y sesgos habituales de este tipo de diseños, realizado en un único centro que ha atendido a un elevado volumen de pacientes con COVID-19. El presente estudio observacional no puede en modo alguno sustituir a un ensayo clínico aleatorizado que aclare si las estatinas son o no eficaces en el contexto de una infección por SARS-CoV-2. Los resultados, por tanto, no son definitivos. Además, no se registró sistemáticamente en todos los pacientes de la cohorte la presencia de mialgias (el efecto adverso más común de las estatinas), ni en todos se determinaron analíticamente los valores de CPK y transaminasas, lo que puede condicionar de alguna manera un sesgo de selección.
En conclusión, en nuestra cohorte, las estatinas no se asociaron de forma independiente con una menor mortalidad en pacientes con COVID-19. Aquellos pacientes que recibieron estatinas durante el ingreso hospitalario presentaron parámetros inflamatorios más elevados, además de un número mayor de eventos trombóticos y hemorrágicos.
Consideraciones éticasEl estudio fue aprobado por el Comité Ético de Investigación Clínica de nuestro centro de acuerdo con las normas éticas establecidas en la Declaración de Helsinki del 1964 y sus modificaciones posteriores. Con base en la legislación nacional para situaciones de alarma sanitaria, no se requirió cumplimentar un documento de consentimiento informado.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesJosé Luis Merino ha recibido honorarios de Bayer, Correvio, Daiichi-Sankyo y Sanofi, sin relación con el trabajo presentado. Esteban López-de-Sá ha recibido honorarios de Zoll Medical Corporation, Boehringer Ingelheim, Servier, Daiichi Sankyo, Rovi, BARD y AstraZeneca, sin relación con el trabajo presentado.







![Análisis de supervivencia según la interrupción o no de estatinas durante el ingreso hospitalario por COVID-19 según el método de Kaplan-Meier en pacientes que tenían tratamiento crónico con dichos fármacos. La interrupción de las mismas no llevó asociada una mayor incidencia de mortalidad [HR 1,01 (0,78-1,30)]. Análisis de supervivencia según la interrupción o no de estatinas durante el ingreso hospitalario por COVID-19 según el método de Kaplan-Meier en pacientes que tenían tratamiento crónico con dichos fármacos. La interrupción de las mismas no llevó asociada una mayor incidencia de mortalidad [HR 1,01 (0,78-1,30)].](https://static.elsevier.es/multimedia/00257753/0000015800000012/v2_202206152104/S0025775321004310/v2_202206152104/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
