La insuficiencia cardíaca y la diabetes mellitus tipo 2 (DM2) son enfermedades crónicas que concurren con frecuencia en un mismo paciente. La DM2 es un reconocido factor de riesgo para el desarrollo de insuficiencia cardíaca y se asocia a una mayor morbimortalidad. Algunos estudios han puesto de manifiesto que, a su vez, los pacientes con insuficiencia cardíaca también tienen un riesgo aumentado de desarrollar DM2, aunque esta relación causal ha sido menos evaluada y los mecanismos que explican esta asociación no están totalmente aclarados. Hemos realizado una revisión de las evidencias disponibles que relacionan la insuficiencia cardíaca con la resistencia a la insulina y con el desarrollo de DM2, y de los posibles mecanismos implicados en esta asociación, entre los que cabe destacar la hiperactivación simpática, el aumento de la concentración de ácidos grasos libres circulantes y la resistencia a la adiponectina.
Heart failure and diabetes are chronic conditions that frequently concur in the same patient. DM2 is a known risk factor for the development of heart failure and is related with a worse outcome. Some studies have found that heart failure is also associated with a greater incidence of diabetes. This relationship has been less studied and the mechanisms underneath this association are not fully understood. We have done a review of the literature in search for studies that evaluate the relationship between heart failure, insulin resistance and the development of type 2 diabetes, as well as the possible mechanisms leading to this situation, such as sympathetic hyperactivation, increased concentration of free fatty acids and adiponectin resistance.
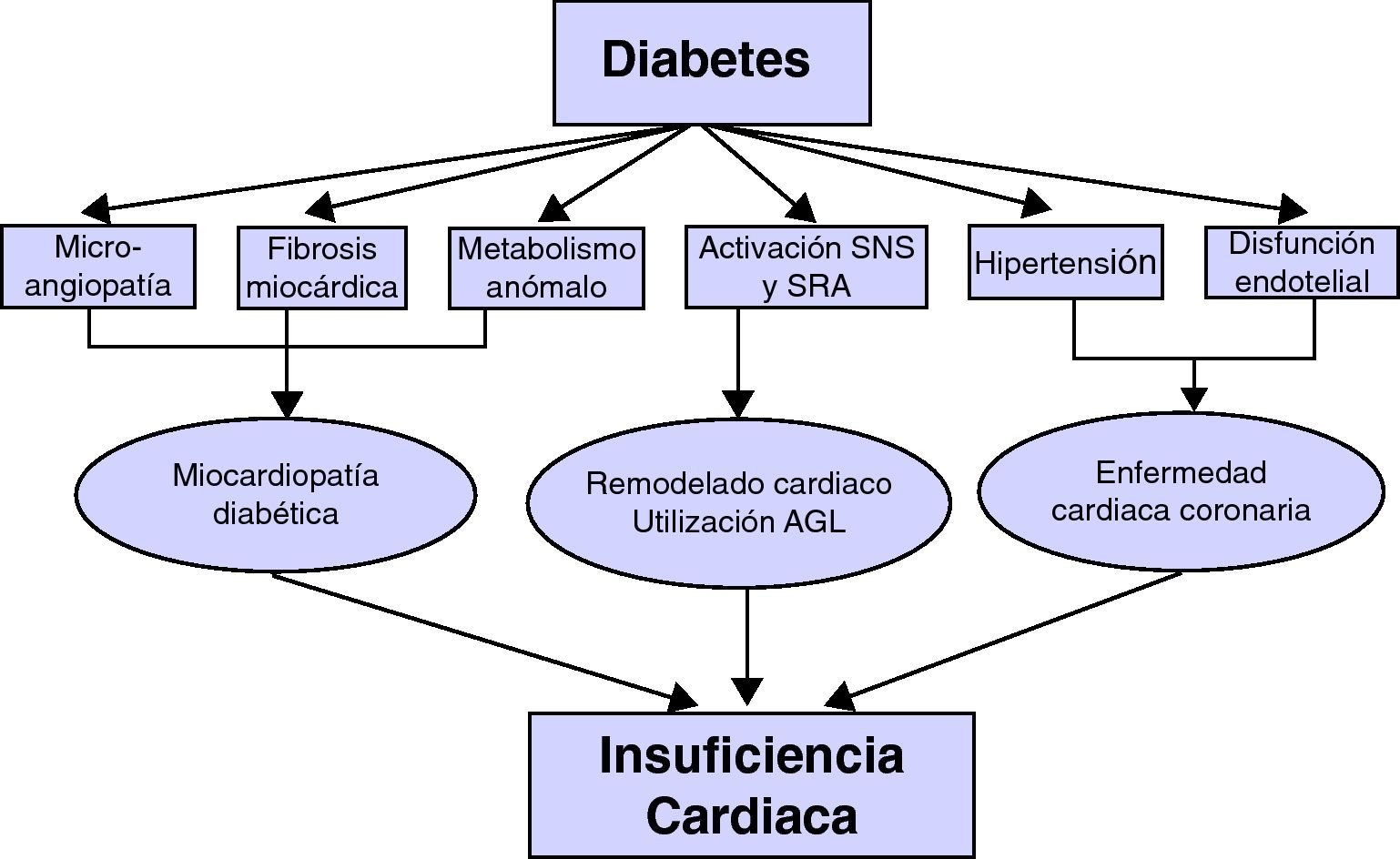
La insuficiencia cardíaca y la diabetes mellitus tipo 2 (DM2) son enfermedades crónicas que concurren con frecuencia en un mismo paciente1,2. La DM2 es un reconocido factor de riesgo para el desarrollo de insuficiencia cardíaca y dicho riesgo aumenta de forma proporcional cuanto peor sea el grado de control metabólico2,3. Más aun, la condición de diabético se asocia a una mayor morbimortalidad en los pacientes con insuficiencia cardíaca4–6. En la figura 1 se muestran varios de los mecanismos fisiopatológicos que relacionan la diabetes con el desarrollo de la insuficiencia cardíaca7–10. Por otra parte, algunos estudios han puesto de manifiesto que, a su vez, los pacientes con insuficiencia cardíaca también tienen un riesgo aumentado de desarrollar DM211–16. Esta relación causal ha sido menos evaluada y los mecanismos que explican esta asociación no están totalmente aclarados. Dada la alta prevalencia de la insuficiencia cardíaca y su elevada morbimortalidad, hemos considerado de interés revisar las evidencias disponibles que relacionan la insuficiencia cardíaca con la resistencia a la insulina y con el desarrollo de DM2.
Diferentes estudios han descrito un aumento en la incidencia de DM2 en los pacientes con insuficiencia cardíaca que en situación basal eran normoglucémicos. La primera demostración del riesgo elevado de desarrollar diabetes fue realizada por Amato et al. en un estudio longitudinal de pacientes geriátricos con insuficiencia cardíaca11. El desarrollo de DM2 durante los 3 años de seguimiento fue del 18,3 y del 28,8% (p < 0,001) en los controles y en los pacientes con insuficiencia cardíaca, respectivamente. La insuficiencia cardíaca fue un factor de riesgo para el desarrollo de DM2 independientemente de la edad, el sexo, el índice de masa corporal o el tratamiento farmacológico de la insuficiencia cardíaca, con un riesgo relativo (RR) ajustado por edad de 1,4 (intervalo de confianza del 95% [IC 95%] 1,1-1,8). Con posterioridad, un subanálisis del estudio SOLVD (Studies On Left Ventricular Dysfunction) detectó una incidencia de DM2 durante un seguimiento medio de 3 años del 5,9% en el grupo tratado con enalapril y de 22,4% en el grupo placebo (RR 0,26; p<0,001)15. Estos resultados coinciden con los aportados más recientemente por el estudio COMET (Carvedilol or Metoprolol European Trial), ensayo clínico aleatorizado que comparaba el uso de carvedilol con metoprolol para el tratamiento de la insuficiencia cardíaca crónica asociada a disfunción ventricular sistólica13. En este estudio se evaluó el desarrollo de diabetes durante 5 años de seguimiento en 2.298 pacientes que no tenían el diagnóstico de DM2 en el momento de su inclusión. Se diagnosticó de DM2 durante el seguimiento a un 10,3 y a un 12,6% de los pacientes que recibieron carvedilol o metoprolol (hazard ratio [HR] 0,78, IC 95% 0,61-0,99, p=0,048), respectivamente.
En general, y según los estudios mencionados, podemos afirmar que la incidencia de DM2 en la población con insuficiencia cardíaca congestiva osciló entre un 10 y un 28%, incidencia mayor con respecto al 6 a 18% observado en la población general ajustada por la edad.
Asociación de la insuficiencia cardíaca con la resistencia a la insulinaAunque los estudios epidemiológicos realizados en los últimos años han establecido la asociación existente entre la insuficiencia cardíaca y el desarrollo de DM2, la explicación fisiopatológica subyacente todavía no está esclarecida. Hay varias líneas de investigación que sugieren que la insuficiencia cardíaca es un estado de resistencia insulínica responsable de una mayor incidencia de DM2 en estos pacientes. En este sentido, estudios clínicos de principios de la década de los 90 utilizando la pinza hiperinsulinémica euglicémica han demostrado la existencia de hiperglucemia en ayunas y resistencia a la insulina en pacientes con insuficiencia cardíaca, con independencia de su etiología17,18. Asimismo, en 38 pacientes con insuficiencia cardíaca asociada a disfunción ventricular sistólica se señaló una disminución del 58% de la sensibilidad a la insulina y un aumento del 131% de la insulinemia en ayunas comparado con controles sanos. El empeoramiento de la resistencia a la insulina no se relacionó con la etiología de la insuficiencia cardíaca, ya fuese por cardiopatía isquémica o por miocardiopatía dilatada19. Más recientemente, Al Zadjali et al. observaron en 129 pacientes con insuficiencia cardíaca una prevalencia de resistencia a la insulina del 61%, situación que se relacionó con el perímetro de la circunferencia abdominal (r=0,37; p<0,001), la concentración de triglicéridos (r=0,34, p <0,001), del colesterol unido a lipoproteínas de alta densidad (colesterol HDL) (r=-0,22, p=0,02) y de leptina (r=0,39, p=0,03)20. Otros estudios han puesto de relieve una elevada prevalencia de alteraciones del metabolismo hidrocarbonado en pacientes con insuficiencia cardíaca. Así, en 94 pacientes afectos de insuficiencia cardíaca se objetivó una prevalencia de DM2 conocida del 29%, de DM2 no conocida en el 15%, intolerancia oral a la glucosa en un 24% y resistencia a la insulina definida por un índice HOMA-IR (homeostasis model assessment-insulin resistance) superior a 2 en el 27%, de manera que un 94,6% de los sujetos afectos de insuficiencia cardíaca presentaban alguna alteración del metabolismo hidrocarbonato en el momento de la inclusión en el estudio21.
Más aun, la sensibilidad a la insulina muestra una relación inversa con la gravedad de la insuficiencia cardíaca, de forma que una capacidad de ejercicio funcional disminuida o valores elevados de péptido natriurético tipo B se asocian a una mayor resistencia a la insulina18,20. Estas observaciones apuntan claramente a la teoría de que la resistencia a la insulina progresa durante la evolución natural de la insuficiencia cardíaca.
Así pues, los hallazgos de todos estos estudios indican que la prevalencia de resistencia a la insulina en pacientes con insuficiencia cardíaca es elevada y que esta se correlaciona con su gravedad.
Mecanismo de la resistencia a la insulina en pacientes con insuficiencia cardíaca crónicaLa insuficiencia cardíaca se caracteriza por una disfunción ventricular izquierda y cambios hemodinámicos, funcionales y morfológicos en los tejidos periféricos, tales como reducción del flujo sanguíneo, anomalías en la estructura mitocondrial, alteraciones en el metabolismo oxidativo del músculo esquelético y atrofia de las fibras lentas sensibles a insulina22–24. Todavía no se conocen con exactitud los mecanismos que hacen que la insuficiencia cardíaca se acompañe de una resistencia a las acciones metabólicas de la insulina, si bien se han analizado varios posibles mecanismos etiopatogénicos que describimos a continuación.
Hiperactivación del sistema nervioso simpáticoEs la hipótesis y la vía patogenética más estudiada y aceptada en la actualidad. Las concentraciones elevadas de norepinefrina se correlacionan tanto con los parámetros hemodinámicos de la insuficiencia cardíaca, como con la sensibilidad a la insulina y la tolerancia a la glucosa17,25,26. Dado que la captación periférica de glucosa e insulina en el músculo esquelético está mediada por el tono vascular de las arteriolas aferentes, la vasoconstricción arteriolar desencadenada por la estimulación de los receptores alfaadrenérgicos provoca que el flujo sanguíneo se desvíe del músculo esquelético con la consiguiente disminución de la utilización de la glucosa27.
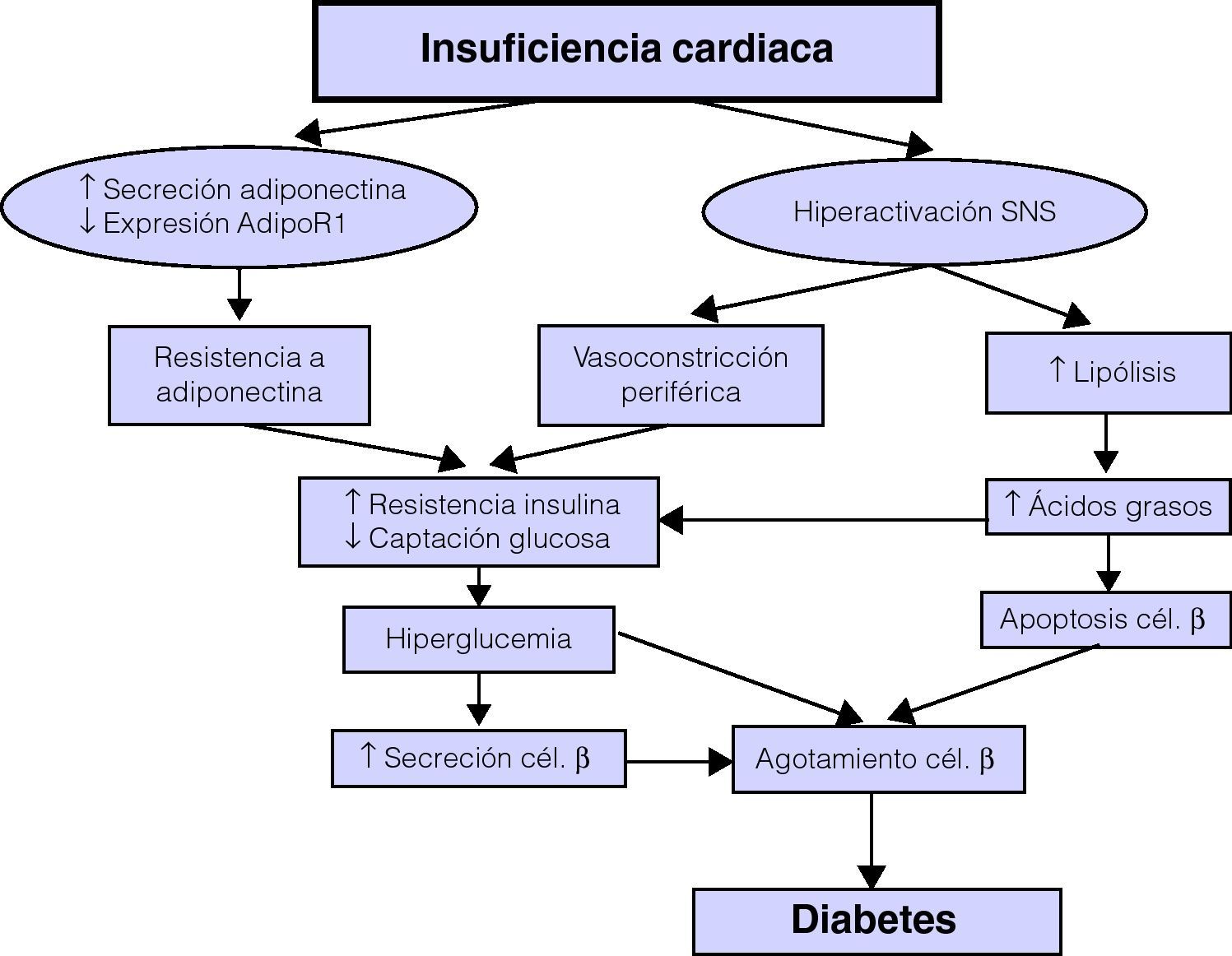
Además, la actividad del sistema nervioso simpático aumenta la lipólisis en el tejido adiposo a través de la activación directa de los receptores celulares betaadrenérgicos, aumentando así las concentraciones de ácidos grasos libres circulantes28. En pacientes con insuficiencia cardíaca, los valores basales elevados de norepinefrina se correlacionan con los de los ácidos grasos libres, y los descensos en los ácidos grasos libres mediados por insulina están atenuados en comparación con los de los individuos sin insuficiencia cardíaca17. El aumento de los ácidos grasos libres inhibe la captación de glucosa mediada por insulina en el músculo esquelético debido a un efecto negativo en el transporte y fosforilación de la glucosa. Además, los ácidos grasos libres aumentan la producción endógena de glucosa mediante la activación de la gluconeogénesis hepática (fig. 2)29.
Si bien la teoría de la hiperactivación simpática como causa de la resistencia a la insulina en la insuficiencia cardíaca ha sido la más promulgada, no sería justo dejar de mencionar aquí que en algunos estudios no se ha encontrado correlación entre los valores plasmáticos de norepinefrina y la resistencia a la insulina19,20. Ello sugiere la existencia de otros factores que influyan en la disminución de la sensibilidad a la insulina en los pacientes con insuficiencia cardíaca.
Resistencia a la adiponectinaLa adiponectina es una adipocitoquina antiinflamatoria, sensibilizadora a la insulina y antiaterogénica, que desempeña un papel fundamental en la homeostasis energética. Estudios observacionales en individuos sanos y en aquellos con riesgo cardiovascular han confirmado el papel protector de la adiponectina30. En pacientes con insuficiencia cardíaca crónica se han constatado repetidamente valores de adiponectina circulante elevados31,32. El origen de esta secreción aumentada no está resuelto. La secreción de adiponectina no es exclusiva del tejido adiposo y datos recientes muestran que otras células, incluidos los miocitos del tejido muscular esquelético y los cardiomiocitos, son capaces de sintetizarla33. Van Berendoncks et al. han descrito un aumento de la expresión de adiponectina en células de músculo esquelético de pacientes con insuficiencia cardíaca leve a moderada34. Además, este incremento se asoció a una disminución en la expresión de los receptores para la adiponectina. Estos valores elevados de adiponectina asociados a una disminución en el número de sus receptores sugiere la existencia de una resistencia a la adiponectina en las células de músculo esquelético en la insuficiencia cardíaca. Por otra parte, se ha documentado en pacientes con insuficiencia cardíaca una correlación significativa entre los niveles de resistencia a la insulina y los valores plasmáticos de adiponectina20.
El hecho de que los pacientes con insuficiencia cardíaca presenten una resistencia a las acciones de la adiponectina podría orientar hacia las posibles causas de la resistencia a la insulina observada en pacientes con insuficiencia cardíaca.
Evolución a diabetes mellitus tipo 2Los pacientes que desarrollan diabetes pueden tener susceptibilidad genética para el fracaso de la respuesta secretora de las células beta pancreáticas a la hiperglucemia crónica causada por la resistencia a la insulina. En este sentido, la insuficiencia cardíaca podría seleccionar a pacientes predispuestos a desarrollar DM2 mediante una reducción en la sensibilidad a la insulina mediada por la activación crónica del sistema nervioso simpático.
La expresión clínica de la DM2 requiere habitualmente la combinación de una resistencia a las acciones periféricas de la insulina y una secreción de insulina disminuida en respuesta a la hiperglucemia35. La resistencia a las acciones de la insulina resulta en una captación de glucosa disminuida en el del músculo esquelético, una inhibición disminuida de la producción hepática de glucosa y un aumento en la lipólisis y en la liberación de ácidos grasos libres desde el tejido adiposo. Los pacientes con insuficiencia cardíaca pueden tener una sensibilidad disminuida a la insulina e intolerancia a la glucosa sin alteraciones en la glucemia basal. Con el tiempo, sin embargo, las consecuencias metabólicas de la resistencia a la insulina, como la hiperglucemia y el aumento de ácidos grasos libres, en una población de individuos genéticamente susceptibles pueden resultar en una disminución de la capacidad de las células beta pancreáticas. Este agotamiento de las células beta se asocia, a su vez, con una disminución en la masa de células beta pancreáticas mediada por apoptosis, tal como han demostrado estudios en autopsias de pacientes con DM236 (fig. 2).
Repercusión de la resistencia a la insulina y la diabetes incidente en el pronóstico de los pacientes con insuficiencia cardíacaLa resistencia a la insulina está implicada en disfunciones metabólicas potencialmente nocivas que pueden afectar el suministro de energía y el flujo sanguíneo tanto al miocardio como al músculo esquelético37,38. La insulina aumenta la utilización de glucosa por el miocardio y reduce la oxidación de ácidos grasos libres mediante varios mecanismos. La obtención de oxígeno para la oxidación de la glucosa es más eficiente que para la oxidación de los ácidos grasos, por lo que este cambio en el metabolismo cardíaco es teóricamente beneficioso para el corazón, especialmente durante la isquemia, y se piensa que es el principal mecanismo que subyace a los efectos beneficiosos observados en varios ensayos clínicos con infusiones de glucosa-insulina y potasio39,40.
La presencia de resistencia a la insulina o DM2 se ha demostrado que afecta a la metabolización de la glucosa a diferentes niveles, desde la de la glucosa por el miocito, hasta la oxidación final por la mitocondria22–24. Estos cambios condicionan una reducción de la eficiencia cardíaca en reposo que puede predisponer al desarrollo de una miocardiopatía diabética, pero también provoca un aumento de la susceptibilidad del corazón resistente a la insulina a la isquemia miocárdica. Se sabe que los sujetos con resistencia a la insulina tienen un riesgo mayor de insuficiencia cardíaca y muerte que los sujetos sensibles a la insulina, y que estas diferencias no pueden justificarse solo por otros factores de riesgo tales como la hipertensión arterial o la enfermedad vascular41.
En este sentido, son varios los estudios que han puesto de manifiesto una relación entre la gravedad de la insuficiencia cardíaca y la resistencia a la insulina12,19,20. Swan et al.19 demostraron que una mayor gravedad de la insuficiencia cardíaca, en términos de capacidad de ejercicio reducida, se correlacionaba con una mayor resistencia a la insulina independientemente de la etiología de la insuficiencia cardíaca. Estos resultados coinciden con los de otros estudios más recientes en los que se observó que la resistencia a la insulina aumenta progresivamente a peor clase funcional de la New York Heart Association12,19,20. Sin embargo, no hay estudios a largo plazo que valoren la repercusión de la resistencia a la insulina y la diabetes incidente sobre el pronóstico vital de los pacientes con insuficiencia cardíaca.
Efectos del tratamiento farmacológico de la insuficiencia cardíaca congestiva sobre la resistencia a la insulina y el riesgo de desarrollar diabetesAlgunas intervenciones farmacológicas, como la administración de inhibidores de la enzima conversora de la angiotensina (IECA), antagonistas de los receptores de la angiotensina II (ARA-II) o betabloqueantes, que mejoran el pronóstico de los pacientes con insuficiencia cardíaca, pueden influir en el desarrollo de diabetes y en la resistencia a la insulina.
IECA y ARA-IILos IECA y los ARA-II han demostrado reducir significativamente la incidencia de diabetes en grandes ensayos clínicos de pacientes con insuficiencia cardíaca congestiva14,15. En el estudio SOLVD (Studies On Left Ventricular Dysfunction) se detectó en el grupo tratado con enalapril una incidencia de diabetes mellitus del 5,9%, mientras que en el grupo placebo fue del 22,4% (RR=0,26, p<0,001)15. En el análisis multivariante, el enalapril fue la variable con mayor poder de predicción para un riesgo disminuido de desarrollar diabetes (HR=0,22, IC 95% 0,1-0,46, p<0,0001). En el estudio CHARM-Preserved, en pacientes con insuficiencia cardíaca crónica y fracción de eyección conservada, el tratamiento con candesartán demostró una reducción del 40% en el desarrollo de diabetes de nuevo diagnóstico, mientras que en los otros subgrupos del estudio CHARM la reducción fue del 22%14. Globalmente, los resultados de estos subanálisis, con las salvedades que ello supone, sugieren que el bloqueo del sistema renina-angiotensina con IECA o con ARA-II previene el desarrollo de DM2 en pacientes con insuficiencia cardíaca crónica. Sin embargo, en un ensayo clínico diseñado por Clodi et al.21 para evaluar el efecto del telmisartán y el candesartán sobre la sensibilidad a la insulina en pacientes con insuficiencia cardíaca, no se encontraron cambios significativos en la sensibilidad a la insulina después de 5 meses de tratamiento.
BetabloqueantesLos betabloqueantes tienen un efecto diferente en el metabolismo glucídico y lipídico según su especificidad sobre los receptores. Así, varios estudios pusieron en evidencia que los betabloqueantes de primera generación aumentaban el riesgo de desarrollar diabetes tras 10 años de tratamiento42. El Atherosclerosis Risk in Communities (ARIC) Study demostró que el propranolol y el timolol aumentaban el riesgo de desarrollar diabetes en un 28%43. En cambio, los betabloqueantes de segunda generación, como el atenolol y el metoprolol, entre otros, se han asociado con unas reducciones menores en la sensibilidad a la insulina (13 y 20%, respectivamente) y en la captación de glucosa corporal total durante el pinzamiento euglucémico hiperinsulinémico27,44. Sin embargo, los betabloqueantes de tercera generación, que combinan propiedades betabloqueantes no selectivas con otros efectos como la vasodilatación y protección contra la oxidación (dilevalol, carvedilol, celiprolol), aumentan en general la sensibilidad a la insulina y mejoran el perfil lipídico. En un estudio con 72 pacientes no diabéticos, la sensibilidad a la insulina disminuyó un 14% después de 12 semanas de tratamiento con metoprolol comparado con un incremento del 9% en los que seguían tratamiento con carvedilol45. En el estudio COMET13, que comparó el efecto del carvedilol y el metoprolol en pacientes con insuficiencia cardíaca crónica, se evaluó el desarrollo de diabetes durante 5 años de seguimiento en 2.298 pacientes que no tenían el diagnóstico de DM2 en el momento de inclusión. Se diagnosticó de DM2 durante el seguimiento a un 10,3 y un 12,6% de los pacientes en el grupo de tratamiento con carvedilol y metoprolol (HR=0,78; IC 95% 0,61-0,99, p=0,048), respectivamente. Estos resultados reflejan un efecto protector del carvedilol sobre el riesgo de desarrollar diabetes de nuevo diagnóstico.
ConclusionesLa insuficiencia cardíaca crónica se asocia a un estado de resistencia a la insulina y a una mayor incidencia de DM2. Son varios los estudios epidemiológicos que han demostrado que la incidencia de DM2 en la población con insuficiencia cardíaca congestiva oscila entre un 10 y 28%, incidencia mayor con respecto al 6 a 18% observado en la población general ajustada por la edad. A pesar de esta evidencia epidemiológica sobre la asociación existente entre la insuficiencia cardíaca y el desarrollo de DM2, la explicación fisiopatológica subyacente todavía no está esclarecida. Hay varias líneas de investigación que sugieren que la insuficiencia cardíaca es un estado de resistencia insulínica responsable de una mayor incidencia de DM2 en estos pacientes. Más aun, la sensibilidad a la insulina muestra una relación inversa con la gravedad de la insuficiencia cardíaca, de forma que una capacidad de ejercicio funcional disminuida o valores elevados de péptido natriurético tipo B se asocian a una mayor resistencia a la insulina. Estas observaciones apuntan claramente a la teoría de que la resistencia a la insulina progresa durante la evolución natural de la insuficiencia cardíaca.
Entre los mecanismos fisiopatológicos que se han propuesto para explicar la asociación entre insuficiencia cardíaca y resistencia a la insulina los más aceptados son la hiperactivación simpática, el aumento de la concentración de ácidos grasos libres circulantes y la resistencia a la adiponectina.
Además, la resistencia a la insulina y el desarrollo de DM2 se relacionan con una mayor gravedad de la insuficiencia cardíaca y con un peor estadio funcional. Varias estrategias terapéuticas farmacológicas para el tratamiento de la insuficiencia cardíaca pueden influir en el riesgo de desarrollar DM2. Queda por demostrar la repercusión sobre el pronóstico vital de la diabetes de nuevo diagnóstico en estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.