El mieloma múltiple (MM) es una enfermedad con afectación multiorgánica, heterogénea y todavía incurable1,2. Su incidencia en España se sitúa entre 2,5 y 3,5 casos por cada 100.000 habitantes, y supone un 1,8% de todas las muertes por cáncer3. La elección correcta del tratamiento puede dar lugar al mantenimiento de la respuesta, así como a una mejor calidad de vida y supervivencia global de los pacientes4. Para ello es necesario un análisis adecuado de la situación de cada paciente y una individualización del tratamiento, en la que es clave la implicación y experiencia del hematólogo. En la actualidad existen muchos documentos de referencia sobre el tratamiento de los pacientes con MM5-9. Sin embargo, las recomendaciones o guías de evidencia son limitadas en pacientes que presentan factores de riesgo o de mal pronóstico1,10.
El objetivo del presente artículo fue dar a conocer la realidad del tratamiento de los pacientes con MM de alto riesgo según la práctica clínica real en España a partir de los resultados extraídos de un cuestionario anónimo diseñado para conocer la práctica clínica habitual y las preferencias reales de los hematólogos de diferentes centros españoles que tratan MM, tanto de nuevo diagnóstico como en el ámbito de la recaída o progresión.
Material y métodosSe desarrolló un cuestionario basado en una revisión de la literatura centrada en el tratamiento de los pacientes con MM en los ámbitos nacional e internacional. Se consideró evaluar a los pacientes desde el diagnóstico hasta las recaídas y los casos refractarios.
A partir de los resultados obtenidos en esta revisión, se identificaron, por una parte, los factores que definirían el perfil de un paciente de alto riesgo y, por otra, las variantes de tratamiento que deberían considerarse para este tipo de enfermos.
Con la información recogida y la colaboración de un comité científico formado por miembros del Grupo Español de Mieloma/Programa Español de Tratamientos en Hematología (GEM/PETHEMA), se desarrolló un cuestionario estructurado, para ser cumplimentado online con el que obtener información tanto de la práctica clínica habitual como de la forma que se consideraría óptima para el tratamiento de los pacientes con MM de alto riesgo en España.
El cuestionario incluía preguntas específicas sobre el diagnóstico, tratamiento y seguimiento del paciente con MM de alto riesgo y sobre cómo debería ser, con base en la evidencia científica disponible. A través del GEM/PETHEMA se invitó a participar en el estudio a un total de 221 hematólogos distribuidos por todo el territorio nacional. Todos los participantes debían tener un mínimo de 5 años de experiencia en la enfermedad de MM y estar dedicados al tratamiento y seguimiento de estos pacientes en sus correspondientes centros.
Los investigadores participantes firmaron, de forma individual, un compromiso de participación y recibieron un acceso personal para cumplimentar el cuestionario de estudio de manera online. Los datos recogidos fueron analizados de forma descriptiva, agregada y de forma disociada para preservar el anonimato de los especialistas participantes. La participación fue voluntaria y no vinculada a honorario alguno.
ResultadosCincuenta hematólogos (22,6%), con una experiencia media de 16,2 años en el tratamiento de pacientes con MM, accedieron a participar en el cuestionario y cumplían con los criterios de selección. El cuestionario se recibió cumplimentado entre mayo y agosto de 2017. Del total de participantes, 46 (92%) ejercían en servicios de hematología, mientras que el resto lo hacía en servicios de oncohematología.
Realidad asistencial del mieloma múltiple en EspañaSegún el 92% de los participantes, la referencia consultada para el tratamiento de pacientes con MM no candidatos a trasplante de progenitores hematopoyéticos (TPH) corresponde al documento de consenso del International Myeloma Working Group (IMWG)6 y es seguido en práctica clínica habitual por el 88%. También es habitual utilizar las guías ESMO5 (78%), las guías NCCN9 (76%), el documento de perspectivas europeas de tratamiento de MM7 (66%) y la oncoguía de MM de Castilla y León8 (64%). Adicionalmente, los hematólogos refirieron que en su práctica clínica consultaban otras 20 referencias clave como apoyo en el tratamiento de estos pacientes. El 87% de los participantes indicó que disponía de protocolos de manejo del MM en su centro (el 20% de obligado cumplimiento).
Respecto al manejo de los pacientes con MM de alto riesgo, el 90% destacó que sería interesante disponer de una guía o documento de referencia nacional, ya que los documentos actuales no se ajustan a la realidad asistencial en el manejo de este perfil concreto de pacientes. Además, el 53% de los hematólogos indicó tener limitaciones de acceso en sus centros de trabajo a algunos tratamientos que consideraban relevantes para el adecuado tratamiento de los pacientes con MM de alto riesgo.
Criterios que definen el perfil de paciente de alto riesgoEl 100% de los participantes destacó la presencia de leucemia de células plasmáticas entre los factores que definen el perfil de alto riesgo de los pacientes con MM. El 91% también consideró la presencia de marcadores citogenéticos y el 80% la enfermedad extramedular o un estadio III según el International Staging System revisado.
Con relación a los marcadores citogenéticos, el 98% de los participantes los determina de forma rutinaria mientras que el 2% restante solo lo emplea si se han identificado previamente otros factores de riesgo asociados. El sistema más utilizado fue la hibridación in situ fluorescente, en el 78% de los resultados. La presencia de alteraciones citogenéticas condicionaría la elección del tratamiento según el 69% de los hematólogos, especialmente si se identifican la deleción 17p o las translocaciones de mal pronóstico que afectan al gen IGH, fundamentalmente t (4;14) o t (14;16) (53% de las opiniones).
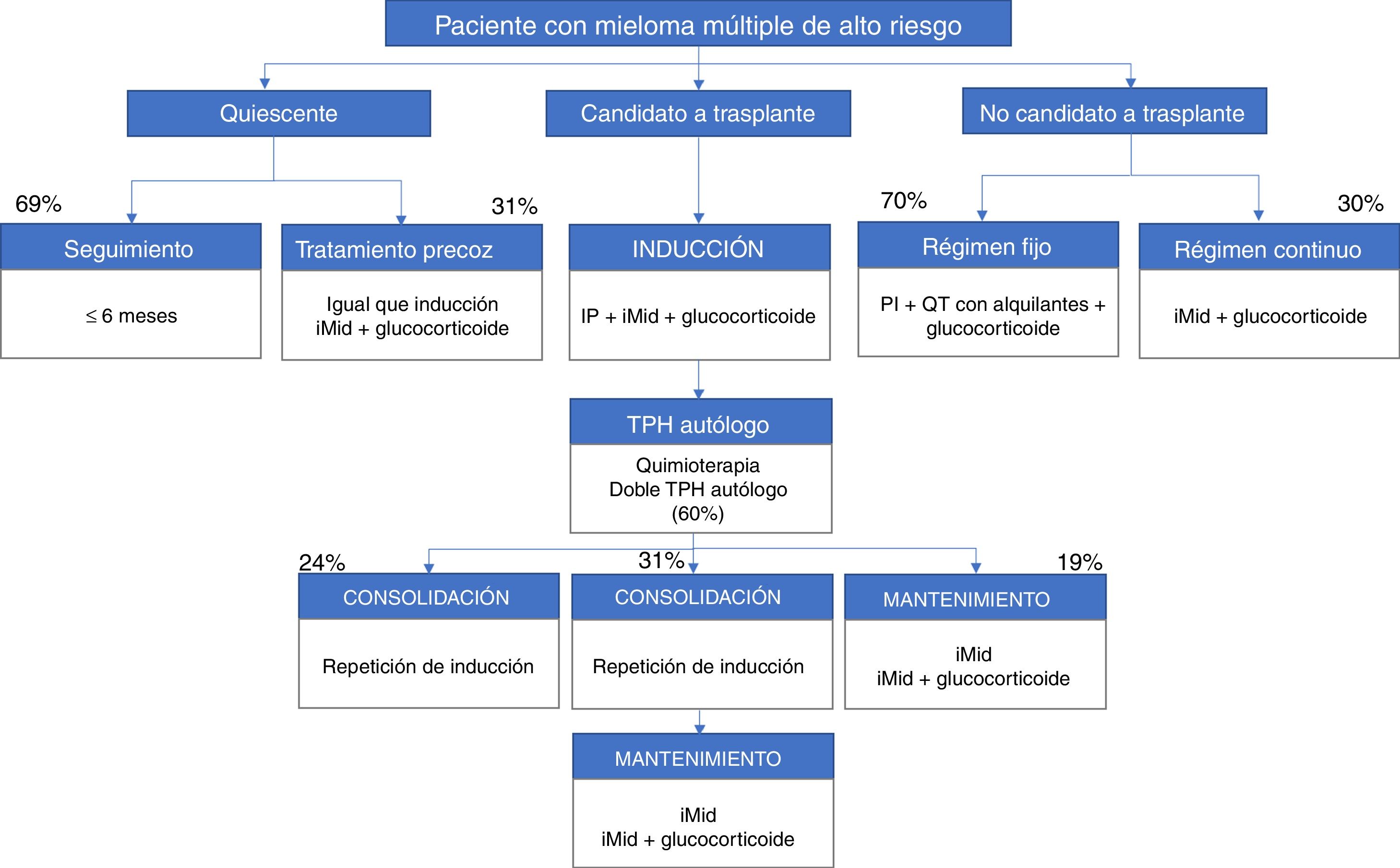
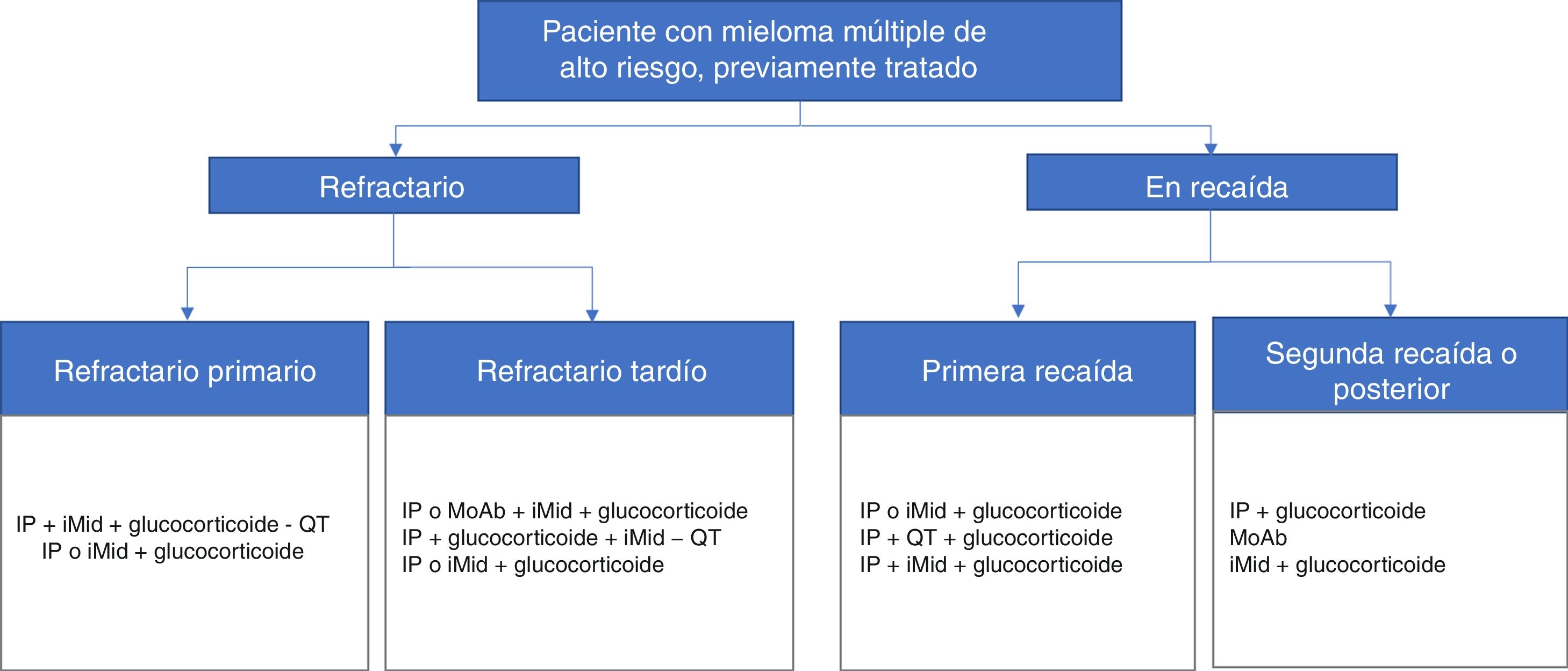
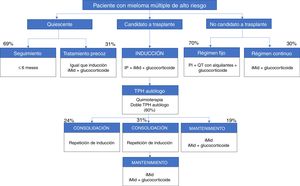
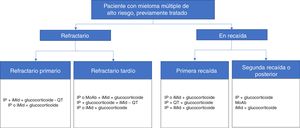
Entre los factores propios del paciente de alto riesgo y determinantes para el tratamiento, los participantes señalaron la neuropatía periférica (82%), la edad (78%), la insuficiencia renal (78%) y diversas cardiopatías (78%). En la figura 1 y en la figura 2 se presenta un resumen de los algoritmos de tratamiento utilizados por los hematólogos participantes en su práctica clínica para el manejo de los pacientes con MM de alto riesgo.
Esquemas de tratamientos autorizados en España para pacientes con nuevo diagnóstico de mieloma múltiple de alto riesgo. Están basadas en las opciones terapéuticas disponibles entre mayo y agosto de 2017.
iMid: agentes inmunomoduladores; IP: inhibidor del proteasoma; QT: quimioterapia; TPH: trasplante de progenitores hematopoyéticos.
Esquemas de tratamientos autorizados en España para pacientes de mieloma múltiple de alto riesgo ya tratados, refractarios o en recaída. Están basadas en las opciones terapéuticas disponibles entre mayo y agosto de 2017.
AbMo: anticuerpos monoclonales; iMid: agentes inmunomoduladores; IP: inhibidor del proteasoma; QT: quimioterapia.
Las recomendaciones proponen mantener un control periódico, pero no tratar al paciente con MM quiescente11 (cuando el MM en fase temprana no presenta síntomas ni complicaciones)5. El 88% de los participantes consideró que la decisión de tratar a estos pacientes depende por igual de los factores propios del individuo y de los del tumor. El 69% afirmó que no iniciaba precozmente el tratamiento, aunque los pacientes presentaran un perfil de alto riesgo de progresión, y solo se limitaban a un seguimiento periódico. En el caso de pacientes de riesgo estándar el seguimiento se llevaba a cabo con menor frecuencia (1-3 meses o 3-6 meses, para el 42% y 24% de los participantes, respectivamente).
El 31% de los hematólogos indicó que trataría de forma temprana a estos pacientes con MM quiescente, generalmente con el mismo tratamiento que hubiera utilizado en pacientes sintomáticos. La combinación de un agente inmunomodulador, un inhibidor del proteasoma y un glucocorticoide sería el tratamiento de elección de casi la mitad de los participantes (47%).
Tratamiento de pacientes de alto riesgo candidatos a trasplanteEl 83% de los participantes señaló que en los pacientes de alto riesgo candidatos a trasplante se deben considerar por igual los factores propios del paciente y los del tumor para establecer un tratamiento óptimo. La combinación triple formada por un inhibidor del proteasoma, un inmunomodulador y un glucocorticoide sería la más utilizada en la práctica clínica para llevar a cabo la inducción, según el 74% de los hematólogos.
Al finalizar la inducción, todos los participantes indicaron que valoraban la respuesta al tratamiento. Sin embargo, solo un 15% de los hematólogos señaló que optaría por repetir la inducción en caso de enfermedad mínima residual positiva (presencia de células de MM que sobreviven a un tratamiento, detectadas mediante citometría de flujo o secuenciación molecular)12.
Tras la inducción, el 96% de los participantes manifestó que realizaría un acondicionamiento con un agente alquilante y un TPH autógeno. En pacientes de alto riesgo, el 60% señaló que llevaría a cabo un doble trasplante autógeno en algo más de la mitad de sus pacientes (59,8%). Entre los principales motivos por los que no se optaría por el doble trasplante de forma rutinaria se encuentran las limitaciones logísticas del propio centro o la necesidad de derivar a otros centros.
Las estrategias de tratamiento postrasplante en este grupo de pacientes son muy variables. Según los hematólogos participantes, en la práctica clínica el 31% de los pacientes era tratado con una estrategia de consolidación seguida de mantenimiento a largo plazo; sin embargo, con base en su criterio, esta opción sería la óptima y debería extenderse a un 54% de los pacientes. En contrapartida, según un 96% de los participantes, en la práctica clínica habitual hay un 26% de los enfermos que no recibe ni consolidación ni mantenimiento y en los que solo se hace un seguimiento periódico cada 1-3 meses. La repetición de la inducción es el tratamiento de consolidación más extendido en la práctica clínica habitual para el 94% de los hematólogos.
El tratamiento de elección en pacientes de alto riesgo en la práctica clínica habitual es el mantenimiento con un inmunomodulador, solo o en combinación con un glucocorticoide a dosis baja, según un 79% de participantes. Este tratamiento se mantendría de forma continua en el tiempo (68%) o con una pauta definida a largo plazo (32%) de aproximadamente 22 ciclos de duración.
Tratamiento de pacientes de alto riesgo no candidatos a trasplantePara el 83% de los hematólogos, la elección de tratamiento en el paciente de alto riesgo no candidato a trasplante dependería por igual de los factores propios del tumor y de los del individuo. En este caso, un 11% priorizaría los factores propios del paciente, mientras que el 6% se decantaría por los del tumor.
El 70% de los hematólogos elegiría un régimen fijo de tratamiento. Esta opción se basaría, en el 80% de los casos, en una combinación triple de un inhibidor del proteasoma, un agente alquilante y un glucocorticoide, utilizada un promedio de 9,4 ciclos. En el caso de optar por un régimen de tipo continuo, en el 75% de los resultados la opción utilizada principalmente sería la combinación de un inmunomodulador y un glucocorticoide.
Tratamiento de los pacientes refractarios o en recaídaPara establecer el tratamiento más adecuado a cada paciente refractario o en recaída, los principales factores que tener en cuenta serían por igual los propios del tumor y los propios del enfermo, tanto en los refractarios primarios (76% de los resultados) y en los refractarios a últimas líneas de tratamiento (74%), como en pacientes en recaída (87%).
El 79% de los hematólogos reconoció la necesidad de aplicar un tratamiento diferente a los pacientes refractarios y a los que tienen recaída. En general, la base del tratamiento de los enfermos refractarios sería las combinaciones con un inhibidor del proteasoma y un anticuerpo monoclonal, o una combinación triple de un inhibidor del proteasoma, un inmunomodulador y un glucocorticoide. En el caso de los pacientes en recaída, el 70% de los participantes opina que no debería retratarse, pero, en caso de hacerlo, los tratamientos de referencia corresponderían a combinaciones con un inmunomodulador si el paciente previamente ha recibido un inhibidor del proteasoma, o con un glucocorticoide, en el caso de que haya recibido antes un inmunomodulador.
DiscusiónLos resultados presentados en este artículo recogen la experiencia clínica real y las recomendaciones de hematólogos de distintos centros españoles que trataban habitualmente a pacientes con MM según los recursos disponibles entre mayo y agosto de 2017. En general, ponen de manifiesto una tendencia común en el tratamiento de estos pacientes, uniforme entre los diferentes centros participantes y alineada con las recomendaciones generales tanto nacionales como internacionales1,2,5,6,13. Sin embargo, no existe un consenso o criterio generalizado a la hora de manejar a los pacientes con MM y factores de alto riesgo. No obstante, los datos recogidos ponen en evidencia que los hematólogos reconocen y consideran los factores que definen un perfil de alto riesgo de acuerdo con las directrices disponibles1,2. De hecho, se reconoce que las translocaciones (4;14), (14;16) y (14;20), la deleción (17/17p) y el cariotipo no hiperdiploide constituyen las alteraciones citogenéticas de alto riesgo. Además, los 1q+ se asocian con mal pronóstico y la presencia de más de 3 alteraciones citogenéticas confiere un riesgo muy alto, con supervivencia reducida14. La clasificación de MM de riesgo alto debe combinar estas alteraciones con la presencia de una clasificación según International Staging System elevada, aumento de la LDH sérica o alteraciones genéticas de riesgo en el perfil de expresión. A pesar de ello, estos factores no parecen ser decisivos en la elección del tratamiento, en contra de lo recomendado internacionalmente15, y se mantienen los mismos tratamientos convencionales que para un paciente de riesgo estándar. Con todo, este hecho ha sido habitual en el tratamiento de los pacientes en diferentes países de nuestro entorno y es en la actualidad cuando se asiste progresiva, aunque paulatinamente, a una toma de decisiones diferente basada en los factores de alto riesgo.
Los resultados señalan que los hematólogos en su práctica clínica siguen las principales recomendaciones para el manejo del paciente con MM5-13 al iniciar, en general, el tratamiento solo cuando hay sintomatología. Sin embargo, comienza a haber evidencias que abogarían por el inicio precoz del tratamiento en los pacientes con MM quiescente (sin síntomas ni complicaciones) para mejorar los resultados14,16. Muchos hematólogos han declarado su preferencia por este tipo de abordaje del paciente asintomático, pero es poco factible en la realidad asistencial de los hospitales españoles debido a los protocolos de tratamiento de los centros y a las limitaciones de acceso a determinados fármacos para el tratamiento del MM. En la actualidad se estudia si la anticipación del tratamiento, bien con el fin de evitar la progresión a mieloma múltiple sintomático, bien con la de erradicar el clon del mieloma, podría mejorar los resultados en términos de supervivencia y, quizás, lograr la curación de alguno de los pacientes14,17.
Según la experiencia de los hematólogos participantes, los pacientes con MM sintomáticos son tratados inmediatamente, en general, siguiendo las guías5,7,8, pero el hecho de que el paciente tenga características de alto riesgo no implica en muchas ocasiones un tratamiento intensivo10,13. Tomando como referencia el tratamiento de inducción en pacientes con MM de alto riesgo candidatos a trasplante, los expertos en España indican que la combinación mayoritariamente utilizada corresponde con la estándar5,7,8 (un inhibidor del proteasoma, un inmunomodulador y un glucocorticoide) mientras que el tratamiento adecuado en este perfil de paciente de alto riesgo sería optar por combinaciones de inhibidores del proteasoma, inmunomoduladores, anticuerpos monoclonales y glucocorticoides y, en los pacientes jóvenes, realizar un doble TPH autógeno15. Este subgrupo de pacientes constituye una necesidad médica no cubierta, por lo que su inclusión en ensayos clínicos es muy recomendable.
Lo mismo ocurre al analizar el tratamiento utilizado en consolidación y mantenimiento de los pacientes con un alto riesgo y candidatos a trasplante, o en los pacientes no candidatos a trasplante. Las respuestas recogidas en el cuestionario reflejan una práctica clínica alineada con las recomendaciones de tratamiento para los pacientes de riesgo estándar5,7,8, pero no están adaptadas a las necesidades de los pacientes de alto riesgo10,13,18.
En general, los hematólogos son conscientes de las necesidades de los pacientes con MM de alto riesgo, pero, por limitaciones de acceso a determinados tratamientos, por los protocolos asistenciales e incluso por limitación de conocimiento para reconocer estas situaciones especiales, no pueden generalizar el uso de tratamientos específicos en este perfil de pacientes. Estos casos incluirían a los pacientes con citogenética adversa19, que requieren un tratamiento diferencial, así como a los pacientes de edad avanzada, en los que el tratamiento debe individualizarse en función de sus características y estado físico y funcional, lo que incluye evitar el uso sistemático y sostenido de glucocorticoides20.
Si se considera el tratamiento de pacientes más complejos, como son aquellos refractarios o en recaída, las opciones se multiplican debido a la diversidad de criterios que considerar (tratamientos previos, características del propio paciente) y también a la ausencia de directrices claras para el tratamiento de este perfil de paciente. Sin embargo, a pesar de que los hematólogos reconocen la necesidad de llevar a cabo un manejo terapéutico diferencial entre los diferentes tipos de pacientes refractarios (primario, tardío o en recaída), las estrategias utilizadas son muy parecidas. Es justamente en este grupo de pacientes en el que la literatura publicada21-23 ofrece una mayor variedad de tratamientos.
Los resultados presentados pretenden reflejar la realidad asistencial del tratamiento del MM de alto riesgo en España, pero son meramente orientativos y descriptivos, ya que la participación en este cuestionario se ha visto limitada a una muestra de 50 hematólogos. Además, los resultados están basados en la experiencia de estos expertos y sus preferencias, pero no se han obtenido de una revisión sistemática de historias clínicas. También hay que tener en cuenta que los resultados están basados en las opciones terapéuticas disponibles entre mayo y agosto de 2017, que fue cuando se recogieron los datos. No obstante, aunque actualmente hay disponibles más fármacos para el tratamiento del MM, en algunos casos, las restricciones de acceso y la falta de consenso y recomendaciones de los principales grupos cooperativos dificulta el tratamiento de los pacientes con MM de alto riesgo. Aun así, recientemente se ha producido un aumento del arsenal terapéutico para el tratamiento del MM, con numerosos ensayos que combinan 3, 4 y hasta 5 fármacos, en un intento por obtener respuestas más profundas, con enfermedad residual mínima indetectable. Posiblemente, en algunos casos, esta estrategia constituya el camino para continuar en la mejoría de los resultados de los pacientes con MM de riesgo alto.
ConclusionesEl presente artículo ofrece una visión general de la complejidad que supone el tratamiento de los pacientes con MM de alto riesgo en España y revela la necesidad de definir pautas de tratamiento diferentes a las de los pacientes con riesgo estándar que permitan individualizar el tratamiento para, en la medida de lo posible, reducir el impacto en el mal pronóstico de este tipo de pacientes.
FinanciaciónLa realización del estudio ha contado con la financiación de Takeda Farmacéutica España y el apoyo logístico y de coordinación del equipo de Real World Insights de IQVIA España.
Conflicto de interesesEl Dr. José-Ángel Hernández-Rivas ha recibido honorarios por asesoramiento y formación de Amgen, Janssen, Takeda, Celgene, Abbvie y BMS. La Dra. Mercedes Gironella Mesa ha recibido honorarios por asesoramiento y formación de Amgen, Janssen, Takeda y Celgene.
Los autores agradecen la participación desinteresada de todos los hematólogos participantes en el estudio, así como la colaboración de GEM/PETHEMA.