La ciclooxigenasa (COX) o prostaglandina endoperóxido-sintetasa (PGH-sintetasa) es la enzima que cataliza la transformación del ácido araquidónico (AA) a prostaglandina H2 (PGH2). Los productos derivados del metabolismo del AA son denominados de forma colectiva eicosanoides. El primer paso en la producción de eicosanoides es la liberación del AA de la membrana fosfolipídica por la acción de la fosfolipasa A2 (PLA2) en respuesta a diferentes estímulos (bradicinina, angiotensina II, trombina, histamina, leucotrienos, citocinas, factores de crecimiento) y la fosfolipasa C, que cataliza la formación de AA y glicerol a partir de los fosfolípidos liberados de la membrana celular. La actividad de las fosfolipasas es el paso limitante que condiciona la velocidad de síntesis de los eicosanoides. Una vez liberado, el AA puede volver a la membrana como fosfolípido, difundir al medio extracelular sin causar efecto alguno o ser metabolizado por diferentes sistemas enzimáticos como COX, lipoxigenasa y citocromo P-450, que catalizan la síntesis de prostaglandinas (PG), leucotrienos y productos derivados de la vía de la epoxigenasa, respectivamente1. Estos compuestos afectan a múltiples vías de señalización intracelulares que modulan un amplio espectro de funciones fisiológicas como la inflamación, la ovulación, la respuesta inmunitaria y la mitogénesis1,2.
La PGH-sintetasa posee dos actividades catalíticas, la primera denominada ciclooxigenasa, que produce un endoperóxido intermedio denominado PGG2, sobre el cual actúa la segunda actividad catalítica que es una peroxidasa y lo transforma en PGH21.
A partir de la PGH2, por acción de diferentes endoperóxido isomerasas se sintetizan la prostaciclina (PGI2), PGD2, PGE2, PGF2* y los tromboxanos dependiendo de los sistemas enzimáticos presentes en los diferentes tipos celulares1,3.
Las PG ejercen su acción a nivel intracelular, a través de receptores nucleares como los de clase PPAR (receptores de activación de la proliferación peroxisomal), que actúan como factores transcripcionales tras la unión al ligando3,4, o como mediador paracrino, donde su acción es consecuencia de la interacción con diversos receptores de las membranas celulares asociados a proteínas G. En la mayoría de los casos, la interacción con su receptor desencadena la activación del sistema adenilciclasa, con el aumento de AMPc, o de la fosfolipasa C y el consiguiente incremento de la concentración de calcio intracelular y diacilgliceroles1.
Los eicosanoides se producen en casi todas las células; por tanto, están involucrados en la mayoría de las funciones orgánicas. En el caso de los productos derivados de la acción de la COX, las funciones más importantes en las que intervienen son: en el proceso inflamatorio produciendo vasodilatación, aumento del flujo sanguíneo local y de la permeabilidad vascular; en la génesis de la fiebre en el sistema nervioso central y de la hiperalgesia localizada al sensibilizar las fibras nociceptivas del sistema nervioso periférico; en la inhibición de la agregación plaquetaria a través de la acción de la prostaciclina; en la respuesta inmunitaria ejercen una acción reguladora con inhibición de la proliferación y función de los linfocitos; en la función renal, con modulación del tono vascular y de la homeostasis del sodio y agua a través de la regulación de la hemodinámica glomerular, reabsorción de sodio y agua tubular y de la secreción de renina; en el tracto gastrointestinal sus acciones más características a nivel gástrico son el aumento del flujo sanguíneo, de la producción de moco y bicarbonato y efectos protectores frente a agentes lesivos sobre la mucosa; en el intestino tienen un papel en la regulación de la motilidad gastrointestinal y de la secreción. Además ejercen otras importantes funciones en el árbol bronquial, en el metabolismo óseo, en órganos endocrinos y en los sistemas reproductores masculino y femenino1,3-6. El conocimiento que se tenía del papel de las PG en el hígado se ha visto incrementado en los últimos años por un número creciente de evidencias clínicas y experimentales que se discutirán en profundidad a lo largo de este artículo.
Isoenzimas de la COX
En 1989 se identificó una segunda isoforma de la enzima COX con una estructura muy similar pero con una diferencia sustancial en cuanto al patrón de expresión y su biología7. La razón para la existencia de dos isoenzimas de la COX es todavía materia de discusión y estudio.
La isoforma COX-1 se expresa de forma constitutiva en prácticamente todos los tejidos, lo que indica que su función principal es la producción de PG para la regulación homeostática. En cambio, la isoforma COX-2 es inducible y, en condiciones basales, sus concentraciones son prácticamente indetectables. Sin embargo, en respuesta a diversos estímulos como lipopolisacárido, interleucina 1, factor de necrosis tumoral alfa (TNF-*), endotoxina y estrés oxidativo, entre otros, se produce un aumento de su expresión y de la producción de PG y tromboxano2,3,8,9. Estudios más recientes han observado que el cerebro, la mácula densa renal y la placenta expresan COX-2 de forma constitutiva, y por tanto también desempeña un papel importante en procesos fisiológicos normales5,10.
El gen de la COX-2 está localizado en el cromosoma 1 y el de la COX-1 se halla en el cromosoma 9. El promotor del gen de la COX-2 contiene una caja TATA y sitios de unión para diferentes factores de transcripción, como el factor nuclear *B (NF-*B) o el factor nuclear para la expresión de interleucina 6 (NF-IL-6), que están implicados en la inducción de COX-2 en respuesta a diversos estímulos2,5,10.
La estructura tridimensional obtenida mediante cristalografía por rayos X es idéntica entre ambas isoformas de COX, al igual que su actividad catalítica y su inhibición por parte de los antiinflamatorios no esteroideos. La COX-2 posee un peso molecular de 71 kD y está formada por unos 600 aminoácidos, compartiendo un 63% de su secuencia con la COX-1. Los residuos del canal de unión con el ligando, los sitios catalíticos y residuos inmediatamente próximos son idénticos salvo por dos posiciones (Ile por Val en posiciones 434 y 523)4,5; a su vez, existen diferencias en sus terminaciones NH2 y COOH2.
Mientras que la localización celular de la COX-1 se restringe al retículo endoplásmico, la COX-2 se distribuye tanto en la región perinuclear, superficie interna de la membrana nuclear, como en el retículo endoplásmico, por lo que los eicosanoides producidos se distribuirán preferentemente por el núcleo, respecto a las PG producidas por la COX-1, y por tanto ejercerán acciones moduladoras sobre la transcripción de genes diana2.
La COX-2, como hemos comentado previamente, no es detectable en condiciones basales en la mayor parte de los tejidos de mamíferos, pero su expresión es rápidamente inducible por factores de crecimiento, promotores tumorales, hormonas, endotoxina bacteriana y diversas citocinas. La regulación de su expresión se produce por diferentes vías, tanto a nivel transcripcional (caja TATA) como postranscripcional, sobre el ARN mensajero (ARNm)5,10.
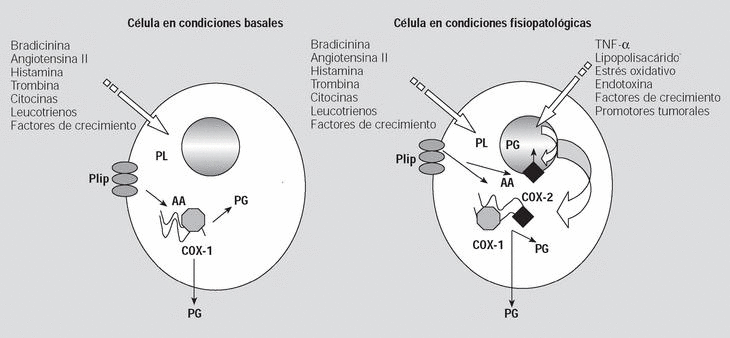
Derivado de lo anteriormente expuesto, se ha planteado que la COX-1 y la COX-2 son sistemas de síntesis de PG parcialmente independientes. La COX-1 produce prostanoides con acción extracelular para o autocrina que actúan en la regulación de la homeostasis del medio, mientras que la COX-2 tendría dos funciones; la primera, en relación con su localización en el retículo endoplásmico, sería la de colaborar en el aumento de la función de COX-1, y la segunda, propia de la COX-2 localizada en la superficie interna de la membrana nuclear, sería la de actuar como un sistema de producción de PG con acción nuclear en la replicación y diferenciación celular10 (fig. 1).
Fig. 1. La ciclooxigenasa (COX) 1 es una enzima constitutiva que produce eicosanoides con acción paracrina o autocrina para la regulación homeostática en la célula en condiciones basales. En cambio, ante determinados estímulos patológicos se induce la expresión de novo de COX-2 que produciría eicosanoides tanto desde su localización en el retículo endoplásmico, como desde la membrana perinuclear. AA: ácido araquidónico; Plip: fosfolípidos de la membrana celular; PL: fosfolipasas; PG: prostaglandinas; TNF-*: factor de necrosis tumoral alfa.
COX-2 e hígado
Papel de la COX-2 en la fisiopatología de las enfermedades hepáticas
Johnston y Kroening11 demostraron que los hepatocitos de rata, incluso ante estímulos apropiados, no expresaban COX-2, a diferencia de otras células intrahepáticas como las células de Kupffer y las células estrelladas o de Ito. Sin embargo, los hepatocitos fetales de rata sí expresan COX-2, perdiendo esta facultad con su diferenciación a hepatocitos adultos. La inhibición de la inducción de la expresión de la COX-2 en hepatocitos adultos de rata depende de factores de transcripción de la familia de los C/EBP que actuarían en el promotor del gen de la COX 2, debido al cambio de expresión de las isoformas de C/EBP con la diferenciación celular12. De este hallazgo se desprende que la expresión de la COX-2 por los hepatocitos adultos puede ser un marcador de desdiferenciación celular.
En el hígado las PG se han involucrado, fundamentalmente, en los procesos de regeneración hepática mediante la estimulación de la proliferación de los hepatocitos13-16, en la remodelación tisular17 y en la hipertensión portal18-22. En relación con el primer proceso, en un modelo animal de rata se observó cómo los factores de crecimiento de hepatocitos y epidérmico provocaban la activación de PLA2 y la liberación de AA, con la producción de PG que actuarían como mediadores autocrinos y provocarían el aumento de síntesis de ADN14. Estudios experimentales más recientes han puesto de manifiesto que esta producción de PG depende fundamentalmente del aumento de expresión de COX-215,16. El segundo proceso establecería una relación entre las PG y la COX-2 con la fibrogénesis. En cultivos de hepatocitos de rata se demostró la síntesis y liberación a la matriz extracelular de metaloproteinasas como respuesta al añadir al medio de cultivo PGE2, siendo ésta paralela al nivel de expresión de la COX-217. En la patogenia de la hipertensión portal, mediante estudios de modelos animales, se ha implicado a las PG, fundamentalmente la PGI2, en la vasodilatación e hiperemia esplácnica18-21. Otros estudios más recientes han puesto de manifiesto que la producción de tromboxano 2, derivado de la COX-2, tiene un papel fundamental en el aumento de la resistencia vascular a nivel sinusoidal22,23, aunque el papel patogénico de las PG, en la hipertensión portal sinusoidal aún no está establecido24.
Implicación de COX-2 en las hepatopatías crónicas
Hepatopatía alcohólica. En la lesión hepática por alcohol las células de Kupfter cumplen un papel predominante, en respuesta al estrés oxidativo y al aumento de la endotoxina bacteriana. La activación del NF-*B por la endotoxina o por radicales libres produce una inducción de la expresión de citocinas proinflamatorias, como el TNF-*, y de COX-2, fundamentalmente en las células de Kupffer25. En modelos de enfermedad alcohólica en ratas se ha demostrado que el aumento de expresión de la COX-2 está asociado a la intensidad de la lesión necroinflamatoria, al aumento de la endotoxina, del TNF-* y de la peroxidación lipídica26,27. En un trabajo, publicado recientemente, se ha implicado a la PGE2 en la esteatosis hepática inducida por alcohol28.
Hepatopatía vírica. Los mecanismos patogénicos de la lesión hepática por virus no están completamente definidos. En estudios recientes se están generando evidencias, cada vez más sólidas, de la participación de la COX-2 en ellos.
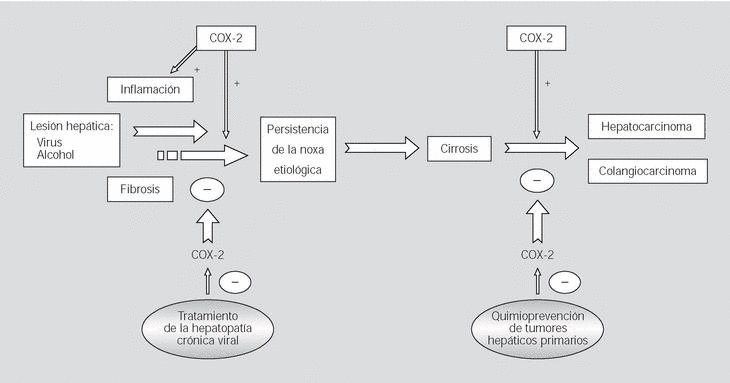
En este sentido, Cheng et al29 observaron un incremento de la expresión hepatocelular de COX-2, tanto en la proteína como en el ARNm, en pacientes con hepatitis crónica por el virus B, en comparación con pacientes con esteatohepatitis no alcohólica y con hígado normal. Estos autores no encontraron relación entre el grado de expresión de COX-2 con el índice de actividad histológica ni con las concentraciones séricas de ADN del virus de la hepatitis B ni de transaminasas. Tampoco encontraron cambios significativos en la expresión de COX-2 en el hígado de pacientes tratados con respuesta favorable y con mejoría de la actividad necroinflamatoria. En otro estudio30, en el que se incluía a pacientes con hepatopatía crónica de origen viral, se demostraba un incremento de la expresión citoplasmática de COX-2 en hepatocitos relacionado con la progresión de la fibrosis pero no con la actividad inflamatoria. Los autores también observaron relación entre los títulos de ácido hialurónico en suero y la expresión intrahepática de la COX-2, lo que apuntaría a la existencia de una asociación patogénica entre la expresión de la COX-2 y la fibrogénesis hepática (fig. 2).
Fig. 2. Papel fisiopatológico de la ciclooxigenasa 2 (COX-2) en las enfermedades del hígado. La lesión hepática inducida por virus o alcohol desencadena fenómenos de inflamación y fibrosis, en los que se hallaría implicada la COX-2, que se identifica entonces como una posible diana terapéutica en esta región. Ante la persistencia de la noxa etiológica, la lesión hepática puede progresar hasta la aparición de cirrosis y hepatocarcinoma. Dado que la COX-2 cumple un papel relevante en la carcinogénesis del hepatocarcinoma y del colangiocarcinoma, la inhibición farmacológica de esta enzima podría ser una estrategia potencial para la quimioprevención de estas neoplasias.
Por otro lado, a pesar de los resultados contradictorios obtenidos en diferentes ensayos clínicos en pacientes con hepatitis crónica viral31,32, se ha propuesto el posible efecto potenciador de la inhibición de la COX-2, mediante antiinflamatorios no esteroideos, sobre la actividad antivírica del interferón alfa33,34. En este sentido, un estudio experimental demostró que el efecto sinérgico antiviral de la indometacina con el interferón alfa estaría en relación con la activación de vías de señalización intracelular que convergen en la activación de las proteínas STAT, que potenciarían la activación de genes dependientes de la acción del interferón alfa34. Por último, en un estudio con un número limitado de pacientes con hepatitis por el virus B, que fueron tratados con indometacina, se observó una importante inhibición de la replicación viral35.
COX-2 y hepatocarcinoma
El interés del estudio de la relación de la COX-2 con la hepatocarcinogénesis ha derivado de la implicación de COX-2 en la carcinogénesis en otros tejidos, principalmente en el cáncer de colon36. La implicación de la COX-2 y de las PG derivadas de su activación, PGE2 fundamentalmente, en la iniciación y el mantenimiento del crecimiento y la supervivencia de las células tumorales se ha relacionado con la inducción de angiogénesis vía factor de crecimiento del endotelio vascular (VEGF)37-39, con la inhibición de la vía apoptótica y el aumento de la adhesión a la matriz extracelular de las células que sobreexpresaban COX-240.
Estudios experimentales han valorado mecanismos carcinogénicos en la región hepática relacionados con la COX-2. En cultivos de hepatocitos tumorales provenientes de pacientes con infección por el virus de la hepatitis C y mediante transfección de la proteína del Core del virus de la hepatitis C a líneas celulares humanas de hepatoblastoma (células HepG2), Tai et al41 demostraron la activación de NF-*B, que es un factor de transcripción que regula la expresión génica de la COX-2, y su implicación en la resistencia a la apoptosis celular. En otro estudio realizado en líneas celulares humanas de hepatoma, se observó cómo un inhibidor selectivo de COX-2, el NS-398, producía una inhibición de la proliferación de las células que sobreexpresaban COX-2, mediante una disminución de la producción de PGE2 asociada a alteraciones de la progresión del ciclo celular y de la tasa de apoptosis42. Esta relación entre la expresión de COX-2, la inhibición de la apoptosis y el aumento de la proliferación celular también se ha demostrado en otros estudios mediante la supresión de la actividad de la COX-2 con sulindaco, nimesulida o NS-39843-46. Todos estos hallazgos indicarían una base racional para el uso de inhibidores de la COX-2 en la quimioprevención del carcinoma hepatocelular47 (fig. 2). Por último, existen estudios experimentales que relacionan la expresión de COX-2 y la capacidad de invasión celular por líneas celulares de hepatoma, vía activación de metaloproteinasas por la PGE2 producida por la proteína X del virus B48, aunque otros autores apuntan a su actuación como un factor permisivo de la invasión celular tumoral pero no suficiente en sí mismo49.
En 1999 se publicaron tres artículos que han servido de referencia en la implicación entre la expresión de COX-2 en el desarrollo del carcinoma hepatocelular. Koga et al50 estudiaron la expresión de la COX-2 en muestras de hígado de 44 pacientes con carcinoma hepatocelular. Los autores encontraron un importante aumento de la expresión de COX-2 en el carcinoma hepatocelular bien diferenciado y una disminución de su expresión en relación con la pérdida de la diferenciación de las células tumorales, por lo que señalan que la COX-2 cumple un papel importante en los estadios iniciales de la hepatocarcinogénesis y en la desdiferenciación de estas células. Los otros dos estudios, publicados por Shiota et al51 y Kondo et al52, corroboran estos hallazgos. Este último estudio demostró una correlación significativa entre la presencia de inflamación en el tejido peritumoral y el nivel de expresión de COX-2 en este tejido. Además, estos autores encontraron una clara relación entre la expresión de COX-2 y la presencia de cirrosis, así como con una menor supervivencia.
Estudios más recientes no aportan nuevos datos53 o plantean controversia debido a sus resultados contradictorios. Así, Morinaga et al54 investigaron la expresión de COX-2 en el tejido tumoral y peritumoral de pacientes con carcinoma hepatocelular. Los autores observaron una mayor expresión de ARNm de la COX-2 en el tejido no tumoral, así como que el nivel de expresión no presentaba diferencias significativas entre la hepatitis crónica y la cirrosis. Además encontraron una correlación positiva entre los niveles de expresión de la COX-2 con el índice de actividad histológica, las concentraciones séricas de GPT y el índice Ki-67, indicador de la actividad regenerativa. Los autores concluyeron que la COX-2 estaría más implicada en la patogenia de la lesión hepática que en la génesis del carcinoma hepatocelular.
COX-2 y colangiocarcinoma
Varios estudios experimentales sobre la expresión de COX-2 en las células ductales del epitelio biliar han aportado nuevos conocimientos sobre la génesis del colangiocarcinoma. Hayashi et al55 encontraron, al estudiar muestras humanas de cáncer de vías biliares, los mayores niveles de expresión de COX-2 en células ductales tumorales; esta expresión es menor en las células ductales no tumorales con reacción inflamatoria y prácticamente inexistente en las células ductales no tumorales. Además encontraron una marcada expresión de COX-2 en las células del epitelio biliar de pacientes con una colangitis esclerosante primaria. Los autores plantean que la COX-2, inducida en la reacción inflamatoria, contribuye a la carcinogénesis en el colangiocarcinoma. El estudio de cultivos de líneas celulares de colangiocarcinoma ha apuntado a la implicación de la COX-2 en la patogenia de esta neoplasia por una serie de evidencias experimentales como la inducción de COX-2 vía activación del receptor del factor de crecimiento epidérmico por los ácidos biliares56, la inhibición de la apoptosis por la COX-257, la implicación de las PG en la proliferación de las células tumorales58 y la supresión del crecimiento de las células tumorales mediante la inhibición selectiva de la COX-255,58. En muestras humanas de colangiocarcinoma se ha demostrado una correlación entre el incremento de la expresión de las proteínas ERBB-2 y COX-259, así como la implicación de la COX-2 en los eventos más tempranos de la carcinogénesis de los ductos biliares y su mayor expresión en los tumores más diferenciados59,60. Todos estos hallazgos indicarían que COX-2 puede ser una diana terapéutica en la quimioprevención del colangiocarcinoma61,62 (fig. 2).
Conclusiones
Existen evidencias cada vez más sólidas sobre el papel que las PG producidas por la COX-2 desempeñan en la patogenia de determinadas enfermedades del hígado. En la hepatopatía alcohólica su expresión inducida en las células de Kupffer se relaciona con la actividad inflamatoria y las PG producidas con la esteatosis hepática. En las hepatitis crónicas por los virus B y C se ha involucrado a la COX-2 en los mecanismos que contribuyen a la lesión hepatocelular y a la fibrosis hepática, así como a las alteraciones hemodinámicas portales, tanto a nivel esplácnico como sinusoidal, características del hígado cirrótico. Especialmente relevante es el papel patogénico de la COX-2 en el carcinoma hepatocelular y el colangiocarcinoma. Se ha demostrado la relación de la sobreexpresión de la COX-2 con los eventos más tempranos de la carcinogénesis de ambos tumores. Los mecanismos por los cuales la COX-2 favorece el desarrollo de estas neoplasias dependen de la inhibición de la apoptosis y del aumento de la proliferación de las células tumorales.
Derivado de estas evidencias experimentales se ha postulado la posible utilidad de inhibidores selectivos de COX-2 tanto en el tratamiento de hepatitis crónicas virales junto al tratamiento antiviral, como en la quimioprevención de las neoplasias hepáticas primarias.