Definición
Resistencia a la insulina
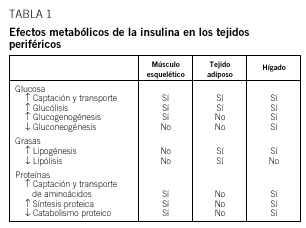
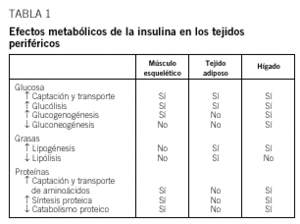
La resistencia a la insulina (RI) se define como la disminución de la capacidad de la insulina para ejercer sus acciones biológicas en tejidos diana típicos, como el músculo esquelético, el hígado o el tejido adiposo (tabla 1). Esta definición está ampliamente demostrada en cuanto al transporte transcelular, a las vías metabólicas de la glucosa y al metabolismo de lípidos. Es posible que el concepto de RI pueda extenderse a las demás acciones (precoces o tardías) de esta hormona, como la captación y transporte transcelular de aminoácidos, la síntesis de proteínas, la regulación de la función endotelial, la estimulación del crecimiento y la proliferación celular o la expresión de numerosos genes reguladores de estas diferentes funciones. En la actualidad, la extensión del concepto de RI a estas otras acciones de la insulina es discutible1 (tabla 1).
Hoy día se considera que la RI crónica o mantenida es el rasgo común de numerosas enfermedades metabólicas y no metabólicas, como la diabetes mellitus (DM) tipo 2, la obesidad, la hipertensión arterial (HTA), las dislipemias o la enfermedad cardiovascular2. La RI puede ser, ocasionalmente, un mecanismo adaptativo fisiológico (p. ej., en la pubertad).
Síndrome de resistencia a la insulina (SRI) o síndrome metabólico (SM): la cuestión terminológica
Ambos términos se utilizan de forma intercambiable con la salvedad que se expone más adelante, si bien aún no se dispone de un consenso universal que permita una unificación (o sinonimia) terminológica.
Criterios de la OMS3
Se considera que existe un SRI o SM si se dan estos criterios: intolerancia a la glucosa, DM tipo 2 o resistencia a la insulina, junto a 2 o más de las siguientes alteraciones: HTA >= 140/90 mmHg, dislipemia definida por hipertrigliceridemia >= 150 mg/dl o descenso del colesterol HDL (varones: 35 mg/dl; mujeres: 39 mg/dl), obesidad central o visceral, microalbuminuria (excreción urinaria de albúmina >= 20 µg/min o cociente albúmina/creatinina > 30 mg/g).
Criterios EGIR (European Group for the Study of Insulin Resistance)4
Presencia de RI o hiperinsulinemia en ayunas (superior al percentil 75%) y dos o más de las siguientes alteraciones: hiperglucemia (glucemia en ayunas >= 110 mg/dl, pero no en el margen diabético), HTA >= 140/90 mmHg o estar recibiendo tratamiento para la hipertensión, dislipemia (triglicéridos [TG] >= 180 mg/dl o colesterol HDL < 40 mg/dl), obesidad central (cociente cintura/cadera en varones >= 94 cm y en mujeres >= 80 cm o índice de masa corporal [IMC] > 30 kg/m2).
Además de estas dos definiciones existen otras, entre las que podemos destacar la publicada por The Third Report National Cholesterol Education Program Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (ATP III) en 20025,6. Se considera que hay un SM ante la presencia de tres o más de los siguientes criterios: obesidad abdominal (diámetro de la cintura > 102 cm para los varones y > 88 cm para las mujeres), hipertrigliceridemia >= 150 mg/dl, colesterol HDL < 40 mg/dl en varones o < 50 mg/dl en mujeres, presión arterial >= 130/85 mmHg y glucosa basal >= 110 mg/dl.
La novedad de esta propuesta es que no incluye la existencia de RI como criterio para la definición del SM, lo que contrasta con las anteriores, y que exige su homologación clinicoepidemiológica antes de adoptarla definitivamente.
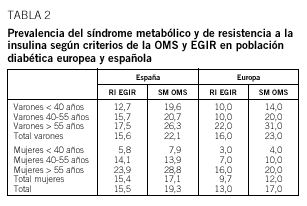
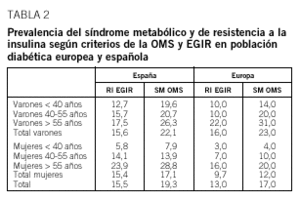
La prevalencia del SM en Europa y en España se detalla en la tabla 2.
Métodos de diagnóstico
Sensibilidad y especificidad de los métodos de diagnóstico
Análisis en muestras reducidas
La técnica del pinzamiento (clamp en la terminología anglosajona) euglucémico hiperinsulinémico (CEH) es considerada el «patrón» de los métodos que cuantifican la sensibilidad a la insulina in vivo. La medida básica del CEH es el denominado valor M, que no es otro que el promedio de glucosa infundida al sujeto en los últimos 20 minutos de la prueba una vez alcanzado el estado estacionario. El valor M representa la sensibilidad a la insulina7 (tabla 3).
El modelo mínimo del metabolismo de la glucosa (MMg) se basa en la ruptura del circuito de realimentación glucemia-insulinemia, ruptura que no es experimental sino matemática. Esta técnica se basa en el modelo del comportamiento de la glucemia durante la prueba de tolerancia intravenosa a la glucosa con la obtención frecuente de muestras de sangre (TTIVGMF) y empleando los «mínimos» elementos: distribución de la glucosa en un único compartimiento, consumo de glucosa por los tejidos periféricos (sensibles e insensibles a la insulina) y producción/consumo hepático de glucosa. La resolución del sistema de ecuaciones pretende obtener un índice de sensibilidad a la insulina (SI) y otro de eficacia de la glucosa (SG). Este método se utiliza con mucha frecuencia en investigación, ya que es el más comparable al del pinzamiento8 (tabla 3).
Análisis en muestras grandes o en estudios epidemiológicos
Concentraciones plasmáticas de insulina en ayunas. Es el método más simple pero tiene una sensibilidad baja.
Homeostasis Model Assessment (HOMA) y su similar, el CIGMA (Continuous infusion of glucose with model assessment)9,10. Ambas técnicas están basadas en modelos matemáticos denominados «estructurales». El HOMA, como el CIGMA, proporciona una medida semicuantitativa de la sensibilidad a la insulina (y de la función de la célula beta), de manera que un sujeto joven, delgado y sano tendrá de promedio una sensibilidad a la insulina igual a 1 y una función de la célula beta del 100% (tabla 3).
Los resultados de estos modelos proporcionan nomogramas en los que a cada par de valores de glucemia e insulinemia les corresponden otros dos de sensibilidad a la insulina y de funcionamiento de la célula beta. En el HOMA, los valores de glucemia e insulinemia se obtienen después de una noche de ayuno (tres determinaciones consecutivas a intervalos de 5 minutos). En el CIGMA, el protocolo experimental es algo más complejo y requiere la infusión intravenosa de una cantidad constante de glucosa durante 1 o 2 horas. Los resultados aportados por diversos autores, en comparación con los del CEH, han sido más que aceptables (r = 0,88 para el HOMA y 0,81 para el CIGMA)11.
Otros métodos
a) Prueba de supresión pancreática12; b) estudio abreviado de tolerancia a la insulina11; c) estudio de tolerancia oral a la glucosa (TTOG) (Matsuda et al)13,14 o, como alternativa, una prueba de tolerancia oral a la comida15; d) método OGIS (oral glucose insulin sensitivity)16, y e) el índice QUICKI17.
En resumen, entre los múltiples métodos que se han publicado hasta este momento, el denominado HOMA es el que mejor ha superado los controles de fiabilidad, si bien debe considerarse un método para evaluar grandes poblaciones o muestras grandes de individuos. De las restantes técnicas basadas en diseños experimentales más complejos se considera que, por razones obvias, los basados en el TTOG son los que deberían imponerse, aunque aún se requiere su validación universal (tabla 3).
Criterios prácticos para la sospecha de RI en atención primaria
Obesidad: IMC > 29,9 kg/m2 (1).
Obesidad central estimada por: perímetro de cintura > 102 cm en varones y > 88 cm en mujeres (2).
Intolerancia a la glucosa, glucemia anormal en ayunas o DM tipo 2.
Antecedentes familiares de DM tipo 2.
Antecedentes personales de diabetes gestacional.
Hipertrigliceridemia 150 mg/dl (2).
HTA (presión arterial sistólica [PAS] > 140 mmHg/presión arterial diastólica [PAD] > 90 mmHg).
En el marco de la atención especializada, los criterios anteriores se complementan con la estimación de la RI según los métodos recomendados anteriormente.
Consecuencias de la resistencia a la insulina
Resistencia a la insulina y enfermedad cardiovascular
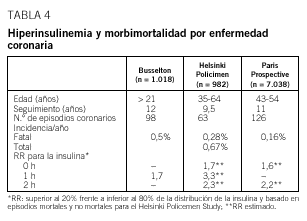
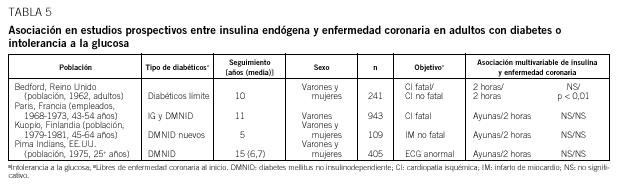
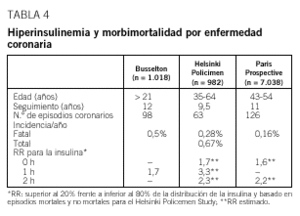
Los datos epidemiológicos disponibles en la actualidad sugieren que la RI es un factor de riesgo para la enfermedad cardiovascular18 (¿factor de riesgo independiente?). Las observaciones epidemiológicas no siempre son concordantes (tablas 4 y 5)19-25.
La relación entre RI y aterogénesis implica diferentes mecanismos combinados, tales como efecto sobre los lípidos, elevación del inhibidor del activador del plasminógeno (PAI-1), incremento del fibrinógeno, disfunción endotelial, aumento del tono vascular, entre otros26,27.
Resistencia a la insulina y diabetes mellitus tipo 2
En la DM tipo 2 coexisten habitualmente dos defectos fisiopatológicos básicos de secuencia temporal variable (uno antes que el otro): defecto en la secreción de insulina y resistencia a la acción de la hormona (RI) en tejidos diana. Uno y otro están condicionados por la interacción entre genes aún mal definidos (predisposición poligénica) y factores ambientales ligados, generalmente, al estilo de vida individual y colectiva: nutrición inadecuada (excesivo aporte energético, errores en la composición cualitativa de la dieta) y escasa actividad física.
Resistencia a la insulina y dislipemias
En la RI, las anormalidades lipídicas más comunes son: a) aumento de los valores de VLDL-TG y de su composición cualitativa (tamaño de partículas, cociente colesterol/triglicéridos); b) aumento de los valores de VLDL-apo B; c) descenso de las concentraciones de HDL; d) elevación de los ácidos grasos libres o no esterificados (AGNE); e) aumento de la lipemia posprandial, y f) presencia de partículas «pequeñas y densas» de LDL.
Estas alteraciones en el perfil lipídico por RI agravan esta situación, particularmente porque las concentraciones elevadas de AGNE disminuyen la captación de glucosa por el músculo esquelético y aumentan el depósito intracelular (p. ej., músculo, islotes de Langerhans) de TG, lo que empeora la situación de RI (lipotoxicidad)28. Este efecto lipotóxico de la RI puede darse incluso en ausencia de intolerancia a la glucosa (efecto tóxico celular de la hiperglucemia crónica)29.
Resistencia a la insulina e hipertensión arterial
Numerosos datos actuales sugieren que la RI y su indicador, la hiperinsulinemia, pueden contribuir a la patogénesis de la HTA. Sin embargo, las relaciones RI-HTA son complejas y varían según numerosos factores30,31, tales como el grupo étnico. Por otro lado, dista de estar universalmente demostrado que en la HTA, situación poligénica y de etiología multifactorial, la RI contribuya sustancialmente a su patogenia32,33.
Resistencia a la insulina e inflamación
En la actualidad está bien reconocido el papel de la RI en el proceso inflamatorio34,35. Así, la inflamación crónica subclínica ha sido propuesta como parte del SRI36, lo que se apoya, entre otros argumentos, en la observación de que los reactantes de fase aguda suelen estar aumentados en la RI. Esta hipótesis implica a numerosas citocinas y factores de crecimiento (proteína C reactiva, factor de necrosis tumoral alfa [TNF-*], interleucina-6 y otros) en la fisiopatología de la RI y de la aterosclerosis37-40.
Resistencia a la insulina y síndrome del ovario poliquístico
El síndrome del ovario poliquístico (SOP) se asocia frecuentemente con RI y se considera que esta hormona es esencial en su patogénesis. Estudios recientes demuestran que el 31-35% de estas pacientes presentan intolerancia oral a la glucosa y del 7,5 al 10% presentan diabetes en la tercera década de la vida41,42. Debido a que del 50 al 80% de las mujeres con SOP son obesas, la RI que presentan puede ser secundaria a la obesidad. La RI del SOP parece ser un proceso intrínseco del síndrome, cuya etiología está en la actualidad muy controvertida.
La asociación de RI e hiperandrogenismo parece tener un componente genético, como sugiere la observación de una elevada prevalencia de DM tipo 2 en los familiares de las pacientes afectadas de SOP43.
Resistencia a la insulina y tratamiento
Tratamiento no farmacológico: dieta y actividad física. Cambios en el estilo de vida
En el tratamiento de la RI o del SM, que es un proceso permanente y dinámico a lo largo del tiempo, existen dos estrategias básicas y complementarias. La primera estrategia terapéutica, indispensable, es no farmacológica.
El tratamiento no farmacológico supone, en primer lugar, eliminar hábitos nocivos, como el excesivo consumo de alcohol (> 30 g/día), de sal (> 300 mg/día) y la supresión (o sustancial reducción) del número de cigarrillos consumidos al día, entre otros factores.
Esta estrategia se apoya en:
a) Dieta.
Los objetivos principales son:
Corregir los errores por exceso o cualitativos de la dieta detectados mediante una cuidadosa historia nutricional y alimentaria de cada individuo. Esta corrección comprende la restricción calórica para reducir el exceso de peso corporal, habitual en el individuo con DM tipo 2 y/o SRI (SM).
Equilibrar la distribución cuantitativa y cualitativa de principios inmediatos, con incremento de la proporción de carbohidratos complejos (50-55% del total de la dieta calórica) y adecuada aportación de fibra (30-40 g/día), reducción de grasas en la dieta (< 30% del aporte calórico total con < 7% de grasas saturadas y en torno al 10% de grasas mono o poliinsaturadas) y aporte de proteínas adecuado a las circunstancias fisiológicas particulares (edad, gestación) si se requiriera.
La mayor incorporación de ácidos grasos monoinsaturados y, sobre todo, poliinsaturados (omega 3, omega 6) tiene un posible beneficio adicional según ciertos estudios, ya que puede modificar la propia composición lipídica de la membrana celular y facilitar la acción de la insulina44-49. Un estudio muy reciente sugiere, paradójicamente, que la ingesta de productos lácteos puede mejorar el síndrome metabólico en individuos con sobrepeso6.
b) Actividad física.
El ejercicio físico aeróbico programado, regularmente sostenido e individualizado en tipo e intensidad, ofrece beneficios definitivos para la prevención de situaciones típicas, como la intolerancia a la glucosa y la DM tipo 250. Dos estudios recientes, el Diabetes Prevention Program en los EE.UU.51 y el Helsinki Diabetes Prevention Study52, establecen de manera inequívoca que una actividad física regular y definida (p. ej., andar durante 30 minutos al día a un ritmo equivalente a 4-5 km/h) previene la aparición de DM tipo 2 o la conversión de intolerancia a la glucosa en hiperglucemia clínica, respectivamente. Los mecanismos por los que el ejercicio físico contribuye a reducir o eliminar la RI son múltiples, complejos e independientes de la pérdida de peso50.
Tratamiento farmacológico
En cuanto al tratamiento farmacológico, en la actualidad está limitado a unos pocos fármacos.
Fármacos sensibilizadores a la insulina
Metformina. Hasta la fecha, su mecanismo de acción sólo es parcialmente conocido y no se dispone de datos experimentales de su efecto directo sobre los tejidos diana, músculo y tejido adiposo. Es posible que su impacto beneficioso sobre la resistencia a la insulina esté mediado por sus efectos sobre la reducción de la producción hepática de glucosa y del llamado fenómeno de la glucotoxicidad53.
El notable estudio United Kingdom Prospective Diabetes Study (UKPDS) 54 demostró que el uso prolongado de metformina en la DM tipo 2 de reciente diagnóstico es tan eficaz en reducir la hemoglobina glucosilada como las sulfonilureas, con la ventaja de inducir menor aumento de peso que éstas. Por su bajo coste, se considera un medicamento de elección en monoterapia para el tratamiento de la DM asociada a obesidad. Adicionalmente, induce una discreta disminución del apetito lo que facilita el control del peso, disminuye las cifras de insulina circulante, no incrementa las cifras de presión arterial53 y puede contribuir a atenuar el riesgo cardiovascular global.
Glitazonas. Esta familia de fármacos, de reciente introducción en la práctica clínica en España, son ligandos de un conjunto (PPAR-*) de factores de transcripción ligando-dependiente, miembros de la superfamilia de receptores nucleares de hormonas esteroides y tiroides denominados «receptores activados de proliferación de peroxisoma» (PPAR: proliferative perisosomal activated receptors).
Existen tres subtipos de receptores PPAR. El PPAR-*, el PPAR-*/ßy el PPAR-*, cada uno clonado por un gen diferente, con distribución tisular y funciones distintas. Los ligandos naturales conocidos de estos receptores son los ácidos grasos y derivados de prostaglandinas (15-PGJ2) y de los leucotrienos (LTB4).
Las glitazonas son una amplia familia de fármacos que se caracterizan por disminuir la resistencia a la insulina. Hay evidencias contrastadas de que las glitazonas estimulan la diferenciación de adipocitos, efecto mediado por la afinidad de las glitazonas con el receptor PPAR-*. Asimismo, las glitazonas poseen un claro efecto insulinomimético y disminuyen la glucemia basal y posprandial de los pacientes con DM tipo 2 sin provocar hipoglucemia ni modificar sustancialmente las concentraciones de insulina circulante. Algunos estudios sugieren un efecto de las glitazonas sobre la producción hepática de glucosa. Este efecto beneficioso es, muy probablemente, indirecto y está relacionado con la disminución de ácidos grasos circulantes como consecuencia del incremento de la actividad de PPAR-*en los adipocitos. También deberemos admitir que ciertas señales desde el adipocito intervienen de algún modo, mejorando la utilización de glucosa en el tejido muscular.
Hasta la fecha se han usado tres glitazonas: troglitazona, rosiglitazona y pioglitazona. La troglitazona se ha retirado del mercado por toxicidad hepática grave en varios casos (fracaso hepático fatal, necesidad de trasplante de hígado). La rosiglitazona se ha empleado en más de 2,5 millones de pacientes sin que se haya observado ninguna señal de hepato-toxicidad como la descrita para la troglitazona ni casos de muerte que pudieran ser atribuidos a este tratamiento. La pioglitazona también está registrada en un buen número de países, incluido España. Tiene un perfil de tolerancia similar al de la rosiglitazona, menor afinidad que ésta por el receptor de PPAR-*y ejerce además un efecto agonista sobre el receptor de PPAR-*.
En Europa, la rosiglitazona y la pioglitazona están indicadas para el tratamiento oral de la DM tipo 2 en pacientes con mal control metabólico, en los que no se logra alcanzar la normoglucemia con metformina o con sulfonilureas o en aquellos pacientes que no toleran la metformina. La combinación con sulfonilureas permite un decremento adicional del 1% en el valor de la hemoglobina glucosilada. La asociación con metformina produce una caída similar e incluso mayor en dosis de rosiglitazona de 8 mg/día. Asimismo, se observa una mejora en la función beta pancreática como consecuencia de una menor lipotoxicidad.
Un aspecto importante en el tratamiento de la resistencia a la insulina por glitazonas son sus posibles efectos beneficiosos sobre la enfermedad cardiovascular. Esta importante posibilidad está en curso de investigación con rosiglitazona.
Por otra parte, en distintos estudios controlados, se ha observado que el uso de las glitazonas puede inducir aumento de peso y favorecer la aparición de edema. Ambos efectos no serían, a priori, beneficiosos, por lo que estos fármacos están contraindicados en aquellos sujetos que presenten cualquier grado de insuficiencia cardíaca. No obstante, estudios muy recientes demuestran que la rosiglitazona ofrece, además, otros efectos beneficiosos importantes, como la reducción de la presión arterial y de los valores circulantes de marcadores inflamatorios que favorecen la génesis de la disfunción endotelial, ambos relevantes en la patogénesis de la enfermedad cardiovascular. Este fármaco afecta también al perfil lipídico, con un aumento inicial de LDL que se estabiliza antes de los 3 meses de su administración, con un cambio favorable en el tamaño de las partículas, pasando de partículas de LDL pequeñas y densas a otras grandes, menos densas y menos aterogénicas, así como un aumento de las partículas HDL y la disminución de los ácidos grasos libres. La pioglitazona ofrece asimismo un efecto beneficioso sobre el lipidograma del sujeto con SM, en el que destaca la disminución de los valores de triglicéridos55-58.
En el SOP, las glitazonas deben utilizarse con cautela y nunca durante el embarazo. En mujeres en edad fértil deben tomarse las medidas oportunas para evitar el embarazo durante la utilización de glitazonas.
Inhibidores de la alfa-glucosidasa
En España se dispone de dos tipos de inhibidores de la alfa- glucosidasa: la acarbosa y el miglitol. Ambos son oligosacáridos complejos que inhibiben la alfa-glucosidasa intestinal y de este modo modulan el proceso de absorción intestinal de glucosa. La diana terapéutica principal es la reducción de la glucemia posprandial. Chiasson et al59 han demostrado que la administración de acarbosa mejoraba el patrón de resistencia a la insulina en pacientes afectados de DM tipo 2 y que, a largo plazo, puede prevenir la transición de intolerancia a la glucosa o DM tipo 2 e incluso atenuar el riesgo cardiovascular asociado a aquella situación59. Los principales efectos adversos no son graves; predominan trastornos gastrointestinales, tales como diarrea o meteorismo, generalmente, dosis-dependiente. La acarbosa, a largo plazo, es más efectiva que otros fármacos (p. ej., metformina) en pacientes ancianos60.
Otras perspectivas farmacológicas
Inhibidores de la lipólisis, agonistas PPAR-*y salicilatos.
Conclusión
a) El tratamiento no farmacológico del SRI (o SM) es en la actualidad un componente indispensable de cualquier plan terapéutico eficaz para mejorar la RI, corregir cualquier componente del SM (intolerancia a la glucosa, dislipemia) así como para prevenir la DM tipo 2 y atenuar sus consecuencias cardiovasculares; b) el tratamiento con fármacos complementa y refuerza, pero no desplaza o sustituye a la dieta, la actividad física ni a la eliminación de cualquier hábito no saludable (tabaquismo, ingesta inmoderada de alcohol e incluso de la persistencia de diversas situaciones de estrés psicofísico); c) la eficacia y buena tolerancia de los fármacos sensibilizadores de la acción de la insulina, ya sean «cl ásicos» (metformina) o «modernos» (glitazonas) están definitivamente probadas y forman parte esencial del arsenal terapéutico moderno del SM como otros (inhibidores de las glucosidasas:acarbosa) que con distinto mecanismo actúan de manera más selectiva en la corrección de situaciones específicas, como la hiperglucemia posprandial.