Objetivos e importancia del control glucémico
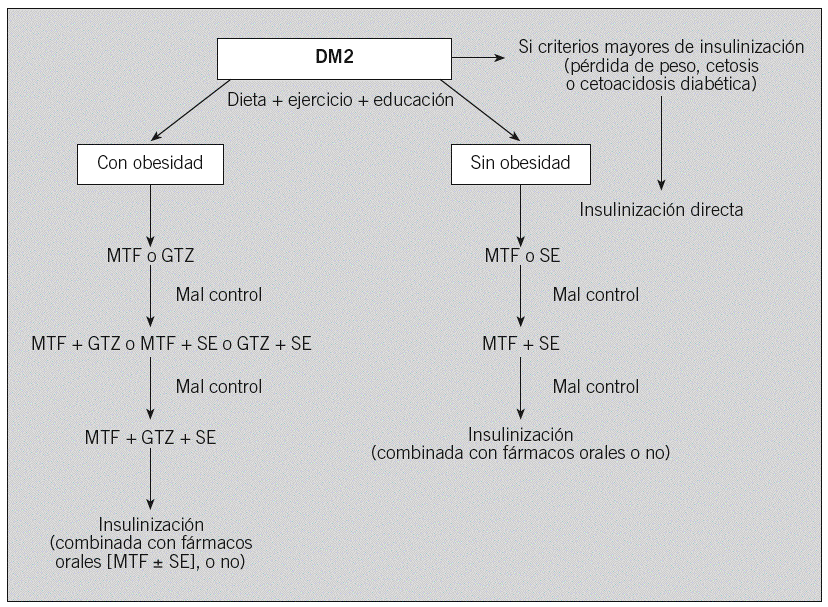
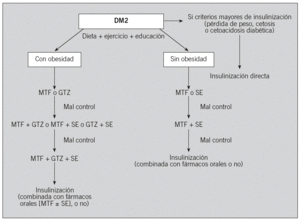
En el tratamiento de la diabetes mellitus tipo 2 (DM2), el objetivo prioritario es obtener un control metabólico óptimo en cuanto a valores de glucosa, lípidos y presión arterial. Este paradigma se basa en estudios (Steno-2, Kumamoto, UKPDS) que demuestran que el buen control puede reducir las complicaciones microvasculares1-3 y en cierta manera la progresión de la enfermedad cardiovascular2,3. El propio buen control glucémico puede contribuir a mejorar otros factores de riesgo cardiovascular no clásicos4,5. Una cifra de hemoglobina glucosilada (HbA1C ) del 7% o superior debería alertar para progresar en el escalonamiento terapéutico, aunque todos sabemos que hay que valorar a cada paciente de forma individual y considerar los riesgos y beneficios que puede comportar la utilización de pautas más intensifica-das6. En esta revisión proponemos un algoritmo terapéutico simplificado (fig. 1), basado en diversas guías de práctica clínica (GPC)6-8 y en la propia experiencia, que, por supuesto, puede ser sometido a debate.
Fig. 1. Una propuesta de algoritmo terapéutico. Los fármacos inhibidores de la alfaglucosidasa pueden utilizarse en caso de intolerancia, contraindicación o alergia a los demás fármacos. Su efecto sobre el control glucémico es pobre y sólo suelen ser efectivos en fases muy iniciales de la diabetes mellitus tipo 2 (DM2). En la última guía de tratamiento de la DM2 (American Diabetes Association/European Association for the Study of Diabetes)7, el algoritmo propuesto ya no distingue entre pacientes con obesidad o sin ella, y a todos se les propone inicialmente metformina (MTF) y, como segundo paso, la elección entre: a) glitazona (GTZ); b) sulfonilurea, o c) insulina basal. Como tercer paso, a) añadir sulfonilurea o insulina; o b) añadir GTZ o insulina, y c) intensificar la insulinización, respectivamente. Como cuarto paso, añadir insulina si no se ha añadido todavía.
Dieta y ejercicio físico
Los cambios en el estilo de vida requieren un programa de tratamiento que integre la dieta y el ejercicio físico9. Para que el programa sea efectivo y se asegure su cumplimiento a largo plazo, hay que realizar un plan nutricional individualizado, variado y con métodos culinarios adecuados, que respeten en lo posible las tradiciones del paciente.
Considerando que la mayoría de los pacientes con DM2 tiene sobrepeso, es muy importante controlar el contenido calórico en el abordaje inicial. Un déficit de 500-1.000 kcal/día permite una pérdida de peso lenta y segura. Se necesita una pérdida de 7.000 kcal para perder 1 kg de peso. En un plan dietético de 2.000 kcal, se recomiendan 6-8 raciones de fécula (3 integrales), 4-5 raciones de verduras, 4-5 raciones de fruta, 2-3 raciones de lácteos desnatados o semidesnatados, 2 raciones como máximo de carne magra y pescado, así como 4-5 raciones de frutos secos, semillas o legumbres10. Con esta pauta dietética no se necesitan aportes adicionales de vitaminas o minerales, y se asegura una cantidad de fibra adecuada (se recomiendan 14 g de fibra por 1.000 calorías). La fuente principal de proteínas debe ser el pescado, los frutos secos, las semillas y legumbres. Si se toma carne, debe ser en filetes delgados, y el pollo, sin piel. Se deben evitar las grasas saturadas (origen animal) y las trans (presentes en platos precocinados o en grasas calentadas a altas temperaturas). La ingesta de colesterol debe ser inferior a 300 mg/día y se deben potenciar las grasas monoinsaturadas (aceite de oliva) y, en menor proporción, las poliinsaturadas (pescado azul). La dieta debe evitar en lo posible los azúcares refinados añadidos, ya que son calorías muy concentradas sin apenas otro aporte nutritivo. La sal debe tomarse con moderación y, si hay hipertensión arterial (HTA), no más de 1,5 g/día. Una dieta rica en potasio (frutas, verduras y legumbres) ayuda a contrarrestar el efecto del sodio y, por lo tanto, a mantener la presión arterial baja.
En cuanto a la proporción de macronutrientes, se recomienda un 15% de proteínas, un 30% de grasas y un 55% de hidratos de carbono11,12. Sin embargo, esta proporción puede variar en función de las preferencias del paciente o de las complicaciones crónicas existentes. Si la función renal es adecuada, se puede aumentar la proporción de proteínas hasta un 20%, a expensas de menos hidratos de carbono, lo cual puede contribuir a la mejoría del control glucémico13. Los pacientes con hipertrigliceridemia pueden beneficiarse de un aumento de la proporción de grasa de hasta un 45% (sobre todo grasa monoinsaturada), a expensas de disminuir los hidratos de carbono14. Para adelgazar, se puede utilizar también durante cortos períodos una dieta muy baja en hidratos de carbono y rica en grasa. Como en pacientes con elevado riesgo cardiovascular se desconocen sus efectos a largo plazo, no se aconseja su uso prolongado15. El alcohol no debe recomendarse, aunque puede tomarse con moderación: no más de 2 bebidas al día en varones y no más de una bebida al día en mujeres (una bebida equivale aproximadamente a una cerveza de 300 ml, un vaso de vino de 175 ml o una copa de cava de 150 ml).
El ejercicio físico ayuda a mejorar el control glucémico en la DM2, la dislipemia y la HTA, principalmente en pacientes con DM2 jóvenes (35-50 años)16-19, pero también en pacientes de edad20 cuando siguen un programa regular. El ejercicio mejora la sensibilidad a la insulina21-25, debido sobre todo a la pérdida de peso progresiva que comporta26-28, pero también a otros mecanismos que no se conocen bien, pero que parecen relacionados con cambios intracelulares, como el paso de transportadores de glucosa hacia la periferia de las células29. También mejora la utilización periférica de glucosa, lo que favorece su almacenamiento en forma de glucógeno16. La caída fisiológica de los valores de insulina tras el ejercicio físico no ocurre en la DM2. En efecto, la producción hepática de glucosa, que ya está aumentada, no se incrementa más. Las hipoglucemias son excepcionales30 debido a este aumento de la producción hepática de glucosa, aunque hay que tener precaución con el uso de sulfonilureas o altas dosis de insulina. Por este motivo, los pacientes con DM2 rara vez necesitan suplementos de hidratos de carbono para la realización de ejercicio moderado, pero pueden ser necesarios si el ejercicio es muy prolongado y se emplean altas dosis de insulina. Con las sulfonilureas suele ser excepcional. Para que el ejercicio afecte la ecuación del equilibrio energético, hay que practicarlo de manera regular, con un mínimo de 30 min al día, 5 días a la semana. Estos 30 min pueden fraccionarse en intervalos de 10 min a lo largo del día. Es necesario que el programa sea gradual, y puede empezarse por un ejercicio suave (p. ej., caminar con esfuerzo progresivo). El ejercicio aeróbico es preferible al anaeróbico porque comporta menos efectos secundarios, aunque los ejercicios de resistencia como parte de un programa aumentan la fuerza muscular, facilitan la integridad de la estructura ósea y pueden mejorar el equilibrio y la coordinación.
En las personas con diabetes, algunas complicaciones potenciales pueden limitar la práctica de ejercicio físico: retinopatía, neuropatía, enfermedad vascular periférica, enfermedad coronaria. En consecuencia, es necesario que se realice previamente un cribado de estas complicaciones para poder adaptar el ejercicio físico en función de su presencia o ausencia. Sería interesante disponer de recursos para realizar una prueba de esfuerzo a todos los pacientes que vayan a realizar ejercicio físico moderado o fuerte. En resumen, el ejercicio físico es beneficioso para controlar la glucemia, el peso y los factores de riesgo cardiovascular en pacientes obesos con DM2. Sin embargo, debido a sus potenciales efectos adversos sobre algunas complicaciones, la valoración riesgo/beneficio tiene que ser individualizada.
Tratamiento farmacológico
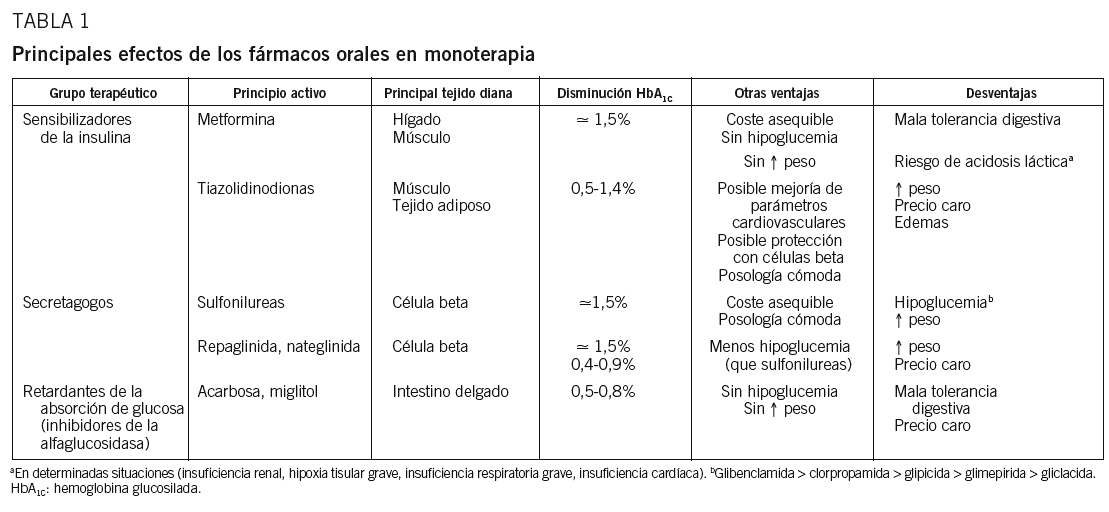
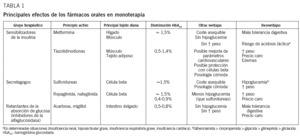
La hiperglucemia de la DM2 es consecuencia de 2 anoma-lías principales: el déficit relativo de secreción de insulina y la resistencia a ésta en los tejidos hepático, muscular y adiposo31-33, aunque en más de la mitad de los casos suele haber una combinación de ambas. El tratamiento farmacológico de la DM2 se fundamenta en fármacos que actúan sobre alguno de los 2 mecanismos citados (tabla 1).
Fármacos sensibilizadores de la insulina
Metformina. La metformina o dimetilbiguanida es la única biguanida aceptada para el tratamiento de la DM2. No suele producir hipoglucemia y su mecanismo de acción no se conoce por completo33. Su efecto regulador de la glucemia se debe principalmente a una reducción de la producción hepática de glucosa del 25-30% (en las personas con DM2 suele estar duplicada), pero también a una disminución de la glucogenólisis y a un incremento de la utilización de glucosa estimulada por insulina en los tejidos muscular y adiposo33-36, mediada por la enzima activada por monofosfato de adenosina37. Asimismo, induce en el hígado la inhibición de la síntesis de ácidos grasos libres, con una activación de su oxidación. Otros efectos, como el aumento de la expresión de hexocinasa hepática y de los transportadores de glucosa, pueden ser secundarios38. También se le atribuye un moderado efecto anorexígeno, todavía no bien demostrado33. Asimismo, parece evidente un efecto beneficioso sobre la actividad fibrinolítica39, lo que, añadido a las anteriores propiedades, a los resultados del estudio UKPDS40, a una menor mortalidad en pacientes con insuficiencia cardíaca41 y a un posible efecto cardioprotector42,43, sitúa a la metformina como el fármaco de primera línea para el tratamiento de la DM2. Su eficacia terapéutica se traduce en una disminución de la glucemia basal, de la media de 24 h, y en descensos de la HbA1C de aproximadamente un 1,5%7 (tabla 1). Está contraindicada en el embarazo y la lactancia, en presencia de cualquier enfermedad que condicione una hipoxia tisular grave, enfermedad intestinal inflamatoria, alcoholismo y, especialmente, en la insuficiencia renal y hepática avanzadas. Algunos autores aconsejan su interrupción temporal en caso de enfermedad febril grave, cirugía mayor y exploraciones radiológicas con contraste intravenoso35. Hay controversia respecto a la utilización de metformina en pacientes de edad avanzada y/o con deterioro de la función renal. Para algunos autores, se puede utilizar con seguridad con un filtrado glomerular de al menos 60 ml/min/1,73 m2 en pacientes ancianos o con función renal alterada44, e incluso con filtrados glomerulares más bajos (40 ml/min/1,73 m2)45. Otros autores46 aconsejan emplear dosis bajas cuando el filtrado glomerular se encuentra entre 30 y 60 ml/min/1,73 m2, y retirarla si el filtrado glomerular es menor de 30 ml/min/1,73 m2. El efecto adverso más grave puede ser la acidosis láctica, pero si se respetan las contraindicaciones es muy poco frecuente (< 1 caso/100.000 pacientes/año)7,47. Revisiones sistemáticas concluyen que no se ha demostrado ninguna relación entre metformina y acidosis láctica o con valores altos de ácido láctico cuando no hay insuficiencia renal47. Según las recomendaciones de las GPC7,8, las evidencias actuales sitúan a la metformina como fármaco de primera elección en el tratamiento de la DM2.
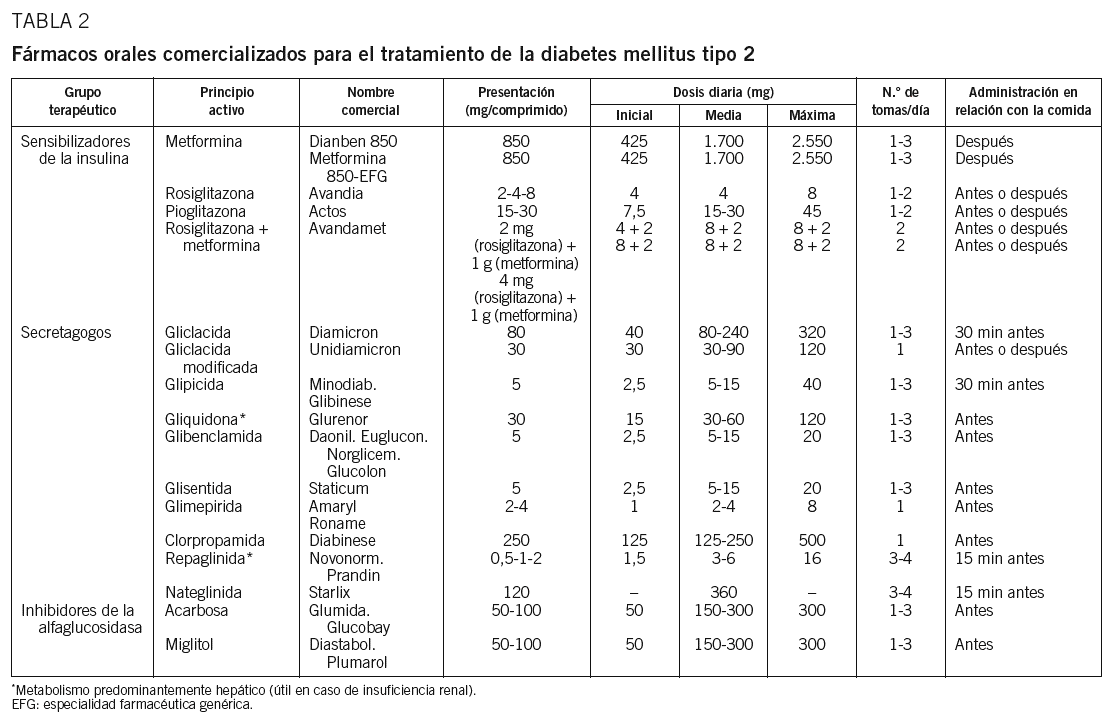
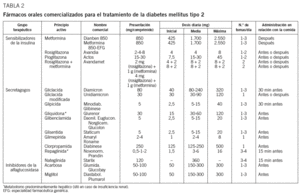
Los efectos secundarios más habituales están en relación con su mala tolerancia digestiva (flatulencia, malestar abdominal, náuseas, sabor metálico y especialmente diarreas), sobre todo si se utilizan dosis altas34,35. En este sentido, es recomendable iniciar el tratamiento con una dosis baja (425 mg en nuestro país), administrada después de una comida, y aumentarla de manera progresiva (425 mg a la semana) hasta llegar a la dosis que mejor se tolere, aunque no se alcance la máxima dosis permitida7,48 (tabla 2). En algunos países se encuentra ya disponible una presentación de liberación retardada, que no parece mejorar la tolerancia digestiva de este principio activo, pero que mantiene la misma eficacia terapéutica con una sola dosis diaria. En general, si se respetan las contraindicaciones, es un fármaco seguro. En este sentido, es aconsejable controlar la función renal anualmente y siempre que se utilicen fármacos potencialmente nefrotóxicos, sobre todo en ancianos.
Tiazolidinodionas (glitazonas o agonistas del receptor de la activación de peroxisomas gamma). En la actualidad, la pioglitazona y la rosiglitazona son los principios activos comercializados de este grupo farmacológico. Su mecanismo de acción no se conoce exactamente, aunque se sabe que activan unos receptores nucleares del sistema del receptor de la activación de peroxisomas gamma, regulador de la transcripción génica. Este sistema activado determina la expresión de proteínas específicas que regulan el metabolismo, modulando la homeostasis de los lípidos, la diferenciación de los adipocitos, la secreción de citocinas, la utilización celular de la glucosa y la sensibilidad a la insulina. Su efecto lipogénico reduce el flujo de ácidos grasos libres, con lo cual contrarrestan la lipotoxicidad49,50. Su eficacia terapéutica se traduce en descensos de la HbA1C del 0,6 al 1,5% (según la dosis utilizada y la cifra de HbA1C inicial) (tabla 1). En este sentido, no se han constatado diferencias entre ambas glitazonas con dosis equivalentes51. Un 25% de las personas tratadas no responden al tratamiento. Su efecto terapéutico no se hace evidente hasta después de unas 6-12 semanas38. Influyen de forma positiva en el perfil lipídico, principalmente la pioglitazona51, pero producen un incremento del peso parecido al que se observa con el tratamiento con sulfonilureas52 o insulina53. Este incremento ponderal se considera multifactorial. Suele ser dependiente de la dosis y parece relacionado con el grado de mejoría del control glucémico, el efecto lipogénico y la retención hídrica que producen54, en especial en tratamiento combinado con sulfonilureas o insulina. También parece que originan una redistribución de la grasa corporal, con una disminución del tejido adiposo abdominal en favor de los depósitos de grasa subcutánea. Por otra parte, la retención hídrica, la anemia por dilución y una posible alteración de las transaminasas son otros efectos indeseables que deben tenerse en cuenta54. Parece aceptado que mejoran diversos parámetros cardiovasculares, como los valores de lípidos, presión arterial, marcadores de inflamación, actividad fibrinolítica, función endotelial y microalbuminuria54. Asimismo, hay estudios que demuestran efectos beneficiosos sobre la esteatohepatitis no alcohólica y también en la función ovárica de mujeres con resistencia a la insulina50. Algunas investigaciones señalan una mejoría en la función de la célula beta, que preservaría la reserva de insulina55-58. Además, mejoran los valores plasmáticos de determinadas citocinas liberadas por el tejido adiposo (como la adiponectina), que parecen desempeñar un papel importante en el desarrollo de la DM2, la resistencia a la insulina y la enfermedad aterosclerótica38,59,60. Estas observaciones apuntan a que las glitazonas podrían desempeñar un papel relevante en fases tempranas de la DM2 y que, potencialmente, podrían modificar la historia natural de la enfermedad y de sus complicaciones61. Cuando el control de la diabetes es insuficiente con la metformina, las nuevas guías7,8 proponen utilizar estos nuevos fármacos como tratamiento sinérgico alternativo a las sulfonilureas, y también en combinación con éstas, cuando no se tolera la metformina o está contraindicada. Una tercera posibilidad sería su utilización como tercer fármaco oral, cuando el tratamiento combinado de sulfonilureas más metformina es insuficiente y no haya insulinopenia ni otras circunstancias que justifiquen una insulinización inmediata. Probablemente uno de los principales dilemas en el tratamiento de la DM2 sea la situación de estos fármacos en el tratamiento combinado, existiendo la disyuntiva de si se deben priorizar los secretagogos cuando la monoterapia con metformina es insuficiente, o bien la insulina cuando el tratamiento combinado de sulfonilureas más metformina no consigue los objetivos de control. Su coste elevado es un condicionamiento nada despreciable en el momento de tomar una decisión terapéutica. Recientemente la Agencia Europea del Medicamento ha aprobado la combinación de pioglitazona con insulina. De momento, se considera que las evidencias científicas que avalan a estos fármacos son todavía limitadas, aunque recientemente se ha publicado un estudio prospectivo con pioglitazona a 3 años en prevención secundaria (estudio PROACTIVE) en el que mejora algunas variables de resultado, si bien parece incrementar la incidencia de insuficiencia cardíaca62. Desde este punto de vista, el riesgo de edema e insuficiencia cardíaca aumenta cuando se combinan estos fármacos con los antiinflamatorios63. Están contraindicadas en pacientes con insuficiencia cardíaca, insuficiencia cardíaca congestiva, anemia y hepatopatía54.
Secretagogos de insulina
Estimulan la secreción endógena de insulina. Incluyen las sulfonilureas y las glinidas35,64.
Sulfonilureas. Estimulan de manera sostenida (varias horas) la liberación de insulina a través de un receptor específico de membrana de los canales de potasio de las células beta del páncreas, y aumentan la sensibilidad de estas células para secretar insulina33. Pueden producir hipoglucemia (sobre todo la glibenclamida, la clorpropamida y, en menor proporción, la glipicida)6 e incremento de peso33,35. Cuando se utilizan con las dosis de máxima eficacia terapéutica, todas tienen efectos parecidos en la reducción de la hiperglucemia, que se traducen en descensos de la HbA1C del 1-2%35 (tabla 1). La elección de una u otra sulfonilurea debe basarse en su potencia, en la prioridad de utilizar fármacos efectivos en monodosis, en el riesgo de hipoglucemia y en el coste económico.
Están contraindicadas en la diabetes tipo 1, diabetes secundaria a pancreatitis, insuficiencia renal (creatinina > 1,4-1,5 mg/dl), embarazo, lactancia, cetosis, procesos intercurrentes graves (infarto, sepsis, etc.), cirugía mayor y alergia a los derivados sulfamídicos64.
Para algunas de las GPC más recientes, las sulfonilureas son la primera opción terapéutica en personas con DM2 sin exceso ponderal, y también lo son como segundo paso cuando la monoterapia con metformina es insuficiente7,8. Desde este punto de vista, no hay consenso sobre la elección terapéutica del segundo fármaco (sulfonilureas, insulina o glitazonas). La cifra de HbA1C, la presencia o ausencia de síntomas relacionados con la hiperglucemia y el precio de la opción escogida son los principales factores que deben guiar la decisión terapéutica.
Glinidas
1. Repaglinida. Es un derivado del ácido benzoico que tiene un mecanismo de acción insulinotrópico parecido al de las sulfonilureas33,35,65. Se une al mismo receptor que las sulfonilureas, pero en un lugar de unión distinto, y estimula la fase rápida de liberación de insulina64. La disminución de la HbA1C es parecida a la conseguida con sulfonilureas35,66, principalmente por su efecto más rápido y amplio sobre la glucemia posprandial. La rápida absorción digestiva y la corta vida media plasmática (1 h) proporcionan un perfil farmacocinético que favorece menos la hiperinsulinemia interprandial y que puede contribuir a que el riesgo de hipoglucemia sea inferior al de las sulfonilureas64, además de inducir menor ganancia de peso. Se aconseja tomarla unos 15 min antes de las comidas, en dosis que pueden oscilar entre 0,5 y 4 mg, ingeridos 2; 3, o 4 veces al día, según el número de ingestas de la dieta33 (tabla 2). Los efectos adversos son similares a los de las sulfonilureas: posible aumento de peso y riesgo de hipoglucemia67. También las contraindicaciones se asemejan a las de las sulfonilureas, aunque, en caso de insuficiencia renal, la excreción biliar de la repaglinida disminuye considerablemente el riesgo de acumulación del fármaco y el peligro de hipoglucemia es menor. Por el contrario, en presencia de hepatopatía clínicamente relevante debe utilizarse con precaución y puede ser necesario disminuir la dosis64. En este sentido, debe evitarse la asociación de repaglinida con genfibrocilo, pues se ha descrito la existencia de una interacción en el metabolismo hepático que prolonga el efecto del secretagogo, habiéndose descrito varios casos de hipoglucemia grave38,68.
2. Nateglinida. Es un derivado de la D-fenilalanina, que actúa aumentando la primera fase de secreción de la insulina de manera parecida a repaglinida. En un principio las indicaciones, contraindicaciones y efectos adversos parecen similares a los de la repaglinida, aunque su efecto en la reducción de la HbA1C es sensiblemente inferior (0,6-0,9%)35 (tabla 1). Su importante eliminación a través del riñón aconseja utilizarla con precaución en situaciones de insuficiencia renal69.
Las GPC más recientes no consideran las glinidas en sus primeras opciones terapéuticas, pero, si predomina el riesgo de hipoglucemia, su utilidad en la práctica diaria es innegable.
Inhibidores de las alfaglucosidasas
Son fármacos que inhiben las enzimas responsables de la hidrólisis de los hidratos de carbono en el intestino, retrasando su digestión y absorción70. Existen 2 principios activos en este grupo terapéutico: la acarbosa y el miglitol. La principal diferencia entre ambos es que, mientras la absorción de la primera es inferior al 2% y se elimina por las heces, el segundo se absorbe en su mayor parte, detectándose en la orina en un 95%69. No actúan directamente sobre ninguna de las alteraciones fisiopatológicas de la DM238. Ambos fármacos disminuyen la glucemia e insulinemia posprandiales, mejoran el perfil glucémico y reducen la HbA1C entre un 0,5 y un 0,8% (tabla 1). Según un reciente metaanálisis, dosis superiores a 150 mg/día no mejoran su eficacia terapéutica y empeoran la tolerancia digestiva71. Los efectos adversos son principalmente gastrointestinales (diarrea, flatulencia, dolor abdominal) y en bastantes casos ocasionan el abandono del tratamiento72,73. También se han descrito alteraciones reversibles de las transaminasas con la acarbosa69,72. Están contraindicados en presencia de enfermedad intestinal grave, pancreatitis, hipersensibilidad a los principios activos, en menores de 18 años, en el embarazo y la lactancia. Además, la acarbosa tampoco debe utilizarse en caso de cirrosis33 y, principalmente el miglitol, en caso de insuficiencia renal69 con valores de creatinina superiores a 2 mg/dl. Las GPC más recientes no los consideran de primera elección terapéutica.
Tratamiento combinado con fármacos orales
Los diferentes grupos terapéuticos de fármacos orales para el tratamiento de la DM2 mejoran el control glucémico mediante mecanismos de acción distintos, aunque sus efectos suelen ser aditivos y complementarios. Teniendo en cuenta que en la DM2 puede prevalecer mayoritariamente una combinación de alteraciones fisiopatológicas32, el tratamiento combinado con fármacos de mecanismo de acción diferente pero sinérgico se convierte en una necesidad. Es muy conocido que la monoterapia es insuficiente en hasta un 30% de los casos. Este hecho, que es común para todos los fármacos, parece relacionado con la gravedad de la hiperglucemia33. Con el tiempo, el deterioro del control glucémico es progresivo, con independencia del fármaco utilizado. En este sentido, el estudio UKPDS74 demuestra que la monoterapia permite mantener los objetivos de control durante un tiempo limitado (a los 9 años de tratamiento con sulfonilureas, metformina o insulina, menos del 25% de los tratados mantenían valores de HbA1C < 7%). Por otra parte, este mismo estudio también pone de manifiesto que el deterioro del control glucémico se relaciona con una pérdida de la función de la célula beta. Esta alteración funcional forma parte de la evolución natural de la enfermedad y viene condicionada por una predisposición genética. En este contexto, cuando el control glucémico es insuficiente con un solo fármaco, las GPC proponen añadir un segundo fármaco oral que tenga un mecanismo de acción distinto pero sinérgico, ya que varios autores33,35,68,75 avalan esta propuesta. Además, la utilización de tratamiento combinado con 2 fármacos permite manejar dosis menores de los principios activos prescritos76, hecho que facilita la tolerancia al tratamiento y reduce la posibilidad de efectos adversos, sin disminuir la efectividad terapéutica. Desde este punto de vista, el efecto esperado que sobre la HbA1C tendrá la adición de un segundo fármaco será similar al obtenido cuando se utiliza en monoterapia34. En teoría, todos los fármacos orales pueden tener efectos sinérgicos y complementarios. No obstante, en la práctica hay ciertas consideraciones que conviene comentar. Por ejemplo, no se recomienda la combinación de una sulfonilurea con una glinida, ya que la acción sostenida de la primera sobre el receptor específico de la célula beta anula el mecanismo de acción corto y rápido de la segunda68. Asimismo, no se dispone de información respecto a la asociación de glinidas con inhibidores de las alfaglucosidasas y su posible efecto aditivo sobre el control de la glucemia posprandial. En general, el tratamiento combinado con sulfonilureas más metformina es el más experimentado en la práctica diaria, el más recomendado y el de mayor potencia hipoglucemiante68. Aunque algunos estudios indican que la asociación de sulfonilureas empeora el pronóstico cardiovascular, especialmente cuando la sulfoniluSUP>42,77,78, el consenso actual es que las evidencias disponibles son todavía insuficientes para desaconsejar dicho tratamiento combinado. En algunas recomendaciones recientes de las GPC dicha combinación se considera la base del tratamiento de la DM2 si no hay contraindicaciones para dichos fármacos8. Asimismo, algunas guías de tratamiento proponen como opción inicial combinar 2 fármacos de mecanismo de acción complementario cuando la HbA1C sea mayor de 8,5-9%7,79.
Una estrategia terapéutica que requiere un comentario especial es la posibilidad de tratamiento combinado con 3 fármacos orales. Varias GPC6-8,79 consideran dicha opción terapéutica (especialmente si la HbA1C < 8%), aunque este triple tratamiento no se ha autorizado de manera explícita en la Unión Europea. Esta posibilidad terapéutica puede ser una alternativa a la insulinoterapia convencional cuando hay dificultades para la aceptación de la insulina68, o si consideramos que todavía no es la mejor opción. En principio, añadir una glitazona a la asociación de sulfonilureas y metformina parece la combinación más potente y mejor estudiada80. La base fisiopatológica de esta asociación se fundamenta en el efecto sinérgico sobre el control glucémico de la estimulación de la célula beta por la sulfonilurea, de la reducción de la neoglucogenia hepática por la metformina y del efecto sobre la sensibilidad a la insulina de las glitazonas, principalmente en los tejidos muscular y adiposo. Esta sinergia puede facilitar la reducción de la HbA1C, que puede oscilar entre el 1 y el 1,8%81,82 en función de la dosis de glitazonas utilizada, manteniendo un perfil de seguridad aceptable. Desde este punto de vista, sería deseable no alcanzar la dosis máxima de la sulfonilurea o metformina y priorizar la adición de una glitazona antes de forzar la dosis de los otros 2 fármacos orales. Los estudios disponibles son todavía insuficientes para poder llegar a conclusiones que permitan generalizar la utilización de este tratamiento triple. Sin embargo, se trata de una opción terapéutica que conviene tener en cuenta antes de iniciar la insulinoterapia. Varias revisiones y GPC señalan que la opción de utilizar inhibidores de las alfaglucosidasas es menos eficaz en la reducción de la glucemia y peor tolerada8,71.
Insulina
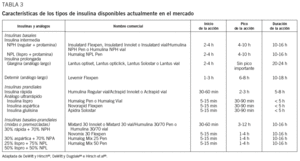
En la tabla 3 se detallan las características de los tipos de insulina comercializados en la actualidad83-85.
En la práctica clínica, una vez que surge la necesidad de iniciar la insulinización, tenemos que plantearnos principalmente 2 decisiones terapéuticas: de una parte, mantener o retirar los fármacos orales; de otra, priorizar la utilización de los nuevos análogos de la insulina o bien iniciar la insulinoterapia con las insulinas humanas convencionales. Las GPC más recientes proponen empezar el tratamiento con insulina cuando el valor de HbA1C supere el 7-7,5% a pesar de dosis altas de fármacos orales. Si se inicia el tratamiento con una insulina basal en monodosis (NPH, NPL, glargina, detemir), recomiendan continuar con metformina y mantener también las sulfonilureas. Para algunos autores83,86,87, continuar el tratamiento con sulfonilureas tiene el valor añadido de poder mantener una secreción de insulina más «fisiológica» (aunque sólo sea residual) directamente a la circulación portal. Este hecho puede facilitar el control de la hiperglucemia diurna, ya que la insulina basal exógena se administra en el tejido subcutáneo periférico y una dosis nocturna influirá básicamente en el control de la glucemia basal. No obstante, otros autores7 recomiendan retirar los secretagogos al añadir a la insulina basal las insulinas prandiales, o al pasar a 2 dosis de NPH o de insulina premezclada. Se considera que, en fases avanzadas de la enfermedad (secreción de insulina en declive y HbA1C > 9-10%), mantener el tratamiento con sulfonilureas puede ser inefectivo83. De otra parte, no disponemos de ningún metaanálisis que evalúe los posibles beneficios de la combinación de metformina, sulfonilureas e insulina5. En la actualidad, la asociación insulina y metformina se considera el tratamiento combinado de primera elección68 según las distintas GPC7,8,88 y las evidencias de diversos estudios7,83,89,90, pues la presencia de metformina contrarresta el aumento de peso, reduce la incidencia de hipoglucemias y disminuye las necesidades de insulina90. Además, los resultados de algunos estudios le otorgan un efecto protector sobre la enfermedad cardiovascular78. La pauta inicial de insulina propuesta es la utilización de una insulina basal una vez al día (detemir, glargina, NPH o NPL, aunque el riesgo de hipoglucemia es mayor con esta última). En general, las principales GPC88,91 recomiendan iniciar la insulinización con insulina nocturna (antes de acostarse), o indistintamente (antes de acostarse o con el desayuno) si se utilizan análogos basales7. En nuestro medio se suele cenar tarde y esta costumbre podría justificar la administración de la insulina nocturna antes de la cena, sin perder los beneficios de la administración a la hora de acostarse (bedtime), pero ganando en comodidad.
Aunque las evidencias científicas con los análogos de la insulina son todavía insuficientes, diversas directrices y GPC8,88,90 consideran razonable su utilización en relación con el menor riesgo de hipoglucemia (especialmente nocturna) y el menor incremento de peso, a pesar de que en la DM2 no hay cambios significativos en la reducción de la HbA1C si los comparamos con la insulina NPH50,92-94. Varias revisiones sistemáticas y metaanálisis apoyan una menor incidencia de hipoglucemias en pacientes tratados con análogos basales. No obstante, un estudio reciente ha puesto de manifiesto que a largo plazo (> 6 meses) la incidencia de hipoglucemia es comparable a la que se observa con insulina NPH92. Cuando una monodosis nocturna no es suficiente, se puede pasar a 2 dosis de NPH o de insulina mixta (premezclada). La tratamiento con múltiples dosis de insulina (una basal + 3 prandiales) se considera la mejor opción de tratamiento8,95 si se precisa una mayor flexibilidad en el horario de administración de insulina y de comidas, en pacientes insulinopénicos principalmente si la HbA1C es mayor del 10% a pesar de dosis máximas de fármacos orales. En general, las necesidades totales de insulina en pacientes con DM2 se estiman en 0,6 U/kg/día96. No obstante, en la práctica clínica, la monodosis nocturna con NPH, NPL, glargina o detemir se recomienda iniciarla con 0,1-0,2 U/kg/día. Si optamos por 2 dosis de insulina NPH o NPL, se necesitarán 0,3-0,5 U/kg/día, repartidas en dos tercios por la mañana y un tercio por la noche. Para su equivalente en glargina o detemir se utilizaría la misma dosis en una sola administración nocturna o diurna, aunque a veces la insulina detemir requiere de su administración en 2 dosis para poder cubrir las 24 h adecuadamente (repartida en un 50 y un 50%, o bien dos tercios por la mañana y un tercio por la noche, como NPH o NPL) y/o aumentar la dosis total. En el tratamiento intensificado se precisarán 0,6-0,7 U/kg/día, repartidas en un 50% de insulina rápida prandial (análogo o no) y un 50% de insulina basal cuando se trata de un análogo de acción prolongada. Si la insulina basal es NPH o NPL, la proporción será del 40% (basal) y del 60% (prandial) (tabla 4).
La utilización de insulinas premezcladas es controvertida. No obstante, algunas GPC6 contemplan su uso cuando los valores de HbA1C son mayores del 8,5%84 o mayores del 10%95. Hay estudios93,97 que comparan análogos basales con premezclas de análogos («análogos bifásicos») y no se observan diferencias significativas entre ellos en cuanto a la HbA1C, hipoglucemias y aumento de peso98. Las insulinas premezcladas suelen utilizarse en pacientes que requieren suplementos de insulina rápida y la utilización de 2 insulinas por separado podría ser motivo de confusión. Las dosis serían de 0,6-0,7 U/kg/día, repartidas en dos tercios antes del desayuno y un tercio antes de la cena, o bien un tercio antes de las 3 comidas principales (tabla 4).
Asegurar cuál es el paradigma en el tratamiento de la DM2 sigue siendo un reto para la investigación. Definir la mejor pauta de insulinoterapia es aún una asignatura pendiente, aunque parece haber consenso en aceptar que los pacientes con deficiencia de insulina son claros candidatos a tratamiento de sustitución con pauta de insulina basal más prandial95. Sea cual sea la pauta de insulina escogida, es deseable la autotitulación de la dosis para ajustar los valores de glucemia. Para unos el objetivo terapéutico serían glucemias menores de 110 mg/dl antes del desayuno y la cena8; para otros7, el valor de glucemia deseable estaría entre 70 y 130 mg/dl. En nuestro medio estos objetivos terapéuticos son de dudosa aceptación, especialmente si tenemos en cuenta que con estas propuestas la expectativa de dosis de insulina en pacientes obesos puede llegar a 1-1,5 U/kg/día, si pretendemos disminuir la HbA1C por debajo del 7%84.
Fármacos antiobesidad que mejoran la tolerancia oral a la glucosa
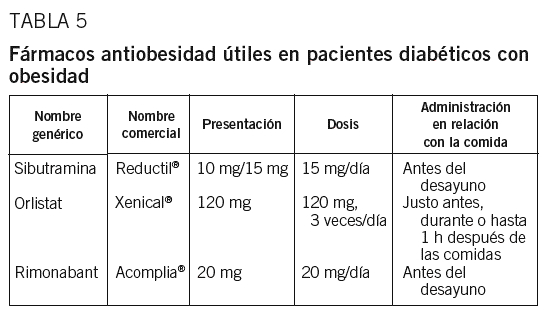
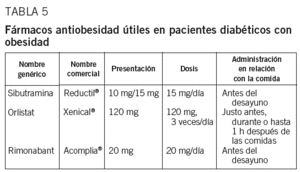
Existe una clara relación entre obesidad y DM2. Las medidas higiénico-dietéticas muchas veces no son suficientes para conseguir una pérdida de peso considerable, con lo que puede ser conveniente añadir algunos fármacos. El orlistat y la sibutramina son los 2 fármacos actualmente aceptados para el tratamiento de la obesidad, esté o no asociada a DM2. El rimonabant es un fármaco que se comercializará próximamente (tabla 5).
Sibutramina. Es un anorexígeno que actúa inhibiendo selectivamente la recaptación de noradrenalina y serotonina. Induce saciedad durante 24 h, con sensación de plenitud precoz. Evita la disminución del metabolismo basal como mecanismo adaptativo a la pérdida de peso, aumentando la termogenia (disminución adicional de 100 kcal/día).
En una revisión sistemática de 29 ensayos clínicos99 se observó una disminución media de 4,45 kg de peso (intervalo de confianza del 95%, 3,62-5,29) a los 12 meses de tratamiento, resultado que corroboró los de otro metanálisis100. En estos estudios se observó una disminución del perfil lipídico, pero todavía no hay datos sobre morbilidad o mortalidad. En este sentido, el estudio mundial SCOUT (Sibutramine Cardiovascular Outcome Trial), que finalizará en 2008, pretende evaluar si la pérdida de peso (con o sin sibutramina) reduce la morbimortalidad cardiovascular a los 5 años en pacientes obesos con alto riesgo cardiovascular.
Hay estudios específicos en pacientes con DM2, como un metaanálisis de 8 estudios101, con un total de 1.093 pacientes diabéticos tratados con metformina, sulfonilureas y/o insulina. De ellos, 552 fueron tratados a la vez con sibutramina (10-20 mg). En él se observó una disminución de peso de 5,5 kg para los pacientes tratados con sibutramina (0,9 kg para placebo) y del perímetro de la cintura de 5,3 cm (1,1 cm para placebo). La pérdida de peso se acompañó de una disminución de los valores de glucosa (0,17 mmol/l) y de HbA1C (0,28%). La presión diastólica y el pulso aumentaron discretamente, mientras que la presión sistólica no se modificó. El perfil lipídico mejoró a expensas de los valores de triglicéridos y de colesterol unido a lipoproteínas de alta densidad (cHDL), pero no se modificaron los de colesterol unido a lipoproteínas de baja densidad (cLDL).
Otro estudio multicéntrico y aleatorizado en pacientes con DM2 demostró que la asociación de metformina y sibutramina era eficaz en la pérdida de peso y en la mejoría del control glucémico al año de tratamiento102. La combinación de distintos tipos de estrategias dietéticas (dietas muy bajas en calorías, productos sustitutivos de comidas) con sibutramina también ha demostrado ser una buena opción en pacientes con DM2 en tratamiento con cualquier tipo de hipoglucemiante103.
La dosis inicial habitual es de 10 mg/día, pero en pacientes diabéticos es mejor empezar directamente con 15 mg/día debido a que son más resistentes al tratamiento (probable efecto contrarrestado por sulfonilureas e insulina). Tanto en pacientes diabéticos como en no diabéticos, una pérdida de 4 kg de peso a los 3 meses fue el mejor predictor de una pérdida de peso superior al 5% a los 12 meses104. Es preciso realizar un seguimiento de la presión arterial y la frecuencia cardíaca cada 15 días durante los 3 primeros meses; mensualmente hasta el sexto mes, y con periodicidad trimestral después de los 6 meses. Son indicaciones de retirada: pérdida a los 3 meses de menos del 5% del peso inicial, aumento de 3 kg respecto al peso perdido, aumento de la presión arterial superior a 10 mmHg, aumento de la frecuencia cardíaca mayor de 10 lat/min o presión arterial mayor de 145/90 mmHg en pacientes hipertensos previamente bien controlados, en 2 visitas consecutivas. Son contraindicaciones: edad menor de 18 años y superior a 65, gestación y lactancia, glaucoma de ángulo cerrado, hipertrofia benigna de próstata con retención aguda de orina, enfermedad cardiovascular --HTA mal controlada (> 145/90 mmHg), arritmias, cardiopatía isquémica, arteriopatía periférica, insuficiencia cardíaca, enfermedad cerebrovascular--, enfermedad psiquiátrica, enfermedad hepática y renal grave, hipertiroidismo, feocromocitoma, ingesta de alcohol y uso concomitante de fármacos antidepresivos (fluoxetina, paroxetina, inhibidores de la monoaminoxida sa, antidepresivos tricíclicos, etc.), antipsicóticos, opiáceos (dextrometorfán, meperidina, pentazocina, fentanilo), litio, triptófano y antimigrañosos como los serotoninérgicos (ergotamina y derivados, triptanos). Los efectos adversos disminuyen con el tiempo y son reversibles. Se consideran 2 grupos en función de su frecuencia: a) palpitaciones, taquicardia, HTA, ansiedad, cefalea, sudación (< 10%), y b) anorexia, estreñimiento, náuseas, boca seca, insomnio (> 10%).
Orlistat. Es un derivado deshidratado de la lipostatina, producida por Streptomyces toxytricini, que actúa como inhibidor específico de las lipasas pancreáticas ocupando el lugar de fijación de los triglicéridos. A dosis plenas inhibe la absorción de hasta el 30% de la grasa de la dieta. Prácticamente no pasa a la circulación sistémica y no interfiere con los tratamientos hipolipemiantes habituales. No es un anorexígeno.
En un metaanálisis reciente105, que incluía 50 estudios en pacientes obesos con o sin diabetes mellitus, se constató una pérdida de 2,89 kg de peso (intervalo de confianza del 95%, 2,27-3,51) con orlistat a dosis plenas a los 12 meses de tratamiento.
Se han realizado estudios específicos en pacientes con DM2, entre ellos, uno multicéntrico de 57 semanas de duración, aleatorizado, doble ciego y controlado con placebo en 391 pacientes que estaban en tratamiento con sulfonilureas106. Este estudio mostró pérdida de peso (el 4,6 frente al 1,7%) y reducción de los valores de HbA1C (0,28 frente al +0,18%), mayores en el grupo tratado con orlistat. Otros estudios realizados en pacientes en tratamiento con metformina observaron resultados similares, sin mayor incidencia de efectos adversos gastrointestinales al asociar los 2 fármacos107,108. Otro estudio realizado en 535 pacientes con DM2 en tratamiento con insulina109 observó pérdida de peso (el 3,9 frente al 1,3%), disminución de HbA1C (el 0,62 frente a un 0,27%), disminución del cLDL (8,6 frente a +3,7 mg/dl) y reducción de los requerimientos de insulina (un 10 frente a un 0%), superiores con orlistat en comparación con placebo. Un metaanálisis de coste-efectividad del uso de orlistat en pacientes con DM2 y obesidad revela resultados positivos a favor del reembolso del coste del fármaco en Suecia y Suiza110.
También se ha estudiado el efecto del orlistat en la prevención de DM2 y de insulinorresistencia111-114. El más importante de estos estudios114 incluyó a 3.305 pacientes con tolerancia oral a la glucosa normal (79%) o alterada (21%), que se aleatorizaron a orlistat (dosis plenas) o placebo. A los 4 años se observó una pérdida de peso superior (5,8 frente a 3,0 kg) y una incidencia acumulada de DM2 inferior (el 6,2 frente al 9,0%) con orlistat respecto a placebo, lo que correspondía a una reducción del riesgo de diabetes del 37,3%. La dosis recomendada es una cápsula de 120 mg justo antes o durante (o hasta 1 h después) de cada una de las 3 comidas principales. Son criterios de buena respuesta: pérdida de más de 2 kg durante el primer mes y de 0,5-1,5 kg a partir del tercer mes. A los 6-12 meses, la respuesta suele ser máxima. Al parecer no hay contraindicaciones, pero se aconseja no utilizar este fármaco en enfermedad gastrointestinal que produzca diarreas. Los efectos adversos son gastrointestinales: manchas oleosas (26%), gases con emisión fecal (23%), tenesmo (22%), deposiciones oleosas (20%) y diarrea (10%). A menudo son transitorios y relacionados con el exceso de grasa de la dieta. No se han observado cambios valorables en las concentraciones de vitaminas liposolubles ni en las características de la mucosa del colon después de la administración de orlistat.
Rimonabant. La hiperactivación del sistema endocannabinoide se asocia a obesidad y dislipemia115,116, ya que aumenta la ingesta y la reserva energética a través de mecanismos centrales y periféricos. El rimonabant es un antagonista/agonista reverso y selectivo de los receptores cannabinoides 1, presentes tanto en el sistema nervioso central como en tejidos periféricos117,118. Los resultados del estudio RIO-Europe119 indicaron que los pacientes tratados durante un año con dosis de 20 mg/día perdieron un promedio de 6,6 kg (frente a 1,8 kg con placebo; p < 0,001) y la disminución de la circunferencia de la cintura fue de 8,5 frente a 2,4 cm con placebo (p < 0,001). También se observó una mejoría de los factores de riesgo metabólicos, siendo el número de pacientes con síndrome metabólico al inicio del 47,7% y al año de tratamiento, del 25,3% (p < 0,001 frente a placebo)120. El perfil de seguridad fue favorable, y los efectos secundarios, leves y transitorios (náuseas en un 12,9 frente al 4,3% en el grupo placebo; diarrea en el 7,2 frente al 3,0%, y mareo en el 8,7 frente al 4,9%). Sólo en un pequeño número de casos se tuvo que interrumpir el tratamiento118. Los resultados del RIO-North America mostraron a los 2 años de tratamiento con 20 mg de rimonabant una pérdida de peso significativa, una reducción de la grasa abdominal y una disminución de los factores de riesgo cadiovascular y de las alteraciones metabólicas, entre ellas la sensibilidad a la insulina121. No se observaron diferencias entre los 3 grupos en cuanto a puntuaciones en el test de ansiedad-depresión (escala Hospital Anxiety Depression). El estudio RIO-Lipids incluía a pacientes con sobrepeso y obesidad, con dislipemia no tratada y sin diabetes122. Con 20 mg de rimonabant durante 12 meses se observaron una pérdida de 6,7 kg y una disminución de 5,4 cm de la circunferencia de la cintura, un aumento del 10% del cHDL y una reducción del 13% de los triglicéridos. También se observó una disminución de las LDL pequeñas y densas, además de un aumento de la adiponectina del 57,7% y una disminución de los valores de proteína C reactiva de 0,9 mg/dl. Finalmente, el estudio RIO-Diabetes se realizó en pacientes con DM2 y sobrepeso que estaban tomando metformina o sulfonilureas y presentaban valores de HbA1C del 6,5-10%123. Los resultados al año en el grupo que recibió 20 mg/día mostraron una pérdida de 3,9 kg y una reducción de la circunferencia de la cintura de 3,3 cm. El cambio de HbA1C fue el siguiente: en el grupo placebo pasó del 7,2 al 7,3%, y en el grupo de 20 mg de rimonabant, del 7,3 al 6,7% (p < 0,001). En los pacientes con valores de HbA1C mayores del 8%, la disminución con 20 mg de rimonabant fue del 1,1%. Las concentraciones de cHDL aumentaron un 8,4%, los triglicéridos disminuyeron un 16,4%, la presión arterial disminuyó 2,3 mmHg y la proteína C reactiva un 25%.
En resumen, la elección de uno u otro fármaco antiobesidad dependerá de los efectos que se deseen obtener y de las posibles contraindicaciones e interacciones. Si se desea un fármaco con pocas interacciones pero que no produzca saciedad, se puede elegir el orlistat. Si se desea un efecto anorexígeno, se elegirá la sibutramina o el rimonabant, teniendo en cuenta que este último tiene efectos beneficiosos añadidos sobre el perfil lipídico y la sensibilidad a la insulina. En la práctica clínica, una posibilidad es añadirlos de manera precoz cuando la dieta y el ejercicio físico no son efectivos en la pérdida de peso. Otra opción es utilizarlos una vez iniciado el tratamiento específico para la diabetes, si el paciente comienza a ganar peso.
Conclusiones
La base del tratamiento de la DM2 es una dieta y una actividad física regular, ambas adaptadas e individualizadas. Aunque sus beneficios son muy evidentes, también lo es la falta de perseverancia en su cumplimiento. Este hecho favorece la instauración precoz del tratamiento farmacológico. En este sentido, algunas de las GPC más recientes aconsejan iniciar dieta, ejercicio y tratamiento farmacológico con metformina tanto en obesos como en no obesos. Otras GPC contemplan las sulfonilureas como la primera opción terapéutica en pacientes con DM2 no obesos y en combinación con metformina cuando la monoterapia con esta biguanida es insuficiente. Desde este punto de vista, la mayoría de la población diabética es candidata a tratamiento combina do con fármacos de mecanismo de acción diferente pero sinérgico, ya que en la mayoría de los casos prevalece una combinación de defectos fisiopatológicos: resistencia a la insulina y déficit de secreción. Como consecuencia, la combinación de fármacos sensibilizadores (metformina, glitazonas) con secretagogos es una prioridad terapéutica. Una nueva opción es el tratamiento combinado con 3 fármacos orales (metformina + sulfonilureas + glitazonas), ya que algunas GPC consideran esta pauta cuando la HbA1C no supera el 8%, si no es factible la insulinización o si ésta no es todavía la mejor opción. Las principales GPC proponen iniciar el tratamiento con insulina cuando la HbA1C se mayor del 7-7,5% a pesar de recibir dosis altas de fármacos orales. En este caso, la primera opción recomendada es iniciar tratamiento con una insulina basal en monodosis (preferentemente nocturna), sin interrumpir el tratamiento oral. En la actualidad la asociación de insulina y metformina se considera el tratamiento combinado de primera elección. Todavía muchos profesionales priorizan iniciar la insulinización con 2 dosis de insulina NPH o NPL, aunque con una monodosis de análogo de acción prolongada puede obtenerse un efecto similar, con menor riesgo de hipoglucemia. En el caso de que haya insulinopenia importante la tendencia actual es el tratamiento sustitutivo con una pauta de insulina basal más prandial en 3-4 dosis. En este contexto, los análogos de insulina adquieren un papel preponderante y su utilización parece razonable, especialmente en pacientes con riesgo de hipoglucemia. Desde un punto de vista práctico, es posible utilizar los fármacos antiobesidad de manera precoz (si la dieta y el ejercicio no son efectivos), o bien si se produce un incremento ponderal durante el tratamiento convencional de la DM2. No obstante, su uso en el tratamiento de la diabetes todavía está lejos del consenso. A pesar de que algunos estudios parecen aportar evidencias acerca de sus efectos beneficiosos sobre el síndrome metabólico (independientes de la pérdida ponderal), parece prematuro otorgar a estos fármacos antiobesidad un protagonismo relevante en el tratamiento de la DM2.
Addendum 24-07-07
En marzo de 2007, la Food and Drug Administration (FDA) notificó posibles efectos adversos de las glitazonas en el metabolismo óseo. Los datos proceden del estudio «A Diabetes Outcome and Progression Trial (ADOPT)»124. En este estudio, la incidencia de fracturas distales en mujeres tratadas con rosiglitazona fue de 2,74/100 pacientes/año, en comparación con metformina (1,54/100 pacientes/año) y glibenclamida (1,19/100 pacientes/año). Este hecho no se ha confirmado en varones y, además, la localización de las fracturas es distinta a las causadas por osteoporosis (predominio proximal, caderas, vértebras). A partir de estos resultados, también se ha llevado a cabo una evaluación específica de los estudios realizados con pioglitazona. En este sentido, se ha observado igualmente un incremento de fracturas en huesos largos distales de mujeres (no en varones) tratadas con esta glitazona (1,9/100 pacientes/año frente a 1,1/100 pacientes/año del fármaco comparador). Según las diferentes autoridades sanitarias, estas evidencias no contraindican el uso de estos fármacos, aunque representan una llamada a la prudencia para los prescriptores.
Por otra parte, en mayo de 2007, a raíz de la publicación de un metaanálisis por parte de Nissen y Wolski125 sobre el aumento del riesgo de infarto de miocardio (odds ratio [OR] = 1,43; intervalo de confianza del 95%, 1,03-1,98; p = 0,03) y muerte por causa cardiovascular (OR = 1,64; intervalo de confianza del 95%, 0,98-2,74; p = 0,06) en pacientes tratados con rosiglitazona (en comparación con un grupo control), se generó una nueva alarma sobre los efectos adversos de las glitazonas. En este caso, la FDA considera que la información actual al respecto todavía es insuficiente, y deja en manos de los profesionales sanitarios la elección personalizada de esta opción terapéutica. Por su parte, la Agencia Europea del Medicamento, en nota de prensa de 23 de mayo de 2007, y la Agencia Española de Medicamentos y Productos Sanitarios, en nota informativa de 24 de mayo de 2007, consideran que en algunos de los ensayos clínicos del metaanálisis de Nissen y Wolski125 se incluyó a pacientes tratados sin seguir las recomendaciones de uso aprobadas para la rosiglitazona en la Unión Europea. Su recomendación es que, según las evidencias actuales, se puede seguir utilizando la rosiglitazona, si se respetan las contraindicaciones reflejadas en las distintas fichas técnicas de los productos que contienen esta glitazona.
Por lo tanto, según las recomendaciones anteriores, hasta el momento de la publicación de esta revisión siguen siendo vigentes los mismos algoritmos terapéuticos propuestos. No obstante, esos resultados pueden obligar a las comisiones de expertos a realizar modificaciones en los planteamientos terapéuticos consensuados. Con independencia de las consideraciones anteriores, la opinión personal de los autores de esta revisión es la de extremar la prudencia y personificar en cada caso la relación riesgo-beneficio de cada prescripción.