El herpes zoster es un proceso relativamente frecuente que afecta a un amplio porcentaje de la población. Se manifiesta con lesiones cutáneas agudas de localización habitualmente en un dermatoma y que suelen producir dolor. Después de la resolución del episodio agudo, especialmente en personas mayores de 50 años, es frecuente la persistencia de síntomas neurológicos acompañados, a menudo, de dolor invalidante denominado neuralgia postherpética (NPH). El diagnóstico precoz y la instauración de un tratamiento en fase temprana puede prevenir la aparición de complicaciones.
Gracias a la colaboración de especialistas expertos en la materia, se ha elaborado este documento con la finalidad de recopilar toda la información disponible en el momento actual sobre la enfermedad y las recomendaciones para su manejo. Este documento no pretende ser una norma de obligado cumplimiento, sino un instrumento de ayuda para el médico que atiende a pacientes con este proceso para así facilitar su conocimiento y mejorar el manejo de éstos.
Definición
El herpes zoster es la manifestación de la reactivación del virus varicela zoster (VVZ), que cursa con afectación cutánea localizada habitualmente en un dermatoma y que se asocia a la inflamación del nervio del área correspondiente1.
En el curso de la varicela, el virus pasa desde la piel y las mucosas a los ganglios sensitivos, asciende centrípetamente por vía nerviosa (fibras nerviosas sensitivas) y también se disemina por vía hematógena2. Los aspectos patogénicos del herpes zoster no están completamente aclarados. Todavía hay controversia sobre si la enfermedad es el resultado de la reactivación de un virus en estado latente o si se trata de una infección persistente. En condiciones normales, el virus se mantiene latente o neutralizado. Si la inmunidad celular desciende por debajo de un grado crítico, el virus continúa replicándose en el ganglio y causa necrosis neuronal, inflamación ganglionar y neuralgia. A través de los nervios sensitivos y las terminaciones nerviosas, el virus avanza hasta la piel, donde produce las lesiones cutáneas3. No se conoce con exactitud cuál es el mecanismo que inicia la reactivación del virus. En la tercera edad, parece que el causante sería la disminución de la inmunidad celular frente al VVZ4. Otras veces su aparición se ha relacionado con estados de inmunodepresión, entre los que se incluyen procesos infecciosos de los que cabe destacar la infección por el virus de la inmunodeficiencia humana (VIH), los linfomas (en particular la enfermedad de Hodgkin) y otras neoplasias, así como los tratamientos inmunodepresores, entre otros. No obstante, en muchos casos la reactivación no se relaciona con ninguna alteración objetivable1.
Hasta 1998 se aceptaba de forma global que había un único serotipo del VVZ5. A partir de ese momento, en un niño afectado de leucemia se aisló una cepa mutante del virus en la gluproteína gE de la envoltura que se denominó VVZ-MSP6. Recientemente han sido diferenciados tres genotipos del VVZ: a) el genotipo europeo (E), aislado principalmente en países europeos y EE.UU.; b) el japonés (J), identificado en Japón, y c) uno denominado mosaico (M), que incluye características de los dos previos y que ha sido aislado preferentemente en países tropicales y en Australia7. Futuros estudios permitirán conocer el significado real de estas variantes y su distribución geográfica8.
Epidemiología
El herpes zoster es una enfermedad infecciosa sin predisposición por sexo, raza o escala social. Un estudio realizado en España que evaluó datos de hospitalización por varicela y herpes zoster muestra una incidencia anual de 4,1 y 8,4 por 100.000 hab/año, respectivamente. Casi la mitad de los pacientes hospitalizados por varicela fueron niños menores de 5 años; por el contrario, el 78% de las hospitalizaciones fueron debidas al herpes zoster y tuvieron lugar en adultos de más de 50 años9. Estudios realizados en diferentes países que han evaluado la infección por herpes zoster en la población general comunican incidencias que varían según los grupos de edad, desde 42 por 100.000 personas/año en personas de 19 o menos años de edad en Rochester, Minnesota (EE.UU.)10, hasta 410 por 100.000 personas/año en un grupo de individuos mayores 15 años en Italia11 y de 373 por 100.000 personas/año en la población general, que comprende todos los grupos de edad, en el Reino Unido12. Más de dos terceras partes de los casos ocurren en personas de más de 50 años y menos del 10% tienen menos de 20 años13. Se estima que el riesgo de presentar herpes zoster durante la vida está alrededor del 10-20%2. En inmunodeprimidos, el herpes zoster ocurre de 20 a 100 veces más que en inmunocompetentes. El herpes zoster suele presentarse una única vez, de forma excepcional algunos pacientes repiten un segundo episodio y menos del 1% lo experimentan más de dos 2 veces. La recidiva suele afectar al mismo dermatoma1.
El único reservorio del VVZ es el ser humano. El virus se transmite de persona a persona por contacto directo a través de la piel o por vía respiratoria o conjuntiva. El paciente puede contagiar la infección del VVZ desde un día antes hasta unos 5 días después de la aparición del exantema o hasta que las lesiones alcanzan el estado de costra1.
Cuadro clínico
Podemos diferenciar en el herpes zoster tres fases: la fase prodrómica, la erupción cutánea y las complicaciones, y la NPH es entre estas una de la más frecuentes1.
Los pródromos, en caso de manifestarse, preceden a la erupción entre 48 y 72 h, ocasionalmente tienen lugar con 1 semana o más tiempo de antelación. Se caracterizan por la presencia de febrícula, cefalea y malestar general. En ocasiones, la primera manifestación clínica es el dolor en toda la zona de piel correspondiente a la metámera afectada. La intensidad es muy variable, desde una mayor sensibilidad al tacto o disestesias, hasta un dolor intenso2.
Generalmente se llega al diagnóstico de herpes zoster en el momento en que se hacen visibles las lesiones papulovesiculares características. Estas se diseminan de forma típica según la distribución del dermatoma de un ganglio sensorial, de forma unilateral y sin pasar la línea media. En la tabla 1 se exponen las características de la erupción cutánea del herpes zoster1.
En los pacientes inmunocompetentes la erupción cutánea se acompaña de dolor en un 60-90% de los casos. Debe distinguirse el dolor agudo, que cursa desde el comienzo de la enfermedad hasta que las lesiones desaparecen, del dolor crónico, que puede durar desde meses hasta años. Este último dolor es el denominado clásicamente NPH2.
La falta de lesiones, su mayor o menor intensidad, su carácter superficial o profundo, su extensión, su localización o la infección en inmunodeprimidos determinan la aparición de una serie de formas de morfología particular (tabla 2)2,3.
Herpes zoster en inmunodeprimidos
Especial mención merece el herpes zoster en personas inmunodeprimidas, entre las que se incluyen por un lado los pacientes afectados de enfermedades que conllevan una disminución de la inmunidad de base y, por otro, las situaciones en que se reduce la inmunidad debido al efecto del tratamiento. La proporción de estos pacientes que manifiestan un herpes zoster oscila entre el 13-15% en personas con enfermedad de Hodgkin, 7-9% en otros linfomas y 1-3% en pacientes con tumores sólidos2,3. Del mismo modo, entre un 20-40% de los pacientes trasplantados de médula ósea presenta un herpes zoster durante el primer año después del trasplante. En el 30% de estos pacientes la infección por VVZ puede diseminarse. También los pacientes con infección por el VIH presentan mayor incidencia de herpes zoster dado que este tiene una tendencia mayor a recurrir2,3. En estos casos, la enfermedad suele tener un curso clínico peculiar, siendo más intenso, con mayor abundancia de lesiones necróticas y mayor afectación de la metámera correspondiente. Las lesiones son en general más persistentes y de curso clínico más tórpido14.
Neuralgia postherpética y otras complicaciones
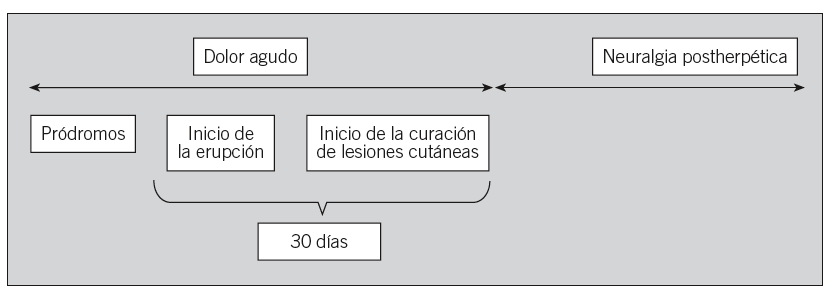
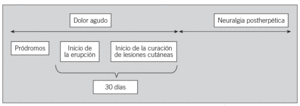
La NPH se define como la presencia de dolor tras la desaparición de la erupción cutánea, aunque son diversas las definiciones empleadas para referirse a esta complicación. En el presente documento se ha consensuado la definición de NPH como la presencia de dolor más de 30 días después del inicio de la erupción cutánea (fig. 1). Se manifiesta de diferentes formas y las más frecuentes son la sensación de quemazón, disestesias, hiperestesias y dolor provocado por mínimos estímulos, y también puede aparecer dolor lancinante de gran intensidad1 (fig. 1). Estos síntomas producen a menudo aparición de fatiga, insomnio, depresión y ansiedad, y afectan de forma importante la calidad de vida de estos pacientes debido a las interferencias que tienen en su vida social y en sus actividades diarias15. La NPH se manifiesta con frecuencia variable según las distintas definiciones empleadas y su aparición está directamente correlacionada con la edad16. La patogenia de la NPH no está aclarada. No parece relacionarse con el grado de inflamación y fibrosis endoneural del nervio afectado. Algunos autores la relacionan con los impulsos anormales que se originan en la raíz del ganglio tras la infección viral3.
Otras complicaciones que aparecen con menor frecuencia incluyen la parálisis motora, la afectación visceral y las complicaciones cutáneas locales.
Fig. 1. Esquema representativo del dolor asociado al herpes zoster.
Diagnóstico
Habitualmente el diagnóstico de herpes zoster es clínico. De todos modos se aconseja el diagnóstico mediante técnicas de laboratorio cuando el cuadro es atípico o plantea dudas diagnósticas con el herpes simple zosteriforme o la erisipela hemorrágica o ampollosa1.
En la tabla 3 se muestra el conjunto de pruebas para el diagnóstico del herpes zoster. El citodiagnóstico de Tzank y el estudio histológico son pruebas inespecíficas que confirman el origen viral de la lesión. El análisis de los anticuerpos en suero permite confirmar el diagnóstico de forma retrospectiva, y es asimismo útil para medir la inmunidad después de la vacunación. El cultivo del virus es la técnica más específica, pero en España se realiza en pocos centros. La inmunología permite la detección del antígeno viral en el tejido mediante inmunofluorescencia directa o indirecta. Es más rápida y económica que el cultivo. Por último, la detección del ADN mediante técnicas de biología molecular (PCR) es muy útil en las formas de zoster sine herpete17-19.
Tratamiento
Con el tratamiento del herpes zoster se pretende: limitar la gravedad, la extensión y la duración del proceso, prevenir la diseminación de la enfermedad, reducir el dolor agudo y, por último, prevenir la NPH20.
De acuerdo con los postulados anteriores, el tratamiento antiviral es beneficioso en la mayoría de los pacientes con herpes zoster, siendo éste imprescindible en los pacientes mayores de 50 años, inmunodeprimidos y en los casos de afectación oftálmica. Otras circunstancias deberán ser consideradas individualmente21. El tratamiento es más efectivo cuando se inicia en las primeras 72 h después del comienzo de la erupción. No obstante, se han comunicado casos en los que se ha iniciado incluso hasta una semana después de haber aparecido las lesiones y ha resultado efectivo22.
Tratamiento antiviral
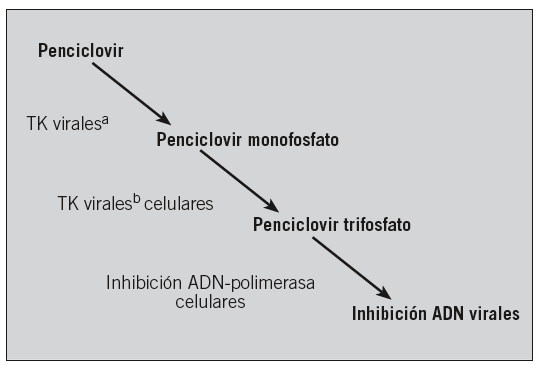
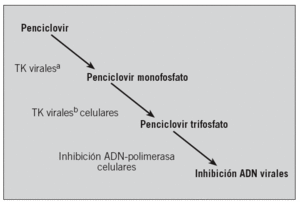
Está representado fundamentalmente por el aciclovir, el valaciclovir, el famciclovir y la brivudina (tabla 4). Los tres primeros actúan por un mecanismo semejante, fosforilizándose inicialmente en aciclovir/penciclovir monofosfato por la timidincinasa (TK) viral. Fosforilizaciones sucesivas por las cinasas celulares dan lugar al aciclovir/penciclovir trifosfato. Este inhibe la síntesis de ADN por un mecanismo competitivo con la deoxiguanidina trifosfato que es el sustrato de la ADN polimerasa23 (fig. 2).
Fig. 2. Mecanismo de acción de los antivirales en el ámbito intracelular.aTK virales: timidincinasa virales. bTK celulares: timidincinasa celulares.
Aciclovir, valaciclovir y famciclovir tienen un excelente perfil de seguridad, tan sólo es importante indicar que en los pacientes renales es necesario modificar la dosis según la función renal, de acuerdo con el aclaramiento de creatinina20. En los pacientes en programa de diálisis los tres fármacos son eliminados sin dificultad.
El aciclovir se utiliza por v.o. a dosis de 800 mg, 5 veces al día durante 7-10 días23. En individuos inmunodeprimidos se utiliza por vía i.v. a dosis de 10 mg/kg i.v./8 h durante 7-10 días. Diversos estudios han mostrado que acorta el tiempo de curación de las lesiones en comparación con el placebo, siendo variable el beneficio en la reducción de la frecuencia o duración de la NPH24-26. Un metaanálisis de estos estudios mostró que los pacientes tratados con aciclovir presentaron también una reducción en la duración del dolor asociado al herpes zoster en fase aguda27. En pacientes con insuficiencia renal moderada (aclaramiento de creatinina inferior a 50 ml/min) la dosis debería reducirse a 800 mg/12 h, y en pacientes con insuficiencia renal avanzada (aclaramiento de creatinina inferior a 15 ml/min) la dosis debería ser de 800 mg/día. El aciclovir presenta un volumen de distribución bajo junto a un elevado perfil hidrofílico, por lo que es fácilmente eliminable mediante hemodiálisis. Por ello, en pacientes hemodializados se debe administrar una dosis posdiálisis. En los pacientes en diálisis peritoneal se debe seguir la misma pauta que en insuficiencia renal avanzada28,29.
El valaciclovir se utiliza en dosis de 1.000 mg, 3 veces al día durante 7 días. No se ha mostrado ningún beneficio adicional extendiendo el tratamiento de 7 a 14 días20. Parece tan efectivo como el aciclovir en la evolución de las lesiones cutáneas, aunque el valaciclovir ha mostrado una reducción significativamente superior en el tiempo medio de resolución del dolor agudo30. Se ha descrito algún caso de síndrome hemolítico urémico y de púrpura trombótica trombocitopénica en pacientes con infección por el VIH, por lo que no se aconseja su utilización en esta población31,32. Se han descrito asimismo en personas sanas interacciones entre la administración oral de aciclovir y valaciclovir con micofenolato mofetil, aunque carecen de relevancia clínica33. En pacientes con insuficiencia renal moderada (aclaramiento de creatinina inferior a 50 ml/min) la dosis debería reducirse a 1.000 mg/12 h y en pacientes con insuficiencia renal avanzada (aclaramiento de creatinina inferior a 15 ml/min) la dosis debería ser de 500 mg/día. El valaciclovir presenta un volumen de distribución bajo junto a un elevado perfil hidrofílico, por lo que es fácilmente eliminable mediante hemodiálisis. Por ello, en pacientes hemodializados se debe administrar una dosis posdiálisis. En los pacientes en diálisis peritoneal, su dializancia es muy baja y se recomienda una dosis de 500 mg/48 h34,35.
El famciclovir después de su administración oral es absorbido en el intestino proximal y convertido rápidamente en el compuesto activo, el penciclovir36. En comparación con el aciclovir y el valaciclovir, el famciclovir es el de mayor biodisponibilidad y el de mayor vida media intracelular. Como el aciclovir y el valaciclovir, se fosforiliza por las cinasas virales y celulares a penciclovir trifosfato que inhibe la ADN polimerasa. Hay algunas diferencias cuantitativas en el mecanismo de acción entre el penciclovir y el aciclovir en términos de grado de fosforilización, estabilidad y concentración de derivados trifosfatos y afinidad por la ADN polimerasa viral36. El penciclovir alcanza niveles intracelulares 100 veces superiores de los que consigue el aciclovir. En su forma trifosfato es un compuesto más estable que el aciclovir y debido a ello posee una mayor vida intracelular, lo que posibilita su administración en una única dosis diaria, pauta de dosificación de mucha mayor comodidad37.
Los estudios que han comparado famciclovir con aciclovir han mostrado cómo la resolución del dolor agudo es más rápida con 750 mg/día de famciclovir38. Los pacientes tratados con famciclovir a dosis de 1.500 mg/día (500 mg, 3 veces al día) por v.o. durante 7 días consecutivos mostraron una resolución más temprana de las lesiones cutáneas que los pacientes tratados con placebo39. El tiempo en que el virus pudo ser aislado también fue inferior en los pacientes tratados con famciclovir39. Asimismo, los pacientes tratados con famciclovir mostraron resolución de la NPH en 63 días, frente a los 119 días del grupo placebo39. Por otro lado, el famciclovir presenta una tolerancia muy buena y se observan cuadros de cefalea y náuseas en proporción similar al grupo placebo39. En un estudio controlado se compararon 4 grupos de tratamiento, 250 mg de famciclovir, 3 veces al día; 500 mg de famciclovir, 2 veces al día; 750 mg de famciclovir, 1 vez al día, y 800 mg de aciclovir, 5 veces al día. Las posologías fueron comparables en cuanto al tiempo de resolución de las lesiones (formación de costras) y la resolución del dolor agudo40. En términos de eficacia los estudios comparativos llevados a cabo entre famciclovir y valaciclovir no han demostrado diferencias relevantes41.
Se ha demostrado eficacia comparable en la curación de las lesiones cutáneas y desaparición del dolor agudo entre el tratamiento con famciclovir 750 mg en dosis única al día; 500 mg, 2 veces al día; 250 mg, 3 veces al día, y aciclovir 800 mg, 5 veces al día42. La pauta de famiciclovir en dosis única diaria de 750 mg resulta sin duda la de mayor comodidad para el paciente, hecho que facilita una mayor adherencia al tratamiento42.
El famciclovir ha demostrado también igual eficacia que la brivudina en la inhibición de la replicación viral asociada al herpes zoster. La incidencia de NPH y su duración fueron similares al comparar una dosis total diaria de 750 mg/día de famciclovir y 125 mg/día de brivudina43.
En pacientes con inmunodepresión, el aciclovir y el famciclovir han sido igualmente eficaces1 (tabla 4). Un estudio controlado mostró cómo los dos tratamientos eran equivalentes en la curación de las lesiones cutáneas y la desaparición del dolor agudo44. Por otro lado, la tolerancia a los dos fármacos fue muy buena44. En los estudios de farmacovigilancia postautorización con el famciclovir se han referido náuseas, cefalea y dolor abdominal inespecífico ocasional en menor proporción a los observados en los estudios clínicos45.
En pacientes en hemodiálisis debe redurcirse la dosis a la mitad y administrar una dosis de 750 mg cada 48 h tras la sesión de hemodiálisis46.
La brivudina (E-5-[2-bromovinil]-2'-desoxiuridina) es un análogo de la timidina que se incorpora en el ADN viral bloqueando de este modo la acción de la ADN polimerasa e inhibiendo la replicación47. Es un antiviral activo frente al VVZ. Este fármaco administrado por v.o. a dosis de 125 mg al día durante 7 días se ha mostrado superior al aciclovir 800 mg, 5 veces al día en el control de la aparición de lesiones agudas en el herpes zoster48. De todos modos la brivudina presenta ciertas contraindicaciones entre las que se incluyen la interacción con el 5-fluoracilo u otras 5-fluoropirimidinas (por ejemplo, floxuridina y tegafur) y su no indicación en pacientes con inmunodepresión49.
El foscarnet es un análogo del pirofosfato inorgánico del ácido fosfonoacético. Actúa produciendo una inhibición de la ADN polimerasa viral. No requiere la fosforilación a una forma activa, como ocurre con los análogos nucleósidos, hecho importante porque la fosforilación es el mecanismo más frecuente de resistencia a los otros antivirales50. Se elimina por el riñón en más del 80% sin metabolizar, por lo que se debe ajustar la dosis en caso de insuficiencia renal. Es el fármaco de elección en los casos de resistencia al aciclovir51. Se administra por vía i.v. en infusión a dosis de 60 mg/kg de peso cada 8 o 12 h durante 2 o 3 semanas.
Otros fármacos como la sorivudina, la netivudina o el lobucavir han sido estudiados para el tratamiento del herpes zoster, pero la gran cantidad de interacciones de la sorivudina y la carcinogenicidad en animales de la netivudina y el lobucavir han limitado su utilización52.
No se recomienda el uso de antivirales tópicos debido a la baja eficacia demostrada y a la frecuente aparición de efectos secundarios.
Tratamiento antiinflamatorio
El uso de glucocorticoides en el herpes zoster es controvertido. Se utilizan por su poder antiinflamatorio que podría evitar el daño neuronal. Parecen tener algún efecto beneficioso a corto plazo, disminuir el dolor agudo y acelerar la curación de las lesiones cutáneas. Se han realizado estudios que evalúan la terapia con glucocorticoides en combinación con aciclovir, y muestran una moderada pero significativa disminución en el tiempo de curación de la lesión cutánea y del dolor agudo53,54. Estos estudios han mostrado también una mejora sustancial en la calidad de vida, medida como la reducción del uso de analgésicos, la mejora del sueño y de la realización de actividades cotidianas54. De todos modos, no se ha podido demostrar ningún efecto beneficioso en cuanto a la limitación de la incidencia o la disminución del tiempo de duración de la NPH.
Tratamiento sintomático
La lesión cutánea debe permanecer limpia y seca para reducir el riesgo de sobreinfección. El dolor agudo puede ser muy grave y en ocasiones requerir la realización de bloqueos del sistema simpático55. A menudo es necesaria también la prescripción de opiáceos. Hay la sospecha de que el control inicial del dolor en la fase aguda puede prevenir la aparición de NPH56.
Tratamiento de la neuralgia postherpética
El tratamiento de la NPH es difícil. La utilización precoz del famciclovir y el valaciclovir tiene efecto en la reducción de la frecuencia y en su duración. Diversos estudios clínicos han evaluado el uso de tratamientos que han sido utilizados durante años, principalmente dosis bajas de antidepresivos como la amitriptilina, la nortriptilina y anticomiciales, como la carbamazepina57. Sin embargo, casi la mitad de los pacientes no responden a estos tratamientos o desarrollan importantes efectos secundarios. Los resultados de los ensayos clínicos controlados recientes apoyan el uso de otros fármacos como la gabapentina, opiáceos como la oxicodona, el parche de lidocaína o la aplicación de capsaicina en forma de crema. Se ha evaluado asimismo la utilidad de los parches transdérmicos de fentanilo58.
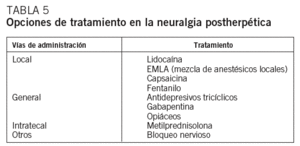
En el momento actual se recomienda comenzar el tratamiento con el parche de lidocaína, la crema EMLA® (lidocaína más prilocaína) o la capsaicina, dada la ausencia de efectos secundarios. Si no se obtienen beneficios o son escasos, pueden utilizarse antidepresivos, como la nortriptilina a dosis de 10-20 mg/día al acostarse con aumento gradual de la dosis. Alternativamente se puede usar gabapentina a dosis bajas que pueden incrementarse paulatinamente hasta 3.500 mg/día, hasta la obtención de respuesta o la aparición de efectos secundarios importantes58. Los opioides y el bloqueo nervioso pueden ser utilizados en casos refractarios. Un ensayo controlado reciente ha comunicado resultados muy buenos con la administración intratecal de metilprednisolona y lidocaína combinadas59 (tabla 5).
Prevención
En 1994 se desarrolló una vacuna con una cepa del virus atenuado de la varicela60. Es una vacuna bien tolerada que ha mostrado una protección alta frente a la varicela61. En España está registrada como especialidad farmacéutica de uso hospitalario y su indicación está limitada a grupos de niños y adultos con riesgo a tener varicela grave (inmunodeprimidos o con enfermedades crónicas) y en personas sanas de su entorno inmediato62. En Corea, Japón y EE.UU. se vacuna frente a la varicela de forma sistemática y universal, y se comprueba su efecto de forma inmediata. La incidencia de la varicela en EE.UU. en el período 1995-2000 disminuyó un 71-84%, y se calculó una tasa de herpes zoster tres veces inferior en los niños vacunados frente a los no vacunados63.
Los datos epidemiológicos disponibles en los países donde la vacunación es sistemática sugieren que ésta daría lugar a una marcada disminución en la incidencia del herpes zoster y de la NPH. Por otro lado, la vacuna establece una infección latente por el virus que podría reactivarse y causar herpes zoster. Por tratarse de un virus atenuado, se puede suponer que en estos casos la clínica sería mucho menos intensa64. De todos modos, hay dudas sobre posibles consecuencias de la vacunación sistemática, como sería el desplazamiento de la infección a la edad adulta, hecho que conllevaría un mayor riesgo de complicaciones. Asimismo, a partir de modelos teóricos se ha pronosticado un hipotético aumento en la incidencia de herpes zoster después de la vacunación masiva. Esto sería debido a la disminución de reinfecciones subclínicas por el virus en estado natural (no atenuado) que de algún=20Textogeneral> En el momento actual se trabaja en una presentación que combinaría la vacuna del virus VVZ con la vacuna triple viral. Esto facilitaría su incorporación al calendario de inmunizaciones sistemáticas en edad escolar61.
Agradecimientos
Este grupo de trabajo agradece la participación de la Dra. Magda Guilera del grupo HOR-Europe en el proceso de elaboración del documento.
Queremos también agradecer de un modo especial a los Dres.
Jordi Peyri y Julián Sánchez, de los servicios de Dermatología del Hospital Virgen del Rocío de Sevilla y del Hospital de Bellvitge de Barcelona, respectivamente. Ambos han participado de manera activa en todo el proceso de elaboración de este artículo.