La cirrosis hepática es una causa muy frecuente de morbilidad y mortalidad en todo el mundo. Los factores etiológicos más frecuentes de cirrosis en nuestro medio son el consumo excesivo de alcohol y la enfermedad hepática por depósito de grasa de origen metabólico. La cirrosis se presenta en dos fases bien diferenciades, compensada y descompensada, según la ausencia o presencia de complicaciones asociadas, respectivamente. Las estrategias terapéuticas actuales se dirigen al control de las complicaciones (ascitis, encefalopatía hepática, infecciones bacterianas o hemorragia digestiva, entre otras) o a la realización de un trasplante hepático si no existen contraindicaciones; no obstante, es importante conseguir la eliminación del factor etiológico responsable de la enfermedad, puesto que ello puede conducir a la desaparición de las complicaciones, estado que se denomina recompensación. El presente artículo propone una revisión actualizada sobre la epidemiología de la cirrosis y sus principales causas, y ofrece una visión general de la clínica y tratamiento de las complicaciones de la enfermedad, además de trazar las futuras líneas de investigación en este campo.
Liver cirrhosis is a common cause of morbidity and mortality worldwide. Excessive alcohol consumption and metabolic associated steatotic liver disease are the most common etiological factors of cirrhosis in our region. Cirrhosis occurs in two well-differentiated phases, compensated and decompensated, depending on the absence or presence of complications, respectively. Current therapeutic strategies are aimed at controlling these complications (such as ascites, hepatic encephalopathy, bacterial infections, or digestive hemorrhage, among others) or performing a liver transplant if there are no contraindications. However, it is important to eliminate the etiological factor responsible for the disease, as this can lead to the disappearance of complications, a state known as recompensation. This article proposes an updated review of the epidemiology of cirrhosis and its main causes, and offers an overview of the clinical features and treatment of the disease's complications, in addition to outlining future lines of research in this field.
La cirrosis hepática representa el estadio final de una gran parte de las enfermedades crónicas del hígado y es actualmente una causa frecuente de morbilidad y mortalidad en todo el mundo1.
Se caracteriza clínicamente por dos estadios diferentes. Una primera fase asintomática en la que los pacientes no presentan complicaciones de la enfermedad y que se conoce como cirrosis compensada, y una segunda fase en la que tiene lugar el desarrollo de síntomas y complicaciones específicas, denominada cirrosis descompensada. En esta fase sintomática, los pacientes desarrollan complicaciones recurrentes, lo que provoca un empeoramiento de la calidad de vida1.
Actualmente no existe ningún tratamiento curativo de la cirrosis, aunque la eliminación del factor etiológico de la misma puede dar lugar en algunas ocasiones a la resolución de los episodios de descompensación. Este fenómeno se denomina recompensación2.
El tratamiento actual de los pacientes con cirrosis se basa en la terapia específica de las complicaciones, siendo el trasplante hepático el único tratamiento capaz de cambiar la historia natural de la enfermedad1.
Esta revisión resume el conocimiento actual disponible sobre las causas de cirrosis, los mecanismos implicados en la progresión y descompensación de la enfermedad, así como la estrategia para el enfoque diagnóstico y terapéutico de estos pacientes.
EpidemiologíaLa cirrosis hepática representa el estadio final de las enfermedades hepáticas crónicas y es una causa mayor de morbimortalidad en la mayoría de los países del mundo1. Produce morbilidad y mortalidad principalmente a través del desarrollo de complicaciones clínicas (ascitis, encefalopatía hepática [EH], infecciones bacterianas, hemorragia digestiva o hepatocarcinoma). La mortalidad asociada a la cirrosis representa un 2,4% de la mortalidad a nivel mundial, y es responsable de aproximadamente dos millones de muertes anualmente, y se sitúa como undécima causa de muerte a nivel global3,4. El impacto de la cirrosis a nivel de salud es especialmente elevado en la población adulta joven, siendo el rango de edad de entre 25 y 49 años el más afectado por la enfermedad5.
En el mundo, la causa más frecuente de mortalidad asociada a la cirrosis es la hepatitis C, seguida por el alcohol, la hepatitis B y la enfermedad hepática de origen metabólico (MASLD), respectivamente6. Sin embargo, en Europa, el consumo excesivo de alcohol es con mucho la causa más frecuente de morbilidad y mortalidad asociada a la cirrosis. A la elevada prevalencia de la hepatopatía causada por el alcohol se suma el hecho de que esta afecta a población significativamente más joven en comparación con otras enfermedades crónicas como la diabetes. Este hecho determina que las enfermedades hepáticas crónicas y en particular la cirrosis constituya la segunda causa de pérdida de años de vida laboral en Europa tras la cardiopatía isquémica, lo cual representa un gran impacto a nivel de salud de la cirrosis hepática7.
Etiología y patogeniaEn nuestro entorno, las causas de cirrosis hepática han experimentado un cambio significativo en los últimos años. La hepatitis C, previamente dominante, ha disminuido drásticamente con la introducción de los antivirales de acción directa (AAD)8. El consumo de alcohol es, actualmente, la causa preponderante en España, seguida de cerca por la enfermedad metabólica hepática4. Es importante destacar que en algunos pacientes puede coexistir más de un factor etiológico, lo que puede acelerar la progresión de la enfermedad. Las principales causas de cirrosis se exponen con detalle en la tabla 11.
Etiología de la cirrosis
| Viral |
| Hepatitis C |
| Hepatitis B |
| Hepatitis D (superpuesta a hepatitis B) |
| Relacionada con el alcohol |
| Enfermedad hepática asociada al consumo de alcohol |
| Metabólicas y genéticas |
| Enfermedad hepática de causa metabólica |
| Hemocromatosis |
| Enfermedad de Wilson |
| Deficiencia de alfa-1 antitripsina |
| Fibrosis quística |
| Deficiencia de lipasa ácida lisosomal |
| Colestasis intrahepática familiar progresiva |
| Tirosinemia tipo 1 |
| Enfermedad por almacenamiento de glucógeno tipo IV |
| Autoinmune |
| Hepatitis autoinmune |
| Colangitis biliar primaria |
| Colangitis esclerosante primaria |
| Biliares |
| Atresia biliar |
| Estenosis biliar |
| Vasculares |
| Síndrome de Budd-Chiari |
| Enfermedad veno-oclusiva |
| Enfermedad hepática crónica asociada con cirugía de Fontan |
| Cirrosis cardiaca |
| Relacionadas con medicamentos (uso a largo plazo) |
| Metotrexato |
| Amiodarona |
| Metildopa |
| Vitamina A |
| Cirrosis criptogénica (causa incierta) |
Adaptado de 1.
El consumo de alcohol conlleva un riesgo sustancial de cirrosis, que está estrechamente vinculado a los patrones de consumo: el riesgo se incrementa significativamente a partir de la ingesta de más de dos unidades de bebida estándar (UBE) de alcohol al día, que corresponden aproximadamente a unos 20 g de alcohol puro, siendo esta cantidad menor en el caso de las mujeres9. El riesgo de padecer cirrosis incrementa con el aumento de la cantidad de alcohol consumido y con el tiempo de consumo. El pronóstico de los pacientes con cirrosis hepática descompensada y consumo continuado de alcohol es desfavorable. Por el contrario, entre los pacientes con cirrosis que adoptan la abstinencia alcohólica, es común observar una recompensación de la enfermedad tras un tiempo prolongado de abstinencia, pudiendo mantenerse esta situación por periodos largos10,11.
Enfermedad hepática de causa metabólicaEl diagnóstico de enfermedad MASLD se establece ante la presencia de esteatosis hepática y la identificación de factores de riesgo cardiometabólicos, además de la ausencia de otras etiologías de enfermedad hepática crónica12. Con la progresión de la enfermedad y el desarrollo de cirrosis, los signos histológicos característicos de MASLD, como la esteatosis y la inflamación hepática, pueden desaparecer. En estos casos el diagnóstico debe establecerse de acuerdo con la presencia de factores de riesgo cardiometabólicos y la ausencia de otros factores etiológicos en un paciente con cirrosis hepática.
Recientemente se ha modificado la nomenclatura de las enfermedades hepáticas que cursan con esteatosis, como la enfermedad hepática asociada al consumo de alcohol o la enfermedad hepática de causa metabólica12. Ambas entidades se engloban dentro del espectro de la enfermedad hepática con esteatosis (SLD). Esta nueva definición tiene como objetivo una nomenclatura positiva respecto de la enfermedad hepática grasa de causa metabólica, y no como una anteposición al consumo de alcohol (previamente se denominaba non-alcoholic fatty liver disease), así como la supresión del término fatty que en inglés tiene un carácter estigmatizador y peyorativo. Además, en esta nueva definición se ha introducido el concepto de la enfermedad mixta asociada al consumo de alcohol junto a la existencia de factores de riesgo cardiometabólicos. Esta entidad se ha denominado MetALD12.
Hepatitis viralesLa cirrosis hepática causada por el virus de la hepatitis C (VHC) actualmente tiene una incidencia residual en nuestro entorno8. Se manifiesta tras una infección crónica por VHC de larga duración; aproximadamente la mitad de los pacientes tienen antecedentes de transfusiones sanguíneas previas a 1989 o bien exposición a drogas por vía parenteral13. El diagnóstico se establece mediante la detección de marcadores serológicos como el anticuerpo contra el VHC (anti-VHC) y el ARN-VHC13.
La infección por el virus de la hepatitis B (VHB) es la causa principal de enfermedad hepática crónica global, especialmente en Asia y África14. Aunque en España la prevalencia de la infección por el VHB es moderada y la vacunación universal ha reducido su incidencia, la migración desde territorios con alta prevalencia ha compensado la disminución en la población local15. El diagnóstico se realiza por la detección del antígeno de superficie del VHB (HBsAg) en suero. La replicación del virus varía entre pacientes, y aquellos con replicación viral activa deben recibir tratamiento con análogos de nucleósidos como tenofovir o entecavir para suprimir la replicación viral y con ello reducir la progresión de la enfermedad y el riesgo de hepatocarcinoma16.
Otras causasLa cirrosis hepática debido a la hepatitis autoinmune es una causa cada vez más frecuente, pero infradiagnosticada. Se desarrolla después de sucesivos brotes de inflamación hepática y se diagnostica mediante análisis sanguíneos (identificación de autoanticuerpos) y hallazgos histológicos; su tratamiento consiste en glucocorticoides y azatioprina17. La colangitis biliar primaria (CBP) y la colangitis esclerosante primaria (CEP), deben ser consideradas en pacientes con alteraciones analíticas en forma de colestasis principalmente (aumento de la gamma-glutamil transferasa [GGT] y de la fosfatasa alcalina [FA]), y la hemocromatosis y la enfermedad de Wilson también requieren atención especializada para su diagnóstico y tratamiento1.
FisiopatologíaLa cirrosis hepática se define como la sustitución del tejido hepático sano por tejido cicatricial, principalmente colágeno, que origina la formación de nódulos de regeneración1. La fibrosis hepática es un proceso dinámico resultado de la inflamación crónica del tejido hepático, causada por los distintos factores etiológicos previamente descritos (virus, alcohol, esteatosis, etc.). Esta inflamación promueve la producción de colágeno y la acumulación de matriz extracelular, dando lugar a la formación de un tejido cicatricial que termina por formar nódulos de regeneración, hecho que define la cirrosis desde un punto de vista histológico. Estas anormalidades estructurales provocan una distorsión en la arquitectura vascular del hígado que incrementa la resistencia al flujo sanguíneo portal y desencadena la aparición progresiva de hipertensión portal. El incremento progresivo de la presión portal es el causante de la mayoría de las complicaciones clínicas de la enfermedad18.
Historia natural y complicacionesLos hallazgos en la exploración física sugestivos de cirrosis se observan principalmente en pacientes con enfermedad descompensada, si bien, se pueden identificar también en aquellos con cirrosis compensada1. Son característicos los angiomas aracniformes en la parte superior del tronco y la cara, mientras que en las manos puede observarse la presencia de eritema palmar. Otro hallazgo sugestivo de hepatopatía crónica es la pérdida de características sexuales secundarias, principalmente disminución del vello, y el desarrollo de ginecomastia. El examen abdominal puede revelar un lóbulo hepático izquierdo agrandado e irregular, además de esplenomegalia, y en ocasiones, puede observarse distensión de las venas abdominales1.
Las enfermedades hepáticas crónicas evolucionan de forma silente a lo largo de años, en un estado asintomático denominado cirrosis compensada; cuando aparecen complicaciones asociadas a la enfermedad, hablamos de cirrosis descompensada1. Las complicaciones más importantes se discuten a continuación:
AscitisLa ascitis se define como la acumulación de líquido en la cavidad peritoneal19. En el caso de los pacientes con cirrosis, la ascitis suele tener una concentración de proteínas inferior a 30g/L y se manifiesta como un aumento en la circunferencia abdominal que causa malestar en el paciente, y suele acompañarse de edema en las extremidades inferiores19,20.
Es la complicación más frecuente en pacientes con cirrosis21 y se asocia con un mayor riesgo de otras complicaciones de la enfermedad21. Su aparición comporta un mal pronóstico además de un significativo deterioro de la calidad de vida de los pacientes. La probabilidad de supervivencia a cinco años de los pacientes con cirrosis y ascitis es de aproximadamente el 30%, en comparación con el 80% de supervivencia de los pacientes con cirrosis compensada21,22.
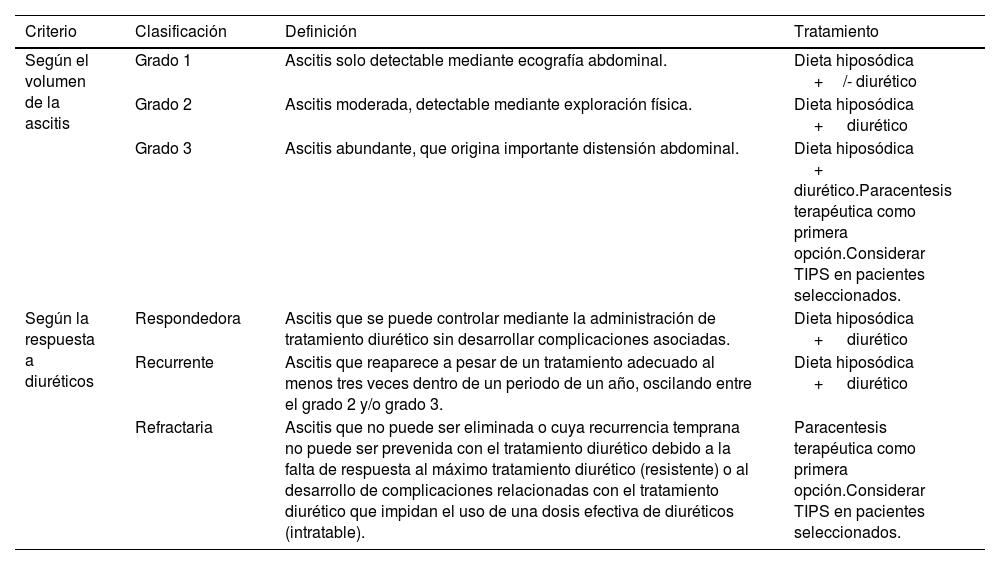
La ascitis se clasifica en función del volumen o bien en función de la respuesta a la dieta baja en sodio y el tratamiento diurético (tabla 2)20. Para su tratamiento es importante evaluar la excreción de sodio en orina, puesto que este parámetro se relaciona con la respuesta al tratamiento diurético, así como con el pronóstico de los pacientes: cuanto más baja es la excreción de sodio en situación basal, peor es el pronóstico de los pacientes y más difícil es la respuesta a diuréticos. El tratamiento de la ascitis consiste en una dieta baja en sodio (aproximadamente 80 mEq de sodio al día), combinada con tratamiento diurético, siendo de elección la espironolactona, asociada o no, a furosemida20.
Clasificación de la ascitis
| Criterio | Clasificación | Definición | Tratamiento |
|---|---|---|---|
| Según el volumen de la ascitis | Grado 1 | Ascitis solo detectable mediante ecografía abdominal. | Dieta hiposódica +/- diurético |
| Grado 2 | Ascitis moderada, detectable mediante exploración física. | Dieta hiposódica + diurético | |
| Grado 3 | Ascitis abundante, que origina importante distensión abdominal. | Dieta hiposódica + diurético.Paracentesis terapéutica como primera opción.Considerar TIPS en pacientes seleccionados. | |
| Según la respuesta a diuréticos | Respondedora | Ascitis que se puede controlar mediante la administración de tratamiento diurético sin desarrollar complicaciones asociadas. | Dieta hiposódica + diurético |
| Recurrente | Ascitis que reaparece a pesar de un tratamiento adecuado al menos tres veces dentro de un periodo de un año, oscilando entre el grado 2 y/o grado 3. | Dieta hiposódica + diurético | |
| Refractaria | Ascitis que no puede ser eliminada o cuya recurrencia temprana no puede ser prevenida con el tratamiento diurético debido a la falta de respuesta al máximo tratamiento diurético (resistente) o al desarrollo de complicaciones relacionadas con el tratamiento diurético que impidan el uso de una dosis efectiva de diuréticos (intratable). | Paracentesis terapéutica como primera opción.Considerar TIPS en pacientes seleccionados. |
TIPS: transjugular intrahepatic portosystemic Shunt.
La hemorragia gastrointestinal debida a rotura de varices esofagogástricas es la segunda complicación más frecuente en pacientes con cirrosis y se asocia a una mortalidad del 20% a las seis semanas20. El riesgo de hemorragia por varices está principalmente relacionado con el tamaño de las varices y aumenta en relación con la gravedad de la disfunción hepática. La profilaxis primaria en pacientes con varices de riesgo y/o mala función hepática debe realizarse mediante el tratamiento con betabloqueadores no cardioselectivos, o bien mediante la realización periódica de ligadura endoscópica de las varices. En el caso de pacientes con antecedente de hemorragia por varices, debe establecerse profilaxis secundaria con la combinación de ambas estrategias2. Los pacientes también pueden presentar hemorragia relacionada con la gastropatía, enteropatía o colopatía por hipertensión portal, que suele ser más insidiosa que la de las varices y generalmente se manifiesta en forma de anemia.
Encefalopatía hepáticaLa EH se define como el espectro de anomalías neuropsiquiátricas potencialmente reversibles secundarias a disfunción hepática, y/o presencia de shunts portosistémicos, y consiste desde la encefalopatía mínima (grados 0 y 1) hasta la encefalopatía manifiesta de forma clínica (grados 2, 3 y 4)23. Las manifestaciones clínicas evidentes de EH se desarrollan en el 30-45% de los pacientes con cirrosis23, siendo la complicación que con mayor frecuencia causa ingreso y reingreso hospitalario24. Todo ello comporta una afectación importante en la calidad de vida de los pacientes y de sus cuidadores25.
Insuficiencia renal aguda y síndrome hepatorrenalLa insuficiencia renal aguda (IRA) es una complicación frecuente en los pacientes con cirrosis hepática, con una prevalencia estimada de entre el 20 y 50% en pacientes ingresados por alguna descompensación de la cirrosis26. El desarrollo de IRA comporta una elevada mortalidad tanto a corto como a largo plazo (28% a 30 días y 63% al año). La presencia de IRA se establece con base en el incremento de creatinina respecto al valor basal y los criterios diagnósticos y clasificación se resumen en la tabla 327.
Criterios diagnósticos y clasificación de insuficiencia renal aguda y del síndrome hepatorrenal en los pacientes con cirrosis hepática
| Definición de IRA en los pacientes con cirrosis hepática | |
|---|---|
| Aumento de la CrS de al menos 0,3 mg/dL (>26,5μmol/L) en 48 horas, o el incremento de un 50% de la CrS respecto a su valor basal, que ha tenido lugar, presumiblemente, en los últimos 7 días. | |
| IRA estadio 1A | Incremento de CrS ≥0,3 mg/dL (≥26,5μmol/L) o de ≥50% del valor de CrS basal en 48 horas, con un valor final de CrS <1,5 mg/dL (133μmol/L). |
| IRA estadio 1B | Incremento de CrS ≥0,3 mg/dL (≥26,5μmol/L) o de ≥50% del valor de CrS basal en 48 horas, con un valor final de CrS ≥1,5 mg/dL (133μmol/L). |
| IRA estadio 2 | Incremento de CrS de entre 2 y 3 veces el valor de CrS basal |
| IRA estadio 3 | Incremento de CrS superior a 3 veces el valor de CrS basal, CrS ≥4,0 mg/dL (353,6μmol/L) con un aumento de al menos 0,3 mg/dL (26,5μmol/L), o necesidad de inicio de terapia sustitutiva renal. |
| Criterios diagnósticos de HRS-IRA de acuerdo con laInternational Club of Ascites | |
| Cirrosis con ascitis | |
| Diagnóstico de IRA de acuerdo con la definición expuesta más arriba. | |
| Ausencia de mejoría tras 48 horas de retirada del tratamiento diurético y expansión con albúmina (1 g/kg de peso). | |
| Ausencia de shock. | |
| No uso concomitante o reciente de fármacos nefrotóxicos (AINE, aminoglucósidos, contraste iodado, etc.) | |
| Ausencia de marcadores de lesión renal estructural, definida como:Ausencia de proteinuria (<500 mg/d)Ausencia de microhematuria (<50 hematíes por campo)Ausencia de hallazgos patológicos en la ecografía renal | |
AINE: antiinflamatorios no esteroideos; CSr: creatinina sérica; IRA: insuficiencia renal aguda.
Los pacientes con cirrosis hepática pueden desarrollar IRA debido a múltiples causas. La identificación de la causa es un aspecto fundamental para definir el tratamiento y establecer el pronóstico. Las causas más frecuentes de IRA en los pacientes con cirrosis son las asociadas a hipovolemia (relacionadas con el tratamiento excesivo con diuréticos, las pérdidas digestivas excesivas o bien asociadas a hemorragia digestiva) así como la necrosis tubular aguda (NTA).
Los pacientes con cirrosis hepática pueden desarrollar un tipo específico de IRA: el síndrome hepatorrenal (SHR-IRA)28. El SHR-IRA es una forma específica de IRA de los pacientes con cirrosis descompensada que se caracteriza por una marcada reducción del flujo sanguíneo renal que comporta una reducción intensa del filtrado glomerular. Existe un subtipo de SHR de presentación más insidiosa, en la que los pacientes presentan una reducción del filtrado glomerular durante más de tres meses, sin cumplir los criterios de IRA. Estos pacientes se clasifican como síndrome hepatorrenal-enfermedad renal crónica (SHR-ERC). SHR-IRA y SHR-ERC han sustituido la antigua nomenclatura de SHR tipo 1 y tipos 2, respectivamente27,28. El diagnóstico de SHR-IRA se realiza solo después de descartar otras causas de IRA y confirmar la ausencia de marcadores de lesión renal aguda estructural, como hematuria, proteinuria o anormalidades renales en la ecografía (tabla 3).
Infecciones bacterianasAlrededor del 25% de pacientes hospitalizados con cirrosis presentan alguna infección durante el ingreso, siendo la infección del tracto urinario y la peritonitis bacteriana espontánea (PBE) los tipos más comunes de infección en pacientes con cirrosis29. Las infecciones bacterianas generalmente están asociadas con el desarrollo de otras complicaciones, como EH o hemorragia digestiva, pudiendo también conducir al fracaso de otros órganos además del hígado, dando lugar al síndrome de insuficiencia hepática aguda sobre crónica (IHAC) 30,31. Es importante destacar que los pacientes con cirrosis que tienen infecciones bacterianas pueden no presentar las características típicas de las infecciones en los pacientes sin enfermedad hepática. Es por este motivo que las infecciones bacterianas deben descartarse en todos los pacientes que presenten complicaciones de la cirrosis o empeoramiento agudo de la función hepática o renal.
La PBE se define como la infección bacteriana del líquido ascítico, sin ninguna fuente intraabdominal identificable de infección20. La presentación clínica de la PBE es muy heterogénea, pudiendo ser asintomática, por lo que debe realizarse una paracentesis diagnóstica en todos los pacientes descompensados hospitalizados con cirrosis y que presentan ascitis, con independencia de la presencia o no de síntomas o signos de infección20. Aunque el diagnóstico temprano y el tratamiento adecuado han mejorado el pronóstico de la PBE a lo largo de los años, la mortalidad intrahospitalaria sigue siendo elevada, aproximadamente del 20%.
Insuficiencia hepática aguda sobre crónicaLa IHAC ocurre en aproximadamente el 30% de los pacientes hospitalizados por cirrosis y comporta un mal pronóstico32. La IHAC es un síndrome caracterizado por la descompensación aguda de la cirrosis asociada con un rápido deterioro de la situación clínica del paciente debido al desarrollo de fracaso multiorgánico. En la mayoría de los pacientes con IHAC puede identificarse un factor precipitante. Las infecciones bacterianas y el consumo de alcohol son los factores precipitantes más frecuentes en pacientes con IHAC en Europa y EE. UU., mientras que las hepatitis virales son los factores precipitantes más frecuentes en pacientes en Asia30. Es importante destacar que en algunos pacientes no puede identificarse ningún factor precipitante.
RecompensaciónAlgunos pacientes con cirrosis descompensada pueden experimentar una mejoría clínica, en general progresiva y lenta, al tratar las causas subyacentes responsables de la cirrosis y evolucionar hacia un estado similar a la cirrosis compensada; este proceso se conoce como recompensación2. Este hecho se asocia a una mejora del pronóstico de estos pacientes, con una marcada reducción de la mortalidad a largo plazo, pudiendo evitar en algunos pacientes la necesidad de un trasplante hepático10.
DiagnósticoEl diagnóstico de cirrosis hepática se establece bien con base en características histológicas, o bien en la combinación de parámetros clínicos, analíticos y de pruebas de imagen1.
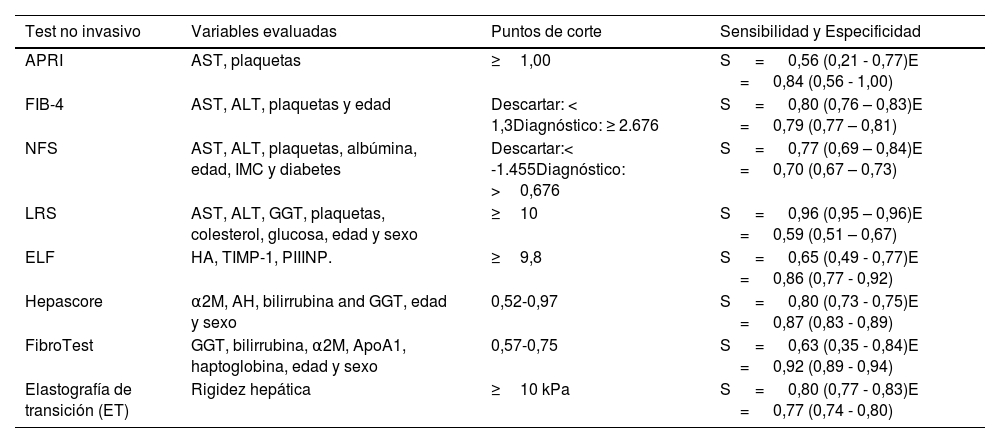
El diagnóstico de pacientes con cirrosis compensada suele hacerse de forma ocasional, a raíz del estudio de pacientes con alteraciones analíticas, principalmente de los parámetros hepáticos, así como plaquetopenia, o con base en la evaluación de pacientes con factores de riesgo de enfermedad hepática crónica (obesidad, diabetes tipo 2, consumo excesivo de alcohol, etc.). En los pacientes con sospecha de cirrosis compensada, el objetivo es evaluar el grado de fibrosis hepática y la posible presencia de hipertensión portal y determinar las causas de la enfermedad1. Estos factores están fuertemente asociados con el riesgo de progresión y el desarrollo de complicaciones de la cirrosis, e informan sobre el tipo de seguimiento necesario. Si bien la biopsia hepática es la prueba de oro para la determinación del grado de fibrosis, su uso está limitado a casos ocasionales, en especial en aquellos en que existan dudas con respecto a la etiología de la enfermedad. Es por ello que, en la actualidad, se han desarrollado distintos test no invasivos (TNI) que permiten con parámetros analíticos sencillos y algunos datos demográficos y clínicos obtener una estimación de la fibrosis hepática33. Estos test permiten la identificación de sujetos con fibrosis hepática y/o cirrosis. Son un ejemplo, el Liver Risk Score, el Fibrosis-4 index (FIB-4) o el AST-to-platelet ratio index (APRI), entre otros (tabla 4)1,34–36.
Test no invasivos para el diagnóstico de fibrosis avanzada
| Test no invasivo | Variables evaluadas | Puntos de corte | Sensibilidad y Especificidad |
|---|---|---|---|
| APRI | AST, plaquetas | ≥1,00 | S = 0,56 (0,21 - 0,77)E = 0,84 (0,56 - 1,00) |
| FIB-4 | AST, ALT, plaquetas y edad | Descartar: < 1,3Diagnóstico: ≥ 2.676 | S = 0,80 (0,76 – 0,83)E = 0,79 (0,77 – 0,81) |
| NFS | AST, ALT, plaquetas, albúmina, edad, IMC y diabetes | Descartar:< -1.455Diagnóstico: >0,676 | S = 0,77 (0,69 – 0,84)E = 0,70 (0,67 – 0,73) |
| LRS | AST, ALT, GGT, plaquetas, colesterol, glucosa, edad y sexo | ≥10 | S = 0,96 (0,95 – 0,96)E = 0,59 (0,51 – 0,67) |
| ELF | HA, TIMP-1, PIIINP. | ≥9,8 | S = 0,65 (0,49 - 0,77)E = 0,86 (0,77 - 0,92) |
| Hepascore | α2M, AH, bilirrubina and GGT, edad y sexo | 0,52-0,97 | S = 0,80 (0,73 - 0,75)E = 0,87 (0,83 - 0,89) |
| FibroTest | GGT, bilirrubina, α2M, ApoA1, haptoglobina, edad y sexo | 0,57-0,75 | S = 0,63 (0,35 - 0,84)E = 0,92 (0,89 - 0,94) |
| Elastografía de transición (ET) | Rigidez hepática | ≥10 kPa | S = 0,80 (0,77 - 0,83)E = 0,77 (0,74 - 0,80) |
AH: ácido hialurónico; ALT: alanin aminotransferasa; ApoA1: apolipoproteína A1; APRI: AST-to-platelet ratio index; AST: aspartato aminotransferasa; E: especificidad; ELF: enhanced liver fibrosis test; ET: elastografía de transición; FIB-4: fibrosis-4 index; GGT, gammaglutamil transferasa; IMC: índice de masa corporal; LRS: liver risk score; NFS: NAFLD fibrosis score; PIIINP, procollagen III N-terminal propeptide; S: sensibilidad; TIMP-1; tissue inhibitor of metalloproteinases-1; α2M: alfa-2-macroglobulina.
Adaptado de54.
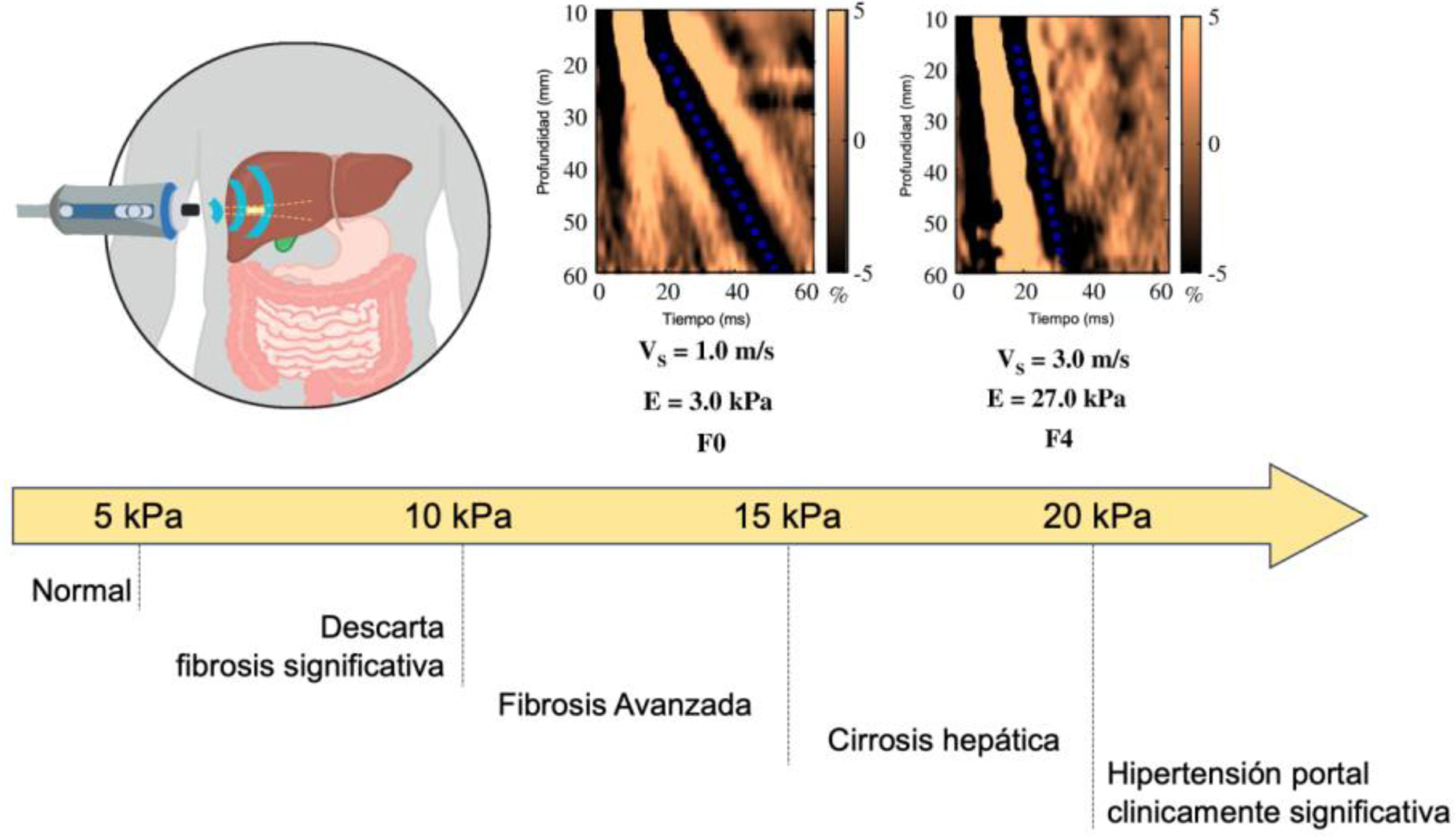
Además de los TNI, otros métodos más directos, como la elastografía hepática, pueden utilizarse para evaluar el grado de fibrosis hepática. La elastografía de transición (ET) es una técnica radiológica que mide la rigidez del hígado y se correlaciona bien con el grado de fibrosis (fig. 1)37. La ET se ha validado para la evaluación de diversas etiologías de enfermedad hepática y es la prueba preferida por su facilidad de uso y utilidad para evaluar la presencia de fibrosis35. Se ha propuesto «regla del 5» para determinar la presencia o no de fibrosis avanzada, de cirrosis y de hipertensión portal2. De forma general, en los pacientes con una ET <10kPa se puede descartar la presencia de fibrosis avanzada, los pacientes con ET entre 10 y 15kPa tienen fibrosis avanzada, mientras que en los pacientes con ET> 15kPa tiene una alta probabilidad de presentar cirrosis hepática. Finalmente, una ET >20kPa suele ser indicativa de la existencia de cirrosis con hipertensión portal clínicamente significativa1,33,35.
Estimación del grado de fibrosis hepática mediante elastografía de transición y «regla del 5» para el riesgo de cirrosis hepática.
Nota: La «regla del 5» hay que tomarla con cautela puesto que no está claramente demostrada, en especial en estudios en población general.
Adaptada de 1,2,37.
El diagnóstico de la cirrosis descompensada es menos complejo. Se basa en la combinación de hallazgos en la exploración física, presencia de complicaciones características (ascitis, encefalopatía, hemorragia por varices), alteraciones analíticas típicas (plaquetopenia, disminución del tiempo de Quick, hipergammaglobulinemia), alteraciones ecográficas compatibles con el diagnóstico de cirrosis (borde hepático irregular, signos de hipertensión portal) y/o presencia de varices esofagogástricas en la fibrogastroscopia1. En los casos en que se cumpla esta combinación de factores la biopsia hepática no es necesaria.
Tratamiento y pronósticoEl tratamiento de la cirrosis hepática se basa, por una parte, en el tratamiento del factor etiológico de la enfermedad hepática, y por otra, en el tratamiento y prevención de las complicaciones de la enfermedad20.
Tratamiento etiológicoEl tratamiento específico de la causa de la cirrosis es fundamental e incluye la abstinencia de alcohol en caso de cirrosis asociada al consumo excesivo de alcohol, el tratamiento antiviral en caso de las hepatitis virales o el control de los factores de riesgo metabólico en la cirrosis por hígado graso de de causa metabólica. Diferentes estudios han demostrado que el tratamiento de la causa de la cirrosis es capaz no solo de frenar la progresión de la cirrosis, sino en muchos casos de revertir la aparición de descompensaciones clínicas en la fase de cirrosis descompensada20.
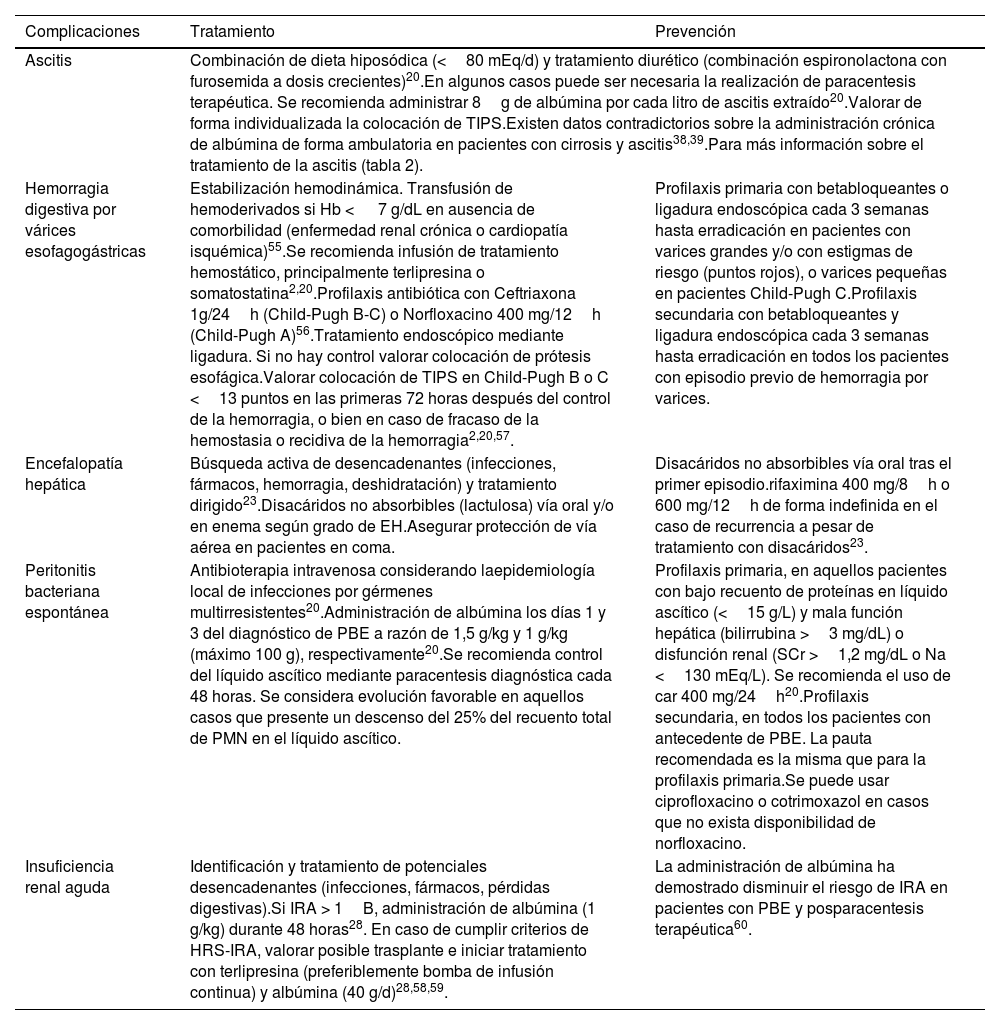
Tratamiento de las complicacionesRespecto a las complicaciones clínicas de la cirrosis, actualmente el tratamiento de las mismas consiste en administrar terapias específicas para cada una de ellas, véase como ejemplo el tratamiento diurético para la descompensación ascítico-edematosa, el tratamiento laxante con disacáridos con o sin antibiótico no absorbible (rifaximina) para la EH23 o el tratamiento de la hemorragia digestiva por varices esofágicas mediante bandas elásticas colocadas por vía endoscópica2. Por otro lado, existen tratamientos dirigidos a la prevención del desarrollo de complicaciones específicas de la cirrosis, como es la administración de antibióticos no absorbibles (norfloxacino) para prevenir la PBE en pacientes de alto riesgo o los betabloqueadores no selectivos para prevenir la hemorragia digestiva por varices esofágicas20. El tratamiento de las complicaciones de la cirrosis hepática se resume en la tabla 5.
Tratamiento de las complicaciones de la cirrosis hepática
| Complicaciones | Tratamiento | Prevención |
|---|---|---|
| Ascitis | Combinación de dieta hiposódica (<80 mEq/d) y tratamiento diurético (combinación espironolactona con furosemida a dosis crecientes)20.En algunos casos puede ser necesaria la realización de paracentesis terapéutica. Se recomienda administrar 8g de albúmina por cada litro de ascitis extraído20.Valorar de forma individualizada la colocación de TIPS.Existen datos contradictorios sobre la administración crónica de albúmina de forma ambulatoria en pacientes con cirrosis y ascitis38,39.Para más información sobre el tratamiento de la ascitis (tabla 2). | |
| Hemorragia digestiva por várices esofagogástricas | Estabilización hemodinámica. Transfusión de hemoderivados si Hb < 7 g/dL en ausencia de comorbilidad (enfermedad renal crónica o cardiopatía isquémica)55.Se recomienda infusión de tratamiento hemostático, principalmente terlipresina o somatostatina2,20.Profilaxis antibiótica con Ceftriaxona 1g/24h (Child-Pugh B-C) o Norfloxacino 400 mg/12h (Child-Pugh A)56.Tratamiento endoscópico mediante ligadura. Si no hay control valorar colocación de prótesis esofágica.Valorar colocación de TIPS en Child-Pugh B o C <13 puntos en las primeras 72 horas después del control de la hemorragia, o bien en caso de fracaso de la hemostasia o recidiva de la hemorragia2,20,57. | Profilaxis primaria con betabloqueantes o ligadura endoscópica cada 3 semanas hasta erradicación en pacientes con varices grandes y/o con estigmas de riesgo (puntos rojos), o varices pequeñas en pacientes Child-Pugh C.Profilaxis secundaria con betabloqueantes y ligadura endoscópica cada 3 semanas hasta erradicación en todos los pacientes con episodio previo de hemorragia por varices. |
| Encefalopatía hepática | Búsqueda activa de desencadenantes (infecciones, fármacos, hemorragia, deshidratación) y tratamiento dirigido23.Disacáridos no absorbibles (lactulosa) vía oral y/o en enema según grado de EH.Asegurar protección de vía aérea en pacientes en coma. | Disacáridos no absorbibles vía oral tras el primer episodio.rifaximina 400 mg/8h o 600 mg/12h de forma indefinida en el caso de recurrencia a pesar de tratamiento con disacáridos23. |
| Peritonitis bacteriana espontánea | Antibioterapia intravenosa considerando laepidemiología local de infecciones por gérmenes multirresistentes20.Administración de albúmina los días 1 y 3 del diagnóstico de PBE a razón de 1,5 g/kg y 1 g/kg (máximo 100 g), respectivamente20.Se recomienda control del líquido ascítico mediante paracentesis diagnóstica cada 48 horas. Se considera evolución favorable en aquellos casos que presente un descenso del 25% del recuento total de PMN en el líquido ascítico. | Profilaxis primaria, en aquellos pacientes con bajo recuento de proteínas en líquido ascítico (<15 g/L) y mala función hepática (bilirrubina >3 mg/dL) o disfunción renal (SCr >1,2 mg/dL o Na <130 mEq/L). Se recomienda el uso de car 400 mg/24h20.Profilaxis secundaria, en todos los pacientes con antecedente de PBE. La pauta recomendada es la misma que para la profilaxis primaria.Se puede usar ciprofloxacino o cotrimoxazol en casos que no exista disponibilidad de norfloxacino. |
| Insuficiencia renal aguda | Identificación y tratamiento de potenciales desencadenantes (infecciones, fármacos, pérdidas digestivas).Si IRA > 1B, administración de albúmina (1 g/kg) durante 48 horas28. En caso de cumplir criterios de HRS-IRA, valorar posible trasplante e iniciar tratamiento con terlipresina (preferiblemente bomba de infusión continua) y albúmina (40 g/d)28,58,59. | La administración de albúmina ha demostrado disminuir el riesgo de IRA en pacientes con PBE y posparacentesis terapéutica60. |
IRA: insuficiencia renal aguda; HRS-IRA: hepatorrenl syndrome - insuficiencia renal aguda; EH: encefalopatía hepática; PBE: peritonitis bacteriana espontánea; PMN: polimorfonucleares; SCr: creatinina sérica; TIPS: transjugular intrahepatic portosystemic shunt.
En los últimos años se ha investigado la eficacia de diferentes tratamientos para evitar la progresión de la cirrosis y sus complicaciones con el fin de mejorar el pronóstico de la enfermedad.
Se han reportado resultados contradictorios con respecto al efecto de la administración crónica de albúmina en pacientes con cirrosis hepática descompensada con ascitis, por lo que se requieren nuevos estudios sobre el efecto de este tratamiento en la cirrosis descompensada antes de recomendar su utilización en la práctica clínica38,39.
También recientemente se ha publicado un estudio que ha evaluado el uso de betabloqueadores en pacientes con cirrosis compensada con respecto a un objetivo combinado de complicaciones de cirrosis o muerte de causa hepática40. El resultado fue positivo para el objetivo primario compuesto, sin embargo, queda por demostrar si este tratamiento tiene efecto positivo sobre la mortalidad debido a la cirrosis.
Finalmente, un estudio reciente llevado a cabo en pacientes con cirrosis descompensada ha evaluado el efecto del tratamiento combinado de simvastatina y rifaximina, de los cuales existían datos previos sobre sus potenciales efectos beneficiosos en la cirrosis hepática. Los resultados de este estudio no mostraron ningún beneficio de esta combinación de tratamiento sobre la aparición de complicaciones de la cirrosis o la supervivencia41.
Dado que por el momento no existen tratamientos efectivos que se hayan demostrado eficaces para mejorar la supervivencia en pacientes con cirrosis hepática descompensada, el trasplante hepático es la única alternativa que se ha mostrado eficaz. Es por ello, que todos los pacientes con cirrosis descompensada y puntuación en la escala de MELD MELD (Model for End-stage Liver Disease [Modelo para la enfermedad hepática terminal]) (ver más adelante) de 15 o más puntos deben ser evaluados para trasplante hepático42.
PronósticoEl pronóstico de los pacientes con cirrosis hepática depende del estadio clínico de la enfermedad, siendo la supervivencia mediana de los pacientes con cirrosis compensada de aproximadamente 10 años desde el diagnóstico y de aproximadamente dos años en los pacientes con cirrosis descompensada21,22.
Existen dos clasificaciones que son las más utilizadas en la actualidad para evaluar el pronóstico de los pacientes con cirrosis. Una de ellas es la clasificación de Child-Turcotte-Pugh, que utiliza la albúmina sérica, los niveles de bilirrubina, el tiempo de protrombina y la presencia de ascitis y encefalopatía43. La otra es el MELD, que utiliza tres variables analíticas que son la bilirrubina, la creatinina y la International Normalized Ratio (INR), y produce una puntuación numérica de seis a 40 puntos con gravedad creciente44. Se han publicado varias modificaciones posteriores de esta clasificación, la más extendida el MELD-sodio, que incluye los niveles de sodio plasmático y ha mostrado mejorar la capacidad pronóstica del MELD, siendo en la actualidad una clasificación ampliamente utilizada en diferentes partes del mundo para priorizar a los pacientes con cirrosis en lista de trasplante hepático45.
Además del estadio de la enfermedad (compensada/descompensada), la supervivencia de los pacientes con cirrosis está también influenciada por la existencia de comorbilidades y la edad del paciente46–49. Las comorbilidades son particularmente importantes en la cirrosis causada por MASLD (cardiopatía isquémica, enfermedad renal crónica, arteriopatía, etc.).
Perspectivas futurasLa cirrosis hepática representa un problema de salud grave y con un gran impacto en nuestro entorno, especialmente en población laboralmente activa. A pesar de la drástica reducción de la hepatitis C como causa de cirrosis, gracias al desarrollo de los AAD, la mortalidad asociada a la cirrosis en el mundo no ha disminuido en los últimos años. Algunos estudios señalan que el número de pacientes afectados aumentará progresivamente en los próximos años6,50. Este incremento se prevé asociado al aumento de pacientes con enfermedad hepática de causa metabólica, en paralelo al auge de la prevalencia de los factores de riesgo cardiovascular, tales como la obesidad, la diabetes mellitus 2 (DM2) o la hipertensión, de un modo similar al que se experimentó en EE. UU. en la década de los 200051. Ante la ausencia de un tratamiento eficaz en pacientes con enfermedad hepática avanzada, actualmente se ha propuesto una estrategia de identificación precoz de sujetos con fibrosis hepática, con el fin de identificar aquellos pacientes con riesgo de desarrollar complicaciones hepáticas e implementar medidas terapéuticas enfocadas a controlar los factores que promueven la progresión de la enfermedad, y en último término, la descompensación y la muerte. En la actualidad, se están desarrollando distintos proyectos internacionales que tienen como objetivo evaluar potenciales estrategias de cribado de fibrosis hepática en población general y en poblaciones de riesgo específicas52-54. Los resultados de estas investigaciones deberían permitir dilucidar la mejor estrategia de diagnóstico precoz en la población y evaluar si se trata de una medida coste-eficaz a nivel poblacional.
FinanciaciónEl presente trabajo ha sido financiado por el programa marco Horizon 2020 de la Comisión Europea, bajo la convocatoria SC1-BHC-30-2019 a través de la beca N° 847989. El financiador no ha participado en el diseño del estudio, recogida, análisis e interpretación de los datos, ni en la redacción de este manuscrito. El presente artículo ha recibido apoyo de becas (número PI20/00579, PI22/00910) integradas en el Plan Nacional I+D+i y cofinanciada por el Instituto de Salud Carlos III-Proyectos de Investigación en Salud-Acción Estratégica en Salud (AES), 2020 y 2022, respectivamente, de las que son beneficiarios el Dr. Ginès y la Dra. Pose.
Consideraciones éticasEn esta revisión literaria, confirmamos el cumplimiento de todas las normas éticas exigidas por Elsevier para publicaciones en revistas revisadas por pares. Aseguramos la originalidad del contenido, con la debida citación de fuentes y sin prácticas de plagio. No existen conflictos de interés, y todos los autores han contribuido significativamente a este trabajo, conforme a los estándares de autoría. Hemos revisado con precisión la literatura y respetado los principios éticos de publicación establecidos.
Conflicto de interesesP. Ginès ha recibido becas de Gilead & Grifols; es consultor para Gilead, RallyBio, SeaBeLife, Merck, Sharp, and Dohme (MSD), Ocelot Bio, Behring, Roche Diagnostics International, Boehringer Ingelheim y Astra Zeneca; y forma parte del comité de ponentes para Pfizer. El resto de los autores declara no tener conflictos a reportar.