Aminobisphosphonates are widely used in the treatment of osteoporosis. They have a high affinity for hydroxyapatite, binding primarily to resorbing surfaces, but also to forming surfaces and to some extent to resting surfaces. They inhibit osteoclasts, thereby decreasing remodelling units. Consequently, they increase bone mass and reduce stress risers. This decreases the risk of fractures. If this decrease is sufficient, they can be temporarily withdrawn (drug holidays), which prevents serious complications (atypical femoral fracture). They probably reduce mortality. Virtually all patients with osteoporosis can benefit from them at some point in the course of their disease (at the beginning of treatment or after the administration of anabolics, selective estrogen receptor modulators or denosumab). If well tolerated orally, alendronate and risedronate are preferable. Otherwise, zoledronate is preferred. Their efficacy vs. cost-safety-convenience ratio makes aminobisphosphonates reference drugs in the field of osteoporosis.
Los aminobisfosfonatos se utilizan ampliamente en el tratamiento de la osteoporosis. Tienen gran afinidad por la hidroxiapatita, uniéndose fundamentalmente a las superficies en resorción, pero también a las superficies en formación y, en cierta medida, a las superficies en reposo. Inhiben a los osteoclastos, con lo que disminuyen las unidades de remodelación. En consecuencia, aumentan la masa ósea y reducen los concentradores de tensión. Ello disminuye el riesgo de fracturas. Si esta disminución es suficiente, pueden retirarse transitoriamente (vacaciones terapéuticas), lo que previene complicaciones graves (fractura atípica de fémur). Probablemente disminuyen la mortalidad. Pueden beneficiarse de ellos prácticamente todos los enfermos con osteoporosis en algún momento de su evolución (al comienzo del tratamiento o tras la administración de anabólicos, moduladores selectivos de los receptores estrogénicos o denosumab). Con buena tolerancia oral son preferibles el alendronato y el risedronato. En caso contrario, lo es el zoledronato. Su relación eficacia frente a coste-seguridad-comodidad los convierte en fármacos de referencia en el campo de la osteoporosis.
Los aminobisfosfonatos (N-BP) son bisfosfonatos (BP) en los que uno de los radicales unidos al carbono (el habitualmente denominado R2) contiene un átomo de nitrógeno. Este radical puede consistir en una cadena hidrocarbonada lineal (BP alquílicos: alendronato, pamidronato, ibandronato) o contener un anillo con un átomo de nitrógeno (BP heterocíclicos: risedronato, zoledronato). La naturaleza de R2 determina la capacidad del BP para disminuir la actividad osteoclástica. Este efecto se debe fundamentalmente a la inhibición de la enzima farnesil-pirofosfato-sintetasa (FPPS), y con ello de la prenilación de las enzimas denominadas «pequeñas GTPasas», implicadas en la organización del citoesqueleto y la formación del «borde rugoso»1,2. La inhibición de la FPPS da lugar además a la acumulación de un metabolito, el Apppl, inductor de apoptosis, aunque esta no sea un mecanismo esencial en el efecto de los N-BP.
Los distintos BP inhiben la FPPS con diferente intensidad: zoledronato>risedronato>ibandronato>alendronato3. Este orden es distinto al de su afinidad por la hidroxiapatita: zoledronato>alendronato>ibandronato>risedronato4. En cualquier caso, estudios sobre su capacidad antirresortiva en el animal de experimentación señalan el siguiente orden: zoledronato>risedronato>ibandronato>alendronato5. En la práctica clínica, sin embargo, el alendronato disminuye los marcadores de recambio óseo (MRO) y aumentan la densidad mineral ósea (DMO) más que el risedronato6,7 debido a que la cantidad por comprimido es mayor en el caso del alendronato.
Aproximadamente la mitad de la dosis de BP que accede al interior del organismo se fija al hueso y la otra mitad se elimina por el riñón. El BP que se fija al hueso lo hace preferentemente en las superficies en resorción, es decir, superficies en las que ya se ha producido una actuación inicial de los osteoclastos, que debería verse seguida posteriormente por la de otros. Sin embargo, estos ya no podrán desarrollar su efecto, porque el BP allí depositado pasará a su interior, anulándolo funcionalmente. Después será liberado al medio, pudiendo volver a unirse a una superficie en resorción. Más tarde, estas superficies en resorción que contienen el fármaco son cubiertas por hueso nuevo. En el frente de mineralización del mismo también se fija BP. El BP puede, además, unirse en cierta proporción a las superficies quiescentes (sobre todo el zoledronato)2 y penetrar en el sistema canalicular osteocitario8. Permanecerá en todas estas localizaciones hasta que en ellas se inicie un nuevo ciclo de remodelación2. De esta forma, el BP se irá eliminando lentamente, a lo largo de años. La unión de los BP a la hidroxiapatita es reversible, liberándose más fácilmente los de menor afinidad.
Se ha demostrado también la actuación de los BP sobre los osteocitos (inhibiendo su apoptosis9) e incluso sobre los osteoblastos (en el subperiostio y en las unidades de remodelación [véase a continuación]), pero estos aspectos no están bien establecidos10.
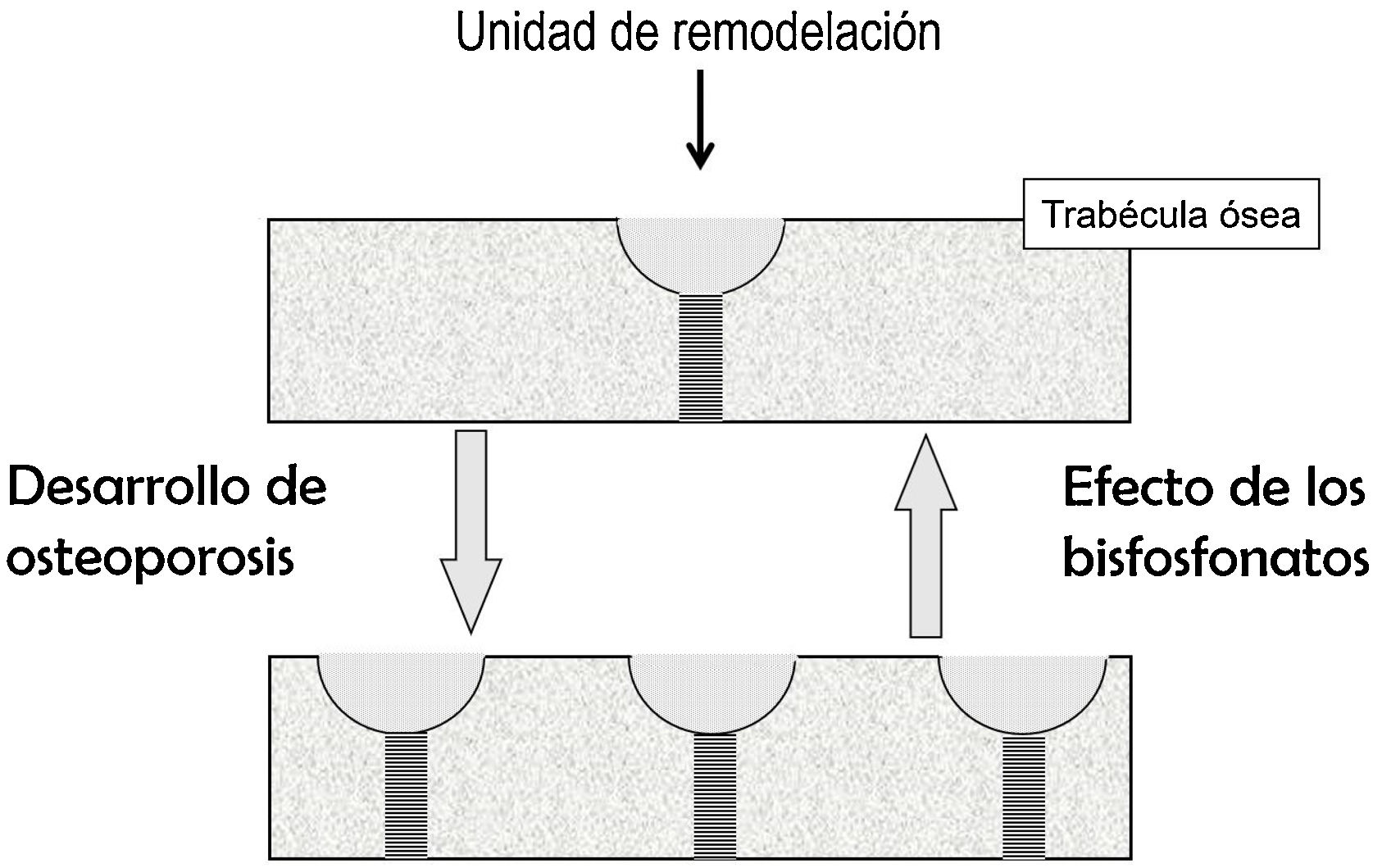
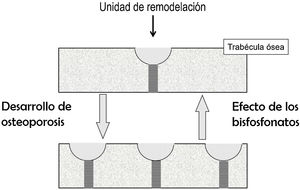
Efecto sobre el recambio óseoEl recambio óseo es el fenómeno por el cual el hueso está renovándose continuamente. Lo hace porque, en pequeños focos dispersos por el esqueleto, primero actúan los osteoclastos, destruyendo hueso, y a continuación los osteoblastos, formando hueso nuevo. Estos focos constituyen las unidades de remodelación (UR). Cuando en ellas se forma menos hueso del que se destruye, se dice que están en balance negativo. El principal mecanismo responsable del desarrollo de fracturas osteoporóticas es el aumento de recambio óseo (y, por tanto, del número de UR). Este aumento promueve 2 tipos de pérdida de hueso: reversible e irreversible. La irreversible es debida al balance negativo de las UR. La reversible se debe a que la apertura de nuevas UR conlleva la aparición de espacios carentes de hueso, que dejan de existir cuando la unidad se cierra. En el hueso trabecular, además, las UR debilitan el tejido óseo porque dan lugar a los «concentradores de tensión», puntos en que la trabécula está más adelgazada.
Los BP disminuyen las fracturas porque, al inhibir a los osteoclastos, frenan el recambio óseo, disminuyendo el número de UR2. Ello supone una recuperación de la pérdida reversible de hueso, con el consiguiente aumento de masa ósea y disminución de los concentradores de tensión (fig. 1). La pérdida irreversible no puede ser corregida por los BP.
Desarrollo de osteoporosis: aumento de las unidades de remodelación y, por tanto, de los espacios de pérdida ósea reversible (representados por las semilunas) y de los concentradores de tensión (representados por las zonas rayadas). Efecto de los bisfosfonatos: fenómenos opuestos. No se representa el comportamiento del balance óseo.
La recuperación de la pérdida ósea reversible se traduce en un aumento de la DMO medida por DXA de un 4-6% durante los primeros 12-18 meses. Después, continúa el aumento durante otros 3-5 años, con mucha menor intensidad. Este segundo aumento se debe a un incremento de la mineralización secundaria (al renovarse las osteonas más despacio, tienen más tiempo para mineralizarse) y no representa un incremento de la masa ósea, aunque pueda contribuir a reforzar la resistencia del hueso. En la tabla 1 se señalan los aumentos de la DMO descritos en los principales estudios de los N-BP a 3 años. Estudios realizados durante 10 años con alendronato11 indican que, entre los 5 y los 10 años, la DMO continúa aumentando en la columna lentamente, mientras que en la cadera se estabiliza. El mecanismo responsable del aumento en la columna es desconocido, habiéndose planteado varias hipótesis2 (mayor duración de la mineralización, retorno de la masa ósea a su nivel homeostático, cierto estímulo osteoformador10); no puede descartarse un componente de artefacto por artrosis vertebral. El mantenimiento en la cadera traduciría un balance óseo de 0 en las UR, tal vez en relación con una disminución en el recorrido de los osteoclastos, y menos probablemente con un posible efecto estimulador de los osteoblastos.
Aumento de densidad mineral ósea por los aminobisfosfonatos respecto a placebo a los 3 años de su administración
| Columna lumbar, % | Cuello femoral, % | Cadera total, % | |
|---|---|---|---|
| Alendronato | |||
| Ensayos fase iii13a | 8,8 | 5,9 | - |
| FIT 114b | 6,2 | 4,1 | 4,7 |
| FIT 215c | 6,6 | 4,6 | 5,0 |
| Risedronato | |||
| VERT-NA17d | 6,5 | 2,8 | - |
| VERT-MN18e | 5,9 | 3,1 | - |
| HIP19f | - | 3,4 | - |
| Ibandronato | |||
| BONE21g | 2,2 | 3,4 | 4,1 |
| Zoledronato | |||
| HORIZON-PFT24h | 6,7 | 5,1 | 6,0 |
| HORIZON-RFT25i | - | 4,3 | 6,4 |
Los números de los superíndices indican la cita bibliográfica; las letras, las dosis administradas.
BONE: Oral Ibandronate Osteoporosis Vertebral Fracture Trial in North America and Europe; FIT: Fracture Intervention Trial; HIP: Hip Intervention Program; HORIZON: Health Outcomes and Reduced Incidence with Zoledronic Acid Once Yearly; iv: vía intravenosa; MN: multinacional; NA: norteamericano; PFT: Pivotal Fracture Trial; RFT: Recurrent Fracture Trial; VERT: Vertebral Efficacy With Risedronate Therapy; vo: vía oral.
El aumento de la DMO que producen los BP depende en parte de su capacidad para disminuir el recambio y en parte del grado de recambio previo a su administración (cuanto mayor sea el número de UR activas, mayor será el número de estas que podrán ser cerradas). Esto último determina que el aumento de DMO en el hueso trabecular sea mayor que en el cortical, ya que en aquel el recambio es mayor. Este hecho, junto con el cierre de los concentradores de tensión, localizados en el hueso trabecular, hace que sea en este donde los BP presentan mayor eficacia antifractura. La disminución de los concentradores de tensión explica que las fracturas vertebrales disminuyan con aumentos discretos de DMO.
La disminución del recambio producida por los BP no es ilimitada2. Tras el descenso inicial se estabiliza, lo que contradice la hipótesis formulada en su tiempo de que los BP podrían conducir a un hueso «congelado», incapaz de renovarse.
Los cambios en los MRO con los N-BP se describieron en sus principales ensayos clínicos (EC). No obstante, dada la poca homogeneidad existente entre ellos, y dado que algunos están en desuso, hemos considerado preferible recoger los datos publicados recientemente por Eastell et al.12. Estos autores han tenido acceso a la determinación de telopéptido C del colágeno tipo 1 (CTX) y propéptido aminoterminal del procolágeno tipo 1 (P1NP) en las muestras de los diversos ensayos, y han comunicado los cambios al sexto mes de tratamiento (en algunos casos en que los valores de CTX o P1NP no estuvieron disponibles, se calcularon indirectamente a partir de la fosfatasa alcalina). En la tabla 2 se señalan los descensos respecto al grupo placebo con los N-BP.
Efecto de los aminobisfosfonatos sobre el P1NP y el CTX a los 6 meses de su administración
| P1NP, % | CTX, % | |
|---|---|---|
| Alendronato | ||
| Ensayos fase iii | 32,9 | 26,3 |
| FIT 1 | 29,5 | 21,9 |
| FIT 2 | 30,4 | 24,0 |
| Risedronato | ||
| VERT-NA | 30,5 | 24,4 |
| VERT-MN | 31,2 | 24,9 |
| HIP | 34,0 | 23,9 |
| Ibandronato | ||
| BONE | 30,0 | 23,9 |
| Zoledronato | ||
| HORIZON-PFT | 34,2 | 41,2 |
| HORIZON-RFT | 28,7 | 23,0 |
BONE: Oral Ibandronate Osteoporosis Vertebral Fracture Trial in North America and Europe; CTX: telopéptido C del colágeno tipo 1; FIT: Fracture Intervention Trial; HIP: Hip Intervention Program; HORIZON: Health Outcomes and Reduced Incidence with Zoledronic Acid Once Yearly; MN: multinacional; NA: norteamericano; PFT: Pivotal Fracture Trial; P1NP: propéptido aminoterminal del procolágeno tipo 1; RFT: Recurrent Fracture Trial; VERT: Vertebral Efficacy With Risedronate Therapy.
Fuente: Eastell et al.12.
La relación entre estos cambios y la disminución de fracturas lleva a los autores a concluir que dichos cambios explican una gran proporción del descenso de las fracturas vertebrales (>50%), pero no de las no vertebrales ni de las de cadera. Ello es concordante con la idea antes señalada del mayor efecto de los BP sobre las fracturas vertebrales.
Demostración del efecto antifractura de los bisfosfonatos y aprobación de su usoLos BP orales presentan una absorción intestinal escasa (<1%), que se ve interferida por los alimentos al unirse al Ca++ y otros cationes presentes en ellos. Por ello deben administrarse en ayunas, esperando media hora (una en el caso del ibandronato) para la ingesta. Además, pueden producir irritación de la mucosa digestiva superior, por lo que tras su toma el paciente debe permanecer en posición erguida, para facilitar el tránsito a través del esófago.
AlendronatoFue el primer BP aprobado para el tratamiento de la osteoporosis (1995). Administrado inicialmente con una pauta de 10mg/día, se pasó después a otra de 70mg/semana, lo que disminuye la probabilidad de molestias digestivas.
Aunque había mostrado su eficacia en un doble EC en que se comprobaba la disminución de las fracturas vertebrales13, Merck diseñó un segundo EC –el Fracture Intervention Trial (FIT)– para dejar perfiladas las características del fármaco. Estaba integrado por 2 subestudios (FIT 1 y FIT 2), publicados en 199614 y 199815. El primero de ellos se realizó en pacientes con fractura vertebral, y en ambos se exigía una DMO en cuello de fémur (CF)≤0,68g/cm2 (Hologic QDR-2000). Cuando se publicó el estudio NHANES III, se constató que esta DMO correspondía a un índice T de –1,6. Muchos pacientes, por tanto, no presentaban osteoporosis densitométrica. Ello creó confusión en la interpretación de los resultados. Finalmente, se publicaron los datos de las pacientes con fractura vertebral o T en CF≤–2,5 del FIT 1 y el 2 en conjunto16, comprobándose una disminución significativa de las fracturas vertebrales radiográficas y clínicas, la fractura de cadera y las fracturas clínicas totales. Esta última fue ya significativa a los 12 meses. En la tabla 3 se muestran los resultados. En 2012 la FDA aprobó una formulación efervescente de 70mg.
Efecto de los aminobisfosfonatos sobre los distintos tipos de fracturas (RR o HR)
| Fracturas vertebrales morfométricas | Fracturas no vertebrales | Fracturas de cadera | Fracturas clínicas | Fracturas vertebrales clínicas | Fracturas de muñeca | |
|---|---|---|---|---|---|---|
| Alendronato | ||||||
| EC fase III13a | 0,52 (0,28-0,95) | 0,79 (0,52-1,22) | - | - | - | - |
| FIT 114b | 0,53 (0,41-0,68) | 0,80 (0,63-1,01) | 0,49 (0,23-0,99) | 0,72 (0,58-0,90) | 0,52 (0,31-0,87) | - |
| FIT 215c | 0,56 (0,39-0,80) | 0,88 (0,74-1,04) | 0,79 (0,43-1,44) | 0,86 (0,73-1,01) | - | 1,19 (0,87-1,64) |
| FIT 1+2, T<−2,5 o fractura vertebral16d | 0,52 (0,42-0,66) | 0,64 (0,51-0,80) | 0,47 (0,26-0,79) | 0,70 (0,59-0,82) | 0,55 (0,36-0,82) | 0,70 (0,49-0,98) |
| Risedronato | ||||||
| VERT-NA17e | 0,59 (0,43-0,82) | 0,60 (0,39-0,94) | - | - | - | - |
| VERT-MN18f | 0,51 (0,36-0,73) | 0,67 (0,44-1,04) | - | - | - | - |
| HIP total19g | - | 0,8 (0,7-1,0) | 0,7 (0,6-0,9) | - | - | - |
| 70-79 a | - | - | 0,6 (0,4-0,9) | - | - | - |
| ≥80 a | - | - | 0,8 (0,6-1,2) | - | - | - |
| Ibandronato | ||||||
| BONE21h | ||||||
| Rama 2,5mg/d | 0,38 (0,25-0,59) | - | - | - | 0,51 (p=0,01) | - |
| Rama intermitente | 0,50 (0,34-0,74) | - | - | - | 0,52 (p=0,01) | - |
| Zoledronato | ||||||
| HORIZON PFT24i | 0,30 (0,24-0,38) | 0,75 (0,64-0,87) | 0,59 (0,42-0,83) | 0,67 (0,58-0,77) | 0,23 (0,14-0,37) | - |
| HORIZON RFT24j | 0,54 (0,32-0,92) | 0,73 (0,55-0,98) | 0,70 (0,41-1,19) | 0,65 (0,50-0,84) | - | - |
Los números de los superíndices indican la cita bibliográfica; las letras, las dosis administradas.
BONE: Oral Ibandronate Osteoporosis Vertebral Fracture Trial in North America and Europe; EC: ensayo clínico; FIT: Fracture Intervention Trial; HIP: Hip Intervention Program; HORIZON: Health Outcomes and Reduced Incidence with Zoledronic Acid Once Yearly; HR: hazard ratio; iv: vía intravenosa; MN: multinacional; NA: norteamericano; PFT: Pivotal Fracture Trial; RFT: Recurrent Fracture Trial; RR: riesgo relativo; VERT: Vertebral Efficacy With Risedronate Therapy; vo: vía oral.
Fue el segundo BP aprobado por la FDA (año 2000) para el tratamiento de la osteoporosis. Inicialmente se administró con una pauta de 5mg/día. Más tarde se pasó a una pauta semanal de 35mg, con menores molestias digestivas.
Procter & Gamble basó el desarrollo del fármaco en los estudios Vertebral Efficacy With Risedronate Therapy (VERT), uno norteamericano (VERT-NA)17 y otro multinacional (VERT-MN)18, publicados en 1999 y 2000, respectivamente. Se incluyeron mujeres con fracturas vertebrales e índice T<−2,0. Las dosis elegidas fueron las de 2,5 y 5mg/día, aunque la primera se abandonó tras una fase inicial. Se eligieron dosis inferiores a las empleadas con el alendronato porque estudios preclínicos indicaban que el risedronato era más potente. Disminuyeron significativamente las fracturas vertebrales y no vertebrales (tabla 3). El descenso en la incidencia de fracturas vertebrales en ambos ensayos se apreció ya a los 12 meses.
Posteriormente, para valorar el efecto en la fractura de cadera se diseñó el estudio Hip Intervention Program19. Las dosis utilizadas fueron 2,5 o 5mg/día. Razones de carácter económico llevaron a modificar el diseño inicial, elaborando otro en que se dividió a las pacientes en 2 grupos: uno de 70-79 años y otro de 80 o más años. La descripción de ambos es compleja, pero en esencia el primero se caracterizaba por presentar osteoporosis marcada y el segundo, determinados factores de riesgo de fractura de cadera. La incidencia de esta fractura disminuyó en el primer grupo, pero no en el segundo (tabla 3).
En 2007 la FDA aprobó una formulación de 75mg diseñada para tomar un comprimido 2 días consecutivos una vez al mes, y en 2008 otra de 150mg para tomar un comprimido mensual. Finalmente, en 2010 aprobó un preparado con una formula galénica especial («gastrorresistente»), destinada a minimizar la interacción del risedronato con los alimentos y a facilitar su absorción. En este preparado se combinan en cada comprimido 35mg de risedronato con 100mg de EDTA (que quela el Ca++ y otros cationes di o trivalentes de los alimentos y del contenido intestinal). Además, el comprimido presenta un recubrimiento entérico sensible al pH, que previene su desintegración en el estómago y retrasa su disolución hasta el intestino delgado. Aumenta su biodisponibilidad y permite que el fármaco sea administrado antes o después del desayuno20.
IbandronatoSe desarrolló con la idea de poder administrar un BP con intervalos prolongados entre dosis. La FDA había aprobado su administración oral diaria en 2003. En 2004 se publicó el estudio BONE21, patrocinado por Hoffmann-La Roche, en que se compararon pacientes tratadas con 2,5mg/día; pacientes tratadas con 20mg a días alternos hasta un total de 12 dosis, en ciclos de 3 meses; y pacientes asignadas a placebo. La incidencia de fracturas vertebrales –morfométricas y clínicas– se redujo significativamente en los 2 primeros grupos (tabla 3). Las fracturas no vertebrales no disminuyeron. Posteriormente, el estudio MOBILE22, con la DMO como medida de resultado, comprobó que 150mg administrados una vez al mes por vía oral no solo no son inferiores, sino que son superiores a 2,5mg/día, aprobando la FDA esta pauta en 2005. Más tarde, en el estudio DIVA23 se comparó la administración oral diaria con la intravenosa (2mg/2 meses o 3mg/3 meses), comprobando que esta era superior. La FDA aprobó el ibandronato intravenoso en 2006.
ZoledronatoFue seleccionado para su desarrollo por Ciba-Geigy en 1987, en un momento en que la administración intravenosa suponía una novedad. Basó su desarrollo en los ensayos Health Outcomes and Reduced Incidence with Zoledronic Acid Once Yearly (HORIZON) Pivotal Fracture Trial (PFT) y Recurrent Fracture Trial (RFT). El primero24 seleccionó enfermas con un índice T en CF≤−2,5, con o sin fracturas vertebrales, o un índice T≤−1,5 junto con al menos 2 fracturas vertebrales leves o una fractura vertebral moderada. Las pacientes se estratificaron en 2 grupos: en el 1 (para valoración de fractura vertebral) no podían recibir otra medicación antiosteoporótica, mientras que en el 2 (para valoración de fractura de cadera junto con el 1) podían recibir calcitonina, raloxifeno, terapia hormonal sustitutiva o tibolona. La administración de 5mg iv anuales durante 3 años disminuyó la incidencia de fracturas vertebrales morfométricas, de cadera, no vertebrales, vertebrales clínicas y cualquier fractura clínica (tabla 3). Se observó un ligero aumento en la incidencia de fibrilación auricular. Este trabajo se publicó en 2007 y la FDA aprobó el uso de zoledronato ese mismo año.
El HORIZON RFT25 fue realizado en pacientes con fractura de cadera. Se comprobó una reducción de las fracturas clínicas (significativa a los 12 meses), de las vertebrales clínicas y de las no vertebrales. Las de cadera no llegaron a reducirse significativamente (tabla 3). Un hallazgo inesperado fue una disminución de la mortalidad del 28% en la rama que recibió zoledronato (p=0,01).
Recientemente se ha realizado un EC26 en mujeres osteopénicas de más de 65 años administrando 4 infusiones de 5mg de zoledronato a intervalos de 18 meses. Disminuyeron significativamente las fracturas por fragilidad en su conjunto (hazard ratio [HR] 0,63), y además específicamente las sintomáticas, las vertebrales morfométricas y las no vertebrales. La mortalidad mostró tendencia a disminuir (HR 0,65; p=0,08).
Estudios comparativosNo se han realizado ensayos clínicos head-to-head que comparen unos N-BP con otros. Se han efectuado, en cambio, varios metaanálisis en red, sin alcanzar resultados uniformes27–30. Un estudio observacional publicado en 2007 concluyó que el risedronato disminuía el riesgo de fracturas de cadera y no vertebrales más que el alendronato31, pero otro realizado 2 años después con la misma metodología no pudo comprobarlo32. Dada la mayor biodisponibilidad del risedronato gastrorresistente, merece señalarse que un reciente estudio retrospectivo en el mundo real que lo comparaba con otros BP orales ha encontrado que reduce más las fracturas osteoporóticas (17% en cualquier localización; 29% en la columna)33.
Efectos adversos y beneficiososEfectos adversosLos efectos adversos de los BP han sido ampliamente revisados en otras publicaciones. Aquí únicamente haremos algún comentario respecto a la fractura atípica de fémur (FAF) y la osteonecrosis de los maxilares (ONM), por haber influido en el desarrollo del concepto de «vacaciones terapéuticas».
Fractura atípica de fémurSe han publicado numerosos trabajos sobre su asociación con los BP, con información no siempre coincidente. Creemos que en estos momentos deben tomarse como referencia los resultados del reciente trabajo de Black et al.34 realizado en casi 200.000 mujeres. Se recogen en la tabla 4.
Epidemiología de la fractura atípica de fémur. Comparación de las fracturas atípicas de fémur provocadas y las fracturas por fragilidad prevenidas durante la administración de bisfosfonatos
| Aumento de incidencia con el tiempo de administración | |||||
|---|---|---|---|---|---|
| Tiempo | Referencia(<0,25 a) | De 0,25 a<3 a | De 3 a<5 a | De 5 a<8 a | ≥8 a |
| HR ajustada | - | 2,54 (0,79-8,4) | 8,86 (2,79-28,20) | 19,88 (6,32-62,49) | 43,5 (13,70-138,15) |
| N.o absoluto FAF/105 personas-año | 0,07 | 0,56 | 2,54 | 6,06 | 13,30 |
| Disminución de la incidencia con el tiempo de administración | ||||
|---|---|---|---|---|
| Tiempo | Referencia (<0,25 a) | >0,25-1,25 a | >1,25-4 a | >4 a |
| HR ajustada | - | 0,52 (0,37-0,72) | 0,21 (0,13-0,34) | 0,26 (0,14-0,48) |
| N.o absoluto FAF/105 personas-año | 4,50 | 1,81 | 0,62 | 0,47 |
| Fracturas por fragilidad evitadas por FAF producida (población caucásica) | ||
|---|---|---|
| Tras 3 años | Tras 5 años | |
| Fracturas de cadera | 75 | 36 |
| Fracturas clínicas | 270 | 170 |
FAF: fractura atípica de fémur.
Fuente: Black et al.34.
No se conocen con exactitud los mecanismos determinantes de la FAF. Parecen relacionados con una interferencia de los BP en los procesos de reparación de fracturas de estrés. El uso de glucocorticoides y el arqueamiento del fémur son factores de riesgo.
Osteonecrosis de los maxilaresEs muy rara en pacientes tratados con BP orales por osteoporosis. Chiu et al.35 han comunicado una incidencia acumulada que pasa del 0,04% el primer año de tratamiento al 2,14% a los 8 años. Habitualmente sigue a una manipulación dentoalveolar. En su patogenia se ha involucrado la inhibición de la remodelación ósea. Se valora también un posible efecto antiangiogénico de los BP36, con alteración del trofismo de la mucosa bucal. Son factores predisponentes una mala higiene bucal y el uso de glucocorticoides. Se cree que la interrupción del tratamiento unos meses antes de la intervención dentaria carece de utilidad, pero hay quien la defiende por el teórico efecto del fármaco sobre la mucosa. Deben intentar evitarse los procedimientos quirúrgicos más invasivos.
Efectos beneficiososEl más importante se refiere a la disminución de la mortalidad, aún no confirmada definitivamente, pero apoyada por numerosos trabajos. Parecen contribuir a ella una menor letalidad por cáncer (mieloma, mama, colon), enfermedad cardiovascular y neumonía37.
Relación de los BP con los fármacos anabólicosTratamiento secuencialOsteoformadores tras los bisfosfonatosLa administración de BP antes de la teriparatida atenúa su efecto sobre el aumento de la DMO38, particularmente en la cadera, donde puede disminuir ligeramente de forma transitoria. No obstante, el estudio VERO39 indica que la atenuación no se traduce en una disminución del efecto antifractura. El estudio STRUCTURE señala que la administración previa de BP atenúa la eficacia del romosozumab para aumentar la DMO, pero no la bloquea40. Puede concluirse que no debe desestimarse la administración de osteoformadores tras los BP cuando se considere procedente.
BP tras los osteoformadoresTras la retirada de cualquier osteoformador debe administrarse un antirresortivo. La eficacia de los N-BP está ampliamente demostrada41–43.
CombinacionesSe ha estudiado el efecto de la combinación de BP con PTH sobre la DMO, pero no sobre las fracturas. La combinación puede plantearse desde el principio del tratamiento, o por adición de la teriparatida a un tratamiento con BP establecido previamente. En relación con la primera posibilidad, un primer trabajo44 indicó que la combinación de teriparatida con alendronato no mejoraba los efectos de aquella. Sin embargo, otro posterior con zoledronato45 concluyó que la combinación proporciona un resultado favorable, al menos los 6 primeros meses. Respecto a los estudios en que la teriparatida se añade a un tratamiento previo con BP, se han comunicado de nuevo resultados negativos46 y positivos47.
Podría concluirse que, en general, la asociación de BP y osteoformadores no está indicada, pero si en alguna situación concreta se considera potencialmente útil, no debe descartarse.
Utilidad e interés de las vacaciones terapéuticasPoco después de ser introducidos los BP en el mercado se planteó la duda de si la duración de su efecto sería limitada, debiendo suspenderse tras unos años de administración. Dos estudios han abordado este problema. El primero es el estudio FLEX48, extensión del FIT, en que mujeres que habían recibido alendronato durante 5 años fueron aleatorizadas a continuar con alendronato o pasar a placebo durante otros 5. El segundo es una extensión del HORIZON PFT49, en que mujeres que habían recibido zoledronato durante 3 años fueron aleatorizadas a continuar con zoledronato o pasar a placebo otros 3. En ambos se comprueba que las pacientes que continúan con el fármaco desarrollan menos fracturas vertebrales (clínicas en el primer caso [riesgo relativo 0,45; 0,24-0,85], morfométricas en el segundo [odds ratio 0,51; 0,26-0,95]). Un análisis post hoc señaló también un efecto beneficioso en las fracturas no vertebrales50.
En ambos estudios se observó que existe una subpoblación de pacientes en que a los 5 (alendronato) o 3 años (zoledronato) de tratamiento el BP puede suspenderse porque el enfermo se sitúa en una zona de bajo riesgo de fractura que el tratamiento no disminuye más. Una vez suspendido, la situación de bajo riesgo se mantiene un cierto tiempo, por seguir actuando el BP enterrado en el hueso. Más tarde, al irse este eliminando, el riesgo de fractura vuelve a aumentar, y el tratamiento debe reintroducirse. Al intervalo de tiempo sin tratamiento se le conoce como «vacaciones terapéuticas».
La posibilidad de suspender el BP en ciertos pacientes sin que aumente la incidencia de fracturas supone una enorme ventaja, por el hecho ya comentado de que su administración prolongada favorece la aparición de FAF y ONM.
Los criterios para instaurar el régimen de vacaciones terapéuticas no se han definido con precisión, pero lógicamente deben derivarse de lo observado en el FLEX y la extensión del HORIZON. Podría decirse que hay 2 criterios indispensables y 2 aconsejables. De acuerdo con los primeros48,49, no debe establecerse un régimen de vacaciones terapéuticas si el paciente tiene un índice T en cadera<−2,5 o si desarrolla una fractura durante el tratamiento. De acuerdo con los segundos, es prudente evitar las vacaciones si tiene más de 75 años o si presenta fracturas vertebrales o de cadera prevalentes (además, lógicamente, si presenta otros factores de riesgo como el tratamiento glucocorticoideo)51,52.
El umbral de −2,5T, pese a haber sido el primero que se identificó como discriminatorio entre quienes necesitaban continuar con el tratamiento y quienes no, ha sido ampliamente debatido, habiéndose propuesto que debería elevarse a −2,0 o −1,5. Las argumentaciones son de carácter especulativo, y fundamentalmente se basan en la idea de que entre el índice T y el riesgo de fractura existe una relación inversa. Frente a esta disquisición teórica se encuentra la evidencia aportada por el FLEX y la extensión del HORIZON de que con valores de dicho índice superiores a −2,5 el paciente ya no obtiene beneficio con el tratamiento (persistiendo, en cambio, el coste, la incomodidad y los efectos secundarios). A este respecto merece mencionarse el reciente trabajo de Black et al.53, según el cual las fracturas vertebrales disminuyen con aumentos de DMO en cadera total del 1,4%, las no vertebrales con aumentos del 2,1% y las de cadera con aumentos del 3,2%, cifras que pueden contrastarse con las señaladas en la tabla 1 para los distintos N-BP.
La duración óptima de las vacaciones no está bien establecida. Debe variar en función del BP (con los de menor adherencia deben ser más cortas) y la evolución de la DMO y los MRO (aunque este último aspecto está mal precisado). Se ha señalado que podría ser de un año para el risedronato, de 2-3 para el alendronato y de 3-5 para el zoledronato.
En relación con las vacaciones terapéuticas cabe hacer un comentario más respecto al zoledronato. Tras la primera extensión del HORIZON-PFT se realizó una segunda de otros 3 años, durante los cuales unas enfermas siguieron siendo tratadas y otras no54. No se observaron diferencias significativas en la DMO y los MRO entre los 2 grupos (la muestra era ya muy pequeña para valorar fracturas). Se dedujo que 9 años de tratamiento no son superiores a 6. De ello podrían extraerse 2 conclusiones: a) las vacaciones serían virtualmente obligadas tras 6 años de zoledronato, y b) 6 inyecciones cubren prácticamente una década de tratamiento.
Diversos estudios observacionales han intentado añadir información sobre las vacaciones terapéuticas, pero en conjunto –probablemente por los sesgos que comportan– no han aportado nada trascendente55–58.
Tratamiento inicial y a largo plazo con los bisfosfonatosIndicaciónLos BP pueden estar indicados en todos los pacientes con osteoporosis en algún momento de su enfermedad. Como parte de un tratamiento secuencial pueden utilizarse al retirar los fármacos osteoformadores, así como al retirar los SERM en mujeres tratadas inicialmente con ellos. En todos los demás pacientes, los BP orales serán el fármaco de elección si no hay problemas que contraindiquen esta vía, particularmente si su edad es –como punto de referencia– inferior a los 75 años59. Si es aconsejable evitar la vía oral o el enfermo es de mayor edad, es preferible empezar el tratamiento con un antirresortivo inyectable, en cuyo caso también podría utilizarse el zoledronato (de eficacia antifractura similar a su alternativa, el denosumab)24,60. Este planteamiento es acorde al recogido en la reciente versión de las Guías de la SEIOMM59.
Tratamiento a largo plazoBP oralesSu administración debe mantenerse los primeros 5 años de tratamiento, salvo que exista alguna contraindicación. Posteriormente debe plantearse la instauración de vacaciones terapéuticas. Si se aceptan, tras ellas se reintroduce el tratamiento, pudiendo volver a plantearse posteriormente otro período de vacaciones. De esta forma, el paciente puede mantenerse en ciclos BP-vacaciones-BP, etc., el resto de su vida. Si el paciente no cumple criterios para pasar a vacaciones, se mantiene en tratamiento, valorando cada 2-3 años la posibilidad de instaurar aquellas. Si tras 10 años de tratamiento continúa sin ser susceptible de pasar a vacaciones, debe valorarse el riesgo de complicaciones (FAF). De ser este alto, podría considerarse la sustitución transitoria del BP por teriparatida. En cualquier caso, la evidencia de que disponemos a partir de los 10 años es prácticamente nula.
ZoledronatoCon él debe valorarse la instauración de vacaciones terapéuticas tras 3 años de tratamiento. Si el paciente llega a ser tratado 6 años, se cree que tras ellos pueden instaurarse vacaciones, en cualquier caso, por lo comentado previamente. Si se considera que el riesgo de fractura osteoporótica es alto, podría administrarse teriparatida transitoriamente antes de volver al zoledronato.
ConclusiónDurante los últimos 25 años los N-BP han sido los fármacos más utilizados en el tratamiento de la osteoporosis. De mecanismo de acción antirresortivo, su eficacia está fuera de toda duda. Su gran apetencia por la hidroxiapatita permite un tipo de pauta terapéutica solo posible con ellos (las «vacaciones terapéuticas»). Son útiles tanto en el tratamiento inicial como en el tratamiento a largo plazo, a veces formando parte de fórmulas terapéuticas secuenciales. Todo ello, junto con su buena tolerancia, les augura un excelente futuro.
FinanciaciónEste trabajo ha sido financiado con una ayuda de Theramex Healthcare Spain. Theramex no ha tenido ninguna participación en la redacción del manuscrito.
Conflicto de interesesJ. González Macías ha recibido financiación para congresos y honorarios por ponencias o moderación de sesiones de Lilly, UCB-Amgen, Menarini, Theramex y Gedeon Richter. Ha intervenido en ensayos clínicos patrocinados por UCB-Amgen y FAES.
J.M. Olmos ha recibido bolsas de viaje y honorarios por ponencias de UCB-Amgen, Eli Lilly, Stada, Gedeon-Richter y Grünenthal. Ha intervenido en ensayos clínicos patrocinados por UCB-Amgen y FAES y ha participado en consejos consultivos de UCB, Stada y Gedeon-Richter.