El tumor budding (TB), definido como la presencia de células neoplásicas individuales o en grupos aislados de hasta 4 células en el frente de invasión del tumor, se ha convertido en las últimas décadas en un marcador pronóstico adverso en el cáncer colorrectal (CCR). El impacto pronóstico del TB en el CCR sigue sin estar claramente definido y los métodos histológicos para su evaluación varían según el centro. El objetivo de este estudio es investigar la asociación entre el TB y el CCR, en términos de evolución oncológica y estadio patológico.
MétodosSe realizó un estudio observacional retrospectivo, incluyendo a los pacientes sometidos a cirugía oncológica curativa de CCR entre enero del 2017 y diciembre del 2022. Se evaluaron los efectos del TB sobre la supervivencia libre de enfermedad (SLE) y la supervivencia global (SG) según las curvas de Kaplan-Meier.
ResultadosEn 78 casos se describió el TB en el informe de anatomía patológica. El TB estuvo presente en 56 pacientes (71,8%), repartido en las siguientes categorías: bajo grado en 22 (39,3%), grado intermedio en 17 (30,4%) y alto grado en 17 (30,4%). La proporción de pacientes que presentaron metástasis ganglionares, invasión linfovascular y perineural fue significativamente mayor en pacientes con TB (26,8 vs. 0%; p=0,008; 41,1 vs. 4,5%; p=0,002; 16,1 vs. 0%; p=0,054, respectivamente). La SLE fue del 86,3% en el TB de bajo grado, del 75,3% en el TB de grado intermedio y del 70,3% en el TB de alto grado. Los casos que reunían el grado intermedio y alto se asociaban a una SG más corta en comparación con el grupo de bajo grado (93,7 y 75,4% vs. 100%; p=0,012, respectivamente).
ConclusiónEstos resultados sugieren que la expresión del TB puede ser un factor de riesgo útil como factor pronóstico para la detección de metástasis en los ganglios linfáticos, de la recurrencia local y de metástasis a distancia en el CCR.
Tumor budding (TB), defined as the presence of individual neoplastic cells or isolated groups of up to 4 cells at the front of tumor invasion, has become an adverse prognostic marker in colorectal cancer (CRC) in recent decades. The prognostic impact of TB in CRC remains not clearly defined and histological methods for its evaluation vary depending on the center. The objective of this study is to investigate the association between TB and CRC, in terms of oncological evolution and pathological stage.
MethodsA retrospective observational study was conducted, including patients undergoing curative oncological surgery for CRC between January 2017 and December 2022. The effects of TB on disease-free survival (DFS) and overall survival (OS) were evaluated according to the Kaplan-Meier curves.
ResultsIn 78 cases TB was described in the pathology report. TB was present in 56 patients (71.8%), divided into the following categories: low grade in 22 (39.3%), intermediate grade in 17 (30.4%) and high grade in 17 (30.4%). The proportion of patients who presented lymph node metastases, lympho-vascular and perineural invasion was significantly higher in patients with TB (26.8% vs 0%, P=.008; 41.1% vs 4.5%, P=.002; 16.1% vs 0% P=.054; respectively). DFS was 86.3% in low-grade TB, 75.3% in intermediate-grade TB, and 70.3% in high-grade TB. Cases with intermediate and high grade were associated with a shorter OS compared to the low grade group (93.7% and 75.4% vs 100% P=.012, respectively).
ConclusionThese results suggest that TB expression may be a useful risk factor as a prognostic factor for the detection of lymph node metastasis, local recurrence, and distant metastasis in CRC.
El tumor budding (TB) se define como células neoplásicas, individuales o en grupos aislados de hasta 4 células, en el frente de invasión del tumor. Este hallazgo histológico, que representa la disociación de las células malignas respecto a la población principal del tumor, ha captado el interés de los patólogos desde que se describió por primera vez en la década del año 19501.
Si bien en la actualidad el TB es el término más común utilizado en los artículos publicados, los términos «desdiferenciación focal» y «transición epitelio-mesenquimal» indican los procesos biológicos que conllevan a la detección de esta característica histológica2. El TB no significa solamente que se ha producido un simple desprendimiento de las células tumorales, sino que también proporciona informaciones sobre la progresión de un tumor maligno, desde una enfermedad al principio localizada, hasta una diseminación sistémica3. Para que este proceso se cumpla, son necesarias la adquisición de específicas características genéticas y la modificación posterior de la expresión de moléculas de adhesión celular4,5.
La utilidad del TB en el ámbito del cáncer colorrectal (CCR) ha sido reconocida en algunas guías clínicas recientes; de hecho, se ha asociado con otras características patológicas agresivas, que incluyen las metástasis ganglionares, la invasión venosa, una pobre diferenciación tumoral y recientemente, la expresión de las proteínas del sistema de reparación de errores de emparejamiento del ADN6. En 2016, la International Tumor Budding Consensus Conference (ITBCC) elaboró un sistema internacional de puntuación, basado en la evidencia en el CCR7. Sin embargo, hasta hace poco, la ausencia de un sistema de puntuación estandarizado dificultaba la implementación del TB en la práctica clínico-patológica. Posteriormente al ITBCC, la literatura ha validado también la asociación entre el TB de grado intermedio/alto con características clínico-patológicas adversas8 y la supervivencia libre de enfermedad (SLE) y la supervivencia global (SG)9.
Varios estudios y revisiones sistemáticas han encontrado que el TB se asociaba de forma independiente con la recurrencia de la enfermedad, la muerte relacionada con el cáncer y la reducción de la SG. Una revisión exhaustiva, realizada en 2020, demostró un peor pronóstico en el contexto de TB en los estadios avanzados, aplicando un análisis multivariante (SLE a los 5 años del 89 al 98% frente a 52 al 80% en el bajo vs. el alto grado, respectivamente)10. Algunos trabajos han proporcionado diferentes sistemas de puntuación para valorar el papel pronóstico del TB; sin embargo, estos estudios presentaron limitaciones, incluidos el sesgo de confusión entre grupos, el tamaño limitado de la muestra y las restricciones a ciertas etapas de la enfermedad11,12.
Debido a la naturaleza novedosa y la introducción de este parámetro relativamente reciente aprobada en un consenso internacional, el TB no se suele utilizar ampliamente en la práctica clínica. En este sentido, el propósito de este estudio es aportar nueva información la asociación entre el TB y el CCR, en términos de evolución oncológica, y de sus características según el estadio patológico.
MétodosEl presente estudio fue aprobado por el comité de ética de la Fundación Jiménez Díaz y realizado según las recomendaciones STROBE para estudios observacionales13. Se incluyeron de forma retrospectiva los datos de los pacientes diagnosticados con CCR, entre los años 2017 y 2022, que se sometieron a cirugía con intención curativa en el Servicio de Cirugía General del Hospital Universitario Ruber Juan Bravo.
Los criterios de inclusión fueron los siguientes: mayor de 18 años, diagnóstico prequirúrgico y/o posquirúrgico de adenocarcinoma colorrectal, cirugía programada o de urgencia (en los casos de estenosis, perforación contenida). Los criterios de exclusión consistieron en: tumores digestivos distintos del adenocarcinoma clásico, estadio M1, presencia de otros tumores en la pieza quirúrgica, la falta de descripción del TB en el informe de anatomía-patológica.
Los datos demográficos del paciente, el tipo de resección, la localización y el tamaño del tumor, el grado de diferenciación, la clasificación TNM, la estadificación IUCC, los ganglios linfáticos y la expresión de la inestabilidad de los microsatélites se extrajeron de la base electrónica de datos hospitalarios, de forma retrospectiva y seudonimizada. Los datos sobre el TB se analizaron a partir de los informes de anatomía-patológica, accesibles a través del sistema de registro hospitalario electrónico.
Los datos de supervivencia se recopilaron a través de los servicios ambulatorios y las consultas hospitalarias, con la colaboración del servicio de oncología de nuestro hospital. La última actualización de los datos de seguimiento se realizó el 31/01/2023.
Cálculo del tamaño de la muestraPublicaciones anteriores describen que el 36,8% de los pacientes con CCR tienen TB en la pieza quirúrgica y que la probabilidad de mortalidad a los 5 años de estos casos es 4,5 veces mayor (IC 95%: 2,5-8,0) respecto a los pacientes sin TB14. Si se espera que la mortalidad del CCR sin TB a los 5 años es del 36%15,16, se debe incluir en el estudio un mínimo de 52 pacientes (40 pacientes sin TB y 12 pacientes con TB) para poder detectar un riesgo relativo de mortalidad a los 5 años mayor o igual a 2,5, con un poder estadístico del 80% y un nivel de significación del 95%.
Estudio patológicoSe utilizó un protocolo estandarizado para evaluar las muestras resecadas17. El margen de resección se informó de acuerdo con la definición de estado R, donde R0 corresponde a un margen libre de tumor de 1mm. Los tumores se clasificaron según el sistema de estadificación TNM actual. El estadio T se definió en función del diámetro máximo del componente invasivo. La clasificación del componente de adenocarcinoma siguió las recomendaciones de la OMS18. La estadificación pronóstica se realizó según la 8.ª edición del manual de estadificación del cáncer del AJCC/UICC17.
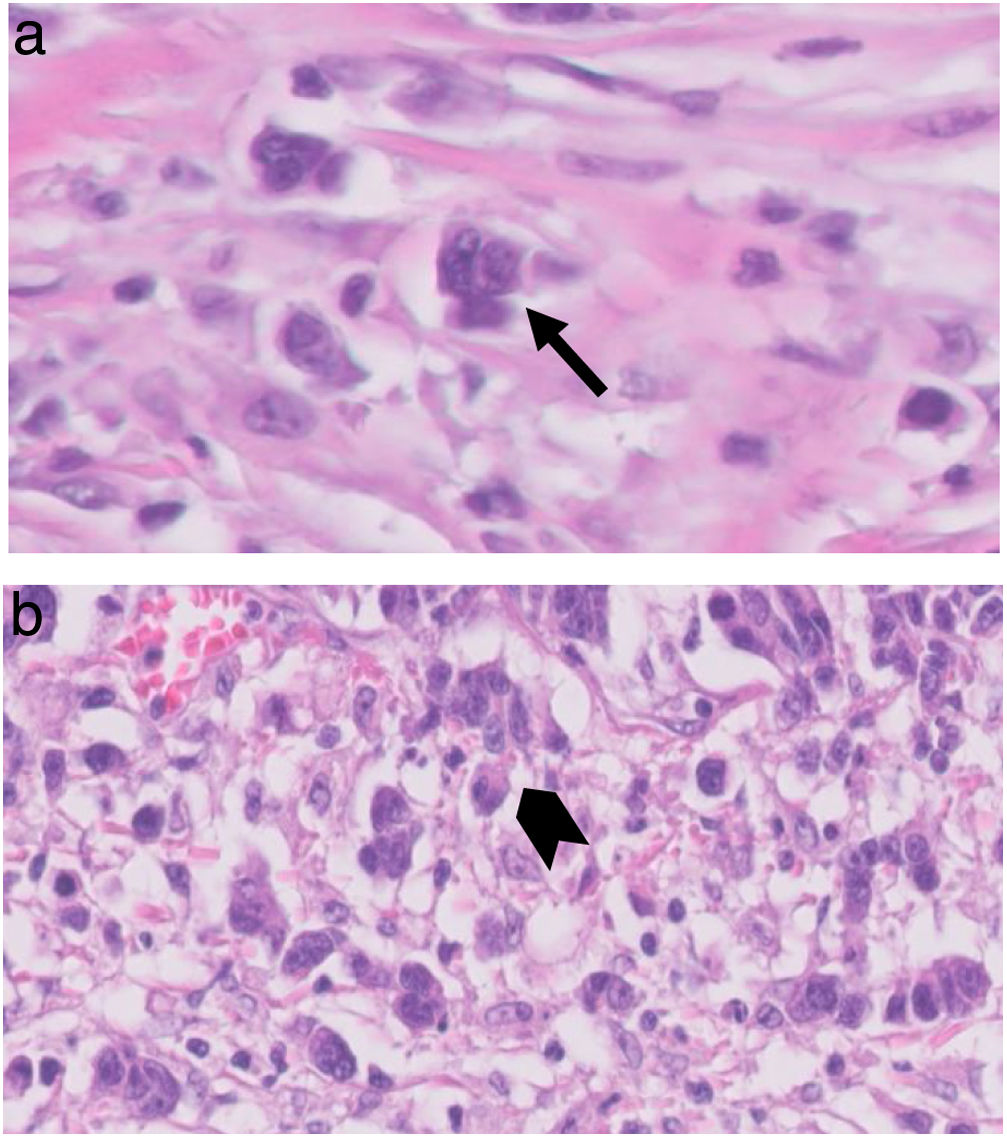
El TB se clasificó según la ITBCC del 20167; los recuentos de TB, en las secciones de H&E, se seleccionaron en un «punto crítico», elegido después de revisar los cristales disponibles de la zona de más infiltración tumoral. El número total de TB se reportó en un área de 0,785mm2; de esta manera, se informaron tanto el número total como una puntuación en tres grados (bajo, 0-4; intermedio, 5-9; alto, igual o más de 10; fig. 1).
Análisis estadísticoLos parámetros cuantitativos no presentaron distribución normal y se expresaron como mediana y rango intercuartílico (RIQ), a menos que se indicara lo contrario. Los parámetros categóricos se representaron como números absolutos y frecuencias relativas. Las comparaciones entre los 2 grupos, con o sin TB, en función de los parámetros histopatológicos categóricos se realizaron mediante la prueba Chi-cuadrado o la prueba exacta de Fisher. Las curvas de supervivencia se crearon según el método de Kaplan-Meier. Las diferencias de supervivencia se evaluaron mediante la prueba log-rank. La SG a los 5 años se definió como el tiempo desde la resección hasta la muerte por cualquier causa o el último seguimiento; la SLE a los 5 años se definió como la ausencia de metástasis o recurrencia local durante el follow-up. Se censuraron los pacientes vivos en el último seguimiento.
La significación estadística se fijó en p<0,05. Para el análisis estadístico se utilizó el programa estadístico IBM SPSS® versión 23.0 (IBM Corp., 2021, Armond, NY, EE. UU.).
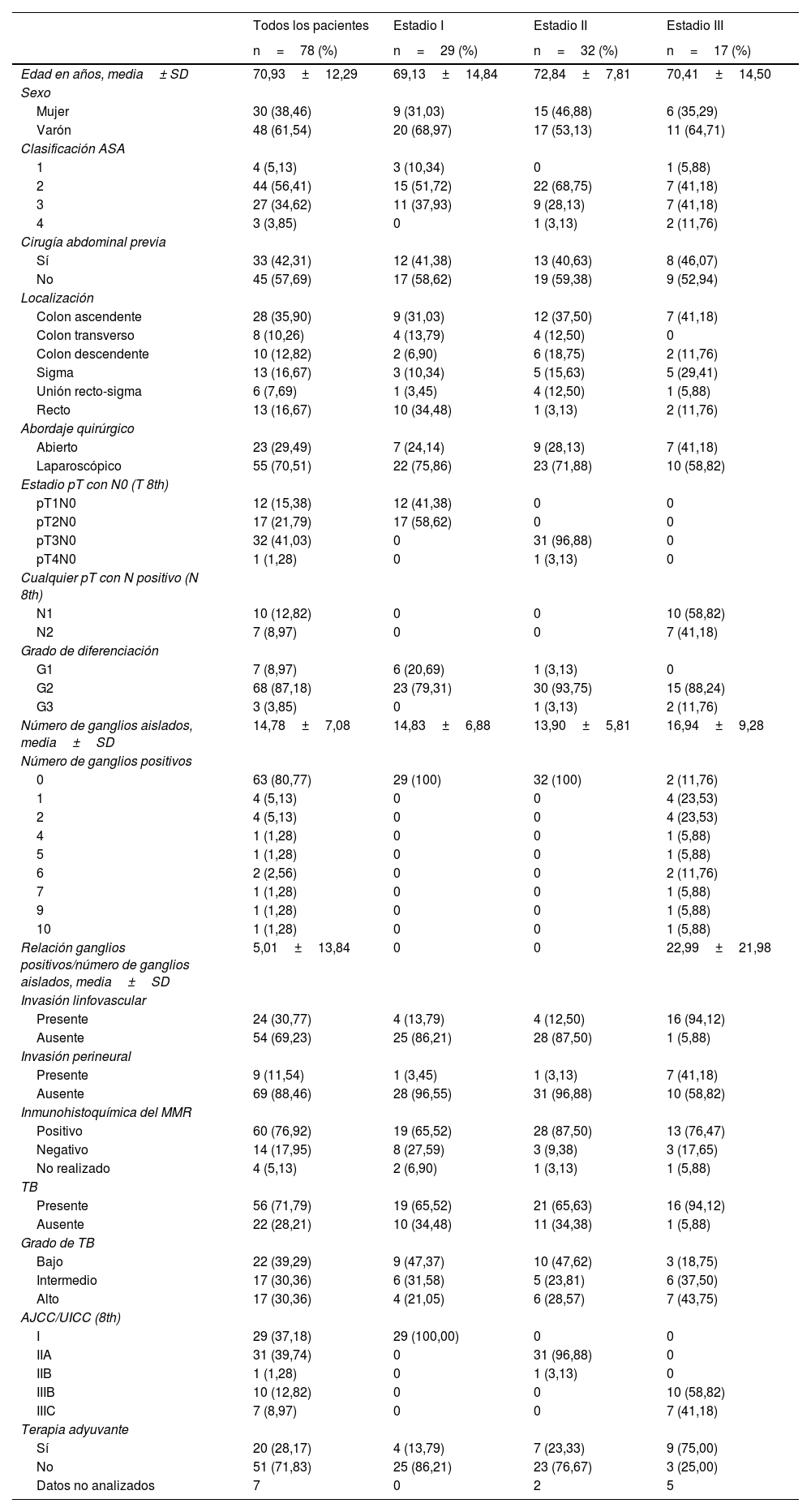
ResultadosEn total, se identificaron 129 pacientes sometidos a colectomía o resección rectal, entre enero del 2017 y diciembre del 2022. Se excluyeron 51 pacientes porque faltaban datos del TB en el informe patológico. La cohorte final de estudio estuvo compuesta por 78 pacientes, todos con descripción completa del TB, su presencia o ausencia, y con los distintos grados. Se describieron 48 varones (61,5%) y 30 mujeres (38,4%), con una mediana de edad de 70,9 años.
En la tabla 1, se resumen las principales características demográficas y clínico-patológicas.
Características clínico/patológicas de los 78 pacientes según el estadio clínico AJCC/UICC
| Todos los pacientes | Estadio I | Estadio II | Estadio III | |
|---|---|---|---|---|
| n=78 (%) | n=29 (%) | n=32 (%) | n=17 (%) | |
| Edad en años, media± SD | 70,93±12,29 | 69,13±14,84 | 72,84±7,81 | 70,41±14,50 |
| Sexo | ||||
| Mujer | 30 (38,46) | 9 (31,03) | 15 (46,88) | 6 (35,29) |
| Varón | 48 (61,54) | 20 (68,97) | 17 (53,13) | 11 (64,71) |
| Clasificación ASA | ||||
| 1 | 4 (5,13) | 3 (10,34) | 0 | 1 (5,88) |
| 2 | 44 (56,41) | 15 (51,72) | 22 (68,75) | 7 (41,18) |
| 3 | 27 (34,62) | 11 (37,93) | 9 (28,13) | 7 (41,18) |
| 4 | 3 (3,85) | 0 | 1 (3,13) | 2 (11,76) |
| Cirugía abdominal previa | ||||
| Sí | 33 (42,31) | 12 (41,38) | 13 (40,63) | 8 (46,07) |
| No | 45 (57,69) | 17 (58,62) | 19 (59,38) | 9 (52,94) |
| Localización | ||||
| Colon ascendente | 28 (35,90) | 9 (31,03) | 12 (37,50) | 7 (41,18) |
| Colon transverso | 8 (10,26) | 4 (13,79) | 4 (12,50) | 0 |
| Colon descendente | 10 (12,82) | 2 (6,90) | 6 (18,75) | 2 (11,76) |
| Sigma | 13 (16,67) | 3 (10,34) | 5 (15,63) | 5 (29,41) |
| Unión recto-sigma | 6 (7,69) | 1 (3,45) | 4 (12,50) | 1 (5,88) |
| Recto | 13 (16,67) | 10 (34,48) | 1 (3,13) | 2 (11,76) |
| Abordaje quirúrgico | ||||
| Abierto | 23 (29,49) | 7 (24,14) | 9 (28,13) | 7 (41,18) |
| Laparoscópico | 55 (70,51) | 22 (75,86) | 23 (71,88) | 10 (58,82) |
| Estadio pT con N0 (T 8th) | ||||
| pT1N0 | 12 (15,38) | 12 (41,38) | 0 | 0 |
| pT2N0 | 17 (21,79) | 17 (58,62) | 0 | 0 |
| pT3N0 | 32 (41,03) | 0 | 31 (96,88) | 0 |
| pT4N0 | 1 (1,28) | 0 | 1 (3,13) | 0 |
| Cualquier pT con N positivo (N 8th) | ||||
| N1 | 10 (12,82) | 0 | 0 | 10 (58,82) |
| N2 | 7 (8,97) | 0 | 0 | 7 (41,18) |
| Grado de diferenciación | ||||
| G1 | 7 (8,97) | 6 (20,69) | 1 (3,13) | 0 |
| G2 | 68 (87,18) | 23 (79,31) | 30 (93,75) | 15 (88,24) |
| G3 | 3 (3,85) | 0 | 1 (3,13) | 2 (11,76) |
| Número de ganglios aislados, media±SD | 14,78±7,08 | 14,83±6,88 | 13,90±5,81 | 16,94±9,28 |
| Número de ganglios positivos | ||||
| 0 | 63 (80,77) | 29 (100) | 32 (100) | 2 (11,76) |
| 1 | 4 (5,13) | 0 | 0 | 4 (23,53) |
| 2 | 4 (5,13) | 0 | 0 | 4 (23,53) |
| 4 | 1 (1,28) | 0 | 0 | 1 (5,88) |
| 5 | 1 (1,28) | 0 | 0 | 1 (5,88) |
| 6 | 2 (2,56) | 0 | 0 | 2 (11,76) |
| 7 | 1 (1,28) | 0 | 0 | 1 (5,88) |
| 9 | 1 (1,28) | 0 | 0 | 1 (5,88) |
| 10 | 1 (1,28) | 0 | 0 | 1 (5,88) |
| Relación ganglios positivos/número de ganglios aislados, media±SD | 5,01±13,84 | 0 | 0 | 22,99±21,98 |
| Invasión linfovascular | ||||
| Presente | 24 (30,77) | 4 (13,79) | 4 (12,50) | 16 (94,12) |
| Ausente | 54 (69,23) | 25 (86,21) | 28 (87,50) | 1 (5,88) |
| Invasión perineural | ||||
| Presente | 9 (11,54) | 1 (3,45) | 1 (3,13) | 7 (41,18) |
| Ausente | 69 (88,46) | 28 (96,55) | 31 (96,88) | 10 (58,82) |
| Inmunohistoquímica del MMR | ||||
| Positivo | 60 (76,92) | 19 (65,52) | 28 (87,50) | 13 (76,47) |
| Negativo | 14 (17,95) | 8 (27,59) | 3 (9,38) | 3 (17,65) |
| No realizado | 4 (5,13) | 2 (6,90) | 1 (3,13) | 1 (5,88) |
| TB | ||||
| Presente | 56 (71,79) | 19 (65,52) | 21 (65,63) | 16 (94,12) |
| Ausente | 22 (28,21) | 10 (34,48) | 11 (34,38) | 1 (5,88) |
| Grado de TB | ||||
| Bajo | 22 (39,29) | 9 (47,37) | 10 (47,62) | 3 (18,75) |
| Intermedio | 17 (30,36) | 6 (31,58) | 5 (23,81) | 6 (37,50) |
| Alto | 17 (30,36) | 4 (21,05) | 6 (28,57) | 7 (43,75) |
| AJCC/UICC (8th) | ||||
| I | 29 (37,18) | 29 (100,00) | 0 | 0 |
| IIA | 31 (39,74) | 0 | 31 (96,88) | 0 |
| IIB | 1 (1,28) | 0 | 1 (3,13) | 0 |
| IIIB | 10 (12,82) | 0 | 0 | 10 (58,82) |
| IIIC | 7 (8,97) | 0 | 0 | 7 (41,18) |
| Terapia adyuvante | ||||
| Sí | 20 (28,17) | 4 (13,79) | 7 (23,33) | 9 (75,00) |
| No | 51 (71,83) | 25 (86,21) | 23 (76,67) | 3 (25,00) |
| Datos no analizados | 7 | 0 | 2 | 5 |
AJCC/UICC: Comité Conjunto Americano sobre el Cáncer/Unión para el Control Internacional del Cáncer; ASA: Clasificación de la Sociedad Estadounidense de Anestesiólogos; MMR: Mismatch Repair, sistema de reparación de desajuste del ADN; SD: desviación estándar; TB: Tumor Budding.
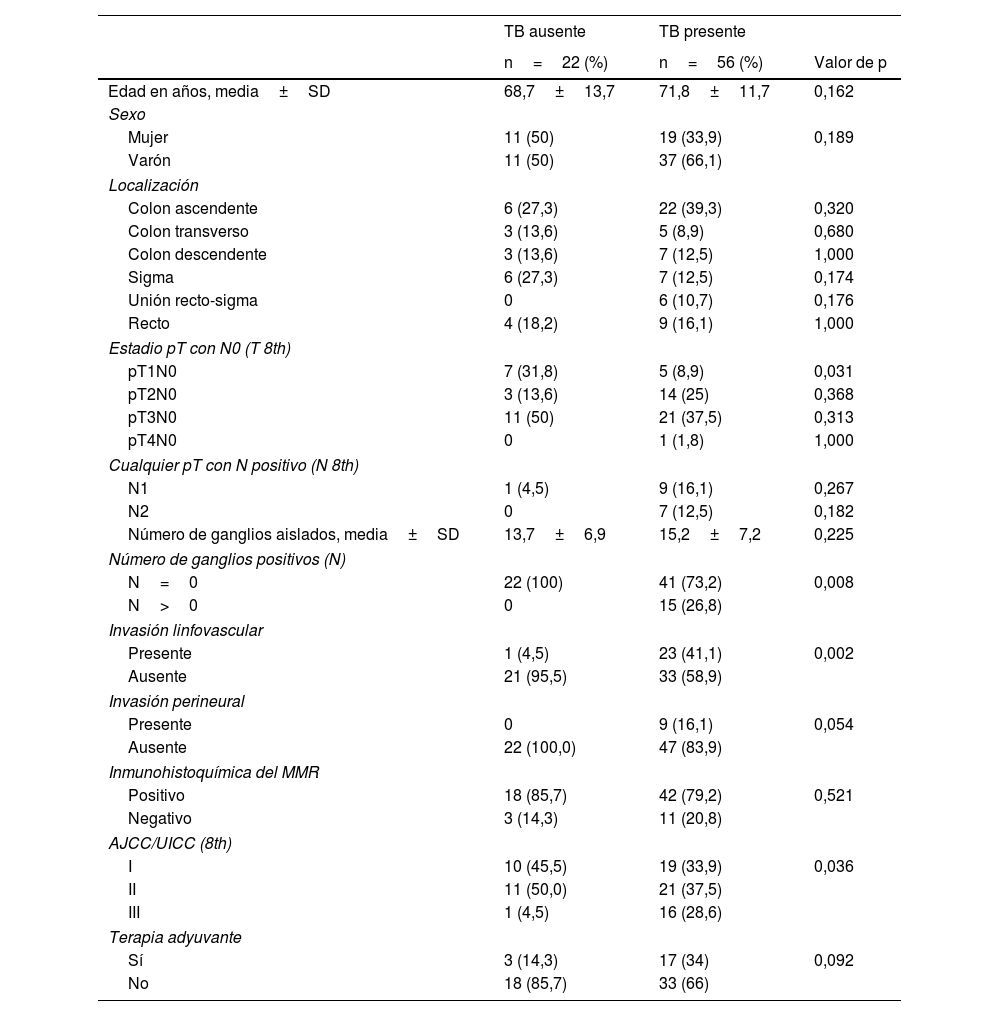
De los 78 casos, el TB estuvo presente en 56 pacientes (71,8%), repartido en las siguientes categorías: bajo grado en 22 (39,3%), grado intermedio en 17 (30,4%) y alto grado en 17 (30,4%). Los tumores se localizaron en colon ascendente (35,9%), colon transverso (10,2%), colon descendente (12,8%), sigma (16,6%), unión recto-sigma (7,6%) y recto (16,6%). Hubo 29 casos (37,1%) en estadio I, 32 casos (41%) en estadio II y 17 casos (21,7%) en estadio III. La mayoría (68%) fueron adenocarcinomas moderadamente diferenciados, mientras que 3 de ellos (3,8%) fueron adenocarcinomas pobremente diferenciados. El estado de inestabilidad de los microsatélites estuvo disponible en 74 casos, con deficiencia de la expresión de las proteínas reparadoras en el 17,9% de los pacientes. Se administró tratamiento neoadyuvante en 20 casos (28,1%).
Características clínicas de los pacientes según el tumor buddingIndependientemente del grado, no hubo asociaciones significativas entre el TB y las variables como sexo, edad, localización del tumor, diferenciación histológica, inestabilidad de microsatélites; mientras que se observaron fuertes asociaciones entre el TB y el estadio pT1, el estadio pN y la invasión linfovascular (tabla 2). La presencia de invasión linfovascular y el número de los ganglios linfáticos positivos se relacionaron, de forma estadísticamente significativa con el TB (p=0,008, p=0,001, respectivamente).
Características clínicas de los pacientes en función del TB
| TB ausente | TB presente | ||
|---|---|---|---|
| n=22 (%) | n=56 (%) | Valor de p | |
| Edad en años, media±SD | 68,7±13,7 | 71,8±11,7 | 0,162 |
| Sexo | |||
| Mujer | 11 (50) | 19 (33,9) | 0,189 |
| Varón | 11 (50) | 37 (66,1) | |
| Localización | |||
| Colon ascendente | 6 (27,3) | 22 (39,3) | 0,320 |
| Colon transverso | 3 (13,6) | 5 (8,9) | 0,680 |
| Colon descendente | 3 (13,6) | 7 (12,5) | 1,000 |
| Sigma | 6 (27,3) | 7 (12,5) | 0,174 |
| Unión recto-sigma | 0 | 6 (10,7) | 0,176 |
| Recto | 4 (18,2) | 9 (16,1) | 1,000 |
| Estadio pT con N0 (T 8th) | |||
| pT1N0 | 7 (31,8) | 5 (8,9) | 0,031 |
| pT2N0 | 3 (13,6) | 14 (25) | 0,368 |
| pT3N0 | 11 (50) | 21 (37,5) | 0,313 |
| pT4N0 | 0 | 1 (1,8) | 1,000 |
| Cualquier pT con N positivo (N 8th) | |||
| N1 | 1 (4,5) | 9 (16,1) | 0,267 |
| N2 | 0 | 7 (12,5) | 0,182 |
| Número de ganglios aislados, media±SD | 13,7±6,9 | 15,2±7,2 | 0,225 |
| Número de ganglios positivos (N) | |||
| N=0 | 22 (100) | 41 (73,2) | 0,008 |
| N>0 | 0 | 15 (26,8) | |
| Invasión linfovascular | |||
| Presente | 1 (4,5) | 23 (41,1) | 0,002 |
| Ausente | 21 (95,5) | 33 (58,9) | |
| Invasión perineural | |||
| Presente | 0 | 9 (16,1) | 0,054 |
| Ausente | 22 (100,0) | 47 (83,9) | |
| Inmunohistoquímica del MMR | |||
| Positivo | 18 (85,7) | 42 (79,2) | 0,521 |
| Negativo | 3 (14,3) | 11 (20,8) | |
| AJCC/UICC (8th) | |||
| I | 10 (45,5) | 19 (33,9) | 0,036 |
| II | 11 (50,0) | 21 (37,5) | |
| III | 1 (4,5) | 16 (28,6) | |
| Terapia adyuvante | |||
| Sí | 3 (14,3) | 17 (34) | 0,092 |
| No | 18 (85,7) | 33 (66) | |
AJCC/UICC: Comité Conjunto Americano sobre el Cáncer/Unión para el Control Internacional del Cáncer; MMR: Mismatch Repair, sistema de reparación de desajuste del ADN; SD: desviación estándar.
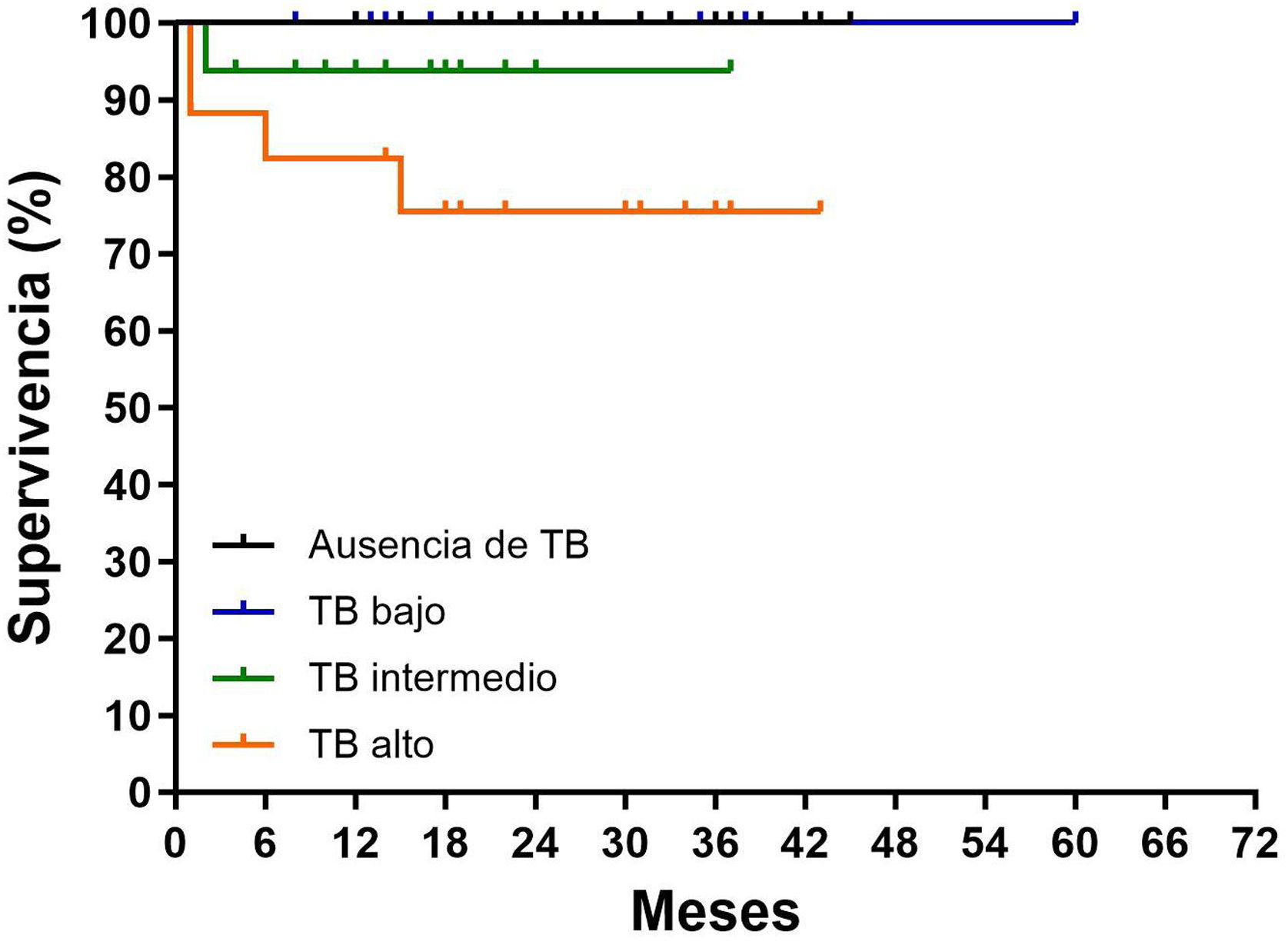
Se produjeron un total de 7 fallecimientos (91% de toda la serie): un caso fallecido en el grupo sin expresión del TB y 6 pacientes en el grupo con TB; comparando la SG entre los 2 grupos (95,5 vs. 89,3%, respectivamente), no se observaron diferencian estadísticamente significativas (p=0,143). Sin embargo, el TB demostró una peor supervivencia de la enfermedad, a los 5 años, según iba aumentando el grado; de hecho, el TB de grado intermedio y alto se asociaron a una SG más corta en comparación con la del TB de bajo grado (93,7 y 75,4% vs. 100%, respectivamente; p=0,012; fig. 2).
Se diagnosticaron 12 pacientes con recidivas de cualquier tipo, metástasis o recurrencia local, obteniendo una SLE de toda la serie del 84,6%. En 2 casos, se observó la coexistencia de metástasis a distancia y recaída local a nivel intraabdominal y anastomótico. En el grupo con TB hubo 11 pacientes con recidiva frente a un solo caso en el grupo sin TB (80,4 vs. 95,5% respectivamente; p=0,096).
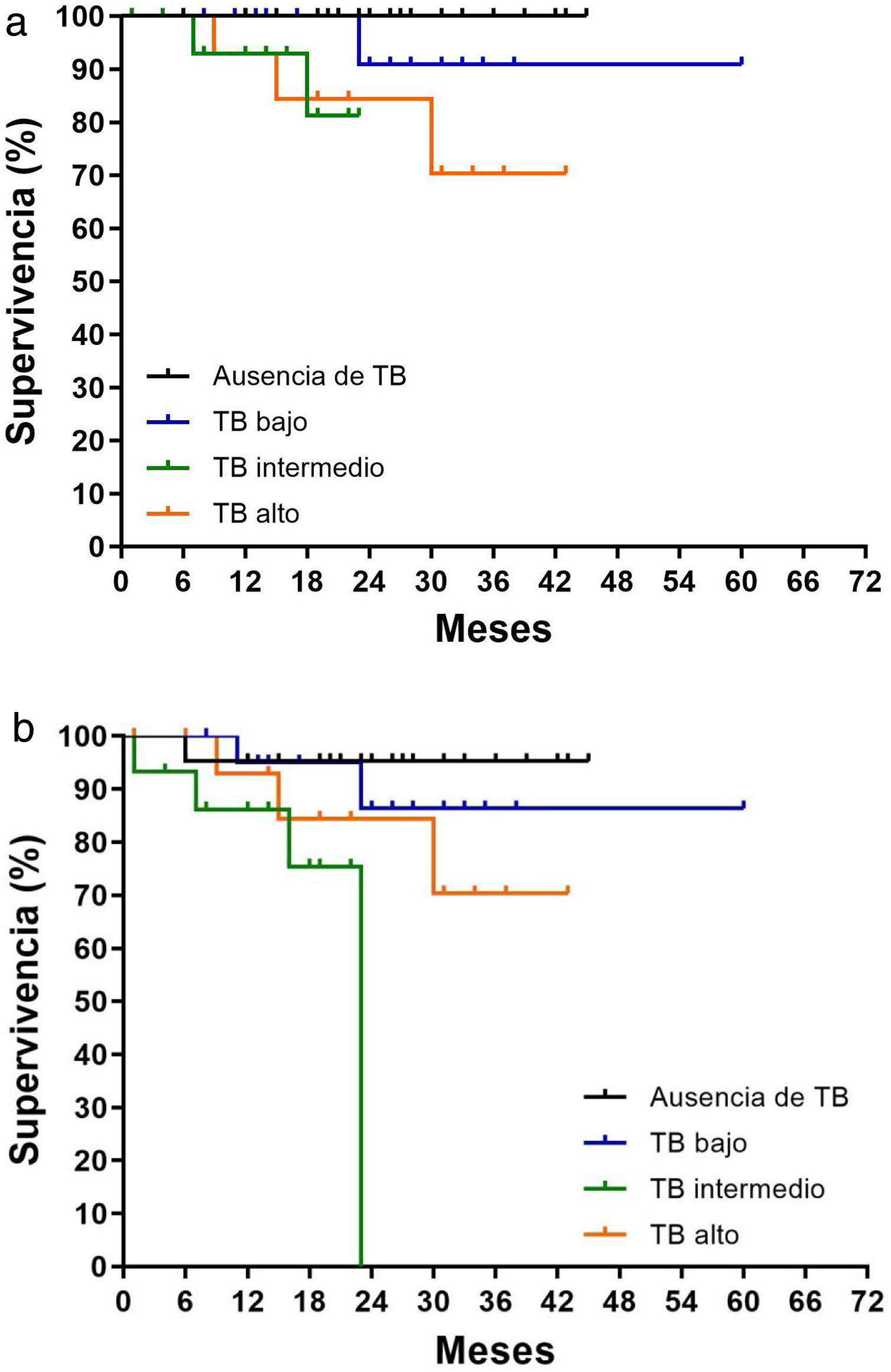
Se observó una SLE con peores resultados según iba aumentando el grado: el 70% en el alto, el 75,3% en el intermedio y el 86,3% en el bajo grado. Se describió una tendencia a una mayor recurrencia local según el grado de TB, sin llegar a una diferencia estadísticamente significativa (p=0,071; fig. 3a). Sin embargo, combinando la tasa de metástasis y recurrencia local con el grado de TB, las curvas de supervivencia de Kaplan-Meier para la SLE mostraron diferencias significativas entre los distintos grados (p=0,034; fig. 3b).
DiscusiónEl TB describe la presencia de células tumorales aisladas o en pequeños grupos en el frente de invasión de los carcinomas. Actualmente se cree que este aspecto morfológico, resultado de la transición desde un fenotipo epitelial a uno mesenquimal, puede representar el primer paso para la invasión tumoral. Por esta razón, el TB se ha considerado como un posible factor pronóstico relacionado al adenocarcinoma de colon. La relevancia pronóstica del TB se ha empezado a reflejar en las últimas publicaciones de la UICC del 2017, así como en su inclusión en las directrices para el cribado, el diagnóstico y el tratamiento del CCR en Europa y Japón19,20. Las directrices de la ESMO (European Society for Medical Oncology) lo han incluido como una característica de alto riesgo, junto con la invasión linfática o venosa21.
Aunque estudios previos habían descrito una asociación entre el TB de alto grado y la invasión linfovascular, reconociendo su importancia como factor de mal pronóstico, existen hoy en día discrepancias en la comunidad científica; en particular, el TB no está todavía incluido actualmente como una característica adversa de alto riesgo en otras líneas guía, incluidas las directrices del NICE (National Institute for Health and Clinical Excellence).
Se han investigado los resultados oncológicos del TB en el CCR, sugiriendo una peor evolución y una mayor tasa de metástasis en los ganglios linfáticos10. En 2016, una revisión basada en estudios retrospectivos, demostró que el TB se asociaba a una peor evolución después de una resección curativa para el CCR en estadio II2; aunque estudios de cohortes retrospectivos analizaron como el TB se asociaba a una peor supervivencia en los pacientes tratados de CCR en estadio II, un estudio de 477 pacientes con CCR en estadio III no demostró que el TB fuera un factor pronóstico independiente22.
En presencia de metástasis, un estudio retrospectivo analizó una tasa de supervivencia a los 5 años del 18,4% para el alto grado, en comparación con el 40,5% para los grados bajo e intermedio (HR: 1,51; p<0,009) en pacientes con CCR metastásico9. Por el contrario, algunos estudios demostraron que la importancia pronóstica del TB no era significativa en un análisis multivariante; de hecho, en 2010, un análisis retrospectivo cuestionó la utilidad del TB en el pronóstico en pacientes con CCR con metástasis ganglionares, sugiriendo que una vez que el tumor se había diseminado a los ganglios linfáticos, su grado no resultaba ser significativo para el comportamiento biológico futuro22.
Ante la heterogeneidad de los resultados y la falta de una unificación sólida en la práctica clínica, este estudio investiga la asociación entre el TB en el frente invasivo y la evolución oncológica en pacientes con resección quirúrgica del CCR.
En nuestro estudio, hemos reclutado un número consecutivo de pacientes con CCR sin metástasis al momento del diagnóstico, excluyendo por lo tanto a los pacientes en estadio clínico IV. Si bien en la literatura el valor del TB parece ser más útil en el CCR temprano, su papel se podría aplicar a todas las etapas del CCR. En estadio III, un análisis retrospectivo mostró una asociación significativa entre el TB de alto grado y la quimiorresistencia23. Es verdad que la utilidad pronóstica del TB es mayor en pacientes con CCR en los estadios I y II, donde puede permitir la identificación de pacientes que tengan un mayor riesgo de metástasis a los ganglios linfáticos24.
Nuestro estudio ha analizado los casos según los estadios de la AJCC/UICC; teniendo en cuenta el estadio clínico y la expresión del TB, el 33,9% eran estadio I, el 37,5% estadio II, el 28,6% estadio III frente al 45,5% estadio I, 50% estadio II, 4,5% estadio III en el grupo sin la presencia del TB, observando una diferencia estadísticamente significativa (p=0,036) (tabla 2). Atendiendo exclusivamente al estadio «T» anatomo-patológico con N0, obtenido tras analizar las piezas quirúrgicas, la distribución en el grupo con TB fue la siguiente: el 8,9% se clasificaron como pT1, el 25% como pT2, el 37,5% como pT3, el 1,8% como pT4. Interesante observar una diferencia estadísticamente significativa a la hora de comparar el estadio pT1N0 en los dos grupos de estudio, con o sin TB (8,9 vs. 31,8%; p=0,031, respectivamente) (tabla 2).
La proporción creciente del TB en tumores con estadio T más avanzados se justificaría por el hecho de que los tumores con más infiltración T suelen ser neoplasias más agresivas y avanzadas y, por lo tanto, con una mayor expresión de TB. Siguiendo esta hipótesis, se encontró una fuerte asociación entre la expresión del TB y el estado negativo/positivo de los ganglios aislados de la pieza quirúrgica (p=0,008) y una mayor tasa de invasión linfovascular (p=0,002) y perineural (p=0,054) (tabla 2).
Con una mediana de seguimiento de 5 años, en el grupo sin expresión del TB hubo solo un caso fallecido y en el grupo con expresión del TB fallecieron 6 pacientes, con una tasa de SG del 95,5 y del 89,3%, respectivamente. A lo hora de diferenciar el grado, hemos podido observar una SG del 100% en el bajo, del 93,7% en el intermedio y del 75,4% en el alto grado respectivamente, con una diferencia estadísticamente significativa (p=0,012) (fig. 2).
El aspecto más relevante es el análisis de los resultados en función de la SLE. En un estudio multicéntrico prospectivo, la tasa de supervivencia libre de recaída a los 5 años fue del 90,9, 85,1 y 74,4%, en los grados bajo, intermedio y alto respectivamente (p<0,001), y el grado de TB se correlacionó significativamente con la recurrencia en el grupo de metástasis hepáticas, pulmonares, ganglionares y peritoneales25. Estos resultados corroboran los datos que hemos encontrado en nuestra serie; la SLE fue del 86,3% en el bajo, del 70,6% en el intermedio y del 76,5% en el alto grado respectivamente, con una diferencia estadísticamente significativa (p=0,034) (fig. 3b).
Se han demostrado hallazgos similares en pacientes con cáncer de recto, tratados con neoadyuvancia26. Aunque la mayoría de los estudios abordan el impacto pronóstico en el CCR sin tratamiento previo, existe controversia en el escenario posneoadyuvante de los tumores rectales tratados con quimiorradioterapia14. En nuestro estudio, hemos analizado los pacientes con cáncer rectal (el 16,67% de la muestra) junto con el resto de los casos, teniendo en cuenta que el efecto de la neoadyuvancia pueda dificultar la valoración del TB, a causa de la fibrosis inducida por la radioterapia y la escasez celular en caso de respuesta completa al tratamiento.
Otro aspecto importante se basa en la elección del método de observación del TB y el tamaño del campo microscópico, recomendando un método estandarizado para estudios futuros20. Por esta razón, la reunión de consenso del 2016 estableció que la observación del TB se debiera realizar en secciones de H&E, más rentable y al mismo tiempo suficiente respecto a la técnica de inmunohistoquímica con el uso de las pancitoqueratinas. El recuento del TB se debe conseguir primero eligiendo un área, definida como «punto crítico» (hotspot), tras escanear 10 campos microscópicos a potencia media, y luego analizar dicha área con un objetivo de ×20, lo que equivale a un campo microscópico de 0,785mm2. En nuestra serie, pudimos protocolizar, según las líneas guía previamente descritas, la valoración del TB en todos los cristales de los pacientes incluidos, gracias a la colaboración de 2 patólogos expertos en patología digestiva.
Resulta destacable el hecho de que, a pesar de las implicaciones pronósticas del TB en la bibliografía, su implementación en el informe de anatomía patológica no resulta ser homogénea y universalmente establecida. En nuestra experiencia, su aplicación ha sido más protocolizada en los últimos años, cuando las piezas del estudio venían revisadas por parte de los mismos patólogos, expertos en la oncología digestiva. Por lo tanto, esto ha implicado la exclusión de 51 pacientes, de los 129 que se sometieron a intervención curativa de CCR, porque carecían de tal descripción. Somos conscientes de que esto conllevaría un sesgo de selección, en la medida que los pacientes excluidos podrían haber modificado los resultados encontrados. Sin embargo, una vez incorporada la descripción del TB de una forma más consolidada, se ha podido llegar a una alta tasa de esta característica histológica en las piezas analizadas y se han conseguido conclusiones significativas en el pronóstico oncológico. Por esta razón, insistimos en la necesidad de protocolizar el TB en los departamentos de cirugía oncológica para poder elaborar investigaciones futuras.
Es necesario afirmar que nuestro estudio presenta algunas limitaciones. En primer lugar, se ha realizado retrospectivamente en una sola institución; por lo tanto, la naturaleza retrospectiva comporta por definición un sesgo de selección. A la hora de seleccionar el método de observación del TB, no hemos comparado de forma sistemática la H&E con otros métodos histológicos, como la inmunohistoquímica. Después de la realización del estudio, se ha obtenido una diferencia entre la proporción esperada de pacientes con TB, descrita en la literatura, y la proporción de pacientes con TB en nuestro estudio (56 pacientes, el 71% de la muestra).
A pesar de estas limitaciones, nuestro estudio presenta algunos aspectos relevantes. Hemos distinguido las características del TB según los tres estadios del CCR y hemos analizado la SG, teniendo en cuenta los diferentes grados. Aunque la muestra comprendía un número pequeño de pacientes, los resultados han sido homogéneos, debido al manejo quirúrgico y clínico por parte del mismo equipo y gracias al análisis sistemático de todos los cristales.
ConclusiónEl TB ha sido considerado, en las últimas décadas, como un marcador pronóstico en el CCR; una mayor expresión del TB se asociaría a un comportamiento tumoral más agresivo y a unos resultados menos favorables en términos de progresión de la enfermedad y supervivencia.
Este estudio proporciona informaciones sobre la morfología del TB según el estadio tumoral y la importancia clínica del mismo como factor de mal pronóstico; de hecho, este trabajo confirma la evidencia publicada que asocia el TB a una supervivencia más corta. Para mejorar la potencia del estudio en cuanto al análisis de subgrupos, debido al número restringido de pacientes, se necesita en un futuro la elaboración de estudios multicéntricos, recogiendo un número más elevado de pacientes en un marco de tiempo determinado.
Se sugiere una aplicación estandarizada y rutinaria del TB y se recomienda y advierte sobre la necesidad de estudios futuros que puedan dilucidar su utilidad en el pronóstico de los estadios precoces y en la toma de decisiones en el tratamiento oncológico de los pacientes con CCR.
Aprobación éticaEste protocolo de estudio fue revisado y aprobado por el Comité de Ética en Investigación de la Fundación Jiménez Díaz, expediente de aprobación n°22/21 (14/12/21) y n°06/22 (04/12/22), con Código de Protocolo PGG-CAD-2022-01. Este estudio se realizó de acuerdo con la Declaración de Helsinki de la Asociación Médica Mundial. Se realizó de acuerdo con la Declaración de Helsinki de la Asociación Médica Mundial, el informe de Belmont, el convenio de Oviedo sobre los derechos humanos y la biomedicina y la ley 14/2007, de 3 de julio, de investigación biomédica. El estudio se realizó conforme a la legislación de la UE sobre datos personales, en concreto la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales, el Real Decreto 1720/2007, la Ley 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
AutoríasPietro Giovanni Giordano: conceptualización, curación de datos, análisis formal, metodología, visualización, redacción del borrador original, revisión y edición de la redacción final. Ana Gabriela Díaz Zelaya: conceptualización, curación de datos, análisis formal, metodología, redacción del borrador original. Yari Yuritzi Aguilera Molina: curación de datos, análisis formal, supervisión, revisión y edición de la redacción final. Nestor Orlando Taboada Mostajo: curación de datos, análisis formal, metodología, revisión y edición de la redacción final. Yelene Ajete Ramos: curación de datos, análisis formal, metodología, revisión y edición de la redacción final. Ricardo Ortega García: curación de datos, análisis formal, metodología, revisión y edición de la redacción final. Esteban Peralta De Michelis: curación de datos, análisis formal, metodología, revisión y edición de la redacción final. Juan Carlos Meneu Díaz: conceptualización, curación de datos, análisis formal, metodología, visualización, redacción del borrador original, revisión y edición de la escritura final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores desean expresar su agradecimiento a la Dra. Cristina Andreu Vázquez, a la Dra Ana Isabel Castillo Varón y al Dr. Israel John Thuissard Vasallo (Grupo de Asesoramiento Metodológico y Estadístico, Universidad Europea de Madrid) por su asesoramiento a la elaboración del análisis estadístico.








![Supervivencia basada en la tasa de recurrencia local y la tasa combinada de metástasis y recurrencia local (supervivencia libre de enfermedad [SLE]): a) Supervivencia basada en la tasa de recurrencia local y grado de TB (p=0,071). b) SLE y grado de TB (p=0,034). Supervivencia basada en la tasa de recurrencia local y la tasa combinada de metástasis y recurrencia local (supervivencia libre de enfermedad [SLE]): a) Supervivencia basada en la tasa de recurrencia local y grado de TB (p=0,071). b) SLE y grado de TB (p=0,034).](https://static.elsevier.es/multimedia/00257753/0000016300000004/v1_202408190637/S0025775324002008/v1_202408190637/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
