La pandemia por SARS-CoV-2 (COVID-19) ha tenido un impacto sin precedentes en la historia reciente de la medicina. A pesar de los avances, la rápida expansión del cuadro ha hecho que nos encontrásemos ante una total ausencia de evidencia científica en la que basar nuestras decisiones asistenciales. Por ello, la comunidad científica ha focalizado su atención en esta patología respondiendo con un número de trabajos sin parangón hasta el momento. Así, a 17 de julio de 2020 se encontraban registrados 2.654 estudios en clinicaltrials.gov relacionados con la COVID-19, 1.480 de ellos catalogados como ensayos clínicos (EECC). A nivel nacional, el Registro Español de Estudios Clínicos (REec) recoge 101 EECC (10 finalizados, 51 reclutando y 40 no iniciados).
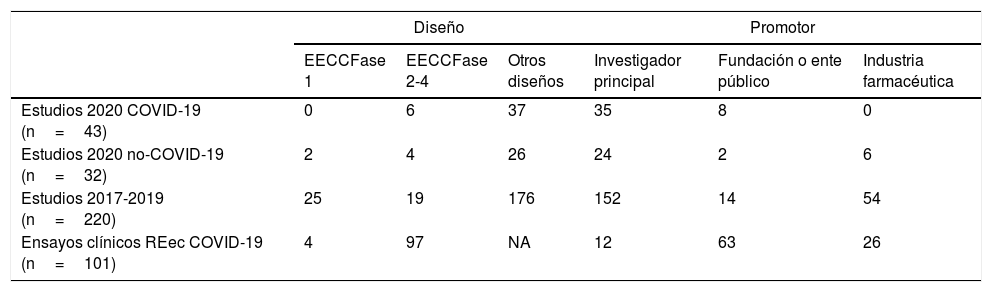
Esta explosividad científica ha implicado también a los Comités de Ética de la Investigación con Medicamentos (CEIm), cuyo funcionamiento ha tenido que adaptarse mediante reuniones no presenciales en las que dar una rápida respuesta a las solicitudes de los investigadores. Desde nuestro CEIm hemos logrado mantener todas las reuniones ordinarias, añadiendo 5 reuniones extraordinarias (3 de ellas de la Comisión Permanente). Entre los meses de marzo y junio hemos evaluado 75 estudios (43 relacionados con COVID-19), un número similar al promedio de los 3años previos (73,3 estudios). A falta de 3 estudios pendientes de decisión definitiva, se han aprobado 38 estudios relacionados con COVID (95% de los evaluados), otro se ha cancelado por el promotor y el restante se ha considerado no evaluable al tratarse de un proyecto puramente asistencial. La mediana hasta emitir un dictamen definitivo en los estudios COVID-19 fue de 14días naturales, frente a los 21días de los años previos. Las características de los estudios y su comparación con los años previos y los datos del REec se presentan en la tabla 1. Si nos fijamos en el carácter multicéntrico de los estudios del REec, los promovidos por la industria son mayoritariamente multicéntricos (88,5%), a diferencia de los promovidos por entidades públicas (39,7%) y por los propios investigadores (11,5%).
Características de los estudios evaluados y registrados en el Registro Español de Estudios Clínicos (REec)abla
| Diseño | Promotor | |||||
|---|---|---|---|---|---|---|
| EECCFase 1 | EECCFase 2-4 | Otros diseños | Investigador principal | Fundación o ente público | Industria farmacéutica | |
| Estudios 2020 COVID-19 (n=43) | 0 | 6 | 37 | 35 | 8 | 0 |
| Estudios 2020 no-COVID-19 (n=32) | 2 | 4 | 26 | 24 | 2 | 6 |
| Estudios 2017-2019 (n=220) | 25 | 19 | 176 | 152 | 14 | 54 |
| Ensayos clínicos REec COVID-19 (n=101) | 4 | 97 | NA | 12 | 63 | 26 |
Es importante reseñar las dificultades en la valoración de los estudios durante esta etapa, ya que la ausencia de evidencia en la que basar nuestra asistencia sanitaria tenía su reflejo en la ausencia de una base científica que sustentase las prácticas a evaluar, un hecho especialmente relevante en los ensayos clínicos1. No podemos olvidar que nuestro papel no es desarrollar la investigación sino velar porque esta se ajuste a los principios éticos fundamentales, sin permitir que el contexto modifique estos principios ni su relevancia2.
Como hemos comentado, nuestro país ha sido muy prolífico en ensayos clínicos. Según datos del REec, hay 26 ensayos en los que se emplea como fármaco en investigación la cloroquina o sus derivados, 10 tocilizumab, 9 corticoides, 7 lopinavir-ritonavir, 6 sarilumab y 5 remdesivir. Sin entrar en el fondo de estos trabajos ni en sus diseños concretos, resulta poco probable que no exista un cierto grado de solapamiento entre algunos de ellos, con las consecuencias que esto conlleva en capacidad de reclutamiento y tiempo hasta completarlo, con el riesgo de que los trabajos carezcan de potencia suficiente para alcanzar conclusiones válidas. Este solapamiento lo hemos podido observar incluso en los estudios evaluados en nuestro comité, ante lo que se instó a los investigadores a unificar los ensayos, sin éxito. Cabe destacar que esta preocupación por la potencia de los estudios se ha producido más allá de nuestro entorno3. En Italia se ha tratado de combatir este fenómeno mediante la designación de un comité único nacional para evaluar todos los estudios que impliquen fármacos para el tratamiento de la COVID-194. Otros autores abogan por la revisión continúa de los mismos, finalizando precozmente aquellos sin visos de aportar información relevante o fusionando aquellos de características similares1. En otras ocasiones se ha recurrido a internacionalizar los trabajos, dada la evolución asíncrona de la pandemia.
Desde nuestro punto de vista, la contundencia con la que nos ha golpeado la COVID-19 únicamente podrá contrarrestarse con una evidencia científica igualmente sólida y contundente, quedando los estudios de baja potencia o calidad relegados únicamente a aportar más sombras que luces en esta batalla. Únicamente desde la concertación de los esfuerzos seremos capaces de alcanzar este objetivo.