Para llegar al diagnóstico de arteritis de células gigantes (ACG) se evalúan signos, síntomas, pruebas de laboratorio, hallazgos de pruebas de imagen y, en ocasiones, los resultados anatomopatológicos de la biopsia de arteria temporal (BAT). El presente estudio describe los resultados del análisis de un algoritmo basado en la clínica y la ecografía de los pacientes con sospecha de ACG, destacando su utilidad diagnóstica, al contrastar su utilización en diferentes escenarios de sospecha clínica.
MétodoEstudio prospectivo multicéntrico que evalúa mediante un circuito preferente (fast track) a los pacientes derivados con sospecha de ACG para la realización de una ecografía de arterias temporales y axilares, agrupándose según baja o alta sospecha clínica de ACG. Cada uno de estos supuestos es evaluado por ecografía, y el resultado puede ser positiva, indeterminada o negativa, obteniendo seis posibles grupos diferentes. Se exploran las posibles áreas de mejora, tras una ecografía negativa o indeterminada. En algunos pacientes se realiza una 18F-FDG-PET/TC. Analizamos los resultados y la aplicación de un algoritmo diagnóstico, confirmando su eficiencia y su aplicabilidad según si hay una alta o baja sospecha clínica.
ResultadosSesenta y nueve pacientes (41 en el grupo de alta sospecha y 28 en el de baja sospecha clínica). Hubo un total de 41 diagnósticos nuevos de ACG: 35 en el grupo de alta sospecha y 6 en el de baja sospecha. El algoritmo inicial tiene una eficiencia global de diagnóstico del 72,5%, si solamente se utiliza la ecografía, que al incluir a la 18F-FDG-PET/TC, mejora al 80,5%. El valor predictivo negativo de la ecografía en los pacientes que presentan una baja sospecha clínica es del 84,6%, y el valor predictivo positivo de la ecografía en los pacientes con una sospecha alta es del 100%, mejorando en este escenario la sensibilidad del 57,1% al 80,8% si hacemos una 18F-FDG-PET/TC. La BAT se realizó a todos los pacientes, sin encontrar diferencias en la sensibilidad o la especificidad respecto a la ecografía. En el caso de tener las tres pruebas realizadas (ecografía, biopsia y 18F-FDG-PET/TC), la sensibilidad aumenta al 92,3% en los pacientes que presentan una alta sospecha clínica.
ConclusiónEn situaciones de alta sospecha clínica, el algoritmo proporciona suficiente información para el diagnóstico de ACG si la ecografía es positiva. En el contexto de baja sospecha clínica, una ecografía negativa es suficiente para descartar el diagnóstico. El 18-FDG-PET-TC puede ser de utilidad en aquellos pacientes con alta sospecha y ecografía negativa o indeterminada.
To reach the diagnosis of giant cell arteritis (GCA), signs, symptoms, laboratory tests, imaging findings, and occasionally anatomopathological results from temporal artery biopsy are evaluated. This study describes the results of an algorithm analysis based on clinical and ultrasound evaluation of patients with suspected GCA, highlighting its diagnostic utility by contrasting its use in different clinical suspicion scenarios.
MethodProspective multicenter study evaluating patients referred with suspected GCA through a preferential circuit (fast track), grouping them according to low or high clinical suspicion of GCA. Each of these scenarios is evaluated by biopsy and ultrasound for all patients, resulting in positive, indeterminate, or negative outcomes, yielding six possible groups. Potential areas of improvement are explored, emphasizing that, following a negative or indeterminate ultrasound, 18-FDG-PET-CT could be recommended. We analyze the results and application of a diagnostic algorithm, confirming its efficiency and applicability based on whether there is high or low clinical suspicion.
ResultsSixty-nine patients (41 in the high suspicion group and 28 in the low suspicion group). There were 41 new diagnoses of GCA: 35 in the high suspicion group and 6 in the low suspicion group. Using ultrasound alone, the initial algorithm has an overall diagnostic efficiency of 72.5%, which improves to 80.5% when including 18F-FDG-PET/CT. The negative predictive value of ultrasound in patients with low clinical suspicion is 84.6%, and the positive predictive value of ultrasound in patients with high suspicion is 100%, improving sensitivity from 57.1% to 80.8% with 18F-FDG-PET/CT in this scenario. Temporal artery biopsy was performed on all patients, with no differences in sensitivity or specificity compared to ultrasound. In cases where all three tests — ultrasound, biopsy, and 18F-FDG-PET/CT — are performed, sensitivity increases to 92.3% in patients with high clinical suspicion.
ConclusionIn situations of high clinical suspicion, the algorithm provides sufficient information for the diagnosis of GCA if ultrasound is positive. A negative ultrasound is sufficient to rule out the diagnosis in the context of low clinical suspicion. 18-FDG-PET-CT may be useful in patients with high suspicion and negative or indeterminate ultrasound results.
La arteritis de células gigantes (ACG) es la vasculitis más frecuente en la edad adulta. La evolución en técnicas de imagen agiliza el diagnóstico, evitando el requisito obligado de antaño de un resultado de biopsia de arteria temporal (BAT) positiva ampliamente aceptado. Asimismo, facilita un mayor conocimiento acerca de las diferentes formas clínicas de presentación y la extensión de la enfermedad1,2.
Para llegar a un diagnóstico preciso de la ACG, la evaluación se basa en síntomas, signos, pruebas de laboratorio, hallazgos de imagen o histopatología del paciente3-5. El abordaje diagnóstico clásico incluye la BAT superficial, considerada el patrón oro, y otras pruebas de imagen; asimismo, realizar un score clínico pre-test en un contexto de sospecha clínica ayuda y aumenta la rentabilidad en el proceso diagnóstico6.
La utilidad, la reproducibilidad y la sensibilidad al cambio de la ecografía vascular en modo Doppler en manos expertas, de arterias temporales y axilares (EATAx) como herramienta diagnóstica para evitar la BAT temporal, está ampliamente aceptada7-9. Sin embargo, la tomografía computarizada con emisión de positrones, marcada con 18F-fluorodesoxiglucosa (18F-FDG-PET/TC), puede ayudar en los casos en que la clínica o la EATAx son negativas o indeterminadas10-12.
Los criterios recientes de clasificación ACR/EULAR 2022 apuestan decididamente por la relevancia de las pruebas de imagen en la clasificación de la ACG dentro del grupo de vasculitis13. Los criterios de clasificación en muchas ocasiones se consideran como criterios diagnósticos, pero, dependiendo del perfil clínico, pueden complicar su cumplimiento estricto, dado que la ACG es una enfermedad muy heterogénea. Por otro lado, se debe destacar que, en la práctica clínica, para alcanzar un diagnóstico de certeza, en pacientes individuales, se requiere la incorporación de criterios clínicos adicionales más allá de los de clasificación, y la interpretación se basa, en ocasiones, en la experiencia clínica del profesional.
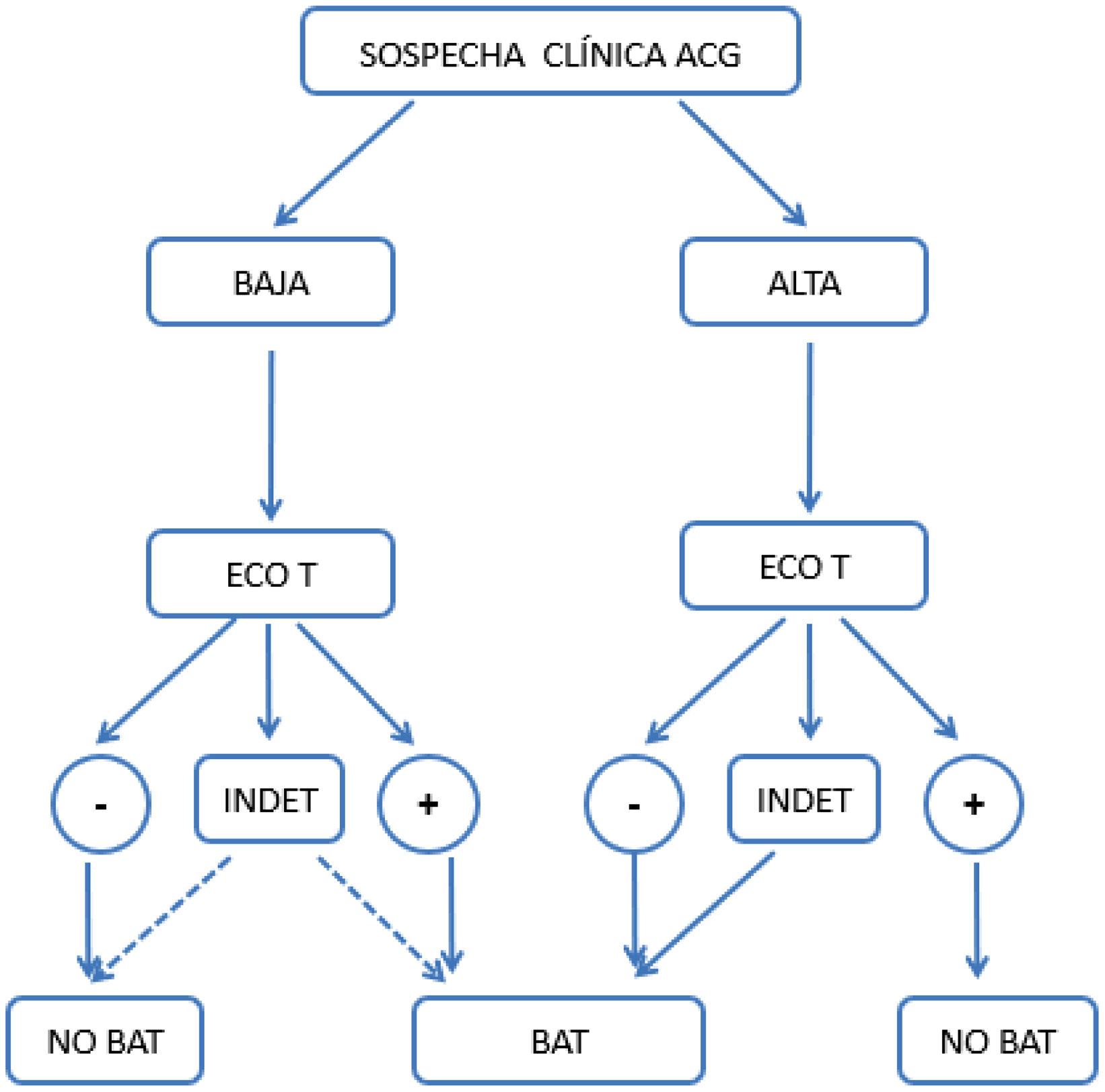
El presente estudio describe los resultados del análisis de un algoritmo previamente publicado (fig. 1)14, destacando su utilidad diagnóstica, al contrastar su utilización en diferentes escenarios de sospecha clínica y explorar áreas de mejora, clasificando aquellos pacientes con EATAx negativa o indeterminada que pueden beneficiarse de un 18F-FDG-PET/TC posterior.
Algoritmo original propuesto para el diagnóstico de ACG en la práctica clínica diaria. Se define como sospecha alta: presencia de cualquiera de las siguientes manifestaciones clínicas: 1)síntomas cefálicos exclusivos (cefalea de instauración reciente, claudicación mandibular o alteraciones visuales); 2)con polimialgia reumática, según criterios EULAR/ACR 2012; 3)síndrome febril inespecífico, una vez descartadas causas infecciosas y siendo negativo el cribado por neoplasias; 4)ictus, sin antecedentes cardiovasculares relevantes ni hallazgos de etiología aterogénica después de estudio dirigido. Sospecha baja: pacientes con sospecha por síntomas distintos a los comentados en el punto anterior (p.ej., cribado de estudio de cefalea, anemia, elevación de los reactantes de fase aguda)14.
ACG: arteritis de células gigantes; ECO: ecografía de arterias temporales y axilares; INDET: resultado de la ecografía «indeterminado», definido como signo del halo en 1 o 2 o menos de las 8 arterias exploradas; NO BAT: no realizar biopsia de arteria temporal; PET-TC: 18F-FDG-PET/TC; −: resultado negativo; +: resultado positivo.
Estudio prospectivo, realizado entre septiembre de 2019 y enero de 2023, en tres centros hospitalarios del área metropolitana de Barcelona.
Aspectos éticosEl protocolo fue aprobado por el Comité Ético del centro con código: PR313/19; CSI 19/66. El estudio fue llevado a cabo siguiendo los estándares de Buena Práctica Clínica y sujeto a los principios éticos de la Declaración de Helsinki.
PoblaciónSe incluyó a pacientes consecutivos que accedían a participar, derivados por sospecha de ACG. Los pacientes podían provenir de consultas de atención especializada ambulatoria, de consultas externas hospitalarias o ingresados. Los diferentes servicios implicados en la derivación fueron medicina de familia, medicina interna, reumatología, neurología y oftalmología. Se activó el circuito de diagnóstico rápido (fast-track), a partir del cual se les hizo una EATAx en 24-48horas hábiles.
VariablesLos datos fueron recogidos en un cuaderno de recogida electrónica para su posterior análisis. A todos se les realizó una anamnesis estructurada, analítica con reactantes de fase aguda, VSG, PCR, y hemograma, EATAx en escala de grises y modo Doppler, y BAT superficial. Se recogieron las dosis y los días de tratamiento con glucocorticoides (GC) antes de las diferentes exploraciones complementarias, y se realizó una revisión a los 6meses para confirmar el diagnóstico definitivo. Se solicitó 18F-FDG-PET/TC a criterio médico, en casos de duda diagnóstica o como estudio de extensión de la afectación vascular de la ACG. El resultado de la 18F-FDG-PET/TC se interpretó según el criterio visual semicuantitativo (0-3) de captación en relación al hígado15.
El patrón oro para el diagnóstico de ACG fue el criterio médico, tomando en cuenta el resultado de la BAT o la presencia de vasculitis de grandes vasos en la 18F-FDG-PET/TC.
La ecografía Doppler vascular se realizó de manera protocolizada en las arterias temporales común, sus ramas parietal, frontal y en arterias axilares bilateralmente (total 8 arterias), por parte de exploradores expertos con más de 10años de experiencia y certificación acreditada mediante ecógrafos de alta gama, P.E., P.M., C.M. y H.C. El diagnóstico definitivo se hizo en base al criterio médico; los médicos que participaron en la toma de decisiones fueron P.E., P.M., J.N. y H.C.
A los pacientes se les agrupó en dos grandes grupos, de baja o alta sospecha clínica de ACG, y dentro de estos dos grupos, se les agrupó según el resultado de la EATAx Doppler (positiva, indeterminada o negativa), conformando un total de 6 grupos diagnósticos. Se utilizaron las siguientes definiciones para clasificar a los pacientes en los grupos correspondientes.
- -
Alta sospecha clínica. Presencia de cualquiera de las siguientes manifestaciones clínicas: 1)síntomas cefálicos exclusivos (cefalea de instauración reciente, claudicación mandibular o alteraciones visuales); 2)con polimialgia reumática, según criterios EULAR/ACR 201216; 3)síndrome febril inespecífico, una vez descartadas causas infecciosas y siendo negativo el cribado por neoplasias, y 4)ictus, sin antecedentes cardiovasculares relevantes, ni hallazgos de etiología aterogénico después de estudio dirigido.
- -
Baja sospecha clínica. Pacientes con sospecha por síntomas distintos a los comentados en el punto anterior (p.ej., cribado de estudio de cefalea, anemia, elevación de los reactantes de fase aguda).
- -
EATAx positiva. Presencia de signo del halo, establecida por OMERACT, en 3 o más de las 8 arterias exploradas4.
- -
EATAx indeterminada. Signo del halo en 1 o 2 de las 8 arterias exploradas.
- -
EATAx negativa. Sin hallazgos patológicos.
Para el análisis estadístico, los resultados de las variables descriptivas se presentan con medidas de tendencia central. Se calcularon la sensibilidad (S), la especificidad (E), el valor predictivo positivo (VPP), el valor predictivo negativo (VPN) y la eficiencia global de las pruebas, razón de verosimilitud positiva (LHR+) y negativa (LHR−) de la EATAx Doppler y la 18F-FDG-PET/TC, con respecto al diagnóstico definitivo. Asimismo, de manera complementaria, post hoc, se calculó el Southend Probability Pretest Score de nuestra cohorte. Este índice se basa en la probabilidad bayesiana, y ha demostrado ser efectivo en la estratificación de las referencias a clínicas fast-track. Inicialmente se calcula una puntuación (PreTest Probability Score [PTPS]), en donde el paciente puede presentar un bajo (LR), intermedio (IR) o alto riesgo (HR) de probabilidad de ACG, al tiempo que descarta diagnósticos que puedan ser confundidos con el diagnóstico de ACG6. Posteriormente se interpretan los resultados de las ecografías en su contexto clínico. La EATAx puede ser positiva o negativa, llegando a un diagnóstico como probable, posible, dudoso o improbable para ACG6.
ResultadosLas características clínico-demográficas de los 69 pacientes se describen en la tabla 1. La cefalea fue el síntoma de derivación más frecuente (59%). Mientras la BAT fue positiva en 21 (30,43%) de los pacientes, el diagnóstico definitivo de ACG se hizo en 41 pacientes (59,42%). La media de edad fue de 75,9 (DE: 7,2) años, sin diferencia significativa entre los diferentes grupos de estudio. Se inició GC en el 36,2% de los casos, sin haber diferencia significativa entre los grupos de EATAx positiva, indeterminada o negativa.
Características generales de los pacientes
| n=69 | |
|---|---|
| Demográficos | |
| Edad, años (DE) | 75,9 (7,18) |
| Sexo femenino, n (%) | 47(68,11) |
| Manifestaciones clínicas | |
| Cumplen criterios clasificación ACR 1990, n (%) | 33 (47,82) |
| Cefalea, n (%) | 41 (59,42) |
| Polimialgia reumática, n (%) | 18 (26,09) |
| Eventos isquémicosa, n (%) | 22 (31,88) |
| Claudicación de extremidades superiores, inferiores, n (%) | 5 (7,25) |
| Fiebre de origen desconocido, n (%) | 12 (17,39) |
| Parámetros analíticos | |
| VSG, mm/h (DE) | 72,23 (36,43) |
| Proteína C reactiva mg/l, mediana [RIC Q1-Q3] | 30,5 [10-109] |
| Hemoglobina, g/l (DE) | 11,86 (1,57) |
| Pruebas complementarias | |
| Biopsia de arteria temporal positiva (BAT), n (%) | 22 (31,88) |
| Días transcurridos desde la primera visita hasta la BAT, mediana [Q1-Q3] | 14 [7-32,5] |
| Dosis de glucocorticoides (mg) previo a la BAT, mediana [Q1-Q3] | 460 [0-1500] |
| Ecografía de arterias temporales y axilares, n (%) | Positiva 22 (32,84)Indeterminada 18 (26,87)Negativa 27 (40,30) |
| Dosis de glucocorticoides (mg) previo al PET-TC (n, % de pacientes que recibieron GC); media (DE)Ecografía positiva (n=7, 31,8%)Ecografía indeterminada (n=12, 33%)Ecografía negativa (n=11, 40,7%) | 680 (582,7)430 (455,7)725 (596,6) |
| 18-FDG-PET-TCb, n (%) | Positivo 15 (36,59)Negativo 26 (63,41) |
| Días transcurridos desde la primera visita hasta el PET-TC, mediana [Q1-Q3] | 13 [6-63] |
| Dosis de glucocorticoides (mg) previo al PET-TC, mediana [Q1-Q3] | 900 [55-1350] |
| Diagnóstico definitivo ACG, n=41 | Alta sospecha 35/41Baja sospecha 6/28 |
Entre los grupos de alta y baja sospecha clínica de ACG hubo diferencia significativa (p<0,05), siendo la prevalencia de diabetes mellitus tipo2, hipertensión arterial y dislipemia mayor en el grupo de baja sospecha clínica de ACG, no así para los antecedentes de evento cardiovascular mayor (tabla 2).
Factores de riesgo cardiovascular presentes en la visita basal
| Comorbilidades, n (%) | |||||
|---|---|---|---|---|---|
| Edad, años (DE) | DM2 | HTA | DLP | MACE | |
| Baja sospecha clínica | 77,92 (10,26) | 17 (62,96) | 25 (92,59) | 19 (70,37) | 4 (14,81) |
| Grupo 1, n=5 | 78,80 (9,50) | 2 (40) | 5 (100) | 3 (60) | 0 |
| Grupo 2, n=10 | 80,80 (8,01) | 7 (70) | 9 (90) | 8 (80) | 3 (30) |
| Grupo 3, n=13 | 74,15 (11,23) | 8 (61,54) | 11 (84,62) | 8 (61,54) | 1 (7,69) |
| Alta sospecha clínica | 74,06 (8,41) | 12 (29,27) | 23 (50,10) | 15 (36,59) | 7 (17,07) |
| Grupo 4, n=20 | 76,00 (7,30) | 9 (45) | 11 (55) | 6 (30) | 5 (25) |
| Grupo 5, n=6 | 71,00 (10,68) | 2 (33,33) | 4 (66,67) | 2 (33,33) | 0 |
| Grupo 6, n=15 | 75,18 (7,92) | 1 (6,67) | 8 (53,33) | 7 (46,67) | 2 (13,33) |
| Total, n=69 | 75,99 (9,18) | 13 (18,84) | 48 (69,57) | 20 (28,99) | 11 (15,94) |
DLP: dislipemia; DM2: diabetes mellitus tipo 2; HTA: hipertensión arterial; MACE: evento cardiovascular mayor.
En el grupo de baja sospecha clínica (n=28) se encontraron 6 pacientes con ACG (21,43%), a los cuales se llegó al diagnóstico por BAT (n=2), 18F-PET/TC positiva para vasculitis de grandes vasos (n=2) y criterio clínico, debido a su buena respuesta a GC (n=2) (tabla 3). En el grupo de alta sospecha clínica (n=41), el 85,36% presentaron un diagnóstico definitivo de ACG (n=35). Los pacientes con alta sospecha de ACG y otro diagnóstico en el seguimiento se distribuyeron de la siguiente manera: neuropatía óptica isquémica no arterítica (n=1), retinopatía hipertensiva/diabética (n=1), condrocalcinosis (n=1), polimialgia reumática corticorresistente (n=1), cefalea post-COVID (n=1), sepsis (n=1), y ninguno de ellos presentó una EATAx positiva (EATAx indeterminada n=2, EATAx negativa n=4).
Resultados de biopsia, 18F-FDG-PET/TC y diagnóstico de ACG, por grupos
| Edad, años (DE) | Biopsia+ | PET-TC+ | Diagnóstico definitivo ACG | |
|---|---|---|---|---|
| Baja sospecha | ||||
| Grupo 1, n=5 | 78,80 (9,50) | 1 (20%) | 1/3 | 2 |
| Grupo 2, n=10 | 80,80 (8,01) | 1 (10%) | 0/4 | 2 |
| Grupo 3, n=13 | 74,15 (11,23) | 0 | 1/3 | 2 |
| Alta sospecha | ||||
| Grupo 4, n=20 | 76,00 (7,30) | 14 (70%) | 5/14 | 20 |
| Grupo 5, n=6 | 71,00 (10,68) | 3 (50%) | 1/4 | 3 |
| Grupo 6, n=15 | 75,18 (7,92) | 3 (20%) | 7/13 | 12 |
Grupo 1: baja sospecha/eco positiva. Grupo 2: baja sospecha/ecografía indeterminada. Grupo 3: baja sospecha/ecografía negativa. Grupo 4: alta sospecha/ecografía positiva. Grupo 5: alta sospecha/ecografía indeterminada. Grupo 6: alta sospecha/ecografía negativa.
De los pacientes con un diagnóstico definitivo de ACG, pero EATAx negativa o indeterminada (n=18), la BAT fue positiva en 7 pacientes (38,9%). A los pacientes con EATAx negativa o indeterminada y BAT negativa (n=11) se les hizo una 18F-FDG-PET/TC, confirmando la afectación por la presencia de vasculitis de grandes vasos en el 72,73% (n=8).
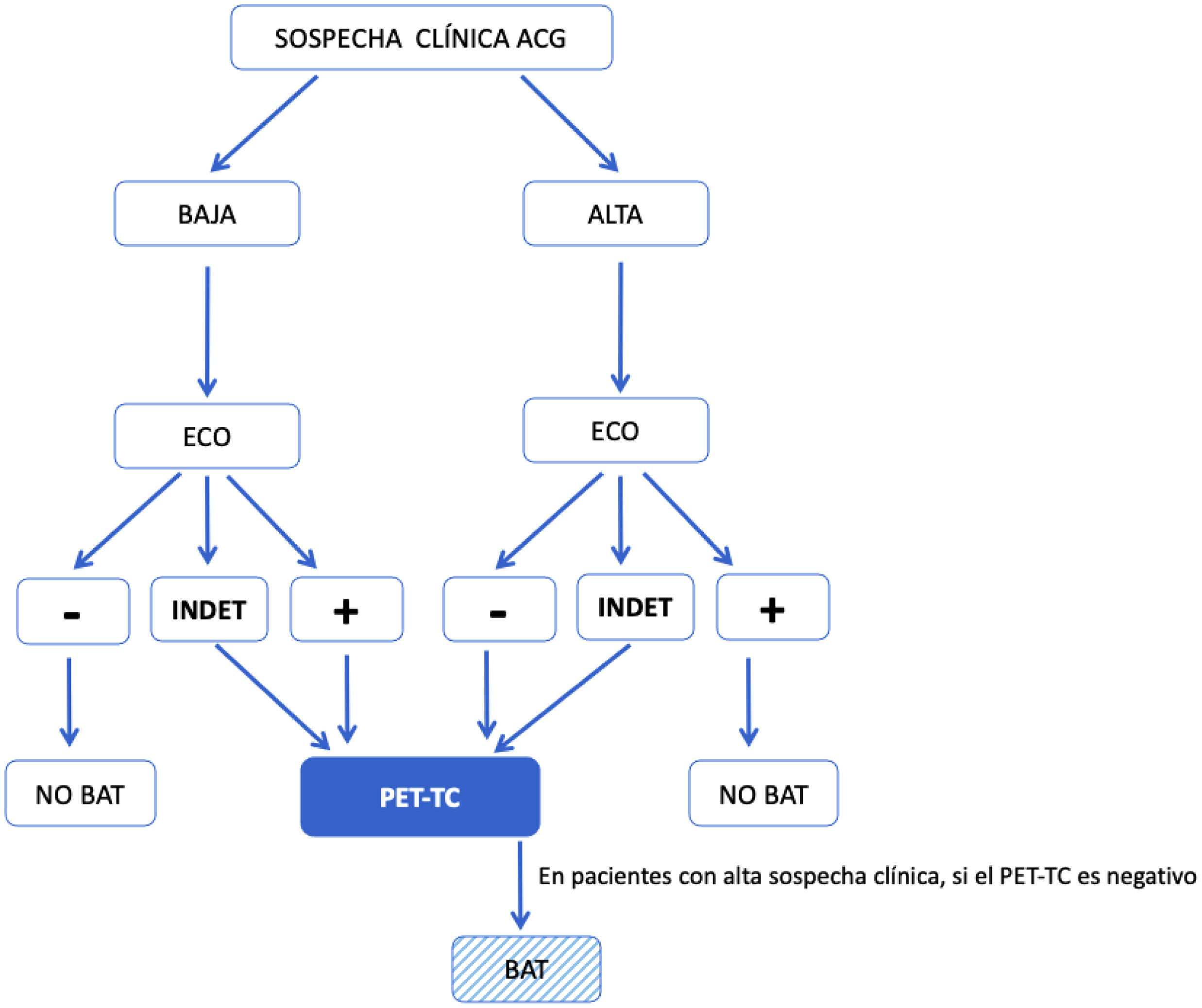
El diseño de nuestro estudio, en el cual incluimos pacientes con baja sospecha clínica y EATAx positiva (grupo1, n=5) y pacientes con alta sospecha clínica y EATAx negativa (grupo6, n=15), obliga a aceptar, a priori, falsos positivos (n=3) y falsos negativos (n=12), respectivamente (tablas 3 y 4). Sin embargo, analizando los resultados, nuestro nuevo algoritmo (fig. 2) presenta, globalmente, una sensibilidad del 77,4% y una especificidad del 90%, con una eficiencia diagnóstica para la EATAx del 72,5% y para la PET-TC del 69,98% (verdaderos positivos +verdaderos negativos /total de pacientes). Al centrarnos en los grupos 3 y 4, que representan una baja sospecha y EATAx negativa (n=13) y alta sospecha y EATAx positiva (n=20), respectivamente, la especificidad de nuestro algoritmo sube al 100% y la sensibilidad sube al 86,36%. De los pacientes con una alta sospecha clínica y una EATAx negativa (n=15), a 13 se les realizó una 18F-FDG-PET/TC, siendo positivo para vasculitis de grandes vasos en 7 casos (53,85%), lo cual llevó a un diagnóstico de ACG, fenotipo extracraneal.
Resultados de sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo en los diferentes escenarios de baja y alta sospecha clínica de ACG
| Sensibilidad | Especificidad | Valor predictivo positivo | Valor predictivo negativo | |
|---|---|---|---|---|
| Baja sospecha clínica | ||||
| Ecografía, n=28 | 33,3%a | 100%a | 40%a | 84,6%a |
| Biopsia, n=28 | 33,3%a | 100%a | 40%a | 84,6%a |
| 18F-PET/TC, n=10 | 40% | 100% | 100% | 62,5% |
| Ecografía+18F-PET/TC, n=10 | 60% | 80% | 75% | 66,7% |
| Ecografía+biopsia+18F-PET/TC, n=10 | 80% | 100% | 100% | 83,3% |
| Alta sospecha clínica | ||||
| Ecografía, n=41 | 57,1%b | 100%b | 100%b | 28,6%b |
| Biopsia, n=41 | 57,1%b | 100%b | 100%b | 28,6%b |
| 18F-PET/TC, n=31 | 50% | 100% | 100% | 27,8% |
| Ecografía+18F-PET/TC, n=31 | 80% | 100% | 100% | 50% |
| Ecografía+biopsia+18F-PET/TC, n=31 | 92,3% | 100% | 100% | 71,4% |
a Todo y que los valores para la sensibilidad (S), la especificidad (E), el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN) son iguales, los pacientes no lo fueron: los positivos para la ecografía (2), 1 se confirmó por BAT y 1 por 18F-FDG-PET/TC; los pacientes que fueron positivos para la BAT (2), 1 tenía ecografía positiva y 1 indeterminada.
Algoritmo modificado propuesto para el diagnóstico de ACG en práctica clínica diaria. Se define como sospecha alta: presencia de cualquiera de las siguientes manifestaciones clínicas: 1)síntomas cefálicos exclusivos (cefalea de instauración reciente, claudicación mandibular o alteraciones visuales); 2)con polimialgia reumática, según criterios EULAR/ACR 2012; 3)síndrome febril inespecífico, una vez descartadas causas infecciosas y siendo negativo el cribado por neoplasias; 4)ictus, sin antecedentes cardiovasculares relevantes ni hallazgos de etiología aterogénica después de estudio dirigido. Sospecha baja: pacientes con sospecha por síntomas distintos a los comentados en el punto anterior (p.ej., cribado de estudio de cefalea, anemia, elevación de los reactantes de fase aguda).
ACG: arteritis de células gigantes; ECO: ecografía de arterias temporales y axilares; INDET: resultado de la ecografía «indeterminado», definido como signo del halo en 1 o 2 o menos de las 8 arterias exploradas; NO BAT: no realizar biopsia de arteria temporal; PET-TC: 18F-FDG-PET/TC; −: resultado negativo; +: resultado positivo.
En la tabla 4 se describe la sensibilidad, la especificidad, el VPP y el VPN de nuestra cohorte. Se compara la EATAx en los diferentes escenarios clínicos; en los pacientes a los que se hizo una PET/TC, se compara la combinación de esta prueba con la EATAx, y finalmente se analizan los resultados aplicando las tres técnicas: ecografía, BAT y PET/TC. La razón de verosimilitud negativa para la EATAx en el diagnóstico de ACG en los pacientes de baja sospecha clínica es del 67%.
En el grupo de baja sospecha clínica no se encontraron diferencias para el VPN entre la EATAx de arterias temporales y axilar y la BAT. El combinar las técnicas de imagen en este grupo, mejoró la sensibilidad para el diagnóstico (33% vs 60%). El VPN fue más bajo, por un falso positivo (fiebre de origen desconocida, con EATAx positiva).
En el grupo de alta sospecha clínica, la EATAx mostró un VPP del 100%, al igual que la BAT o la PET-TC positiva. El combinar técnicas de imagen en este grupo mejoró la sensibilidad para el diagnóstico (57,1% vs 80%), ayudando a detectar aquellos pacientes con una ACG de predominio extracraneal.
Al aplicar el PTPS a nuestra población encontramos que 19 (27,53%) presentaban un LR, 21 (30,43%) un IR y 29 (42,03%) un HR, de los cuales se llega al diagnóstico de ACG en el 4,35% (3), el 17,39% (12) y el 36,23% (25), respectivamente, en cada grupo. Mientras que, con el algoritmo propuesto, se clasificó a 28 (40,58%) en baja sospecha y a 41 (59,42%) en alta sospecha clínica de ACG, diagnosticando de ACG al 8,69% (6) y al 50,72% (35), respectivamente.
DiscusiónLa EATAx Doppler de alta resolución está ampliamente extendida y se considera una herramienta imprescindible en aquellas unidades que atienden pacientes con la sospecha diagnóstica de ACG10. Un resultado favorable permite, según los nuevos criterios ACR/EULAR 2022, clasificar a un paciente con ACG13. Recientemente, Molina-Collada et al.17 describen el primer estudio externo de validación de estos criterios de clasificación para el diagnóstico de pacientes con sospecha de ACG y demuestran un rendimiento adecuado en el respaldo del diagnóstico clínico y mejoría en la precisión diagnóstica en comparación con los criterios de clasificación de la ACG de ACR de 1990. Además, Narváez et al.18 han publicado datos en que los nuevos criterios de clasificación son más sensibles en entornos de la vida real que los antiguos criterios ACR en los diferentes fenotipos clínicos, en donde incluye a pacientes con ACG craneal y extracraneal.
En este trabajo mostramos los resultados tanto de la EATAx como de la BAT para el abordaje diagnóstico inicial y la PET/TC a criterio del médico para ampliar estudio o confirmar la presencia de vasculitis de grandes vasos. Podemos observar que nuestro algoritmo, que parte de la sospecha clínica y el resultado de la EATAx, en una clínica fast track, refuerza la importancia de una EATAx positiva para el diagnóstico de ACG, haciendo énfasis en una interpretación cautelosa y un análisis crítico, recordando los siguientes principios: a)la importancia de tener en cuenta el contexto clínico del paciente6,10,19; b)realizar un recuento del número de arterias afectadas20, y c)por último, la curva de aprendizaje del examinador21-23. En aquellos casos en que la EATAx resulte indeterminada o negativa, se debe extender el estudio a otras pruebas de diagnóstico, como una 18F-FDG-PET/TC o la BAT.
En la misma línea que las recomendaciones EULAR/ACR recientes, que aconsejan el uso de las pruebas de imagen en pacientes con sospecha de ACG10, el algoritmo propuesto, en el contexto de una sospecha alta y una EATAx positiva, la BAT no es imprescindible para confirmar el diagnóstico. En nuestros resultados (tabla 4) vemos que la BAT aporta poco de forma independiente, dado que tanto en el grupo de baja como en el de alta sospecha clínica el VPN y el VPP son idénticos a los de la EATAx (84,6% y 100%, respectivamente), evitando así un procedimiento invasivo con las connotaciones ampliamente conocidas de la BAT, así como la naturaleza segmentaria de la enfermedad, responsable de resultados falsos negativos24, en vez de una prueba en el punto de cuidado del paciente en menos de 24-28horas.
Por otro lado, los síntomas propuestos por nuestro algoritmo original, de alta y baja sospecha clínica, tan solo cumplieron parcialmente el objetivo en el resto de los grupos, y ante la duda de una EATAx indeterminada se debe tratar con glucocorticoides, mientras se llega a confirmar o bien a descartar el diagnóstico, y es aquí donde la 18F-FDG-PET/TC tiene especial interés, pudiendo ser de utilidad en aquellos pacientes, como se ha comentado, con alta sospecha y ecografía negativa o indeterminada.
Moreel et al.25 recientemente han publicado una revisión sistemática y metaanálisis sobre el rendimiento diagnóstico de la combinación de PET/TC, EATAx y resonancia magnética en ACG. Sus resultados avalan que la combinación de EATAx de arterias temporales y de grandes vasos, junto con PET/TC, demuestra una precisión sobresaliente en el diagnóstico de la ACG. La ecográfica de grandes vasos, además de las arterias temporales, y la evaluación PET/TC de las arterias craneales, además de los grandes vasos, aumentaron la sensibilidad (91% frente al 80% para la EATAx [p<0,0001] y 82% frente al 68% para PET/TC [p=0,07], respectivamente), sin disminuir la especificidad. Los autores destacan que la elección entre PET/TC y EATAx depende del contexto, de la experiencia y de la situación clínica y de los recursos hospitalarios.
A pesar que el algoritmo inicial propuesto por el grupo investigador14 no tuvo un mal rendimiento, hemos aprendido y comprobado que, ante datos ecográficos no esperables, tales como baja sospecha y EATAx positiva, o bien alta sospecha y EATAx negativa, se ha de solicitar una PET-TC y valorar la confirmación histopatológica con una BAT, por lo que proponemos el algoritmo diagnóstico de la figura 2.
Sebastian et al.6 publicaron un algoritmo que ha demostrado ser efectivo en la estratificación de las referencias a clínicas fast-track. Este enfoque presenta una sensibilidad, una especificidad, un VPP y un VPN de la EATAx en general y en todas las categorías mucho más altos que los informados hasta la fecha, presentando, en la población total, una sensibilidad del 97%, una especificidad del 97% y una precisión del 97%, respecto a trabajos previos con sensibilidad entre el 81,8 y el 91,6% y especificidad entre el 77 y el 95,83%7,19,22. Al aplicar el PTPS a nuestra población se llega al diagnóstico de ACG en el 4,35% para el grupo de LR, en el 17,39% en el de IR y en el 36,23% en el de HR. Mientras que, con el algoritmo propuesto, se diagnosticó de ACG al 8,69% en el grupo de baja sospecha y al 50,72% en el grupo de alto riesgo. Ambos abordajes, PTPS y el algoritmo propuesto, estratifican a algunos pacientes como claros positivos y descartan a claros negativos, dejando a un número de pacientes con una clínica intermedia (PTPS) o una EATAx indeterminada (algoritmo propuesto) en necesidad de pruebas complementarias y revaloración clínica. Los dominios del PTPS, tales como los demográficos, analíticos y clínicos, en los que cada variable pondera de manera distinta (por ejemplo: ser mujer, de mayor edad y con menor tiempo de evolución de la sintomatología), aumenta la probabilidad del diagnóstico.
Nuestro algoritmo y proyecto de clínica fast track presentado en este estudio prospectivo muestra ciertas fortalezas. Una de ellas es dibujar dos escenarios opuestos de sospecha clínica contrapuestos, con BAT y conducta terapéutica en función de la clínica y resultados de ecografía, en la que puntualmente se incluye una 18F-FDG-PET/TC como prueba complementaria para confirmar o descartar el diagnóstico. En segundo lugar, el trabajo permite escenificar la práctica clínica diaria real, describiendo los diferentes motivos de derivación según el fenotipo clínico de una enfermedad muy heterogénea, y que en casos de afectación exclusiva de grandes vasos era hasta hace muy poco infradiagnosticada. Esto ha permitido evolucionar en el perfil y el algoritmo de diagnóstico con un uso más extendido de la PET/TC. Por último, queremos destacar que se trata de un estudio multicéntrico, representativo de nuestra área geográfica, en el cual los exploradores de EATAx Doppler son expertos acreditados con una muy larga experiencia en la exploración en escala de grises y modo Doppler.
El proyecto asimismo presenta algunas limitaciones, entre ellas la falta de homogeneidad de los 6 diferentes grupos de diagnóstico, factor debido al ser la ACG una patología poco frecuente. Asimismo, este proyecto fue realizado durante la fase crítica de la pandemia por COVID-19, motivo por el cual algunos pacientes con baja sospecha rechazaron participar en el estudio para evitar desplazamientos y la BAT. Para resolver esta limitación se decidió poner un mínimo de 5 por grupo, y luego se continuó como en la práctica clínica habitual.
En una cohorte de baja sospecha clínica recomendamos el uso de la EATAx como suficiente si el resultado es negativo. Si la EATAx es positiva, recomendamos iniciar tratamiento y valorar individualmente cada caso a la hora de solicitar una PET-TC y/o una BAT, decantándonos más por la PET/TC, dada su mayor sensibilidad.
En una cohorte de alta sospecha clínica, el uso de la EATAx y su resultado positivo son suficientes para el diagnóstico de ACG. Teniendo en cuenta que un grupo de pacientes con alta sospecha clínica pueden presentar una EATAx indeterminada o negativa (n=21) y encontrar ACG (n=15), recomendamos el uso de la PET-TC como segunda prueba de imagen, para rescatar diagnósticos de ACG extracraneal.
La BAT siempre nos confirmará el diagnóstico, pero una EATAx dentro del contexto clínico correcto también parece ser suficiente. La PET-TC es útil tanto en baja como en alta sospecha clínica, pero se ha de ser consciente de que, por el coste, la radiación y la posible disponibilidad, en casos de baja sospecha clínica su VPN es moderado (62,5%), y en el caso de alta sospecha lo recomendamos cuando en la EATAx se encuentran pocas1-2 o ninguna arteria afectada.
Como conclusión, queremos destacar que el diseño del algoritmo y su aplicación no va en contra del gold standard clásico de esta enfermedad, como es la BAT. El objetivo final es validar este algoritmo y reforzar el papel de la EATAx Doppler como técnica de imagen poco invasiva, accesible y que permite una amplia evaluación de la actividad de la enfermedad en diferentes vasos con una sensibilidad mejorada y una tasa menor de falsos negativos respecto a la BAT.
El diagnóstico definitivo de ACG precisa de un enfoque integral multidisciplinar con implicación de diferentes especialidades debido a los variados fenotipos de presentación, y en los últimos años debemos reconocer la mejora en las nuevas técnicas de diagnóstico. La combinación de todas ellas (pruebas de imagen, como la EATAx Doppler vascular y la PET/CT), junto con la evaluación clínica, nos ha llevado hoy en día a una mejora en la precisión diagnóstica y a poder iniciar un tratamiento de manera rápida, evitando complicaciones cardiovasculares graves e irreversibles.
Consideraciones éticasEl trabajo descrito se ha llevado a cabo de conformidad con el Código de Ética de la Asociación Médica Mundial, Declaración de Helsinki.
Se obtuvo el consentimiento informado de cada paciente y se realizaron todos los procedimientos éticos.
Se han respetado los derechos de privacidad de los sujetos humanos. Se obtuvo aprobación del Comité Ético de Investigación Clínica (PR313/19; CSI 19/66).
FinanciaciónEste trabajo recibió apoyo financiero de la Societat Catalana de Reumatologia a través de la beca Kern 2018-2019, para proyectos de investigación individual y colaborativa: «Prueba de concepto del algoritmo de aplicación de la ecografía en el diagnóstico de la arteritis de células gigantes», presentado por las Dras. Patricia Moya y Paula Estrada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Societat Catalana de Reumatologia, por otorgar una beca competitiva a PE y PM para realizar este proyecto. Al Departamento de Medicina de la Universidad de Barcelona y la Universidad Autónoma de Barcelona.