Las vacunas son productos biológicos utilizados para conseguir una inmunización activa artificial. Actualmente hay vacunas cada vez más potentes, eficaces y seguras. Se está ampliando la lista de enfermedades prevenibles con vacunas, que, junto a la cada vez mayor población susceptible de ser vacunada, hace previsible que aumenten los productos vacunales en este siglo.
Este artículo pretende ser un breve pero práctico, resumen del concepto y tipos de vacunas, los avances acontecidos en las últimas décadas sobre fundamentos de la respuesta inmunitaria y componentes de las vacunas (destacando el papel de los adyuvantes). Estos conceptos acarrean los criterios de cuándo, cómo vacunar, a quiénes y por qué no hacerlo.
Con la ambición de que este texto sea útil finalizará con un somero repaso al porqué hay personas que rechazan las vacunas.
Vaccines are biological products used to achieve active artificial immunization. Nowadays, vaccines are increasingly powerful, effective and safe. The list of vaccine-preventable diseases is expanding, which together with the increasing population likely to be vaccinated, it is expected that vaccine products will increase this century.
This article is a brief but practical overview of the concept and types of vaccines, advances that have taken place recent decades on the fundamentals of the immune response and vaccine components (including the role of adjuvants). These concepts give rise to the criteria for when and how to vaccinate, to whom and why not to do it.
With the hope that this text is useful, it ends with a brief overview as to why there are people who refuse vaccinations.
En torno a las vacunas confluyen múltiples intereses: sociales, tecnológicos, económicos, supersticiosos junto a un quehacer de muchos sanitarios que probablemente no son conscientes de todo lo que hay detrás del simple acto de «administrar una vacuna».
La primera persona que dejó constancia que no se podía enfermar dos veces por el mismo proceso fue Tucídides, sobre el 430 a.C. en una floreciente Atenas. Su propuesta fue que cuidasen a los enfermos las personas que habían sobrevivido con anterioridad al mismo proceso porque no podrían volver a enfermar de esa misma enfermedad. Debieron pasar unos 22 siglos para que, a finales del xviii, Jenner aplicase la primera vacuna. Fue contra la viruela. Etimológicamene «vacunación» significa inoculación con fluido de «vaca», animal del que provenían las primeras «vacunas», aunque ya hay referencias sobre vacunación antivariólica en China en el siglo xi. En 1979 la OMS declaró erradicada la viruela.
La amplitud del tema no permite su presentación en un solo artículo, por ello, este tendrá su continuación en «Actualización en los calendarios vacunales españoles». Aun así, hay muchos aspectos en los que no entraremos pero sí mencionaremos, por ejemplo, como que actualmente se está investigando su aplicación en la prevención y tratamiento de otras enfermedades no infecciosas: melanomas, cáncer de pulmón, esclerosis múltiple, enfermedad de Alzheimer, etc. Se investigan nuevas formas de administración: intranasales, transcutánea (parches), alimentos transgénicos o bacterias no patógenas que contengan el antígeno inmunizante, hay nuevas estrategias y enfoques. Estos 2 artículos queremos enfocarlos en el conocimiento práctico de nuestro quehacer diario y en el que necesitamos para las dudas que nos muestran nuestros pacientes en las consultas habituales.
Concepto de vacunaUna vacuna es una suspensión de microorganismos vivos atenuados, inactivos, de una de sus partes o de un producto derivado de ellos que se administra para producir una infección similar a la infección natural pero sin peligro para el que la recibe, con el objetivo de producir una respuesta inmunitaria que le proteja frente a ulteriores contactos con el germen del que se le ha vacunado. Si la protección se extiende a personas no vacunadas se habla de inmunidad de grupo o de rebaño.
Respuesta inmunitariaLa inmunidad de los mamíferos consta de 2 ramas:
- 1.
Innata, que es inespecífica.
- 2.
Adquirida, que es específica o adaptativa y evolutivamente más tardía. De ella depende la memoria inmunológica. Comprende:
- a.
Inmunidad celular (linfocitosT).
- b.
Inmunidad humoral (linfocitos B y los anticuerpos).
- a.
La innata corre a cargo de los macrófagos, neutrófilos, células natural killer, dendríticas y diferentes citoquinas, interferones, quemocinas, proteína C reactiva y complemento. Reconoce a antígenos inespecíficos. Se activa en minutos-horas después de tener contacto con la infección, tiempo imprescindible para que la inmunidad adquirida ejerza su acción efectora1.
La inmunidad adquirida reconoce estructuras moleculares comunes a muchos microorganismos, denominados patrones moleculares asociados a los patógenos (PAMS), que no se encuentran en las células humanas1.
Los receptores tolls like (TLR) reconocen a los PAMS2. Actualmente se conocen 12 TLR3 anclados en la superficie de las células presentadoras de antígenos (CPA) o en sus fagolisosomas. Los TLR al unirse al PAMS desencadenan una cascada de reacciones que concluyen en la activación celular con síntesis y liberación de linfocinas que destruirán al patógeno por un lado y por otro estimularán la célula T hacia el desarrollo de una respuesta CD4+ T helper (Th1) o CD8+ linfocitos citotóxicos. En resumen, los TLR reconocen al patógeno y regulan la respuesta efectora adaptativa.
Sin especificidad y sin memoria inmunológica no habría vacunas4. La especificidad descansa en el reconocimiento antigénico que se realiza a través de receptores específicos de la célula T (TCR) o por las inmunoglobulinas de superficie de las células B, de las cuales existen miles de millones1. Las CPA son el nexo de unión entre la inmunidad innata y la adquirida, las más importantes son las células dendríticas, también son CPA los macrófagos y las células B activadas. Cada célula dendrítica expresa distintos receptores y procesa el antígeno de forma diferente, dando lugar a diferentes respuestas adaptativas. Sin profundizar más en este apasionante y complejo terreno sí cabe añadir que hay una regulación recíproca entre las respuestas Th1 y Th2 por medio de interleucinas que estimulan o inhiben respuestas de la otra vía. El tipo de respuesta la determina la naturaleza del antígeno y depende en último término de qué CPA y qué TRL van a intervenir en su reconocimiento y presentación4.
Las respuesta Th1 activará linfocitos citotóxicos que defenderán de microorganismos intracelulares (malaria, virus, etc.), será esta vía la que deberá activar una vacuna encaminada a la defensa de estos gérmenes. Sin embargo, si se busca una vacuna para virus o toxinas circulantes (difteria, tétanos, enterovirus, etc.) lo que se deberá activar es una respuesta Th2 (respuesta humoral).
En otros casos será la interacción de ambas vías la que conduzca a la defensa; como en la primovacunación frente a varicela en la que por una parte hay correlación entre los títulos de anticuerpos y el grado de protección y, por otra, aunque estos anticuerpos en muchos individuos se pierden con el tiempo, estas personas no adquieren la enfermedad al entrar en contacto con el virus ya que se generó inmunidad celular.
No se conoce con exactitud cómo se genera la memoria inmunológica.
La idea más convencional es la diferenciación lineal, esto es, que un estímulo antigénico producirá células efectoras, algunas de las cuales se diferenciarán en células de memoria. Se ha propuesto que el balance entre células efectoras y de memoria depende del nivel de estimulación antigénica: altas dosis de antígeno inducen formación de células efectoras a corto plazo; dosis más bajas producen memoria inmunitaria y muy altas dosis producen tolerancia. Por tanto, la cantidad de antígeno administrada en la vacuna es crucial.
Otra cuestión es si la población de células de memoria que se forma tras la primera exposición al antígeno permanece estable durante mucho tiempo sin estímulos antigénicos repetidos. Las células de memoria CD4+ y CD8+ pueden mantenerse durante mucho tiempo sin estímulo antigénico5.
Un caso concreto es la respuesta a los polisacáridos que forman cápsulas en bacterias comunes (neumococos, Haemophilus influenzae tipo B [Hib], Neisseria, etc.) que estimulan a la célula B sin intervención de la T (antígenos independientes de la célula T), por lo tanto no se generan células de memoria y no habrá respuestas secundarias de anticuerpos con dosis de recuerdo. Además los antígenos polisacáridos son poco inmunógenos en menores de 18 meses debido a su incapacidad de segregar IgG2 (inmunoglobulina que vehiculiza a los anticuerpos frente a aquellos antígenos). Por ello se han conjugado los antígenos polisacáridos con diferentes proteínas (toxoide tetánico, diftérico, etc.). Así, un antígeno independiente de la célula T pasa a ser T dependiente, genera memoria y serán útiles las vacunas de refuerzo.
Este es el fundamento de las vacunas frente al Hib y al neumococo.
Tipos de vacunas- 1.
Con agente infeccioso completo:
- •
Vivas atenuadas. Las más exigentes en transporte, conservación e indicaciones.
- •
Inactivadas.
- •
- 2.
De subunidades (parte del agente infeccioso).
- 3.
Constituidas por un producto extracelular del agente infeccioso (toxoide).
- 1.
Antígeno inmunizante.
- 2.
Líquido de suspensión (solución destilada). Pueden contener trazas de proteínas de los cultivos (huevo).
- 3.
Preservantes, estabilizantes y antibióticos. Impiden el crecimiento bacteriano y la depravación de la vacuna. Son los más directamente implicados en las reacciones tóxicas o alérgicas. Como ejemplos:
- •
Los mercuriales (timerosal): usado desde 1928 como antiséptico y antifúngico. Desde 1990 en desuso siguiendo el principio de precaución, no hay evidencias científicas que avalen su relación con daño cerebral o con el autismo. Actualmente, siguiendo recomendaciones de la OMS, por razones logísticas, se sigue usando en envases multidosis. En los países desarrollados las vacunas infantiles están libres de esta sustancia6.
- •
Gelatina: causa reacciones alérgicas en 0,5-2 por millón de dosis, probablemente, es la responsable de la mayoría de los casos de alergia atribuida a la primovacunación de triple vírica. La sensibilización se produciría por las vacunas previas difteria-tétanos-tos ferina acelular (DTPa) que también lo contienen.
- •
Antibióticos, polisorbato, glicina, albúmina, etc.
- •
- 4.
Adyuvante7,8: es cualquier sustancia que incorporada a una vacuna acelera, prolonga o potencia la respuesta inmunológica frente a la misma.
Las vacunas actuales, por motivos de seguridad, están altamente purificadas, lo que las hace menos inmunógenas. Los adyuvantes solventan este déficit además de permitir usarlas en personas con inmunidad disminuida, necesitando mucha menos cantidad de antígeno por vacuna y menor número de dosis.
Su mecanismo de acción es básicamente por efecto «depot»: facilita el acceso del antígeno a la CPA y potencia la respuesta inmunitaria.
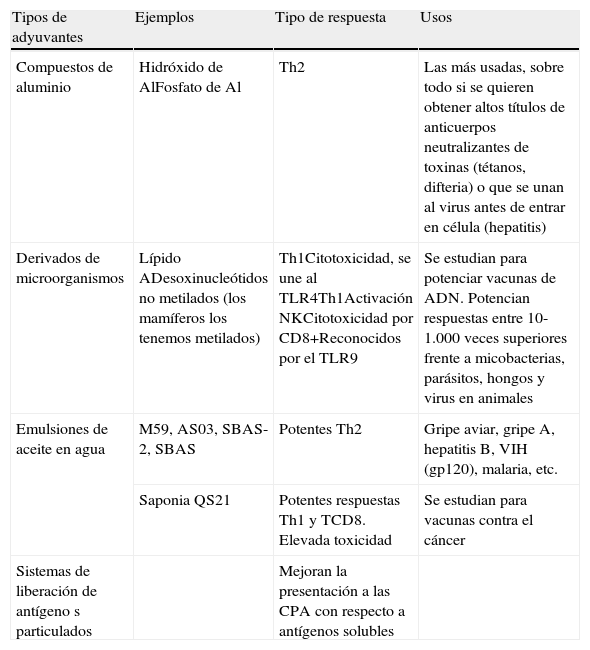
El primero fue el desarrollado por Freund hace más de 5 décadas. Actualmente hay varios grupos y diversas clasificaciones, los más usados o estudiados se recogen en la tabla 1. Incluso alguna citocina se ha usado como adyuvante y están en estudio los interferones para vacunas HB en no respondedores. Se estudian combinaciones de adyuvantes, de estos, el más prometedor es el AS04.
Tipos de adyuvantes
| Tipos de adyuvantes | Ejemplos | Tipo de respuesta | Usos |
| Compuestos de aluminio | Hidróxido de AlFosfato de Al | Th2 | Las más usadas, sobre todo si se quieren obtener altos títulos de anticuerpos neutralizantes de toxinas (tétanos, difteria) o que se unan al virus antes de entrar en célula (hepatitis) |
| Derivados de microorganismos | Lípido ADesoxinucleótidos no metilados (los mamíferos los tenemos metilados) | Th1Citotoxicidad, se une al TLR4Th1Activación NKCitotoxicidad por CD8+Reconocidos por el TLR9 | Se estudian para potenciar vacunas de ADN. Potencian respuestas entre 10-1.000 veces superiores frente a micobacterias, parásitos, hongos y virus en animales |
| Emulsiones de aceite en agua | M59, AS03, SBAS-2, SBAS | Potentes Th2 | Gripe aviar, gripe A, hepatitis B, VIH (gp120), malaria, etc. |
| Saponia QS21 | Potentes respuestas Th1 y TCD8. Elevada toxicidad | Se estudian para vacunas contra el cáncer | |
| Sistemas de liberación de antígeno s particulados | Mejoran la presentación a las CPA con respecto a antígenos solubles |
El más usado es el monofosforil lípido A que es el menos tóxico.
Complejos inmunoestimulatorios. Micro y nanopartículas a modo de jaulas que contienen antígenos, colesterol y saponinas. Se funden con las membranas celulares y libera antígeno en el interior celular. Usados en vacunas gripales.
Liposomas, virosomas y partículas virus-like. Encapsulan antígenos. Se unen a los receptores virales. Producen respuestas citotóxicas con presentación simultánea a CPAs, vía los HLA clase I (ADN) y los HLA clase II (proteínas). Usadas en vacunas antigripales para ancianos y contra papilomavirus.
La edad de primovacunación depende de la capacidad de responder al antígeno y de las interferencias con los anticuerpos transferidos desde la madre in utero. Los anticuerpos maternos no interfieren con toxoides ni con vacunas de microorganismos muertos9. Por ello la triple vírica: sarampión-rubéola-paperas (SRP) y la varicela no se administran, como mínimo, hasta los 12 meses. Los casos de varicela son más frecuentes cuando se administra la vacuna a los 12 que a los 15 meses10. Hijos de madres que padecieron el sarampión natural tienen anticuerpos hasta los 10-12 meses, en los de las mujeres vacunadas ya no se detectan a los 6 meses11. Si la madre no ha presentado la enfermedad ni ha sido vacunada el neonato será susceptible desde el nacimiento. Consecuencia de ello fue el brote de sarampión (177 casos), acaecido en la comunidad de Madrid en 2006-2007, controlado cuando se vacunó entre los 6-11 meses de edad.
La edad mínima recomendada de las vacunas frente a difteria, tétanos, tos ferina, polio y Hib es 6 semanas, normalmente se administran a los 2 meses9.
ContraindicacionesSon excepcionales:
- •
Anafilaxia a un componente de la vacuna con anterioridad.
- •
Pacientes inmunodeprimidos o convivientes tienen contraindicadas las vacunas de virus vivos atenuados (VIH: si se puede vacunar de triple vírica si los CD4 son mayores del 15%, y de varicela con un porcentaje mayor del 25%).
- •
Las embarazadas no deberían ser vacunadas con virus vivos atenuados, sí se podrían vacunar de fiebre amarilla si van a estar en zona endémica. No está indicada la interrupción del embarazo si la mujer inadvertidamente se ha vacunado de rubéola o varicela, no se han constatado fetopatías. Se recomienda un intervalo de 4 semanas entre vacuna de virus vivos atenuados y embarazo.
- •
Rango de edad fuera de lo establecido.
- •
Encefalopatía debida a causa no identificable en los 7 días siguientes a la vacuna frente a tos ferina.
- •
Vacunas inactivadas en sujetos con inmunodeficiencias.
- •
Encefalopatía progresiva hasta que el trastorno se haya estabilizado.
- •
Enfermedad: infecciosa grave (no las leves), leucemias, trasplantes, tratamientos inmunodepresores, diátesis hemorrágica.
- •
La triple vírica puede negativizar el Mantoux si se realiza las 4-6 semanas después de administrar la vacuna. Se realizará el mismo día o tras ese intervalo12.
- •
Los prematuros son vacunados según su edad cronológica. Excepto los menores de 2.000 g en los que se espera hasta que tengan ese peso o un mes de edad. Si la madre es AgHBs positiva se procede igual que un niño a término (administración de inmunoglobulina hiperinmunitario y vacuna frente a hepatitis B [HB]), esa vacuna no será contabilizada13.
- •
Se pueden administrar vacunas mientras se están tomando antibióticos, excepto en vacuna frente a la tifoidea que se espera 48 h de la última dosis.
- •
La administración de inmunoglobulinas, gammaglobulinas y productos sanguíneos pueden interferir con algunas vacunas, deberá tenerse en cuenta la dosis y el tipo de producto y esperar un intervalo de tiempo antes de vacunar. No interfieren los concentrados de hematíes ni el palivizumab (anticuerpo monoclonal administrado a prematuros para prevenir infección por virus sincitial respiratorio).
- •
Corticoides: si la dosis de prednisona o su equivalente es superior a 20mg/día o a 2mg/kg/día durante 14 días o más se debe esperar un mes a administrar una vacuna (No interfieren corticoides inhalados, ni en cremas, ni dosis menores).
Las vacunas que llevan adyuvantes deben administrarse por vía intramuscular en un ángulo de 90° (excepto triple vírica, varicela, zóster y vacuna polisacárida de meningococo, que serán subcutáneas, a 45°) No se deben usar los músculos de la nalga porque existe la posibilidad de lesionar el nervio ciático y porque se ha demostrado una menor inmunogenicidad de la HB.
La administración de vacunas con agujas de calibre ancho (calibre 23 de 0,6mm) y largas (25mm) reducen la reactogenicidad en comparación con las más cortas, sin afectar a su inmunogenicidad14.
Para una respuesta adecuada, la mayoría de las vacunas requieren más de una dosis. Vacunas distintas se pueden administrar en la misma visita, cualquiera que sea su composición; las tasas de seroconversión y reactogenicidad no son diferentes a hacerlo por separado. Si son varias las vacunas y no se hace en el mismo acto se pueden administrar con cualquier intervalo, excepto si se administran 2 vacunas con virus vivos que deberá esperarse 4 semanas entre ambas. El alargamiento del intervalo entre 2 dosis de la misma vacuna no disminuye la eficacia9 (dosis administrada, dosis válida). Las dosis administradas demasiado cercanas en el tiempo o en una edad demasiado temprana pudieran llevar a una respuesta inmunitaria subóptima. En la primovacunación durante el primer año de vida el intervalo entre dosis será al menos de 4 semanas. Si la segunda dosis se administra en los 4 días previos a la finalización del intervalo será válida, si se administró 5 días o más no lo será.
Se recomienda que las 3 dosis de primovacunación de DTPa se hagan con la vacuna de un mismo fabricante. Las vacunas frente a Hib, HB, hepatitis A (HA), DTP se pueden intercambiar entre fabricantes15. La escasez de vacunas no debe dar lugar a retraso en la vacunación9.
Cada vez se postula más «la disminución del dolor de la inyección», para ello se ha propuesto: introducción rápida de la aguja, sin aspiración y retirada rápida; método del camino en Z (traccionar la piel y tejido subcutáneo –inyectar–, soltar la piel una vez retirada la aguja); mantener al niño envuelto y abrazado; distraerle; administrar sacarosa al 15-20%, 2 min antes de la inyección (menores de 3 meses); mamar mientras se le administra.
Es frecuente utilizar paracetamol tras la vacunación, hasta se preconiza darlo antes de la misma. Sin embargo, un estudio reciente16, ha demostrado que la administración profiláctica de paracetamol después de la vacunación disminuye la inmunogenicidad a varios antígenos vacunales tanto en primovacunación como en refuerzo, más evidente en vacunas conjugadas y de toxoides (¿Disminución de señales inflamatorias en el sitio de la inyección?).
Realidades, miedos y prejuiciosEn el marco de la salud pública, en términos coste-efectividad, la potabilización del agua y las vacunas son las medidas de mayor impacto en lo referente a prevención de enfermedades infecciosas, de hecho han cambiado la situación sanitaria mundial.
Se han extendido falsos conceptos17,18: sobrestimar el dolor que causa su administración, creer que disminuyen la inmunidad, que en la composición entran sustancias tóxicas o que su principal interés es el económico pero el más trascendente es el que pudieran ser causa de enfermedad. Las vacunas, rara vez, pueden tener efectos secundarios, que han sido usados como «generalización» por los grupos antivacuna. A continuación enumeramos someramente algunos de los falsos mitos más extendidos esgrimidos por los grupos antivacuna y los de mayor divulgación donde se originaron; también expondremos los porcentajes reales de los efectos secundarios evidenciados8,12,19:
- •
Autismo y enfermedad inflamatoria intestinal. Fueron relacionadas con la administración de la triple vírica. Wakefield y colaboradores en 1998 describieron en 8 de 12 niños ingresados por manifestaciones intestinales e hiperplasia intestinal linfoide y trastornos del espectro autista, cuadro que se puso de manifiesto poco después de recibir la vacuna. Ha habido múltiples estudios posteriores con cientos de miles de niños incluidos que fueron seguidos tras la vacuna con triple vírica y no se ha encontrado relación ni con la enfermedad intestinal ni con el autismo.
Las vacunas antitos ferina y antirrubeólica también han sido incriminadas en el autismo, sin encontrarse estadísticamente esa relación.
Las que contienen timerosal, además de relacionarlas con el autismo, se han tratado de vincular con trastornos del desarrollo neuropsíquico (hiperactividad, inatención, retrasos del lenguaje). El timerosal se metaboliza a etilmercurio, al cual no se le conoce papel de neurotoxina, la cantidad final de mercurio que se detecta es mínima. Sin embargo, en la contaminación ambiental lo que se encuentra es metilmercurio (dañino para cerebro y riñón).
- •
Enfermedades desmielinizantes del SNC. Su relación con la vacuna de la HB surge en Francia en 1994 (en 1998 en la propia Francia se constató una menor incidencia en los vacunados que en los no vacunados).
- •
Tras la implantación de la vacuna universal no ha cambiado la epidemiología de las enfermedades desmielinizantes.
- •
Encefalopatía permanente. En 1994 en Gran Bretaña se relacionó la DTPe (difteria-tétanos-tos ferina de células enteras) con 1/330.000 dosis en los 7 días siguientes a su administración. Actualmente hay imposibilidad deontológica de reproducir el único estudio sobre ello porque se usa la forma acelular de la vacuna (DTPa).
- •
Síndrome de Guillain-Barré. Se puede admitir una asociación causal entre administración de determinados lotes de vacunas antigripales y dicho síndrome. Su presentación con otras vacunas (tétanos, triple vírica y anti-HB) son coincidencias.
- •
Otras enfermedades autoinmunes. Esclerosis múltiple, diabetes mellitus tipo 1, lupus eritematoso, artritis reumatoide, se relacionaban con la vacuna HB pero no se ha demostrado.
- •
Muerte súbita del lactante. En 2003 en Europa se declararon 5 casos en las 24 h siguientes a la administración de vacunas combinadas hexavalente (difteria, tétanos, tos ferina acelular, vacuna polio intramuscular, HB, Hib). En mayo de 2003, la Agencia Europea del Medicamento no recomienda ningún cambio. Hay millones de dosis administradas desde entonces, no se han corroborado esas 5 muertes por esa causa.
- •
Diabetes mellitus tipo 1. Relacionada por neozelandeses con las vacunas frente al Hib y la HB basándose en estudios con animales. No se ha demostrado nada similar en el hombre.
- •
Enfermedades atópicas, sobre todo asma. Según la hipótesis de la higiene han aumentado por la falta de estímulos antigénicos inducidos por el no padecimiento de enfermedades infecciosas en la infancia. Las vacunas implicadas incluyen difteria-tétanos-tos ferina de células enteras, triple vírica, vacuna polio oral, HB y antigripales, junto al papel de los coadyuvantes en su respuesta mediadora Th2. Sin embargo, esta hipótesis no está corroborada y el aumento de las enfermedades atópicas empezó antes del uso sistematizado de las vacunas. Autores finlandeses han documentado20 mayor carga de enfermedad atópica entre niños que han pasado sarampión que entre vacunados.
- •
Cáncer. En 1961 se detectó el virus SV40 en lotes vacunales antipolio y a pesar de los controles se volvió a detectar 2 años después y en 1980 en vacunas antihepatitis A. Este virus ha sido relacionado con neoplasias cerebrales, mesoteliomas, ostosarcomas y linfomas no hodgkinianos. Los estudios epidemiológicos no han registrado diferencias significativas, el Immunization Safety Review Committee de Estados Unidos está permanentemente revisando estos temas.
- •
Sistemas de inmunización. Los grupos antivacunas también arguyen que las vacunas producen sobrecarga y deterioro de los sistemas de inmunización. Frente a esto está el hecho que se calcula que el organismo del lactante sano puede desarrollar anticuerpos efectivos frente a 10.000 antígenos en todo momento. Un lactante vacunado en los años 1980 recibía unos 3.000 antígenos, en la actualidad reciben por vía vacunal un máximo de 160.
- •
Transmisión vacunal de virus o partículas virales. Se ha desmentido que vacunas como polio oral, triple vírica o antifiebre amarilla puedan transmitir virus (en algunos lotes de esta última se han detectado retrovirus aviares, en las otras no hay datos para tal especulación). En 2001 se abandonó el uso de productos potencialmente contaminables por priones causantes de la enfermedad de Creutzfeldt-Jakob, no hay asociación causal.
- •
Se ha sugerido, no demostrado, que las vacunas de la polio usadas en la década de 1950 podían ser las causantes de las primeras infecciones por VIH. El origen de esta especulación se encuentra en que en aquella época hubo vacunas antipolio cultivadas en tejido de chimpancé que se probaron en África y en chimpancés africanos se aisló el SVICPZ (Simian inmunodeficency virus aislados en chimpancé), la coincidencia es con que los primeros casos de inmunodeficiencia humana también fueron originarios de África. Se estudia la relación entre SVICPZ y VIH (no entre SVICPZ y virus vacunales antipolio)12,21.
- •
Se han postulado otras relaciones, en estudio y seguimiento. Meningitis con parotiditis y vacuna polio oral; polio paralítica en contactos con vacunados con VPO (el riesgo se estima en 1 por 2,4 millones de dosis, por ello se está cambiando a vacunar con polio inactivada intramuscular); trastornos sensoriales y esterilidad con sarampión y parotiditis; trombocitopenia con sarampión, parotiditis, polio inactivada y anti-Hib.
Sí que hay evidencia, con los datos de Vaccine Adverse Event Reporting System que puede haber reacción alérgica grave para triple vírica en 1,8 casos/millón de dosis; HB en 1,67casos/millón de dosis; difteria-tétanos-tos ferina en 21 casos/millón de dosis; y varicela en 3 casos/millón de dosis.
Entre las reacciones neurológicas se encuentran:
- •
Encefalitis. Difteria-tétanos-tos ferina de células enteras y sarampión, un caso por millón de dosis; parotiditis 0,4/millón.
- •
Convulsiones. Difteria-tétanos-tos ferina acelular 0,7-2 casos por 1.000 vacunados, con triple vírica es de 0,3.
- •
Hipotonía y disminución de la conciencia en las primeras 10 h. DT 0,04 casos por 1.000 vacunados; difteria-tétanos-tos ferina acelular 0,026/1.000; con toxoide tétanico difteria tipo adulto y HB la incidencia es de 0,014/1.000; polio inactivada 0,007/1.000.
- •
Polineuropatía. Sobre todo en inmunodeprimidos y con vacunas de virus vivos.
- •
Síntoma de llanto e irritabilidad en menores de 6 meses y en las primeras horas. Con remisión espontánea, de 0,004-0,06/1.000 vacunados.
Las vacunas son productos biológicos sintéticos diseñados para la prevención de enfermedades infecciosas, ampliándose el espectro a enfermedades hasta ahora no evitables (malaria, VIH, caries, etc.).
El estudio de la inmunidad, junto a la universalización de la administración de vacunas, ha logrado la erradicación de enfermedades infecciosas y tasas de morbimorbilidad impensables hace solo unas décadas. Las actuales promociones de médicos residentes puede que sean las últimas en ver varicela en nuestro entorno.
No debemos infravalorar nuestra responsabilidad en conseguir una cobertura vacunal universal ni ignorar la importancia de la administración de una «simple vacuna».
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.