Se presenta una revisión de los principales aspectos derivados del estudio de la frecuencia de los defectos congénitos, explicando la importancia y utilidad de ese conocimiento, e ilustrándola con diversos ejemplos basados en el análisis de los datos del Estudio Colaborativo Español de Malformaciones Congénitas (ECEMC). De dicho análisis se deduce que la frecuencia global de recién nacidos con defectos congénitos en España ha venido disminuyendo a lo largo del tiempo para muchos defectos. Ese descenso es consecuencia, fundamentalmente, del impacto de las interrupciones voluntarias del embarazo (IVE) tras la detección de alteraciones en el feto. No obstante, otros factores, como el mejor cuidado de los embarazos, la planificación de los mismos, y el aumento de la cultura sanitaria de la población, podrían estar teniendo algún efecto, aunque mucho menos patente que el derivado de la realización de IVE. Esa disminución de la frecuencia no ha sido uniforme en todas las CC.AA. Por otra parte, hay ciertos defectos para los que se ha registrado un incremento secular, derivado de la mejora y uso generalizado de las técnicas diagnósticas, tanto prenatales como postnatales. Por otra parte, se ha observado que la diversificación étnica en nuestro país, resultante de la inmigración, está teniendo también cierto impacto sobre la frecuencia de recién nacidos con defectos congénitos en España. Esos grupos de población minoritarios, en general, junto con diferencias en las frecuencias de ciertas mutaciones de genes recesivos, tienen unas condiciones socio-sanitarias que determinan un mayor riesgo para defectos congénitos. Todos estos aspectos son importantes y han de ser tenidos en cuenta a la hora de diseñar los planes de prevención de estas patologías.
A review is presented of the main aspects arising from the study of the frequency of congenital defects, explaining the importance and use of this knowledge, and illustrating it with different examples based on the analysis of data from the ECEMC (Estudio Colaborativo Español de Malformaciones Congénitas) (Spanish Collaborative Study of Congenital Malformations). From this analysis it was observed that the overall frequency of newborns with congenital defects in Spain has been decreasing gradually for many defects. This drop is mainly a result of voluntary termination of pregnancy (TOP) after the detection of foetal abnormalities. However, other factors, such as the improved care of pregnant women and pregnancy planning, plus the increase in the health culture of the population, could also be having some effect, although a lot less obvious than that due to TOP. This decrease in frequency has not been uniform in all the Autonomous Communities. On the other hand, there are certain defects that have shown a secular increase, arising from the improvement and general use of both prenatal and post-natal diagnostic techniques. Furthermore, it has been observed that the ethnical diversification in our country, resulting from immigration, is also having a certain impact on the frequency of newborns with congenital abnormalities in Spain. These minority population groups, in general, along with the differences in the frequency of certain recessive gene mutations, have socio-health conditions that lead to a higher risk of congenital defects. All these aspects are important and have to be taken into account when designing prevention plans for these diseases.
La frecuencia global de defectos congénitos (DC) se sitúa, en todos los países y grupos humanos, entre el 2 y el 3% en el momento del nacimiento. Sin embargo, algunos DC son difícilmente detectables en los recién nacidos, por lo que si se amplía el período de observación a los primeros años de vida, esa cifra se eleva hasta el 6–7%, al incluir los defectos de aparición evolutiva, como los funcionales e intelectuales. Sin embargo, la gran mayoría de los DC, individualmente, cumplen la definición de enfermedad rara (ER), entendiendo como tal cualquier patología cuya frecuencia es inferior a 5 casos por cada 10.000 individuos1. Esa baja frecuencia determina, por una parte, que muchos de ellos sean difíciles de reconocer y de diagnosticar, especialmente los cuadros clínicos constituidos por múltiples DC. En este sentido, es en la consulta de atención primaria donde se van a poder detectar muchos de los síndromes y DC evolutivos, lo cual pone de manifiesto el papel fundamental de esos profesionales sanitarios. Por otra parte, el hecho de que muchos DC sean poco frecuentes hace que también sea difícil encontrar especialistas con experiencia en su manejo.
Para ofrecer una idea acerca de la importancia cuantitativa y cualitativa de estas patologías, baste mencionar la estimación de que cada año nacen 7,9 millones de niños con DC graves en todo el mundo, y 3,3 millones mueren también anualmente antes de cumplir los 5 años2. Además, por la discapacidad que conllevan muchos de ellos, las personas afectadas pueden requerir tratamientos crónicos y ser dependientes de por vida. Por tanto, sin entrar a valorar los costes personales y económicos, simplemente atendiendo a la elevada morbilidad y mortalidad que se asocian a los DC, está clara su importancia socio-sanitaria.
¿Por qué es importante conocer la frecuencia de los defectos congénitos?La frecuencia con la que se producen los distintos DC no es exactamente igual en todas las poblaciones, ni constante a lo largo del tiempo, ya que está influida por multitud de factores genéticos y ambientales, que pueden variar de unas áreas a otras, y según los períodos. Ello significa que es obligado efectuar una estimación de la frecuencia de los DC en cada población y momento. La principal utilidad de conocer la frecuencia es que permite cuantificar su impacto en cada área, y a partir de esa cuantificación, es posible:
- a)
Planificar y distribuir adecuadamente los recursos disponibles para la atención a los pacientes afectados y sus familias.
- b)
Establecer prioridades asistenciales en base a los recursos disponibles y las necesidades, tratando de ajustar esos recursos a estas últimas.
- c)
Diseñar y poner en marcha campañas formativas (para los profesionales sanitarios), informativas (para los profesionales y para la población general) y preventivas en lo que respecta a los DC. Esas campañas han de estar adaptadas a la frecuencia de los distintos DC y a sus condicionantes locales. Por ejemplo, si en un área determinada la población es muy endogámica, debe diseñarse un plan informativo a la población acerca de los riesgos que comportan las uniones consanguíneas, y un plan preventivo para la identificación de familias con mayor riesgo y para la detección de portadores de genes relacionados con determinadas patologías.
- d)
Estimar el riesgo individual de cualquier miembro de una población, a partir de la frecuencia poblacional correspondiente. Por ejemplo, si se desea conocer el riesgo de anotia/microtia en la población española, o se intenta proveer de servicios adecuados para la atención de los casos con este defecto, han de consultarse los datos correspondientes a nuestra población, en la que el defecto se produce en 18 casos por cada 100.000 nacimientos3, y no los de otra. Por ejemplo, si se consultaran los datos de Sudamérica4 (40 casos por cada 100.000 nacimientos), la conclusión sería que el riesgo para este defecto es más de 2 veces superior al real en España, lo que podría conllevar una planificación inadecuada de los recursos asistenciales. En el «Boletín del ECEMC», accesible a través de Internet, se pueden encontrar las frecuencias de un número considerable de DC (http://www.ciberer.es/documentos/ECEMC_2009_AF.PDF).
- e)
Establecer sistemas de vigilancia (tanto temporal como geográfica) de la frecuencia de los DC, para tratar de detectar precozmente variaciones inusuales de la misma.
Mediante la vigilancia epidemiológica de la frecuencia de los DC se pretende evitar una tragedia similar a la acaecida a principios de los años 60 del pasado siglo, cuando en todo el mundo nacieron entre 8.000 y 10.000 niños con defectos por reducción de extremidades y otros DC, como consecuencia de la exposición prenatal a un fármaco, la Talidomida, utilizado como antiemético5.
En un sistema de vigilancia epidemiológica sobre DC, la hipótesis de trabajo establece que si se conoce la frecuencia de estas patologías y sus variaciones normales, cualquier variación anormal que se detecte debe ser considerada como indicio de un cambio en los agentes o factores causales de los DC en un determinado momento y lugar. Así pues, como en cualquier otro sistema de vigilancia, lo que se pretende es detectar precozmente las variaciones anormales de la frecuencia para poner en marcha la investigación causal y prevenir el mayor número de casos.
La tragedia de la Talidomida hizo que surgieran diversas iniciativas en varios países de todo el mundo, encaminadas a vigilar la frecuencia de los DC. Entre ellos se encuentra España, donde se creó el ECEMC en 1976. El programa del ECEMC ha hecho posible el conocimiento de las cifras de frecuencia al nacimiento de los distintos DC en nuestro medio, su evolución a lo largo del tiempo y su distribución por CC.AA. Dentro del marco internacional, el ECEMC forma parte del International Clearinghouse for Birth Defects Surveillance and Research (ICBDSR)4 y el European Surveillance of Congenital Anomalies (EUROCAT)6, organismos que dedican gran parte de su trabajo a la vigilancia comparativa de las frecuencias de los DC en los diversos países que los integran.
El ECEMC está basado en un sistema permanente de registro de recién nacidos con DC (casos) y recién nacidos sanos (controles), con base hospitalaria. Está organizado como una red, en la que participan más de 370 pediatras y otros especialistas de hospitales de toda España7, que constituyen el Grupo Periférico del ECEMC, y que junto con un Grupo Coordinador del mismo, componen un equipo multidisciplinar estrechamente relacionado. El Grupo Coordinador desarrolla su actividad en el Centro de Investigación sobre Anomalías Congénitas (CIAC) del Instituto de Salud Carlos III, en Madrid. La investigación se lleva a cabo con 4 enfoques principales: clínico, genético y citogenético, epidemiológico y teratológico. A lo largo de su extensa trayectoria desde 1976, ha controlado un total de 2.607.113 nacimientos, procedentes de 146 hospitales ubicados en las 17 CC.AA. españolas y el Principado de Andorra. La cobertura total del registro (según los datos definitivos del año 2007 publicados por el Instituto Nacional de Estadística) es del 21,55% de los nacimientos nacionales. Entre el total de recién nacidos controlados, se detectaron DC en 39.902, que fueron registrados como casos. Otros tantos recién nacidos sin DC fueron registrados como controles, como grupo de comparación para los estudios causales. Para cada caso y cada control, se recogen datos sobre más de 310 variables, que son las que se analizan en la investigación causal. El hecho de que se trate de una serie de recién nacidos consecutivos, es decir, no seleccionados por haber sido derivados a ciertos servicios hospitalarios, es lo que permite efectuar estudios sobre frecuencias y causas.
¿Cuál es la frecuencia global de recién nacidos con DC en España, su evolución en el tiempo y sus causas?La frecuencia global de recién nacidos con DC en España, al igual que en muchos otros países, no ha sido constante a lo largo del tiempo. De hecho, ha experimentado un descenso progresivo desde el año 1985, que es estadísticamente significativo. Para entender esa evolución en nuestro país, es preciso tener en cuenta que a mediados del año 1985 se aprobó en España la Ley Orgánica 9/1985 (BOE del 12 de julio), por la que dejó de ser punible la interrupción del embarazo en determinados supuestos, contemplando uno de ellos la posibilidad de que el feto presente anomalías. Esta realidad implica que, a partir de ese momento, la frecuencia al nacimiento de todos aquellos DC detectables prenatalmente es susceptible de verse influida por el impacto de la interrupción de una cierta proporción de gestaciones en las que el feto esté afectado. La frecuencia registrada con anterioridad a dicho año, se puede considerar la frecuencia basal de los DC en nuestro país, que se sitúa en el 2,22% (intervalo de confianza al 95%: 2,17–2,27), y se suele considerar el período comprendido entre 1980 y 1985 como el período basal. Sin embargo, según los datos más actuales analizados, correspondientes al año 2008, la frecuencia global ha descendido hasta el 1,03% (intervalo de confianza: 0,97–1,10). Dicho descenso a partir de 1985 es atribuible, fundamentalmente, al impacto de las interrupciones voluntarias del embarazo (IVE) tras la detección de alteraciones fetales. Por tanto, la diferencia entre la frecuencia real registrada en un año determinado y la frecuencia basal, se puede considerar como una estimación del impacto de las IVE sobre la frecuencia neonatal. No obstante, en el descenso de la frecuencia deben estar influyendo también, aunque con un impacto muchísimo menor, el progresivo mejor cuidado médico de la gestación, la planificación de la misma, así como el incremento de la cultura sanitaria de nuestra población. Sin embargo, como los productos de las IVE por DC no suelen ser estudiados adecuadamente, ni se recogen los datos necesarios, es muy difícil distinguir su efecto del de esos otros factores que también pueden estar influyendo en la frecuencia. Además, hay que tener en cuenta que en los últimos años, la inmigración está teniendo un considerable impacto sobre la frecuencia de DC en España. Ello se debe a que en los grupos inmigrantes, por sus especiales condiciones socio-culturales y sanitarias, y por sus propias frecuencias de mutaciones génicas recesivas, se registra una mayor frecuencia de DC, como se explicará más adelante.
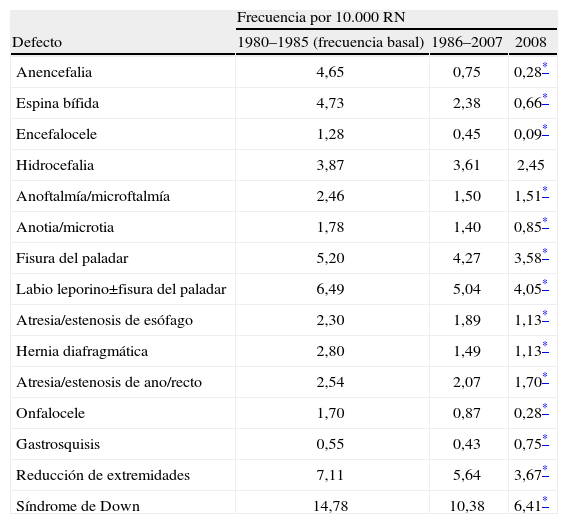
¿Qué se conoce sobre la evolución temporal de la frecuencia de ciertos defectos congénitos?En la tabla 1 se puede apreciar la distribución de la frecuencia en España de 15 DC seleccionados, en 3 períodos de tiempo, siendo el primero de ellos el período basal. Se trata de defectos cuya frecuencia se suele estudiar también en otros programas de vigilancia epidemiológica de todo el mundo, debido a su importancia numérica y/o a la morbilidad o mortalidad que conllevan. Para estudiar la evolución de la frecuencia a lo largo del tiempo, se aplica la prueba de tendencia lineal. Tras aplicar dicha prueba en los datos de la tabla 1, queda patente que para la mayoría de los defectos que incluye, la frecuencia al nacimiento ha disminuido desde el período basal, y de forma estadísticamente significativa. Esos descensos son atribuibles, fundamentalmente, como se ha explicado, al impacto de las IVE. Viendo en detalle la tabla, puede llamar la atención el descenso de la frecuencia de anoftalmía/microftalmía, que son defectos oculares difícilmente detectables intraútero y que, por tanto, no deberían verse influidos por la posibilidad de realizar IVE; en este caso, la disminución de su frecuencia es consecuencia indirecta del impacto de las IVE tras la detección de otras alteraciones del desarrollo prenatal, que son fácilmente detectables, a las que se asocian estos defectos oculares.
ECEMC: distribución de la frecuencia de 16 defectos congénitos seleccionados, en 3 períodos de tiempo
| Frecuencia por 10.000 RN | |||
| Defecto | 1980–1985 (frecuencia basal) | 1986–2007 | 2008 |
| Anencefalia | 4,65 | 0,75 | 0,28* |
| Espina bífida | 4,73 | 2,38 | 0,66* |
| Encefalocele | 1,28 | 0,45 | 0,09* |
| Hidrocefalia | 3,87 | 3,61 | 2,45 |
| Anoftalmía/microftalmía | 2,46 | 1,50 | 1,51* |
| Anotia/microtia | 1,78 | 1,40 | 0,85* |
| Fisura del paladar | 5,20 | 4,27 | 3,58* |
| Labio leporino±fisura del paladar | 6,49 | 5,04 | 4,05* |
| Atresia/estenosis de esófago | 2,30 | 1,89 | 1,13* |
| Hernia diafragmática | 2,80 | 1,49 | 1,13* |
| Atresia/estenosis de ano/recto | 2,54 | 2,07 | 1,70* |
| Onfalocele | 1,70 | 0,87 | 0,28* |
| Gastrosquisis | 0,55 | 0,43 | 0,75* |
| Reducción de extremidades | 7,11 | 5,64 | 3,67* |
| Síndrome de Down | 14,78 | 10,38 | 6,41* |
Los defectos para los cuales se ha podido medir un mayor impacto de las IVE sobre la frecuencia al nacimiento son: el síndrome de Down, la anencefalia y la espina bífida.
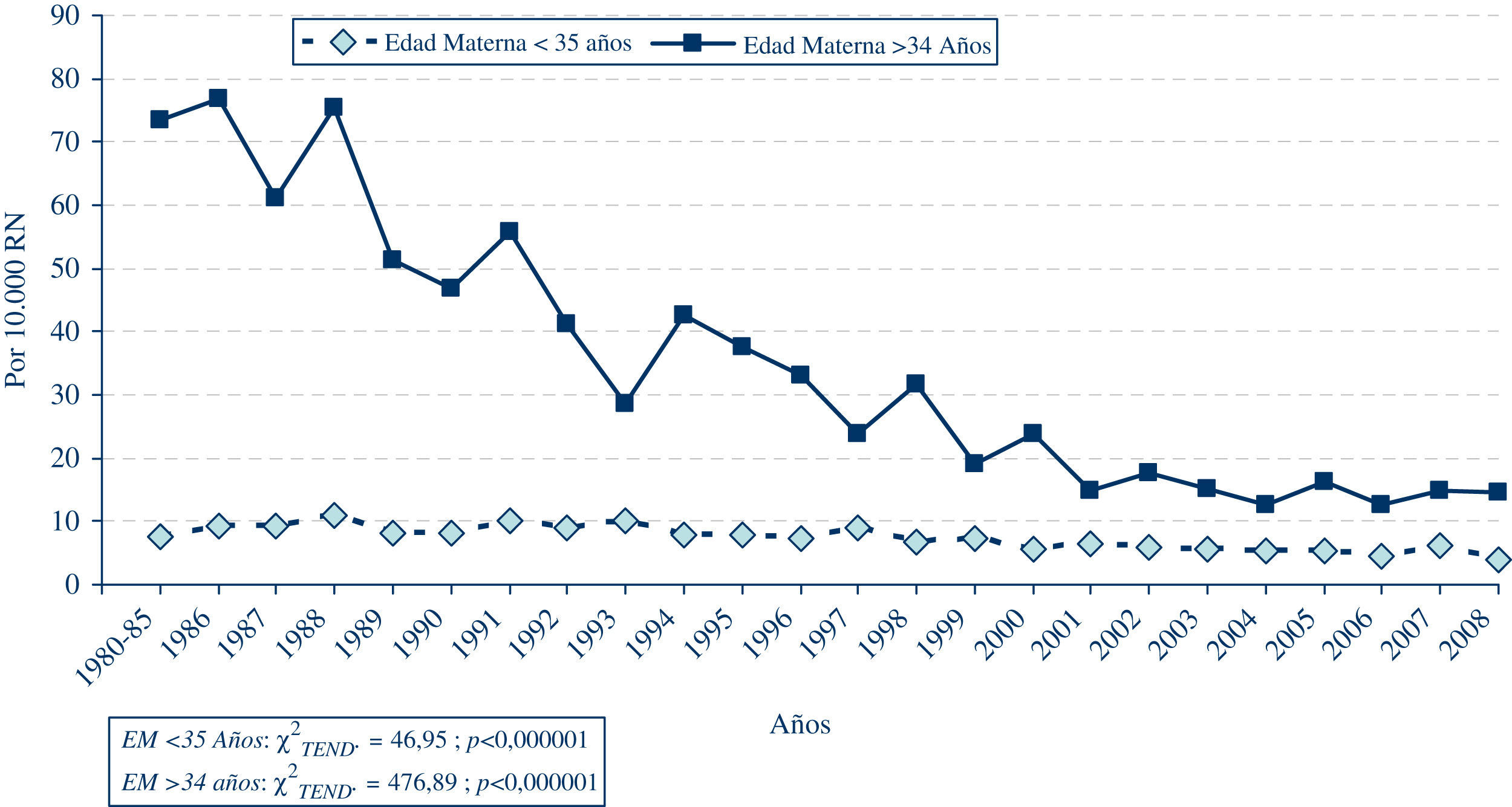
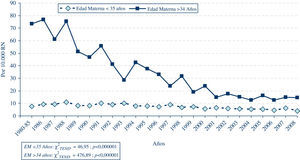
Con respecto al síndrome de Down (gráfica 1), la evolución de su frecuencia no ha sido igual en todas las CC.AA.8, puesto que dicha frecuencia depende fuertemente de la proporción de madres añosas en cada población, y de la existencia de planes específicos de detección prenatal. En la gráfica 1 se puede apreciar que el grupo en el cual se registra un descenso más acusado es el de las madres de más de 35 años, estrato al que van dirigidos de forma especial los planes de diagnóstico prenatal, al ser el grupo de más riesgo para esta patología.
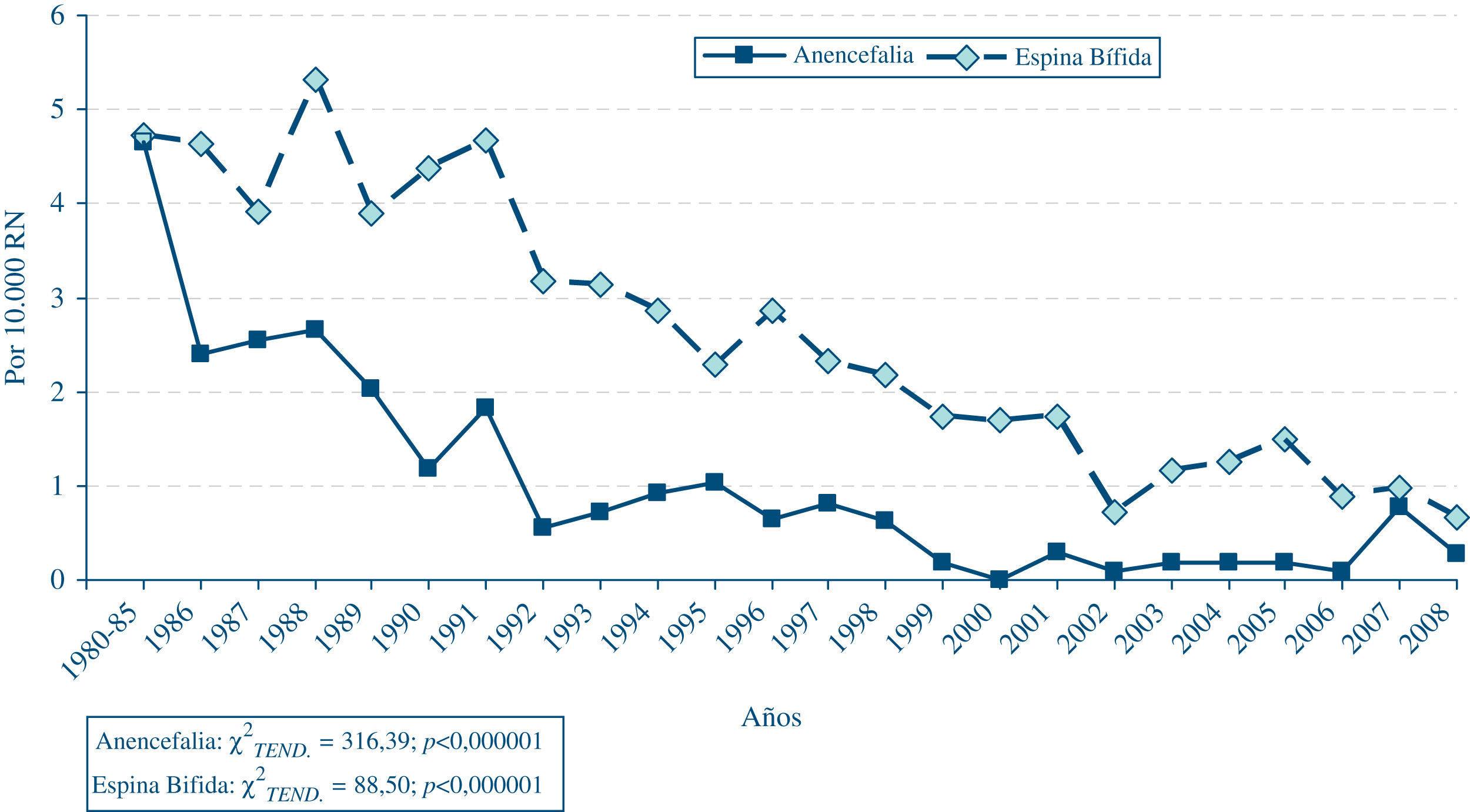
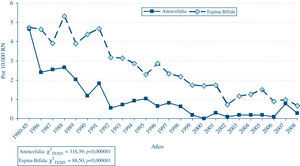
En relación con la anencefalia y la espina bífida, cuya frecuencia ha experimentado también descensos muy acusados a lo largo del tiempo, estos no han sido uniformes en todas las circunscripciones autonómicas3,9, al igual que ocurría con el síndrome de Down. La distribución anual de la frecuencia al nacimiento de estos 2 defectos (gráfica 2) ha sido también diferente entre sí. Aunque el descenso global ha sido de la misma magnitud, en el caso de la anencefalia la disminución inicial tras la aprobación de las IVE por DC fue más drástica que en el caso de la espina bífida, defecto para el que la caída de la frecuencia ha sido más paulatina. Este hecho es lógico, puesto que, por una parte, la anencefalia es un defecto más fácilmente detectable intraútero, incluso en etapas muy precoces de la gestación. Por otra, la interrupción del embarazo en casos de anencefalia está sujeta a unas consideraciones éticas muy diferentes a las que se plantean con la espina bífida, ya que los fetos con anencefalia van a ser inviables posnatalmente. En la distribución de la frecuencia de los defectos del tubo neural, debería estar influyendo de forma muy notable el efecto preventivo de la suplementación periconcepcional materna con ácido fólico, que logra prevenir alrededor del 70% de los casos. Sin embargo, en los datos del ECEMC10 se ha podido comprobar que no se está llevando a cabo de forma adecuada, ni en cuanto al momento de la suplementación, ni en cuanto a la dosis, con lo cual se está dejando de aprovechar una de las pocas oportunidades para ejercer la prevención de los DC. Esto, que ocurre también en otros países en mayor o menor medida, pone de manifiesto, tal como han expuesto algunos investigadores11, un fallo de los sistemas sanitarios y de salud pública en lo que se refiere a la implantación de las medidas preventivas conocidas. En este sentido, la consulta de atención primaria tiene un papel esencial para que se inicie la suplementación con ácido fólico desde el momento en que una pareja se plantee tener un hijo.
Los defectos comentados son ejemplos para los que se ha observado un patrón descendente en su frecuencia. Sin embargo, y aunque la tendencia se va generalizando a más defectos, hay otros que muestran tendencias diferentes a éstas, por diversas causas, como se expone en el Boletín del ECEMC (http://www.ciberer.es/documentos/ECEMC_2009_AF.PDF).
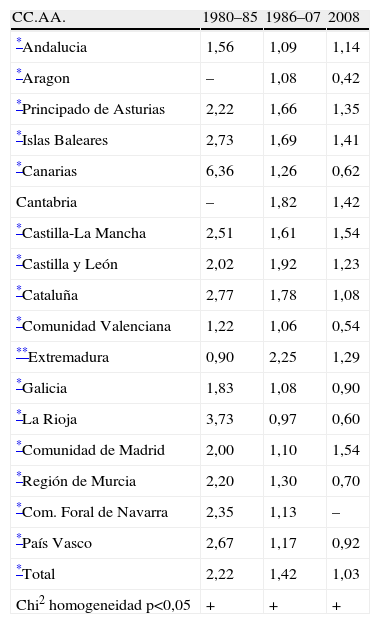
¿Cómo es la distribución geográfica de la frecuencia de recién nacidos con DC?La frecuencia de DC y su evolución temporal no ha sido uniforme en toda España, sino que difiere de unas autonomías a otras, debido a la influencia de los diferentes condicionantes existentes en cada una de ellas. En la tabla 2 se puede apreciar la distribución témporo-espacial del porcentaje de recién nacidos con cualquier tipo de DC, por CC.AA. y en los 3 períodos de tiempo considerados más habitualmente, siendo el primero de ellos el período basal. En la mayoría de las autonomías se ha registrado un descenso secular estadísticamente significativo (se han marcado con asteriscos las CC.AA. donde la tendencia lineal —creciente o decreciente— es estadísticamente significativa). Únicamente en Extremadura se ha observado un incremento, que se considera debido a cuestiones metodológicas, ya que la frecuencia registrada en el período basal en esa comunidad fue muy baja, siendo también pequeño el número de nacimientos controlados en esa época, por lo que no debía ser representativa de la frecuencia real en dicha circunscripción.
ECEMC: distribución témporo-espacial de la frecuencia global de recién nacidos con DC (%)
| CC.AA. | 1980–85 | 1986–07 | 2008 |
| *Andalucia | 1,56 | 1,09 | 1,14 |
| *Aragon | – | 1,08 | 0,42 |
| *Principado de Asturias | 2,22 | 1,66 | 1,35 |
| *Islas Baleares | 2,73 | 1,69 | 1,41 |
| *Canarias | 6,36 | 1,26 | 0,62 |
| Cantabria | – | 1,82 | 1,42 |
| *Castilla-La Mancha | 2,51 | 1,61 | 1,54 |
| *Castilla y León | 2,02 | 1,92 | 1,23 |
| *Cataluña | 2,77 | 1,78 | 1,08 |
| *Comunidad Valenciana | 1,22 | 1,06 | 0,54 |
| **Extremadura | 0,90 | 2,25 | 1,29 |
| *Galicia | 1,83 | 1,08 | 0,90 |
| *La Rioja | 3,73 | 0,97 | 0,60 |
| *Comunidad de Madrid | 2,00 | 1,10 | 1,54 |
| *Región de Murcia | 2,20 | 1,30 | 0,70 |
| *Com. Foral de Navarra | 2,35 | 1,13 | – |
| *País Vasco | 2,67 | 1,17 | 0,92 |
| *Total | 2,22 | 1,42 | 1,03 |
| Chi2 homogeneidad p<0,05 | + | + | + |
En la parte inferior de la tabla 2 figuran también los resultados de la prueba de homogeneidad geográfica para cada período, y de ellos se deduce que han existido y existen diferencias entre autonomías en lo que respecta a la frecuencia de DC. Ello puede responder en los 2 últimos períodos al diferente impacto que han tenido las IVE y los diversos planes sanitarios para detección precoz y prevención de DC. Estos datos sirven como ejemplo de la utilidad del análisis de la distribución geográfica de la frecuencia, que también es aplicable para detectar variaciones locales que pudieran estar relacionadas con modificaciones en los factores causales, circunscritas a determinadas áreas.
Una aplicación particular del estudio de la distribución geográfica es la determinación de la frecuencia local de portadores de genes relacionados con determinadas patologías12, que es un dato útil, también en atención primaria, para informar a la población acerca de los riesgos de tener descendencia con esas patologías.
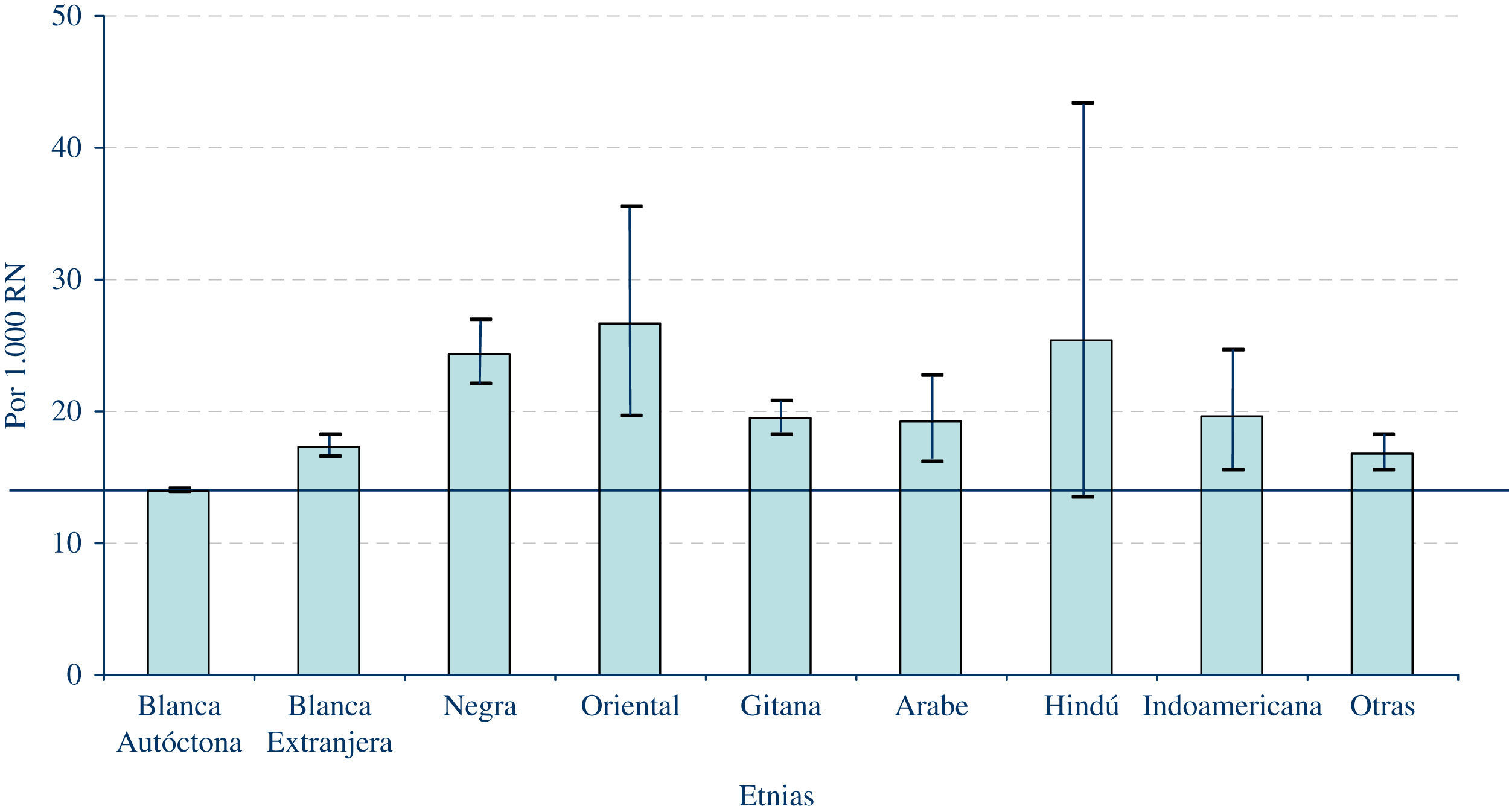
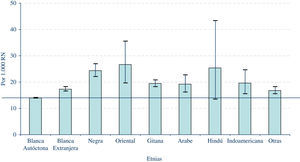
¿De qué modo está influyendo la inmigración sobre la frecuencia de DC en España?Entre los factores a tener en cuenta a la hora de interpretar las variaciones de la frecuencia, tanto a lo largo del tiempo, como geográficas, se encuentra la inmigración. El movimiento migratorio hacia España ha sido muy notorio en los últimos años. Así, mientras el porcentaje de padres de procedencia extranjera entre los controles del ECEMC se situaba en el 3,5% en el período 1980–1997, en 2008 esa cifra ascendió hasta el 23,19%. Ello ha influido en la diversificación étnica en nuestro país, y tiene una repercusión sobre la frecuencia de los DC en España. De hecho, mientras la frecuencia global de recién nacidos con DC (considerando todos los grupos étnicos) alcanza el 1,52% (con intervalo de confianza al 95%: 1,51–1,54), si se restringe el cálculo al grupo de etnia blanca autóctona española, dicha frecuencia se sitúa en el 1,40% (intervalo de confianza: 1,38–1,41). En la gráfica 3 se puede apreciar la comparación de la frecuencia de recién nacidos con DC en los distintos grupos étnicos, frente a la frecuencia registrada en el grupo de etnia blanca autóctona española, que se ha tomado como referencia. Como queda patente en dicha gráfica, en todos los grupos la frecuencia es superior a la del grupo de etnia blanca autóctona, siendo la diferencia estadísticamente significativa para todos salvo el grupo hindú. Las diferencias se deben, probablemente, a las condiciones socio-sanitarias de esos grupos poblacionales, aunque el diferente sustrato genético y cierto grado de endogamia, podrían también determinar un mayor riesgo para ciertas patologías. Todos estos datos ponen de manifiesto la necesidad de diseñar planes de prevención y de salud específicos para estos grupos de población, que incidan en aspectos como la vacunación, control médico del embarazo, alimentación y otros factores que puedan favorecer un buen desarrollo prenatal.
ConclusionesPara finalizar, cabe enumerar los factores más destacados que están influyendo, en diferentes sentidos, sobre la frecuencia de los DC en España y su evolución: la mejora y uso generalizado de las técnicas diagnósticas, la IVE en determinados casos, el mejor cuidado del embarazo, la suplementación periconcepcional con ácido fólico, el aumento progresivo de las edades parentales, la incorporación materna al ámbito laboral, la inmigración, la mayor información de la población sobre actitudes preventivas, y es de desear que la investigación sobre las causas por las que se producen estas patologías, que conllevan una elevada morbilidad, discapacidad, dependencia y mortalidad precoz, cada vez influya más en la prevención primaria de DC.