La vejiga hiperactiva (VH) es un problema frecuente entre hombres y mujeres. Los antimuscarínicos son la referencia de la terapia para la VH y actúan bloqueando los receptores muscarínicos (subtipos M2 y M3) en la vejiga. La persistencia con el tratamiento antimuscarínico suele ser baja, debido a la percepción de falta de eficacia y a los efectos adversos. Por todo ello, se necesitan nuevos tratamientos con mecanismos de acción diferentes, que tengan un perfil de tolerabilidad más aceptable y que mejoren los principales síntomas de la VH.
Mirabegrón es una nueva opción terapéutica para todos los pacientes con VH y podría resolver una necesidad aún no cubierta en pacientes no satisfechos o en los que no está indicado el tratamiento antimuscarínico, siendo una opción alternativa para los pacientes con VH.
Overactive Bladder (OAB) is a common problem among men and women. Antimuscarinic drugs are a reference treatment for OAB and act by blocking the muscarinic receptors (M2 and M3 subtypes) in the bladder. Adherence to antimuscarinic treatment is usually low, due to the perceived lack of efficacy and adverse effects. Therefore, new treatments with different mechanisms of action and a more acceptable tolerability profile are needed, and that improve the symptoms of OAB.
Mirabegron is a new treatment option for all patients with OAB and could solve an unmet need in patients still not satisfied, or where the antimuscarinic therapy is not indicated, is an alternative option for patients with OAB.
Muchos adultos presentan uno o más síntomas del tracto urinario inferior (STUI) en algún momento de su vida y la prevalencia de estos síntomas aumenta con la edad1. Según los datos de un estudio poblacional, las mujeres presentaron síntomas de llenado con más frecuencia que los hombres (59,2% frente al 51,3%), al contrario de lo que ocurría con los síntomas de vaciado (hombres: 25,7%; mujeres: 19,5%) y los síntomas posmiccionales (hombres: 16,9%; mujeres: 14,2%)1.
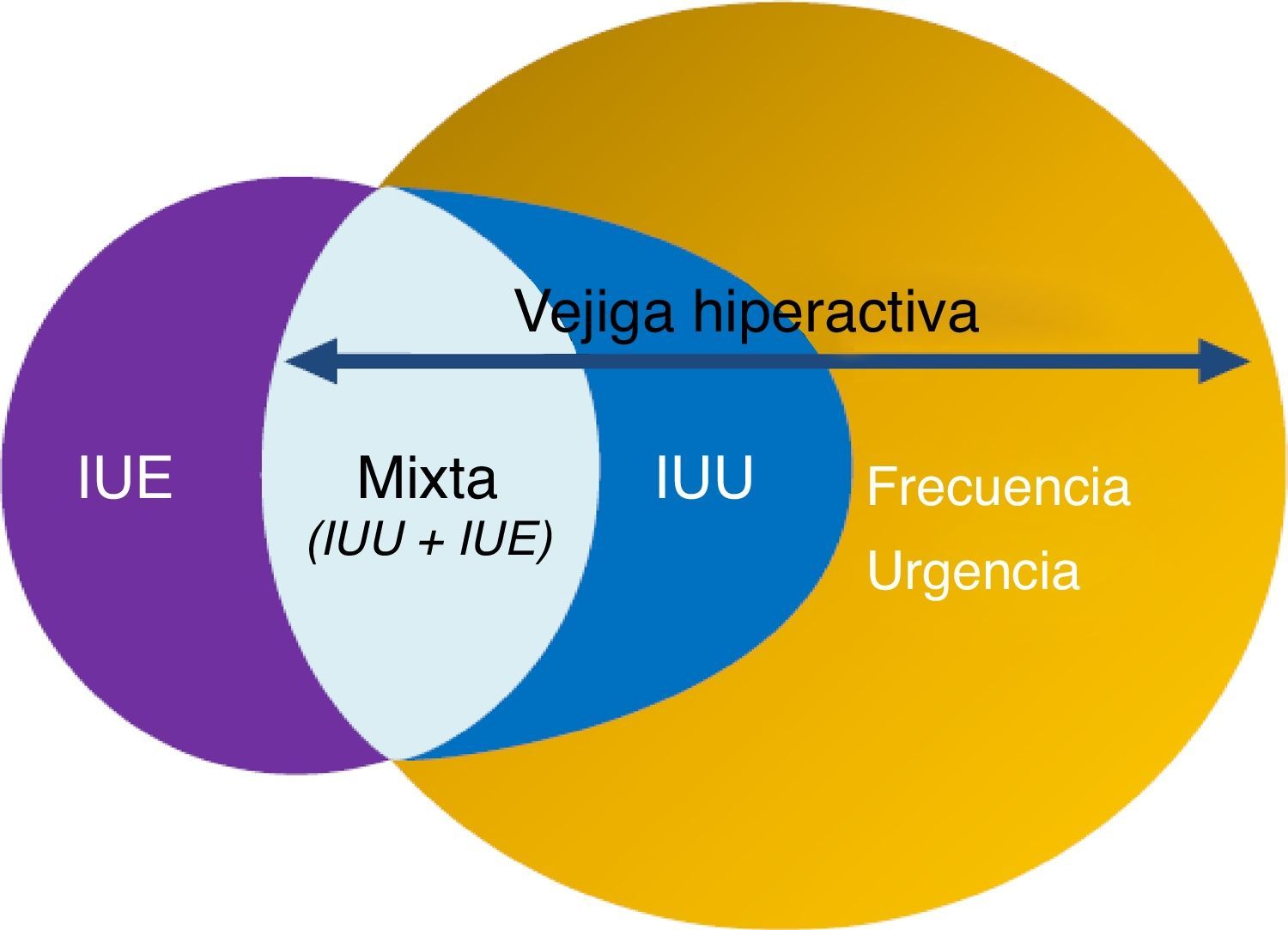
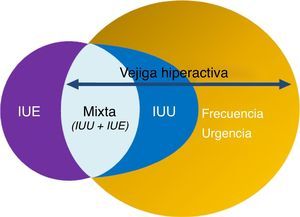
La Sociedad Internacional de Continencia (ICS) definió en 2002 el síndrome de vejiga hiperactiva (VH) como un síndrome caracterizado por la presencia de urgencia miccional aislada o en combinación con otros síntomas, como incontinencia de urgencia (IUU), generalmente asociada a un aumento de la frecuencia miccional y nocturia, en ausencia de otra enfermedad demostrable2.
La VH, por tanto, es un síndrome cuyos síntomas son coincidentes con los STUI de llenado. Estas combinaciones de síntomas son indicativas de hiperactividad del detrusor demostrable urodinámicamente pero pueden ser debidas a otras formas de disfunción uretro-vesical. Estos términos pueden ser usados si no existe infección probada u otra patología3,4 (fig. 1). Según el estudio EPIC, realizado en 5 países europeos, la prevalencia de la VH en población>18 años es del 11,8%, siendo similar entre hombres (10,8%) y mujeres (12,8%)1. En España, la prevalencia en la población general>40 años es del 21,5%, siendo más elevada en mujeres (25,6%) que en varones (17,4%). Tan solo el 28,4% de los sujetos con síntomas compatibles había sido diagnosticado de VH y solo el 16,7% estaba recibiendo tratamiento5.
Para entender la fisiopatología de la VH es importante conocer la fisiología de la micción. En la micción podemos distinguir 2 fases: fases de llenado y de vaciado vesical, las cuales deben ocurrir de forma secuencial y estar controladas por el sistema nervioso central (SNC) y sistema nervioso vegetativo (simpático y parasimpático)6,7.
En la fase de llenado vesical predomina la acción del simpático por la estimulación de los nervios hipogástricos que dependen de los núcleos medulares simpáticos de las metámeras D10-L2, produciendo la relajación del músculo detrusor por efecto de receptores beta adrenérgicos y el cierre del cuello vesical por efecto de receptores alfa-1-adrenérgicos, inhibiéndose en esta fase el sistema nervioso parasimpático.
En la fase de vaciado vesical predomina la acción del parasimpático por la estimulación de los nervios pélvicos que dependen de los núcleos medulares parasimpáticos de las metámeras S2-S4, el músculo detrusor se contrae por estímulos de receptores colinérgicos muscarínicos del cuerpo vesical, sobre todo los tipos M2 y M3, junto con la relajación del cuello vesical y de la uretra por una inhibición del sistema nervioso simpático.
El esfínter uretral externo depende del SNC, es voluntario y está inervado por el nervio pudendo por estimulación de receptores colinérgicos nicotínicos. Las neuronas motoras del esfínter uretral externo se encuentran en el borde lateral externo del asta anterior de las metámeras S2-S4 (núcleo de Onuf).
Por ello, para que la continencia se mantenga debe existir una buena coordinación entre la vejiga y la uretra, requiriéndose una integridad orgánica y una adecuada inervación del tracto urinario inferior.
Fisiopatología de la vejiga hiperactivaLa VH presenta una etiopatogenia multifactorial. Las causas de la VH pueden tener un origen neurogénico, urotelial, miogénico o idiopático. Cualquiera de estos mecanismos puede producir la sintomatología urinaria asociada con la VH8,9.
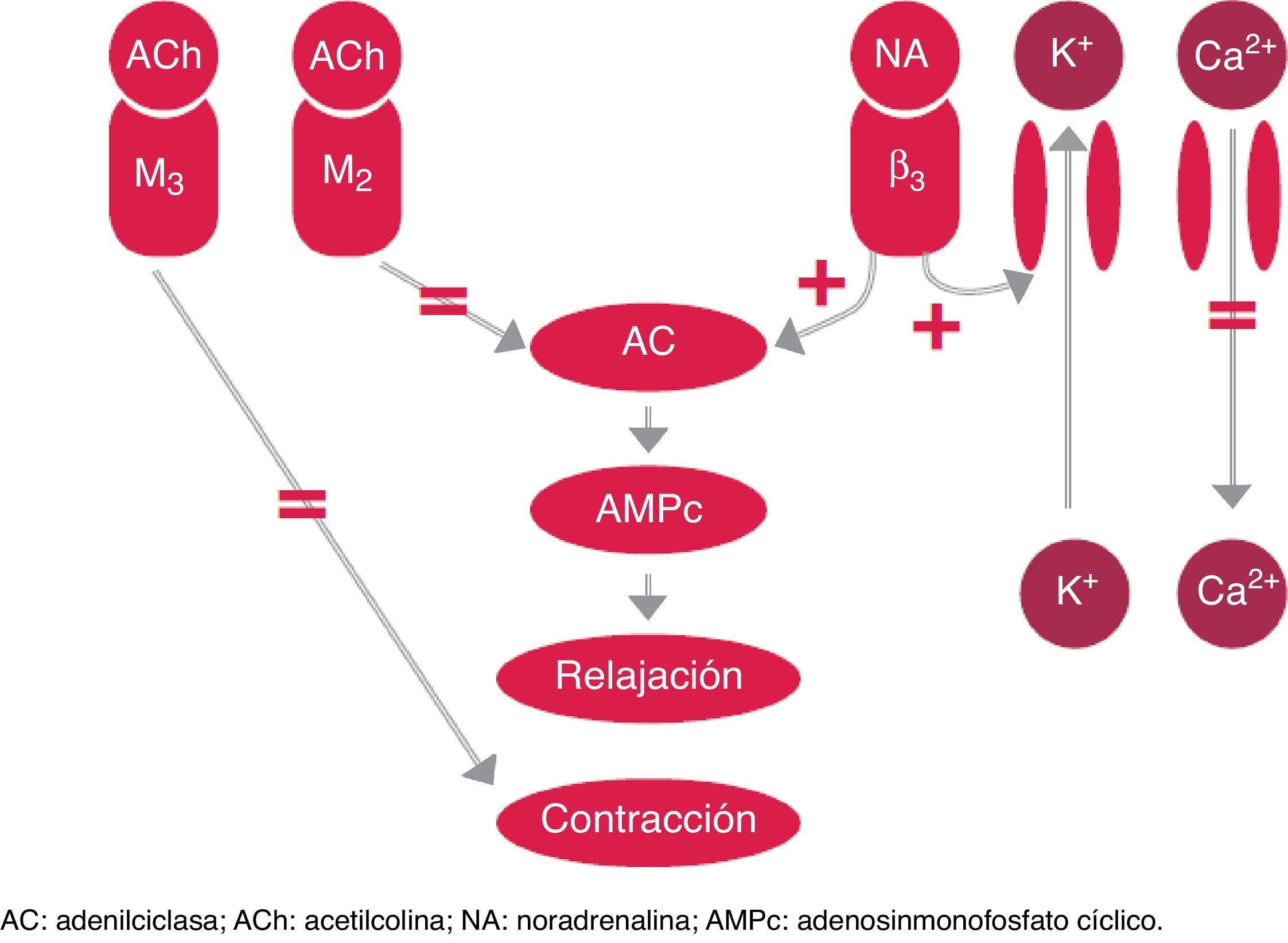
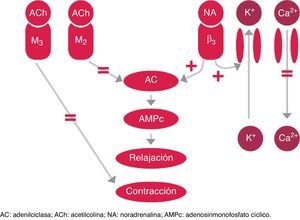
El aumento de la contractilidad del detrusor hiperactivo en la VH se debe a la hipersensibilidad de los receptores muscarínicos (M2 o M3). La acetilcolina liberada en las vías del sistema nervioso parasimpático produce la activación de los receptores M3, responsables de la contracción de la vejiga. Por otra parte, la activación de los receptores M2 produce una reducción del adenosinmonofosfato cíclico (AMPc) previniendo la relajación9. Los fármacos antimuscarínicos actúan sobre la activación de la vía parasimpática que produce la contracción del detrusor (fig. 2).
Control simpático y parasimpático de la fase de llenado y lugar de acción de los tratamientos farmacológicos orales para el tratamiento de la VH.
Recientes avances en la fisiopatología de la VH han identificado 3 subtipos de receptores beta adrenérgicos (beta-1, 2 y 3) en el detrusor y el urotelio10-12. Los receptores beta-3 adrenérgicos son predominantes, con más del 97% del total de ARN mensajero del receptor beta adrenérgico13, y se considera que es el subtipo principal implicado en la relajación del detrusor en humanos14. Como se ha comentado anteriormente, durante la fase de llenado vesical predomina la estimulación de la función simpática. Se libera noradrenalina de las terminaciones nerviosas, lo que induce predominantemente la activación del receptor beta-3 adrenérgico en la musculatura de la vejiga y, por tanto, la relajación del músculo liso de la misma, mediante aumento de las concentraciones de AMPc15.
Estos hallazgos han llevado al desarrollo de fármacos agonistas beta-3 adrenérgicos, como mirabegrón, recientemente aprobado en España, que actúan estimulando los receptores beta-3 y produciendo relajación del detrusor.
La vejiga hiperactiva y su tratamiento en la actualidadLos hombres y las mujeres con síntomas de VH refieren bajos niveles de calidad de vida (CdV) relacionada con la salud y productividad laboral, así como altos niveles de ansiedad y depresión, en comparación con aquellos que no tienen síntomas o con síntomas mínimos (sin molestias)16. Así pues, el principal objetivo del tratamiento es mejorar la CdV, y una combinación de terapia conductual y tratamiento farmacológico suele permitir a los pacientes alcanzar resultados aceptables6. No obstante, se necesitan nuevas opciones terapéuticas que ofrezcan un adecuado balance entre eficacia y tolerabilidad, y que mejoren los resultados reportados por los pacientes.
La sistemática diagnóstica de la VH se basa en unos puntos básicos17-19:
- 1.
Una detallada historia clínica.
- 2.
Un examen físico completo.
- 3.
Un análisis de orina.
- 4.
La valoración del diario miccional y de los cuestionarios de síntomas.
- 5.
En algunos pacientes seleccionados puede ser necesaria la medición del residuo miccional y un cultivo de orina.
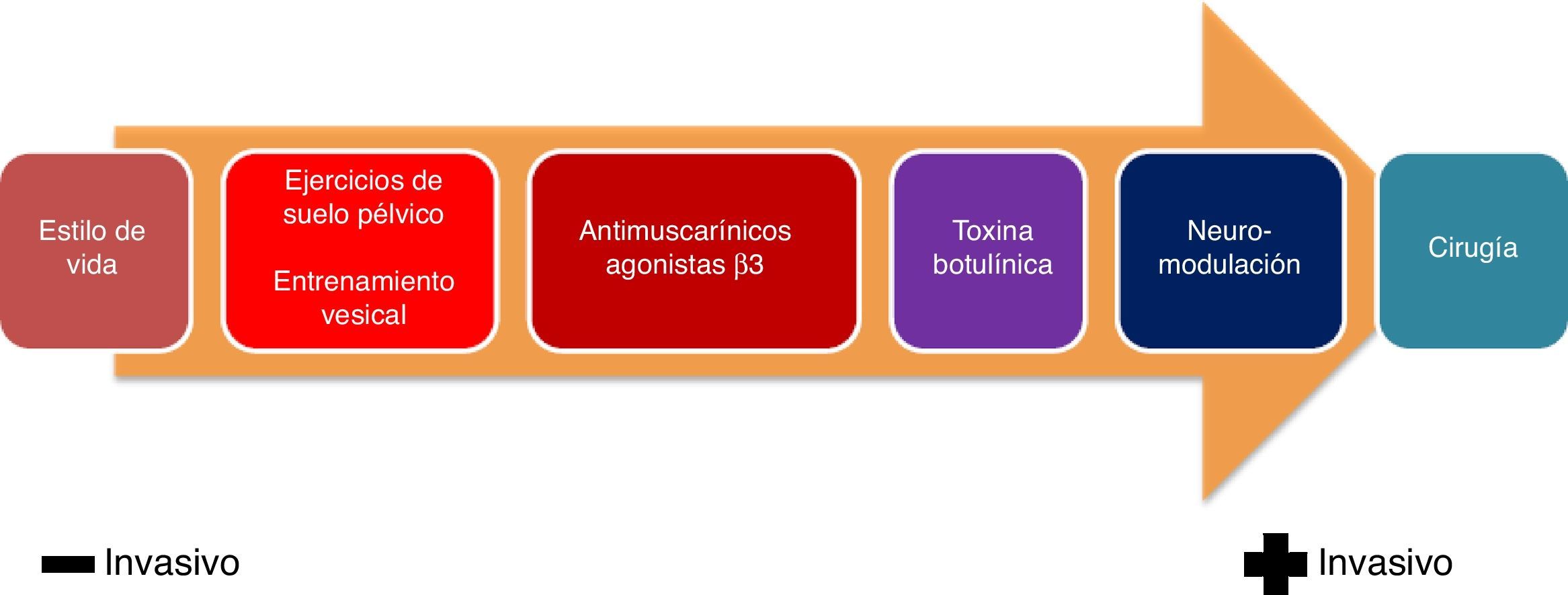
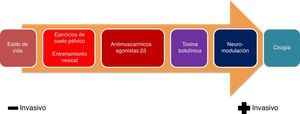
El tratamiento de la VH debe realizarse de forma escalonada, comenzando con medidas menos invasivas hasta llegar a opciones más agresivas en función de la respuesta terapéutica obtenida (fig. 3)19.
1. Cambios en estilo de vida: recomendaciones higiénico-dietéticas: el tratamiento no farmacológico de la VH constituye la primera alternativa que debe contemplarse en todos los pacientes, no debiéndose plantear otras medidas terapéuticas sin este primer nivel de intervención.
Para diseñar y ejecutar con éxito este tratamiento conservador es fundamental conocer las características médicas del paciente, los síntomas urinarios (urgencia, polaquiuria, nocturia, escapes de orina) y su severidad e impacto sobre su CdV, la situación funcional (física y mental), así como el grado de motivación y la disponibilidad de familiares y/o cuidadores, junto con el grado de implicación de estos en el abordaje del problema.
Conviene recordar que el tratamiento de la VH debe ser integral y multidisciplinar, requiriéndose la gran mayoría de las veces la combinación de medidas no farmacológicas y farmacológicas, aunque lamentablemente en algunos pacientes muy deteriorados, la única opción posible sea el tratamiento paliativo.
Este tratamiento integral debe plantearse de forma individualizada y totalmente realista, dirigido a conseguir los siguientes objetivos: mejorar la CdV, reducir la severidad de la incontinencia o el número de escapes y cuando sea posible, recuperar la continencia.
Dentro del tratamiento no farmacológico se incluyen diferentes medidas conservadoras17-21:
- –
Reducción del peso (GR: A): la obesidad se ha identificado como un factor de riesgo de incontinencia urinaria (IU) en diferentes estudios epidemiológicos (NE: 1b). Existe la evidencia científica de que la prevalencia de IUU se incrementa proporcionalmente con el aumento del índice de masa corporal. Una pérdida de peso (> 5%) en mujeres con obesidad ha demostrado que mejora la IU (NE: 1b). También la pérdida de peso en adultos obesos con diabetes mellitus reduce el riesgo de desarrollo de IU (NE: 1b).
- –
Reducción del consumo de cafeína (GR: B): la reducción de la ingesta de cafeína puede mejorar los síntomas de urgencia y frecuencia (NE: 2), pero no la IU (NE: 2).
- –
Control de la ingesta de líquidos (GR: C): la reducción de la ingesta de líquidos puede reducir la frecuencia y urgencia asociadas a la VH. Hay que tener en cuenta que la restricción de la ingesta de líquidos puede producir efectos indeseados, como ITU, deshidratación o estreñimiento. Se recomienda que las causas de la elevada ingesta de líquidos sean estudiadas en la historia clínica del paciente.
- –
Tratamiento del estreñimiento (GR: C): hay una consistente asociación entre una historia de estreñimiento y el desarrollo de la IU (NE: 3). Aunque no hay evidencia de que el tratamiento del estreñimiento mejore la IU (NE: 4), sí es aconsejable que se recomienden medidas para tratarlo en caso de presencia en pacientes con IU.
- –
Abandono del hábito tabáquico (GR: A): no existe una evidencia científica consistente en que las personas fumadoras (especialmente en aquellas con un consumo>20 cigarrillos/día) presenten mayor probabilidad de IU (NE: 3), pero se ha observado que puede asociarse a IU grave (NE: 3). Aunque no existe evidencia de que el abandono del hábito tabáquico mejore los síntomas de IU (NE: 4), sí se recomienda que a todos los pacientes con VH fumadores se les indique el abandono del hábito tabáquico.
2. Programas de modificación de la conducta17: han demostrado que pueden mejorar los síntomas de la IU (NE: 1b), aunque su efecto disminuye después de su finalización (NE: 2). Los programas de modificación de la conducta pueden adaptarse a las necesidades y las capacidades de los pacientes. No se asocian a los efectos adversos de los fármacos, pero es necesaria la participación activa del paciente y un esfuerzo y tiempo por parte del médico. La combinación de las terapias de modificación de la conducta, junto con el tratamiento farmacológico oral, puede presentar beneficios (NE: 1b). Estos programas de modificación de la conducta incluyen:
2.1. Entrenamiento vesical (GR: A): el objetivo del entrenamiento vesical es ayudar al paciente a recuperar el control de la vejiga y aumentar su capacidad para reducir el número de episodios de incontinencia y la frecuencia miccional.
Se basa en programar las micciones de acuerdo con su esquema miccional (obtenido a través del diario miccional), recomendando orinar antes de que puedan percibir el deseo miccional y presentar los escapes por urgencia. Progresivamente se va aumentando el intervalo entre micciones de forma gradual en media hora, hasta conseguir espaciar la micción entre 3 y 4 h. Si hay escapes se reducen los tiempos.
Está demostrado el efecto positivo de esta técnica en el manejo de la VH, estando además exento de efectos adversos, si bien requiere la aceptación y la colaboración del paciente, así como un buen grado de capacidad física y mental para llevar a cabo este programa.
2.2. Ejercicios del suelo pélvico (ejercicios de Kegel) (GR: A): la realización de estos ejercicios durante al menos 3 meses han demostrado ser un tratamiento seguro y eficaz en el manejo de la IUE, la IUU y mixta (NE 1, GR A). No se han comunicado efectos adversos con escasos abandonos de la terapia.
Se aconseja realizar series de 3 o 4 veces al día de 15 contracciones durante un periodo de 15 a 20 semanas y evaluar la respuesta clínica. Con el uso de algunos dispositivos (conos vaginales o bolas chinas) se pueden mejorar la comprensión y el cumplimiento de esta técnica, aunque no aporta ningún beneficio adicional a la realización de ejercicios de Kegel.
2.3. Biofeed-back (biorretroalimentación) (GR: B): esta técnica se basa en la toma de conciencia de una función biológica, en este caso de la micción, siendo posible reforzarla mediante una señal táctil, visual o auditiva. El paciente percibe la señal y aprende a regular y modificar por autocontrol, siendo útil para ayudar a fortalecer o relajar la musculatura perineal y controlar la inestabilidad vesical. Existen 3 tipos de biorretroalimentación: muscular, vesical y vésico-esfinteriano.
Esta técnica requiere una buena capacidad funcional y un alto grado de colaboración, junto con la intervención de un terapeuta, lo cual limita de forma considerable empleo en los pacientes mayores.
Tratamiento farmacológicoAntimuscarínicos (GR: A)Hasta ahora, los antimuscarínicos han sido la piedra angular del tratamiento de la VH. Estos fármacos actúan bloqueando los receptores muscarínicos en la vejiga, lo que reduce las contracciones no voluntarias.
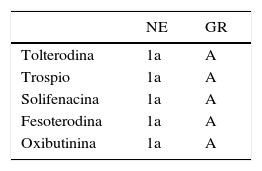
Los antimuscarínicos han demostrado su eficacia en el tratamiento de la VH y en la mejora de la CdV22. No hay evidencia consistente de que un antimuscarínico sea superior a otro en la mejora de la IUU (NE: 1a) o en la mejora de la CdV (NE: 1a)17,19. Los antimuscarínicos difieren en sus perfiles farmacológicos (p. ej., por su afinidad al receptor muscarínicos y otros mecanismos de acción), sus propiedades farmacocinéticas (como la solubilidad y la semivida media) y su formulación de liberación inmediata, liberación prolongada o transdérmica17,19. En la tabla 1 se recogen los antimuscarínicos disponibles en España con su nivel de evidencia (NE) y su grado de recomendación (GR).
Antimuscarínicos disponibles en España
| NE | GR | |
|---|---|---|
| Tolterodina | 1a | A |
| Trospio | 1a | A |
| Solifenacina | 1a | A |
| Fesoterodina | 1a | A |
| Oxibutinina | 1a | A |
Tomado de Adot et al.17
Los antimuscarínicos se asocian a efectos adversos, como son, entre otros, sequedad de boca, estreñimiento y sequedad ocular, que en la práctica clínica conducen al abandono del tratamiento por parte del paciente.
Por ello, en las personas mayores y de cara a evitar efectos secundarios (fundamentalmente derivados de la actividad anticolinérgica) se deberá comenzar siempre con dosis muy bajas de todos estos fármacos y aumentarlas muy progresivamente hasta conseguir el efecto deseado o la dosis mínima eficaz, siempre que no aparezcan efectos secundarios23.
Se debe evitar su uso en pacientes con glaucoma de ángulo estrecho, colitis ulcerosa severa, íleo intestinal, estenosis pilórica, insuficiencia renal grave, hepatopatía grave, lactancia y miastenia gravis24. De igual modo, se deben pautar con precaución en pacientes tratados con otros fármacos como sedantes, hipnóticos, en presencia de deterioro cognitivo y en pacientes mayores que toman inhibidores de la colinesterasa24.
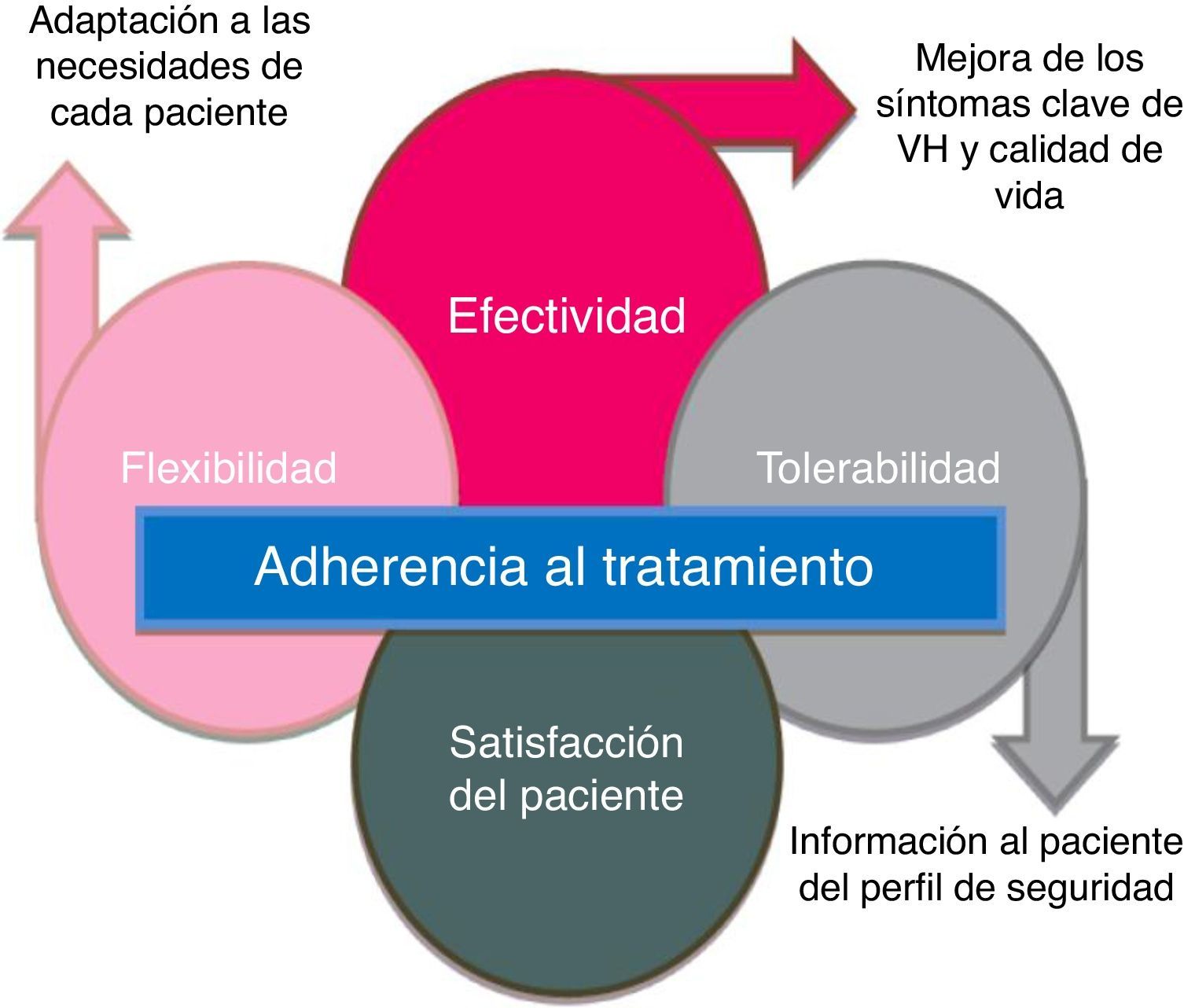
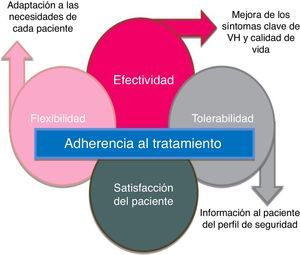
Para que el tratamiento farmacológico sea beneficioso en una patología crónica, la adherencia y la persistencia con el tratamiento son fundamentales25. El síndrome de VH es una condición crónica que requiere tratamiento a largo plazo; sin embargo, se ha observado que la persistencia al tratamiento farmacológico es baja. Más de la mitad de los pacientes abandonarán dicho tratamiento en los primeros 3 meses19.
La baja persistencia suele atribuirse principalmente a la falta de eficacia y a los efectos adversos26-30, aunque esto puede solucionarse, en parte, determinando unas expectativas realistas junto a los pacientes en el momento de la prescripción26. Se han identificado los factores predictivos de la interrupción de la terapia para la VH y la persistencia podría mejorarse informando a los pacientes de forma proactiva sobre la magnitud del beneficio esperado, la intensidad de los efectos adversos antimuscarínicos y los regímenes de dosificación30. Así pues, los tratamientos nuevos para la VH deben ofrecer a los pacientes un adecuado balance de eficacia y tolerabilidad; esto junto con una información adecuada al paciente facilitará que se cumplan las expectativas y se mejore la persistencia con el tratamiento (fig. 4).
Beta-3 agonistas: mirabegrón (GR: B)Los agonistas y antagonistas de los receptores adrenérgicos dirigidos a los subtipos de receptores beta-1 y 2 han sido durante mucho tiempo la referencia en la medicina cardiovascular y pulmonar. Más recientemente se han investigado los receptores beta-3 adrenérgicos como diana terapéutica en varias indicaciones, especialmente la obesidad y la diabetes tipo 2, aunque con un éxito limitado31. El fracaso de la mayoría de los compuestos evaluados puede atribuirse al hallazgo de que los patrones de expresión de los receptores beta-3 adrenérgicos de la mayoría de las especies animales son considerablemente diferentes de los patrones de expresión en humanos, especialmente en el tejido adiposo32.
Mirabegrón es un agonista de los receptores beta-3 adrenérgicos que se investigó inicialmente como posible tratamiento de la diabetes tipo 2. Los estudios preliminares en otras indicaciones demostraron el potencial de los agonistas de los receptores beta-3 adrenérgicos como tratamiento de los síntomas de la VH11 y, por lo tanto, mirabegrón se evaluó en este campo. Mirabegrón es el primer fármaco de esta clase que ha sido aprobado y comercializado en Japón, EE. UU. y Europa para el tratamiento de la VH33.
Mirabegrón es una nueva opción de tratamiento para los pacientes con VH y es el primer fármaco de una nueva clase terapéutica en el tratamiento de la VH. Supone una innovación en una terapia basada en antimuscarínicos en los últimos 30 años33-35.
La dosis recomendada de mirabegrón es de 50mg en toma única diaria con o sin alimentos36.
Mirabegrón, como agonista de los receptores beta-3 adrenérgicos de la vejiga, induce la relajación del musculo liso de esta, aumentando las concentraciones del AMPc y mostrando un efecto relajante de la misma. Aumenta el volumen medio miccional y disminuye la frecuencia de las contracciones no miccionales del detrusor, sin afectar a la presión de vaciado o la orina residual17.
Mirabegrón 50mgha sido evaluado en 3 estudios controlados con placebo, doble ciego, aleatorizados fase iii, de 12 semanas de duración, para el tratamiento de la VH con síntomas de urgencia y frecuencia con o sin IU37-39. Se incluyó a pacientes mujeres (72%) y varones (28%) con una media de edad de 59 años. La población estudiada estaba compuesta por pacientes no tratados previamente con antimuscarínicos (48%) y pacientes tratados previamente con medicación antimuscarínica (52%). En uno de estos estudios, se estableció un control activo (tolterodina de liberación prolongada de 4mg)37. Los pacientes seleccionados tenían una media de ≥ 8 episodios de frecuencia/24 h y al menos 3 episodios de urgencia con o sin IUU recogidos en un diario miccional basal de 3 días (DM3D). Los principales criterios de exclusión en el momento de la aleatorización fueron: obstrucción vesical clínicamente significativa con riesgo de retención de orina, incontinencia de esfuerzo significativa o incontinencia mixta (esfuerzo/urgencia) con predominio del componente de esfuerzo, volumen miccional total medio>3.000ml registrado en un DM3D, aumento clínicamente significativo en las variables de laboratorio durante la selección, hipertensión grave (en posición sentada, media presión arterial sistólica ≥180mmHg y/o media presión arterial diastólica ≥ 110mmHg).
Mirabegrón 50mgha demostrado ser eficaz en la reducción de los episodios de IU y reducción de la frecuencia y urgencia urinaria (NE: 1a)19,37-42, mejorando de forma estadísticamente significativa las medidas de CdV relacionada con la salud: satisfacción con el tratamiento y molestias relacionadas con los síntomas17.
Mirabegrón 50mgha demostrado su eficacia en pacientes que previamente interrumpieron el tratamiento para la VH con antimuscarínicos43.
En los 3 estudios controlados con placebo, doble ciego fase iii de 12 semanas de duración, el 88% de los pacientes completó el tratamiento con mirabegrón y el 4% abandonó el estudio debido a acontecimientos adversos. La mayoría de las reacciones adversas fueron de intensidad leve a moderada. Las reacciones adversas frecuentes referidas por los pacientes tratados con mirabegrón 50mg fueron taquicardia e infecciones del tracto urinario. La frecuencia de taquicardia fue del 1,2% e indujo al abandono en el 0,1% de los pacientes tratados con mirabegrón 50mg. La frecuencia de infecciones del tracto urinario fue del 2,9% en pacientes tratados con mirabegrón 50mg, no siendo esta causa de retirada del tratamiento. Entre las reacciones adversas graves se incluía la fibrilación auricular (0,2%)37-39. Las reacciones adversas observadas durante el estudio con control activo (antimuscarínico) de un año de duración (largo plazo)44 fueron similares en tipo e intensidad a las observadas en los 3 estudios controlados con placebo, doble ciego fase iii de 12 semanas de duración37-39.
Un reciente metaanálisis que incluyó 44 estudios clínicos aleatorizados con 27.309 pacientes mostró que mirabegrón 50mg es tan efectivo como los antimuscarínicos en la reducción de la IU y la frecuencia miccional45.
Se debe tener precaución en el empleo de mirabegrón en algunas situaciones especiales36:
- –
Insuficiencia renal: no se ha estudiado mirabegrón en pacientes con enfermedad renal en fase terminal (TFG<15ml/min/1,73 m2 o pacientes que requieren hemodiálisis) y, por tanto, no se recomienda su uso en esta población de pacientes. Los datos son limitados en pacientes con insuficiencia renal grave (TFG 15 a 29ml/min/1,73 m2); con base en un estudio farmacocinético se recomienda en esta población una reducción de la dosis a 25mg. No se recomienda el uso de mirabegrón en pacientes con insuficiencia renal grave (TFG de 15 a 29ml/min/1,73 m2) que reciben de forma concomitante inhibidores potentes del CYP3A.
- –
Insuficiencia hepática: no se ha estudiado mirabegrón en pacientes con insuficiencia hepática grave (Child-Pugh clase C) y, por tanto, no se recomienda su uso en esta población de pacientes. No se recomienda el uso de mirabegrón en pacientes con insuficiencia hepática moderada (Child-Pugh clase B) que reciben de forma concomitante inhibidores potentes del CYP3A.
- –
Hipertensión: no se ha evaluado mirabegrón en pacientes con hipertensión grave no controlada (presión arterial sistólica ≥ 180mmHg y/o presión arterial diastólica ≥ 110mmHg); por tanto, no se recomienda su uso en esta población de pacientes. Los datos son limitados en pacientes con hipertensión en estadio 2 (presión arterial sistólica ≥ 160mmHg o presión arterial diastólica ≥ 100mmHg). Se han notificado casos graves de hipertensión y aumento de la presión arterial en pacientes en tratamiento con mirabegrón; por ello se recomienda tomar la presión arterial antes de iniciar el tratamiento y controlarla regularmente, especialmente en pacientes con hipertensión46.
- –
Pacientes con prolongación congénita o adquirida del intervalo QT: mirabegrón, a dosis terapéuticas, no ha demostrado prolongación del intervalo QT clínicamente relevante en los ensayos clínicos. Sin embargo, ya que en estos ensayos no se incluyó a pacientes con antecedentes de prolongación del intervalo QT o pacientes que estuvieran tomando medicamentos que se sabe que prolongan el intervalo QT, se desconoce el efecto de mirabegrón en estos pacientes. Por tanto, se debe tener precaución cuando se administre mirabegrón en estos pacientes.
- –
Pacientes con obstrucción de la salida de la vejiga (OSV) y pacientes que toman antimuscarínicos para la VH: se ha notificado retención urinaria en pacientes con OSV y en pacientes que toman antimuscarínicos para la VH en la experiencia poscomercialización en pacientes que toman mirabegrón. Un estudio clínico controlado de seguridad en pacientes con OSV no demostró aumento de la retención urinaria en pacientes tratados con mirabegrón; sin embargo, mirabegrón se debe administrar con precaución a pacientes con OSV clínicamente significativa. Mirabegrón además se debe administrar con precaución a pacientes que toman antimuscarínicos para el tratamiento de la VH36.
Mirabegrón se transporta y se metaboliza a través de múltiples vías. Así, es un sustrato para el citocromo P450 (CYP) 3A4, CYP2D6, butirilcolinesterasa, uridina difosfato-glucuronosiltranferasas (UGT), transportador de flujo de glicoproteína P (P-gp) y de los transportadores de influjo de los cationes orgánicos (OCT) OCT1, OCT2 y OCT3. Los estudios de mirabegrón en microsomas hepáticos humanos y enzimas CYP humanas recombinantes mostraron que mirabegrón es un inhibidor moderado y tiempo dependiente de CYP2D6 y un inhibidor débil del CYP3A. Mirabegrón inhibía el transporte de fármacos mediado por P-gp a concentraciones elevadas. Sin embargo, no se esperan interacciones farmacológicas clínicamente relevantes entre mirabegrón y los medicamentos que inhiban, induzcan o sean sustrato para una de las isoenzimas de CYP o transportadores, excepto en el caso del efecto inhibidor de mirabegrón sobre el metabolismo de los sustratos del CYP2D6. Sí se recomienda precaución si mirabegrón se administra de forma concomitante con medicamentos que tienen un estrecho margen terapéutico y que sean metabolizados de forma significativa por el CYP2D6, tales como, tioridazina, antiarrítmicos tipo 1C (p. ej., flecainida, propafenona) y antidepresivos tricíclicos (p. ej., imipramina, desipramina). También se recomienda precaución si mirabegrón se administra de forma concomitante con sustratos del CYP2D6 que son dosificados individualmente36.
ConclusionesLa VH es un problema frecuente entre hombres y mujeres. Aunque existen tratamientos eficaces, se necesitan nuevos fármacos que ofrezcan un mejor balance entre eficacia y tolerabilidad, con la posibilidad de mejorar la persistencia de los pacientes con el tratamiento.
Los antimuscarínicos son la referencia de la terapia para la VH y actúan bloqueando los receptores muscarínicos (subtipos M2 y M3) en la vejiga (GR: A). La persistencia con el tratamiento antimuscarínico suele ser baja, debido a la percepción de falta de eficacia y a los efectos adversos. Asimismo, el tratamiento antimuscarínico está contraindicado en ciertas patologías, por lo que el manejo terapéutico de la VH en este tipo de pacientes es más complicado.
Mirabegrón es una nueva opción terapéutica para los pacientes con VH y podría resolver una necesidad aún no cubierta en pacientes no satisfechos o en los que no está indicado el tratamiento antimuscarínico, siendo una opción alternativa para los pacientes con VH (GR: B).
Mirabegrón es el primer agonista de los receptores beta-3 adrenérgicos que se ha comercializado para el tratamiento de la VH, y produce su efecto a través de un nuevo mecanismo de acción, diferente al de los antimuscarínicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
| Nivel de evidencia | Tipo de datos científicos |
|---|---|
| 1a | Datos científicos procedentes de metaanálisis de ensayos aleatorizados |
| 1b | Datos científicos procedentes de, al menos, un ensayo aleatorizado |
| 2a | Datos científicos procedentes de un estudio controlado bien diseñado sin aleatorización |
| 2b | Datos científicos procedentes de, al menos, un estudio cuasiexperimental bien diseñado de otro tipo |
| 3 | Datos científicos procedentes de estudios no experimentales bien diseñados, como estudios comparativos, estudios de correlación y casos clínicos |
| 4 | Datos científicos procedentes de informes u opiniones de comités de expertos o de la experiencia clínica de autoridades en la materia |
| Grado de recomendación | Naturaleza de las recomendaciones |
|---|---|
| A | Basadas en, al menos, un ensayo aleatorizado o criterio de los expertos en base a evidencia indirecta de calidad |
| B | Basada en estudios clínicos bien realizados, pero sin ensayos clínicos aleatorizados |
| C | Emitida a pesar de la ausencia de estudios clínicos de buena calidad directamente aplicables |