La toracocentesis es una prueba sencilla y con escasas complicaciones que aporta información relevante en el diagnóstico de un derrame pleural, a través de una correcta interpretación del análisis del líquido pleural.
Una iniciativa interesante sería incorporar esta técnica a aquellos equipos de Atención Primaria que atienden a pacientes graves y complejos con dificultades para el desplazamiento a centros especializados distantes de sus domicilios. En este contexto, un buen conocimiento de las posibilidades diagnósticas que ofrece el análisis del líquido pleural podría ser de gran utilidad, en manos de personal bien entrenado, para establecer la etiología de un derrame pleural e iniciar, con la mayor celeridad posible, su tratamiento.
Este artículo trata de contribuir a ello, trasmitiendo unas pautas de cómo una técnica sencilla puede aportar información relevante para conocer la etiología del derrame pleural y que podría implementarse en un determinado marco de Atención Primaria.
Thoracentesis is a simple test with few complications that provides relevant information in the diagnosis of a pleural effusion, through a correct interpretation of the pleural fluid analysis.
An interesting initiative would be to incorporate this technique by those Primary Care teams that treat serious and complex patients, with difficulties in moving to specialised centres far from their homes. In this context, a good knowledge of the diagnostic possibilities offered by the pleural fluid analysis could be very useful in the hands of well trained staff to establish the aetiology of a pleural effusion and be able to initiate, as quickly as possible, its treatment.
This article aims to contribute to this, by suggesting guidelines on how a simple technique can provide relevant information in order to determine the aetiology of pleural effusion, and which could be implemented within a given Primary Care framework.
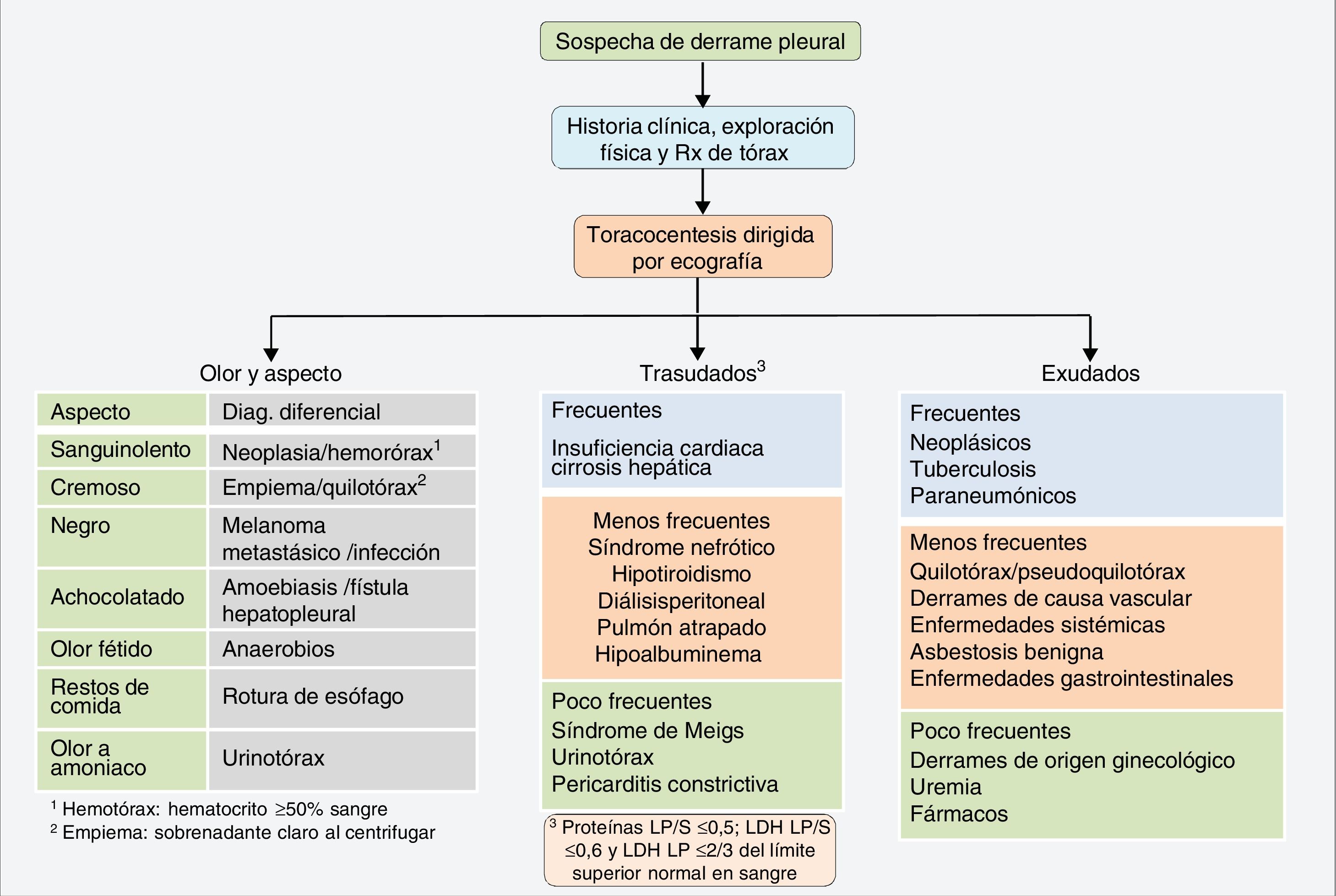
El derrame pleural (DP) es una situación frecuente en la práctica clínica, con una prevalencia de alrededor de 400 casos/100.000 habitantes. Aunque hay más de 50 enfermedades reconocidas que lo pueden causar1 (fig. 1), en una serie de más de 3.000 pacientes estudiados de forma consecutiva mediante una toracocentesis diagnóstica, más del 75% se debieron solamente a cuatro etiologías: insuficiencia cardiaca, neumonía, neoplasia y tuberculosis2.
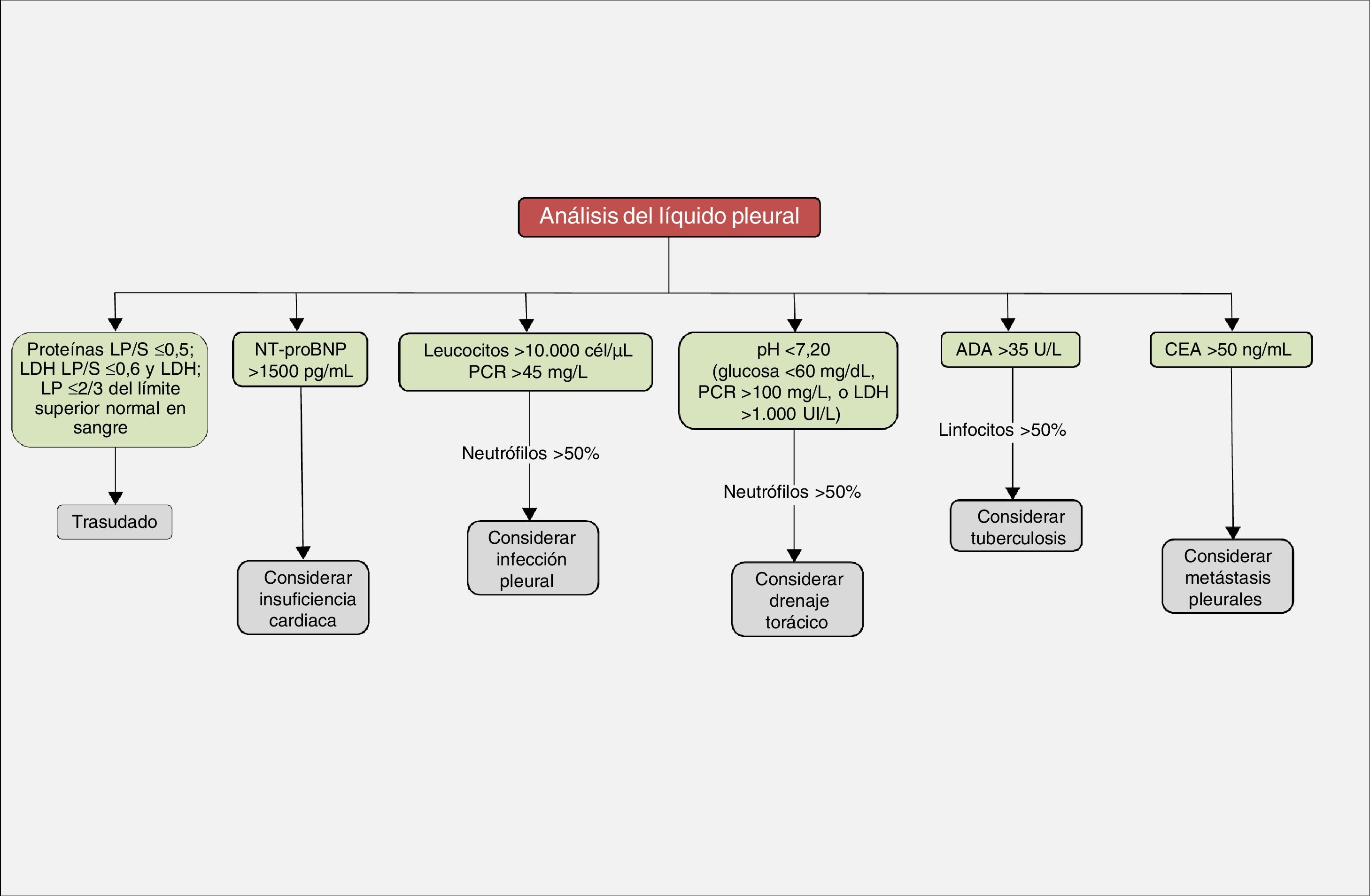
El DP es la acumulación de líquido en el espacio pleural, como consecuencia de un desequilibrio entre la formación de líquido y su absorción por la pleura, ya sea por un cambio en las presiones hidrostáticas/oncóticas entre los espacios y vasos pleurales (trasudados), ya sea por una alteración en las superficies pleurales, con la consiguiente alteración de la permeabilidad capilar (exudados). En los trasudados, la pleura no está afectada y el desequilibrio en las presiones hidrostáticas/oncóticas se produce en enfermedades como la insuficiencia cardiaca, cirrosis hepática, síndrome nefrótico, etc. (fig. 1). El diagnóstico suele ser clínico y generalmente no son necesarias más pruebas diagnósticas. En los exudados, la pleura está directamente afectada, lo que provoca un aumento de la permeabilidad capilar o una obstrucción del drenaje linfático. El líquido pleural (LP) contiene concentraciones más elevadas de solutos que los trasudados (proteínas, lactato deshidrogenasa [LDH]), el diagnóstico diferencial es más amplio (fig. 1) y suele ser necesario recurrir a más pruebas diagnósticas. Para diferenciarlos se utilizan los criterios de Light. Se considerará un exudado si el cociente de proteínas en LP/suero>0,5; el cociente LDH en LP/suero es>0,6 o la LDH en LP es>2/3 del límite normal superior en sangre3. Es suficiente con que cumpla uno solo de los criterios para que se considere un exudado. Sin embargo, su margen de error es amplio, ya que hasta un 25% de los trasudados pueden clasificarse erróneamente como exudados4.
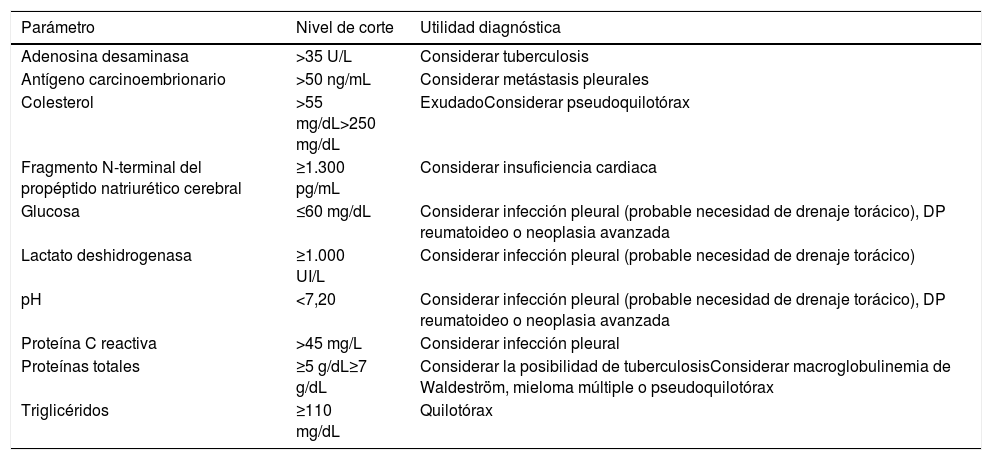
Los trasudados no suelen tener más de 1.000 células/μL y son, generalmente, de predominio linfocítico. Un recuento de más de 10.000 células/μL suele corresponder a una infección pleural, pancreatitis aguda o absceso hepático. Un número de células superior a 50.000/μL solo suele observarse en los DP infecciosos complicados y en empiemas. El tipo de célula existente en cada DP también es relevante5. Los neutrófilos son las células predominantes (≥50% del recuento celular) en enfermedades inflamatorias agudas como neumonías, pancreatitis, absceso subfrénico o embolia pulmonar. En las enfermedades de más tiempo de evolución, del tipo neoplasia o tuberculosis, el predominio celular será linfocítico (≥50%). La presencia de un DP eosinofílico (≥10%) no es un indicador de benignidad y su estudio deberá ser igual al de cualquier DP (tabla 1). Otras determinaciones bioquímicas útiles se muestran en la tabla 2.
Etiología de los exudados pleurales de acuerdo a su predominio celular
| Polimorfonucleares | Linfocitos | Eosinófilos |
|---|---|---|
| ParaneumónicosEmpiemaEmbolia pulmonar con infartoPancreatitis agudaAbsceso en abdomen superior | TuberculosisMalignosLinfomaQuilotóraxSíndrome de uñas amarillasSarcoidosisDerrame pleural reumatoideo | Asbestosis benignaEmbolia pulmonarFármacosMalignosHemotóraxTuberculosisSarcoidosis |
Otras determinaciones bioquímicas útiles en líquido pleural
| Parámetro | Nivel de corte | Utilidad diagnóstica |
|---|---|---|
| Adenosina desaminasa | >35 U/L | Considerar tuberculosis |
| Antígeno carcinoembrionario | >50 ng/mL | Considerar metástasis pleurales |
| Colesterol | >55 mg/dL>250 mg/dL | ExudadoConsiderar pseudoquilotórax |
| Fragmento N-terminal del propéptido natriurético cerebral | ≥1.300 pg/mL | Considerar insuficiencia cardiaca |
| Glucosa | ≤60 mg/dL | Considerar infección pleural (probable necesidad de drenaje torácico), DP reumatoideo o neoplasia avanzada |
| Lactato deshidrogenasa | ≥1.000 UI/L | Considerar infección pleural (probable necesidad de drenaje torácico) |
| pH | <7,20 | Considerar infección pleural (probable necesidad de drenaje torácico), DP reumatoideo o neoplasia avanzada |
| Proteína C reactiva | >45 mg/L | Considerar infección pleural |
| Proteínas totales | ≥5 g/dL≥7 g/dL | Considerar la posibilidad de tuberculosisConsiderar macroglobulinemia de Waldeström, mieloma múltiple o pseudoquilotórax |
| Triglicéridos | ≥110 mg/dL | Quilotórax |
El aspecto y el olor del líquido pueden proporcionar información relevante sobre la etiología del DP. Un líquido transparente o de color pajizo señala un trasudado, pero no se puede excluir un exudado paucicelular. Si el DP es hemático y no hay antecedentes de traumatismo, el diagnóstico más probable será neoplasia. Un hemotórax (hematocrito del líquido ≥50% del de la sangre) suele deberse a un traumatismo penetrante o a un procedimiento invasivo. Un líquido lechoso puede corresponder a un quilotórax, pseudoquilotórax o un empiema. Al centrifugar, el sobrenadante se vuelve claro en los últimos y permanece lechoso en los primeros6. Otros aspectos y olores se recogen en la figura 1.
Los pacientes con enfermedades oncológicas, crónicas o degenerativas avanzadas, múltiples comorbilidades y pronóstico limitado o en programas de cuidados paliativos son claros candidatos a desarrollar un DP. La introducción de la ecografía en Atención Primaria7 abre la puerta a la realización de toracocentesis en este nivel asistencial. El envejecimiento paulatino de la población, junto con el progresivo aumento de los pacientes crónicos, constituye un nuevo escenario a la hora de organizar los servicios sanitarios. La mayoría de las estrategias de atención a la cronicidad señalan que la Atención Primaria debe ser el eje sobre el que se articule la atención a estos enfermos8,9. En este contexto, muy probablemente asistiremos en los próximos años a la incorporación a la cartera de servicios de Atención Primaria y de equipos de soporte domiciliario de actividades y técnicas mínimamente invasivas, sencillas y seguras y a que se puedan llevar a cabo tanto en los propios domicilios de los enfermos como en los distintos centros de salud. La toracocentesis guiada por ecografía (para aumentar su rendimiento y minimizar su riesgo) será, sin duda, una de ellas.
Aunque en la actualidad existe poca evidencia al respecto, equipos de soporte de Atención Primaria han llevado a cabo toracocentesis terapéuticas con fines paliativos en el domicilio de los pacientes y su conclusión es que son útiles, seguras y poco complejas10,11.
Antes de hacer una toracocentesis no suele ser necesaria ninguna analítica ni se precisa premedicación pero, si existe riesgo de reacción vagal, puede inyectarse 1mg de atropina intramuscular o subcutánea 30 min antes de la prueba. Mediante la ecografía se identifica el DP (localización, profundidad, loculación y septos) y sirve de guía para la toracocentesis12. Una aguja de 21-22 G, una llave de 3vías y una jeringa de 50mL es suficiente para extraer el líquido de forma gradual y enviar al laboratorio para su análisis13. La toracocentesis terapéutica está indicada en aquellos pacientes con un DP crónico recidivante cuya expectativa de vida es corta, generalmente no mayor al mes, y su objetivo es aliviarle la disnea. Es el caso de los DP neoplásicos o los debidos a insuficiencia cardiaca o hepática refractarios al tratamiento14. La técnica es similar a la de la toracocentesis convencional, pero con una aguja más larga (5,5cm) que sirve de fiador al catéter de 14-18 G. Una vez extraídos 50 cc de LP para analizar, la aguja se retira, se avanza el catéter y se aspira el LP adicional con la propia jeringa, o con un sistema de bajas presiones negativas. No se recomienda extraer más de 1-1,5 L en 24 h para no causar un edema pulmonar ex vacuo13.
La complicación más frecuente de la toracocentesis es la reacción vagal. Bajo control ecográfico, el neumotórax es infrecuente y, si se produce, rara vez necesita drenaje torácico. La principal contraindicación es el riesgo de hemorragia. No suele haber problemas en pacientes con más de 50.000 plaquetas/μL. En enfermos en tratamiento con anticoagulantes, o con potencial riesgo de sangrado, la toracocentesis sigue siendo segura si se utilizan agujas de pequeño calibre.
Las muestras deben recogerse en frascos para microbiología (5mL), bioquímica (5mL) y citología (la mayor cantidad posible si se piensa en malignidad —al menos 40-60mL—)14 y enviarse a temperatura ambiente lo antes posible, pero si se prevé un retraso, pueden refrigerarse a 4°C hasta 14 días, sin deterioro en el rendimiento diagnóstico15.
En resumen, poner esta técnica en manos de equipos de Atención Primaria que atienden a pacientes con enfermedades avanzadas y complejas con dificultades para trasladarse a centros especializados lejanos a sus domicilios podría ser de utilidad para mejorar su sintomatología (toracocentesis terapéutica), o bien para contribuir, con base en los conocimientos del LP, a establecer la etiología del DP (fig. 2). Para ello será necesario poner en marcha nuevos modelos organizativos y circuitos asistenciales resolutivos, antes de acercar estas exploraciones a pie de cama de los pacientes.
FinanciaciónEste trabajo se ha realizado sin ningún tipo de beca.
Conflicto de interesesTodos los autores han firmado un documento de conflicto de intereses. Ninguno tiene conflicto de intereses.
Confirmamos que ninguno de los autores tiene conflicto de intereses