Introducción
El síndrome de Sjögren es un trastorno autoinmunitario caracterizado por una inflamación crónica de las glándulas exocrinas que afecta predominante pero no exclusivamente a las glándulas salivales y lagrimales, por una infiltración linfocitaria que altera su arquitectura normal y provoca su destrucción. En determinados pacientes pueden afectarse todas las glándulas exocrinas de las vías aéreas y digestivas superiores.
La incidencia de esta enfermedad autoinmune sistémica en otorrinolaringología es elevada, como han demostrado algunos estudios, pero debido a lo inespecífico de su clínica no se diagnostica en muchas ocasiones si no se realiza una anamnesis dirigida. El diagnóstico de este síndrome en la consulta del otorrinolaringólogo se realiza principalmente a partir de los signos secundarios a la xerostomía producida por la afección de las glándulas salivales. No obstante, es importante conocer las posibles alteraciones de este síndrome en las otras áreas de la otorrinolaringología: oído, nariz y senos paranasales y la faringolaringe.
Afección del oído
En las enfermedades autoinmunes no es infrecuente la afección del oído, y en el síndrome de Sjögren se ha descrito tanto primaria como asociada con otras enfermedades autoinmunes. Pueden estar implicadas todas las estructuras anatómicas del oído (interno, medio y externo), y ello puede traducirse en síntomas como otalgia, acúfenos, vértigo e hipoacusia, y en signos como sequedad de la piel del conducto auditivo, cera seca y ocupación del oído medio por mal funcionamiento de la trompa de Eustaquio (tabla 1).
Oído externo
Se ha descrito la afección del conducto auditivo externo y de la membrana timpánica como complicación del síndrome de Sjögren. En estos pacientes puede desarrollarse una otitis externa fibrosante, cuyo tratamiento consiste en la humectación del conducto auditivo externo y el tratamiento corticoideo tópico. En casos graves puede ser necesaria la práctica de una meatoplastia o reconstrucción del conducto para ampliarlo. Si la otitis afecta a la membrana timpánica puede ser necesaria una timpanoplastia tipo I.
También se ha descrito la inflamación del cartílago auricular en pacientes con síndrome de Sjögren primario, con una histología similar con la de la policondritis recidivante asociada a algunas enfermedades autoinmunes. La afección uni o bilateral del cartílago del pabellón auricular puede acompañarse de una afección dolorosa de los cartílagos nasales y edema cervical doloroso que mejora con tratamiento antiinflamatorio. En estos pacientes se ha puesto de manifiesto, mediante inmunofluorescencia indirecta, la presencia de anticuerpos contra cartílago humano.
Oído medio
En un estudio presentado por Doig et al con 22 pacientes diagnosticados de síndrome de Sjögren primario, seis tenían hipoacusia, de los que en cinco era de transmisión. La prevalencia de hipoacusia de conducción en pacientes con este síndrome sugiere que la sequedad de la mucosa del oído medio y la trompa de Eustaquio es un factor predisponente importante. A pesar de que en estos pacientes se describe como habitual la disfunción tubárica, el diagnóstico de otitis media es poco frecuente. Cuando ésta ocurre, puede ser útil para la recuperación de la audición la exéresis de las costras en la nasofaringe en la salida de la trompa de Eustaquio. Para los pacientes que además padecen artritis reumatoide, se ha descrito la posibilidad de cambios artríticos en los huesecillos del oído medio que aumenten la hipoacusia de transmisión, aunque parece una hipótesis poco probable.
Oído interno
La hipoacusia que se puede observar en estos pacientes puede ser neurosensorial, de transmisión o una combinación de ambas. En el síndrome de Sjögren se ha descrito una alta prevalencia de neuropatías craneales, aunque pocos estudios han buscado específicamente síntomas y signos de alteraciones del VIII par craneal. La hipoacusia y los acúfenos pueden aparecer aproximadamente en el 25% de los enfermos, presentándose de forma súbita en algunos de ellos.
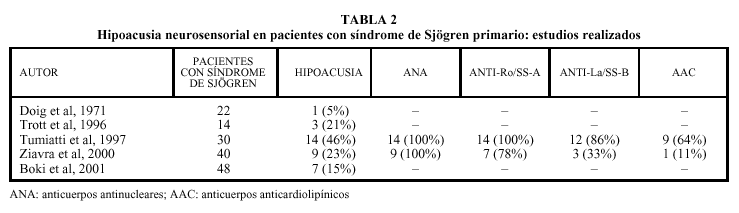
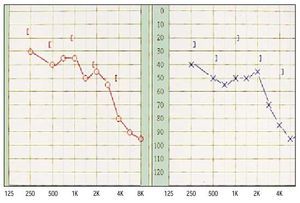
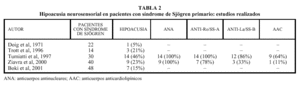
Hasta la fecha, cinco trabajos han analizado la existencia de hipoacusia neurosensorial en pacientes con síndrome de Sjögren (tabla 2). De los 154 pacientes estudiados en total, se detectó hipoacusia en 34 (22%), aunque los porcentajes oscilan de forma importante entre el 5 y el 46%. Esta amplia variación posiblemente esté en relación con el escaso número de pacientes estudiados en cada uno de los trabajos (entre 14 y 48 pacientes como máximo). Doig et al en 1971, fueron los primeros autores en estudiar, de forma específica la afección otorrinolaringológica en el síndrome de Sjögren, encontrando en sus pacientes un 6% de hipoacusia. Ya en 1996, Trott et al registraron una hipoacusia neurosensorial en el 21% de los pacientes diagnosticados con este síndrome, a partir del estudio prospectivo de 14 personas. Tumiatti et al encontraron una alta prevalencia de hipoacusia neurosensorial (46%) en 30 enfermos con síndrome de Sjögren, en comparación con sólo el 2,5% de 40 mujeres sanas que configuraron el grupo control. La hipoacusia no se pudo relacionar con la duración y gravedad del síndrome, la presencia de otras complicaciones extraglandulares o el tratamiento corticoideo previo, pero sí con una alta incidencia en algunos estudios de anticuerpos anticardiolipínicos que se han relacionado con hipoacusias súbitas en pacientes con otras enfermedades autoinmunes. Ziavra et al, en un trabajo más reciente, diagnosticaron hipoacusia en el 22,5% de 45 mujeres diagnosticadas con el síndrome de Sjögren, y la cóclea es la estructura afectada en todos los casos, predominantemente en frecuencias altas. Estos resultados son similares a los presentados por Boki et al a partir de un estudio de casos y controles con 48 pacientes con síndrome de Sjögren primario y en el que se demostraba significativamente una afec-ción de la audición a 4.000 y 8.000 Hz (fig. 1).
Fig. 1. Audiograma que evidencia una hipoacusia neurosensorial bilateral de predominio en 4.000 y 8.000 Hz. La curva continua de color rojo presenta el umbral auditivo por vía aérea del oído derecho y la de color azul la del oído izquierdo. Los paréntesis ponen de manifiesto los valores obtenidos en la vía ósea.
Se ha intentado relacionar la hipoacusia con otras manifestaciones clínicas de este síndrome, sin resultado. Respecto a los parámetros inmunológicos, ya hemos comentado la asociación descrita por Tumiatti et al con la presencia de anticuerpos anticardiolipínicos (el 64% de los pacientes con hipoacusia frente a sólo el 19% de los pacientes sin hipoacusia). Dicha asociación no ha sido corroborada por trabajos más recientes5. Tanto el estudio de Tumiatti et al como el de Ziavra et al detectan en los pacientes con síndrome de Sjögren e hipoacusia elevados porcentajes de anticuerpos como ANA (100%), anti-Ro/SS-A (78-100%) y anti-La/SS-B (33-86%), aunque sin demostrar diferencias significativas con el grupo de pacientes sin hipoacusia (tabla 2).
En las enfermedades autoinmunes los inmunocomplejos pueden causar hipoacusia al bloquear los capilares sanguíneos y causar isquemia o inflamación local en el oído interno. La lesión se situaría en la stria vascularis, donde el flujo sanguíneo es menor. La hipoacusia generalmente afecta a las frecuencias agudas, lo que representa una mayor afección de la espira basal de la cóclea.
En los síndromes de Sjögren secundarios a enfermedades reumáticas, la hipoacusia neurosensorial podría ser producida por fármacos ototóxicos como los salicilatos. La hipoacusia neurosensorial de origen autoinmune es una de los pocos tipos de pérdidas auditivas que pueden ser tratadas, con una buena respuesta a la terapia inmunosupresora.
La afección autoinmune del oído interno en el síndrome de Sjögren puede producir, además de una hipoacusia neurosensorial, una disfunción vestibular y la aparición de cuadros vertiginosos. Estos cuadros son infrecuentes y no han podido evidenciarse en otros estudios mediante electronistagmografía.
Afección nasosinusal
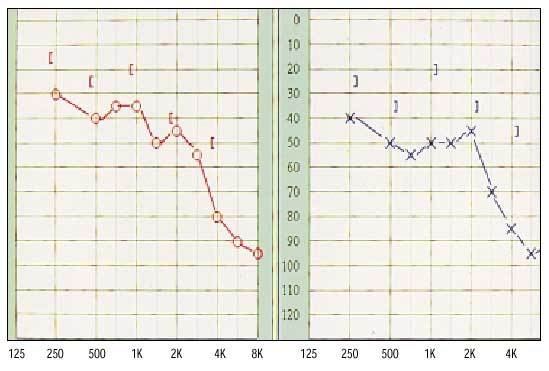
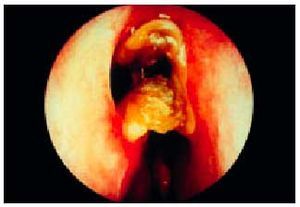
En el área nasosinusal, la clínica principal es la sensación de sequedad y la formación de costras de moco (fig. 2) que padece aproximadamente la sexta parte de los pacientes, aunque sólo puede objetivarse en la exploración de aproximadamente la mitad de ellos. La sequedad y atrofia de la mucosa nasal pueden explicar la frecuente aparición de epistaxis que se presenta, según las series, entre el 21 y el 35% de los pacientes diagnosticados con el síndrome de Sjögren. Como consecuencia de la atrofia de la mucosa y de los episodios de epistaxis, puede producirse una perforación del tabique nasal principalmente en la zona anterior. Para evitar estas complicaciones, los pacientes deben humedecer la nariz, de forma crónica al igual que lo hacen con los ojos y la boca; los cartílagos del tabique y el dorso nasal también pueden afectarse en los cuadros de policondritis recidivantes que se observan en algunos de los pacientes.
Fig. 2. Imagen de la fosa nasal izquierda de un paciente con rinitis y abundantes costras de moco.
Otra clínica frecuente que se observa en los pacientes con el este síndrome son las alteraciones del gusto y del olfato, que han podido ser cuantificadas. Las alteraciones en la secreción de la mucosa olfatoria parecen repercutir en déficit sensoriales olfatorios, pero no se ha podido demostrar una relación causa-efecto. La alteración de la secreción de la mucosa parece estar relacionada con la afección de las glándulas de Bowman. La mejoría del aspecto de la mucosa y de las secreciones nasales obtenida con el tratamiento se acompaña de una mejoría subjetiva del sentido del olfato, que pueden acercarse a valores normales.
La alteración de la secreción nasosinusal favorece la infección de estas estructuras y la aparición de sinusitis. En el estudio de las enfermedades autoinmunes nasales existe un mayor porcentaje de infecciones en aquellas que tienen asociado un síndrome seco por alteración de la mucosa. Por tanto, ante pacientes con rinitis con abundantes costras o sinusitis crónicas sin una causa predisponente o resistente al tratamiento, tenemos que descartar una enfermedad sistémica.
Afección faringolaríngea
Todas las vías respiratorias pueden verse afectadas por el síndrome de Sjögren. La sequedad de mucosas ocurre en la práctica totalidad de los pacientes a nivel de la faringe, además de la boca. Aunque frecuente, la lesión es leve y tiene poca importancia clínica en la mayoría de los casos. Los síntomas más frecuentes que pueden presentar los pacientes con síndrome de Sjögren son el prurito y la sensación de cuerpo extraño faríngeo secundaria a la sequedad de la mucosa faringolaríngea. Estos síntomas provocan frecuentemente carraspeo y tos seca. En algunas ocasiones el paciente puede referir el cuadro como doloroso.
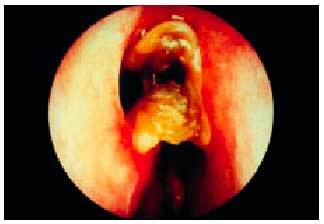
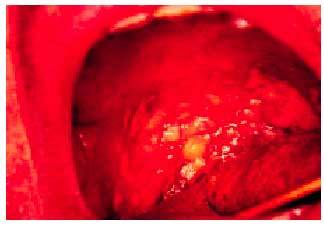
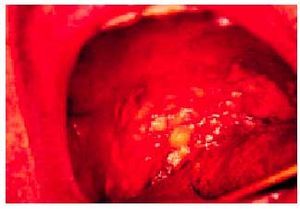
En la exploración se puede observar sequedad, eritema y mucosidad seca en la pared posterior faríngea, que puede cubrir la trompa de Eustaquio en la nasofaringe. Estas condiciones pueden favorecer la proliferación micótica en orofaringe (fig. 3).
Fig. 3. Candidiasis orofaríngea de predominio en paladar blando.
La sequedad faríngea provoca también problemas de disfagia que aparece aproximadamente en el 30% de los pacientes. Otros autores opinan que la disfagia se debe a que en un tercio de los pacientes con síndrome de Sjögren se observa una alteración de la peristalsis y que la disminución del flujo salival sólo agrava estos síntomas. Se ha descrito la asociación del síndrome de Sjögren con estenosis poscricoidea evidenciada con estudios baritados del tránsito esofágico, similares a las evidenciadas en algunos cuadros sideropénicos.
En la laringe, el síndrome de Sjögren puede progresar hacia la laringitis crónica en la que la mucosa laríngea está siempre seca y consecuentemente lleva a la atrofia. La sequedad de la mucosa puede provocar la aparición de mucosidad sobre las cuerdas vocales. La sequedad laríngea y la mucosidad pueden dificultar la correcta ondulación de la mucosa durante la fonación, lo que provoca la aparición de una disfonía en una quinta parte de los pacientes con síndrome de Sjögren. Algunos autores han descrito complicaciones neurológicas por afección del sistema nervioso central que se manifiesta por movimientos distónicos involuntarios de la boca y la laringe. También se ha descrito la aparición de tumoraciones laríngeas recidivantes en las bandas ventriculares, que obligan a practicar una exéresis quirúrgica y cuyo estudio histológico revela atrofia importante de las glándulas, con dilatación de sus ductos excretores e infiltración linfocítica.
Bibliografía general
Barrs DM, McDonal TJ, Duffy J. Sjögren's syndrome involving the larynx: report of a case. J Laryngol Otol 1979;93:933-6.
Boki KA, Ioannidis JP, Segas JV, Maragkoudakis PV, Petrou D, Adamopoulus GK, Moutsopoulos HM. How significant is sensorineural hearing loss in primary Sjögren's syndrome? J Rheumatol 2001;28:798-801.
Doig A, Whaley K, Dick WC, Nuki G, Williamson J, Buchanan WW. Otolaryngologycal aspects of Sjögren's syndrome. BMJ 1971;4:460-3.
Garcia-Carrasco M, Ramos-Casals M, Rosas J, Pallares L, Calvo-Alen J, Cervera R, et al. Primary Sjogren syndrome: clinical and immunologic disease patterns in a cohort of 400 patients. Medicine (Baltimore) 2002;81:270-80.
Henkin IR, Talal N, Larson AL, Mattern CFT. Abnormalities of taste an smell and Sjögren's syndrome. Ann Intern Med 1972;76:375-83.
Ito K, Yuyama S, Yamashita K, Hiiragi K, Tsukuda M, Ohishi K. A case report of Sjögren's syndrome with repeated false cord swelling. ORL J Otorhinolaryngol Relat Spec 1994;56:173-6.
Kontingen YT, Ramsay H, Hietanes J, Sorsa T, Nordstrom D. Otitis externa sicca/fibrotising external otitis (FEO) as a complication of Sjögren's syndrome. Clin Exp Rheumatol 2000;18:746-8.
Strome M, Kelly JH, Fried MP. Laringe. En: Strome M, Kelly JH, Fried MP, editores. Otorrinolaringología: diagnóstico y terapéutica. Barcelona: Salvat, 1987; p. 237.
Trott MS, Hughes GB, Calabrese LH, Barna BP, Nodar RH. Hearing and Sjögren's syndrome. Ear Nose Throat J 1996;75:666.
Tumiati B, Casoli P, Parmeggiani A. Hearing loss in the Sjögren's syndrome. Ann Intern Med 1997;126:450.
Ziavra N, Politi EN, Kastanioudakis I, Shevas A, Drosos AA. Hearing loss in Sjögren's syndrome patients: a comparative study. Clin Exp Rheumatol 2000;18:725-8.