Aunque se desconoce con exactitud su mecanismo de acción, los antipalúdicos (AP) poseen un efecto antiinflamatorio, inmunosupresor y modulador de la respuesta inmunitaria, lo que les confiere su eficacia en este tipo de enfermedades. Los AP pueden asociarse a otros fármacos antirreumáticos y actúan como ahorradores de corticoides. En un estudio prospectivo en pacientes con LES se observó que el grupo placebo requirió tres veces más corticoides que el grupo tratado con hidroxicloroquina. Son bien absorbidos y tolerados cuando son administrados por vía oral y su biodisponibilidad es buena. Además, excepto por su capacidad para provocar retinopatía, casi carecen de efectos secundarios graves, incluso durante el embarazo y la lactancia.
En los últimos años se han demostrado nuevas propiedades de los AP (efecto beneficioso sobre el perfil lipídico, efecto antitrombótico), que mejoran y completan su acción terapéutica en las enfermedades autoinmunes sistémicas y reumáticas. Todo ello hace de los AP uno de los grupos de fármacos más útiles, más seguros y más ampliamente utilizados en el tratamiento de muchas enfermedades reumáticas.
Los antipalúdicos (AP) fueron empleados por primera vez como tratamiento de una enfermedad autoinmune en 1894, cuando Payne utilizó con éxito la quinina para tratar a un paciente con lupus cutáneo1. Más tarde, durante la Segunda Guerra Mundial, se observó que los soldados destinados en el Pacífico con lupus eritematoso sistémico (LES) o artritis reumatoide (AR) experimentaban una sorprendente mejoría cuando tomaban AP para tratar o prevenir la malaria2. En 1951, Page3 destacó el relevante papel que desempeñaban los AP en el tratamiento del LES, aunque no fue hasta la década de los setenta cuando se realizaron los primeros estudios controlados en los que se demostró su eficacia4. Así pues, durante más de medio siglo los AP se han utilizado de manera generalizada en los pacientes con este tipo de enfermedades, sobre todo en el lupus y la AR5-7.
Características farmacocinéticas e interacciones medicamentosas
Los principales AP utilizados en las conectivopatías y en otras enfermedades reumatológicas son: cloroquina (Resochín®), hidroxicloroquina (Dolquine®) ambos derivados de la 4-aminoquinolina y, en menor grado, quinacrina (Atabrina®), derivada de la 9-aminocridina.
La absorción de estos fármacos es rápida y no se modifica con la ingestión de los alimentos. Su unión a las proteínas plasmáticas es alta y posee una buena biodisponibilidad. Las concentraciones máximas en sangre se alcanzan en pocas horas (2-8 h) tras su toma, pero tardan entre 4 semanas (cloroquina) y 6 meses (hidroxicloroquina) en llegar a una concentración estable en plasma tras una administración continuada. La vida media es muy larga (50 ± 16 días para la hidroxicloroquina) y se acumulan en múltiples órganos (hígado, bazo, riñón y pulmón) y en los tejidos ricos en melanina (piel, iris, coroides, retina). Aunque una parte del catabolismo se realiza en el hígado (15-30%), la mayor parte (50%) se produce en el riñón, por lo que en los casos de insuficiencia renal grave las dosis de AP se deben ajustar.
Pueden interaccionar con otros fármacos. La administración simultánea de AP con metotrexato en pacientes con AR modificó favorablemente la farmacocinética de este último y descendió la frecuencia de las alteraciones de las enzimas hepáticas observadas en estos pacientes, todo ello sin disminuir su actividad sobre la inmunidad8. Asimismo, los AP pueden elevar las concentraciones de la indometacina y la D-penicilamina9, favoreciendo la aparición de efectos secundarios, y pueden disminuir los valores de digoxina10. Se ha sugerido que el tabaco podría disminuir la eficacia de los AP en pacientes con lupus discoide y lupus cutáneo subagudo, si bien este extremo no se ha demostrado en el LES11,12.
Mecanismo de acción
Aunque todavía no se conoce con exactitud el o los mecanismos de acción de los AP, se ha sugerido que su principal vía de actuación podría consistir en la interrupción del procesamiento de los antígenos por parte del sistema monocítico-macrofágico y su presentación a los linfocitos T helper CD4+13. Este efecto podría residir en la capacidad que tienen los AP para aumentar el pH de los lisosomas estabilizando su membrana, alterando la degradación de los antígenos y dificultando la unión de éstos a las cadenas α y ß de las moléculas del sistema principal de histocompatibilidad (HLA) clase II.
Asimismo, los AP podrían inhibir la producción de ciertas citocinas (IL-1, 2 y 6, TNF-α) y del C3 del complemento, y dificultar con ello la quimiotaxis y la fagocitosis de los macrófagos y los neutrófilos, frenar la actividad natural killer, bloquear la respuesta mediada por los anticuerpos y disminuir la formación de complejos antígeno-anticuerpo (tabla 1).
Por último, a dosis terapéuticas poseen un efecto antiinflamatorio significativo al inhibir la fosfolipasa A2 y C, reduciendo la formación de ácido araquidónico, precursor de las prostaglandinas y de los leucotrienos14.
Dosificación de los antipalúdicos
En general, la dosis de inicio recomendada para la hidroxicloroquina es de 400 mg (6,5 mg/kg/día) en una sola dosis diaria o fraccionada en dos tomas. El efecto terapéutico suele comenzar aproximadamente a las 2-3 semanas y alcanza el pico máximo de eficacia a los 3-6 meses. Por lo que respecta a la cloroquina, la dosis de inicio recomendada oscila entre 250 y 500 mg al día (aproximadamente 4 mg/kg/día) y su efecto beneficioso es más rápido: 1-2 meses.
Aunque el tratamiento con AP no es en ningún caso urgente, se ha demostrado que el inicio del tratamiento con dosis superiores a las habitualmente empleadas en el tratamiento de mantenimiento se acompañó de un mayor grado de respuesta a las 6 semanas, si bien el uso de dosis excesivas provocó una mayor incidencia de efectos adversos gastrointestinales pero no oculares15.
Una vez alcanzado el efecto terapéutico deseado, y con objeto de minimizar la aparición de efectos adversos, se debe reducir la dosis progresivamente (cada 3-6 meses) hasta alcanzar la mínima necesaria para mantener la enfermedad bajo control. Lograda esta situación, el tratamiento puede prolongarse indefinidamente mientras no aparezcan signos de toxicidad.
Aunque hasta ahora se creía que los valores de AP en sangre no se correlacionaban con su eficacia, en un estudio reciente se ha demostrado una débil pero predecible relación entre la concentración en sangre de la desetilcloroquina (un metabolito de la hidroxicloroquina) y la eficacia del tratamiento en pacientes con AR. Además, se observó una asociación entre los efectos adversos gastrointestinales y las concentraciones elevadas de desetilcloroquina16. Aun así, la determinación de los valores de AP en sangre no es útil en la práctica clínica.
En los casos en que exista una respuesta insuficiente, sobre todo en pacientes con lupus y lesiones cutáneas rebeldes, la combinación de hidroxicloroquina o cloroquina con quinacrina, a dosis inferiores a las habituales o a días alternos, puede resultar útil17. Además, esta sinergia permite, en algunas ocasiones, evitar o reducir el uso de corticoides u otros fármacos inmunosupresores para el control de la enfermedad18.
Antipalúdicos en el lupus eritematoso sistémico y el síndrome antifosfolípido
Los AP forman parte del tratamiento del LES y el lupus cutáneo19 de forma generalizada desde hace más de 5 décadas, y es la conectivopatía que más se beneficia del uso de estos fármacos. En un estudio sobre una cohorte de pacientes con lupus (Hopkins Hospital), el 35% estaba recibiendo AP y el 50% había sido tratado con AP en algún momento de la enfermedad.
En 1975, Rudnicki et al, en un estudio retrospectivo, observaron un aumento de las recaídas entre los pacientes que no tomaban AP, y ya sugirieron que estos fármacos eran eficaces para reducir la actividad de la enfermedad4. Más recientemente, dos estudios prospectivos aleatorizados20,21 confirmaron que la suspensión de los AP provocaba un aumento significativo del número de brotes lúpicos, y que los pacientes no tratados con AP tenían 2,5 veces más probabilidad de presentar brotes y con mayor frecuencia.
Algunos autores consideran que los pacientes con LES deberían ser tratados desde el inicio de la enfermedad con AP, excepto los casos que se inician con una forma muy agresiva22. Esta opinión vendría avalada por los resultados de un reciente estudio prospectivo en el que se demuestra que el uso de hidroxicloroquina disminuye el daño corporal calculado mediante el índice SLICC/ACR en pacientes con LES tras un seguimiento medio de 45,7 meses23. Este efecto protector de la hidroxicloroquina podría deberse, entre otras causas, a su efecto sobre el ahorro de corticoides e inmunosupresores4,6 (disminuyendo así el daño producido por estos fármacos), a su efecto beneficioso sobre el perfil lipídico especialmente entre los pacientes que toman corticoides24 (reduciendo la aparición de arteriosclerosis y las complicaciones cardiovasculares asociadas a ésta), a su efecto protector contra la osteoporosis, al disminuir la pérdida de masa ósea25 y a su acción antitrombótica.
En general, los pacientes que más se benefician del tratamiento con AP son los que presentan una forma de lupus leve-moderado con afección de predominio cutáneo y articular26. En este sentido, existen pocas dudas acerca de la eficacia de los AP en el tratamiento de las lesiones cutáneas del lupus y constituye la parte más importante y eficaz de su indicación. Aunque se desconocen los mecanismos exactos mediante los cuales los AP ejercen su efecto beneficioso en la piel, se ha sugerido que, además de las acciones generales de inmunosupresión y antiinflamatorias ya comentadas, tendrían un efecto fotoprotector19. Se sabe que en algunos pacientes la exposición a la luz ultravioleta puede provocar un brote lúpico. Se ha demostrado que la cloroquina tópica protege contra el eritema provocado por la luz ultravioleta, y la quinacrina es capaz de inhibir la fotosensibilidad inducida por el láser, incrementando la tolerancia a la luz ultravioleta. Aunque no existen estudios prospectivos en pacientes con lupus, en un estudio controlado en pacientes con erupción lumínica polimorfa, la administración de 400 mg diarios de hidroxicloroquina demostró un significativo efecto fotoprotector27. Por todo ello, algunos autores proponen aumentar la dosis de AP durante el verano con objeto de mantener las manifestaciones cutáneas asociadas a la fotosensibilidad bajo control.
En cuanto a su efecto sobre los síntomas musculosqueléticos, Williams et al demostraron una mejoría importante de la afección articular valorada de forma subjetiva por los pacientes; sin embargo, no hubo diferencias significativas en otros parámetros articulares objetivos, probablemente por problemas metodológicos28. Debido a su efecto estimulante sobre la corteza cerebral, se ha sugerido que podrían ser útiles en algunas situaciones de disfunción cognitiva y en el tratamiento de la astenia asociada al LES, aunque en un estudio reciente se encontró un mayor índice de cansancio entre los pacientes que tomaban hidroxicloroquina29. Asimismo, pueden ser beneficiosos en el control de casos leves de serositis (pleuritis y, en menor grado, pericarditis) y podrían mejorar la sensación de malestar general y otros síntomas generales, como la fiebre y la pérdida de peso4,22.
Como se ha mencionado con anterioridad, los AP poseen un efecto antitrombótico al inhibir la agregación y la adhesión plaquetarias de una manera dependiente de la dosis30. En algunos estudios observacionales se ha demostrado este efecto antitrombótico en pacientes lúpicos tratados con AP31,32. En ratones previamente tratados con anticuerpos IgG anticardiolipina, a los que se les provocaba una trombosis venosa femoral, la administración de hidroxicloroquina causó una disminución significativa de la formación del trombo y una reducción de su tamaño33. La hidroxicloroquina también es capaz de revertir la expresión de marcadores de activación en plaquetas previamente activadas con anticuerpos antifosfolípido IgG humanos34. Además, se ha comunicado la eficacia de la cloroquina en el tratamiento de una trombocitopenia grave en el contexto de un síndrome antifosfolípido primario, resistente a dosis altas de corticoides, danazol y aspirina35. Por todo ello, algunos autores abogan por el uso de los AP como profilaxis antitrombótica en pacientes con anticuerpos antifosfolípido que todavía no han presentado ningún episodio trombótico36.
Artritis reumatoide
Los AP, sobre todo la hidroxicloroquina, son considerados fármacos razonablemente eficaces en el tratamiento de la AR37. Casi el 70% de los pacientes que reciben hidroxicloroquina experimentan una mejoría clínica de su enfermedad38. Sin embargo, su efecto beneficioso en monoterapia comparado con algunos fármacos antirreumáticos es menor. O'Dell et al39 compararon la eficacia de la minociclina y la hidroxicloroquina en 60 pacientes recientemente diagnosticados de AR seropositiva tratados con prednisona a dosis bajas. Los pacientes tratados con minociclina presentaron una mejoría superior tras 2 años de seguimiento que los que recibieron AP; además, los primeros recibieron al final del estudio una dosis menor de corticoides. Asimismo, en un metaanálisis de 3 estudios controlados, la hidroxicloroquina fue menos eficaz que el metotrexato en el tratamiento de la artritis reumatoide juvenil40. Por último, en un estudio en el que se interrogó a 375 reumatólogos norteamericanos sobre sus preferencias en el tratamiento de la AR, la hidroxicloroquina fue el fármaco prescrito con mayor frecuencia a los pacientes con AR leve, mientras que los que presentaban una actividad moderada-grave eran tratados en mayor medida con metotrexato41.
Sin embargo, los AP han demostrado ser más eficaces en combinación con otros fármacos antirreumáticos. Recientemente, en un estudio controlado y a doble ciego, se comparó la eficacia de metotrexato más hidroxicloroquina, metotrexato más sulfasalazina o la combinación de los tres fármacos, tras 2 años de seguimiento, en 171 pacientes con AR. La combinación de los tres fármacos fue algo superior a la combinación de metotrexato e hidroxicloroquina, y muy superior a la combinación de metotrexato más sulfasalazina, siendo todos los tratamientos bien tolerados42. En otro estudio, el retraso en 9 meses del inicio del tratamiento con hidroxicloroquina de la AR de diagnóstico reciente se correlacionó con una situación clínica peor a los 3 años de seguimiento, en comparación con los pacientes que recibieron hidroxicloroquina desde el inicio43.
Aun así, parece que los AP son menos eficaces en el control de las manifestaciones articulares en la AR que en el LES. Morand et al44 realizaron un estudio observacional sobre 37 pacientes con LES y 166 pacientes con AR tratados con 200-400 mg diarios de hidroxicloroquina. A los 24 meses de seguimiento, el 76% de los pacientes con LES continuaba tomando hidroxicloroquina, frente al 46% de los pacientes con AR. El principal motivo de abandono de la hidroxicloroquina entre los pacientes con AR fue su ineficacia, mientras que
en los pacientes con LES fue la remisión de la enfermedad. El abandono del tratamiento por efectos secundarios en ambos grupos fue escaso.
Síndrome de Sjögren
Hasta la fecha el tratamiento del síndrome de Sjögren (SS) es empírico y sintomático, y no se dispone por el momento de ningún tratamiento capaz de modificar el curso de la enfermedad45. La hidroxicloroquina se ha usado con éxito en el tratamiento de las artralgias, las mialgias y los síntomas generales de los enfermos con SS46. Sin embargo, se dispone de pocos estudios controlados, a largo plazo, en los que se valore la verdadera eficacia de los AP en el SS. Además, a menudo presentan problemas metodológicos: los criterios de clasificación de los pacientes con SS son distintos47, el tiempo de seguimiento probablemente es insuficiente48 y todos incluyen un escaso número de pacientes. Por ello, las conclusiones son difíciles y a veces contradictorias.
En un estudio abierto, Fox et al49 valoraron la eficacia de 200 mg diarios de hidroxicloroquina durante un año en 10 pacientes con SS primario. Los pacientes tratados con AP experimentaron una mejoría de las artralgias, las mialgias y la frecuencia con que presentaron inflamación de las glándulas salivares y los ganglios linfáticos, pero no mejoraron las manifestaciones clínicas relacionadas con la sequedad ocular y oral (el test de Schirmer y el flujo salival parotídeo fueron similares a los del grupo que recibió placebo). En cambio, sí observaron un descenso de la VSG, de la concentración de hipergammaglobulinemia y de algunos autoanticuerpos. Posteriormente, Kruize et al50 realizaron un estudio prospectivo, a doble ciego, en 19 pacientes con SS primario, 10 de ellos tratados con 400 mg diarios de hidroxicloroquina y 9 con placebo, con un seguimiento de 2 años. Los pacientes tratados con AP no presentaron una mejoría clínica significativa respecto a los tratados con placebo en ninguno de los parámetros estudiados (artromialgias, cansancio, sequedad ocular u oral e inflamación parotídea). Estos autores sí encontraron, en cambio, un descenso de la VSG y la hipergammaglobulinemia. Recientemente, Thisler et al48 valoraron en un estudio abierto, la eficacia de 200 mg diarios de hidroxicloroquina en 14 pacientes con SS primario seguidos durante 12 meses. Los pacientes tratados con AP sólo obtuvieron un discreto beneficio de las artralgias, la inflamaión parotídea y la xerostomía. Se observó, además, una disminución de algunos marcadores inflamatorios en la saliva como prueba del efecto antiinflamatorio e inmunorregulador de los AP en el SS. Sólo en un estudio retrospectivo realizado sobre 50 pacientes con SS primario seguidos durante 2 años, la hidroxicloroquina (6-7 mg/kg/día) provocó una sustancial mejoría de los síntomas oculares y orales, y de algunas manifestaciones sistémicas, como las artralgias y las mialgias47.
En definitiva, aunque los resultados son contradictorios, la hidroxicloroquina podría mejorar algunas manifestaciones extraglandulares (sobre todo las artralgias y mialgias), pero tendrían poco efecto sobre la sequedad ocular y oral. Asimismo, han demostrado tener un efecto inmunorregulador en el SS, cuyo significado y trascendencia sobre la actividad de la enfermedad y la prevención del desarrollo de linfomas, más frecuentes en estos pacientes, son inciertos. Es necesario realizar al respecto nuevos estudios controlados, a doble ciego, con un número suficiente de pacientes y con un seguimiento a muy largo plazo.
Uso de antipalúdicos en otras enfermedades autoinmunes sistémicas y reumatológicas
Aparte de las ya comentadas, los AP han sido empleados con mayor o menor éxito en poco menos de 30 enfermedades no infecciosas, muchas de ellas enfermedades autoinmunes sistémicas y reumatológicas51.
En los últimos 20 años, los AP han sido utilizados con éxito como tratamiento en combinación con corticoides en las manifestaciones cutáneas de la dermatomiositis52,53. Sin embargo, sólo se disponen de estudios no controlados que a menudo incluyen un pequeño número de casos. Incluso, recientemente se publicó un estudio retrospectivo sobre 42 pacientes con dermatomiositis tratados con hidroxicloroquina, en el que se observó una elevada incidencia de efectos adversos cutáneos (31%) en comparación con enfermos con LES54.
Se ha encontrado cierto efecto beneficioso de los AP en las lesiones cutáneas de la sarcoidosis, si bien no existen estudios controlados que respalden esta indicación55,56. Asimismo, se han informado casos aislados de tratamiento exitoso con AP en sinusitis57, neurosarcoidosis58 y afección pulmonar difusa59.
Los AP tienen una indicación controvertida en la artritis psoriásica. No existen estudios controlados que demuestren su eficacia, e incluso se ha atribuido a estos fármacos la exacerbación de las lesiones cutáneas60,61. Sin embargo, algunos estudios no controlados han demostrado un cierto efecto beneficioso61,62.
Aunque con poca evidencia, el uso de los AP en el reumatismo palindrómico no sólo parece mejorar la duración y la frecuencia de los episodios de artritis63, sino que podría disminuir el riesgo de desarrollo posterior de AR y otras conectivopatías64.
En un pequeño estudio controlado a doble ciego se observó un posible efecto beneficioso de la quinina en pacientes con espondilitis anquilopoyética, si bien este extremo debería confirmarse en estudios controlados con un número mayor de casos y un seguimiento a largo plazo65. Asimismo, la combinación de bajas dosis de corticoides e hidroxicloroquina fue eficaz en 3 pacientes con síndrome RS3PE66. También, en un estudio no controlado, la hidroxicloroquina resultó ser beneficiosa en 6 de 8 pacientes con osteoartritis erosiva resistente a tratamiento con AINE67.
Efectos secundarios de los antipalúdicos
A las dosis recomendadas, los AP son seguros y muy bien tolerados aunque, en general, la hidroxicloroquina es mejor tolerada que la cloroquina. Se considera que su toxicidad depende más de la dosis diaria que de la dosis acumulada o de la duración del tratamiento. Aun así, existen ciertas reacciones adversas asociadas al uso de AP que conviene reconocer.
Gastrointestinales
De todos los efectos adversos relacionados con el uso de AP, los gastrointestinales son los más frecuentes. Alrededor del 10% de los pacientes que toman hidroxicloroquina y el 20% de los que reciben cloroquina refieren anorexia, dolor abdominal, pirosis, náuseas, vómitos o diarrea. Estos síntomas suelen ser transitorios, desaparecen o mejoran con el tiempo o con la disminución de la dosis, y no suelen obligar a su retirada. Se puede mejorar su tolerancia administrándolos con las comidas. La afección hepática es excepcional.
Síntomas generales
Entre un 5 y un 10% de los pacientes que toman AP pueden presentar síntomas generales inespecíficos como molestias musculosqueléticas, síntomas seudogripales, astenia y, en ocasiones, pérdida de peso, que suelen remitir en una o dos semanas sin necesidad de suspender el tratamiento.
Alteraciones cutáneas
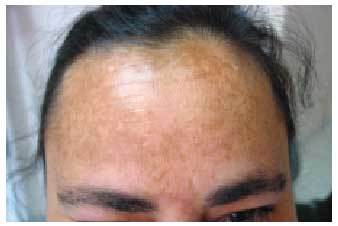
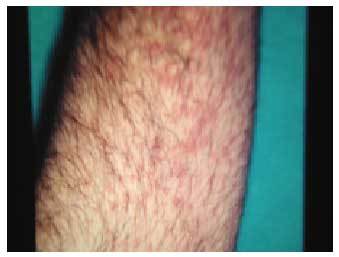
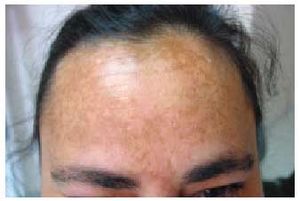
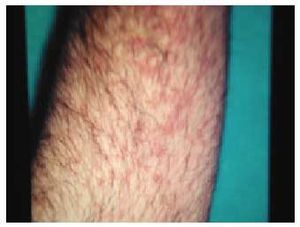
Los efectos adversos cutáneos son frecuentes, siendo los responsables de aproximadamente el 3% de los abandonos del tratamiento antipalúdico68. Incluyen una amplia variedad de manifestaciones. Los cambios en la pigmentación de la piel69 (fig. 1) y de las mucosas aparecen entre el 10 y el 25% de los pacientes que toman cloroquina y, en menor medida, entre los tratados con hidroxicloroquina. Aparecen tras períodos prolongados de tratamiento y suelen ser reversibles tras la retirada del mismo. La pigmentación de las encías es relativamente frecuente, así como la decoloración grisácea de la raíz del pelo, las pestañas, las cejas y la barba (efecto blanqueador). El lecho ungueal puede verse también difusamente pigmentado o pueden aparecer bandas transversales en las uñas. Otros efectos secundarios cutáneos de los AP son: prurito70-72, sequedad de la piel, alopecia, urticaria, brotes de psoriasis, erupciones morbiliformes (fig. 2) o maculopapulares y dermatitis exfoliativas.
Fig. 1. Pigmentación cutánea debida a un tratamiento con hidroxicloroquina.
Fig. 2. Exantema morbiliforme secundario a la toma de hidroxicloroquina.
Afección ocular
La toxicidad ocular es el efecto secundario más temido, aunque en la actualidad es muy infrecuente, dados los controles oftalmológicos periódicos que deben realizarse a los pacientes que toman AP. La toxicidad corneal es la complicación más frecuente (20-30%), pero tiene una escasa repercusión visual y revierte con la suspensión del tratamiento o la reducción de la dosis. Consiste en opacidades grisáceas puntiformes difusas en la córnea y se diagnostica mediante la lámpara de hendidura. Algunos autores sugieren que la toxicidad corneal podría servir como un signo de alerta de la posible aparición de una maculopatía posterior73. La toxicidad retiniana es la complicación ocular más importante, por cuanto puede conducir a una pérdida definitiva de la visión. Se desconoce su patogenia. En cualquier caso, dada la lenta excreción de estos fármacos, lo que favorece la acumulación a pesar del cese del tratamiento, es de suma importancia la detección precoz. Aunque tanto la cloroquina como la hidroxicloroquina pueden provocar maculopatía, ésta última es más segura y presenta una incidencia de retinotoxicidad menor74. En un estudio multicéntrico realizado sobre 1.207 pacientes, en uno solo (0,08%) se demostró retinopatía por hidroxicloroquina75. La maculopatía parece relacionada con la dosis diaria del fármaco, siendo rara, aunque posible76, su aparición con dosis diarias inferiores a 250 mg de cloroquina o 400 mg de hidroxicloroquina. En 1992, Bernstein77 revisó todos los casos de retinopatía por cloroquina publicados y concluyó que la mayoría ocurrió en pacientes que recibían dosis superiores a las recomendadas y, en una menor proporción, en pacientes que llevaban tomando cloroquina más de 10 años. Otros factores que determinan la aparición de la retinopatía son la edad y el estado de las funciones renal y hepática. Inicialmente, la retinopatía inducida por AP es asintomática, y tras varios años puede manifestarse clínicamente como dificultad para la lectura, fotofobia, visión lejana borrosa y defectos del campo visual78. La exploración del campo visual y de la visión cromática puede ayudar a su diagnóstico durante los estadios tempranos, constatándose la aparición de escotomas centrales o paracentrales para el color rojo. En la actualidad, no existe un tratamiento específico para la retinopatía asociada a los AP y la única medida efectiva consiste en la retirada del tratamiento ante la menor sospecha de inicio de esta complicación. Es muy importante no sobrepasar las dosis diarias establecidas como más seguras, así como realizar un examen oftalmológico periódico que incluya la medida de la agudeza visual, un examen del fondo de ojo y de la visión cromática, un test de Amsler y un examen con lámpara de hendidura antes de iniciar el tratamiento, y posteriormente con una periodicidad semestral o anual79, aunque otros autores abogan por revisiones trimestrales en el caso de la cloroquina.
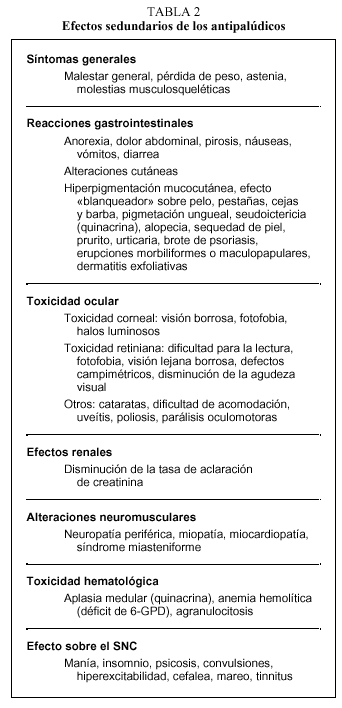
Otros efectos secundarios menos frecuentes asociados a los AP se recogen en la tabla 2.
Embarazo y lactancia
El uso de antipalúdicos durante el embarazo es controvertido. Todos ellos atraviesan la barrera placentaria y pueden depositarse en el feto. Sin embargo, se sabe que su retirada puede provocar, como en el caso del LES, un empeoramiento de la enfermedad que podría comprometer la vida del feto y la integridad de la madre.
Aunque no demasiado largas, existen en la bibliografía algunas series de pacientes embarazadas tratadas con antipalúdicos por malaria80 o por alguna conectivopatía81-83, en las que se demuestra que el uso de estos fármacos durante el embarazo es relativamente seguro. La incidencia de malformaciones congénitas relacionadas con los AP (como paladar hendido, sordera o retinopatía) se ha estimado en un 1,2-3,3%, frente a menos de un 1% en la población general80,82. Recientemente, se ha demostrado que el uso de AP durante el embarazo no supone un riesgo significativo de toxicidad ocular para el feto84. Por otro lado, la formación del ojo y el oído en el feto comienza hacia la octava semana. Dado que la vida media de los AP es muy larga, la retirada de estos fármacos inmediatamente antes de la concepción o en las primeras fases del embarazo, no evita la exposición del feto durante el período de mayor riesgo teratógeno. Por todo ello, algunos autores85,86 recomiendan mantener la terapia antipalúdica durante el embarazo (sobre todo la hidroxicloroquina) siempre que sea necesario, si bien este criterio no es unánime; otros optan por la retirada inmediata de cualquier AP mientras no existan datos concluyentes sobre su inocuidad en el feto y el recién nacido.
Alrededor del 1% de la dosis de AP administrada a la madre se excreta por la leche materna. Sin embargo, no parece que este hecho tenga implicaciones clínicas sobre el lactante, por lo que estaría indicado, en caso de necesidad, mantener el tratamiento con AP durante la lactancia.
*Otros autores y miembros del Grupo Lupus Virgen de las Nieves son:
L. Jáimez, J.D. Mediavilla, J.M. Osorio, J. Pasquau, P.L. Carrillo-Alascio, E. Milla, J. Muñoz-Alonso, C. Vera, D. Esteva, N. Navarrete, P. Macías, M. Guzmán-Úbeda, R. Cáliz, A. García-Sánchez, M.A. Ferrer, V. García-Mellado, J. Tercedor, E. García-Lora, J. Espelt, D. López-Segarra, J. Prieto, S. Medialdea, T. Muros y G. Piédrola