La mujer presenta durante la gestación cambios fisiológicos en la piel; también puede padecer determinadas dermatosis patológicas. En el presente artículo haremos una exposición de esos cambios fisiológicos, así como de las dermatosis que sólo ocurren en el embarazo, y de las denominadas dermatosis específicas del embarazo. Reconocer las principales dermatosis de la mujer embarazada, a través de la historia clínica y la exploración física, nos llevará a establecer el diagnóstico y un correcto tratamiento. La importancia de alguna de las dermatosis que a continuación presentamos radica en el riesgo que suponen tanto para la madre como para el feto.
Cambios fisiológicos durante el embarazo
Todas las gestantes sufren de manera más o menos acusada cambios en la piel y en los anejos cutáneos. La causa de los mismos es la nueva situación endocrina, hormonal e inmunológica que supone el embarazo. Estos cambios podemos agruparlos según las estructuras afectadas:
Cambios del tejido conjuntivo
Hasta un 90% de las embarazadas presentan estrías, sobre todo en el último trimestre de la gestación. Histológicamente, suponen una rotura de la dermis, bajo una epidermis intacta, cuyo resultado son líneas de piel atrófica, con trayectos lineales o zigzagueantes. La causa principal es mecánica, pero también se relaciona con causas endocrinas, dado que experimentalmente estas estrías no se reproducen con expansores de piel para reconstrucciones quirúrgicas. A esto se añaden factores genéticos, puesto que las mujeres con embarazos múltiples, en las que cabría esperar, desde el punto de vista endocrino y mecánico, la presencia de un gran número de estrías, en ocasiones no desarrollan ninguna. El tratamiento principal es el preventivo. Se han ensayado diversos fármacos, como retinoides, hidrolizados de colágeno y elastina, alfatocoferol, sin demostrar ninguno mejorías significativas. En los últimos años hay autores que proponen como tratamiento eficaz el láser de CO2.
Es relativamente frecuente la aparición de fibromas péndulos en el cuello, las axilas y los pliegues submamarios. Se han propuesto factores hormonales en su etiopatogenia.
Cambios vasculares
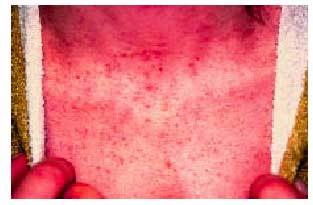
Se atribuyen a las elevadas cifras de estrógenos circulantes. Las arañas vasculares, o telangiectasias, suelen aparacer en la cara, la parte superior del tronco (fig. 1), las manos y los brazos, hacia el segundo o quinto mes de embarazo. Es frecuente que desaparezcan pasados
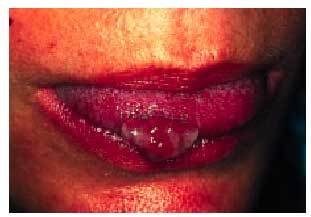
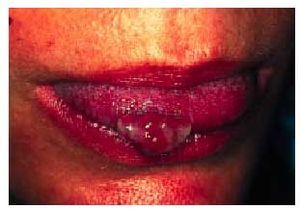
3 meses del parto. Hasta en el 70% de las gestantes de raza blanca y en el 30% de las de raza negra puede aparecer un eritema palmar, moteado, en eminencia tenar e hipotenar, que también suele desaparecer en el período posparto. Ocasionalmente, se presenta en la embarazada una gingivitis hipertrófica, y sobre la misma una proliferación capilar, que se conoce con el nombre de épulis del embarazo, granuloma gravidarum, o granuloma piógeno del embarazo. Puede aparecer junto a una pieza dental y sobre la superficie de la lengua (fig. 2) o de la mucosa bucal. No es raro que sangre con la práctica de la higiene bucal. No precisa tratamiento y la sintomatología mejora con la administración de vitamina C. Algunos factores hormonales y mecánicos contribuyen a la aparición de varices y hemorroides.
Fig. 1. Telangiectasias en la parte superior del tronco.
Fig. 2. Granuloma gravidarum.
Cambios pigmentarios
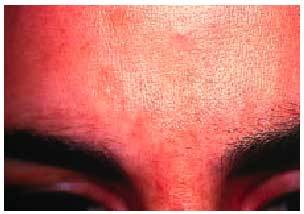
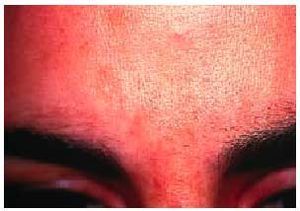
La mayoría de las embarazadas sufren un aumento generalizado de la pigmentación durante la gestación, que se atribuye a un aumento de los valores de hormona melanocito-estimulante, de estrógenos, y posiblemente de progesterona. La hiperpigmentación de la línea alba se denomina línea nigra, y el reborde hiperpigmentado de la aréola mamaria se conoce como aréola secundaria. También se puede hiperpigmentar la zona de la vulva, los labios menores, el ano y las axilas, careciendo de significación patológica. Entre un 13 y un 75% de las gestantes, según las series, presenta unas máculas irregulares, bien delimitadas, simétricas en la frente, las mejillas, el labio superior y el mentón, que se conocen con el nombre de melasma (fig. 3). Patogénicamente se asocia con un estímulo hormonal de la melanogénesis, y se ve claramente influenciado por la radiación ultravioleta, que suele suponer la persistencia del cuadro después del parto. Se han usado varios tratamientos blanqueantes, como la hidroquinona al 2 y al 4%, el ácido azelaico al 20%, el ácido kójico y el ácido ascórbico, a veces incluso asociados entre sí, o combinados con tretinoína, ácido glicólico e hidrocortisona, favoreciendo esto su penetración y eficacia. También se usan los peelings o exfoliaciones químicas, y el láser, principalmente el de rubí Q-switched. Durante y después del tratamiento es fundamental la fotoprotección; además, es la única recomendada durante el período de la gestación.
Fig. 3. Melasma.
Cambios en los anejos
Durante la gestación se produce un aumento de los folículos pilosos en la fase de anágeno; tras el parto, de forma compensatoria, se produce una entrada rápida de los mismos en la fase de telógeno, que desencadena una alopecia posparto. Este efluvio telogénico suele recuperarse pasados entre 3 y 12 meses del parto.
Las uñas pueden presentar onicólisis distal y surcos transversales. Algunas gestantes experimentan un aumento en la excreción de sebo. En cuanto a las glándulas sudoríparas, la mayoría de los autores indican un aumento de secreción de las ecrinas; sin embargo, existe controversia respecto a las apocrinas y, aunque la mayoría de los autores defiende que no existen cambios significativos, otros consideran que existe una disminución en la secreción de las mismas.
Dermatosis exclusivas del embarazo
Impétigo herpetiforme
Es una afección muy poco frecuente asociada al embarazo, principalmente descrita en el tercer trimestre. La mayoría de los autores coinciden en considerarla un brote de una variante de la psoriasis pustulosa en una persona predispuesta. Se manifiesta como placas simétricas eritematosas, con pústulas estériles en la periferia; comienza en los pliegues y se extiende centrífugamente. Se acompaña de una importante clínica
sistémica en la gestante: anorexia, náuseas, vómitos, diarrea, tetania y delirios. Estos síntomas acompañantes la diferencian de otras dermatosis del embarazo (tabla 1) que comentaremos a continuación. Analíticamente, pueden encontrarse bajas concentraciones de vitamina D e hipocalcemia. La histología es indistinguible de una psoriasis pustulosa, con pústulas subcórneas. El tratamiento consiste en la administración de corticoides sistémicos. Se ha descrito también el uso de PUVA y de retinoides en el período posparto. No supone riesgo para la madre, pero sí hay casos descritos de insuficiencia placentaria y aborto.
Colestasis intrahepática del embarazo
Es una entidad asociada generalmente al tercer trimestre de la gestación. Se relaciona con una disfunción de la vía biliar intrahepática, provocando un aumento de los ácidos biliares en la sangre, así como elevación del patrón de colestasis. Existe historia familiar hasta en un 50% de los casos. Se presenta como un prurito intratable, y excoriaciones secundarias al rascado, inespecíficas. El tratamiento es sintomático para el prurito, con antihistamínicos e hidratación. En casos graves se han usado resinas de intercambio iónico, como la colestiramina y el ácido ursodesoxicólico, así como UVB, con resultados variables.
Dermatosis específicas del embarazo
Herpes gestationis o penfigoide gestacional
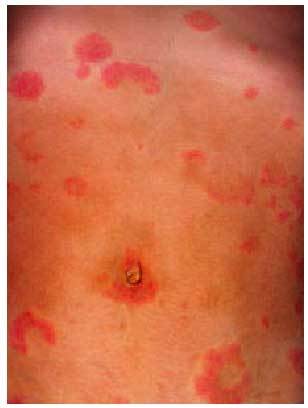
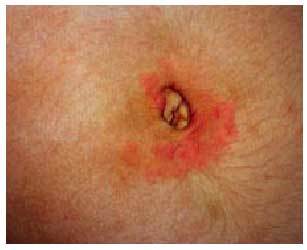
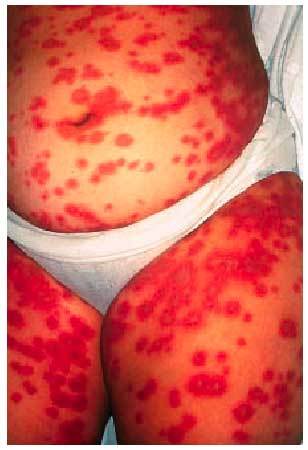
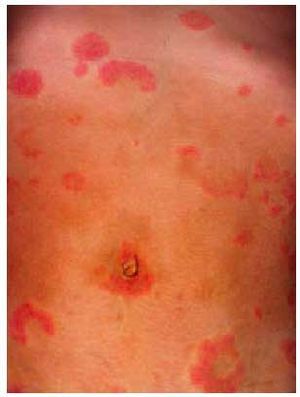
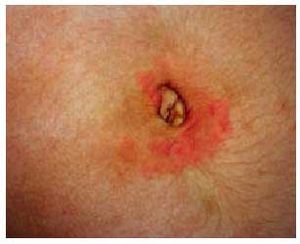
Su patogenia es conocida, y consiste en una reacción alogénica entre linfocitos maternos y el HLA paterno, ante una expresión aberrante de las moléculas de clase II del HLA placentario, dirigidos contra el antígeno de 180 kD de los hemidesmosomas de la membrana basal epidérmica, posiblemente como reacción cruzada con el antígeno 2 del penfigoide ampollar. Existe entre las pacientes una elevada incidencia de HLA-DR3 y HLA-DR4. Se presenta típicamente en el segundo o tercer trimestre del embarazo. Son placas urticariformes que hasta en un 87% de los casos se inician en la zona periumbilical (fig. 4), eritematosas, que pueden adquirir formas anulares policíclicas y desarrollar una erupción ampollar generalizada (fig. 5). En la anatomía patológica se observa una vesícula subepidérmica. La inmunofluorescencia de la piel perilesional demuestra un depósito lineal de C3 con o sin IgG a lo largo de la membrana basal. Se trata con corticoides sistémicos (0,5 mg/ kg/día de prednisona) y, debido a las posibles exacerbaciones posparto, algunos autores proponen aumentar la dosis de corticoides inmediatamente tras el alumbramiento. No existe riesgo vital para la gestante, pero se han descrito hasta en un 10% de los casos herpes gestationis neonatal, no aumentando la morbilidad ni la mortalidad del recién nacido. Suele recurrir en sucesivos embarazos, por lo que hay quienes desaconsejan nuevas gestaciones.
Fig. 4. Un 87% de los herpes gestationis comienza en la zona periumbilical.
Fig. 5. Herpes gestationis o penfigoide gestacional.
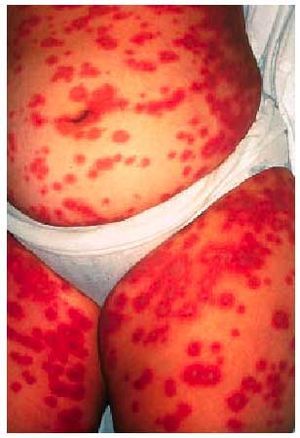
Erupción polimorfa del embarazo
Anteriormente se denominaba pápulas y placas pruriginosas urticariformes del embarazo (PUPPP). Es la más frecuente de las dermatosis, con una incidencia de una de cada 160-300 gestantes. Es más frecuente en primíparas y en el tercer trimestre de la gestación. Puede estar causada por la toma de anticonceptivos orales. Normalmente, se inicia como pápulas en el trayecto de las estrías del abdomen de la gestante, respetando la zona umbilical. Sin embargo, puede presentarse también como placas urticariformes, vesículas, lesiones purpúricas, lesiones en diana o lesiones policíclicas. La erupción puede extenderse a los muslos, las nalgas, los pechos y los brazos, respetando generalmente las palmas, las plantas y la cara. La presentación clínica sugiere una reacción de hipersensibilidad. Se han implicado también los estrógenos y la progesterona como factores etiopatogénicos en algunos casos. Algunos autores especulan que en la patogenia estaría implicada la rápida distensión de la pared abdominal, lo cual conlleva una lesión del tejido conectivo, de ahí su aparición sobre las estrías. El estudio anatomopatológico demuestra espongiosis e infiltración perivascular de células inflamatorias. Es importante realizar un estudio de inmunofluorescencia de la piel perilesional, para descartar, si resulta negativo, el penfigoide gestacional. Suele resolverse favorablemente en unas 6 semanas, incluso sin tratamiento; éste estará dirigido básicamente a controlar el prurito asociado, con emolientes, antihistamínicos y, a veces, corticoides tópicos. No suele recurrir en posteriores embarazos.
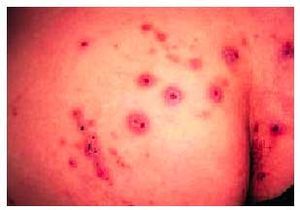
Prurigo del embarazo
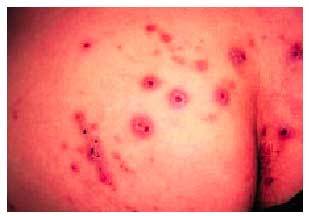
Se presenta en cualquier trimestre del embarazo. Son pápulas y nódulos eritematosos en la zona de extensión de las extremidades y, ocasionalmente, en el abdomen. Estas lesiones se asemejan al prurigo nodular de la paciente no embarazada (fig. 6). La causa es desconocida, pero frecuentemente se presenta en mujeres con un trasfondo atópico. El tratamiento ha de estar dirigido a aliviar los síntomas, con antihistamínicos y corticoides tópicos. Generalmente, se resuelve tras el parto (fig. 7).
Fig. 6. Herpes gestationis o penfigoide gestacional.
Fig. 7. Prurigo del embarazo.
Foliculitis del embarazo
Es una foliculitis aguda, asociada al segundo o tercer trimestre de la gestación. Se presenta en forma de pápulas foliculares generalizadas, sobre todo en el tronco y las extremidades, muy pruriginosas. Son pápulas estériles, que diferenciaremos de las foliculitis infecciosas por el cultivo. Algunos autores la consideran una forma de acné hormonal. El tratamiento es sintomático. No supone riesgo fetal ni materno. Se resuelve a las 2 o 3 semanas del parto.
Fármacos durante el embarazo
Existen grandes dificultades a la hora de identificar un efecto adverso teratógeno, ya que las mujeres gestantes, por razones éticas, como es obvio, quedan excluidas de los ensayos clínicos. Así, los únicos datos de que disponemos son los que extrapolamos de estudios realizados con animales, y aquellos casos individuales, recogidos en la bibliografía, de recién nacidos malformados asociados con la utilización de medicamentos durante la gestación.
Existe una clasificación que agrupa de la siguiente forma los riesgos de los fármacos durante la gestación:
Clase A. Los estudios controlados no demuestran ningún riesgo. Los estudios adecuados y bien controlados con mujeres gestantes no han podido demostrar ningún riesgo para el feto.
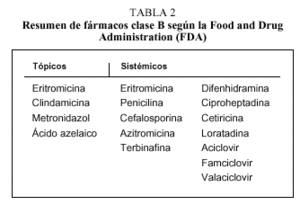
Clase B. No se han encontrado evidencias de riesgos en seres humanos. Los resultados con animales demuestran algún riesgo, pero los resultados con personas no; o si no se han realizado estudios adecuados con seres humanos, los resultados con animales son negativos (tabla 2).
Clase C. No pueden descartarse los riesgos. Carecemos de estudios con personas, y los pocos estudios realizados con animales demuestran un riesgo fetal. Sin embargo, las supuestas ventajas pueden justificar el riesgo potencial (tabla 3).
Clase D. Hay evidencias reales de riesgo. Los datos de la investigación, o posmarketing, demuestran la existencia de riesgo para el feto. Sin embargo, las supuestas ventajas pueden justificar el riesgo potencial.
Clase X. Contraindicados en la gestación. Los estudios experimentales realizados con animales o personas, o los informes de investigación o del período posmarketing, han demostrado riesgos fetales claramente superiores a cualquier posible ventaja para la paciente (tabla 4).
A continuación exponemos un breve resumen de los fármacos que se usan en dermatología y la valoración frente al embarazo que de ellos se hace en distintas fuentes.
Infecciones bacterianas
Parecen ser seguros tanto la mupirocina como la bacitracina (clase C), antibióticos tópicos muy usados en infecciones bacterianas; la cantidad absorbida es casi nula, por lo que no asocian efectos teratogénicos. Aun así, no hay estudios controlados al respecto. Continuando con los antibióticos tópicos, la clindamicina y la eritromicina pueden estar indicadas en el tratamiento del acné; tanto en administración oral como tópica no se ha demostrado teratogenicidad con el empleo de estos fármacos. El metronidazol tópico puede usarse en la rosácea y en las vaginosis bacterianas. La penicilinas se consideran fármacos seguros durante la gestación, así como las cefalosporinas, tanto en la gestación como en la lactancia. Conviene también conocer la capacidad malformativa fetal de la nitrofurantoína administrada por vía oral. Las sulfonamidas, consideradas como de clase B durante la mayor parte del período gestacional, se incluyen dentro de los fármacos de clase D (hay evidencias reales de riesgo) usados cerca del período a término, debido a que asocian un mayor riesgo en el feto de hiperbilirrubinemia y quernícterus. La sulfasalacina está contraindicada durante la lactancia porque puede asociar diarrea hemorrágica en los recién nacidos. Por sus efectos sobre los cartílagos de crecimiento, deben evitarse las quinolonas durante la gestación y la lactancia.
Infecciones fúngicas
Los derivados imidazólicos tópicos son los antimicóticos de elección durante la gestación. Clotrimazol y oxiconazol (clase B), econazol, miconazol, sertaconazol (clase C), tienen un espectro de acción muy amplio, siendo efectivos frente a tiñas, pitiriasis versicolor y candidiasis cutáneas. También se usan como antifúngicos por vía vaginal. El sulfuro de selenio no está indicado en el embarazo. Es muy empleado fuera de la gestación en el tratamiento de la pitiriasis versicolor; sin embargo, su considerable absorción sistémica al aplicarse sobre la piel dañada, o en grandes extensiones, se ha asociado en algunos estudios a teratogenicidad y abortos espontáneos; por ello, así como por la alternativa segura y efectiva de los imidazólicos, no se usa durante el embarazo.
Antiescabióticos
Al igual que fuera del período de la gestación, la permetrina al 5% es el fármaco de elección en la paciente embarazada. El hexacloruro de gammabenceno al 1% (lindano) está contraindicado durante la gestación y la lactancia. Es un insecticida organoclorado que puede absorberse por vía transcutánea y provocar teratogenicidad, así como un efecto neurotóxico.
Antivirales
Empleados por vía sistémica, el aciclovir y el penciclovir tienen un mínimo efecto teratogénico. En aplicación tópica, si ésta es correcta en cuanto a dosis y tiempo, las concentraciones en sangre que pueden detectarse son mínimas, pudiendo usarse sin problemas durante la gestación. Recomendamos usar el aciclovir por vía oral (clase B) sólo en infecciones diseminadas durante la gestación. La información es casi inexistente respecto a los nuevos antivirales, famciclovir y valaciclovir.
Contamos actualmente con varios tratamientos para las verrugas genitales que, sin embargo, en la gestante suponen un problema de más difícil abordaje. Dada la presencia de embriotoxicidad y anomalías fetales que han demostrado algunos estudios realizados en animales con la aplicación tópica de la resina de podofilino, consideramos que ésta no está indicada durante el embarazo. Algo similar podemos añadir sobre el 5-fluorouracilo. Existe un inmunomodulador local de reciente aparición para el tratamiento de las verrugas genitales. Su absorción sistémica es mínima cuando se aplica localmente; sin embargo, dada la poca experiencia clínica que disponemos hasta ahora en gestantes, recomendaríamos valorar el cociente riesgo-beneficio para su uso. Más aún cuando contamos con una alternativa útil e inocua como es la crioterapia.
Tratamientos para la psoriasis
La psoriasis tiene una prevalencia en la población del 2-3%, y empeora con relativa frecuencia durante el período gestacional. El ácido salicílico, empleado ampliamente como queratolítico en distintas fórmulas, no se debe administrar después de la semana 28, dada la asociación en ciertos trabajos de la toma regular de aspirina y el cierre prematuro del ductus arterial. Se recomienda evitar el uso tópico de antralinas y alquitranes en la paciente embarazada, por la posible absorción sistémica de subproductos mutagénicos. Con respecto a los análogos de la vitamina D (calcipotriol, tacalcitol), no hay estudios realizados en humanos pero sí en animales, que demuestran la presencia de toxicidad materna y anomalías esqueléticas en el feto. Los retinoides sistémicos, como la acitretina, usados en la psoriasis fuera del período gestacional, están absolutamente contraindicados durante el embarazo. Se consideran de clase X. Se asocian a malformaciones graves con un predominio de afección del sistema nervioso central, el área craneofacial --con alteraciones en los ojos, los oídos, el paladar y la zona facial--, malformaciones cardíacas, óseas y tímicas. Incluso si son usados por mujeres en edad fértil, es necesario añadir una pauta de anticonceptivos seguros. Por el tipo de enfermedades en que están indicados, los retinoides tópicos se usan ampliamente en mujeres en edad fértil. Revisten una cierta polémica, no en cuanto a su capacidad teratogénica, sino a la concentración plasmática que puedan alcanzar en aplicaciones tópicas. Esta concentración depende de variables como el número de veces de aplicación, la extensión a tratar, la cantidad de producto aplicado, la zona de piel enferma y, por tanto, en gran parte depende no sólo de la pauta dermatológica sino de la ejecución del tratamiento por parte de la paciente; por ello, recomendamos la contraindicación total de retinoides tópicos durante el embarazo.
La terapia PUVA está contraindicada durante la gestación. Existe un riesgo considerablemente aumentado de malformaciones fetales, y de muerte intrauterina.
Los corticoides sistémicos se han asociado en varios estudios a malformaciones fetales, como fisura del paladar, abortos espontáneos y retraso del crecimiento intrauterino. Por ello, deben evitarse durante el primer trimestre del embarazo. En el resto de la gestación, y siempre valorando el cociente riesgo-beneficio, los corticoides sistémicos de baja potencia se podrán aplicar durante breves períodos y nunca sobre grandes superficies corporales; de lo contrario, su absorción sistémica conllevará concentraciones plasmáticas cuyos efectos adversos serán similares a los observados en la posología oral.
Antipruriginosos
Los antihistamínicos de primera generación se consideran relativamente seguros durante la gestación. La difenhidramina está incluida dentro de los fármacos de clase B de la Food and Drug Administration (FDA). La administración de antihistamínicos en el tercer trimestre del embarazo, en el período entre la viabilidad y la madurez del feto, se ha asociado en algunos estudios con la fibroplasia retrolenticular en niños prematuros nacidos de madres que habían tomado antihistamínicos 2 semanas antes del parto. Con los antihistamínicos de segunda generación existe poca experiencia todavía, por lo que se recomienda precaución en su uso. Cetiricina y loratadina son los únicos antihistamínicos no sedantes que se incluyen en la clase B de la FDA.
Cosméticos
Son muchos los productos que, incluidos en la categoría de cosméticos, actúan como medicamentos. Un ejemplo claro lo constituye la tretinoína y otros retinoides ya mencionados anteriormente, los cuales se indican en el fotoenvejecimiento cutáneo. Por ello, creemos que en un futuro todos los cosméticos deberían incluir su composición completa en el prospecto.
Fotoprotectores
Los estudios hasta ahora realizados se limitan únicamente a animales. En general, la absorción de los fotoprotectores es mínima, dado que su función la realizan permaneciendo largo tiempo en la capa córnea; por tanto, su capacidad teratogénica es mínima también. Sin embargo, estudios realizados en roedores con ácido propenoico han demostrado un retraso del crecimiento intrauterino en los fetos.
Antitranspirantes
La mujer gestante que utiliza sales de aluminio como antitranspirante para superficies extensas (p. ej., manos y pies) debería suspenderlo, pues la administración oral o intravenosa de aluminio se ha asociado a teratogenicidad.
Tintes de pelo
Se pueden clasificar en tintes temporales, progresivos, semipermanentes o permanentes. Los tintes temporales son seguros durante el embarazo. Algunos estudios realizados con animales han puesto de manifiesto que la exposición de 4-nitrofenilendiamina a dosis superiores a 265 mg/kg/día daba lugar a malformaciones congénitas. Los tintes semipermanentes contienen nitroanilinas, nitrofenilendiaminas y nitroaminofenoles. Los tintes permanentes no han demostrado ningún potencial teratogénico. Los tintes progresivos, que casi únicamente son usados por los varones, no deben emplearlos las mujeres embarazadas, dado su contenido en plomo; éste puede depositarse en los tejidos inertes.
Analgésicos
Los AINE se consideran de clase B, excepto en el tercer trimestre, cerca del parto, que son incluidos en la clase D por su asociación con el oligohidramnios y la persistencia del ductus arterioso, puesta de manifiesto en distintos estudios. El acetaminofeno a corto plazo se considera seguro durante la gestación.
Anestésicos
La lidocaína, un anestésico local usado para la cirugía menor, puede usarse en todas las fases del embarazo. Atraviesa con facilidad la placenta, pero la concentración sérica alcanzada en el feto es mínima, siendo muy poco probable que provoque efectos adversos de teratogenicidad. Si lo usamos con adrenalina, con un efecto vasoconstrictor, dificultamos el paso transplacentario.
Bibliografía recomendada
Aronson IK, Bond S, Fiedler VC, Vomvouras S, Gruber D, Ruiz C. Pruritic urticarial papulesand plaques of pregnancy: clinical and immunopathologic observations in 57 patients. J Am Acad Dermatol 1998;39:933-9.
Beckett MA, Goldberg NS. Pruritic urticarial papules and plaques of pregnancy and skin distention. Arch Dermatol 1991;127:125-6.
Beveridge GW, Harkness RA, Livingston JRB. Impetigo herpetiformis in two sucessive pregnancies. Br J Dermatol 1966;78:106-12.
Borrego Hernando L, Iglesias Díez L. Dermatosis específicas del embarazo. Actualización. Actas Dermosifilogr 2002;93:159-67.
Elson ML. Use of tretinoin in female health practice. Int J Fertil Womens Med 1998;43:117-21.
Goh CL, Dlova CN. A retrospective study on the clinical presentation and treatment outcome of melasma in a tertiary dermatological referral centre in Singapore. Singapore Med J 1999;40:455-8.
González MC, Reyes H, Arrese M, Figueroa D, Lorca B, Andersen M, et al. Intrahepatic cholestasis of pregnancy in twin pregnancy. J Hepatol 1989;9:84-90.
Holmes RC, Black MM. The fetal prognosis in pemphigoid gestationis. Br J Dermatol 1984;110:67-72.
Jenkins RE, Shornick JK, Black MM. Pemphigoid gestationis. J Eur Acad Dermatol Veneorol 1993;2:163-73.
Karna P, Broecker AH. Neonatal herpes gestationis. J Pediatr 1991;119:299-301.
Karpati S, Stolz W, Meurer M, Braun-Falco O, Krieg T. Herpes gestationis: ultraestructural identification of the extracellular antigenic sitesin diseased skin using immunogold techniques. Br J Dermatol 191;125:317-24.
Lacroix I, Damase-Michel C, Lapeyre-Mestre M, Montastruc JL. Prescription of drugs during pregnancy in France. Lancet 2000; 356:1735-6.
Martínez-Frías M. Medicamentos durante el embarazo. En: Asociación Española de Derecho Farmacéutico, editor. Derecho a la información de los ciudadanos en los prospectos de los medicamentos. Madrid: Juste, 1999; p. 85-101.
Nouri K, Romagosa R, Chartier T, Bowes L, Spencer JM. Comparison of the 585 nm pulse dye laser and the short pulsed CO2 laser in the treatment of striae distensae in skin types IV and VI. Dermatol Surg 1999,25:368-70.
Pribanich S, Simpson FG, Held B, Yarbrough CL, White SN. Low dose tretinoin does not improve striae distensae: a doble-blind, placebo control study. Cutis 1994;54:121-4.
Roger D, Vaillant L, Fignon A, Pierre F, Bacq Y, Brechot JF, et al. Specific pruritic dermatoses of pregnancy: a prospective study of 3192 women. Arch Dermatol 1994;130:734-9.
Sasseville D, Wilkinson RD, Schnader JY. Dermatoses of pregnancy. Int J Dermatol 1981;20:223-41.
Saurat JH. Immunofluorescence biopsy for pruritic urticarial papules and plaques of pregnancy. J Am Acad Dermatol 1989;20:711.
Shornick JK. Dermatoses of pregnancy. Semin Cutan Med Surg 1998;17:172-81.
Stockton DL, Paller AS. Drug administration to the pregnant or lactating woman: a reference guide for dermatologists. J Am Acad Dermatol 1990;23:83-103.
Wilkinson SM, Buckler H, Wilkinson N, et al. Androgen levels in pruritic folliculitis of pregnancy. Clin Exp Dermatol 1995;20:234-6.
Winton GB, Lewis CW. Dermatoses of pregnancy. J Am Acad Dermatol 1982;6:977-98.