La legionelosis fue reconocida por primera vez en un importante brote epidémico de neumonía que afectó a los asistentes a la convención de la Legión americana, celebrada en un hotel de Filadelfia en 1976. Cinco meses después del brote fue identificado el agente etiológico Legionella pneumophila, un bacilo que no había sido reconocido hasta entonces como causa de enfermedad humana. El examen de especímenes, recogidos anteriormente, permitió asociar dicho agente con brotes epidémicos ocurridos cerca de treinta años antes.
Actualmente existe un elevado conocimiento de la bacteria causal, los mecanismnos patogénicos, la epidemiología de la infección, el tratamiento y la prevención de la enfermedad. A pesar de ello, es un proceso que sigue produciendo notables problemas de salud pública en muchos países, sin duda debido a que se asocia a la expansión de la tecnología y a las formas modernas de vida (intensa industrialización, expansión de los sistemas de refrigeración, estancia en hoteles), que no han ido acompañadas de una aplicación paralela de las debidas medidas de higiene y sanidad ambiental.
Expresión clínica y formas epidemiológicas de presentación
La legionelosis es una enfermedad aguda producida por la bacteria Legionella, que presenta dos cuadros bien diferenciados tanto clínica como epidemiológicamente: la enfermedad del legionario y la fiebre de Pontiac.
La enfermedad del legionario. Consiste en un síndrome de neumonía de espectro clínico variable, que puede cursar desde formas leves hasta enfermedad grave con insuficiencia respiratoria y fracaso multiorgánico. Los pacientes con mayor predisposición a la enfermedad son los tratados con inmunosupresores o que han recibido trasplante de órgano sólido, aunque la mayoría de casos ocurren en individuos de edad avanzada, fumadores o con broncopatía crónica. El período de incubación es de 2 a 10 días; en general, suele ser de 5 a 6 días1.
Se presenta en forma de casos esporádicos y de brotes epidémicos. Es habitual diferenciar el entorno comunitario del hospitalario en que se presentan estas dos formas. En la comunidad, gran parte de los casos son esporádicos sin relación con brotes conocidos. Algunos brotes son de aparición puntual o explosiva, mientras que otros tienen una evolución de meses o años2. Se han documentado muchos brotes prolongados en hospitales y hoteles, que han sido atribuidos a la contaminación de los sistemas de abastecimiento de agua por Legionella; también han ocurrido numerosos brotes de este tipo en el ámbito comunitario, algunos de ellos de notable relevancia sanitaria y social; en general se deben a torres de refrigeración contaminadas que mediante la emisión de aerosoles diseminan el microorganismo. Una forma de presentación frecuente en la actualidad es la aparición de casos o brotes sucesivos en el tiempo en entornos hospitalarios; dicha situación debería ser designada como legionelosis nosocomial endémica3.
Los casos de aparición esporádica en la comunidad constituyen la presentación más frecuente de la enfermedad, le siguen en orden de frecuencia los que forman parte de brotes comunitarios, y figuran en tercera posición los de origen nosocomial. Los casos adquiridos en viajes pueden ser incluidos en brotes comunitarios o bien clasificados como esporádicos de la comunidad, aunque también pueden considerarse como un grupo característico aparte.
La fiebre de Pontiac. Es un proceso epidémico de carácter leve parecido a una gripe, con fiebre, artromialgias y afectación general. Tiene un curso autolimitado: los enfermos se recuperan espontáneamente sin tratamiento en 2-5 días. Afecta a personas jóvenes sanas. Su incidencia conocida es muy baja, siendo mucho menos frecuente que la enfermedad del legionario. Los brotes se han descrito en trabajadores de oficinas e industrias y en usuarios de baños y jacuzzi. Posiblemente existen formas esporádicas, aunque la falta de una prueba diagnóstica específica dificulta su reconocimiento. El período de incubación es de 5 a 66 horas; en general, de 24 a 48 horas1.
Distribución geográfica y estacional
Se han descrito casos de la enfermedad del legionario en África, América del Norte y del Sur, Australia, Europa y Japón por lo que puede decirse que se distribuye por todo el mundo. Ahora bien, como los edificios que cuentan con un circuito complejo de suministro de agua y con sistemas de acondicionamiento de aire se hallan más extendidos en los países desarrollados, es en ellos donde la enfermedad presenta una mayor incidencia y constituye un notable problema de salud pública.
En España se han descrito casos de la enfermedad en prácticamente toda la geografía peninsular e insular, aunque la distribución entre comunidades autónomas y provincias es muy heterogénea. En Europa, en los últimos años se han producido grandes brotes epidémicos en Países Bajos, Bélgica, y singularmente en España. La mitad, aproximadamente, de los casos declarados en Inglaterra y otros países del norte de Europa, han sido adquiridos en viajes a otros países, fundamentalmente del sur de Europa, como España, Turquía, Francia, Italia y Grecia. La tasa más alta de legionelosis en visitantes la posee Turquía4. En Estados Unidos la incidencia de legionelosis es muy variable, siendo más elevada en algunos estados del nordeste5. En todo caso debe tenerse en cuenta que el conocimiento de la distribución de la enfermedad se halla sin duda relacionado con las técnicas usadas para su diagnóstico y notificación.
Aunque hay notificaciones de la enfermedad durante todo el año, la mayor parte de los casos esporádicos y brotes comunitarios se produce a finales del verano y el otoño, debido presumiblemente a que el microorganismo prolifera mejor en los reservorios acuáticos durante los meses de calor. En los hospitales, los casos y brotes, que fundamentalmente se asocian a los circuitos de distribución de agua sanitaria caliente, se pueden producir durante todo el año.
Incidencia, letalidad y prevalencia
Incidencia. No se conoce bien la incidencia de la enfermedad del legionario, puesto que los estudios realizados en grupos poblacionales representativos han sido escasos hasta ahora. Las estimaciones disponibles muestran un rango entre 2 y 20 casos por 100.000 habitantes año. En un estudio prospectivo de una cobertura del 10% de la población de Seattle la incidencia anual se estimó en 12 casos por 100.000 habitantes6. En Nottingham se observó una incidencia mucho más baja, de 1,9 por 100.000 habitantes7, mientras que en el estudio prospectivo de Ohio la incidencia fue de 6 por 100.000 adultos8.
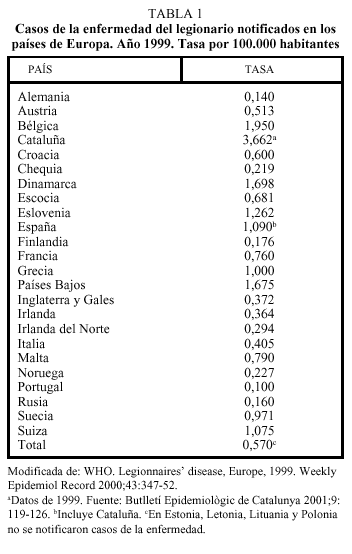
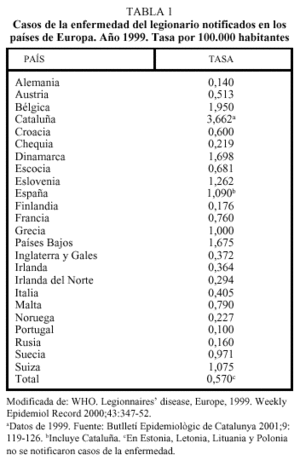
En España, en la mayoría de países de Europa y en EE.UU., la declaración de casos de legionelosis aumentó de forma notable en la década de los noventa, debido a las mejoras en las técnicas diagnósticas, especialmente por la introducción de la detección del antígeno en orina, y al perfeccionamiento de los sistemas de vigilancia. El CDC estima que cada año se producen en los EE.UU. entre 10.000 y 20.000 casos de la enfermedad, de los que se declaran a las autoridades entre 1.500 y 1.800, el 23% de los cuales, aproximadamente, son nosocomiales9. En el año 1999, se notificaron en Cataluña10, España y Europa4, 221, 430 y 2260 casos, respectivamente, y las tasas de incidencia fueron: 3,66 casos por 100.000 habitantes, 1,09 y 0,57, respectivamente (tabla 1). En Europa, en dicho año, después de la elevada tasa de Cataluña, los países con tasas más altas fueron Bélgica, Dinamarca, Países Bajos, Eslovenia, Suiza y Grecia; el 9,1% de los casos declarados fueron nosocomiales, el 31,8% pertenecían a brotes comunitarios, el 13,5% se hallaban asociados a viajes al extranjero, el 7,1% a viajes en el país de residencia y el 38,6% restante, eran esporádicos. En Inglaterra y Gales se declaran cada año unos 200 casos. En el año 2000 fueron declarados 610 casos en Francia, de los que el 20% eran nosocomiales, el 9% se asociaban a estancias en hoteles y campings, el 5% a viajes al extranjero y la mayoría eran esporádicos; la incidencia anual notificada fue de 1 caso por 100.000, si bien se estima que solamente se declararon el 33% de los casos11. La incidencia es mucho más elevada en las zonas urbanas, suburbanas e industriales, que en las rurales.
En los varones, la tasa de incidencia suele ser mucho más elevada, prácticamente más del doble que en las mujeres. Además, la incidencia se acumula en edades avanzadas: más de la mitad de los casos se declaran en personas de más de 60 años y más del 90% en las mayores de 30 años. En los jóvenes y niños es poco frecuente.
La tasa de ataque suele ser baja en los brotes de la enfermedad del legionario (del 1 al 5% de la población expuesta) y muy elevada en la fiebre de Pontiac (más del 90%)12.
Letalidad. En las neumonías por legionela la letalidad se sitúa, en general, entre el 10 y el 30%. Son determinantes de la misma: las características del inóculo, la especie y serogrupo del microorganismo, la adquisición comunitaria o nosocomial, los factores individuales de susceptibilidad y el tratamiento administrado al inicio del proceso. Las neumonías nosocomiales suelen tener mayor letalidad que las comunitarias.
En el destacado estudio sobre los casos notificados al CDC de los EEUU entre 1980 y 1989, la letalidad global fue del 25%, siendo del 20% en los que la adquirieron en la comunidad y del 40% en los enfermos con neumonía nosocomial. La letalidad asociada a L. pneumophila serogrupo 1 fue del 35,6%, la del serogrupo 6, del 62,9% y la de L. micdadei, del 8,6%5. Se observó que factores como inmunosupresión, edad avanzada, insuficiencia renal terminal, cáncer y adquisición nosocomial de la enfermedad, se asociaban de forma independiente a una evolución fatal. Debe destacarse la elevada letalidad de esta serie, debido seguramente al hecho de que en los EE.UU. en la década de los ochenta, sólo se diagnosticaban y/o declaraban los casos graves. De todas formas, en brotes nosocomiales descritos recientemente en los EE.UU., se han publicado cifras de letalidad del 35 y 48% (12,13). Esta última cifra procede de un centro de trasplantes en el que en 8 de los 12 fallecidos la enfermedad se diagnosticó en especímenes necrópsicos; además, en los pacientes trasplantados el riesgo de muerte por legionelosis es más elevado que en el resto de pacientes inmunodeprimidos.
Prevalencia de la infección. Se ha sugerido que el agente puede producir una infección respiratoria subclínica o moderada de tipo inespecífico, pues en adultos sin historia de neumonía puede detectarse una elevada prevalencia de anticuerpos frente a gran variedad de especies y serogrupos de legionela. Los anticuerpos detectados responden a una serorreactividad específica frente a legionela, y no pueden atribuirse a una reacción cruzada con otras bacterias. En algunas encuestas seroepidemiológicas realizadas en poblaciones de diferentes países, se ha observado que del 1 al 20% de los adultos presentan anticuerpos frente a serogrupos de L. pneumophila y otras especies, a una dilución 1:128 o mayor14-16. En el brote inicial de la enfermedad del legionario, en Filadelfia, en el año 1976, el 44% de los trabajadores estudiados del hotel afectado mostraban una serología positiva sin haber presentado la enfermedad ni síntomas aparentes17. En un brote hospitalario de larga duración se estudió de manera prospectiva un grupo de pacientes y personal del centro, observándose la seroconversión en 15 personas, de las cuales 8 no habían manifestado ninguna enfermedad respiratoria18. En los adultos sanos las infecciones subclínicas son frecuentes. Se desconoce si las infecciones previas protegen frente a nuevas infecciones por idéntico serogrupo de legionela o por uno nuevo.
Cadena epidemiológica
Microorganismo
Hasta ahora han sido reconocidos 35 especies de Legionella y 48 serogrupos. De los 18 serogrupos reconocidos de L. pneumophila, 1 y 6 son los que con mayor frecuencia causan enfermedad. Además de este serogrupo, destacan como patógenas las especies L. micdadei, L. bozemanii, L. dumoffii, L. longbeachae, que han sido aisladas principalmente en pacientes inmunodeprimidos con neumonía.
Las legionelas tienen la estructura característica de los bacilos gramnegativos, con una dimensión de 0,3 a 0,9 µm de ancho y 1,5 a 5 µm de largo. Presentan desde formas cocoides o bacilares en los tejidos a formas muy alargadas en algunos cultivos. Son mótiles (excepto L. oakridgensis) por uno o más flagelos polares o subpolares, y en ellas se ha demostrado la presencia de fímbrias y de una estructura polisacárida acídica extracelular.
Se tiñen muy tenuemente con la coloración de Gram, en cambio lo hacen bien con el método de Giménez y las técnicas argénticas. No son alcohol-ácido-resistentes, aunque L. micdadei lo es débilmente en muestras clínicas o de tejidos. Desde el punto de vista metabólico son aerobias estrictas, capnófilas, escasamente sacarolíticas y en general metabólicamente poco activas. La principal fuente de energía la obtienen de los aminoácidos, algunos de los cuales son esenciales para su crecimiento. Si bien se desarrollan muy bien en presencia de hierro, éste no es un factor esencial, aunque sí lo es la cisteina para el primoaislamiento.
Reservorio
Legionella se considera una bacteria ambiental, pues su hábitat natural o reservorio primario son las aguas superficiales, como lagos y ríos. No se ha aislado en agua salada. Muchos de los aislamientos obtenidos de muestras naturales son de especies o serogrupos no asociados a afección humana.
La dificultad para obtener el crecimiento de Legionella en medios de cultivo contrasta con su ubicuidad en el medio acuático natural, en el que se halla presente en concentraciones muy bajas. La legionela consigue nutrientes en su hábitat natural porque son aportados por otros microorganismos, como amebas, protozoos ciliados y otros, que en el caso de los continentes artificiales como cañerías, acumuladores e interiores de las torres de refrigeración, se hallan dentro de biocapas («biofilms») que recubren las superficies. Las amebas y los protozoos se consideran huéspedes naturales y amplificadores de Legionella spp. La ecología y la supervivencia de Legionella en el medio acuático están muy relacionadas con estos microorganismos en los que la bacteria es capaz de proliferar, sobrevivir y resistir factores ambientales hostiles. La interacción entre legionela y un protozoo o ameba genera un endosimbionte que proporciona al huésped aminoácidos y otros factores de crecimiento que la mayoría de protozoos necesitan como nutrientes. En contrapartida, la capacidad que posee la legionela para vivir intracelularmente le ayuda a soportar condiciones adversas. Así, cuando se siembra L. pneumophila en un medio que contiene alga de un azul verdoso, es capaz de replicarse sometida a grandes variaciones de temperatura y pH19. La bacteria requiere factores de virulencia para infectar a otros microorganismos. Seguramente, la liberación de substratos orgánicos originados en la fotosíntesis proporciona nutrientes esenciales para la multiplicación de la bacteria. Hasta ahora se conocen cinco géneros de amebas (Acanthamoeba, Naegleria, Hartmannella, Vahlkampfia y Echinamoeba) y un género de protozoo (Tetrahymena) capaces de soportar el crecimiento intracelular de L. pneumophila. Otras especies de legionela muestran un número inferior de huéspedes. Los sistemas de distribución de agua sanitaria frecuentemente se hallan colonizados por Hartmannella vermiformis. Las biocapas incorporan algas y microorganismos (flavobacterias y cianobacterias) que se adhieren a las paredes de las conducciones y depósitos de agua.
La formación de las biocapas se ve favorecida por el estancamiento de agua, la existencia de ramales o tramos ciegos o de uso infrecuente, la disminución del flujo de agua, los materiales usados en la construcción de las cañerías o de las bombas, y la temperatura del agua. Se considera que la formación de biocapas es una adaptación a la precariedad en nutrientes del agua sanitaria. Los microorganismos que forman las biocapas comparten nutrientes procedentes de materiales de la superficie de la tubería o de la fase acuosa. Entre los géneros bacterianos que proporcionan factores de crecimiento a la legionela figuran Pseudomonas spp., Acinetobacter spp., Flavobacterium y Alcaligenes spp. El material en que crecen los microorganismos incluye productos de corrosión del metal. La biocapa facilita así el crecimiento bacteriano de legionela y la protege frente a la acción de los biocidas y las técnicas de prevención aplicadas contra ella, como son el hipercalentamiento o la hipercloración20.
Las bacterias del género Legionella son termofílicas, crecen en el agua a temperaturas entre 20 y 50 ºC y poseen un desarrollo óptimo entre 35 y 38 ºC. Estas temperaturas son inusuales en hábitats acuáticos, aunque frecuentes en las instalaciones y dispositivos que en los últimos treinta años han tenido una amplia expansión en la sociedad, como por ejemplo, las torres de refrigeración en las que la temperatura del agua suele mantenerse a unos 25-35 ºC para conseguir una máxima eficiencia. Por debajo de los 20ºC las bacterias permanecen latentes, sin multiplicarse, sobreviven durante un período de tiempo variable entre 40 y 60 ºC y mueren por encima de los 60 ºC.
La legionela, desde su nicho natural en las aguas superficiales y a través de la red de distribución, puede pasar a colonizar los sistemas de suministro de agua de las poblaciones, e incorporarse a los circuitos de agua sanitaria fría y caliente y depósitos de edificios y vivien-
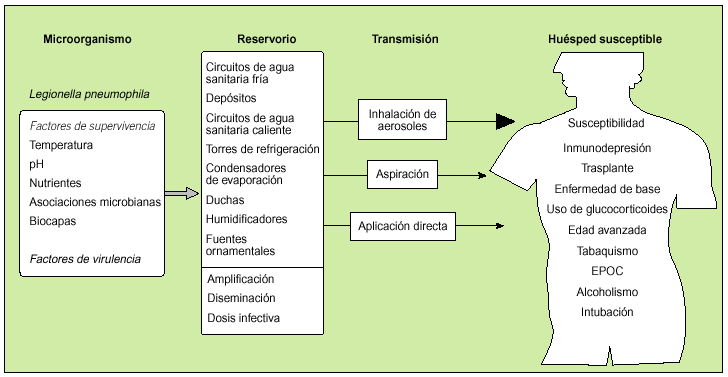
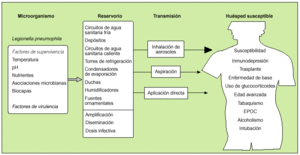
das, que pueden convertirse en reservorios secundarios donde sobrevive el microorganismo. Las instalaciones, equipos y dispositivos que requieren agua para su funcionamiento y la reciben de los citados circuitos, como las torres de refrigeración, los condensadores de evaporación y las bañeras de hidromasaje, constituyen fuentes desde donde el agente se transmite al ser humano (fig. 1). Muchas de estas fuentes también pueden actuar como reservorios.
Figura 1. Esquema de la cadena epidemiológica de la enfermedad del Legionario. En el apartado de reservorio se indican los principales sistemas y equipos que, una vez colonizados por el microorganismo, pueden actuar como reservorios o como fuentes de infección; en la parte inferior de la columna se señalan los mecanismos para que una fuente pueda transmitir de forma efectiva la infección (amplificación y diseminación, con la producción de dosis infectivas). En el apartado sobre transmisión se muestran las tres vías de propagación, de las que la inhalacion de aerosoles es la de mayor trascendencia epidemiológica. En la última columna se exponen los principales factores que incrementan la susceptibilidad del huésped.
Para que pueda infectar a un individuo, la bacteria, además de colonizar un reservorio, debe haberse amplificado a efectos de que el inóculo sea suficiente. Este fenómeno de la amplificación ocurre cuando el crecimiento y multiplicación bacteriana es rápido y masivo, debido a que las condiciones de temperatura, aporte de nutrientes a través de lodos, materia orgánica y asociaciones microbianas, la humedad y pH, y otras características fisicoquímicas, son favorables. Se puede producir en los reservorios y fuentes antes citadas. Por otro lado, en las fuentes pueden generarse aerosoles que se diseminan por el entorno y llegan al ser humano. Además, algunos de estos sistemas artificiales poseen ventiladores que contribuyen a diseminar extensamente el microorganismo.
Mecanismos de transmisión
La infección se transmite por vía aérea a través de la inhalación de aerosoles o gotitas respirables (< 5 µm) que contienen legionela, y también por microaspiración de agua contaminada1,2,21-23. Mediante ambas vías, las partículas microbianas pueden llegar al alveolo pulmonar donde quedan retenidas. El tracto respiratorio constituye la puerta de entrada del microorganismo en el ser humano. La inhalacion de aerosoles es la vía de mayor trascendencia epidemiológica (fig. 1).
Como tercer mecanismo de transmisión debe comentarse que se han descrito casos de neumonía por instilación de agua contaminada en vías respiratorias, o al usar agua contaminada para limpiar una herida quirúrgica21,24,25. La eventual aplicación directa del microorganismo en áreas corporales susceptibles constituye el tercer posible mecanismo de transmisión de la infección, aunque es muy infrecuente.
En modelos animales se ha constatado la inducción de neumonía al exponer conejillos de Indias y ratas a aerosoles de legionela; estos animales también pueden ser infectados mediante la inoculación intratraqueal o intraperitoneal; en cambio, no se infectan al depositar bacterias virulentas en el agua de bebida o directamente en la boca. En ausencia de neumonía no se ha demostrado la colonización faríngea en el hombre. La vía inhalatoria parece ser el principal mecanismo de infección. Hasta ahora, las evidencias a favor de la microaspiración son clínicas.
No se ha descrito la transmisión de legionela por vía aérea a largas distancias. La supervivencia de la bacteria en el aire es corta por su escasa resistencia a la desecación y por los efectos de la radiación ultravioleta. Los aerosoles o partículas pequeñas de agua pueden alcanzar algunos kilómetros pero no llegar a grandes distancias, como sucede con el polvo o las esporas de hongos. En un brote acaecido en Rhode Island, que afectó a 17 personas y causó 2 muertes, se aisló L. pneumophila serogrupo 1 que, según un análisis de campos pulsantes, mostraba un patrón genético relacionado con el microorganismo aislado en otro brote que sucedió unas semanas antes a 28 km de distancia26. En este caso, cabe pensar que el desplazamiento del microorganismo se produjo a través de la vía del abastecimiento de agua.
Tampoco se ha demostrado la transmisión de persona a persona, por lo que no es necesario aplicar medidas de aislamiento de los enfermos. El hombre es un huésped accidental de la bacteria, ya que no es necesario para su supervivencia, ni replicación. La adquisición de la enfermedad se halla condicionada por el tamaño del inóculo, la susceptibilidad del huésped y unos factores de invasividad, patogenicidad y virulencia no bien conocidos. No se ha detectado la existencia de portadores crónicos.
Hace pocos años un grupo italiano de investigadores ha descrito el primer caso de legionelosis animal: un ternero que murió de neumonía por L. pneumophila serogrupo 1. En su tejido pulmonar y en el sedimento de un viejo aparato eléctrico usado para calentar el agua para el rebaño, se detectó idéntico subtipo bacteriano. En el rebaño la prevalencia de anticuerpos frente a legionela fue muy baja27. Este caso sugiere que los bovinos también son huéspedes accidentales de la bacteria. Debe destacarse que existen diversas variedades de roedores susceptibles a legionela que se utilizan para modelos de laboratorio.
Inhalación de aerosoles
Existe una amplia documentación de legionelosis asociadas a aerosoles diseminados por torres de refrigeración y condensadores de evaporación, si bien no se conoce con certeza el riesgo que cabe atribuir a estas instalaciones en la generación de la enfermedad, ya que, por ejemplo, en los EE.UU. y otros países industrializados, hay miles de torres de refrigeración y en el 30-50% de ellas se puede detectar legionela en algún momento28. En todo caso, la proporción de torres de refrigeración que de forma efectiva disemina la bacteria es muy baja29. Esta vía de diseminación tiene especial importancia en los brotes de legionelosis comunitaria y en los casos esporádicos; en cambio, es menos rele-
vante en el ámbito hospitalario. En las torres de refrigeración, se puede producir una gran amplificación de legionela y una notable producción de aerosol contaminado, si el mantenimiento y la limpieza son insuficientes, en especial en aquellas que funcionan de manera discontinua o irregular y mantienen agua estancada durante largos períodos de tiempo. La diseminación puede ser muy elevada al poner en marcha una torre que ha estado inactiva durante semanas y no se ha limpiado antes de entrar en servicio30. En general, los aerosoles de las torres de refrigeración pueden transmitir la infección dentro de un área geográfica limitada de unos 200 m; ahora bien, en determinadas circunstancias, como vientos y corrientes de aire favorables, los aerosoles transportadores de legionela pueden alcanzar de 1,6 a 3,2 km31. Yu ha minimizado la importancia de las torres de refrigeración en la transmisión de la enfermedad, alegando que en muy pocos brotes atribuidos a torres se ha estudiado a fondo y descartado que el agente hubiera llegado a los individuos a través del agua sanitaria21,22. Los sistemas y conductos de aire condicionado de los edificios pueden aspirar y distribuir aerosoles procedentes de torres de refrigeración o de condensadores de evaporación, situados en zonas próximas. Los sistemas de aire acondicionado que no utilizan agua para intercambiar el calor, como los aparatos domésticos o de ventana, o los de automóvil, en sí mismos no representan ningún riesgo intrínseco, pues no producen aerosoles.
Teóricamente, se pueden formar gotitas de agua respirables, de tamaño muy pequeño, siempre que se rompe y fragmenta una corriente de agua, como sucede en las duchas y los aerosoles, y cuando el agua impacta sobre superficies duras o al estallar burbujas32. Desde que se hizo el primer aislamiento ambiental de L. pneumophila en el difusor de una ducha33, éstas han sido consideradas un mecanismo generador de aerosoles y, por lo tanto, potencialmente diseminadoras del microorganismo. Se les ha supuesto una notable importancia en hospitales y hoteles. Diversos estudios retrospectivos han sugerido la posibilidad de que las duchas diseminen los microorganismos que colonizan el extremo de las mismas o bien el agua del suministro, sin embargo hasta ahora ninguna de estas posibilidades ha sido confirmada mediante estudios prospectivos, ni con estudios de simulación, que han permitido observar que sólo se aerosoliza un pequeño número de bacterias, las cuales además llegan a una distancia muy corta (unos centímetros).
Las bañeras de hidromasaje y las saunas pueden ser un buen amplificador del microorganismo y también un eficaz diseminador al producir aerosoles, pudiendo resultar afectados los usuarios de la instalación y las personas que se hallan en su proximidad. Los aerosoles procedentes de fuentes ornamentales también pueden transmitir la infección.
Los humidificadores son aparatos mecánicos que permiten mantener una determinada humedad en el ambiente; humidifican el aire añadiéndole agua. Pueden arrastrar partículas microbianas si el agua usada para llenar el depósito está colonizada por legionela. Este mecanismo de diseminación del microorganismo se ha constatado experimentalmente34. Se dispone de múltiples referencias sobre la implicación de los humidificadores en la transmisión de la enfermedad, tanto respecto a los aparatos acoplados a los equipos de terapia respiratoria como a los utilizados en la humidificación de salas hospitalarias o de locales con otros usos. El riesgo es menor en los equipos que no forman aerosoles, como los humidificadores que producen vapor por ebullición del agua y los que funcionan por capilaridad, por ello, en los edificios con personas de alto riesgo se recomienda el uso de humidificadores de vapor de agua.
Los nebulizadores producen aerosoles con partículas de tamaño uniforme. Pueden diseminar legionela si el agua usada está colonizada. Se han descrito casos en que estaba contaminada el agua usada para lavar el depósito de agua35. Estos aparatos han sido implicados tanto en el entorno hospitalario como en la comunidad. Un nebulizador ultrasónico usado en una tienda para humidificar la sección de productos vegetales produjo un brote que afectó a 28 personas36.
También han sido implicados otros equipos de terapia respiratoria, como las bolsas de uso manual para la resucitación y los respiradores de presión positiva intermitente34. Ninguno de los dos cuenta con depósito de agua, sin embargo el agua usada para limpiar los tubos y componentes puede haber producido la colonización de algún elemento.
No existen evidencias firmes de la implicación de obras y construcciones en la aparición de casos y brotes23, pues no se ha demostrado la transmisión de la enfermedad por la inhalación de polvo. Se ha sugerido que las excavaciones podrían producir la diseminación de aerosoles de agua contaminada procedente de filtraciones y roturas en los sistemas de distribución de agua37,38.
Se desconoce la dosis infectiva de legionela. Los datos de la investigación de un brote epidémico atribuido a un condensador de evaporación sugieren que para adquirir la enfermedad es suficiente la exposición a 1 ufc (unidad formadora de colonias) por 50 l de aire39.
Aspiración
Según Yu3,21,22,37, la aspiración es probablemente el principal mecanismo de transmisión. Este autor argumenta que la colonización de la flora orofaríngea por L. pneumophila es una posibilidad teórica, y si bien no hay todavía ninguna prueba experimental, las evidencias circunstanciales son claras. La anestesia general con intubación endotraqueal es un factor que predispone a la aspiración; por esta razón, las intervenciones quirúrgicas han sido más frecuentes en los pacientes con legionelosis que en los enfermos con neumonía de otro origen; los enfermos con legionelosis tienen más antecedentes de intubación y, por otro lado, ésta ha sido de mayor duración. Los pacientes oncológicos con intervenciones quirúrgicas en la cabeza o el cuello tienen un alto riesgo de aspiración, tanto por los propios resultados de la cirugía como por su historia de tabaquismo; en estos pacientes legionela es una causa frecuente de neumonía (el 30% de los casos). Según estudios prospectivos, la colocación de sondas nasogástricas o endotraqueales es un factor de riesgo de legionelosis y la microaspiración de agua, la presumible vía de entrada24,40,41.
El consumo de hielo procedente de una máquina de hacer cubitos produjo algunos casos42. En el brote inicial de Filadelfia el consumo de agua fue un factor implicado en la adquisición de la enfermedad17. En algunos casos el mecanismo de transmisión por las duchas se habría producido a través de la aspiración de agua y no por vía de aerosoles.
La limpieza y aclarado de los tubos y componentes de los equipos de terapia respiratoria con agua procedente de un grifo, si éste está contaminado, pueden provocar que los microorganismos sean instilados directamente al pulmón34.
Susceptibilidad del huésped
Los factores de riesgo de mayor intensidad para la adquisición de la enfermedad son el tratamiento inmunosupresor (terapia antirrechazo en los enfermos con trasplante de médula o de órgano sólido; en especial el tratamiento con corticoides), haber recibido un trasplante de órgano sólido (riñón, corazón, hígado o pulmón), y una serie de procesos de base como neoplasia, quimioterapia, diabetes e insuficiencia renal terminal. El uso de corticoides es un notable factor de riesgo independiente descrito en 1994 por Carratalà et al43 en un estudio de 300 episodios de neumonía nosocomial, en que se observó que el uso de corticoides y de quimioterapia citotóxica se hallaba asociado de forma positiva con la enfermedad. Existe un moderado incremento del riesgo en las personas de más de 65 años, los fumadores, los pacientes con enfermedad respiratoria crónica, o con insuficiencia cardíaca y los alcohólicos.
Los enfermos con trasplante renal tienen un riesgo elevado de legionelosis que alcanza un riesgo relativo de 10 si siguen un tratamiento prolongado con esteroides. En los pacientes con trasplante pulmonar se ha descrito una incidencia anual del 2 al 20%, del 2% en los de corazón y del 27% en los de hígado44.
El estudio de series recientes de pacientes con formas clínicas menos graves, diagnosticadas exclusivamente mediante la detección del antígeno urinario, ha dado lugar a que el hábito tabáquico adquiriera un protagonismo muy relevante como factor predisponente a la enfermedad. Se ha constatado, además, que la infección por legionela puede producirse en todas las edades aunque en los niños continúa siendo excepcional y en individuos previamente sanos. En un estudio reciente, la legionela fue la causa más frecuente de neumonía adquirida en la comunidad en el grupo de enfermos de edad inferior a 60 años y sin enfermedades de base, mientras que el neumococo lo era en el de edad superior a 60 años y con procesos de base45. Estas observaciones no modifican los anteriores conceptos sobre los factores de riesgo intensos y moderados, pues tienen su explicación en la paradoja del riesgo señalada por Rose: «Un gran número de personas expuestas a un riesgo pequeño puede generar más casos de la enfermedad que un pequeño número expuesto a un riesgo elevado»46.
En los enfermos de sida la incidencia de legionelosis es similar a la de la población no infectada por el VIH, sin embargo la enfermedad suele ser más grave47. En los pacientes neutropénicos o con trastornos de la función inmunitaria humoral la incidencia es similar a la de la población general, en cambio es más elevada en los que presentan trastornos del sistema inmunitario celular. Los pacientes afectos de leucemia de células peludas son especialmente susceptibles.
Es ilustrativo de los factores de riesgo citados, los casos registrados en los Países Bajos entre los clientes de una sauna48. En el curso de seis años hubo seis casos de la enfermedad, cinco varones y una mujer, y dos muertes, una en un varón de 55 años que tenía una historia
de leucemia de células peludas y otra en una mujer de 28 años con un riñón trasplantado. Todos los casos menos uno eran fumadores importantes. La mediana de edad de los varones era de 50 años.
Yu ha destacado la fuerte asociación existente entre legionela y cirugía, debido a que aproximadamente el 40% de los casos nosocomiales publicados ha ocurrido en pacientes operados3,20,21,37. También ha señalado que las infecciones por legionela aumentan con el uso de anestesia general y la intubación endotraqueal. En este sentido, Blatt et al observaron que la presencia de un tubo nasogástrico es un factor de riesgo para el desarrollo de la enfermedad47. La asociación entre anestesia, intubación endotraqueal, tubo nasogástrico y enfermedad por legionela sugiere que la aspiración de secreciones orofaríngeas, colonizadas por legionela, puede ser un mecanismo importante de transmisión de la infección. Por todo ello, Yu ha insistido en el hecho de que los factores de riesgo para la legionelosis nosocomial son los mismos que los de la neumonía por aspiración.
En niños sanos la enfermedad es muy infrecuente. Los niños que la adquieren suelen presentar inmunosupresión o enfermedades pulmonares de base; la mayor parte de casos se diagnostican en niños ingresados en unidades de neonatos o en cuidados intensivos pediátricos. En los recién nacidos los casos suelen presentar neumonía nosocomial asociada a ventilación mecánica. Muchos casos nosocomiales se hallan asociados a la colonización del suministro de agua. Debe comentarse que se han publicado algunos casos de neumonía nosocomial en niños inmunocompetentes49.
Fuentes comunitarias y hospitalarias
Fuentes comunitarias
Las instalaciones que con mayor frecuencia se hallan colonizadas por legionela y que se han identificado como fuentes de infección comunitaria son las torres de refrigeración y los condensadores de evaporación. También deben tenerse en cuenta las instalaciones y dispositivos que utilizan agua en su funcionamento y producen aerosoles, tanto si se hallan ubicadas en el interior como en el exterior de edificios, por ejemplo: fuentes ornamentales, sistemas de riego por aspersión, piscinas, bañeras de hidromasaje y otras de características similares. Los factores que condicionan el riesgo son los siguientes:
Desinfección del agua
La desinfección es indispensable siempre que exista depósito, tanto en los casos en que el abastecimiento se realiza mediante captación propia, como en aquellos en que el agua procede de la red de abastecimiento público, debido a que a pesar de que el agua procedente de la red lleva una concentración adecuada de cloro, durante el almacenamiento el cloro libre residual se evapora y, por lo tanto, es indispensable una recloración para mantener unas concentraciones de desinfectante que garanticen las adecuadas condiciones microbiológicas.
Circuitos de agua cerrados en la red de agua sanitaria caliente
En la mayoría de los edificios de concurrencia pública, la producción de agua sanitaria caliente se realiza mediante circuitos primarios cerrados, con acumuladores o intercambiadores de calor. Los elementos que forman parte de las instalaciones del circuito de agua caliente son los que tienen más riesgo de ser colonizados por legionela. Los serpentines de calefacción o los circuitos de los intercambiadores y los acumuladores de calor pueden llegar fácilmente a recubrirse de incrustaciones, que pueden desprenderse y sedimentar juntamente con otras partículas en suspensión presentes en el agua, y así formar un sedimento que disminuye el rendimiento térmico del sistema y produce un descenso de la temperatura del agua. Los sedimentos e incrustaciones favorecen el acantonamiento de legionela y disminuyen la eficacia de la desinfección debido a que dificultan la acción del cloro. Este fenómeno facilita el crecimiento de los microorganismos, creándose las condiciones óptimas para su proliferación. Es importante, por ello, que en los sistemas de agua caliente se realice un tratamiento y/o un mantenimiento que reduzca la formación de incrustaciones y corrosiones.
Fuentes hospitalarias
El reservorio clásico de legionela en el hospital es, fundamentalmente, el sistema de distribución de agua sanitaria caliente, aunque también puede hallarse implicado el circuito de agua sanitaria fría. En los últimos años las torres de refrigeración han perdido protagonismo como origen de casos de legionelosis nosocomial. El hospital ofrece múltiples fuentes potenciales de exposición. Los aerosoles más habitualmente implicados en la aparición de legionelosis nosocomial son los generados por las duchas. La colonización orofaríngea y la aspiración de agua sanitaria podrían explicar algunos casos. Se han descrito casos asociados con el uso de nebulizadores y equipos de terapia respiratoria, material de irrigación, piscinas para hidroterapia, equipos de extinción de incendios utilizados recientemente y cubitos de hielo producidos por máquinas situadas en las plantas de hospitalización, entre otras fuentes. Debe comentarse que en la bibliografía científica actual han desaparecido los brotes nosocomiales asociados a torres de refrigeración; Yu, en un análisis de los brotes publicados, ha rebatido las eventuales evidencias a favor de su implicación causal3. Los factores que condicionan el riesgo son los siguientes:
Colonización de las aguas
Diversos estudios han constatado la colonización de los sistemas de agua sanitaria de los hospitales con cifras que oscilan entre el 12 y el 80%50. En un estudio realizado en 40 hospitales del Reino Unido se detectó legionela en el 70%51, Alary y Joly52, en Quebec, hallaron legionela en el 68% de los 84 hospitales estudiados. En cambio, Liu et al53, en el Reino Unido, sólo hallaron contaminación por legionela en el 12% de los 17 hospitales estudiados. En EE.UU., en un estudio realizado en 77 hospitales que realizaban vigilancia sistemática de las aguas, se halló en el 34%54. En un estudio realizado en 20 hospitales de Cataluña se detectó su presencia en el 82%55.
Los factores que condicionan la contaminación de las aguas de los hospitales se hallan estrechamente relacionados con la estructura de soporte hidromecánico del centro. Entre ellos cabe citar, el diseño del sistema de distribución de agua sanitaria, la temperatura, su antigüedad, la composición iónica, el pH, la conductividad del agua y los materiales usados en la fabricación de las cañerías y válvulas. La persistente colonización de los sistemas de agua potable de los hospitales por L. pneumophila se debe, al menos en parte, a que el organis-
mo tolera bajas concentraciones de cloro durante largo tiempo56-58.
La complejidad de los sistemas de distribución de agua está muy relacionada con el tamaño del hospital. La existencia de recovecos y ramales ciegos facilita la replicación del microorganismo en numerosos puntos del sistema. El volumen, la disposición y la antigüedad de los acumuladores influyen sobre el inóculo de legionela. Alary y Joly52, al estudiar los factores que contribuyen a la colonización de las aguas de los hospitales, obtuvieron como variables significativas el tamaño del centro, la presencia de acumuladores muy grandes, las temperaturas bajas en los puntos periféricos y los intercambiadores de calor muy antiguos.
Amplificación del inóculo
Si se cierra durante sólo 5 min la válvula de un tramo de tubería contaminada por legionela, el inóculo bacteriano puede incrementarse 35 veces59 (de 150 ufc/ml antes del cierre a 5.370 ufc/ml al abrir). Esta observación, corroborada diversas veces, explica la mayoría de brotes hospitalarios. Cuando se abre un tramo de un circuito de agua sanitaria colonizado por legionela que hasta aquel momento había estado cerrado, se ha incrementado el inóculo bacteriano a límites muy altos, condicionando la aparición de una acumulación de casos de neumonía nosocomial. Es en estos momentos cuando suele detectarse el primer caso de legionelosis, aunque es muy probable que se hubieran presentado casos mucho antes, que permanecieron sin diagnosticar13. La rotura de cañerías durante la construcción y la irrupción de elementos externos en su interior, la despresurización de las plantas más altas del hospital durante las horas de máximo consumo con estancamiento de agua durante minutos u horas, la reparación y puesta en marcha de una bomba de recirculación, con vaciado al circuito general de agua estancada detrás de la bomba, son circunstancias que amplifican enormemente el inóculo bacteriano.
Temperatura del agua
La temperatura media del agua caliente (45-50 ºC) en acumuladores o circuitos de agua sanitaria de edificios grandes exigida por los reglamentos antiguos era idónea para la colonización por L. pneumophila. El efecto térmico sobre las cañerías aumenta en ellas los depósitos calcáreos y de materia orgánica que contribuyen a generar la biocapa en la que vive la legionela. Además, la acción desinfectante del cloro es menor en el agua caliente que en la fría, debido a su evaporación a temperaturas elevadas, lo cual impide mantener las concentraciones mínimas adecuadas en los últimos tramos de la red. Por este motivo, el circuito de agua sanitaria caliente ha sido implicado en la mayoría de brotes de
legionelosis nosocomial. A partir del año 1998 la reglamentación española de instalaciones térmicas de edificios60 y las normas UNE, que cita aquélla, obligan a que las temperaturas de acumulación sean, como mínimo, de 55 ºC, y recomiendan la de 60 ºC, de forma que en el punto más distante de la red o en la conducción de retorno la temperatura mínima sea de 50 ºC.