La esclerosis múltiple (EM) es una enfermedad crónica inflamatoria del sistema nervioso central (SNC) que puede afectar a cualquier edad, predominando en las mujeres. Afecta a personas predispuestas genéticamente que estarían expuestas, probablemente en la infan-
cia, a un agente ambiental que ocasionaría una dis función del sistema inmunológico, que desarrollaría una acción autolesiva dirigida contra la sustancia blanca, provocando desmielinización que ocasionaría un defecto en la conducción de los impulsos nerviosos.
Anatomía patológica
En el estudio anatomopatológico se observan lesiones focales de la sustancia blanca, denominadas placas, en las que lo más llamativo es la pérdida de mielina (desmielinización) con un grado variable de destrucción axonal1,2. Estas lesiones suelen ser múltiples, están distribuidas por todo el SNC y característicamente se localizan en la sustancia blanca periventricular. Su tamaño es, en general, menor de 1,5 cm de diámetro, con tendencia a coalescer, resultando en placas de mayor tamaño.
Histológicamente se observa un infiltrado inflamatorio perivascular formado por células T CD4+ junto a macrófagos y astrocitos. Existe, además, activación de células B.
Epidemiología
La EM es la enfermedad neurológica más frecuente en adultos jóvenes en Europa y Norteamérica, constituyendo una de las principales causas de invalidez para este grupo de edad. La enfermedad puede comenzar a cualquier edad, siendo rara antes de los 10 y después de los 60 años. Afecta con mayor frecuencia a las mujeres en una proporción aproximada de 2:1.
Los estudios de prevalencia han permitido apreciar una distribución irregular, detectándose mayores frecuencias entre los 40 y 60 grados de latitud norte3. En España la prevalencia se estima alrededor de 60 por 100.000 habitantes4, lo que situaría a nuestro país en una zona de alta prevalencia.
Patogenia
La patogenia de la EM es aún desconocida, pero parece ser de índole inmunológica.
La hipótesis patogénica más aceptada es que la EM es fruto de la conjunción de una determinada predisposición genética y un factor ambiental, probablemente viral, que originaría una alteración en la respuesta inmune, de tipo autoinmune, que a su vez sería la causante de la inflamación y desmielinización propias de la enfermedad5,6.
El proceso de desmielinización produce una alteración en la conducción saltatoria típica de las vías mielinizadas normales, enlenteciéndose la conducción e incluso bloqueándose, lo que da lugar a la aparición de los síntomas de la enfermedad.
Los síntomas permanentes de la EM se deben a blo queos permanentes de la conducción, mientras que los síntomas transitorios reflejan un descenso de la velocidad de conducción por debajo del umbral de seguridad.
Clínica
La clínica de la EM presenta una enorme variabilidad, en función de la localización de las lesiones desmielinizantes que pueden ocurrir a todo lo largo del neuroeje. Sin embargo, las lesiones muestran predilección por ciertas partes del SNC: periventriculares, nervio y quiasma óptico, tronco cerebral, pedúnculos cerebelosos y mé-
dula.
A pesar de que la desmielinización puede ocurrir en cualquier localización del SNC, la sintomatología inicial suele ser relativamente limitada. Las formas de presentación más frecuentes son la neuritis óptica, mielitis y síndromes de tronco cerebral.
Los pacientes con EM muestran un amplio espectro de signos y síntomas, a menudo relacionados con la gravedad y la forma de presentación de su enfermedad. Una considerable proporción de los pacientes con enfer medad de larga evolución presenta en la exploración neurológica una hiperreflexia, espasticidad, respuesta plantar en extensión, debilidad, ataxia, pérdida de sensibilidad y alteraciones visuales y esfinterianas7.
Trastornos visuales
El hallazgo más frecuente es la neuritis óptica. La neuritis óptica, forma muy frecuente de presentación, cursa con dolor ocular, pérdida de visión con un escotoma central, defecto pupilar aferente y discromatopsia (incorrecta visión del color). Durante el episodio agudo, el fondo de ojo puede ser normal (neuritis retrobulbar) o bien, mucho más infrecuente, presentar edema de papila (papilitis). La alteración visual empeora con el ejercicio y el calor (fenómeno de Uthoff).
Síntomas motores
La pérdida de fuerza puede ser poco intensa manifestándose inicialmente sólo con el esfuerzo o en condiciones de aumento de temperatura ambiental. En otros pacientes, la debilidad motora puede ser intensa, impidiendo la deambulación.
El déficit motor es muy frecuente, y se caracteriza por pérdida de fuerza en uno o más miembros. En la exploración se aprecian paresias o parálisis francas, hiperreflexia muscular profunda, ausencia de reflejos cutáneos abdominales y signo de Babinski.
Síntomas sensitivos
La alteración de la sensibilidad es un síntoma de inicio muy frecuente, consiste en la aparición de sensaciones de hormigueo (parestesias) o disestesias o acorchamiento de uno o más miembros o del tronco, sugestivas de afección del haz espinotalámico; así como sensación de banda constrictiva en el tronco o los miembros, indicando afección de los cordones posteriores.
En la exploración se pueden apreciar hipoestesia táctil, térmica y dolorosa, o disminución de la sensibilidad profunda, posicional y vibratoria, así como signo de Romberg con frecuencia positivo.
Disfunción cerebelosa
Los signos y síntomas cerebelosos no son frecuentes como forma de inicio de la EM, pero sí en la enfermedad de larga evolución o bien en la EM grave. Se puede presentar en forma de disartria cerebelosa (lenguaje escándido), incoordinación motora de los miembros o inestabilidad en la marcha. Es una de las alteraciones más incapacitantes de la EM.
Disfunción del tronco cerebral
Los síntomas producidos por la disfunción del tronco cerebral, como disartria, diplopía, disfagia o vértigo, pueden ser también la forma de inicio de la enfermedad.
En la exploración, son típicas de la EM la presencia de nistagmo horizontal, vertical, rotatorio o retráctil y la oftalmoplejía internuclear, característica de la EM (al mirar a un lado el ojo que aduce no pasa de la línea media y el ojo que abduce muestra sacudidas nistag-
moides). Asimismo, es típico el temblor intencional, dismetría, ataxia de los miembros o del tronco, con inestabilidad en el test de Romberg y en la marcha.
Alteraciones vesicales, intestinales y sexuales
En el curso de la enfermedad, aproximadamente un 70% de los pacientes presentan clínica de disfunción esfinteriana. Existen diferentes alteraciones urinarias, vejiga espástica, en la que pequeños volúmenes de orina desencadenan la micción, con micciones frecuentes (urgencia, aumento de la frecuencia e incontinencia); vejiga flácida con volúmenes residuales elevados y micción por rebosamiento, y una combinación de ambos tipos de vejiga (disinergia vesical), que es la alteración más frecuente en la EM. Aproximadamente el 50% de los pacientes presenta alteraciones sexuales, impotencia y dificultades en la eyaculación en los varones y anorgasmia en las mujeres.
Afección cognitiva
La existencia de un deterioro neuropsicológico en la EM aparece en un 40-70% de pacientes. El patrón de deterioro cognitivo no es uniforme, implicando principalmente la memoria reciente, atención mantenida, fluencia verbal, razonamiento conceptual y percepción espacial visual8.
Otros
Fatiga. La existencia de una fatiga excesiva es un síntoma corriente en los pacientes con EM, muy exacerbada por el calor.
Signo de Lhermitte. Sensación de calambre eléctrico descendiendo por la espalda a los miembros inferiores al flexionar el cuello.
Síndromes paroxísticos. Los síndromes paroxísticos se dan en un 1-4% de los enfermos con EM, y son muy característico de la enfermedad. Estos síntomas se caracterizan por ser intensos, de breve duración (de segundos a minutos) y estereotipados. Los más frecuentes son: neuralgia del trigémino, crisis tónicas, disartria, ataxia, parestesias, prurito y diplopía.
Formas clínicas de la esclerosis múltiple
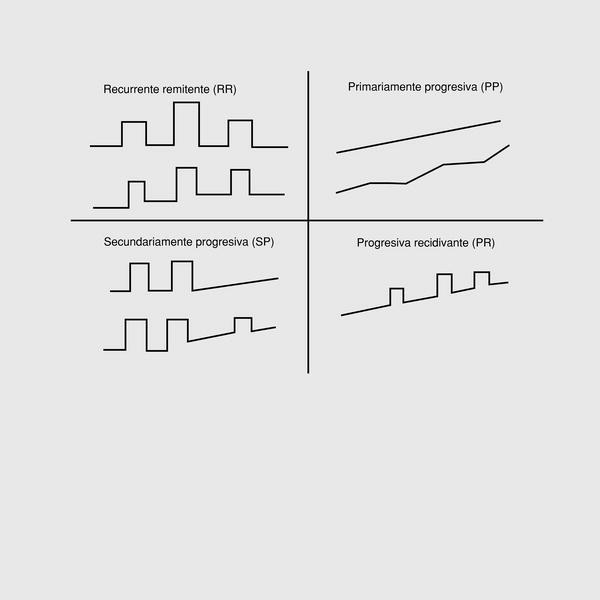
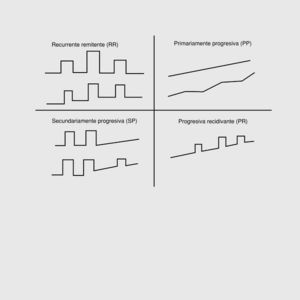
La EM se puede subdividir en diferentes tipos clínicos según el perfil temporal de los brotes y la progresión9 (fig. 1).
Fig. 1. Formas clínicas de la esclerosis múltiple.
Recurrente remitente (RR). Brotes de la enfermedad claramente definidas con recuperación completa o con secuela. Representa el 85% de los pacientes.
Secundariamente progresiva (SP). Curso inicial remitente recurrente, seguido de progresión no relacionada con los brotes. Pueden existir brotes superimpuestos. Tras 10 años de enfermedad, el 50% de los pacientes pasa del curso en brotes (remitente recurrente) a un curso secundariamente progresivo.
Primariamente progresiva (PP). Progresión de la enfermedad desde el inicio, con estabilizaciones ocasionales y mejorías menores temporales. No presentan brotes. Representa el 15% de los pacientes con EM.
Progresiva recidivante (PR). Enfermedad progresiva desde el inicio con brotes durante su evolución posterior. Muy infrecuente.
Investigaciones paraclínicas
Resonancia magnética
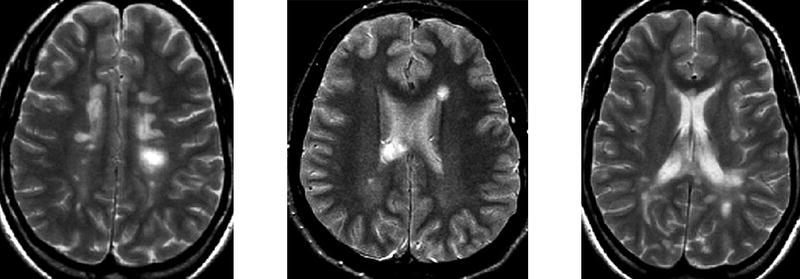
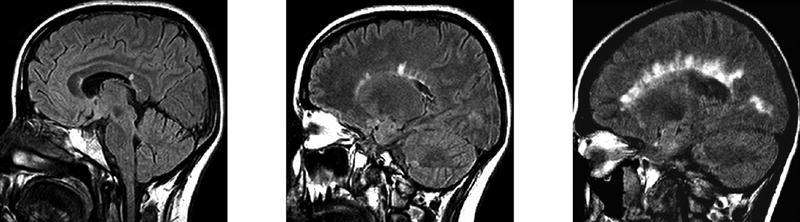
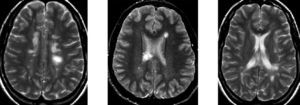
La resonancia magnética (RM) permite descartar otras enfermedades, evidenciar lesiones desmielinizantes no sospechadas clínicamente y es útil para monitorizar la actividad en los ensayos clínicos. Las placas de EM se manifiestan hiperintensas en las secuencias potenciadas en T2 y en densidad protónica. Característicamente son lesiones múltiples, de pequeño tamaño y de morfología nodular, a pesar de que la presencia de al menos una placa de morfología ovoidea con su eje mayor perpendicular al eje anteroposterior de los hemisferios cerebrales aparece en la gran mayoría de pacientes con EM clínicamente definida (figs. 2a y b).
Fig. 2A y B. A) Secuencias potenciadas en T2 en un paciente con EMCD. Se observan lesiones características en situación periventricular, algunas de morfología ovoidea. B) RM craneal de paciente con EMCD. Lesiones hiperintensas que rodean el cuerpo calloso adoptando una disposición radial.
Mediante la RM, se puede determinar en un solo estudio los criterios de diseminación espacial (presencia de más de una lesión) y temporal (el estudio ponderado en T1 con gadolinio evidencia lesiones agudas).
La RM craneal detecta lesiones en el 95-99% y la RM cervical en el 75% de los pacientes con EM10.
Líquido cefalorraquídeo
El estudio de líquido cefalorraquídeo (LCR) en la EM es de aspecto macroscópico normal. El número de cé lulas es normal en la mayoría de los pacientes. Las proteínas totales son normales o están ligeramente ele vadas. Un hallazgo característico es la elevación relativa de las inmunoglobulinas, especialmente la IgG, lo que implica síntesis intratecal. Asimismo, también es característica la presencia de bandas oligoclonales (BOC) en el LCR. La técnica más sensible es el isoelectroenfoque en gel de poliacrilamida, que permite detectar BOC en el 95% de los casos. De todas formas, existen falsos positivos y pueden aparecer en algunas otras enfermedades, como panencefalitis esclerosante subaguda, infecciones virales, infecciones crónicas del SNC, síndrome de Guillain-Barré, ictus, etc.)11.
Potenciales evocados
Los potenciales evocados (PE) son potenciales eléctricos generados en el SNC tras la estimulación de un órgano sensitivo/sensorial periférico. Los potenciales evocados más usados son los visuales (PEV), los auditivos de tronco cerebral (PEAT) y los somatosensitivos (PESS). Los más útiles son los PEV por su mayor sensibilidad (85%), seguidos de los PESS (75%), siendo los menos sensibles los PEAT (60%).
Diagnóstico
El diagnóstico clínico de EM se realiza tomando en consideración la existencia de criterios clínicos de diseminación espacial (existencia de síntomas y signos que indiquen la existencia de dos lesiones independientes en el SNC) y de dispersión temporal (dos o más episodios de disfunción neurológica).
Criterios clínicos para el diagnóstico de esclerosis múltiple
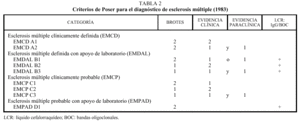
Los criterios de Schumacher para el diagnóstico de la EM asocian la historia natural de la enfermedad y los hallazgos clínicos12 (tabla 1).
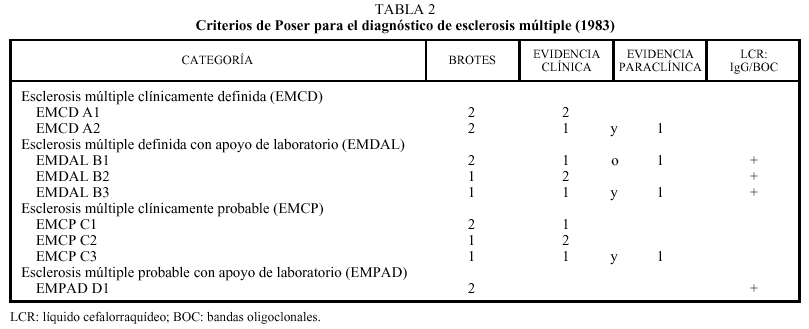
La diseminación en el tiempo es un buen marcador para la EM, y se acepta de acuerdo con los criterios de Poser13 que un paciente padece una EM clínicamente definida si presenta diseminación temporal (dos brotes) y diseminación espacial (dos lesiones en el neuroeje). Después de un primer brote es posible establecer el diagnóstico de la enfermedad con apoyo de laboratorio, según los mismos criterios, precisándose de la presencia de BOC en el LCR o de secreción intratecal de IgG y evidencia clínica o paraclínica de diseminación espacial (tabla 2).
Se define brote como la ocurrencia de síntomas de disfunción neurológica de más de 24 horas de duración. La remisión es una mejoría hasta la desaparición de los síntomas y signos que han estado presentes al menos durante 24 horas. La evidencia clínica de una lesión es la presencia de algún signo clínico anormal en la exploración neurológica. La evidencia paraclínica de una lesión es la demostración de una lesión en el SNC, haya o no dado lugar a síntomas o signos. Incluye los resultados obtenidos del estudio de los potenciales evocados, técnicas de neuroimagen y LCR. En la actualidad, se han elaborado unos criterios diagnósticos de la forma clínica primariamente progresiva.
Tratamiento
Tratamiento del brote agudo
El tratamiento que se utiliza en las exacerbaciones de la EM son los glucocorticoides. Éstos aceleran el ritmo de recuperación de los brotes; sin embargo, no se ha demostrado que estos fármacos tengan incidencia sobre el grado de recuperación. Se administra, generalmente, metilprednisolona intravenosa a altas dosis (1 g de 6-metilprednisolona) en bolos durante 3-5 días, seguidas por dosis descendentes escalonadas de prednisona por vía oral14.
Tratamiento de mantenimiento
Interferones
Los interferones (IFN) son un grupo de más de 20 glucoproteínas producidas por numerosas células del organismo tras infecciones virales, o tras la interacción de éstas con superantígenos o mitógenos, compartiendo todos ellos la capacidad de interferir con la infección viral.
En el mercado existen 3 tipos de IFN-ß: IFN-ß 1b subcutáneo (Betaferon®); IFN-ß 1a subcutáneo (Rebif®) e IFN-ß 1a intramuscular (Avonex®).
Los IFN son parcialmente eficaces en el tratamiento fundamental de la EM. Han demostrado, en las formas remitentes-recurrentes, su capacidad para disminuir el número de brotes en un 30%, su intensidad en un 50%, así como la progresión de la enfermedad y, fundamentalmente, disminuyen de forma muy importante la aparición de lesiones activas en la RM15-18.
En pacientes con EM SP, el IFN-ß 1b ha demostrado ser eficaz para retrasar la progresión de la enferme dad19. Están disponibles en nuestro país para el tratamiento de las formas RR activas (todos) y SP activas (Betaferon®).
Los principales efectos adversos de este fármaco consisten en reacciones cutáneas en el punto de inyección, síndrome seudogripal y linfopenia.
Copolímero I (acetato de glatiramer)
Es un péptido sintético que, al parecer, compite con la proteína básica de la mielina, produciendo un fenómeno de tolerancia inmunológica. Disminuye el número de brotes. Ha sido aprobado en EM RR, en otros países y representado un tratamiento alternativo para aquellos pacientes en los que no se observa un beneficio con IFN20.
Mitoxantrona
Es un potente fármaco antineoplásico. Existen tres estudios que sugieren que la mitoxantrona resulta efectiva en reducir la actividad de la EM tanto en pacientes con EM RR agresiva como en pacientes con EM SP21-23. Es una alternativa cuando otros fármacos no son efectivos. Su efecto secundario más temido es la cardiotoxicidad.
Inmunoglobulinas intravenosas
Las inmunoglobulinas intravenosas podrían promover la remielinización, aunque este mecanismo no se ha podido demostrar clínicamente. En algún estudio se ha demostrado que reduce en un 50% el número de brotes. Estos resultados deben confirmarse antes de utilizarlo en la práctica clínica24.
Azatioprina
Es un inmunosupresor inespecífico. Produce una disminución del número de brotes y un efecto modesto sobre la progresión de la enfermedad25.
Existen terapias muy sofisticadas que requieren validación clínica: anticuerpos monoclonales, citocinas, terapia génica, etc.
Tratamiento sintomático
El objetivo del tratamiento sintomático es aliviar los síntomas de la enfermedad. Además, es el único tratamiento que podemos aplicar en muchos pacientes.
Espasticidad. El fármaco más utilizado es el baclofén (Lioresal®). También se utiliza la tizanidina (Sirdalud®), así como el diazepam (Valium®).
Temblor. El temblor es un síntoma frecuente y muy incapacitante. El fármaco más utilizado es el clonazepam, aunque los resultados son pobres. En determinados pacientes en uso de ondansetron (Zofran®) puede ser de utilidad.
Fatiga. La fatiga está presente en gran parte de paciente afectados de EM. La amantadina ha demostrado algún beneficio, así como la pemolina.
Alteraciones urinarias. Para la vejiga espástica, se utilizan anticolinérgicos orales, como la oxibutinina (Ditropan®), para reducir la hiperactividad del músculo de trusor de la vejiga. En la vejiga flácida el tratamiento es el sondaje vesical intermitente. En el caso de disinergia vesical se emplea prazosin para disminuir la disiner gia entre el esfínter y el detrusor, a través de la relajación del esfínter interno.
Alteraciones sexuales. El sildenafilo (Viagra®) ha demostrado ser eficaz en la disfunción eréctil masculina.
Síntomas paroxísticos. La neuralgia del trigémino y la epilepsia deben recibir su tratamiento habitual. Otros tipos de trastornos paroxísticos responden a la carbamacepina.
Tratamiento rehabilitador. Debe incluir la fisioterapia, terapia ocupacional y la psicoterapia.