Las fisuras anales son la causa más frecuente del dolor anal y sangrado tras la defecación. Se presentan como laceraciones o ulceraciones cortas (< 1 cm) de la dermis, entre el orificio anal y la línea dentada. Su patogenia continúa sin esclarecerse totalmente. Más del 85% de las mismas se presentan en la región posterior de la línea media. La presencia de fisuras fuera de esta localización obliga a descartar una enfermedad inflamatoria intestinal, entre otros diagnósticos.
La aproximación terapéutica clásica nos llevaba a recomendar la cirugía, mediante esfinterotomía lateral, tras el fracaso del tratamiento conservador. En la última década se han realizado multitud de ensayos de distintas sustancias, algunas de las cuales
han empezado a utilizarse en atención primaria de salud. Nuestro trabajo pretender revisar la bibliografía que sobre esta afección se ha publicado desde 1975 hasta la actualidad. Se ha profundizado más en estas últimas posibilidades y en su aplicación en atención primaria de salud.
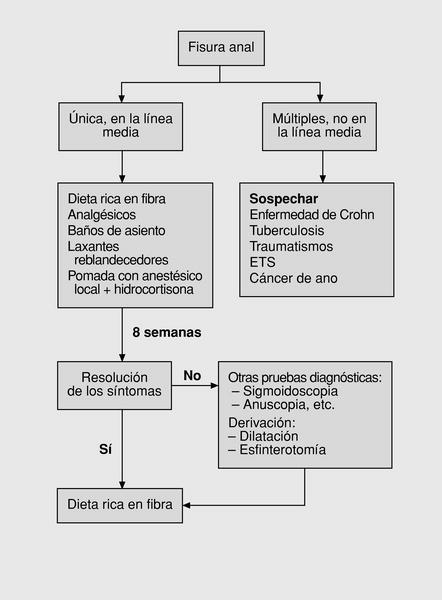
Las fisuras anales son pequeñas grietas o lesiones ulcerosas de morfología elíptica o lineal y de naturaleza benigna que aparecen en la porción más distal del canal anal1. La mayoría de ellas ocurren en la línea media posterior, pero también pueden aparecer en la línea media anterior (el 12% de las que aparecen en mujeres y el 7% de las que aparecen en varones)2. Presentan una incidencia similar en ambos sexos y afecta predominantemente a jóvenes y adultos de mediana edad3. Se estima que en torno a medio millón de casos aparecen anualmente en Estados Unidos y Europa4. La presencia de fisuras múltiples o en otras localizaciones debe hacernos pensar en otras enfermedades y establecer el diagnóstico diferencial con colitis ulcerosa, enfermedad de Crohn, tuberculosis, sífilis o síndrome de inmunode ficiencia humana. Conviene recordar que más de la mitad de las fisuras relacionadas con la enfermedad inflamatoria intestinal se presentan en la línea media posterior y son dolorosas5,6.
Las fisuras agudas tienen una marcada tendencia a la curación espontánea7 hasta un 93% de los casos8 pero una proporción de las mismas progresa a la forma crónica, con gran resistencia a la cicatrización. Las fisuras anales crónicas representan aproximadamente el 10%
de las consultas que se realizan en las clínicas proctológicas9, aunque su incidencia real está subestimada, dado que más del 80% de los pacientes con enfermedades anorrectales benignas no acuden al médico10.
Los síntomas clásicos son el dolor intenso y desproporcionado durante la defecación o después de la misma, que dura desde minutos a algunas horas, el sangrado que mancha el papel higiénico y el prurito. El dolor de las fisuras anales presenta frecuentemente las características cronopatológicas de un dolor en tres tiempos: dolor intenso durante la defecación, alivio breve y pasajero posdefecación y, de nuevo, dolor-ardor11.
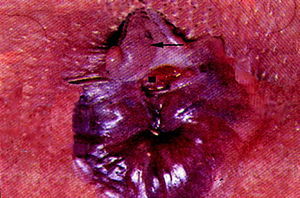
Para el examen clínico de las fisuras anales es preciso que el paciente adopte la posición genupectoral o la posición de Sims (decúbito lateral con la rodillas flexionadas). Es necesario que se separen bien las nalgas, pues frecuentemente las fisuras pasan desapercibidas a la inspección por el espasmo anal asociado, que dificulta su visualización12. La exploración mediante tacto rectal o mediante proctoscopio es frecuentemente imposible debido al dolor que experimentan los enfermos. Bajo anestesia general, la fisura se ve como una herida lineal o con forma de pera que rompe la mucosa del canal anal por debajo de la línea dentada (fig. 1).
Fig. 1. Fotografía de una fisura anal crónica. * Hemorroide centinela.jFibras del esfínter anal interno.
Las fisuras agudas se diferencian de las crónicas por su apariencia13 (tabla 1) y por su evolución. Sin embargo, no existe ninguna definición estricta del tiempo que ha de durar una fisura para que sea considerada crónica. Algunos autores consideran que a partir de 8-12 se-
manas de evolución éstas deben considerarse cronifi cadas14,15.
Anatomía
El ano, teóricamente, es un simple orificio donde termina el tubo digestivo; sin embargo, en anatomía aplicada se añaden a él partes que son inmediatas y que lo transforman en un verdadero conducto de unos 15-20 mm: el conducto anal, que se continúa con la parte más inferior del recto por arriba, y por abajo con la piel que le subsigue y le rodea16. El conducto o canal anal anatómico se extiende desde la línea dentada hasta el borde del ano, mientras que el quirúrgico, algo más largo, tiene su inicio en el anillo anorrectal. Tanto uno como otro son más extensos en el varón que en la mujer, y no se encuentran diferencias significativas con la edad de los pacientes17.
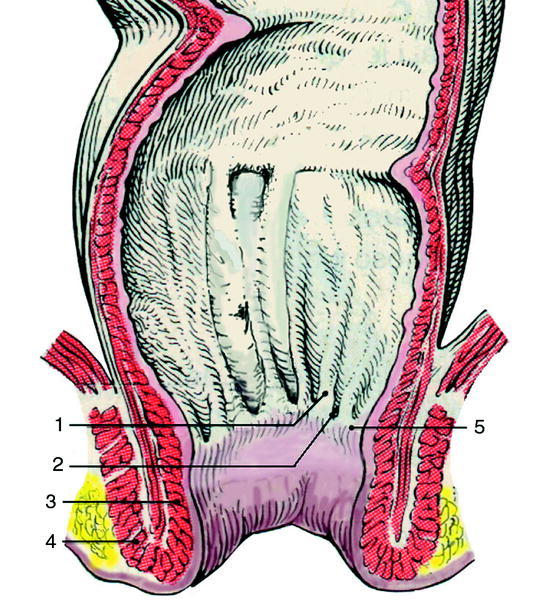
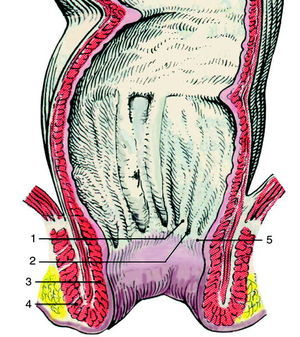
En la figura 218 se han representado y señalado los accidentes y estructuras más importantes de esta región anatómica. Cabe subrayar aquí que la denominada línea dentada, también conocida como anorrectal, es el pliegue transversal que une las columnas de Morgani y que sirve de límite anatómico superior al ano. El resto de estructuras de interés quedan reseñadas en el pie de la figura.
Fig. 2. Sección del canal anal. 1) Columnas de Morgagni; 2) válvulas semilunares; 3) esfínter anal interno; 4) esfínter anal externo, y 5) línea dentada.
En relación con el esfínter anal es importante comen tar que el interno es en realidad un engrosamiento del músculo liso intestinal que se puede ver y palpar des de el exterior del ano como un anillo muscular de unos 5 mm de ancho. Por otro lado, el esfínter anal externo está formado por una banda superior, una media y una inferior en forma de «U» que envuelven el recto cuando atraviesan el suelo pélvico. La banda superior constituye el músculo puborrectal y se inserta hacia delante en el pubis; la mediana se inserta hacia atrás, en el sacro, y la inferior se inserta también hacia delante pero en la piel del periné19.
Fisiología
Para una mejor comprensión de las bases de los nuevos tratamientos médicos empleados para la fisura anal es preciso realizar un recordatorio mínimo del control fisiológico del esfínter.
En el ser humano, el esfínter anal interno (EAI) se encuentra en un estado de contracción parcial permanente que se relaja en respuesta a la distensión rectal (reflejo rectoesfinteriano). Este estado de contracción tónica se debe en parte a la acción de la inervación simpática que llega a través del nervio hipogástrico, procedente del quinto segmento lumbar. Por otra parte, depende de las propiedades miógenas intrínsecas del propio esfínter20. Durante el sueño se produce, de forma fisiológica, una relajación del tono que conduce a disminuciones del 39% de la presión anal en reposo21. La presión anal máxima en reposo (PARM) depende fundamentalmente de la contracción tónica del esfínter interno22, a la que debemos la continencia23; mientras que la presión máxima voluntaria (PAMV) es debida principalmente a la acción del esfínter externo y tiene como función posponer la defecación24.
La mayoría de las fibras nerviosas simpáticas posganglionares son adrenérgicas. En el ser humano23,25,26, a diferencia de otros animales27,28, la estimulación adrenérgica se encarga de mantener el tono de esfínter anal interno, por activación de los receptores alfa, mientras que la estimulación beta produce una disminución del tono. Sobre este aspecto se ha demostrado una acción diferencial entre los distintos subtipos de *-adrenoceptores29: Mientras que los *1 ejercen efectos excitatorios sobre la fibra muscular lisa, los *2 ejercen una modulación de reflejo rectoanal, bloqueando la relajación del esfínter ante la distensión rectal.
La inervación parasimpática procede de los segmentos sacros primero, segundo y tercero y es vehiculada a través del plexo pélvico. Todas las fibras nerviosas postganglionares parasimpáticas son colinérgicas. La acetilcolina, en el esfínter anal interno, ejerce, a través de los receptores muscarínicos30, una relajación del tono del esfínter. Sin embargo, parece ser que esta acción no es directa sino que se produce a través de las neuronas entéricas, estimulando en ellas la producción de óxido nítrico31.
El tercer sistema en juego es el sistema nervioso entérico, definido como una tercera división del sistema nervioso autónomo. Este sistema entérico recibe impulsos tanto del simpático como del parasimpático. Está lo calizado en el tracto gastrointestinal y comprende los plexos submucosos interno y externo (Meissner y Schbadack), el plexo mientérico (Auerbach) y el plexo subseroso32. Se han identificado múltiples neurotransmisores entéricos que pueden ser liberados desde una misma neurona, pero en el esfínter anal interno, parece ser el óxido nítrico el de mayor importancia. En esta localización el óxido nítrico produce disminución del tono anal, y su síntesis está estimulada por la acetilcolina33. En las tiras aisladas de músculo liso de humanos, la estimulación por campos eléctricos actúa imitando la estimulación nerviosa. En el EAI produce relajación que es abolida por tetradotoxina, neurotoxina universal, lo que indica que la relajación está mediada por nervios. Esta relajación no se ve afectada por los antagonistas de la acetilcolina y está mediada por un neurotransmisor no adrenérgico-no colinérgico (NANC). Se ha propuesto que este neurotransmisor NANC pudiera ser el adenosín trifosfato (ATP) o el péptido vasoactivo intestinal, pero no se ha demostrado fehacientemente su papel en el ser humano34. Sin embargo, existe una evidencia creciente de que este papel está desarrollado por el óxido nítrico35-39.
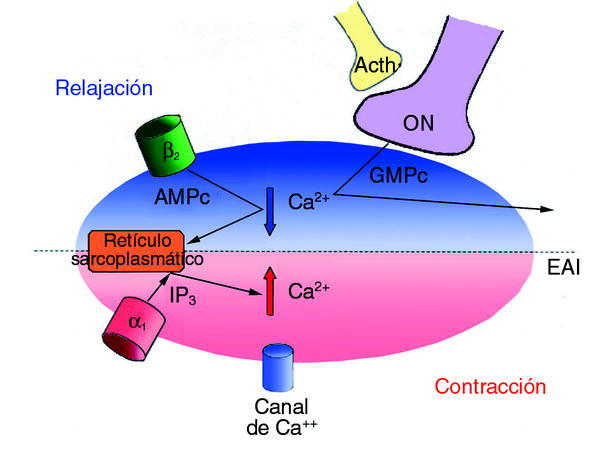
En resumen, la contracción del músculo liso de EAI está bajo control del sistema nervioso autónomo, incluido el entérico. Pero a escala celular, la contracción muscular está determinada por los cambios en la concentración de calcio en el citosol y dependiente, parcialmente, de la concentración de calcio extracelular y el flujo a través de la célula40. El aumento del calcio intracitoplasmático permite la unión de éste a la calmodulina, que a su vez activa la cinasa de la cadena ligera de la miosina y supone el inicio de una serie de reacciones que determinan la contracción de la fibra muscular lisa. El calcio intracitoplasmático puede elevarse por dos vías:
1. Entrada directa desde el exterior, a través de los canales de calcio de la membrana sarcoplásmica.
2. Estimulación de los *1-adrenoceptores. En este caso, el aumento de calcio se debe a su liberación desde el retículo sarcoplásmico, fenómeno mediado por el inositol trifosfato que se produce en la interacción del neurotransmisor con el receptor *1-adrenérgico.
Por su parte, la relajación puede ser inducida por los bloqueadores de los canales del calcio, por los antagonistas alfa, por la estimulación ß-adrenérgica que produce el regreso del calcio intracitoplasmático al retículo, mediado por el adenosín monofosfato (AMP) cíclico, y por la acción del óxido nítrico, que a través del guanosín monofosfato (GMP) cíclico también disminuye la concentración de calcio en el citosol. También es posible que el óxido nítrico produzca relajación alterando los canales de potasio de la celular muscular lisa, generando un estado de hiperpolarización41. La estimulación de los receptores muscarínicos produce aumento de la liberación de óxido nítrico por las neuronas entéricas y secundariamente, disminución del calcio intracelular.
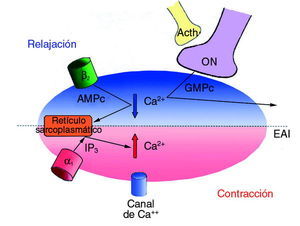
En definitiva, y esto es lo que más nos interesa para poder entender la dirección de los esfuerzos investigadores, la relajación del músculo liso del esfínter anal interno puede producirse por estimulación de las neuronas entéricas NANC, de los receptores parasimpáticos muscarínicos o simpáticos ß-adrenérgicos y por la inhibición de los canales de calcio42. La contracción del esfínter depende de un aumento del calcio intracitoplasmático y está mediada por la estimulación de los receptores *-adrenérgicos43. En la figura 3 se presenta un esquema de todos estos aspectos.
Fig. 3. Esquema del control neurológico del esfínter anal interno.
Patogenia
Como ya se ha comentado, el origen de las fisuras anales no está plenamente dilucidado. Se han emitido numerosas teorías en el intento de desentrañar la causa subyacente de esta afección tan dolorosa. La mayoría de ellas entran en conflicto y ninguna ofrece una explicación completa a las características de las fisuras crónicas.
Tradicionalmente se ha considerado que el estreñimiento, con el paso de heces muy duras a través del canal anal, era la causa fundamental de las fisuras anales, excepción hecha de otros traumatismos. De esta manera, las heces duras desgarrarían hacia abajo una papila anal, dejando una laceración lineal y una porción de mucosa enrollada que, edematosa por los repetidos traumatismos, terminaría por formar la hemorroide centinela44. Sin embargo, esta hipótesis patogénica no explica el porqué de la gran tendencia de las fisuras a aparecer en la línea media, ni es congruente con el hecho de que encima de la fisura se vea, frecuentemente, la papila intacta. Tampoco ofrece explicación al hecho de que algunas fisuras tiendan a cicatrizar fácilmente y otras no. Se postuló, entonces, que la región posterior del canal anal debería estar pobremente vascularizada y eso la haría más propensa a la aparición de fisuras. Aun así, el antecedente de estreñimiento en pacientes con fisuras sólo aparece en un 25% de los casos, y hasta en un 7% de éstos se recoge el antecedente de diarrea, que pudiera ser considerado un factor predisponente45. En un estudio más reciente, el número de enfermos que refieren haber tenido heces duras no supera el 14%1.
La tendencia a la cronicidad de algunas fisuras se achacó a infección secundaria de las mismas. En este sentido Shafik46 propone que la disrupción de la mucosa anal que caracteriza a las fisuras expone a células epiteliales o al seno anorrectal, que actúan como favorecedores de la infección y facilitan la cronicidad de las mismas. En la primera década de este siglo, Miles47 propuso que la cronicidad de las fisuras se debía a la existencia de una brida en el canal anal distal que originaba varicosidades y que las fisuras se mantenían por la flebitis de esos vasos, propugnando la división de esta brida como tratamiento. Según esta teoría, la predilección por aparecer en la línea media posterior se debía a la disposición anatómica de la zona que la hacía más propensa a recibir traumatismos por las heces. Más tarde, Eisenhammer48 presentó que esta brida o banda no estaba compuesta sino por fibras de la porción distal del EAI.
La hipertonía del EAI ha sido considerada causa de las fisuras anales durante muchos años, y así el tratamiento ha estado dirigido a eliminarla. Pero, ¿cuál es el origen de esta hipertonía? Algunos autores49 proponen que se debe a una miositis, al comprobar, mediante análisis histológico, una mayor proporción de tejidos fibrosos en los EAI de pac ientes con fisuras que en los controles.
Si existe una hipertonía del EAI, la presión en reposo de los pacientes con fisura debe ser mayor que la de los pacientes sanos. A pesar de fracasos iniciales50, muchos autores51-65 han demostrado, con variedad de técnicas, un aumento de la presión anal de reposo en pacientes con fisuras, mientras la presión voluntaria máxima se mantiene en valores similares a los de los individuos sanos. Ahora bien, la hiperpresión del canal anal no tiene en sí misma una repercusión patológica y en sujetos sanos asintomáticos la presión del canal anal en reposo puede tener el mismo nivel que en los pacientes con fisuras66.
A la luz de estos conocimientos cabría plantearse si el espasmo esfinteriano es primario o secundario al dolor, siempre presente en los pacientes con fisuras. Se ha postulado que la hipertonía precede a la fisura46 y varios estudios terminan de contestar a esta pregunta. En dos de ellos el espasmo persiste a pesar del tratamiento local con anestésico51,67. En un tercer trabajo68, realizado en España, se confirma que los pacientes que se han curado con tratamiento conservador sufren un aumento progresivo de su presión anal de reposo hasta niveles similares a los que mantenían antes del tratamiento, permaneciendo libre de síntomas. De los trabajos anteriores se puede colegir que la hipertonía del esfínter parece más primaria que secundaria al dolor.
Se han encontrado otras alteraciones en la fisiología del canal anal de los pacientes con fisuras, tales como un reflejo rectoanal inhibitorio anómalo, menor número de relajaciones espontáneas, alteraciones en las ondas y oscilaciones de la presión anal, y una zona de alta presión mayor, pero no tienen una relevancia clínica demostrada66,69.
Anteriormente hemos mencionado que la hipertonía de esfínter no era una condición suficiente para explicar la patogenia de las fisuras anales; es necesaria la presencia de otra condición: la isquemia.
El canal anal distal se encuentra irrigado por las arterias hemorroidales inferiores, ramas de las pudendas internas, que a su vez lo son de la hipogástrica o ilíaca interna. Ya en 1937 Blaisdell70 señala que la distinta configuración del esfínter anal externo en la parte posterior determina en esta región una mayor susceptibilidad a los traumatismos por falta de irrigación. En 1989, Klosterhalfen et al71 publican un trabajo basado en la realización de 41 angiografías de la arteria hemorroidal inferior en cadáveres humanos. Del análisis de los datos deduce la existencia de dos patrones de distribución: en el 85% de los casos, la arteria presenta muy pocas ramas en la región de la comisura posterior del esfínter anal; en el otro 15%, la proporción de ramas no es distinta de la de otras regiones del esfínter. El análisis histológico y morfométrico de los casos del primer grupo reveló que tanto el espacio subanodermal como el esfínter presentaban una gran pobreza de capilares en la región de la línea media posterior. Esto sugería fuertemente que esta región era más propensa a la isquemia, lo que explica la predilección de las fisuras anales por aparecer en esta región y la ausencia de tejido de granulación que caracteriza a las fisuras crónicas.
En 1993, Klug y Knock72 miden la presión parcial de oxígeno en la dermis anal de pacientes con fisuras anales agudas. Para ello usan un sensor de pO2 incorporado a un dilatador anal. Confirman la existencia de una pO2 significativamente reducida en la región de la fisura y concluyen que las fisuras anales están asociadas con defectos de la microcirculación de la dermis anal.
En un trabajo de Schouten et al73 se demuestra, usando flujometría Doppler por láser, un flujo sanguíneo disminuido en la comisura posterior del canal anal, comparado con los otros tres cuadrantes. Durante el estudio, el flujo sanguíneo se correlacionó negativamente con la presión anal en reposo. Este flujo sanguíneo se eleva bajo anestesia o tras esfinterotomía lateral74.
Por tanto, la patogenia de las fisuras anales crónicas está determinada por la existencia de dos condiciones imbricadas: la hipertonía del esfínter interno y la isquemia regional. La hipertonía genera una alta presión que junto a la pobre vascularización de esta zona produce un índice de perfusión lo suficientemente bajo como para producir lesión y para impedir la curación57,75. Tanto la dilatación anal como la esfinterotomía disminuyen la presión anal haciendo que se eleve el índice de perfusión y permitiendo la curación de las fisuras. El estreñimiento, cuando se produce, debe ser considerado un factor precipitante, y puede ser su papel más determinante en la patogenia de las fisuras agudas.
Aun así, nos seguimos preguntando cuál es la causa primigenia de ambos factores patogénicos. Existe una creciente evidencia de que el estrés psicológico produce una elevación sustancial de la presión del canal anal. Ratas sometidas a estrés desarrollan cambios en los receptores ß1-adrenérgicos. También se ha afirmado que el esfínter anal de pacientes con fisuras presenta una hipersensibilidad a los agonistas ß276. ¿Se puede deducir de estos datos que el estrés es esa causa primigenia? Creemos que no, pero es preciso contar con el estrés como uno de los factores que intervienen en la patogenia de las mismas. Por último, Maria et al77 han apuntado recientemente la posibilidad de que la interacción de componentes inmunes con el endotelio perianal pueda constituir un mecanismo determinante de la isquemia y la hipertonía. De hecho encontraron anticuerpos antiendoteliales en los pacientes con fisuras y hemorroides, pero no en los controles. De esta manera, el endotelio estaría involucrado en la patogenia de las enfermedades anales. Las células del endotelio podrían actuar como células presentadoras de antígenos que llevarían a la formación de anticuerpos contra el endotelio alterado. En algunas ocasiones el endotelio dañado produce sustancias vasoactivas que, en este caso, contribuirían al incremento del tono basal y en consecuencia de la isquemia de la comisura posterior. De otro modo, los anticuerpos antiendoteliales pueden ser los responsables de la amplificación de un daño vascular primario, inducido por mecanismos poco conocidos. El pequeño número de pacientes involucrados en este estudio hace que tomemos esta hipótesis con la máxima cautela.
Tratamiento de las fisuras
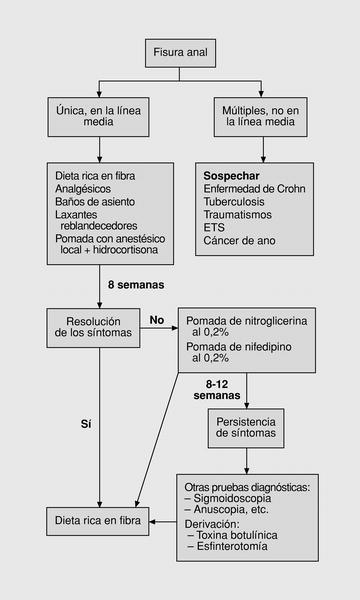
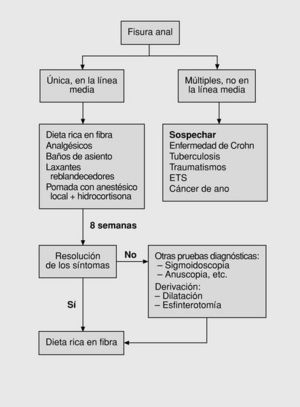
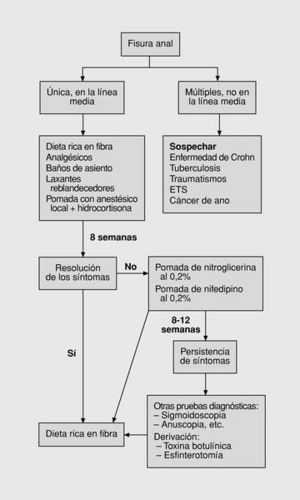
Hasta principios de los años noventa el algoritmo de tratamiento de las fisuras anales era muy sencillo (fig. 4). Tras el inicial diagnóstico diferencial, se sigue tratamiento conservador al menos durante 2 semanas. Si se produce la resolución de los síntomas se mantiene al paciente con una dieta rica en fibras. Si persisten se deriva para valoración de tratamiento quirúrgico78,79.
Fig. 4. Primer algoritmo: esquema clásico.
A continuación se analiza la efectividad de las posibilidades terapéuticas apuntadas en este primer algoritmo.
Tratamiento conservador
El tratamiento conservador se ha basado en la hipótesis patogénica del estreñimiento como causa de las fisuras; por tanto, su prevención es su pilar básico80. En el estudio prospectivo de casos y controles realizado por Jensen81 en 1988 sobre factores de riesgo para el desarrollo de fisuras anales agudas se demostró que:
1. Los pacientes que tomaron una dieta que contenía corteza de frutas, vegetales y pan integral tuvieron un riesgo significativamente inferior de desarrollar fisuras anales.
2. Los pacientes que consumían pan blanco, salsas espesadas con roux (una base de grasas y harina para las salsas), bacon y salchichas, tuvieron un incremento significativo del riesgo de padecer fisuras.
3. La tasa de curaciones fue del 87% tras 3 semanas de tratamiento. La recidiva de las fisuras anales agudas fue también menor en aquellos pacientes que se mantuvieron con un suplemento dietético de fibra frente a los que tomaron placebo (lactulosa)82. De ello se deduce que el suplemento de fibras en la dieta debe ser una de las medidas a aplicar.
En un trabajo posterior83, el mismo autor demuestra que el tratamiento con suplementos de fibra dietética y baños de asiento calientes es superior a la aplicación local de anestésicos, aunque no está exento de efectos indeseables84. En la búsqueda bibliográfica realizada no se han encontrado documentos sobre la influencia del tratamiento dietético en la evolución de las fisuras crónicas.
En el primer tercio del siglo xx se ensayó la inyección local de agentes anestésicos en el esfínter como parte del tratamiento conservador tanto de fisuras anales agudas como crónicas85-87, pero se abandonó por la escasa tasa de curación (inferior al 50%) y los graves efectos indeseables que producía (dolor local, abscesos e incontinencia)88. La inyección de esclerosantes se siguió de la aparición de sepsis locales y rápida recidiva89.
En la actualidad existe un amplio espectro de fórmulas magistrales que se recomiendan para el tratamiento de las fisuras. La mayoría de ellas están realizadas combinando agentes sedantes (subgalato de bismuto, óxido de cinc) con esteroides tópicos y anestésicos locales. Hasta el presente desconocemos que hayan sido evaluadas en ensayos clínicos, salvo el realizado con la pomada llamada Proctosedyl90 (Roussel Laboratories, Uxbridge, Reino Unido). En el estudio referenciado, la pomada se usó en el tratamiento de fisuras agudas, consiguiendo una curación del 80%. Este ensayo no era controlado y entre los pacientes había niños y adultos captados por 45 médicos generales de distintos lugares del Reino Unido. Se trató simultáneamente el estreñimiento en aquellos pacientes que lo sufrían y fueron los que mejores resultados obtuvieron.
Los supositorios de belladona, utilizados desde principios del siglo xix, se abandonaron por los efectos sistémicos que provocaban91. La cauterización con nitrato de plata ha tenido resultados decepcionantes92.
Como ya se ha comentado, otro de los elementos que entran a formar parte del tratamiento conservador son las pomadas de anestésicos y/o corticoides tópicos, a las que se añaden diversas sustancias. En el citado estudio83, no se pudieron establecer diferencias en cuanto al alivio de síntomas entre los pacientes tratados con suplementos de dieta, con lidocaína al 2%, o con hidrocortisona al 2%. Las tasas de curación sí fueron significativamente favorables a los tratamientos con suplemento de fibra e hidrocortisona. Por otro lado, el uso de anestésicos tópicos puede producir ocasionalmente perdidas de sensibilidad en la piel.
Dos estudios más afrontan el tratamiento de las fisuras anales con lidocaína51,93. Ambos concluyen que las tasas de curación con lidocaína son bajas (inferiores al 50%), con tasas de recidiva altas. La presencia de signos de cronicidad en las fisuras fue un predictor de fracaso del tratamiento, por lo que sólo deberían usarse en la fisuras agudas. Sin embargo, existen estudios que demuestran curaciones de hasta el 45% en fisuras con más de 6 meses de evolución, sólo con pomada de lidocaína94.
Los anestésicos locales se han combinado con enzimas proteolíticas95, estreptocinasa-estreptodornasa96, solcoderm97, ácido m-cresolsulfónico y formaldehído98 en el tratamiento de las fisuras, pero ninguno de ellos ha tenido suficiente aceptación. Una mención especial merece el solcoderm. Se trata de una solución acuosa de ácidos orgánicos e inorgánicos, iones de cobre y nitratos. Chen et al97 presentaron tasas de curación del 84% tras la aplicación de esta solución en pacientes con fisuras anales agudas. Para los autores, la solución causa una isquemia local que contribuye a la formación de tejido de granulación. A la vista de los conocimientos posteriores es más probable que su mecanismo de acción sea la cesión de óxido nítrico.
En múltiples trabajos se usan como coadyuvantes del tratamiento los laxantes reblandecedores de heces, que han llegado a formar parte de tratamiento conservador protocolizado y que pretenden evitar el factor traumático que suponen las heces duras.
Tradicionalmente se han recomendado los baños de asiento calientes para el tratamiento tanto de las fisuras como de otras afecciones anales (posthemorroidectomía, hematomas perianales, etc.). Sin embargo, existe controversia en cuanto al papel real que los baños calientes pudieran tener como agente terapéutico99,100. Para algunos autores la función de los baños calientes era fundamentalmente analgésica. Pero, recientemente, un trabajo de Jiang et al101 ha demostrado que el calor local puede ser efectivo, no sólo por su capacidad analgésica sino también por ser capaz de disminuir la presión anal a través de un reflejo somatoanal, haciéndolo de manera más evidente en aquellos pacientes que partían con una presión de reposo mayor, como era el caso de los que tenían fisuras anales.
En resumen, el tratamiento conservador debería constar de suplementos de fibra dietética, laxantes reblandecedores, baños de asiento calientes, pomada de anestésico local y/o hidrocortisona y analgésicos por vía general. Estas medidas producen una importante mejoría sintomática en la primera semana, curando las fisuras completamente entre 2 y 4 semanas102. Por desgracia, como ya se ha comentado, el éxito de esta terapia no es universal.
Tratamiento invasivo
Desde que en 1838, Récaimer103 publicara la primera descripción de la técnica de la dilatación anal, su uso como parte del tratamiento de las fisuras anales ha sufrido importantes altibajos. A lo largo de este tiempo su uso ha sido sugerido por varios autores104-106 y aún en la actualidad, con variaciones, se siguen encontrando defensores107.
La gran ventaja que señalan sus valedores es la facilidad de realización; sin embargo, es una técnica difícil de estandarizar y capaz de producir daños incontrolados e irreversibles sobre el esfínter108. Existe gran variabilidad entre los distintos autores en cuanto a la fuerza que se debe emplear, el grado y la duración de la dilatación recomendada. La mayoría usan para la dilatación digital la introducción en el canal anal de 4 dedos durante al menos 4 minutos109,110. Ante las críticas de difícil estandarización de la técnica, algunos autores han intentado regular el proceso mediante el empleo de limitadores de la separación de los dedos, o reemplazando los dedos por dilatadores o balones72. Aunque la comparación de los resultados de la dilatación es difícil por lo comentado anteriormente, de los 16 ensayos analizados por Lund y Scholefield111, la mayoría comunica un rápido alivio sintomático. La proporción de recurrencias se sitúa entre el 2,2 y el 56,5% y tiende a ser mayor cuanto mayor es el seguimiento. Se notifica entre un 0 y un 39,2% de pacientes con alteraciones en la continencia de gases o que manchan la ropa interior, y hasta un 16,2% de incontinencia fecal manifiesta. Estos procesos se dan con mayor frecuencia en los pacientes que presentaban una baja presión anal de reposo112,113. En un trabajo114 realizado sobre 20 pacientes que ha bían sufrido una dilatación anal entre 2 y 6 años antes, se describe que sólo dos presentaban problemas menores de continencia, pero que 11 mostraban alteraciones esfinterianas en el estudio endoecográfico, de los cuales cuatro tenían roturas del esfínter interno. Estos pacientes no presentaban en el momento del estudio alteraciones de la continencia, pero ¿qué ocurrirá cuando el esfínter se debilite con la edad? Los trastornos de la continencia no son las únicas complicaciones de la dilatación anal, el sangrado de la fisura, los hematomas perianales, el prolapso hemorroidal y los abscesos perianales, así como las bacteriemias, son procesos descri tos como secundarios a la realización de dilataciones anales115.
Estos datos han llevado a algunos autores a considerar la dilatación como una técnica que debe abandonarse116.
Las intervenciones quirúrgicas desarrolladas para el tratamiento de las fisuras anales pretenden resolver la hipertonía del esfínter mediante incisió ;n del mismo. Se vienen realizando desde principios del siglo xix, y desde entonces se han convertido en uno de los procederes quirúrgicos más frecuentes, existiendo múltiples variantes descritas. De entre ellas, sin lugar a dudas, la esfinterotomía lateral interna es, en la actualidad, el tratamiento quirúrgico de elección. Puede realizarse con una técnica abierta o subcutánea, con anestesia general o local, pero unas y otras producen el efecto deseado: una disminución de la presión anal. Las ventajas e inconvenientes de las variantes descritas son tema de controversia. Hay investigadores que aseguran que con la esfinterotomía cerrada, subcutánea, la estancia hospitalaria y el registro del dolor tras la operación es menor117. Otros no encuentran diferencias entre ambos procedimientos en cuanto a proporción de recidivas, complicaciones postoperatorias o alteraciones de la continencia a corto y largo plazo118. Finalmente, hay quien describe una mayor proporción de incontinencia tras la esfinterotomía abierta119, y otros un mayor porcentaje de recidivas con la subcutánea120. El tema continúa sometido a debate, y se ha publicado recientemente un metaanálisis exhaustivo recomendable para los lectores más interesados121. En cuanto al tipo de anestesia usada es importante comentar que aunque inicialmente se describió una alta proporción de recidivas en los pacientes operados con anestesia local, posteriormente varios autores han abogado por esta técnica como un procedimiento ambulatorio y que exponen buenos resultados en sus series122-126.
En general, se admite que la esfinterotomía produce unos buenos resultados en cuanto a la curación de la fisura (el 90% curan en 1-2 meses), y a la baja proporción de recidivas126. Los estudios manométricos presentan una reducción del 35% en la presión anal de reposo en los pacientes tratados con esfinterotomía y un aumento de flujo local sanguíneo del 65%75. Sin embargo, esta reducción en la presión anal es permanente y está asociada a asimetrías esfinterianas y, en algunos casos, a deformidades del esfínter127. Como consecuencia, la incontinencia para heces o gases es común, con prevalencias variables que van desde el 35128,129 al 0%130, según las series. En la valoración de estos porcentajes también existen discrepancias: unos piensan que éstos son menores que los obtenidos tras la dilatación anal131, mientras que para otros son similares132,133.
Un aspecto fundamental a la hora de evaluar una técnica es el grado de satisfacción que produce en quien la sufre. Éste es alto en los pacientes que han sido intervenidos mediante esfinterotomía lateral134, a pesar de las secuelas.
En vista de los resultados anteriores, la Sociedad Americana de Cirugía Colorrectal135 recomienda tener especial cuidado antes de realizar una esfinterotomía lateral en pacientes con diarrea, síndrome del intestino irritable, diabetes y en pacientes ancianos. La esfinterotomía no está recomendada en las fisuras de pacientes con infección por el VIH136. También invitan a la realización de manometría y ecografía endoanal antes de la cirugía en pacientes con fisuras recurrentes. Algunos autores sugieren que sea una manometría previa la que determine la intervención que se debe realizar137, aunque también hay quien considera innecesaria esta posibilidad138.
Una técnica también al uso en el tratamiento de las fisuras anales es la de la anoplastia: aplicación de un colgajo de piel perianal que cubre la fisura para fa vorecer su curación (advacement flap). Este procedimiento no mejora los resultados obtenidos con la es finterotomía139 y debería ser relegado al tratamiento de aquellas fisuras que se presentan en pacientes con baja presión anal de reposo, pobre presión máxima
voluntaria, o en mujeres con historia de alto riesgo obstétrico y en los que la esfinterotomía no es acon sejable140.
Nuevas perspectivas de tratamiento conservador
Siguiendo el protocolo expuesto en la figura 4, las fisuras que no curaban con el tratamiento conservador debían ser derivadas para el empleo de técnicas más agresivas: dilatación anal y/o esfinterotomía. Es conocido que esta última produce un elevado porcentaje de curaciones definitivas, con baja tasa de recidiva, pero presenta el inconveniente de dejar secuelas permanentes en la dinámica anal que llevan a un importante número de pacientes a padecer incontinencia en mayor o menor grado.
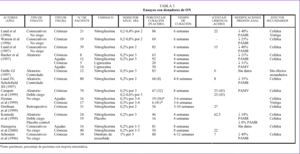
Así, el tratamiento ideal de las fisuras anales debería inducir una reducción temporal de la presión de reposo que permitiera la curación sin causar alteraciones permanentes en la función del esfínter. El avance en el conocimiento de los mecanismos íntimos de control de la contracción muscular está permitiendo progresar en el intento de manipular farmacológicamente el tono del esfínter anal, en la búsqueda de la solución ideal (ta bla 2).
Donadores de óxido nítrico (ON)
Denominamos donadores de ON a aquellos compuestos capaces de liberar este mediador activo y también a aquellos que, aunque no liberan ON directamente, expulsan compuestos relacionados con éste que a su vez puede convertirse en ON141. Desde el descubrimiento del óxido nítrico como factor endotelial relajante del músculo liso vascular, esta molécula se ha implicado en muchos procesos fisiológicos y patológicos.
A principios de la década de los noventa, se realizan tres importantes descubrimientos:
1. Existía una creciente evidencia de que el ON desempeñaba un papel decisivo en la relajación del EAI142,143.
2. El aporte exógeno de ON era capaz de producir una potente relajación del esfínter interno35.
3. La enzima responsable de la generación de ON estaba presente en las neuronas del recto y el ano144.
En consecuencia, se iniciaron una serie de experiencias con nitratos orgánicos como donadores de ON.
Los donadores de ON actúan disminuyendo la presión anal, y quizás también por vasodilatación43, llevando a un aumento del flujo anodermal que permite la curación de las fisuras75.
La nitroglicerina sublingual en vaporizador confirmó que reducía la PAMR por un breve lapso de tiempo, pero a costa de unos efectos secundarios inadmisibles145. Si la nitroglicerina sublingual era capaz de disminuir la PAMR, y podía producir su acción aplicada tópicamente, el siguiente paso estaba anunciado. Así, Guillemot et al146,147 describen el efecto que sobre la presión anal en reposo tienen 5 mg de nitroglicerina en pomada. Se produce una rápida disminución de la presión tanto en los controles sanos como en los que sufren estreñimiento. La duración de este efecto es muy variable en el tiempo y aparece un alto porcentaje de pacientes con cefalea, un efecto secundario que nos acompañará a lo largo de la presente revisión. Loder et al148 introducen el término de «esfinterotomía química reversible» para referirse a la acción de la nitroglicerina, que ellos emplean en pomada al 0,2% sobre una variedad de patologías anales (hemorroides, fisuras, constipación). Registran una importante disminución de la presión anal de reposo que aparece a los 20 min de la aplicación y persiste durante 9 h.
A partir de este momento la eficacia clínica de la aplicación tópica de nitratos orgánicos en el tratamiento de las fisuras ha sido constatada en múltiples estudios observacionales y no controlados efectuados sobre series limitadas de pacientes. En 1995, Gorfine149,150 publica los resultados de dos pequeños ensayos en los que constata alta tasas de curación, en torno al 80%, de las fisuras anales con 0,5-1 g de nitroglicerina tópica al 0,3-0,5%, aplicada varias veces al día durante al menos un mes. Los pacientes también recibieron una dieta rica en fibra, laxantes formadores de masa (semillas de phyllium) y baños de asiento calientes. Junto a estas tasas de curación se registró un significativa y rápida disminución del dolor, valorada por escala analógica, que se iniciaba pocos minutos después de la aplicación y se mantenía durante varias horas. Los pacientes que no curaron experimentaron una clara mejoría de su sintomatología. Sorprendentemente, por las dosis usadas, sólo se registró un 33% de casos de cefalea ligera y transitoria como efecto secundario.
En las fisuras crónicas también se ha utilizado la nitroglicerina. En un ensayo151, posteriormente ampliado152, Loder et al consiguen una tasa de curación del 86% aplicando 0,5 g de pomada de nitroglicerina al 0,2%, dos veces al día durante 6 semanas. Algunos de los pacientes habían tenido una recidiva tras haber sufrido esfinterotomía y curaron. No se observó caída significativa de la PAMR en aquellos pacientes en los que el tratamiento fracasó, incluido uno con enfermedad de Crohn. La cefalea sólo apareció en el 20% de los enfermos y un 15% sufrieron recidiva, que en el 80% de los casos fue tratada con éxito con un nuevo tratamiento con nitroglicerina.
Los resultados anteriores fueron confirmados en un estudio controlado. En este estudio153, 80 pacientes con fisuras anales crónicas fueron distribuidos aleatoriamente para ser tratados con dos aplicaciones diarias de placebo o con 0,5 g de pomada de nitroglicerina al 0,2% durante 8 semanas. En el grupo activo el dolor se redujo significativamente a las 2 semanas, no siendo así en el grupo placebo. Al final de las 8 semanas, el porcentaje de curaciones en el grupo de nitroglicerina era del 68 frente al 8% en el grupo placebo. La cefalea se presentó en el 58% de los pacientes con tratamiento activo, pero también en el 18% de los pacientes que recibieron placebo. Sólo uno de los pacientes, del grupo de la nitroglicerina, suspendió el tratamiento debido a la intensidad de la cefalea. El porcentaje de recurrencia se fijó en el 8%, y todos respondieron a un nuevo tratamiento con nitroglicerina. La PAMR sólo descendió en un 35%, en los pacientes sometidos a tratamiento activo.
Desde 1997, fecha del último trabajo citado, han seguido apareciendo ensayos controlados y no controla dos sobre la eficacia de la nitroglicerina en las fisuras anales. Sorprendentemente, en 1999 Hyman y Cataldo154 publican los resultados de un estudio realizado
sobre 33 pacientes con fisuras anales, 16 agudas y 17 crónicas, en los que se empleó como tratamiento nitroglicerina tópica al 0,3% tres veces al día y tras la defecación. De sus resultados (porcentajes de curación del 19% para las fisuras agudas y del 6% para las cróni-
cas junto al muy alto porcentaje de efectos secunda rios [88%] y subsecuentes abandonos [10%]) concluyen que la nitroglicerina tópica produce más cefaleas que alivio de los síntomas. La ausencia de medidas para evitar la absorción a través de la piel de los dedos con los que se aplica la pomada, así como la inexistencia de un sistema de liberación que garantice la cantidad de pomada adecuada, le han sido imputados a este trabajo para explicar tan bajos resultados155. En este mismo año, Hasegawa et al156 publican un artículo en el que atribuyen a la terapia con nitroglicerina al 0,2% una tasa de curaciones de fisuras crónicas del 50%. Los mismos autores atribuyen este «escaso» porcentaje a la baja
dosificación y al escaso número de aplicaciones que se propugnó, entre 1 y 3 según la aparición de cefalea. Casi simultáneamente, Kennedy et al157 publican los resul tados de un ensayo aleatorio, doble ciego, controlado con placebo, con nitroglicerina al 0,2% tres veces al
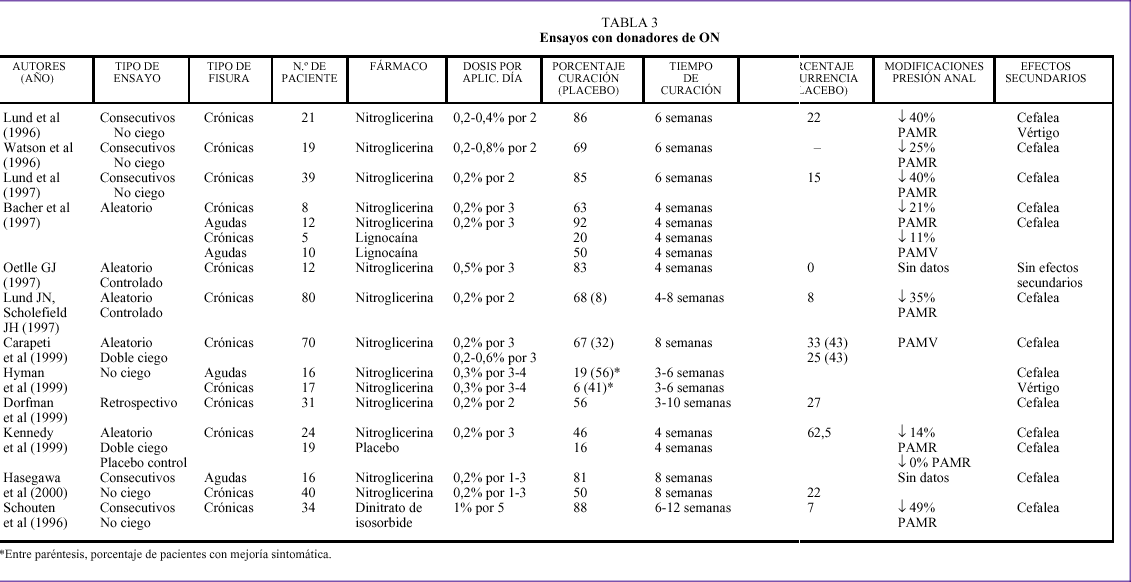
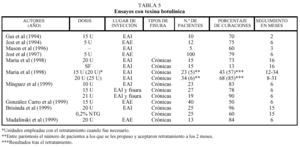
día frente a placebo. Se obtiene una tasa de curación del 46% a las 4 semanas, frente al 16% del placebo. Sin embargo, el porcentaje de recidivas es del 65% tras un seguimiento medio de 28,5 meses. Un segundo tratamiento con nitroglicerina disminuye el porcentaje de fracasos. La revisión retrospectiva de 31 pacientes tratados con nitroglicerina, realizada por Dorfman et al158, arroja resultados comparables. En la tabla 3 intentamos resumir los datos más sobresalientes de la mayoría de los trabajos citados.
Uno de los aspectos más controvertidos en cuanto al uso de nitroglicerina hace referencia a la dosis ideal que se debe utilizar159, y en relación con éste, la inexistencia de un sistema de liberación adecuado que garantice la cantidad de pomada que se va a manejar64,155. Watson et al15 trataron a un grupo de 19 pacientes con fisuras anales crónicas con 200 mg de pomada de nitroglicerina aplicada dos veces al día durante 6 semanas. La pomada contenía nitroglicerina en un abanico de concentraciones entre el 0,2 y el 0,8%. Para cada paciente se eligió la pomada que era capaz de producir un descenso de la PAMR superior al 25%. Seis pacientes, (31%), se excluyeron del estudio por diferentes motivos: efectos secundarios, retirada, intervención quirúrgica, etc. De los 13 restantes, nueve (69%) presentaron curación de sus fisuras a las 6 semanas de tratamiento. De ellos uno solo lo consiguió con una concentración del 0,2%. En este trabajo también se verifica que la duración del efecto de la nitroglicerina es menor de las 12 h previamente enunciadas por Loder et al151 y que el fenómeno de taquifilaxia, ya descrito en esta sustancia en su empleo como fármaco en la angina de pecho160, apareció en tres de los pacientes.
Carapeti et al22 realizaron, recientemente, un ensayo aleatorio y doble ciego sobre 70 pacientes en el que compararon la eficacia de nitroglicerina en dos grupos. El primero de ellos recibió nitroglicerina al 0,2% tres veces al día durante 8 semanas, mientras que el segundo recibió dosis crecientes de ésta que se iniciaron por concentraciones de 0,2% y se aumentaron un 0,1% por semana hasta alcanzar una concentración del 0,6%. Del análisis de los resultados no se obtienen diferencias significativas en el porcentaje de curaciones entre las dos formas de dosificación, pero sí en cuanto al número de recidivas (menor para el grupo de dosis crecientes). La ausencia de diferencias significativas en cuanto a los efectos secundarios, especialmente cefaleas, entre ambos grupos, es explicada por los autores a través del fenómeno de taquifilaxia.
Por su parte, Ferrández y Rial11 establecen que la concentración adecuada es la del 0,2%, ya que con un 0,4% o con un 0,3% la frecuencia de cefaleas es elevada.
El efecto que la nitroglicerina tiene sobre la presión anal es reversible, y los valores de la PAMR vuelven a los valores anteriores tras el tratamiento,lo que supone un riesgo para la recidiva. Los resultados tras un seguimiento medio de 28 meses evidencian un porcentaje de recidiva de los síntomas del 27%161.
Oettle162 compara los resultados de la esfinterotomía lateral internal con la aplicación de nitroglicerina al 0,5% en un pequeño estudio aleatorio y controlado. Aunque los resultados son más positivos para la intervención quirúrgica, pero sin significación estadística, se concluye que la nitroglicerina puede constituirse en una alternativa eficaz, y puede evitar la intervención en más de un 80% de los casos. Llama la atención la ausencia de recidivas y de efectos secundarios que presenta el tratamiento con nitroglicerina en este estudio.
Lo que sí parece bastante claro en ese momento es la superioridad del tratamiento con nitroglicerina sobre el convencional. Bacher et al163 comparan la efectividad de la pomada de nitroglicerina al 0,2% con un gel de lidocaína tanto en fisuras agudas como en crónicas. Demuestran la mayor eficacia de la nitroglicerina en ambos casos.
En cuanto a los efectos secundarios con nitroglicerina recordamos el moderado y transitorio dolor de cabeza, que puede llegar a durar hasta 12 h, junto con sensación de quemazón anal. Sin embargo, no se ha registrado ningún episodio de incontinencia. Los síncopes y otros efectos secundarios también son posibles164.
También se han utilizado otros agentes donadores de ON, como el dinitrato de isosorbide21. En este caso se realizó sobre 34 pacientes con fisuras anales crónicas, aplicándose un gramo de pomada al 1%, cinco veces al día, cada 3 h, y descansando durante el sueño. Todos los pacientes sufrieron cefalea moderada durante los primeros 2 días. El dolor anal desapareció en todos los pacientes antes de los 10 días de tratamiento. Se registró una caída del 49% en la presión de reposo, que se producía a los 5 min de la aplicación y se mantenía durante 41 min de media. Asociada a esta caída de la presión se produce un significativo aumento del flujo sanguíneo anodermal, valorado por flujometría Dop-
pler láser. Las tasas de curación a las 6, 9 y 12 sema nas fueron, respectivamente, del 41, el 65 y el 88%. El porcentaje de recidivas fue del 7%. No se especi fica si se usa el tratamiento conservador simultáneamente.
En definitiva, los donadores de ON son capaces de inducir la curación de las fisuras anales crónicas en un porcentaje entre el 46 y el 88%21,152,157, lo que consiguen por relajación de esfínter anal, confirmada mediante manometría con descenso de la PAMR de entre el 14 y el 49% y la ausencia, salvo excepciones, de disminución de la presión máxima voluntaria, con aumento consecuente del flujo anodermal. Por contra, además de los inconvenientes ya comentados de las cefaleas y la taquifilaxia, la corta duración del efecto de estos fármacos, entre 39 min y 9 h, obliga a una alta frecuencia de aplicaciones142 que dificulta el cumplimiento.
A modo de resumen, podemos afirmar que hasta principios del año 2000, los tratamientos con nitratos orgánicos, especialmente con nitroglicerina, presentaban una serie de ventajas con respecto al tratamiento quirúrgico que les permitirían en breve tiempo convertirse en el tratamiento de elección de las fisuras anales crónicas. Estas ventajas, de forma sintética, eran: a) eficacia similar en cuanto al alivio del dolor y algo menor en la curación; b) sin efectos secundarios graves o permanentes; c) no interfieren con la esfinterotomía, si es necesaria tras el fracaso de los donadores de ON; d) efecto reversible sobre el tono del EAI, y e) bajo coste (tabla 4).
Aunque algunos autores seguían manteniendo sus dudas165, la evidencia acumulada se consideró suficiente como para recomendar el uso de los donadores de ON por parte de los médicos de atención primaria166, y así lo hicieron167 y lo hicimos168. El procedimiento para obtener la pomada de nitroglicerina es sencillo: en nuestro país existe una presentación de nitroglicerina en gel (solinitrina gel 2%®); sobre esta base se solicita de los servicios farmacéuticos la preparación de una pomada al 0,2%, o la concentración que se considere, mediante dilución en parafina blanca suave. El resultado debe guardarse en un frasco protector de la luz. Los pacientes deben ser adiestrados en la forma y cantidad a aplicar, unos 500 mgs, e informados de los posibles efectos adversos. Se debe recomendar que se usen guantes o toallitas para la aplicación del producto, con el fin de evitar la absorción de nitroglicerina a partir de la piel de los dedos. El bajo coste del tratamiento (35 pesetas por día168) es otro factor importante a tener en cuenta.
La industria farmacéutica, siempre pendiente de estos avances, tiene en avanzado estado de investigación el lanzamiento de un producto para las fisuras anales. Se trata de una formulación que combina un donante de ON con un polímero hidrogel que permite una liberación constante y sostenida de la sustancia activa4. Se cree que la eliminación de los picos de absorción que se producen con el uso de la formulación magistral, permitirá una reducción importante de los efectos secundarios. De igual forma, una liberación sostenida podría aumentar el tiempo de acción sobre el tono del esfínter anal y la eficacia del tratamiento. La experimentación, en fase II, está pendiente de determinar la dosificación óptima.
Bloqueadores de los canales del calcio
El nifedipino, que ya había sido usado en el tratamiento de la acalasia169, también ha demostrado su capacidad para disminuir el tono del esfínter anal cuando es administrado por vía sublingual170. En el estudio citado se administraron 20 mg de nifedipino por vía sublingual a dos grupos de 10 individuos cada uno. El primer grupo estaba constituido por pacientes con prolapso hemorroidal o fisura anal, el segundo por personas sanas. A los 30 min se realizó una manometría confirmándose una disminución de la presión en el canal anal del 32% en el grupo de pacientes y del 24% en el grupo de sanos. Durante el ensayo no se registraron variaciones significativas de la presión sanguínea ni del ritmo cardíaco, pero 3 sujetos sufrieron una cefalea transitoria o rubicundez facial.
En un estudio con nifedipino oral administrado dos veces al día171 se consiguió la curación del 60% de los pacientes con fisuras anales, sobre un total de 15 tratados durante 8 semanas. Sin embargo, la presencia de efectos secundarios, cefalea y rubicundez facial fue demasiado alta, y el seguimiento demasiado corto172. En un ensayo aleatorio y doble ciego, Antropoli et al173 demuestran que el nifedipino en gel al 2% aplicado dos veces al día, durante 21 días, produce una tasa de curaciones del 95% en pacientes con fisuras agudas, en contraposición con el 50% de aquellos que fueron tratados con hidrocortisona al 1% más lidocaína al 1%. También confirman una disminución del 30% de la presión anal de reposo y del 16% de la presión máxima voluntaria. No se presentaron efectos secundarios sistémicos y sólo el 2% manifestó ligera y temporal rubefacción local. Tanto el grupo control como el grupo de nifedipino recibieron tratamiento con laxantes, dieta rica en fibra y la medicación fue aplicada con un dilatador anal.
El nifedipino presenta dos claras ventajas frente a la nitroglicerina: su mayor vida media y su estabilidad. Al aplicarlo localmente se suma a su efecto inhibidor de la contracción del esfínter, sus propiedades antiinflamatorias y el aumento que produce en la microcirculación. Sin embargo, no existen aún suficientes datos contrastados como para promover su uso extensivo174.
El diltiazem, otro bloqueador de los canales de calcio, también ha sido probado en el tratamiento de las fisuras anales. En un estudio piloto no aleatorio175, 10 de 15 pacientes curaron sus fisuras anales utilizando una pomada con diltiazem al 2% sin efectos secundarios.
Agonistas colinérgicos muscarínicos
En la revisión bibliográfica realizada sólo hemos encontrado un trabajo175 en el que se ha usado un agonista muscarínico, el betanecol, como agente terapéutico de las fisuras anales. Como ya comentamos en el apartado de fisiología, los agonistas muscarínicos producen una importante inhibición del tono del esfínter. En el citado estudio se consiguen porcentajes de curación similares a los obtenidos con nitroglicerina y diltiazem.
Antagonistas y agonistas adrenérgicos
Muy recientemente se han iniciado varios trabajos176,177 con fenilefrina tópica, agonista *-adrenérgico, en la incontinencia fecal. Este agonista adrenérgico aumenta el tono del esfínter anal. El camino inverso, el del uso de los antagonistas adrenérgicos para disminuir el tono esfinteriano, inició su andadura hace ya algunos años, pero sin frutos relevantes hasta el momento y con una efectividad pendiente de evaluar.
Los antagonistas *1-adrenérgicos se han usado en el tratamiento de la obstrucción uretral secundaria a hipertrofia benigna de próstata con buenos resultados178. En relación con la enfermedad rectal, el salbutamol (albuterol) inhalado, un ß2-adrenérgico, ha demostrado ser
capaz de reducir la duración de los episodios dolorosos en la proctalgia fugaz, por un mecanismo aún desconocido179. De igual forma, la indoramina, un antagonista *1, y el salbutamol, administrados por vía oral, producen una disminución significativa de la presión anal de reposo, tanto en individuos sanos como en pacientes con fisuras anales180,181. Sin embargo, el descenso de la presión es mayor en pacientes con fisuras anales cuando se usa salbutamol, e igual al de los controles sanos cuando se administra indoramina181. Esta aparente hipersensibilidad de los receptores ß también ha sido demostrada en estudios in vitro, empleando isoproterenol, otro agonista ß-adrenérgico76.
Toxina botulínica (TB)
De manera paralela al desarrollo de las investigaciones con donadores de ON, se han difundido diversas experiencias con TB en el tratamiento de las fisuras anales.
Las toxinas botulínicas son las proteínas neurotóxicas producidas por las bacterias anaerobias del género Clostridium, agentes patógenos del botulismo. Estas sustancias constituyen una de las toxinas más letales182. Se conocen siete serotipos de TB (de la A a la G). La infección humana por C. botulinum se produce esencialmente por la insuficiente esterilización de las conservas y está producida por los serotipos A, B y E183. La toxina A es la responsable del cuadro clínico más característico con parálisis flácidas duraderas; por esta razón, la toxina A aparece como la más interesante para los objetivos terapéuticos en el ser humano184.
Las propiedades miorrelajantes de la TB hacen que se utilice desde hace años para neutralizar ciertas hiperto nías musculares estriadas, en particular las distonías focales (blefarospasmo, distonías cervicales, laríngeas, oromandibulares, etc.), el hemiespamo facial, la disinergia esfinteriana urinaria, disfonía espasmódica, temblores y tics185. Inicialmente éste fue su espectro terapéutico, pero recientes trabajos tanto en animales como en el ser humano han sugerido su potencial interés en situaciones de hipertonía del músculo liso, tales como la acalasia y las fisuras anales186. Desde ese momento son cada vez más numerosas las circunstancias en las que la TB puede tener un papel terapéutico. Para una revisión de las nuevas aplicaciones de la toxina botulínica, recomendamos al lector la reciente publicación de Olalla et al187.
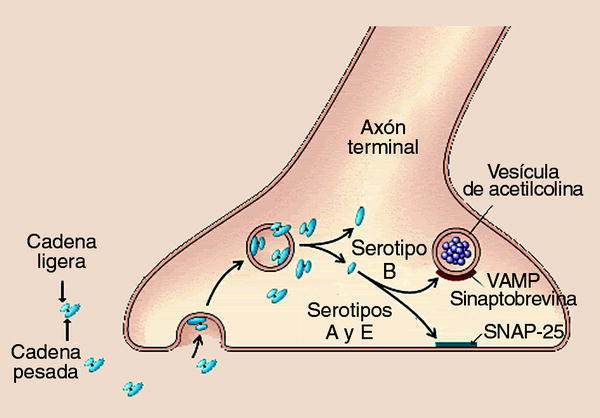
En relación con la estructura de la toxina botulínica recordaremos que se trata de proteínas bicatenarias de peso molecular aproximado de 150 kDa, constituidas por una cadena ligera (50 kDa) unida a una cadena pesada (100 kDa) por un puente disulfuro.
Su mecanismo de acción no está totalmente esclare cido188. Bloquean la liberación de acetilcolina en las terminaciones nerviosas sin destruirlas. Este bloqueo es irreversible pero se acompaña de una respuesta neuronal que supone la puesta en funcionamiento de nuevas sinapsis que permiten la recuperación funcional de la neurotransmisión.
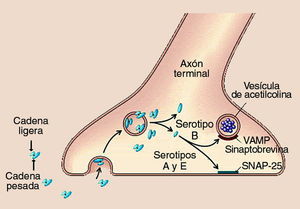
El modo de acción intracelular se produce en cuatro etapas (fig. 5): a) unión de la cadena pesada a receptores específicos de la membrana de las terminaciones nerviosas; b) internalización de la toxina con formación de una vesícula; c) liberación al citoplasma por la acción, como canal189, de la cadena pesada; reducción del puente disulfuro190; liberación de la cadena ligera, y d) bloqueo del mecanismo de liberación de la acetilcolina por la cadena ligera191, dependiente del calcio192.
Fig. 5. Esquema del mecanismo de acción de la toxina botulínica.
El último paso es diferente según el serotipo de TB del que se trate. En el caso de la toxina A, su cadena ligera, tiene como proteína diana a la SNAP-25193,194 (synap tosome-associated membrane protein of 25 kDa), una proteína de la superficie citoplasmática de la membrana presináptica, que conduce a un bloqueo de la liberación de acetilcolina195.
Sin embargo, la evidencia de que el bloqueo de la liberación de acetilcolina lleve, en nuestro caso, a la relajación del esfínter es poco convincente. Más aún cuando la acetilcolina tiene un efecto inhibidor sobre el tono de EAI, en varias especies196,197, y por tanto cabría esperar un incremento del mismo. Sin embargo, en otras especies198 su acción es la de un agonista de la contracción, e incluso en algunas tiene un efecto dual, estimulando la relajación por vía de la estimulación del sistema NANC, y la contracción por estimulación noradrenérgica199. De manera similar, en el ser humano, la acetilcolina ha sido descrita como inhibidora del tono30 y como productora de contracción del esfínter200. Con estos datos parece claro que el control neurológico y por tanto el papel de la acetilcolina sobre el tono del esfínter anal es una característica de especie.
Lo que sí está demostrado es que la inyección de toxina botulínica sobre el esfínter interno humano produce una disminución de la presión de reposo, sin alteración de la presión máxima voluntaria201, más dependiente del esfínter anal externo. Esto podría ser debido a que la toxina botulínica también antagoniza la respuesta a la noradrenalina pero no la respuesta de los NANC. Así, los neurotransmisores NANC actuarían, en presencia de toxina botulínica, sin la oposición de los receptores adrenérgicos, resultando en una disminución del tono anal202. Sin embargo, la inyección de la toxina sobre el esfínter externo203,204 también produce la curación, con disminución de la presión máxima voluntaria. El papel que el debilitamiento del esfínter externo tenga sobre la curación de las fisuras crónicas es aún controvertido. Por otro lado, pudiera ser que el efecto de la toxina botulínica sobre el esfínter interno sea el resultado de otras acciones de la misma, distintas del bloqueo de la liberación de acetilcolina, como el bloqueo de la liberación de noradrenalina o la inducción de actividad en la ON-sintetasa205. A buen seguro que el papel de los distintos sistemas en la inhibición del tono del esfínter interno por parte de la toxina botulínica será objeto de numerosos estudios en un futuro próximo.
Como terapéutica para las fisuras presenta una gran ventaja comparada con los donadores de ON: la duración de su acción206. Esta acción, aunque limitada y reversible en el tiempo, no precisa de una administración repetida, manteniéndose al menos durante 3 meses207. Esto, unido a la ausencia de daños permanentes sobre el esfínter, otorga a esta posibilidad terapéutica un gran atractivo.
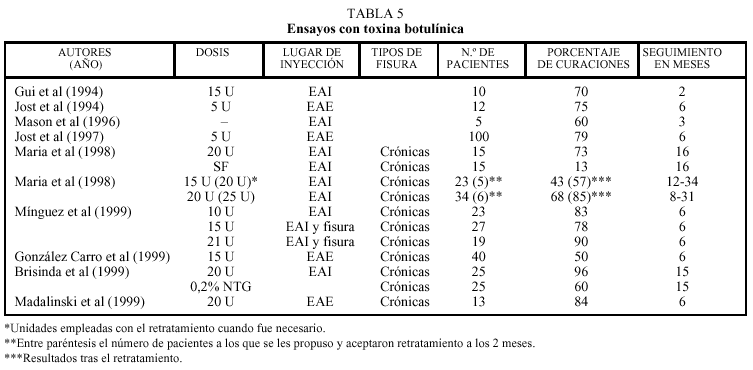
En cuanto a su capacidad para producir la curación de las fisuras, son ya bastantes los trabajos que aseguran tasas hasta del 96%. A continuación se resumen los resultados que a nuestro criterio han sido de mayor interés.
Los primeros en describir el uso de la toxina botulínica en el tratamiento de las fisuras anales son Jost et al203,204. Posteriormente, dos pequeños estudios201,207 notificaron la curación de 3 de 5 y 7 de 10, fisuras crónicas, respectivamente, con la inyección de toxina botulínica, confirmando también la reducción de la presión anal de reposo. Más tarde, dos nuevos trabajos208,209 con mayor número de pacientes (26 y 100, respectivamente) refieren tasas de curación superiores al 80% a los 3 meses de la inyección de toxina botulínica. En el segundo de los trabajos citados se describe una incidencia de incontinencia fecal transitoria del 7%. Trabajos del grupo de Jost reflejan una incidencia de casi un 25% de trombosis perianal tras la inyección de toxina botulí nica210.
En 1998 se publica el primer ensayo doble ciego controlado con placebo, del empleo de toxina botulínica intraesfinteriana en pacientes con fisuras anales crónicas14. El trabajo estaba bien diseñado y ejecutado y sólo puede señalarse que el grupo placebo tenía una edad significativamente mayor que el grupo de tratamiento activo. En el estudio, a los 2 meses del tratamiento, la toxina botulínica produce la curación de 11 de los 15 pacientes, por sólo 2 de los 15 que recibieron placebo (suero fisiológico). La toxina se inyectó en el esfínter interno, a diferencia de lo realizado en alguno de los trabajos previos. En los pacientes tratados la presión anal de reposo descendió 28 mm Hg de media, mientras que la presión máxima voluntaria no sufrió variación significativa. También, a diferencia de los estudios anter iores, la dosis empleada fue más alta (20-25 frente a 2,5-5 U). Los pacientes que recibieron placebo o que no respondieron al primer tratamiento con toxina recibieron una segunda dosis de 25 U. No se observaron recurrencias con un seguimiento de 16 meses de media. Quizá por el importante aumento en la dosis188. Sólo se registró un caso de incontinencia autolimitada a los gases.
Sin embargo, aún faltaba un ensayo que comparara la toxina botulínica con la nitroglicerina. Éste apareció en 1999, de la mano del mismo grupo de Roma211. El 50% de pacientes con fisuras crónicas son aleatoriamente asignados para recibir o 20 U de toxina botulínica inyectadas en el esfínter anal interno a ambos lados de la línea media anterior (grupo 1), o 1,2 g de pomada de nitroglicerina al 0,2% dos veces al día durante 6 semanas, (grupo 2). Ambos grupos fueron similares en cuanto a edad, sexo, duración de los síntomas y PAMR y PAMV basales. En la evaluación realizada a los 2 meses el 96% de los pacientes del grupo de la toxina habían curado frente al 60% de los que fueron tratados con nitroglicerina. Un único paciente del grupo de la toxina botulínica y nueve de los del grupo de la nitroglicerina sufrieron recidiva de su fisura que curó en los 10 casos cruzando el tratamiento recibido. Tras 16 meses de seguimiento no hubo nuevas recidivas. Los valores de la PAMR se redujeron en un 29% en el grupo 1 y en un 14% en el grupo 2, siendo las mediciones realizadas a los 2 meses de iniciado el tratamiento. Un 20% de los pacientes del grupo 2 refirieron cefaleas durante el tratamiento y uno lo abandonó por esa causa. No se registró ningún episodio de incontinencia en ninguno de los dos grupos. El ensayo no tiene ningún defecto formal en cuanto a su planteamiento y ejecución. De los anteriores datos se colige que la toxina botulínica es más efectiva que la nitroglicerina en el tratamiento de las fisuras anales crónicas.
Ya se ha comentado el desconocimiento existente sobre la función del esfínter externo en la patogenia de las fisuras anales. La inyección de toxina botulínica en el esfínter interno parece no alterar la dinámica del externo: la presión máxima voluntaria no se modifica. Sin embargo, dada la extrema delgadez del esfínter interno, y la capacidad de difusión de la toxina, es difícil ima ginar que ésta no tenga ningún efecto sobre el esfínter externo212. Parece claro que son necesarios nuevos es tudios que diluciden cuál es la participación del EAE en la patogenia y el tratamiento de las fisuras anales crónicas.
Cuando la toxina botulínica no produce la curación de las fisuras se ha indicado la esfinterotomía como alternativa terapéutica. Sin embargo, la reinyección de toxina botulínica en dosis más altas a las empleadas inicialmente (5 U en la dosis inicial y 10 U en la segunda), consigue tasas de curación del 63-73% en aquellos pacientes en los que el primer tratamiento o no fue eficaz o han sufrido una recidiva de la lesión. El aumento de la dosis se asocia a un aumento de la proporción de pacientes que sufre incontinencia fecal moderada (6,7%), pero sin efectos sistémicos213. Por tanto, el fracaso del primer tratamiento con toxina botulínica no debe considerarse indicación absoluta de esfinterotomía. En otras afecciones se puede utilizar hasta 50 o más tratamientos secuenciales con toxina botulínica sin riesgos adicionales. En cuanto a los factores de no respuesta, los trabajos se han centrado en el músculo esquelético, por lo que la transferencia de conclusiones debe hacerse con cautela. Entre estos factores se señala la atrofia muscular a la que pueden conducir los tratamientos múltiples y la aparición de anticuerpos séricos anti-TB214. Estos anticuerpos se presentan en una proporción variable de los casos tratados y pueden ser responsables de la ausencia de respuesta215. Entre las causas que determinan su aparición se establecen las dosis elevadas, repetidas y la proximidad de las zonas de punción (más de 100 U por inyección)216, situaciones que no se dan en las terapias empleadas para las fisuras anales, pero que hay que tener presente ante la posibilidad de reinyección antes sugerida.
Como en todas las terapias de reciente introducción, algunos aspectos aún están por establecerse claramente; en especial dos: la dosis de toxina botulínica a utilizar y el lugar donde se debe realizar la punción. En relación con el primer punto parece claro que tanto el alivio sintomático como el resto de aspectos clínicos son mejores a mayor dosis217 de entre las empleadas por los distintos autores y que oscilan entre 5 y 25 U. En cuanto al lugar de aplicación se han realizado ensayos sobre el esfínter interno, el esfínter externo, a ambos lados de la fisura, repartiendo la dosis total entre varios lugares, etc. Salvo excepciones, no parece que existan grandes variaciones en cuanto a los porcentajes de curación (tabla 5), pero el lugar de inyección determina parcialmente la dis minución de la presión anal de reposo y la difusión de la toxina218. También podría tener efecto sobre el tipo y número de complicaciones que aparecen219. Resulta evidente que son necesarios más trabajos para poder estandarizar la técnica en cuanto a los dos aspectos enunciados3.
En relación con los efectos secundarios, en el transcurso del tiempo, la relación de los mismos se ha ido acortando y reduciendo. Desde los trabajos iniciales de Jost210 en los que se relacionaba hasta un 25% de trombosis perianales, hemos pasado a extensos ensayos en los que se registran menos del 2% de infecciones en el lugar de la punción, menos del 2% de hematomas perianales y alrededor de 13% de incontinencia temporal de algún grado, siempre reversible de forma espontá nea217. En cuanto a las contraindicaciones para el uso de toxina botulínica, de nuevo debemos fijarnos en las establecidas para los pacientes tratados por enfermedades del músculo esquelético. La mujer embarazada o lactante, así como los pacientes con anomalías de la neurotransmisión (miastenia, síndrome de Lambert Eaton) constituyen las principales contraindicacio nes220. La utilización concomitante de tratamientos que puedan actuar sobre la neurotransmisión (curarizantes, polimixina, tetraciclinas, lincomicina, estreptomicina) y, por consiguiente, potenciar los efectos de la TB, están desaconsejados. La hipersensibilidad conocida a la TB y la alergia a la albúmina son igualmente contraindicaciones.
Un dato significativo que es importante recalcar es que con la aplicación de TB la necesidad de cirugía para estos pacientes puede reducirse hasta el 5% de los casos217. Sin embargo, y a pesar de los prometedores resultados es poco probable que esta terapia se aplique
a gran escala debido al alto coste221, que alcanza los 238 dólares (46.000 ptas; 280 euros) por tratamiento, frente a los 10 dólares (1.950 ptas; 11,7 euros) de un tratamiento con nitroglicerina222. Éste, junto a la fácil aplicación de otros recursos, será uno de los principales
escollos para que la técnica se aplique en atención primaria de salud223. Por otro lado, la técnica no necesi ta de un gran adiestramiento ni de especiales medios: una vez detectado por palpación el esfínter interno se procede la inyección de la TB por medio de una aguja de 27G sin que sea necesaria ni sedación ni anestesia local.
Otras posibles terapias
Como hemos podido comprobar hasta este momento, en los últimos 10 años se ha producido una expansión de nuevas terapias para las fisuras anales. Este impulso arranca del mayor conocimiento que sobre la inervación de EAI existe en la actualidad. Uno de los agentes con los que este impulso investigador se prolonga es la trimebutina (3,45-trimetoxibenzoato de 2-[dimetilamino]-2-fenilbutilo). Ho et al224 han confirmado su capacidad para reducir hasta en un 35% la presión anal de reposo. Usado como antiespasmódico y antisecretor gástrico, es una amina terciaria, derivada de la etanolamina. Actúa reduciendo los espasmos de la musculatura lisa y la secreción de diversos tipos glandulares mediante el bloqueo selectivo de los receptores muscarínicos de la acetilcolina en los órganos correspondientes; también posee acción antidopaminérgica. Sin embargo, el papel que pudiera tener en el tratamiento de las fisuras anales está aún por definir.
Conclusiones
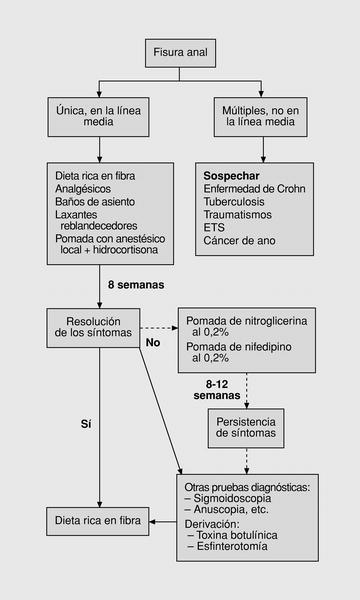
A partir de los datos recogidos en la anterior revisión bibliográfica, coincidíamos con Pitt y Boulos225 en que existía suficiente evidencia como para recomendar un cambio sustancial en el algoritmo de tratamiento de las fisuras (fig. 6). Así lo pusimos en práctica y lo comunicamos a nuestros respectivos centros de trabajo para su adopción.
Fig. 6. Segundo algoritmo: introducción de nuevas terapias.
Sin embargo, la reciente publicación del estudio de Altomare et al226, nos ha obligado a replantearnos la situación. Los autores realizan un ensayo multicéntrico, aleatorio, controlado con placebo y doble ciego sobre 132 pacientes con fisuras anales crónicas. Se asignaron a dos grupos, un grupo placebo y otro al que se le aplic aba 200 mg de pomada de nitroglicerina al 0,2% dos veces al día durante 4 semanas. A todos los pacientes se les recomendó firmemente la toma de lactulosa, una dieta rica en fibras, baños de asiento calientes y evitar el uso de papel higiénico. Los resultados de este ensayo contrastan con los referidos hasta el momento. El tratamiento con nitroglicerina es incapaz de demostrar su superioridad frente al placebo. Esta separación en los efectos obtenidos es difícil de entender dado que el protocolo seguido es muy similar al usado por autores previos. Lo que más llama la atención es el alto porcentaje de curaciones en el grupo placebo (51,7%), ya que resultados en torno al 50% como el de los autores con nitroglicerina, ya se habían registrado en otros estudios. Dos aspectos conflictivos del trabajo son la escasa duración del tratamiento, 4 semanas, y la cantidad de pomada administrada (200 mg). ¿Son insuficientes y ésa es la causa de los resultados? Sin embargo, con el mismo período, otros autores habían publicado tasas de curación de hasta el 83%. Lo mismo ocurre con la concentración de la pomada. Aún con estas dosis, refieren un 37% de pacientes con dolores de cabeza y seis abandonos. El porcentaje de recurrencia se sitúa en el 19% tras un seguimiento medio de 12 meses. Desde la perspectiva aportada por sus resultados definen el tratamiento con nitroglicerina como decepcionante.
Para Madoff227,228, la historia de la nitroglicerina como tratamiento de las fisuras anales es una historia repetida: un nuevo procedimiento aparece en escena con buenas perspectivas porque se basa en una nueva tecnología o en nuevos conocimientos. Los trabajos iniciales demuestran excelentes resultados. Pero el tiempo pasa y con él se introducen las complicaciones. Nuevas investigaciones demuestran que el procedimiento no es tan bueno como parecía al principio, sus efectos adversos son mayores de los esperados, o sus resultados no sobrepasan el de los anteriores tratamientos. Al final, el tratamiento es sólo efectivo en algunas circunstancias.
Sin coincidir plenamente con Madoff, creemos que algo parecido está ocurriendo con los donadores de ON y de ahí resultados como los de Hyman y Cataldo154 o los de este ensayo de Altamore et al. La variabilidad en la forma de preparación de la pomada o la ausencia de un sistema de liberación estándar que garantice la cantidad a aplicar son problemas que deben encontrar solución antes de que se pueda recomendar su uso exten sivo.
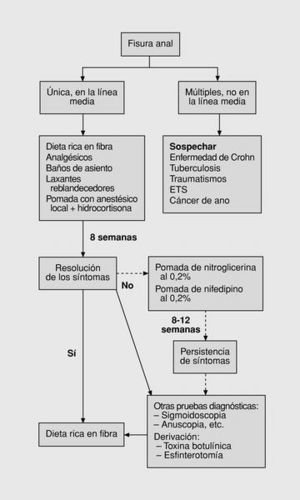
Desde la publicación del último trabajo referido, nuestro protocolo ha sufrido las convenientes rectificaciones (fig. 7) y así, coincidiendo con la propuesta previa de Banerjee9, creemos que en el ámbito de la atención primaria, las fisuras anales deben tratarse inicialmente con tratamiento conservador, piedra angular de la ter apéutica de esta afección. Si estas medidas fallan, o se aprecian características de cronicidad en las fisuras, debe derivarse a los pacientes al servicio de proctología correspondiente102. Los tratamientos con donadores de ON y nifedipino continúan siendo de interés, pero mientras no se resuelvan los problemas metodológi cos señalados deberían quedar en una segunda línea para el médico de atención primaria. Quizás encuen tren su hueco mientras se produce la consulta con el especialista, colaborando con el «virtual efecto tera-
péutico de las listas de espera»140, como una opción más en el tratamiento de las fisuras agudas229, o en los pacientes en los que la intervención quirúrgica esté desaconsejada227. Hoy por hoy la terapia con TB queda fuera del alcance de la atención primaria, a pesar de sus prometedores resultados.
Fig. 7. Tercer algoritmo: esquema actual.
Agradecimientos
Queremos expresar nuestro agradecimiento a Don Eduardo Achótegui Assailly, por la inestimable ayuda prestada para la consecución de algunos de los originales consultados para la realización del presente trabajo.