Existen más de cien mil especies de hongos en la naturaleza, de los que menos de 100 son patógenos en la especie humana. Son organismos eucariotas aclorófilos y heterotrofos que se reproducen sexual y asexualmente, envueltos por una pared celular compuesta de quitina, glucano, manano y otros polisacáridos y forman parte de un único reino: Fungi. Su posibilidad de crecimiento en las diferentes estructuras hace que se dividan en micosis superficiales, mucocutáneas y profundas.
El fenómeno biológico común más característico que presentan los hongos causantes de micosis profundas es su dimorfismo, es decir, existen en la naturaleza en fase miceliana (mohos) y cambian hacia la fase levaduriforme durante su etapa parasitaria.
Las micosis profundas o sistémicas son enfermedades frecuentes en países en vías de desarrollo y en países desarrollados con áreas en las que las circunstancias ambientales facilitan el desarrollo de los hongos que las producen. Estas enfermedades son especialmente frecuentes en toda América y determinadas zonas de África. Su incidencia no es demasiado alta en comparación con las enfermedades bacterianas, virales o parasitarias, pero al igual que éstas, su propagación puede ser facilitada por los viajes internacionales, emigrantes o la adopción de niños por familias de países europeos1.
La presente revisión tiene por objeto el estudio de las características de varias micosis, consideradas como enfermedades importadas, como son histoplasmosis, blastomicosis, coccidioidomicosis y paracoccidioidomicosis, especialmente en sus aspectos clínicos y de tratamiento, tanto en adultos como en niños.
Histoplasmosis
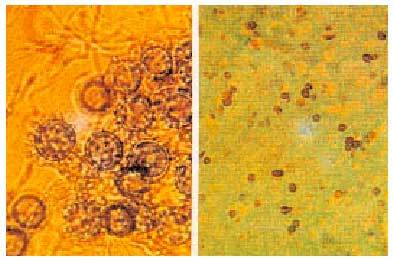
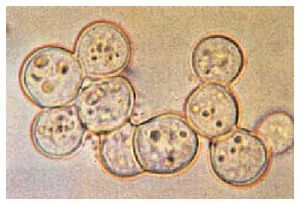
Esta enfermedad está producida por Histoplasma capsulatum, hongo dimórfico que crece como un moho en la naturaleza o en agar de Sabouraud a temperatura ambiente y en los tejidos humanos como levadura. Las hifas poseen dos clases de esporas: grandes y pequeñas, que permiten su identificación. También pueden ser identificadas mediante hibridación del ácido nucleico. H. capsulatum crece por gemación como una pequeña levadura en los tejidos y en agar enriquecido con glucosa, cisteína y sangre a 37 °C. A pesar de su nombre, el hongo no posee cápsula (fig. 1).
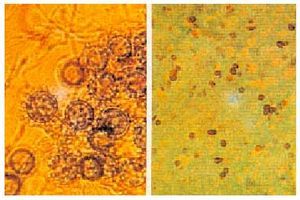
Fig. 1. Histoplasma capsulatum. Izquierda: forma de moho desarrollado en el medio de Sabouraud, con filamentos y paredes con macroconidias. Derecha: forma de levaduras que se encuentran en el tejido. (Coloración argéntica de Gomori).
Epidemiología
Este hongo es muy frecuente en diversas partes del mundo. En los EE.UU. aparece en regiones del centro, sureste y Atlántico medio, siguiendo los ríos Ohio y Misisipí, zonas en donde las circunstancias ambientales favorecen su desarrollo. H. capsulatum tiene especial preferencia por los suelos húmedos, donde abundan madera podrida, excretas de ciertas aves (palomas y gallinas) y murciélagos. Por esta razón, esta micosis aparece con relativa frecuencia en personas que manejan y se exponen al polvo que se forma al limpiar el suelo de gallineros y corrales, remover la tierra, o bien al practicar la espeleología. La histoplasmosis no se transmite de persona a persona. El período de incubación es de una a 3 semanas desde el momento de la exposición2.
Patogenia y anatomía patológica
Las pequeñas esporas o microconidias de H. capsulatum llegan a los alveolos tras ser inhaladas y allí se convierten en formas con capacidad de gemación. Con el tiempo se produce una fuerte reacción granulomatosa que puede ir seguida de caseificación o calcificación, como en la tuberculosis.
En los niños, la infección primaria suele curar completamente, pero pueden quedar calcificaciones punteadas en los ganglios del hilio o en pulmón. En ocasiones, una diseminación transitoria produce granulomas calcificados en el bazo. En el pulmón de la persona adulta puede quedar una masa redondeada de tejido cicatrizal con o sin calcificación central, conocida como histoplasmoma.
En algunos pacientes la histoplasmosis se convierte en una infección progresiva y potencialmente mortal. La enfermedad se manifiesta como una neumonía fibrosocavitaria crónica o bien como una infección diseminada. En ambos casos no hay historia de histoplasmosis pulmonar primaria aguda. La forma pulmonar crónica predomina en varones de más de 40 años de edad, fumadores en casi todos los casos. En los niños pequeños y pacientes inmunodeprimidos, como en enfermos de sida, se observan con frecuencia formas evolutivas agudas y rápidamente mortales de la enfermedad. En los adultos previamente sanos son más frecuentes las formas de infección diseminada, que son más crónicas pero igualmente mortales3.
Manifestaciones clínicas
La clínica pone de manifiesto gran polimorfismo, desde las formas totalmente asintomáticas hasta las crónicas o letales, pasando por las que cursan como un cuadro de gripe banal. Existen tres formas de histoplasmosis: infección pulmonar aguda, histoplasmosis pulmonar crónica e histoplasmosis diseminada progresiva4,5.
La mayoría de las infecciones agudas son asintomáticas o leves y permanecen sin diagnosticar. Las manifestaciones típicas son fiebre, cefalea, tos, dolor torácico y disnea, malestar y el hallazgo radiográfico de adenopatías hiliares con o sin una o más áreas de neumonitis. En algunas epidemias se han encontrado eritema nudoso, eritema multiforme y artritis.
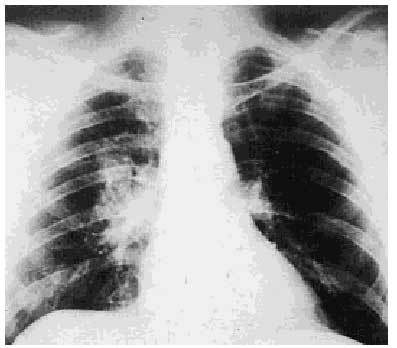
En los niños y en adultos jóvenes las adenopatías hiliares pueden producir temporalmente compresión del bronquio del lóbulo medio derecho. Puede aparecer también una mediastinitis fibrosa y, como consecuencia, pericarditis subaguda. Las estructuras mediastínicas quedan bloqueadas por la fibrosis progresiva que, al cabo de los años, puede producir compresión de las venas pulmonares, de la vena cava superior, las arterias pulmonares y el esófago (fig. 2).
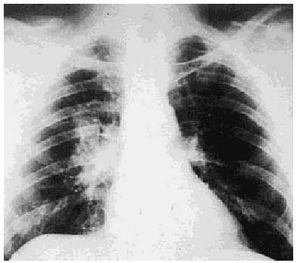
Fig. 2. Imagen radiográfica de una infección primaria por Histoplasma capsulatum, que evidencia infiltración multifocal irregular y sombras hiliares prominentes.
La forma pulmonar crónica de la histoplasmosis es una infección oportunista que se parece clínicamente a la tuberculosis en los pacientes adultos y es muy rara en niños. Se caracteriza por un comienzo gradual de semanas o meses, de tos con expectoración hemoptoica cada vez más abundante, pérdida de peso y, en ocasiones, fiebre y sudores nocturnos. La radiografía de torax revela infiltrados apicales fibrosonodulares uni o bilaterales. Un tercio de los casos permanece estable o mejora, y el resto empeora, apareciendo retracciones y cavidades en los lóbulos superiores. La aparición de enfisema y bullas compromete la función respiratoria. La muerte sobreviene al cabo de meses o años debido a cor pulmonale, neumonía bacteriana o por la propia histoplasmosis.
La forma diseminada de la histoplasmosis puede ser aguda, subaguda o crónica y puede confundirse con tuberculosis miliar. Afecta con frecuencia a niños lactantes e inmunodeprimidos y habitualmente cursa con fiebre, diarrea, adelgazamiento, hepatoesplenomegalia, adenopatías, ictericia, anemia, leucopenia y trombopenia. En un cuarto de los pacientes aproximadamente se han descrito úlceras induradas de la boca, la lengua, la nariz y la laringe. También se han descrito a lo largo de la enfermedad hepatitis granulomatosa, enfermedad de Addison, úlceras digestivas, endocarditis y meningitis crónica. La histoplasmosis ocular, como forma rara de histoplasmosis, puede manifestarse en forma de uveítis3,6.
Diagnóstico
El diagnóstico más efectivo se realiza mediante cultivo del agente etiológico. En el caso de histoplasmosis pulmonar crónica, el mejor método es cultivar el esputo. En los casos de histoplasmosis diseminada se emplea el hemocultivo y los cultivos de médula ósea, lesiones cutáneas, muestras de hígado y líquido de lavado broncoalveolar.
Los frotis de sangre y líquido del lavado broncoalveolar teñidos con Giemsa o frotis de tejidos infectados, como el pulmón, médula ósea o ganglios linfáticos, también se han empleado para el diagnóstico, así como la detección de antígenos de histoplasma en sangre y orina, y la demostración de anticuerpos frente a H. capsulatum mediante fijación del complemento. Los datos de laboratorio y los aportados por la radiografía de torax ya descritos pueden ayudar al diagnóstico. El diagnóstico diferencial debe efectuarse con leucemia, linfomas, sarcoidosis y tuberculosis.
Tratamiento
Los casos de histoplasmosis pulmonar aguda no precisan tratamiento. Los pacientes con fibrosis mediastínica pueden mejorar con la cirugía, pero tiene mal pronóstico. Todos los pacientes con histoplasmosis pulmonar fibrosonodular crónica deben recibir tratamiento quimioterápico.
En casos de pacientes, tanto adultos como niños, con formas graves de la enfermedad, inmonodeprimidos o con afección del sistema nervioso central, el fármaco de elección es la anfotericina B por vía intravenosa en infusión lenta durante varias horas, a dosis de 0,6 mg por kg de peso una vez al día. Este fármaco debe sustituirse por itraconazol en cuanto el paciente mejora, a dosis de 200 mg dos veces al día. Esta dosis puede reducirse a la mitad 10 semanas después si los valores de este preparado son de 2 µg/ml como mínimo. El tratamiento con itraconazol se debe administrar durante toda la vida a los pacientes con sida4,7.
En pacientes inmunocompetentes se puede iniciar el tratamiento con itraconazol a dosis de 200 mg dos veces al día durante 6 a 12 meses. También puede administrarse ketoconazol a dosis de 400 a 800 mg una vez al día en pacientes inmunocompetentes y sin afección del sistema nervioso central5,8.
La anfotericina B, pese a ser el fármaco antimicótico más importante, puede producir diferentes efectos adversos, como fiebre, naúseas, vómitos, cefaleas, mialgias, alteraciones de la función renal y anemia; también se han observado toxicidad cardiovascular, reacciones anafilácticas y convulsiones, especialmente en niños2.
Blastomicosis
La blastomicosis es una micosis producida por Blastomyces dermatitidis, hongo dimórfico que crece a temperatura ambiente como un moho blanco o bronceado, mientras que en el huésped o en temperatura a 37 °C adopta forma de células levaduriformes redondas y con gemación. Su identificación se lleva a cabo por su dimorfismo, su aspecto, las pequeñas esporas vehiculadas por las hifas del moho o por los resultados de la hibridación del ácido nucleico.
Epidemiología, patogenia y anatomía patológica
Esta enfermedad es rara y afecta a determinadas zonas y grupos de edad. Se observa principalmente en el sureste y centro de los EE.UU., Canadá, Africa, Centroamérica y, en raras ocasiones, en Suramérica. La máxima incidencia se encuentra en pacientes de 20 a 69 años y la relación varón mujer es de 10:1. El período de incubación es aproximadamente de 30-40 días.
Esta infección se adquiere al inhalar el hongo a partir del suelo que contiene excrementos de aves u otros animales, de la vegetación en descomposición o de la madera carcomida. No se transmite de una persona a otra. La primoinfección pulmonar puede curarse de forma espontánea o volverse crónica, en cuyo caso puede observarse invasión de otras zonas del pulmón, formación de cavidades o formación de lesiones endobronquiales. La infección suele diseminarse a la piel por vía hematógena, tejido subcutáneo, huesos, próstata, epidídimo y mucosa de la nariz, boca o laringe. Con menos frecuencia la infección invade cerebro, meninges, hígado, ganglios linfáticos y bazo. La infección puede no manifestarse durante semanas o años después de aparecer la lesión pulmonar. En la respuesta inflamatoria intervienen linfocitos, células gigantes y neutrófilos.
Manifestaciones clínicas
La blastomicosis se presenta como una infección pulmonar o extrapulmonar. Se han descrito tres formas de infección pulmonar: asintomática, neumonía aguda y neumonía crónica.
La blastomicosis pulmonar se manifiesta de forma aguda como una neumonía que cura de forma espontánea. Los signos y síntomas son fiebre, tos con expectoración y hemoptisis, mialgias y malestar general que suelen desaparecer al cabo de un mes. Los infiltrados pulmonares, así como los derrames pleurales que pueden aparecer, se resuelven lentamente conforme B. dermatitidis desaparece del esputo.
En gran parte de los casos la blastomicosis comienza de forma insidiosa y sigue un curso progresivo crónico. Aparecen fiebre, tos, pérdida de peso, lesiones cutáneas y dolores torácicos inespecíficos. En dos tercios de los casos aparecen signos radiográficos anormales, con uno o más infiltrados neumónicos o nodulares. Es raro que existan calcificaciones, adenopatías hiliares o grandes derrames pleurales.
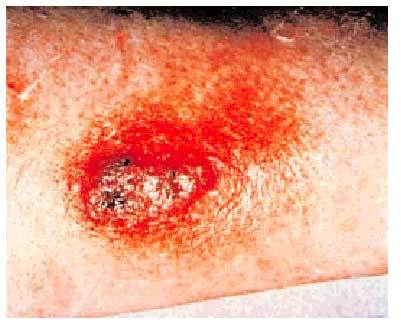
La enfermedad extrapulmonar o diseminada se manifiesta con lesiones cutáneas que predominan en las partes expuestas y aumentan de tamaño durante semanas pasando de pequeñas pápulas a lesiones verrugosas, costrosas o ulceradas bien delimitadas. El dolor y las adenopatías regionales son mínimas y las lesiones de las mucosas se parecen a las del carcinoma epidermoide (fig. 3).
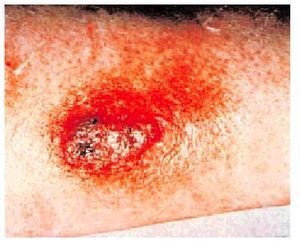
Fig. 3. Típica lesión cutánea costrosa y proliferativa, en un paciente afectado de blastomicosis diseminada.
Se pueden encontrar lesiones osteolíticas en casi todos los huesos, especialmente los planos del cráneo, vértebras y costillas, que se manifiestan como abscesos fríos o fístulas. La propagación a una articulación contigua puede causar inflamación en la misma. Las lesiones de la próstata y epidídimo se parecen clínicamente a las de la tuberculosis. En algunos pacientes existe infección del sistema nervioso central que se caracteriza por la apar ición de abscesos intracraneales o meningitis, así como blastomicosis laríngea que se manifiesta como una masa, tras infección primaria de vías respiratorias superiores9,10. El diagnóstico diferencial debe realizarse con la tuberculosis, sarcoidosis y cáncer. Se han referido casos excepcionales de infecciones intrauterinas o congénitas2.
Diagnóstico
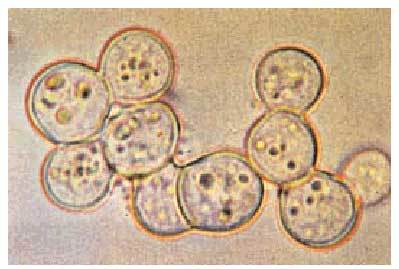
El diagnóstico se realiza demostrando la presencia del hongo en cultivo de esputo, pus, orina o líquido cefaloraquídeo. En ocasiones puede realizarse mediante la visualización del microorganismo en un frotis reciente o en corte histopatológico, aunque para ello se requiere cierta experiencia. La prueba serológica más efectiva es la inmunoabsorción enzimática, y las pruebas cutáneas son poco fiables (fig. 4).
Fig. 4. Células esféricas de levaduras gemantes de Blastomyces dermatitidis, con gruesas paredes refractarias, observada en biopsia de una lesión cutánea.
Tratamiento
El fármaco de elección es la anfotericina B a dosis de 0,6 mg por kg de peso y día, por vía intravenosa en casos de pacientes con infecciones graves, rápidamente progresivas o que causan meningitis. Si existen lesiones cutáneas y pulmonares no cavitarias deben tratarse durante 8 a 10 semanas a dosis total de 2 g en adultos. Las lesiones pulmonares cavitarias o las infecciones que se extienden fuera del pulmón deben tratarse durante 10 a 12 semanas con 2,5 g o más.
En pacientes con blastomicosis indolora no meníngea de gravedad leve o moderada el tratamiento debe realizarse con itraconazol a dosis de 200 mg dos veces al día tomados con alimento. También es eficaz el ketoconazol a dosis de 400 a 800 mg al día. Ambos fármacos se emplean durante 6 a 12 meses8.
Coccidioidomicosis
Esta micosis, también denominada fiebre del valle de San Joaquín, reumatismo del desierto y granuloma coccidioide, está producida por Coccidioides immitis. Se presenta en dos formas: como un moho velloso de color blanco en la mayoría de los medios de cultivo y en forma de esférulas sin gemación en los tejidos del huésped o en ciertas condiciones especiales. Este microorganismo se reproduce en los tejidos del huésped formando pequeñas endosporas dentro de las esférulas adultas. Al romperse, las endósporas que quedan libres aumentan de tamaño, forman esférulas y se repite el ciclo. El hongo se identifica por su aspecto y por formar esporas con forma de tonel de pared gruesa, llamadas artrosporas, en las hifas del moho.
Epidemiología, patogenia y anatomía patológica
Este microorganismo es un saprofito del suelo de ciertas regiones áridas de toda América. En los EE.UU. se encuentra preferentemente en Arizona, California y Texas. La infección se produce al inhalar las artrosporas del suelo vehiculadas por el aire. Esta primoinfección pulmonar sólo causa síntomas en un 40% de los casos, y oscila entre los de una enfermedad parecida a la gripe hasta los de una neumonía grave. No existe la transmisión de persona a persona y la infección congénita sólo se produce en casos excepcionales2.
Los casos de infección leve y curación espontánea llaman la atención por haber afectado a muchas personas de forma simultánea o por haber provocado reacciones de hipersensibilidad, como urticaria, eritema nudoso, eritema multiforme, eritema tóxico, artralgias, artritis y conjuntivitis. Pueden observarse múltiples casos en zonas determinadas tras 10 a 14 días después de la exposición al polvo en un área endémica mientras se buscan minerales, participan en maniobras militares o trabajan en la construcción. Los tornados pueden trasladar las esporas a zonas vecinas no endémicas y causar cierto número de casos agrupados de enfermedad.
La evolución habitual de la neumonía primaria producida por C. immitis es hacia la curación completa; no obstante, las zonas de neumonitis producen imágenes en las radiografías en forma de moneda denominadas ciccidioidomas. A veces, quedan como secuelas cavidades de paredes finas y puede existir derrame pleural. A pesar de ello, la curación espontánea de esta forma es frecuente.
Una complicación frecuente es la diseminación fuera del pulmón y de los ganglios hiliares. Ocurre con más frecuencia en sujetos de raza negra, filipinos, indígenas norteamericanos, mexicanos, mujeres embarazadas y pacientes inmunodeprimidos.
Esta micosis produce una reacción granulomatosa crónica en los tejidos del huésped acompañada con frecuencia de necrosis caseosa. Las lesiones pulmonares y de los ganglios hiliares pueden calcificarse. La infección induce la formación de anticuerpos IgM e IgG, pero ninguno de ellos ejerce un papel protector. La cantidad de anticuerpos IgG-específicos sirve para medir con cierta aproximación la carga del antígeno, es decir, la intensidad de la infección, y un título elevado de anticuerpos es signo de mal pronóstico.
Manifestaciones clínicas
La infección humana adopta tres formas: una infección primaria, benigna y que cura espontáneamente; lesiones pulmonares residuales, y forma diseminada, rara y a veces mortal. Esta enfermedad es más leve en los niños, aunque la incidencia de las complicaciones es como en los adultos. Se ha comunicado la transmisión de la infección de la madre al feto y de la madre al recién nacido11,12.
Los síntomas de primoinfección pulmonar aparecen tras un período de incubación de 1 a 4 semanas, con una media de 10 a 16 días y consisten en fiebre, tos, dolor torácico, malestar y, a veces, reacciones de hipersensibilidad, como las enumeradas anteriormente. En las radiografías de tórax pueden verse infiltrados, adenopatías hiliares y derrame pleural y puede existir ligera eosinofilia en sangre periférica. La mejoría comienza de forma espontánea después de varios días a 2 semanas de enfermedad y suele finalizar con una recuperación completa.
Las lesiones pulmonares residuales consisten en cavidades de pared fina y sus manifestaciones consisten en tos y hemoptisis en la mitad de los casos. En el resto de los enfermos no suele haber síntomas. En casos de afección pulmonar crónica progresiva se produce tos, expectoración, fiebre y pérdida de peso.
La forma diseminada es similar a la tuberculosis y aparece durante la primoinfección. En ocasiones hay reactivaciones acompañadas de diseminación años más tarde, especialmente si se sobreañade una enfermedad de Hodgkin, linfoma no Hodgkin, trasplante renal, sida u otra inmunodepresión. En casos de coccidioidomicosis pulmonar primaria debe sospecharse diseminación si aparece fiebre, malestar, adenopatías hiliares, elevación de la velocidad de eritrosedimentación y títulos elevados de fijación del complemento.
Con el tiempo, aparecen lesiones en los huesos, piel, tejido subcutáneo, vísceras, meninges y articulaciones. La meningitis puede ser también la manifestación inicial de esta micosis en su forma diseminada. Las lesiones cutáneas son insidiosas y maculopapulosas; los tejidos blandos y las lesiones óseas contienen pus y pueden dar lugar a fístulas. Sin tratamiento la coccidioidomicosis empeora hasta causar la muerte en un plazo de semanas a años13,14.
Diagnóstico
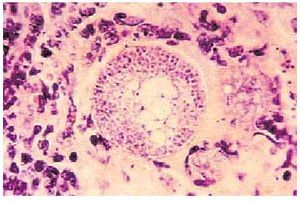
El diagnóstico se realiza mediante cultivos y preparaciones en fresco de esputo, orina y pus, para la identificación de C. immitis. También son útiles las biopsias en las que se puede investigar la presencia de esférulas más pequeñas, que deberán diferenciarse de las formas sin gemación de Blastomyces y Cryptococcus, aunque la morfología de las esférulas adultas tiene valor diagnóstico (fig. 5).
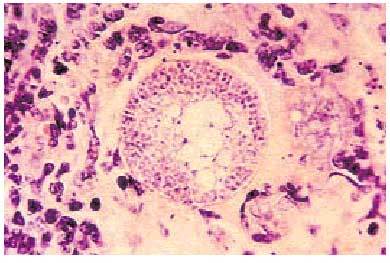
Fig. 5. Sección histológica del tejido pulmonar en el que se observa una esférula de Coccidioides immitis que contiene múltiples endosporas.
Las pruebas serológicas son de mucha utilidad, especialmente la aglutinación al látex y las pruebas de difusión en gel de ágar. La prueba de fijación del complemento se emplea fundamentalmente para estudiar el líquido cefalorraquídeo (LCR) y las situaciones de seroconversión.
Las pruebas cutáneas pueden ser útiles en los estudios epidemiológicos, como por ejemplo para delimitar una zona endémica, pero su utilidad como prueba diagnóstica es limitada, debido a la frecuencia de resultados negativos que se observan en las formas diseminadas y de cavidades de pared fina de esta enfermedad15.
Tratamiento
Las formas pulmonares primarias suelen desaparecer espontáneamente. No obstante, a veces pueden estar indicados anfotericina B o itraconazol con el fin de abortar la forma diseminada o el paso a una forma pulmonar crónica de la enfermedad.
En casos de infección grave o en la forma diseminada rápidamente progresiva está indicada la anfotericina B a dosis de 0,5 a 0,7 mg por kg de peso al día, por vía intravenosa. Tras la mejoría, a los 2 o 3 meses, se administra ketoconazol (400 mg al día), itraconazol (200 mg dos veces al día) o fluconazol (400-600 mg al día). Estos preparados se administran por vía oral y se mantienen durante años.
Los pacientes con meningitis por Coccidioides se tratan inicialmente con fluconazol (400 a 800 mg al día), asociado o no a anfotericina B por vía intratecal. En las lesiones óseas puede ser necesario el desbridamiento quirúrgico o drenaje de los abscesos, así como resección o desbridamiento de las lesiones pulmonares crónicas progresivas si éstas se circunscriben a un solo lóbulo pulmonar16.
Paracoccidioidomicosis
Esta micosis también denominada granuloma paracoccidioide, enfermedad de Lutz y blastomicosis Suramericana, está producida por Paracoccidioides brasiliensis, hongo dimórfico que crece por gemación como una levadura en los tejidos y como una levadura o moho en un medio de cultivo. Este microorganismo puede ser identificado tanto por su aspecto macroscópico como microscópico. A veces se confunde con Blastomyces dermatitidis.
Epidemiología
La áreas endémicas son Brasil y otras zonas de Suramérica y México, pero su carácter larvado puede condicionar que el diagnóstico se haga muchos años después de que el paciente haya abandonado el área endémica. El período de incubación oscila entre un mes y varios años. El hongo crece preferentemente en bosques tropicales húmedos o subtropicales lluviosos y la infección se adquiere al inhalar las esporas del ambiente, pero sigue sin estar claro el reservorio de este microorganismo en la naturaleza.
Manifestaciones clínicas
Inicialmente la infección pulmonar produce escasos síntomas y puede pasar inadvertida. La diseminación del hongo por la sangre hasta las mucosas de la boca, la nariz y otras zonas hace que el paciente acuda al médico. La clínica consiste en úlceras induradas y lesiones granulomatosas de la boca, la orofaringe, la laringe y la nariz. También existen adenomegalias con supuración, lesiones cutáneas y de los genitales, además de tos productiva, pérdida de peso, disnea y fiebre. La radiografía de tórax puede evidenciar signos de neumonía con focos dispersos bilaterales, lesiones nodulares y cavitación. En casos mortales la infección se propaga a las glándulas suprarrenales, tubo digestivo y otras vísceras2,17,18.
Diagnóstico
Los frotis y los cortes histológicos pueden identificar el microorganismo mediante examen directo y cultivos. Las pruebas serológicas, entre ellas la fijación del complemento y la inmunofluorescencia, ayudan a confirmar el diagnóstico y a controlar la respuesta al tratamiento. La intradermorreacción con antígeno fúngico sólo tiene interés epidemiológico.
Tratamiento
El tratamiento se lleva a cabo con ketoconazol o itraconazol a dosis de 200 a 400 mg al día, por vía oral, durante un año. En casos graves se utiliza la anfotericina B por vía intravenosa, a las pautas indicadas, seguida de itraconazol.