de estas categorías puede originar diagnósticos erróneos y acabar en procedimientos innecesarios y costosos. Así, evaluaremos la amenorrea según el trastorno se sitúe en el aparato genital, el ovario, la hipófisis anterior o en el hipotálamo
y el sistema nervioso central.
En la práctica diaria de la ginecología existen pocos problemas que representen un reto tan grande al clínico como el de la amenorrea. El médico debe examinar una serie de enfermedades que en muchos casos afectan a sistemas y órganos que no son frecuentes en el día a día del ginecólogo y que en ocasiones pueden implicar riesgos importantes de morbimortalidad para el sujeto afectado.
El objetivo de esta revisión es proporcionar unas pautas simples, entre las que se incluyen el diagnóstico y el tratamiento de este problema. A partir de esta primera base, y una vez orientado el caso, se pueden solicitar pruebas más detalladas que confirmen el diagnóstico y decidir la consulta con otros especialistas (psiquiatra, cirujano, neurólogo, endocrinólogo, etc.) que también pueden ser partícipes. Como se verá, en la mayoría de los casos los problemas pueden orientarse de una manera relativamente simple y ser tratados sin dificultad por el ginecólogo de cabecera.
Entendemos por amenorrea la situación en la que falta la menstruación a los 14 años con retraso del crecimiento puberal o de desarrollo de los caracteres sexuales secundarios o bien cuando tal sucede a los 16 años, con independencia del desarrollo y de la aparición de las características sexuales. Igualmente, cuando en una mujer que ya ha menstruado se produce la falta de menstruación durante un período equivalente a por lo menos tres intervalos del ciclo anterior, o 6 meses de falta del ciclo.
Sin embargo, debemos considerar que la aceptación estricta de estos criterios puede derivar en un tratamiento inadecuado de casos individuales. No hay razón para retrasar la evaluación de un paciente en el que sospechemos síndromes de Turner o de Morris. Además, cualquier paciente, con independencia de su edad, merece nuestra atención puesto que su ansiedad ya es de por sí un motivo de consulta. Finalmente, siempre se debe excluir la posibilidad de un embarazo.
Clásicamente se ha clasificado la amenorrea como primaria o secundaria según el momento de su aparición. Si bien este criterio es propio de las definiciones anteriores, la experiencia demuestra que la ubicación prematura de una paciente en estas categorías puede acabar en diagnósticos erróneos y en procedimientos innecesarios y costosos.
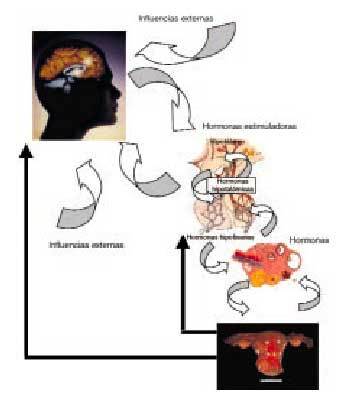
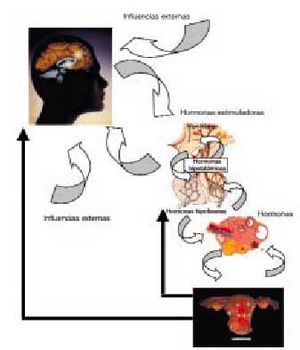
La fisiología del ciclo menstrual permite identificar varios compartimientos bien definidos de cuyo funcionamiento adecuado depende la menstruación regular. Así, evaluaremos la amenorrea según el trastorno se sitúe en (fig. 1) el aparato genital (primer compartimiento), en el ovario (segundo compartimiento), en la hipófisis anterior (tercer compartimiento) o en el hipotálamo y sistema nervioso central (cuarto compartimiento).
Fig. 1. Mecanismos de regulación del ciclo menstrual.
Evaluación de la amenorrea
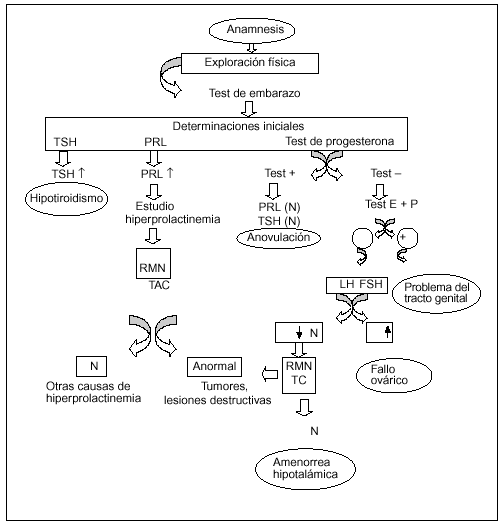
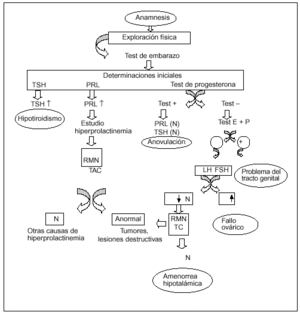
El inicio de todo estudio se fundamenta en la anamnesis y el examen físico, por los que ya se puede detectar signos de trastornos psicológicos, historia familiar de anomalías genéticas, problemas físicos, estado nutricional, y crecimiento y desarrollo anormales, entre otros. A continuación, se estudia a la paciente desde un punto de vista terapéutico y de laboratorio, según unas pautas de decisión que desarrollamos (fig. 2).
Fig. 2. Algoritmo diagnóstico de la amenorrea. TSH: hormona tirotropa; PRL: prolactina; RMN: resonancia magnética nuclear; TAC: tomografía axial computarizada; LH: hormona luteoestimulante; FSH: hormona foliculostimulante.
Tras descartar el embarazo, el paso inicial consiste en la determinación de los valores de hormona tirotropa (TSH) y prolactina (PRL), y la realización de un test de gestágenos.
Si bien las pacientes con amenorrea e hipotiroidismo en las que éste no se manifiesta clínicamente son poco frecuentes, la determinación de TSH está justificada porque el tratamiento del hipotiroidismo es sencillo y produce una rápida vuelta de los ciclos ovulatorios y la desaparición de la galactorrea.
La acción mantenida de hormonas de origen hipotalámico, como la hormona liberadora de tirotropina (TRH) en los casos de hipotiroidismo primario y de la hormona liberadora de gonadotropina (GnRH) en los casos de fallo ovárico prematuro, puede provocar el crecimiento de la hipófisis, y puede observarse en los estudios por imagen la existencia de un tumor o seudotumor hipofisario, que con el tratamiento apropiado puede llegar a desaparecer y observarse nuevamente una hipófisis de tamaño normal.
El objetivo del test de gestágenos es evaluar el valor de estrógenos y la integridad del tracto genital de salida. Consiste en la administración oral de progesterona micronizada (300 mg) o de acetato de medroxiprogesterona en administración oral, 10 mg diarios durante 5 días.
En los 2-7 días posteriores al tratamiento con gestágenos puede suceder que la paciente sangre o no. En caso positivo, se confirma la presencia de un tracto de salida funcional y de un endometrio reactivo preparado por los estrógenos de la propia paciente. Con esta demostración de la presencia de estrógenos, se establece la función mínima del ovario, de la hipófisis y del sistema nervioso central (SNC).
Cuando no se observa galactorrea y los valores séricos de prolactina son normales (inferiores a 20 ng/ml), no es necesario el estudio por imagen para descartar un tumor hipofisario si la mujer sangra en respuesta a la deprivación. En cambio, si los valores de prolactina son elevados, es imprescindible la evaluación de la hipófisis mediante estudios por imágenes.
Cuando el tratamiento con un gestágeno no produce un sangrado por deprivación, el tracto genital de salida no se encuentra íntegro o bien el endometrio no es funcional y no tiene lugar la proliferación endometrial inducida por estrógenos, en este caso se administra por vía oral un tratamiento estroprogestagénico combinado y secuencial (tratamiento hormonal sustitutivo [THS], anticonceptivos orales [ACO]) para estimular la proliferación endometrial y el sangrado por deprivación tendrá lugar siempre y cuando exista un útero funcionalmente normal y el tracto genital de salida esté abierto. Frente a un test negativo es prudente repetir el tratamiento con estrógenos para confirmar el resultado.
En este punto, la paciente amenorreica puede sangrar o no. Si no lo hace, se puede establecer el diagnóstico de un fallo en el primer compartimiento (endometrio, tracto genital de salida). Si lo hace, se puede suponer que el primer compartimiento funciona correctamente con una estimulación con estrógenos apropiada.
Desde un punto de vista práctico, cuando el examen de la pelvis demuestra genitales externos e internos normales, y cuando no existen antecedentes de infección ni de traumatismo (como legrado), es muy poco probable que haya un defecto en el tracto de salida.
El siguiente nivel diagnóstico permite determinar si la falta de estrógenos se debe a un fallo en el folículo (segundo compartimiento) o en el eje SNC-hipotálamo-hipófisis (tercer y cuarto compartimientos). La determinación del valor de gonadotropinas en estos casos nos permite clasificar las amenorreas con déficit estrogénico en hipogonadismos híper, hipo y normogonadotropos.
Hipogonadismos hipergonadotropos
Las concentraciones elevadas de gonadotropinas pueden tener graves implicaciones clínicas; por tanto, conviene repetir las determinaciones, para asegurar que no se trata de un estado transitorio. La probabilidad de asociación entre valores de gonadotropinas muy elevados y ausencia/atresia de folículos ováricos es muy elevada, pero no es segura al 100%. Existen situaciones poco frecuentes en las que, a pesar de existir valores elevados de gonadotropinas, los ovarios contienen folículos. Entre ellas se hallan los tumores productores de gonadotropinas, el déficit aislado de una gonadotropina, los adenomas hipofisarios secretores de gonadotropinas, la perimenopausia, el síndrome del ovario resistente, el fallo ovárico prematuro secundario a una enfermedad autoinmune, la galactosemia y el déficit de 17-hidroxilasa (P450c17).
Debe determinarse el cariotipo en todas las pacientes menores de 30 años con fallo ovárico e hipogonadismo hipergonadotropo. El mosaicismo con un cromosoma Y requiere la excisión de las gónadas, pues la presencia de componente testicular en la gónada conlleva un riesgo significativo de formación de un tumor maligno (gonadoblastomas, disgerminomas, tumores del saco vitelino y coriocarcinoma). Se debe tener en consideración el hecho de que casi el 30% de las pacientes con un cromosoma Y no desarrollan signos de virilización. Después de los 30 años conviene considerar la amenorrea con valores elevados de gonadotropinas como menopausia precoz.
El fallo ovárico precoz puede deberse a deleciones del cromosoma X. Debe considerarse que si bien el diagnóstico no es esencial para el tratamiento, estas anomalías se asocian con infertilidad por fallo ovárico precoz y esta información puede influir sobre las decisiones de planificación familiar del resto de los miembros familiares.
Hipogonadismos normogonadotropos
Una paradoja frecuente es el hecho de detectar en pacientes hipoestrogénicas (resultado negativo en el test de gestágenos) valores normales de FSH y LH. Si los valores de estas hormonas fueran normales, el crecimiento folicular se debería mantener y, por tanto, los valores de estrógenos deberían ser suficientes para inducir una respuesta de sangrado a la deprivación gestagénica. La respuesta está en la heterogeneidad de las hormonas glucoproteicas.
Las moléculas de gonadotropinas producidas por estas pacientes amenorreicas contienen mayores cantidades de ácido siálico en la porción de carbohidratos. Por ello, estas moléculas están cualitativamente alteradas y son biológicamente inactivas. Otra posibilidad más infrecuente es un trastorno hereditario de la síntesis de gonadotropinas que genera hormonas inmunológicamente activas, pero biológicamente inactivas.
Hipogonadismos hipogonadotropos
En mujeres con amenorrea hipoestrogénica con los valores de gonadotropinas bajos o normales es necesario determinar el origen, para distinguir entre una etiología hipofisaria o SNC-hipotalámica de la amenorrea; para ello contamos con estudios por imagen de la silla turca.
El procedimiento diagnóstico de elección es la resonancia magnética nuclear (RMN) con contraste o la tomografía axial computarizada (TAC) con cortes finos y contraste endovenoso.
La alta incidencia de adenomas hipofisarios en mujeres con amenorrea ha estimulado la búsqueda de un método diagnóstico fiable. Las pruebas de laboratorio no han demostrado su utilidad para distinguir trastornos hipotalámicos de hipofisarios. Estos tests incluyen la estimulación con GnRH o con TRH y otras pruebas para modificar la prolactina, la hormona de crecimiento y la secreción de hormona adrenocorticotropa (ACTH). La respuesta inhibitoria de la PRL tras la estimulación con TRH es la más frecuente, pero algunos pacientes con tumores responden normalmente. La variación en las respuestas a todas estas pruebas es la norma.
A las pacientes con amenorrea y sin galactorrea cuyo estudio por imagen es normal se clasifican como amenorrea hipotalámica. La etiopatogenia es la supresión de la secreción pulsátil de GnRH por debajo de un rango crítico. El diagnóstico se establece por exclusión al no poder evaluar el hipotálamo para confirmar el diagnóstico.
Trastornos compartimentales específicos
Una vez localizado anatómicamente el compartimiento afectado, el médico puede iniciar los pasos necesarios para definir el trastorno específico que provoca la amenorrea. En la tabla 1 se detalla por compartimientos la frecuencia de los trastornos más comunes que son causa de amenorrea.
Primer compartimiento: trastornos del aparato genital femenino
Síndrome de Asherman
La amenorrea en este caso es fruto de la destrucción del endometrio. Esta situación generalmente es consecuencia de un legrado posparto excesivo que provoca la creación de múltiples sinequias intrauterinas. En la histerografía se observa un patrón típico, pero el diagnóstico por histeroscopia es el más exacto ya que permite detectar adherencias mínimas que no son visibles en la histerografía. Estas sinequias pueden obstruir total o parcialmente la cavidad endometrial, el orificio cervical interno o el canal cervical. El síndrome de Asherman puede aparecer tras cualquier tipo de cirugía uterina, incluidas la cesárea, la miomectomía y la metroplastia. La histeroscopia con lisis directa de las adhesiones produce mejores resultados que el legrado. Después de la cirugía, se debe utilizar un método (DIU, foley pediátrica intrauterina) para impedir que la cavidad vuelva a sinequiarse. Debe iniciarse antes de la operación un tratamiento antibiótico de amplio espectro, que se continuará por 10 días. Además, se tratará a la paciente durante dos meses con altas dosis de estrógenos. En algunos casos puede ser necesario realizar procedimientos repetidos para recuperar el ciclo.
Anomalías müllerianas
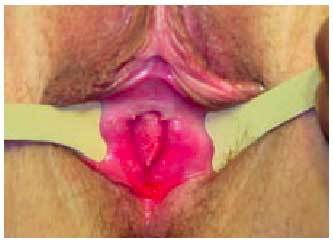
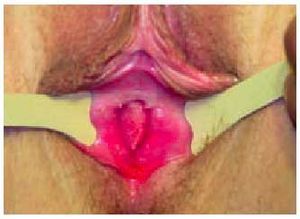
En casos de amenorrea primaria, se debe comprobar la integridad de los conductos müllerianos. Por medio de la exploración se puede descartar la presencia de un himen imperforado, la obliteración del orificio vaginal y la falta de continuidad de la vagina (fig. 4). Es posible que cérvix o útero estén ausentes y que el útero esté presente pero no la cavidad, o incluso que exista cavidad pero no endometrio. El problema clínico de la amenorrea por obstrucción es la aparición de un hematocolpos, hematometra o hemoperitoneo. En todos los casos, se debe intentar drenar desde la parte inferior.
Fig. 4. Agenesia de vagina en paciente con síndrome de Rokitansky.
La RMN nos permitirá determinar con precisión la anomalía anatómica y su extensión. Un correcto diagnóstico previo nos permitirá la planificación de la cirugía más adecuada.
Resistencia a los andrógenos (feminización testicular)
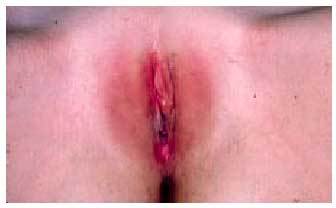
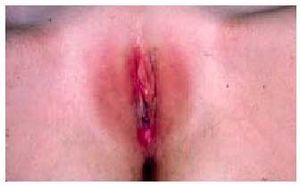
Ante una vagina ciega y ausencia uterina debe realizarse el diagnóstico diferencial con el síndrome de Morris o de resistencia a los andrógenos o feminización testicular. Debe sospecharse cuando la paciente presenta una amenorrea primaria, carece de genitales internos y de vello corporal y de niña presentó hernias inguinales (por falta de descenso testicular) (fig. 5). Este síndrome se caracteriza por fenotipo femenino normal, cariotipo masculino normal, y valores masculinos normales o ligeramente elevados de testosterona y elevados de LH.
Fig. 5. Ausencia de vello púbico en paciente afectada del síndrome de Morris o feminización testicular.
Segundo compartimiento: trastornos ováricos
En el 30-40% de los casos de amenorrea primaria debidos a problemas en el desarrollo de las gónadas se observan unas cintillas anormales: son las disgenesias gonadales. Estas pacientes pueden agruparse de acuerdo con los siguientes cariotipos: 45,X (50%), mosaicos (25%) o 46,XX (25%). Las disgenesias gonadales también pueden cursar con amenorrea secundaria. Los cariotipos más frecuentes en este caso son el 46,XX (el más frecuente), los mosaicos (45,X/46,XX) y las deleciones en los brazos cortos y largos de X. Con menos frecuencia es posible hallar 47,XXX y pacientes con síndrome de Turner.
Los dos cromosomas X deben estar presentes en los oocitos para que no tenga lugar la atresia folicular acelerada. El hallazgo de un cariotipo normal en pacientes con fallo ovárico probablemente implica alteraciones genéticas específicas para explicar la pérdida de actividad.
Síndrome de Turner
El síndrome de Turner es un trastorno genético caracterizado por baja talla, pterigium colli, tórax en coraza y mayor angulación en el codo, que cursa con un hipogonadismo hipergonadotropo. Estas pacientes se presentan con amenorrea primaria pues a falta de folículos ováricos no se producen esteroides sexuales en la pubertad. En las pacientes con síndrome de Turner se deben descartar trastornos autoinmunes (hipotiroidismo), anomalías cardiovasculares y renales. Se debe determinar el cariotipo de todas las pacientes con fenotipo de síndrome de Turner y gonadotropinas elevadas para confirmar la presencia de una única línea celular de un solo cromosoma X, propia del síndrome puro, pues el 40% de los sujetos con supuesto síndrome de Turner son en realidad mosaicos o padecen aberraciones estructurales en los cromosomas X o Y.
Mosaicismo
Descartar el mosaicismo es importante pues la presencia de un cromosoma Y o fragmentos del mismo implica la extirpación de las gónadas, pues el componente testicular dentro de la gónada predispone a la formación de tumores y a la virilización. Por tanto, también en adultos aparentemente normales con gonadotropinas elevadas se debe determinar el cariotipo para detectar un cromosoma Y silencioso y realizar la gonadectomía preventiva. Cuando el análisis citogenético estándar es dudoso, se debe continuar el análisis con sondas de ADN específicas para X e Y.
El impacto del mosaicismo, incluso sin una línea que contenga Y, es importante. Con un componente XX (XX/XO) es posible hallar tejido ovárico funcional dentro de la gónada tal que puede producir cierto grado de desarrollo femenino y, en ocasiones, hasta menstruaciones y reproducción, si bien la menopausia suele ser precoz, por aceleración de la atresia folicular.
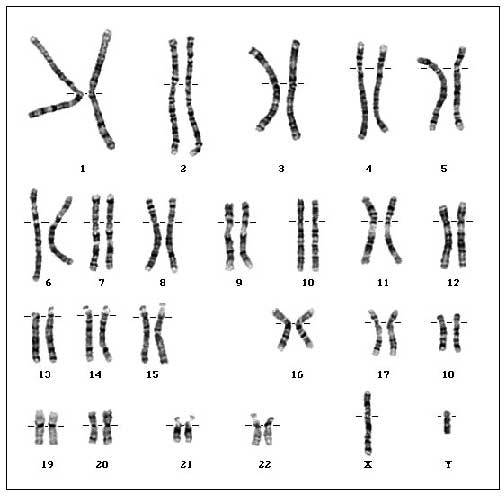
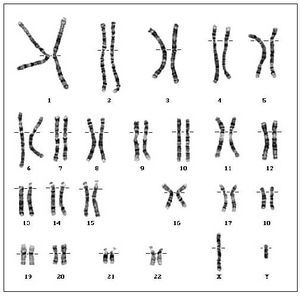
Disgenesia gonadal XY
También llamada síndrome de Swyer, se trata de pacientes con fenotipo femenino normal con sistema mülleriano palpable, valores de testosterona femeninos normales pero con cariotipo XY (fig. 6). La transformación tumoral de las cintillas gonadales puede ocurrir
en cualquier edad, y se deben extirpar al producirse el diagnóstico.
Fig. 6. Cariotipo normal 46 XY en paciente con síndrome de Swyer.
Síndrome de ovario resistente
Estos casos de hipogonadismo cursan con valores de gonadotropinas elevados a pesar de la presencia de folículos ováricos. La biopsia del ovario es el único medio diagnóstico, si bien su utilidad es más que discutible. El estudio histológico demuestra la existencia de folículos y la ausencia de infiltraciones linfocíticas, observadas en las enfermedades autoinmunes. El embarazo, si no imposible, es poco probable por lo que a estas pacientes debe proponérseles la donación de oocitos.
Fallo ovárico precoz
El fallo ovárico precoz es una entidad bastante común. Aproximadamente el 1% de las mujeres presentará un fallo ovárico antes de los 40 años y en mujeres con amenorrea primaria la prevalencia oscila entre el 10 y el 28%. En la mayoría de los casos, la etiología no se conoce, si bien probablemente se trate de un trastorno genético, con desaparición acelerada de folículos. En estos casos no es raro detectar anomalías en los cromosomas sexuales. Además, el fallo ovárico puede ser secundario a un proceso autoinmune, infeccioso o a irradiación o quimioterapia.
Aproximadamente entre un 10 y un 20% de los casos con cariotipos normales presentan recuperación espontánea de la función menstrual, por lo que no podemos asegurar que estas mujeres permanezcan estériles para siempre. La biopsia ovárica no está indicada y una investigación mínima (estudio inmunitario y evaluación de la actividad ovaricohipofisaria) es lo conveniente. Como en otros casos de amenorrea hipoestrogénica, está indicado el tratamiento hormonal. Sin embargo, por la posibilidad de ovulaciones espontáneas, los anticonceptivos orales son de elección si no se desea un embarazo. Frente al deseo de embarazo debe sugerirse, como mejor opción, la donación de oocitos.
Tercer compartimiento: trastornos en la hipófisis anterior
Los dos tumores hipofisarios más comunes son los adenomas secretores de prolactina y los tumores clínicamente no funcionales. En ocasiones la sospecha de un tumor hipofisario surge por los signos de acromegalia causados por la secreción anómala de hGH, o enfermedad de Cushing por exceso de ACTH. La amenorrea y/o la galactorrea pueden preceder a la eventual manifestación clínica de uno de estos tumores. Como la presentación inicial de la acromegalia puede evidenciar valores elevados de prolactina y amenorrea, se deben determinar las concentraciones de factor de crecimiento similar a la insulina tipo I (IGF-I) circulantes en todos los pacientes con un macroadenoma (> 10 mm de diámetro).
La mayoría de los adenomas no funcionales segregan FSH (subunidad alfa) y los pacientes suelen presentarse con síntomas secundarios al efecto masa. En los adenomas hipofisarios no se produce la regulación negativa de la secreción de gonadotropinas en respuesta al tratamiento con un agonista de GnRH a diferencia de lo que sucede en las hipófisis normales. En la mayoría de estos casos la amenorrea tiene lugar por la compresión del tallo hipofisario por el tumor y freno al envío de GnRH. Por ello, puede observarse un aumento de la prolactina en estas pacientes.
La hipofisitis linfocítica es una infiltración autoinmune que puede remedar un tumor hipofisario, y que con frecuencia ocurre en el embarazo o en los 6 meses posteriores al parto.
Adenomas hipofisarios secretores de prolactina
El tratamiento de elección de los prolactinomas (macro y micro) son los agonistas dopaminérgicos, con las dosis más bajas posibles. Los valores de prolactina pueden servir de marcadores. Suspender el tratamiento suele producir de nuevo el crecimiento tumoral por lo que la administración debe mantenerse durante largos períodos. Si hay respuesta al tratamiento es aconsejable repetir la RMN tras un año de tratamiento para evaluar el tamaño del tumor. La cirugía transesfenoidal está indicada cuando después del tratamiento farmacológico de un macroadenoma persisten la extensión supraselar o los trastornos visuales; igualmente debe considerarse para reducir masa en tumores de gran tamaño antes de iniciar el tratamiento médico a largo plazo. Raramente se indicará en los microadenomas, salvo expresa petición de la paciente bien informada. Los valores de prolactina suelen aumentar al interrumpirse el tratamiento dopaminérgico, si bien la mayoría de tumores no vuelven a crecer. Aproximadamente el 10% de los macroadenomas no se reducen con los agonistas de la dopamina, a pesar de la normalización de los valores de prolactina; estos casos son compatibles con tumores no funcionales que interrumpen el flujo de dopamina por compresión del tallo y entonces está indicada la cirugía. El tratamiento de los microadenomas se dirige a resolver la sintomatología: amenorrea, galactorrea y trastornos de la libido. Cuando se requiere de anticoncepción están indicados los anticonceptivos hormonales orales a bajas dosis pues no inducen el crecimiento tumoral.
El síndrome de silla turca vacía
En el síndrome de la silla turca vacía el diafragma selar está incompleto, lo que permite la extensión del espacio subaracnoideo hacia la fosa hipofisaria. El suelo selar puede estar desmineralizado por presión del líquido cefalorraquídeo y la hipófisis se observa reducida de tamaño y aplanada. En el 5% de las autopsias se demuestra una silla vacía, y el 85% de los casos son mujeres. La RMN en el estudio de la hiperprolactinemia ha demostrado una incidencia de silla turca vacía en el 4-16% de las pacientes que se presentan con amenorrea-galactorrea (fig. 7). En algunos casos la silla vacía se pudo originar por un infarto del tumor. La silla turca vacía no evoluciona a insuficiencia hipofisaria. Debido a la posibilidad de que coexista un adenoma, estas pacientes deben someterse a controles anuales para detectar, si fuera el caso, el crecimiento del tumor.
Fig. 7. Imagen de RM donde se observa la ausencia de la hipófisis en un síndrome de la silla turca vacía.
Síndrome de Sheehan
El síndrome de Sheehan es secundario a una hemorragia posparto que conduce al infarto y necrosis hipofisarios. Los síntomas de fallo hipofisario aparecen en el posparto inmediato, incluyendo la agalactia y la pérdida de vello en áreas sexuales. Los déficit de hGH y gonadotropinas son los más comunes; pero también puede cursar con déficit de ACTH y de TSH. Los déficit de ADH son muy extraños.
Cuarto compartimiento: trastornos del sistema nervioso central
Amenorrea hipotalámica
Las pacientes con amenorrea hipotalámica, la amenorrea hipogonadotropea más común, tienen un trastorno en la secreción pulsátil de GnRH. El diagnóstico es por exclusión de lesiones hipofisarias y suele asociarse a situaciones estresantes. En muchas mujeres la amenorrea hipotalámica se presenta asociada con trastornos alimentarios y con la práctica deportiva; aun así se deben descartar otros diagnósticos antes de iniciar un tratamiento sustitutivo o intentar una inducción de la ovulación.
Esta amenorrea se caracteriza por valores de normales o bajos de gonadotropinas, valores normales de prolactina, imagen normal de la silla turca y test de gestágenos negativo. A largo plazo, el 72% de los casos
de amenorrea hipotalámica por estrés o pérdida de peso se resuelve de forma espontánea. En este último caso, la recuperación de la función menstrual se asocia con la normalización del peso.
Las pacientes con amenorrea hipotalámica presentan un descenso en la frecuencia de los pulsos de GnRH por exceso de dopamina que puede deberse tanto al aumento de los opioides como de la dopamina endógenos.
Pérdida de peso, anorexia y bulimia
Anorexia nerviosa. Es una conducta anómala relacionada con la incapacidad de enfrentar el inicio de la sexualidad adulta. Tanto la anorexia nerviosa como la bulimia se caracterizan por un temor patológico a la gordura.
La obesidad puede cursar con amenorrea, pero en estos casos normalmente se debe a anovulación y no es hipogonadotropa, a menos que la paciente también presente un trastorno emocional. Por contra, la pérdida súbita de peso puede producir una amenorrea hipogonadotropa.
Clínicamente, puede cursar desde un período limitado de amenorrea asociada con una dieta estricta hasta una enfermedad grave con deterioro potencialmente mortal (la tasa de mortalidad asociada con esta entidad alcanza hasta un 15%). Es frecuente que el ginecólogo sea el primero en reconocer la anorexia nerviosa en una paciente que consulta por amenorrea.
El cuadro clínico suele aparecer tras una dieta para controlar el peso. Un ejercicio físico excesivo, incluyendo un gran número de actividades extraescolares, puede ser el signo inicial de la anorexia. Estas pacientes son competitivas y su rendimiento escolar suele ser superior a la media. Son frecuentes el retraso del desarrollo psicosexual y una iniciación sexual tardía.
Además de la amenorrea, los signos más comunes son el estreñimiento marcado, la hipotensión, hipotermia, sequedad de piel, vello suave en espalda y glúteos, bradicardia y edema. El abuso de diuréticos y laxantes puede provocar hipopotasemia. La hipercarotenemia, también frecuente, no siempre se asocia con la ingestión de grandes cantidades de vegetales, lo que sugiere un defecto en la utilización de vitamina A y puede considerarse un marcador metabólico.
Bulimia. Es un síndrome que se caracteriza por la ingestión compulsiva de gran cantidad de alimentos seguida de vómitos autoinducidos. La bulimia se observa en aproximadamente la mitad de los pacientes con anorexia nerviosa.
Los casos graves de anorexia nerviosa son tratados con mayor frecuencia por los psiquiatras. Sin embargo, las anoréxicas que están en el límite por lo general acuden al ginecólogo, al pediatra o al médico de la familia y se presentan como adolescentes con bajo peso, amenorrea e hiperactividad (buenas notas en los estudios y gran cantidad de actividades extraescolares). La amenorrea puede ser previa, coincidente o posterior a la pérdida de peso.
Las alteraciones del apetito, la sed, la temperatura, el sueño, el equilibrio autonómico y secreción endocrina asociadas a la anorexia son fruto de la disfunción de mecanismos regulados por el hipotálamo. El laboratorio cursa con valores de FSH y LH bajos, de cortisol elevados, prolactina normales, TSH y tiroxina (T4) normales, pero de 3,5,3'-triiodotironina bajo. Gran parte de los síntomas (estreñimiento, intolerancia al frío, bradicardia, hipotensión, sequedad de piel e hipercarotenemia) se pueden explicar por este hipotiroidismo relativo. Con el aumento de peso, todos los cambios metabólicos se corrigen y se normaliza el metabolismo. Si bien la secreción de gonadotropinas se puede recuperar con el aumento de peso, el 30% de las pacientes permanece amenorreico.
El origen central de esta amenorrea se sustenta en la demostración de la recuperación de la respuesta a la GnRH tras conseguir un peso aproximadamente un 15% más bajo que el ideal, y además esta recuperación de la respuesta ocurre antes de la reanudación de la menstruación. En las pacientes con anorexia nerviosa persisten los valores de gonadotropinas bajos. Con el aumento de peso, aparece la secreción episódica de LH asociada al sueño y con la recuperación total, el patrón de 24 h de picos fluctuantes. Esta serie de cambios relacionada con el aumento y la pérdida de peso se explica por el incremento y el descenso de la secreción pulsátil de GnRH. El neuropéptido Y puede ser el punto de unión entre el control de la ingestión y la secreción de GnRH. El neuropéptido Y se sintetiza en el núcleo arcuato del hipotálamo. Este péptido estimula el comportamiento alimentario e inhibe la secreción de gonadotropinas. Los valores de neuropéptido Y aumentan en respuesta al ayuno y se encuentran elevados en el líquido cefalorraquídeo de las pacientes anoréxicas.
Una explicación detallada de la relación entre la amenorrea y el bajo peso corporal es suficiente en algunas pacientes para retornar al peso y a la función menstrual normales. Si el progreso es lento, se debe iniciar tratamiento hormonal de sustitución. En adultos de menos de 50 kg, si persiste la pérdida de peso es recomendable la consulta con el psiquiatra.
La falta de un tratamiento rápido y eficaz obliga al médico a esforzarse para lograr un diagnóstico temprano del cuadro, para que la intervención psicológica llegue antes de que la gravedad del síndrome progrese, de ahí que los ginecólogos deban controlar el peso y la dieta de las jóvenes amenorreicas. La administración de bloqueadores de la recaptación de serotonina se reserva para pacientes con depresión clínica, lo que es bastante frecuente.
Ejercicio físico y amenorrea
El patrón de supresión hipotalámica y amenorrea es frecuente en las atletas, así como en las mujeres que realizan cualquier tipo de actividad que implica esfuerzo físico exagerado. Casi un tercio de las corredoras que conservan el ciclo tienen fases lúteas cortas o son anovuladoras. Cuando se inicia el entrenamiento antes de la aparición de la menarquia, ésta puede tardar en aparecer hasta 3 años y la posterior incidencia de trastornos del ciclo es superior. Se han propuesto diversas explicaciones posibles, como el valor crítico de grasa corporal y el efecto del propio estrés. Las atletas que pesan menos de 55 kg y pierden más de 5 kg al entrenarse son las que presentarán amenorrea con mayor frecuencia.
El inicio y la regularidad de la función menstrual requieren que el peso se mantenga sobre el nivel crítico y, por tanto, también la grasa corporal debe superar los valores críticos. En el control de estas pacientes es útil el normograma de Frisch, que se basa en el cálculo de la cantidad total de agua en el cuerpo como un porcentaje del peso corporal. Esto se relaciona con el porcentaje de grasa corporal: el percentil 10 a los 13 equivale a un 17% de grasa corporal (cantidad mínima necesaria para la menarquia) y el percentil 10 a los 16 años equivale a aproximadamente un 22% de grasa corporal (mínimo necesario para mantener la menstruación). Una pérdida de peso que oscile entre el 10 y el 15% del peso normal para la talla representa una pérdida de aproximadamente un tercio de la grasa corporal, lo que implica situarse por debajo del 22%, con lo que aparecen trastornos menstruales.
Defectos genéticos hereditarios
Los defectos genéticos que cursan con hipogonadismo hipogonadotropo son poco frecuentes. El déficit de secreción de la GnRH se observa en el síndrome de Kallmann y en la hipoplasia suprarrenal. Se ha descrito una mutación en la subunidad beta de LH y una mutación en la subunidad beta de FSH en casos de mujeres con amenorrea primaria pero no de la subunidad alfa de la FSH. La alteración de los genes de la subunidad beta se traduce en inactividad inmunorreactiva o biológica de la misma. En caso de deseo gestacional, el tratamiento de elección son las gonadotropinas exógenas.
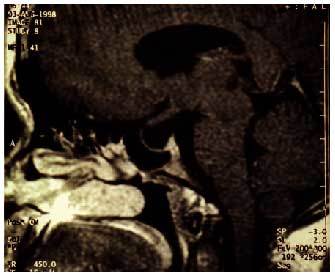
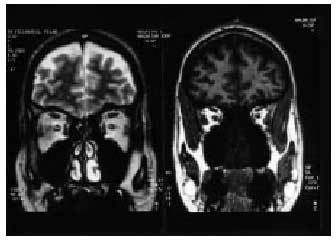
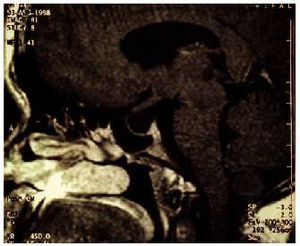
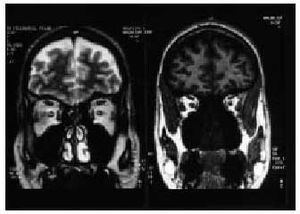
Síndrome de Kallmann. Este síndrome de hipogonadismo hipogonadotropo congénito por secreción deficiente de GnRH se asocia con anosmia o hiposmia y amenorrea. Es una entidad muy poco frecuente en las mujeres. Esta enfermedad se ha denominado de diversas maneras según el autor al que se atribuya la descripción original de este síndrome (Maestre de San Juan, De Morsier, Kallmann). En las mujeres, el trastorno se caracteriza por amenorrea primaria, falta de desarrollo sexual, valores bajos de gonadotropinas, cariotipo femenino normal y anosmia. No es extraño que las pacientes no perciban el defecto olfativo. Los ovarios conservan la capacidad de respuesta a las gonadotropinas, y es posible inducir la ovulación con gonadotropinas exógenas. El síndrome de Kallmann se relaciona con un defecto anatómico específico (fig. 3). La RMN y las necropsias demuestran la hipoplasia o la ausencia de surco y bulbo olfatorio en el encéfalo anterior. Este defecto es fruto de la falta de migración de los axones olfatorios y las neuronas productoras de GnRH desde la placoda olfatoria de la nariz. Las células que producen GnRH se originan en la región olfatoria y luego migran, durante la embriogénesis, a lo largo de las fibras del primer nervio craneano que conecta la nariz con el rinencéfalo.
Fig. 3. Imágenes de RM donde se observa la ausencia de los bulbos olfatorios y surcos en una paciente afectada de síndrome de Kallman.
Se conocen tres modos de transmisión hereditaria: ligada al cromosoma X, autosómica dominante y autosómica recesiva. El hecho de ser de cinco a siete veces más frecuente entre los varones sugiere que la transmisión ligada al cromosoma X es la más común. El síndrome de Kallmann cursa en ocasiones con otros trastornos causados por deleciones o traslocaciones de genes contiguos en el brazo corto distal del cromosoma X; así pueden observarse casos con baja talla o ictiosis y deficiencia de sulfatasas ligadas al cromosoma X. Las mutaciones ligadas al cromosoma X responsables de este síndrome comprometen a un solo gen (KAL) en el brazo corto del cromosoma X (Xp22.3) que codifica una proteína responsable de las funciones necesarias para la migración neuronal, la anosmina 1. El síndrome de Kallmann con anosmia y amenorrea ligado a mutaciones del cromosoma X se produce porque este complejo nervioso no penetra en el rinencéfalo, lo que impide la correcta migración de las neuronas productoras de GnRH. Pueden presentarse también otras anomalías de cariz neurológico, como movimientos especulares, deficiencias auditivas o ataxia cerebelar. Las mujeres que sufren este síndrome también pueden presentar anomalías renales y óseas, hipoacusia, discromatopsia y paladar o labio hendido, situaciones que apuntan la expresión del gen en otros tejidos.
Hipoplasia suprarrenal. La hipoplasia suprarrenal es un trastorno hereditario ligado al cromosoma X que cursa con insuficiencia suprarrenal y, en los supervivientes, hipogonadismo hipogonadotropo. Esta entidad tiene lugar por mutaciones del gen DAX-1, que codifica una proteína estructuralmente similar a los receptores para los que no se han identificado ligandos. En estos casos raros, se observa tanto una secreción deficiente de GnRH como una respuesta deficitaria a esta hormona.
Tratamiento hormonal
En las pacientes con amenorrea hipoestrogénica que no son candidatas a la inducción de la ovulación está indicado el tratamiento hormonal de sustitución. Esto incluye a las pacientes diagnosticadas de fallo ovárico, amenorreas hipotalámicas y menopausias quirúrgicas por ooforectomía bilateral en edad fértil.
Entre los motivos para indicar un tratamiento de reemplazo hormonal, uno de los más fundamentados es la relación existente entre el fallo ovárico precoz y la enfermedad cardiovascular. En este punto debe considerarse el hecho que las atletas y, en general, las practicantes de ejercicio físico presentan unos valores de colesterol de alta densidad superior a la media y que tiene acción cardioprotectora. Otro de los motivos es la prevención de la osteoporosis. La densidad mineral ósea de la mujeres depende, por una parte, del pico de masa ósea alcanzado al final de la adolescencia y, por otra, del mantenimiento de los valores de esteroides sexuales durante los años fértiles siguientes. La obtención de una mineralización ósea óptima en los primeros años de vida es clave, pues el riesgo de fracturas por osteoporosis depende de la masa ósea en el momento de la menopausia y de la tasa de pérdida de masa ósea tras ésta. Casi toda la masa ósea se acumula en los años posteriores a la menarquia y principalmente alrededor de los 18 años al fin de la adolescencia. Debe tenerse bien presente que ni el ejercicio físico más intenso llegará a compensar los efectos del hipoestrogenismo mantenido sobre los huesos.
Las mediciones regulares de densidad mineral ósea están indicadas para evaluar la eficacia del tratamiento hormonal y comprobar los cambios dietéticos y en los hábitos de vida.
En los casos de pacientes con amenorrea hipoestrogénica que se niegan a recibir tratamiento de reemplazo hormonal, debe recomendarse un suplemento de calcio a dosis de 1.000-1.500 mg/día. Cuando se combina con ejercicio físico, las dosis de calcio son más efectivas que el ejercicio o el calcio por separado. También debe sugerirse a las pacientes que reciben tratamiento hormonal de reemplazo que mantengan una ingestión adecuada de calcio y vitamina D.
Es importante informar a las pacientes que presentan amenorrea hipotalámica funcional que el tratamiento hormonal no evita embarazos no deseados, pues puede recuperarse inadvertidamente la función menstrual. Es conveniente tratar a las pacientes que desean planificación familiar con un anticonceptivo hormonal oral de bajas dosis, de modo que tanto se corrija la carencia estrogénica como se administre una anticoncepción eficaz. Es importante considerar esta opción en mujeres con fallo ovárico precoz porque la recuperación de la función ovárica puede pasar inadvertida. En casos en los que interese evitar la menstruación (p. ej., deportistas de elite) puede sugerirse la toma de anticonceptivos hormonales orales de modo continuado.
Bibliografía general
Balasch J, Vanrell JA. Los nuevos conceptos sobre el ciclo ovárico. Clin Invest Ginecol Obstet 1992;19:429-38.
Balasch J. Regulación neuroendocrina del ciclo genital. En: Vanrell JA, Iglesias X, Cabero Ll, editores. Manual de obstetricia y ginecología para pregraduados. Barcelona: Ediciones Científicas y Técnicas, S.A., 1994; p. 23-6.
Bouchard P, Caraty A, Coelingh Bennink HJT, Pavlou SN. GnRH, GnRH analogs, gonadotropins and gonadal peptides. New York: The Parthenon Publishing Group Ltd., 1993.
Calaf J, Webb S. Regulación central de la función gonadal. En: Vanrell JA, Calaf J, Balasch J y Viscasillas P, editores. Fertilidad y esterilidad humanas. Barcelona: Ediciones Científicas y Técnicas, S.A., 1992; p. 11-24.
Castelo-Branco C. Hormonas ováricas, hormonas hipotalámicas y gonadotropinas. En: Vanrell JA, Iglesias X, Cabero Ll, editores. Manual de Obstetricia y Ginecología para pregraduados. Barcelona: Ediciones Científicas y Técnicas, S.A., 1994.
Castelo-Branco C, Vicente JJ, Pons F, Martínez de Osaba MJ, Casals E, Vanrell JA. Bone mineral density in young hypothalamic amenorrheic women treated with oral contraceptives containing different doses of ethinyl estradiol. J Reprod Med 2001;46:875-9.
Castelo-Branco C, Vanrell JA. Pseudohermafroditismos femeninos. En: Pellicer A, Simón C, editores. Cuadernos de medicina reproductiva: amenorreas. Vol. 6, n.o 1. Madrid: Editorial Médica Panamericana, 2000.
Crosignani G, Vegetti W. A practical guide to the diagnosis and management of amenorrhoea. Drugs. 1996;52:671-81.
Cummings DC. Exercise associated amenorrhea, low bone density, and estrogen replacement therapy. Arch Intern Med 1996;156: 2193-5.
Drinkwater B, Nelson K, Chesnut C, Bremner W, Shainholtz S, Southworth M, et al. Bone mineral content of amenorrheic and eumenorrheic athletes. N Engl J Med 1984;311:277-81.
Gómez X, Castelo-Branco C. Repercusión ginecológica de la patología nutricional. Arch Ginecol Obst (Ur) 1999;37:189-93.
Gómez X, Castelo-Branco C. Trastornos nutricionales y amenorrea. Pautas diagnósticas. Salud Total de la Mujer 1999;1:49-52.
Hergendroeder A, O'Brian Smith E, Shypailo R, Jones L, Klish W, Ellis K. Bone mineral changes in young women with hypothalamic amenorrhea treated with oral contraceptives, medroxyprogesterona, or placebo over 12 months. Am J Obstet Gynecol 1997; 176:1017-25.
Pérez-López F. Hormonas y antihormonas en ginecología. Zaragoza: Prensas Universitarias de Zaragoza, 1998.
Speroff L, Glass RH, Kase NG. Endocrinología ginecológica e infertilidad. Barcelona: AWW. 2000.
Vanrell JA, Calaf J, Balasch J, Viscasillas P. Fertilidad y esterilidad humanas. Barcelona: Masson, 1999.
Warren M. Evaluation of secondary amenorrhea. J Clin Endocrinol Metab 1996;81:437-42.
Wolf AS, Esser Mittag J. Ginecología pediátrica y juvenil. Esplugues de Llobregat: EDIMSA, 2000.