Rickettsiosis: patogenia y fisiopatología
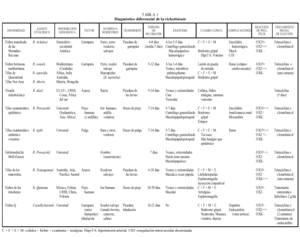
Las rickettsiosis son un conjunto de enfermedades producidas por microorganismos de la familia Rickettsiaceae. Las rickettsias son parásitos intracelulares obligados, cocobacilos gramnegativos pleomórficos. Se multiplican y dividen por fusión binaria transversal en el interior de las células huésped, igual que en animales y en el hombre, salvo la Coxiella burnetii (causa de la fiebre Q). Siguen un ciclo en el que interviene un insecto vector y un animal reservorio (tabla 1). La presencia de reservorio y vectores indígenas de la cuenca mediterránea es un problema que preocupa a los distintos países por posibles nuevos brotes1,2.
La infección se produce a través de la piel o el aparato respiratorio, mediante picadura del vector infectado, a través de las heces (la infección se produce cuando los microorganismos son restregados en la herida causada por la picadura) o también al inhalar el polvo infectado o heces secas del vector1,2.
Las rickettsias invaden en minutos las células endoteliales de pequeños vasos y de músculo liso. La lesión se produce al proliferar los microorganismos, que además pueden ejercer una acción citotóxica3 (ésta es la causa de las manifestaciones clínicas). Fenómenos de inmunidad humoral e hipersensibilidad retardada están implicados en el desarrollo de esta vasculitis, que es la lesión anatomopatológica básica. Se ha sugerido el aumento de prostaglandinas (PG1 y PG2) y leucotrienos (LTB4) en las células endoteliales y los macrófagos lesionados como causa del aumento de la permeabilidad capilar2.
Cada especie de rickettsia desencadena un proceso clínico específico, de distinta gravedad. Debido al tropismo por las células vasculares, producen vasculitis dérmicas, viscerales y del SNC. La R. conorii (causante de la fiebre botonosa) es menos agresiva que R. rickettsii (fiebre manchada de las Montañas Rocosas) y R. prowazekii (tifus epidémico)1,2.
Fiebre botonosa mediterránea
Etiología
La fiebre botonosa mediterránea es una enfermedad aguda endémica descrita por primera vez por Connor (que dio el nombre a la R. conorii) y Bruch en 1910.
El agente causal es la R. conorii (pleomórfico, de 0,2 * 0,6 micras, gramnegativo, se tiñe de rojo con Giemsa). Se transmite por la picadura de una garrapata ixódide (garrapata dura), que es el vector y reservorio habitual (Rhipicephalus sanguineus o garrapata del perro) la cual se adhiere a la piel y clava la trompa para succionar sangre de los vasos superficiales y se desprende a los 10-12 días. Puede producir reacción local por la picadura o la enfermedad como tal. Reservorios ocasionales pueden ser el perro y otros animales parasitados por la garrapata (liebre y roedores). Los perros y las
garrapatas no sufren daño.
La enfermedad es leve y se caracteriza por una lesión inicial (mancha negra), fiebre de varios días a 2 semanas de duración y erupción generalizada maculopapulosa eritematosa4,5. En la convalecencia aparecen anticuerpos específicos fijadores del complemento, pero las aglutininas frente a Proteus OX-19 se hallan presentes a títulos bajos.
Epidemiología
La infección se adquiere por vía cutánea, mediante la picadura de garrapatas infectadas por R. conorii (si la garrapata no está infectada, no produce la enfermedad), también por vía conjuntival, al frotarse el sujeto los ojos tras haber aplastado una garrapata.
Es endémica en la cuenca mediterránea (sur de Europa, sur y este de África, India y Oriente Medio), con alta incidencia en Cataluña. Produce brotes epidémicos en verano y otoño (80%)6. Se produce más frecuentemente en zonas rurales y suburbanas.
Afecta a ambos sexos, pero algo más frecuentemente a los varones. La mayor incidencia se da en niños de 0 a 9 años, y la menor en individuos de 15-44 años. En un 80% existe el antecedente de contacto con perros y ocasionalmente se conoce la picadura de garrapata5-8. Presentan alto riesgo los viajeros que se exponen a garrapatas y perros en áreas endémicas, sobre todo los que van a safaris en las tierras altas y los chaparrales.
Clínica
Normalmente, la evolución es la de una enfermedad leve, aunque existen casos fulminantes que pueden acabar con la vida del paciente (2,5%)6. El período de incubación es de 8-12 días.
La sintomatología tiene un inicio brusco con malestar general, cefalea intensa, fiebre elevada y otros síntomas (a veces enantema orofaríngeo y conjuntivitis). La tríada típica se compone de mancha negra, fiebre y exantema:
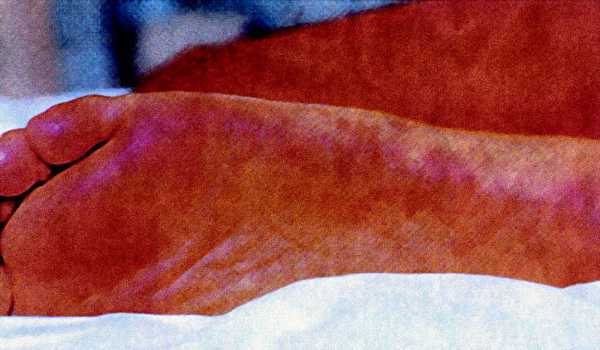
Mancha negra
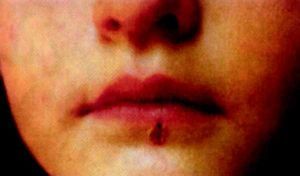
Es el chancro de inoculación de la garrapata. Su incidencia es variable (20-80%), aunque existen estudios donde se objetiva una incidencia del 70-80%5. Inicialmente, es una pápula que suele aparecer antes que la fiebre, después se convierte en una zona necrótica (escara negruzca) de 1-10 mm de diámetro, de bordes netos, ligeramente prominente, con un halo eritematoso, que al desprenderse no deja cicatriz, sólo una pigmentación residual. Es indolora y sólo ocasionalmente pruriginosa, por lo que muchas veces pasa inadvertida. Raras veces hay 2-3 cerca. En los adultos se suele localizar en zonas cubiertas, pliegues de flexión de extremidades inferiores, zona interglútea, ingles, genitales y tronco. En niños se localiza en las zonas ya mencionadas y, sobre todo, en la cabeza. Se suele acompañar de adenopatías satélites y, a veces, linfangitis7-9.
Fiebre
Aparece en el 90-97% de los casos, es alta (39-40%), continua, con ligeros descensos matutinos y resistente a antitérmicos. Desaparece entre el segundo y cuarto día de iniciado el tratamiento antibiótico correcto7-9.
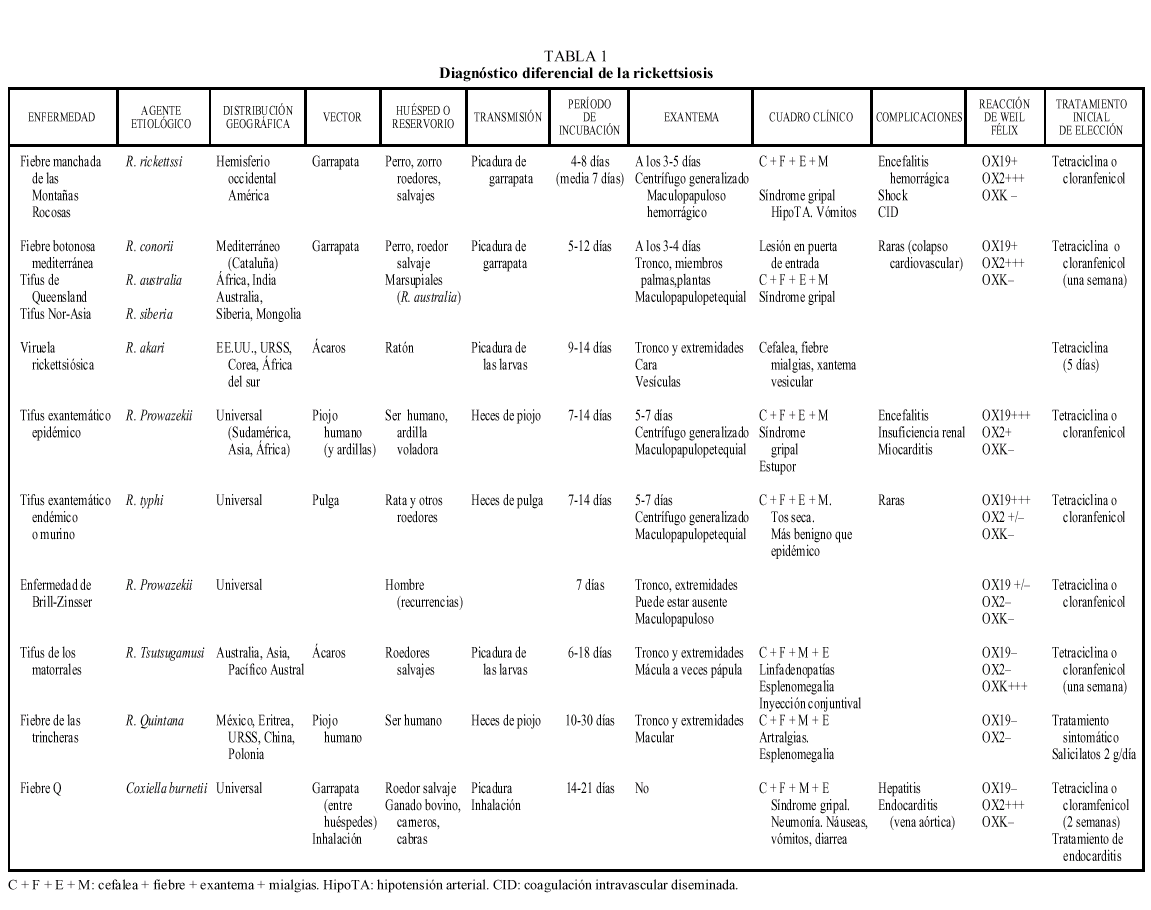
Exantema
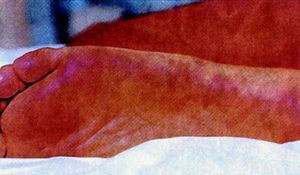
Aparece en el 90-96% de los casos entre el tercer y quinto día de evolución, coincidiendo con la exacerbación de la temperatura. Son maculopápulas eritematosas (primero máculas de 2-5 mm de diámetro que se convierten en pápulas y, posteriormente, se endurecen a modo de botones), no pruriginosas y no confluentes. En ocasiones se transforman en lesiones petequiales o púrpuras, por lo que es necesario hacer el diagnóstico di ferencial con la meningococemia y las infecciones virales. Se inicia en las extremidades inferiores y se generaliza rápidamente, afectando al tronco, el cuero cabelludo, la región palmoplantar y, levemente, la cara. Suelen persistir durante 15-20 días. A veces pueden adquirir, posteriormente, una coloración oscura e incluso hemorrágica. En ocasiones aparecen formas atípicas urticariformes, vesiculosas o nodulares.
Otros síntomas son mialgias intensas (que duelen más a la presión, sobre todo en los miembros inferiores), artralgias (principalmente de la rodilla y la región lumbosacra), en ocasiones mono o poliartrosis, dolor abdominal con náuseas y diarrea, hepatosplenomegalia y/o esplenomegalia, hipoacusia transitoria, congestión conjuntival bilateral, quemosis (por frotamiento del ojo con el dedo contaminado), etc. Sin embargo, existen casos en los que el único síntoma son las adenopatías, por lo que si una persona viaja a un área endémica hay que considerar esta posibilidad7-9.
Complicaciones
El pronóstico, por lo general, es leve, benigno, aunque puede producir la muerte en inmunodeprimidos y en ancianos7,8. En la infancia las complicaciones son poco frecuentes, aunque son graves si existe déficit de glucosa-6PDH.
Las complicaciones pueden afectar a cualquier órgano. Cabe mencionar los tipos siguientes:
Gastrointestinales: vómitos, diarrea, afección hepática (sólo se suele producir subictericia transitoria), hemorragia digestiva alta (HDA), pancreatitis.
Cardiovasculares: son raras, como miocarditis, pericarditis, arritmias, tromboflebitis.
Respiratorias: poco frecuentes, sobre todo pleuritis, derrame pleural.
Neurológicas: meningoencefalitis, convulsiones, accidentes vasculares cerebrales, radiculoneuritis, en ocasiones cuadro psiquiátrico.
Oculares: uveítis autoinmune, neurorretinitis.
Renales: proteinuria leve (frecuente) y fracaso renal (raro).
Osteomusculares: artritis.
Otras: anemia y trombopenia autoinmunes, alteraciones electrolíticas, síndrome mononucleósico, orquitis, coagulación intravascular diseminada (CID).
La resolución del cuadro se produce normalmente a los 10-20 días, sin secuelas. Se han descrito formas letales similares a la fiebre manchada de las Montañas Rocosas, donde aparecen alteraciones de la conciencia, afección hepática grave, alteraciones electrolíticas, insuficiencia respiratoria, CID, fracaso renal agudo y/o shock. El tratamiento antibiótico precoz es importante para evitar la alta mortalidad en estos casos7,8,10.
Diagnóstico
Se basa, sobre todo, en la clínica, los datos de laboratorio y la serología. Seguidamente, se exponen las distintas técnicas que existen:
Diagnóstico clínico. Consiste en identificar la tríada clásica, además de otros síntomas y los factores epidemiológicos de picadura de garrapata o el contacto con perros de caza, época del año1,2, etc. (figs. 1 y 2).
Fig. 1. Exantema con afección de plantas.
Fig. 2. Mancha negra.
Diagnóstico de laboratorio. Se deben valorar los siguientes aspectos: aumento de VSG; leucocitos normales, leucopenia o raramente leucocitosis, con desviación izquierda; no hay anemia o ésta es moderada, al igual que la trombopenia; se suelen elevar las enzimas hepáticas (GOP, GPT, GGT) sin signos de insuficiencia hepática; aumento de enzimas musculares (CPK, LDH, aldolasa). Todo lo anterior se normaliza habitualmente después de transcurrido un mes. Otras alteraciones pueden ser: hipoalbuminemia, aumento de creatinina, hiponatremia, hipocaliemia, alteraciones del sedimento urinario (leucocituria, proteinuria, microhematuria)1. El LCR es normal.
Diagnóstico por inmunofluorescencia directa. Permite un diagnóstico precoz biopsiando la mancha negra en los primeros días, visualizándose capilaritis y el germen dentro de las células endoteliales capilares7-9.
Cultivo. Se realiza mediante inoculación de sangre del paciente en ratones o conejillos de Indias, y es muy difícil de realizar y con alto riesgo de contagio para el personal.
Serología. Puede llevarse a cabo de 2 maneras distintas:
Inmunofluorescencia indirecta. Es la técnica más específica y sensible. Determina IgM específica diferenciando la infección aguda o la seropositividad residual. Se positiviza a partir del séptimo día de aparición del exantema (positivo a títulos superiores a 1/40). También se puede determinar la IgG (positivo a títulos superiores a 1/80). Se debe obtener una muestra para estudio en la primera consulta y a las 2 semanas del inicio de la clínica (las Ig aparecen al final de la primera semana y son máximas a las 3-4 semanas). Pero en niños aparecen falsos negativos debido a la inmadurez de su sistema inmune, por ello se debe repetir al mes del comienzo de la enfermedad7-9.
Reacción de Weil-Félix. Prueba de aglutinación cruzada de Proteus OX2 y OX19 por los anticuerpos del suero del enfermo. Tiene baja sensibilidad y falta de especificidad.
Anatomía patológica de biopsia hepática. Presenta un aumento de la fibrosis de espacios porta con discretos infiltrados de la células redondas y una hiperplasia de células de Kupffer, así como alguna necrosis focal en los lobulillos con acúmulos linfohistiocitarias sin formación de granulomas7-9.
Técnicas recientes. La PCR para la detección del ADN de R. conorii en coágulos de los enfermos. Es posible que se adopte esta técnica para el diagnóstico rápido de esta enfermedad.
Diagnóstico diferencial
Se debe realizar, en primer lugar, con otras rickettsiosis (el tifus epidémico respeta palmas y plantas y es raro en España, el endémico es más roseoliforme, en la fiebre tifoidea es más acusado el estupor y la esplenomegalia con un exantema más discreto); también con otras enfermedades exantemáticas (sarampión, rubéola, varicela en fase inicial de pápula, etc.), con infecciones meningocócicas, infecciones virales especialmente enterovirus, púrpura de Schönlein-Henoch y otras vasculitis, con heridas sobreinfectadas con linfangitis, etc.7,8.
Tratamiento
Es importante iniciar el tratamiento antibiótico lo antes posible, ya que acorta el período febril, disminuye los síntomas y evita complicaciones graves. Se produce una mejoría a las 24 h y la fiebre cede en 2-4 días, pero el tratamiento debe continuar hasta pasadas 48 h de la desaparición de la fiebre8,11. Los fármacos que se utilizan son:
Tetraciclinas. Es el tratamiento clásico y de primera elección. La tetraciclina produce daño en el esmalte dental y su dosis en adultos es de 250 mg/6 h o 500 mg/ 12 h v.o. o i.v. y en niños de 25-50 mg/kg/día en 4 dosis (máximo 2 g/día). La doxiciclina produce menor daño dental y se puede administrar en niños menores de 8 años si no han tomado tetraciclina o doxiciclina anteriormente8,11; la dosis en adultos es de 100 mg/12 h v.o. o i.v., durante 7 días o 2 días después de desaparecer la fiebre, y en niños es de 2-4 mg/kg/día, cada 12 h durante 7-10 días, o 4 mg/kg/24 h un día y 2 mg/kg/día durante 8 días5.
Debido a que en menores de 8 años las tetraciclinas a dosis acumulativas producen efectos sobre la dentición y osificación, se han llevado a cabo estudios en los que se demuestra la eficacia de la monodosis o una pauta corta de doxiciclina sin estos efectos secundarios: en adultos una dosis única de 200 mg y en niños una dosis única de 50 mg o 2,5-5 mg/kg/12 h en 2 dosis de carga, v.o. o i.v. (máximo 300 mg).
Cloranfenicol. Es eficaz, pero más tóxico, por lo que sólo se usa en casos graves que no responden a tetraciclina, por ejemplo si existen complicaciones neurológicas, ya que atraviesa la barrera hematoencefálica11. Algunos autores lo recomiendan en menores de 8 años y enfermos con alteración renal leve. La dosis en adultos es de 2-3 g/día v.o., i.v., i.m., en 4 dosis, y en niños de 50-75 mg/kg/día, en 4 dosis (máximo 3 g/día) o una dosis de 50 mg/kg y después 50 mg/kg/día, en 3-4 dosis.
Macrólidos. La josamicina está recomendada en alérgicos a las tetraciclinas, si no hay complicaciones en la enfermedad y en embarazadas, las dosis en adultos son de 1g/12 h v.o., durante 5 días, y en niños de 50 mg/ kg/8-12 h, durante 5 días. La eritromicina es menos eficaz que la tetraciclina, las dosis en adultos son de 250 mg/6 h o 500 mg/12 h, y en niños de 50 mg/kg/día, en 3-4 dosis.
Quinolonas. El ciprofloxacino es eficaz y se usa en adultos cuando no se está seguro del diagnóstico y se quieren cubrir otros microorganismos. Hay limitaciones para su uso en niños por el riesgo de que aparezcan alteraciones articulares sobre el crecimiento, en embarazadas y durante la lactancia12. La dosis en adultos es de 250 mg/12 h. Las dosis de levofloxacino en adultos es de 500 mg/24 h v.o o i.v.
Otros. Existen pocos estudios al respecto, por lo que no se suelen usar roxitromicina ni rifampicina. Son ineficaces los betalactámicos, los aminoglucósidos y el cotrimoxazol. Las resistencias no están descritas, debido a que los antibiogramas son difíciles de realizar.
Se puede usar paracetamol u otros analgésicos/antipiréticos y los medicamentos necesarios para el tratamiento de las complicaciones si aparecen. Si el estado de los pacientes presenta gravedad, es preciso proceder a su ingreso, administrar líquidos parenterales y aplicar otras medidas. Los glucocorticoides no son beneficiosos.
En casos especiales como en inmunodeprimidos, pacientes infectados por el VIH, etc., el tratamiento es similar.
Profilaxis
Hay que evitar la picadura de garrapata, el contacto con la caza (perros, etc.) sobre todo en verano y otoño. Hay que aplicar repelentes (dietiltoluamida, dimetiltalato) y usar ropa que proteja. El tratamiento de las garrapatas del perro se realiza con insecticidas.
Si ha picado la garrapata, hay que eliminarla completamente sin que quede el aparato chupador incrustado en la piel. Se deben eliminar cuanto antes, usando guantes y echando sobre la garrapata aceite, alcohol, nafta o queroseno.
No existe una vacuna específica debido a que, a pesar de que se produce inmunidad de grupo con R. rickettsii, la vacuna de ésta no protege contra R. conorii.
La profilaxis con antibióticos es controvertida. Se debe usar sólo en situaciones especiales (ancianos e inmunodeprimidos picados por garrapata), pues sólo demoraría el comienzo de la enfermedad, pero no su aparición14. Se puede utilizar doxiciclina durante 5 días a las mismas dosis que para el tratamiento o azitromicina. En un estudio croata se comprobó que tras ser picadas por garrapata 124 personas, se detectaron anticuerpos frente a R. conorii en el 31,5% de las que habían recibido profilaxis; de los que no recibieron profilaxis, el 25,6% contrajo la enfermedad y el 34,8% estuvo asintomático; los que recibieron profilaxis no se vieron afectados13.
Lo más importante es la vigilancia, y si aparecen signos clínicos hay que empezar el tratamiento.