Conceptos básicos
Curación. Se considera que una persona está curada en el momento en que no tiene ningún riesgo de recidiva de la enfermedad que ha padecido. Así, no basta con que no exista evidencia de enfermedad, hemos de tener la certeza absoluta de que la enfermedad no reapare-
cerá.
Consideramos que un grupo de pacientes está estadísticamente curado cuando el riesgo de fallecer es el mismo que un grupo de personas del mismo medio, estratificadas por edad y sexo, que no hayan padecido la enfermedad.
Curación del cáncer de mama. Un trabajo retrospectivo, realizado en la ciudad de Turku (Finlandia), estudió la supervivencia de 622 pacientes que habían sido diagnosticadas de cáncer de mama entre los años 1945 y 1969. El tratamiento que habían recibido fue sólo locorregional: mastectomía con o sin radioterapia sobre la pared torácica. Ninguna había seguido tratamiento sistémico alguno, ni quimioterapia ni hormonoterapia. Tras un seguimiento de 40 años no se pudo constatar que se llegase a un plateau. El porcentaje de supervivencia corregido, excluyendo otras causas de fallecimiento distintas al cáncer de mama, fue de 36% a los 20 años, el 32% a los 30 años, y el 29% a los 40 años del diagnóstico1.
El pronóstico estaba relacionado con el tamaño del tumor primitivo, el tipo histológico, con el grado nuclear y la afección ganglionar. La no aparición de cáncer de mama contralateral era factor protector y dicho subgrupo parecía alcanzar un plateau a los 30 años.
En la actualidad, no tenemos bases científicas para afirmar que podemos curar el cáncer de mama. El seguimiento que tendríamos que tener de los diferentes tratamientos que se investigan en la actualidad tendría que ser superior a los 20 o 30 años.
Se considera que una paciente con cáncer de mama está curada en el momento en que no tenga ningún riesgo de recidiva de enfermedad. Se considera que una paciente con cáncer de mama está individualmente curada cuando fallece por causas distintas al cáncer de mama.
Quimioterapia adyuvante dentro de ensayos clínicos
Los primeros ensayos clínicos controlados, que estudiaron el papel de la quimioterapia con finalidad adyuvante en el cáncer de mama se iniciaron en los años setenta. Dos fueron los grupos que publicaron los primeros resultados positivos uno americano y multicéntrico encabezado por B. Fisher, y el segundo, italiano, realizado en el Istituto per la Cura dei Tumori de Milán. Bonadonna publicó en 1976 un trabajo que incluía un total de 386 pacientes intervenidas de cáncer de mama2. Las pacientes habían sido mastectomizadas y tenían ganglios positivos en la disección axilar, siendo el estudio de extensión negativo para metástasis. Las pacientes fueron aleatorizadas en dos grupos: el primero no seguía ningún tipo de tratamiento sistémico adyuvante, el segundo seguía tratamiento sistémico con quimioterapia según el esquema CMF (ciclofosfamida, metotrexato y 5-fluorouracilo).
La primera publicación, en 1976, demostraba que tras 5 años de seguimiento el grupo de pacientes que habían sido tratadas con CMF tenían una supervivencia libre de enfermedad y una supervivencia global superior al grupo de pacientes que sólo seguían control clínico. Estos datos fueron repetidamente confirmados a los 10, 15 y 20 años.
El beneficio del tratamiento era evidente en pacientes premenopáusicas especialmente, cuando la afección axilar era de 1-3 ganglios. No se evidenciaba ninguna diferencia en el desarrollo de amenorrea en las pacientes premenopáusicas en lo que se refería a la supervivencia.
Dosis
En 1981 Valagussa comprueba, en el mismo grupo de pacientes que siguieron CMF en el trabajo de Bonadonna, la relación de la dosis de quimioterapia administrada con la supervivencia. Así, este autor observó que, cuando se administra entre el 85 y el 100% de la dosis total calculada, se obtiene el máximo de beneficio en supervivencia del régimen CMF. Confor-
me se disminuye el porcentaje de quimioterapia administrada, empeora la supervivencia. Cuando la dosis administrada es inferior al 65% de la dosis prevista el beneficio con respecto al grupo control es nulo, similar a la no administración de quimioterapia3.
Así, se desarrolló el concepto de dosis-intensidad, que relaciona la dosis del fármaco administrado por superficie cutánea con el tiempo expresado en semanas (mg/ m2/semanas).
Dosis-densidad y tratamiento secuencial
La dosis-densidad es un concepto nuevo que busca mejorar la relación dosis-intensidad de los quimioterápicos cuando estos se administran en asociación. Así, se considera que la administración de un fármaco de forma secuencial mejora la efectividad del mismo.
La primera asociación secuencial que se demostró eficaz en el tratamiento adyuvante del cáncer de mama fue ADM-CMF. El estudio se realizó en 405 pacientes con 4 o más ganglios positivos5. Se aleatorizaron a seguir 4 ciclos de adriamicina en monoterapia seguidos de 8 CMF (ADM-CMF) o a alternar una dosis de adriamicina con 2 de CMF (ADM/CMF). Con ello, se buscaba mejorar la dosis densidad de la adriamicina y del CMF.
El intervalo libre de enfermedad fue del 42% a los 10 años de las pacientes tratadas con el esquema secuencial ADM-CMF, frente al 28% de las pacientes tratadas con el régimen alternado ADM/CMF, con un porcentaje de supervivencia global del 58 frente al 44% respectivamente.
Quimiohormonoterapia
En un estudio realizado por el International Collaborative Cancer Group, en el cual se incluyeron 604 mujeres posmenopáusicas afectadas de cáncer de mama con ganglios positivos y receptores estrogénicos positivos, que fueron aleatorizados a seguir tratamiento con tamoxifeno (una antraciclina) más quimioterapia, se ha evidenciado, con un seguimiento de 42 meses, un claro beneficio de la quimiohormonoterapia.
Nuevos fármacos
La aparición de una nueva familia de quimioterápicos ha demostrado ser especialmente activa frente al cáncer de mama, los taxanos. Tanto paclitaxel como docetaxel obtienen un porcentaje de respuestas muy elevado en la enfermedad metastásica.
Recientemente, se han comunicado ya los primeros resultados en adyuvancia. Un estudio ha reunido 3.060 pacientes con ganglios positivos, que se aleatorizaron a seguir tratamiento con adriamicina más ciclofosfamida, frente a adriamicina, ciclofosfamida y paclitaxel de forma secuencial. No se han demostrado diferencias entre ambos grupos, tanto en lo que se refiere a recidiva local y sistémica, como a la supervivencia global.
Quimioterapia con altas dosis
La administración de altas dosis de quimioterapia con tal de mejorar la dosis-intensidad del quimioterápico ha sido desde hace muchos años considerado como el ideal
del tratamiento con citostáticos. En los últimos años las mejoras tecnológicas han facilitado el rescate de la aplasia medular ocasionada por una dosis elevada de quimioterapia. Primero el trasplante de médula ósea y, posteriormente la selección de células progenitoras en sangre periférica han permitido la implantación de esta modalidad de tratamiento con una morbimortalidad aceptable3.
Son pocos los estudios aleatorios que han comparado la administración de dosis altas con la administración de dosis convencionales de quimioterapia. Los pocos comunicados hasta la fecha han sido realizados en grupos de pacientes con más de 10 ganglios axilares afectados, o pacientes con carcinomas localmente avanzados que han respondido al tratamiento neoadyuvante. Todos estos estudios no han evidenciado una ventaja de las elevadas dosis13. Así, hoy día, no existe indicación para las dosis elevadas, cuya administración no está justificada fuera de protocolos de investigación.
Ganglios negativos
Son tres los estudios clínicos que han demostrado la eficacia del tratamiento quimioterápico en pacientes con ganglios negativos. El primero, con más de 8 años de seguimiento, fue realizado en Milán; sólo agrupa 90 pacientes que fueron aleatorizados a seguir tratamiento con CMF o no. La supervivencia libre de enfermedad a los 8 años del grupo control es del 39% frente al 80% del grupo que fue tratado con CMF3.
En el segundo estudio, que agrupa 737 pacientes, es multicéntrico y está coordinado por B. Fisher, las pacientes eran aleatorizadas a seguir o no tratamiento con metotrexato y 5-fluorouracilo. A los 5 años de seguimiento el grupo control tiene una supervivencia libre de enfermedad del 67%, frente al 76% del grupo tratado.
El tercer estudio valora un total de 425 pacientes que son aleatorizadas a seguir tratamiento con CMF más prednisona o control. Tras un seguimiento de 5 años el grupo tratado tiene una supervivencia libre de enfermedad del 83%, frente a un 61% del grupo control.
Factores de pronóstico
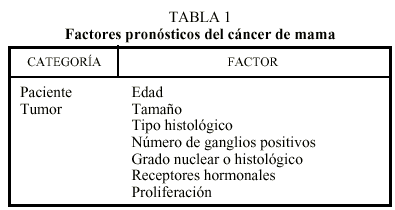
Son muchos los factores de pronóstico o de predicción de respuesta que se están estudiando en diversos ensayos, sin embargo son pocos los que son admitidos por todos. En la tabla 1 se resumen los factores admitidos por todos los grupos.
Metaanálisis de los estudios clínicos sobre quimioterapia adyuvante
En 1992 se publica el análisis integrado de 133 estudios aleatorios sobre tratamiento adyuvante en el cáncer de mama. Con este trabajo se despejaron las dudas que podían existir sobre la ventaja que el tratamiento sistémico podía proporcionar7.
Ganglios positivos
Pacientes premenopáusicas. El metaanálisis incluye un total de 31 estudios aleatorizados iniciados antes de 1985. Se incluyen un total de 11.000 pacientes que han sido aleatorizadas a seguir o no tratamiento quimioterápico adyuvante. El período mínimo de tratamiento quimioterapico fue de 2 meses. Así, un tratamiento quimioterápico administrado por lo menos durante 2 meses reduce la recidiva en un 30% por año de seguimiento y la mortalidad en un 18%. Se puede afirmar que una de cada 3 o 4 recidivas y una de cada 5 o 6 muertes son evitadas por la quimioterapia a los 10 años de seguimiento.
Pacientes posmenopáusicas. Casi la totalidad de los estudios clínicos aleatorios no habían evidenciado ningún beneficio del tratamiento quimioterápico administrado en pacientes posmenopáusicas con ganglios positivos. Sin embargo, el metaanálisis demostró una reducción anual en la recidiva de un 24% y de la mortalidad de un 13%. Este beneficio se pierde en pacientes mayores de 70 años.
Ganglios negativos
El metaanálisis confirmó el beneficio de la quimioterapia en pacientes con ganglios negativos. Se constató una reducción anual en el porcentaje de recidiva del 26% y una reducción de la mortalidad del 18%.
Tratamiento quimioterápico estándar
Los estudios aleatorizados que comparaban el uso de regímenes con antraciclinas contra CMF no demostraron diferencias significativas. Sin embargo, los resultados del metaanálisis del EBCTCG han demostrado que los esquemas con antraciclinas reducen en un 12% el porcentaje de recidiva anual y en un 11% el porcentaje de supervivencia comparados al CMF. En la tabla 2 se resumen los tratamientos quimioterápicos recomendados.
Beneficio del tratamiento con quimioterapia sobre la población general
En el estudio realizado en Turku se compara en la segunda parte del mismo la supervivencia de las pacientes durante el período 1945-1969 con la supervivencia de las pacientes tratadas en dicha ciudad durante 1970-1979 y 1980-1984. Se pudo observar que la supervivencia había mejorado significativamente tanto en las pacientes con ganglios positivos como negativos. Dicho beneficio se debe imputar a los distintos tratamientos sistémicos seguidos por las pacientes en los dos últimos períodos de tiempo1.
Mejor documentado está el beneficio del tratamiento sistémico obtenido en la población general por Olivotto8. Este trabajo estudia la mortalidad en un estado de Canadá, British Columbia, en tres períodos distintos: 1974, 1980 y 1984. En dicho estado la atención de la paciente con cáncer estaba protocolizada y todos los hospitales empleaban los mismos protocolos. Así, se pudo observar que la implantación de la quimioterapia, en este caso CMF, y la implantación de la hormonoterapia, tamoxifeno, ha supuesto un beneficio en la supervivencia de las pacientes tratadas por cáncer de mama.
Devesa, en 1995, publicó un estudio basado en los datos del registro poblacional del cáncer de los EE.UU.9. Se comparaba la incidencia del cáncer y la mortalidad de los períodos 1975-1979 y 1987-1991, y se observó que la incidencia de cáncer de mama se había incrementado en un 30,1%. Parte de este incremento se debía al aumento de la esperanza de vida de la población y a la mejora del diagnóstico precoz. La incidencia entre los 55 y 74 años de edad se había incrementado en un 39,3%, y en un 36,9% cuando la edad superaba los 75 años. Sin embargo, la mortalidad por cáncer de mama apenas se había modificado: el incremento era del 1,9%. La única franja de edad en la que se apreció una disminución de la mortalidad por cáncer de mama fue entre 35 y 54 años (un 8,6%). Este dato señala el beneficio de los tratamientos sistémicos sobre la población general.
Quimioterapia primaria
En la actualidad, no puede existir ningún tipo de duda sobre el beneficio que proporciona la quimioterapia a las pacientes con cáncer de mama. Si bien hasta la fecha las pacientes reciben quimioterapia tras la intervención quirúrgica, el mejor conocimiento de la enfermedad y de las ventajas que los diferentes tratamientos pueden ocasionar pone en duda la correcta secuencia a seguir10.
Así nace el concepto de quimioterapia primaria, que es aquella que se administra antes de la cirugía en aquellos cánceres de mama que son operables de entrada.
Podemos destacar los siguientes aspectos:
Los estudios aleatorios no han demostrado diferencias entre los tratamientos sistémicos primarios y la adyuvancia.
Los tratamientos sistémicos primarios permiten incrementar el porcentaje terapéutico de tratamiento quirúrgico conservador.
Las pacientes que presentan respuesta al tratamiento sistémico primario tienen una mejor supervivencia que las que no responden. La respuesta es, por tanto, un factor de pronóstico.
El tratamiento sistémico primario permite el estudio de los distintos factores de predicción de respuesta que pueden ser útiles en el futuro a la hora de elegir el tipo de tratamiento sistémico.
Las reuniones de consenso
Las reuniones de consenso han sido determinantes a la hora de marcar una directrices a los diferentes profesionales que tratan el cáncer de mama. La primera que se realizó fue la de St. Gallen, cuya última edición tuvo lugar en febrero del 200112. También el National Institutes of Health de los Estados Unidos realizó reuniones de expertos, la última en noviembre de 200011. Asimismo, hay que mencionar diferentes guías clínicas que han buscado homogeneizar los tratamientos del cáncer de mama; en esta línea, el gobierno de Canadá se puede considerar el modelo.
Los consensos mencionados consideran demostrado de forma concluyente el beneficio de los tratamientos sistémicos en la supervivencia de las pacientes con cáncer de mama. Este beneficio se ha demostrado tanto en los tumores con ganglios positivos como en aquellos con ganglios negativos. De estos consensos se pueden obtener diversas conclusiones. En lo que se refiere a administración de quimioterapia adyuvante podemos citar los siguientes:
La administración de poliquimioterapia es superior a la monoterapia.
La duración óptima de la quimioterapia es de 6 meses.
Los regímenes con antraciclinas son ligeramente más activos que el CMF.
Las dosis de antraciclinas utilizadas no provocan una excesiva toxicidad cardíaca a largo plazo.
No existe evidencia sobre el beneficio de la quimioterapia a altas dosis en el cáncer de mama.
El papel de los taxanos está aún por definir. Son fármacos muy activos en la enfermedad metástasica, pero los estudios en adyuvancia no son todavía concluyentes.
Se ha demostrado que en los tumores con receptores hormonales positivos la adición de hormonoterapia, una vez finalizada la quimioterapia, beneficia la supervivencia global.
Aún no existe evidencia sobre la utilización de factores de predicción de respuesta a la hora de elegir el tipo de tratamiento quimioterápico a seguir.
En lo que se refiere a administración de hormonoterapia adyuvante, destacamos los siguientes aspectos:
La decisión de administrar hormonoterapia viene dada por la presencia de receptores hormonales en el tumor primitivo. La hormonoterapia no es eficaz en los tumores receptores hormonales negativos.
La determinación de los receptores hormonales puede ser bioquímica o inmunohistoquímica. Se consideran positivos cuando sean igual o mayor de 10 fentomoles por el método bioquímico o igual o superior al 10% por el método inmunohistoquímico.
La hormonoterapia se debe recomendar siempre que los receptores hormonales sean positivos independientemente de la edad, el estado menstrual, la afección ganglionar y el tamaño tumoral.
Constituyen una excepción las pacientes premenopáusicas con tumores menores de 10 mm o los pacientes mayores con riesgo de enfermedad tromboembólica.
El tamoxifeno es el fármaco más comúnmente utilizado en la hormonoterapia adyuvante. No existen datos para la utilización de los inhibidores de la aromatasa o el raloxifeno.
La ablación ovárica produce similares beneficios a la quimioterapia en pacientes premenopáusicas. Sin embargo, no existe evidencia de que la asociación de
quimioterapia y ablación ovárica produzca mayores beneficios. La combinación de diversos tratamientos hormonales no ha sido suficientemente estudiada respecto a la adyuvancia.
La duración del tratamiento con tamoxifeno debe ser de 5 años.
Por último, en la tabla 3 se expresan las indicaciones de tratamiento sistémico del ICO.