La administración intranasal de opioides es una alternativa eficaz a otras vías de administración, por las excepcionales condiciones de la mucosa nasal para su absorción. Esta vía es óptima para el tratamiento del dolor irruptivo oncológico, que exige un analgésico potente, de inicio rápido, corta duración, fácil administración y pocos efectos adversos. Entre los fentanilos de absorción transmucosa, los intranasales son los que se adaptan mejor al dolor irruptivo oncológico; disponemos de los preparados en solución acuosa y con pectina, rápidos y efectivos. No son intercambiables, solo sustituibles tras una nueva titulación. El fentanilo intranasal con pectina presenta un perfil de acción fiable frente a eventuales pérdidas por goteo posnasal o aclaramiento mucociliar. De aplicación sencilla, cómoda y rápida, y no influenciada por la frecuente xerostomía de los enfermos con cáncer avanzado, ni la posible mucositis oral, ni rinitis. No es dependiente de las habilidades del enfermo para su administración. No genera efectos adversos relevantes, sistémicos o locales. Con inicio de la analgesia a los 5min de su aplicación, buena tolerabilidad y aceptación por parte de los pacientes. Efectivo, no suele precisar de correcciones en la dosificación tras la titulación, incluso a largo plazo. Esta revisión recuerda las características de la vía intranasal junto al uso de distintos opioides, particularizando la atención en el fentanilo intranasal con pectina.
Intranasal (IN) opioid administration is a highly effective alternative to other routes of administration due to the exceptional conditions of the nasal mucosa for opioid absorption. This route is ideal for fentanyl administration for the treatment of breakthrough cancer pain, which requires an analgesic that is potent, with rapid onset, short duration, easy administration and few adverse effects. Among transmucosal fentanyl preparations, the best adapted to breakthrough cancer pain are IN preparations. These rapid and effective preparations are available in aqueous solution and in pectin. They are not interchangeable and can only be substituted after a new titration. Fentanyl pectin nasal spray has a reliable profile of action against eventual losses due to postnasal drip or mucociliary clearance. The preparation is simply and easy to administer with rapid onset and is not affected by the dry mouth that is common in advanced cancer patients, or possible oral mucositis or rhinitis. Administration does not depend on the patient's skill. This drug has no relevant systemic or local adverse effects. Onset of analgesia occurs 5minutes after application and the drug is well tolerated and accepted by patients. Dose adjustments are not normally required after titration, even in the long-term. This review describes the characteristics of the IN route, together with the use of distinct opioids, with particular emphasis on fentanyl pectin nasal spray.
El dolor es un problema común en el cáncer, más si es avanzado, que puede afectar al 70-90% de los enfermos. El dolor irruptivo oncológico (DIO) también es muy frecuente (15-95% de los casos, según series). Se caracteriza por el rápido inicio hasta el acmé (3-5min), corta duración (≈ 30-45min), gran intensidad (escala visual analógica≥7) y frecuencia variable. Puede ser previsible o no, dependiendo de que su etiología sea conocida y que sea de aparición predecible1. Genera un profundo impacto sobre la calidad de vida de enfermos y familias, con pérdida de capacidad funcional, consecuencias psicosociales, ansiedad y depresión. Su manejo inadecuado es causa de sobrecarga asistencial en los servicios de urgencias, los ingresos y las visitas domiciliarias2.
Su tratamiento es complejo. Tradicionalmente se basó en las «dosis de rescate» del opioide oral de liberación rápida, junto a una valoración de las circunstancias que rodean su aparición para manejarlas con coadyuvantes y otras formas de tratamiento. No obstante, incluso estando controladas, pueden ser insuficientes en la erradicación de cada episodio doloroso.
Con la aparición de los «fentanilos (FNL) rápidos» transmucosos se aproxima el opioide ideal para el manejo del DIO, ya que son fármacos: a) de rápida absorción; b) de breve duración de acción; c) de gran potencia que asegura una analgesia suficiente, y d) de administración sencilla.
En España están disponibles: citrato de fentanilo oral transmucoso en stick (CFOT), comprimido bucal de fentanilo (CBF), comprimido de fentanilo sublingual, film bucal de fentanilo y los de presentación intranasal: en solución acuosa (FINA) y fentanilo intranasal con pectina (FINP).
Fisiología de la narizLas principales funciones de la nariz son la humidificación y calentamiento del aire inspirado, es asiento del sentido del olfato y tiene función defensiva como barrera frente a patógenos y sustancias nocivas3,4.
En el interior de las fosas nasales, los cornetes y las microvellosidades del epitelio de la cavidad nasal amplían enormemente la superficie mucosa (≈ 150a 180cm2). Está muy vascularizada desde ramas de la arteria oftálmica y maxilar interna, cuyas divisiones forman una amplia red capilar fenestrada que ofrece un amplio flujo sanguíneo por unidad de volumen de tejido, superior al del músculo, hígado y cerebro. La mucosa está recubierta por un epitelio ciliado secretor de moco con funciones de protección física, enzimática y antibacteriana.
La mucosa está recubierta por una película de moco en constante movimiento por el movimiento ciliar en dirección a la nasofaringe, lo que constituye el aclaramiento mucociliar que «barre» de sustancias nocivas y patógenos la cavidad nasal. Se han identificado enzimas que degradan gran cantidad de moléculas en su tránsito hacia la nasofaringe.
Administración intranasal de fármacosLa aplicación tópica intranasal es la vía de elección para el tratamiento de enfermedades locales. Descongestivos y corticoides son ejemplos comunes; ejercen su efecto local a dosis inferiores a las necesarias para conseguir esa acción en administración sistémica y así se evitan efectos adversos.
Más recientemente, el interés tiende a focalizarse en medicamentos que, administrados por esta vía, ejerzan una acción sistémica para fármacos con pobre absorción enteral o que presentan un gran primer paso hepático. La administración intranasal permite soslayar la barrera hematoencefálica ofreciendo un rápido paso al sistema nervioso central, con poca invasividad, buena biodisponibilidad, rápido inicio de acción, no dolorosa, bien tolerada, de fácil reconocimiento y manejo por los enfermos y sin necesitar de dispositivos esterilizados4.
Entre los analgésicos, la vía intranasal es eficaz en el tratamiento del dolor agudo, migrañoso, postraumático, posquirúrgico y tumoral, en particular el DIO; así se evita la administración parenteral de medicamentos, que pueden no ser aceptables ni óptimos en todas las situaciones.
La administración intranasal es una vía alternativa para muchos medicamentos. En la tabla 1 se ofrece un listado de medicamentos de administración intranasal, aunque no es una lista exhaustiva, con posible interés en cuidados paliativos5 (tabla 1).
Medicamentos de administración intranasal.
| Disponibles en otros países o sometidos a estudio |
| Oxicodona, hidromorfona, buprenorfina, sufentanilo, alfentanilo, meperidina, butorfanol, morfina |
| Indometacina, dihidroergotamina, ketorolaco |
| Metoclopramida, granisetrón |
| Midazolam, ketamina |
| Disponibles en España |
| Fentanilo |
| Sumatriptán, zolmitriptán |
| Desmopresina, calcitonina (uso restringido; recientemente retirada*) |
El paso a través del epitelio nasal se verifica por 2 mecanismos: transcelular, a través de difusión pasiva, principalmente para medicamentos liposolubles, o por endocitosis para grandes moléculas, y paracelular, que involucra a pequeñas moléculas a través de la pared lateral de las células epiteliales por pequeños poros y uniones estrechas.
El flujo sanguíneo nasal es determinante, al mantener un gradiente de concentración que facilita la difusión pasiva. La vasoconstricción nasal disminuye la absorción de fármacos, también al modificar el flujo mucoso.
El aclaramiento mucociliar es otro elemento a considerar; los factores que incrementan la producción de moco, disminuyen su viscosidad o aumentan el movimiento ciliar lo aumentan. Donde se deposite el medicamento tiene importancia. Los liberados en la zona posterior son barridos antes que los que lo hacen en la anterior. Un espray entrega el fármaco más anteriormente que la administración en gotas y este tarda más tiempo en ser aclarado. Los medicamentos hidrofílicos son muy solubles en el moco y su paso por la membrana es más lento, siendo aclarados en una alta proporción (es el caso de la morfina [MFN] en solución acuosa).
Los factores ambientales condicionan e influyen en el aclaramiento mucociliar. El tabaquismo lo disminuye al aumentar la viscosidad del moco y reducir el número de cilios, las infecciones locales empeoran el aclaramiento.
No se debe ignorar la degradación enzimática local, aunque su impacto no es bien conocido. Se ha identificado una amplia variedad de enzimas. En el caso del FNL se desconoce la magnitud con que es degradado en la mucosa nasal por isoenzimas del CIT CYP3A4.
Las propiedades fisicoquímicas del medicamento influyen en la absorción. Las moléculas lipofílicas de bajo peso molecular, como el FNL, se absorben bien con perfiles farmacocinéticos similares a la administración intravenosa. El pH en la cavidad nasal oscila entre 5 y 6,5. Según el pH local y el pKa del fármaco, este se encontrará más o menos ionizado (la fracción no ionizada es más permeable). Los pH extremos dificultan la absorción y pueden dañar la mucosa.
La hidrosolubilidad es otro factor limitante, ya que el volumen de medicación a administrar por fosa es pequeño (100-150μl). Sustancias poco hidrosolubles necesitan ser vehiculizadas en un mayor volumen hídrico. Aunque se han ensayado volúmenes de hasta 1 ml sin incidencias, estos podrían tener un paso relevante a la faringe y ser deglutidos.
La forma farmacéutica y su estabilidad son cruciales. La formulación más simple son las gotas nasales, aunque la cantidad exacta es difícil de determinar y son más rápidamente aclaradas. Las soluciones y suspensiones en espray se prefieren a los esprays en polvo, más irritantes. Otra formulación sencilla es una solución acuosa del preparado parenteral en un espray. Podría ser un riesgo, ya que la absorción del fármaco puede no ser controlada al expulsarse en parte como goteo nasal anterior o posterior (y ser deglutida); puede ser retirada por el aclaramiento mucociliar (que tiende a retirar el 50% de una fórmula líquida en 15-20min). La formulación del fármaco debe tener una viscosidad idónea para aumentar el tiempo de contacto con la mucosa, pese al aclaramiento mucociliar. Por todo ello, el pico y la concentración plasmática pueden variar desde concentraciones potencialmente tóxicas, con altas concentraciones al inicio de la administración, a concentraciones subóptimas7.
Se han desarrollado sistemas como emulsiones lipídicas, microesferas, polímeros bioadhesivos, etc., para mejorar la absorción. Hay que considerar los excipientes, solubilizadores, gelificantes, conservantes, etc., con potencial irritante. Recientemente, los dispositivos de gel en espray reducen el goteo posnasal y el moqueo anterior, aumentan el tiempo de contacto con la mucosa, disminuyen localmente el aclaramiento y aumentan la absorción.
En conclusión, las estrategias industriales para potenciar la absorción intranasal de medicamentos incluyen el conocimiento de las propiedades de la mucosa nasal. Las propias características del fármaco. El uso de inhibidores enzimáticos, de potenciadores de la absorción o de nuevas formulaciones farmacéuticas puede evitar la degradación enzimática o el aclaramiento mucociliar, aumentando el tiempo de contacto del fármaco con la mucosa y su absorción, incrementando su biodisponibilidad.
La vía intranasal: analgésicos opioidesSe han testado en voluntarios sanos varios opioides en administración intranasal. En Estados Unidos, el butorfanol en solución acuosa (Stadol NS®) es bien tolerado. Sin diferencias en la absorción en presencia de rinitis, aunque podría disminuir por el uso concomitante de vasoconstrictores nasales8. Se ha comparado frente a placebo y se ha usado sin comparaciones por vía intranasal con eficacia, aunque se describieron con frecuencia efectos adversos, transitorios y moderados. Es más interesante su uso en pacientes quirúrgicos ambulantes tras el alta. En un pequeño estudio se comparó frente a codeína y paracetamol con equivalencia analgésica, aunque en el grupo con butorfanol se abandonaba más el tratamiento por efectos adversos.
Se ha estudiado el alfentanilo, con un tiempo para alcanzar la máxima concentración plasmática (Tmax) de 9min y una biodisponiblidad del 65%, el sufentanilo 10 y 78, y el FNL 5 y 71, respectivamente. Menos lipofílicos tienen retrasado el Tmax: oxicodona, buprenorfina y butorfanol. Todos ellos evaluados en dolor postoperatorio de distintas patologías y administrados como solución acuosa desde sus preparados parenterales. Algunos de sus estudios fueron abiertos, no controlados o no aleatorizados, limitados para tomar decisiones clínicas sobre la base de ellos.
No obstante, sí cabe citar algunas conclusiones prácticas: el alivio del dolor suele ser bueno, entre 12 y 22min, con picos de analgesia dentro de la hora, consistentes con los datos farmacocinéticos disponibles. Los enfermos admiten la vía intranasal como alternativa válida a los sistemas de analgesia controlada por el paciente (PCA) o a la administración intramuscular. Son raras las referencias a sensación de mal gusto, excepto con butorfanol y meperidina. Los efectos secundarios pueden separarse en los debidos a la ruta de administración y los debidos al propio opioide. No se ha constatado depresión respiratoria ni deterioro hemodinámico, aunque algunos enfermos refieren irritación nasal transitoria al suspender el medicamento. Ya que la necesidad de analgesia es corta y decreciente en el postoperatorio, no cabe pensar en problemas nasales a largo plazo.
Morfina intranasalEl tratamiento clásico recomendado para el DIO ha sido la MFN oral de liberación rápida (MOLR). La vía nasal es una alternativa. La MFN, hidrofílica, se absorbe pobremente por vía nasal, con perfiles farmacocinéticos similares a los de la vía oral. Este problema se podría soslayar combinándola con chitosán, un polímero bioadhesivo que enlentece el aclaramiento mucociliar permitiendo un mayor tiempo de absorción.
En un estudio con voluntarios sanos9 la morfina-chitosán (M-CH) fue bien tolerada aumentando la biodisponibilidad nasal desde el 10 al 56%, con un perfil farmacocinético parecido al de la perfusión lenta de MFN intravenosa (i.v.). El efecto sistémico más llamativo fue la sedación. Disponible en Estados Unidos (RylomineTM) con un Tmax de 13-27min y biodisponibilidad del 60-83%.
Se ha estudiado en el dolor postoperatorio tras cirugía ortopédica frente a MFN i.v. y placebo con perfil analgésico y farmacocinético similar a la MFN i.v., aunque con un Tmax retrasado10. Desde los 30min ya hay alivio del dolor y se mantiene durante al menos 4 h. Los efectos secundarios locales son transitorios, incluyendo gusto amargo; los sistémicos son los propios de los opioides.
También se ha ensayado en un estudio con dosis única y en dolor dentario posquirúrgico frente a MFN i.v., MOLR y placebo11 con resultados similares al estudio anterior. El tiempo para percibir el primer alivio del dolor osciló entre los 9 y 18min con los 3 preparados. Pronto el placebo se reveló como un analgésico inútil. A los 12min, las puntuaciones de dolor disminuyen notablemente con la MFN i.v., seguida de la M-CH a los 16min y muy retrasada la MOLR. El alivio se consideró completo a los 60 y 90min con la MFN i.v. y M-CH, respectivamente; con MOLR se alcanzó a las 2 h, manteniéndose a las 6 h con los 3 preparados. Se encontró una equivalencia 2:1 respecto a la MFN i.v. Los efectos secundarios fueron los esperables de los opioides. A nivel nasal algún eritema y rinorrea, leves y moderados. A veces sensación de gusto amargo. M-CH podría ser una alternativa a la PCA en enfermos quirúrgicos.
Morfina intranasal en el dolor irruptivo oncológicoSe ha estudiado la eficacia y tolerabilidad de un espray de M-CH a distintas concentraciones en el DIO de enfermos de unidades de cuidados paliativos (14 pacientes y 20 episodios tratados)12. Los enfermos aceptan la M-CH con una satisfacción descrita como buena o muy buena, con pocos efectos nasales y leves, con gusto amargo por el aclaramiento de MFN hacia la orofaringe. La sedación, casi siempre ligera o moderada, fue el efecto sistémico más frecuente. La mejoría del dolor se reconoce ya a los 5min, alcanzando un máximo a los 45min. En 9 episodios, los enfermos recibieron una dosis de su analgésico habitual 1 a 4h tras la administración de la M-CH, pero no fue necesario ningún rescate en la hora inicial. Estos resultados deberían confirmarse frente a MOLR y CFOT.
En un pequeño estudio con 11 pacientes, abierto, no controlado, con dosis única de 40 mg de MFN intranasal en solución acuosa para tratamiento de DIO13, se extrajeron muestras de sangre desde los 5 hasta los 240min tras la administración. Se midió la intensidad del dolor, el grado de alivio y se preguntó el tiempo en que notaron el inicio del alivio. Un Tmax fue de 21min (rango, 10-30), la biodisponibilidad fue del 22% y la vida media (VM) de eliminación de 2h. Hay que destacar que el inicio del alivio del DIO fue en los primeros 5min, y fue significativo a los 9min. La intensidad del dolor se redujo en 2 puntos (escala numérica de 0-10). El alivio supuso casi 2 puntos (escala cualitativa de 0-4). Con pocos efectos adversos, en general nasales y de intensidad menor. Estos resultados deberían motivar a realizar estudios prospectivos, aleatorizados y controlados para conocer la utilidad real de la MFN intranasal en esta indicación.
Administración intranasal y dolor irruptivo oncológico: fentanilo intranasalPor las características del DIO, entre los opioides de elección se sitúa el FNL, con un perfil farmacocinético muy aproximado al episodio de DIO típico.
Las últimas en llegar a España han sido las presentaciones transmucosas intranasales en solución acuosa y con pectina. Ambas de fácil administración, rápido inicio de acción, evitan el metabolismo intestinal y de primer paso hepático. Aplicables en enfermos nauseosos, con vómitos, afectos de mucositis oral o más comúnmente de xerostomía con escasa producción de saliva. Cuentan con un inicio de acción más precoz respecto a los FNL transmucosos (FNL TM) orales14. Son particularmente útiles en algunos episodios de DIO intensos y muy recortados en el tiempo, por ejemplo en el acto de tratamiento radioterápico.
La absorción tras la administración nasal podría tener una cierta variabilidad según preparados y esto podría alterar la predicción del efecto; no obstante el rápido inicio de acción compensaría este problema, ya que permite una dosificación adicional si la inicial resultara subterapéutica8.
Los FNL intranasales (FNL IN) están indicados en el tratamiento del DIO en adultos con tratamiento opioide de mantenimiento para dolor oncológico, un mínimo de 60 mg de MFN o equivalente durante al menos 1 semana15,16.
El FNL es un opioide fuerte, lipofílico, de bajo peso molecular. Una vez absorbido se distribuye rápidamente por los tejidos mejor irrigados como cerebro, corazón o pulmones, luego a otros menos irrigados como músculo y grasa, desde donde es redistribuido lentamente al plasma. Estos hechos explican la corta duración de la acción a pesar de su larga VM (por ello es esencial respetar los tiempos de uso entre uno y otro episodio de DIO, ya que con dosis repetidas puede aparecer toxicidad por acumulación).
Se metaboliza en el hígado por la CYP3A4 a norfentanilo, inactivo desde que se excreta por la orina. Las interacciones a través de la isoenzima CIT P450 CYP3A4 deben tenerse en cuenta: inhibidores enzimáticos como el fluconazol, ketoconazol e itraconazol, inhibidores de la proteasa, verapamilo y diltiazem pueden incrementar las concentraciones plasmáticas de FNL. Por el contrario, los inductores enzimáticos como fenitoína, carbamazepina o rifampicina pueden disminuir sus concentraciones, aunque no parece que condicionen la analgesia17.
Fentanilo intranasal: situación actualEn el control de síntomas18, la vía oral es la preferible. En el control del DIO hay rutas alternativas más efectivas, con mejor absorción al soslayar el primer paso hepático, e incluyen: a) vía parenteral, que cuenta con un rápido inicio de acción, pero puede ser dolorosa, causar otras molestias y, frecuentemente, debe ser manejada por personal especializado; b) vías sublingual y transmucosa oral, de amplio uso, aunque su absorción puede estar limitada por la cantidad de fármaco deglutido; además la falta de saliva y/o la coexistencia de mucositis pueden limitar la aplicación y absorción óptima por estas vías.
La vía intranasal es idónea para el control del dolor, se ha utilizado con varios analgésicos, autoadministrada con una sistemática familiar para enfermos y cuidadores, con un rápido inicio de acción, sin efecto de primer paso, con mínimos efectos adversos. Fiable en pacientes ingresados y ambulantes. Entre los opioides, actualmente el interés se centra en el FNL.
El FNL IN alcanza una biodisponibilidad de al menos un 70%, con un Tmax de 5-16min. La concentración máxima (Cmax) es dependiente de la dosis. La VM en administración intranasal es de unos 65min. En la administración transmucosa la biodisponibilidad es algo menor y el área bajo la curva y la VM son mayores. Frente a la administración i.v., la intranasal tiene un inicio de acción algo más lento y una VM algo más corta.
Los efectos adversos por la ruta intranasal son escasos y leves-moderados: malestar e irritación nasal, rara vez epistaxis o rinofaringitis. No es más frecuente la depresión respiratoria. Los efectos sistémicos, raros, son los comunes a los opioides, sobre todo sedación, náuseas y estreñimiento.
El FNL IN se ha usado en el postoperatorio frente a opioides débiles, con mejoría del dolor a los 30min. Con mejores resultados que con antiinflamatorios no esteroideos, con o sin opioides débiles y petidina asociados. Se ha utilizado en analgesia pediátrica en distintos postoperatorios y en dolor por fractura ósea frente a MFN, con buenos resultados. Se ha comparado frente al FNL i.v. en PCA en el postoperatorio de cirugía abdominal, ortopédica y tiroidea en un estudio aleatorizado, controlado, doble ciego y simulado. En ambos grupos, el primer alivio detectable aparece a los 21min con intranasal y a los 22min en i.v.
No parece que dolencias como el resfriado común tengan importancia en la absorción intranasal del FNL. Tampoco la presencia de rinitis alérgica. Sin embargo, el vasoconstrictor nasal oximetazolina sí podría reducir la absorción del FNL IN.
Un estudio con voluntarios sanos19 ha evaluado los parámetros farmacocinéticos del FINP en sujetos con rinitis alérgica en 3 condiciones: a) ausencia de síntomas; b) rinitis sintomática sin tratamiento, y c) rinitis sintomática en tratamiento con oximetazolina nasal. Respecto a la biodisponibilidad global, apenas hay cambios (una disminución del 8-9% en el grupo tratado con oximetazolina). Pero sí disminuye notablemente la Cmax y se retrasa, casi se triplica, el Tmax con el uso del vasoconstrictor. Los parámetros farmacocinéticos se distorsionan de manera similar en el caso del FINA. Se puede concluir que el uso de vasoconstrictores nasales, con seguridad afectará a la analgesia, como mínimo la retrasará. Se desaconseja el uso concomitante del FNL IN con vasoconstrictores nasales.
Fentanilo intranasal en solución acuosa frente a placebo y citrato de fentanilo oral transmucoso en stickPara comprobar el efecto del FINA (Instanyl®) en el tratamiento del DIO se realizó un estudio multicéntrico, doble ciego, cruzado y aleatorizado frente a placebo20. Tras la titulación se incluyeron en la fase de eficacia a doble ciego 111 pacientes, con extensión a 10 meses para evaluar la tolerabilidad a largo plazo en 108 pacientes. Se trataron 8 episodios de DIO, hasta 4 al día, con 1 placebo y 3 FINA para cada 4 episodios de dolor. En total, 659 episodios se trataron con FINA y 219 con placebo.
A los 10min ya había una clara diferencia de alivio del dolor con FINA frente a placebo, medido por escala numérica, y también se encontró un alivio de la intensidad del dolor en más de un 33% y un 50% superior en todos los tiempos de medición desde los 10 a los 60min con el FNL IN, aunque se necesitó repetir la dosis en el 64% de los episodios de DIO21. La necesidad de administración del rescate habitual fue más baja con FINA, un 14,2% de los episodios (94 de 659) frente a placebo, un 45%.
Los efectos secundarios se refirieron en un 20% de los casos, el más frecuente fue la náusea. Los nasales fueron escasos y bien tolerados. Tampoco a largo plazo se vieron efectos adversos relevantes relacionados con el FINA.
Otro estudio, abierto, multicéntrico, aleatorizado y cruzado, controlado con CFOT (Actiq®)22 es una de las pocas comparaciones directas entre CFOT y FNL TM de la bibliografía. Se trataron 577 episodios con FINA y 577 con CFOT. EL resultado principal fue la valoración del tiempo en alcanzar un alivio «significativo» del dolor (el referido subjetivamente por el enfermo sin explicación del investigador), junto a la magnitud del alivio del dolor desde los 5 a los 60min, analizándose la mejoría del dolor a los 10 y 30min y la proporción de episodios dolorosos aliviados en≥33 y 50%. Se preguntó por la facilidad de administración del medicamento, la impresión general respecto al grado de alivio del dolor y la preferencia de los pacientes por uno de los 2 medicamentos. La seguridad se midió incluyendo la incidencia y naturaleza de efectos adversos. Se recogió y analizó la dosis del tratamiento de fondo y la dosis necesitada para el rescate efectivo del dolor con ambos medicamentos.
Se comprobó una débil asociación entre las dosis efectivas de FINA y de CFOT. Los que se titularon a dosis más altas de Instanyl® tendían a requerir dosis más altas de Actiq® (aunque sin datos como para establecer una equivalencia). También hubo una débil asociación entre la dosis de opioide basal y la dosis titulada de los FNL, pero sigue siendo imprescindible la titulación de la dosis eficaz.
Se alcanzó un alivio significativo del dolor a los 11min con el FINA y a los 16min con el CFOT. Los enfermos refirieron empezar a notar mejoría antes con FINA que con CFOT, incluso a los 5min; entre los 10 y 30min con resultados favorables para el FINA. Con mayor frecuencia se alcanzaron alivios del dolor en más del 33 y del 50% con FINA que con CFOT y en tiempos más precoces. Ello tiene relevancia, ya que el máximo dolor en el DIO acontece en los primerosminutos. Las diferencias en los últimos 30min del estudio se estrecharon; indican el rápido alivio del dolor con FINA y la buena acción analgésica de CFOT, con Tmax más retrasado respecto al FNL IN. El uso del rescate basal fue de un 7,8% con FINA y de un 4,9% con CFOT. Se requirió una segunda dosis del FNL en un 60% de los episodios tratados con FINA y en un 30% con CFOT17.
Los enfermos prefirieron el FINA en un 77,4%. Entienden que es fácil de usar, con suficiente potencia analgésica y pocos efectos adversos. Se reconoció que aporta un perfil muy similar a las características del episodio de DIO.
Los efectos secundarios, aunque frecuentes, estuvieron más en relación con la enfermedad de base que con el tratamiento. Estos últimos fueron moderados y transitorios, en general náuseas y vómitos. Un enfermo presentó úlceras nasales. No hubo fallecimientos relacionados con FINA ni CFOT.
Fentanilo intranasal con pectina: farmacocinética y biodisponibilidad relativaEn voluntarios sanos21, la administración de FINP (PecFent®) a dosis terapéuticas (100 a 800 μg) ha demostrado frente a CFOT (200μg) una rápida absorción (Tmax, 15-21 frente a 20-40min del CFOT) en cualquiera de las concentraciones y una Cmax hasta 9 veces más que el CFOT, así como una media de 2,3 y una biodisponibilidad relativa frente a CFOT que alcanza hasta el 163%. Estos datos sugieren idoneidad farmacocinética del FINP en el alivio del DIO.
El incremento en la biodisponibilidad relativa y el aumento en la Cmax respecto a CFOT podrían hacer suponer que es posible usar dosificaciones menores para obtener equianalgesia respecto a CFOT. Actualmente, ninguno de los FNL TM son intercambiables entre sí. Precisan una titulación individualizada. El FINP debe ser titulado desde la dosis más baja (100μg).
El FINP ofrece unos perfiles de Tmax y Cmax muy agudos y escarpados comparados con CFOT y CBF. Y son más suaves cuando se comparan con otros FNL IN en presentaciones no gelificantes. Estas últimas tienen una gran Cmax, pero pueden resultar impredecibles, con amplia variabilidad entre dosis, debido al goteo posnasal, al aclaramiento mucociliar nasal y a posibles pérdidas nasales anteriores por goteo. Además, en el FNL IN sin formulación en gel, con frecuencia es necesaria una segunda administración del fármaco, lo que sucede raramente en el FINP. Lo esencial del perfil farmacocinético del FINP es permitir que el fármaco se mantenga durante más tiempo en la zona de aplicación, sin variabilidad interdosis en los valores terapéuticos deseados.
Los efectos adversos son escasos y leves incluso con dosis altas. Algunos sujetos presentaron un pequeño eritema nasal, malestar local y cefalea, moderados y transitorios. Las constantes vitales, el electrocardiograma, los estudios analíticos y la exploración nasal especializada no revelaron patología alguna.
PecSysTM: sistema gelificante in situ que optimiza la liberación nasal del fentaniloSe ha desarrollado la tecnología PecSysTM (PS)7, que controla la liberación del FNL para mejorar la biodisponibilidad mediante la facilitación de la adhesión a la mucosa. Además está en estudio para la administración intranasal de buprenorfina.
La pectina es un polisacárido vegetal de amplio uso en la industria alimentaria, que forma parte de aditivos permitidos (E440), con seguridad contrastada. Destacan sus usos médicos y farmacéuticos: se ha usado tanto en la diarrea como en el estreñimiento y en tratamientos para la obesidad como saciante. Es un excipiente reconocido en Europa y Estados Unidos. Forma parte de Orabase® y Stomahesive® y también de Gelsite®, una formulación que gelifica in situ para inyectables depot, y de Gelvac®, para la administración de vacunas intranasales.
La solución PS tiene una baja viscosidad y puede administrarse en un volumen de 0,1 ml. Una pulverización del espray libera la solución como un penacho de gotitas que se depositan uniformemente sobre la mucosa nasal, donde interaccionan con los iones de calcio del fluido mucoso y se produce la gelificación local, de la que se va liberando el fármaco aumentando el tiempo de contacto con la mucosa. Se reduce la variabilidad en el pico de Cmax y mantiene concentraciones terapéuticas en plasma más duraderas. La pectina, por su alto peso molecular y por gelificar, no se absorbe vía intranasal, drena posteriormente por el aclaramiento mucociliar y es ingerida.
La tecnología PS23 se ha ensayado en modelos de cavidad nasal in vitro administrando FINP frente a preparados en solución no gelificante. Se observa en estos últimos un claro goteo posnasal hacia la nasofaringe, perdiéndose parte del preparado. In vivo supondría deglución del fármaco. Si eventualmente hubiera alguna pérdida por goteo anterior estaríamos en una situación de variabilidad interdosis del FNL IN, con riesgo de sobredosificación o de alivio insuficiente del dolor. Frente a esa situación, el sistema PS asegura un Tmax adecuado y corto en el tiempo y una Cmax algo más recortada, pero con menor variabilidad, y un comportamiento más predecible del medicamento14. Cuando se compara con la absorción derivada de una simple solución acuosa se espera que las gotas de gel sean aclaradas de la mucosa en unos 30-40min, mientras que la solución acuosa es aclarada más precozmente.
Aunque las concentraciones de calcio intranasal se controlan fisiológicamente, cabría pensar que patologías como la rinitis alérgica y otros procesos infecciosos que afecten al medioambiente local podrían alterar la absorción; sin embargo, solo se ha demostrado un pequeño impacto en la absorción de fármacos. El PS es funcionante a distintas concentraciones de calcio local.
PecFent® se ha comparado frente a FNL con otros polímeros bioadhesivos como el chitosán y el chitosán-poloxamer 188 en un estudio en fase I, aleatorizado, abierto, de dosis única y cruzado con voluntarios sanos. A cada uno se le administró una dosis de 100 μg/100 μl de una preparación de FNL IN de las 3 formulaciones. Se estudiaron sus parámetros farmacocinéticos y se compararon con una dosis de CFOT 200 μg24. Las preparaciones intranasales muestran un Tmax más corto y una Cmax y una biodisponibilidad superiores a las del CFOT. Las concentraciones plasmáticas son similares a la hora de la administración. Los FNL con chitosán tienen un Tmax algo más corto y una Cmax mayor que el FINP. Sin embargo, lo que parece ser una ventaja farmacocinética aproximándose aún más al perfil del episodio típico de DIO, acaba no siendo tal cosa, ya que en este estudio se ha comprobado entre los preparados con chitosán una mayor tasa de acontecimientos adversos nasales que apenas se aprecian con el FINP, que es mínimamente irritante. No obstante es un estudio sin potencia estadística.
Fentanilo intranasal con pectina en el dolor irruptivo oncológico: eficacia y seguridadEn el estudio CP043, multicéntrico, aleatorizado, doble ciego, cruzado, controlado con placebo, se estudió FINP tras titulación de la dosis efectiva en 83 de 114 pacientes25. Se trataron 10 episodios de DIO con 7 dosis de FINP y otras 3 de placebo. Se evaluó el alivio del dolor desde los 5 a los 60min. Se trataron 459 episodios de DIO con FINP y 200 con placebo. La eficacia analgésica fue patente en tiempo e intensidad, el inicio de alivio del dolor se apreció a los 5min de la aplicación y fue claramente notorio desde los 10min en adelante. Globalmente, el 90% de los enfermos tratados con FINP no precisaron una dosis adicional de rescate.
Se notificó la ausencia de efectos adversos relevantes similares al placebo (náuseas-vómitos, mareos) y la clara preferencia por el FINP de los pacientes cuando fueron preguntados a los 30 y 60min; lo entendieron de uso sencillo más del 68% de los pacientes. Los efectos adversos nasales como sequedad, picores, moqueo o más raramente epistaxis fueros raros, moderados y transitorios; la exploración nasal no reveló problemas serios. Los enfermos que acabaron el estudio fueron posteriormente incluidos en el estudio de seguridad, tolerabilidad y consistencia de la eficacia a largo plazo.
Portenoy et al26, sobre el estudio anterior evaluaron la eficacia analgésica con la diferencia de la intensidad del dolor, desde el dolor al inicio del episodio basal al medido desde los 5 a los 60min, y también el uso de medicación de rescate. Se recogió la incidencia de efectos adversos. Se pidió opinión sobre la satisfacción con el espray y la facilidad de uso.
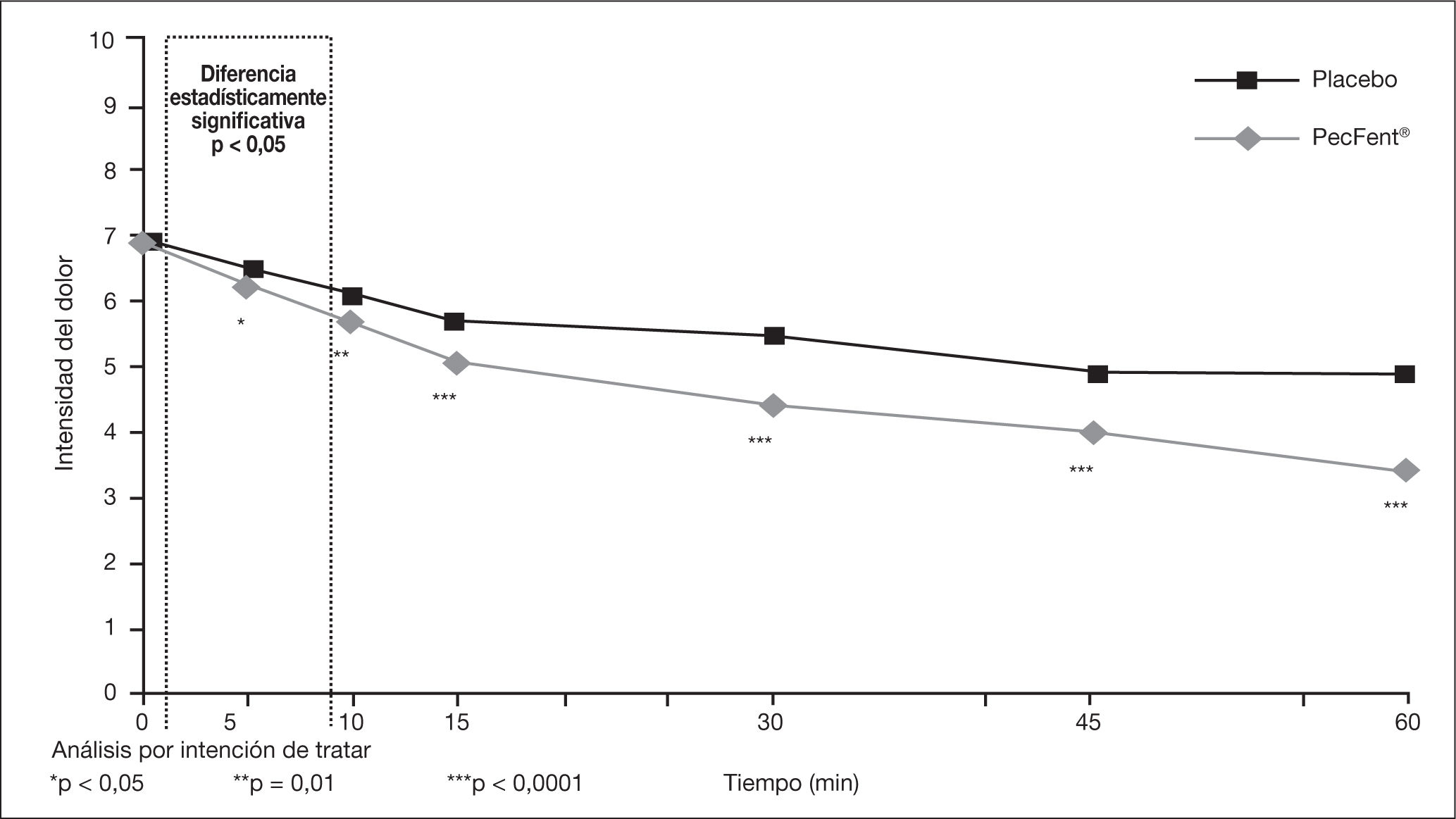
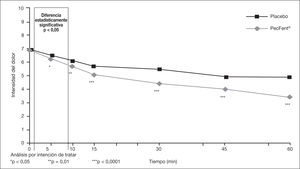
El FINP alivió mejor el dolor desde los 5min frente a placebo, siendo más notable desde los 10min, y un alivio superior a los 30min (objetivo primario del estudio), incluyendo los lapsos intermedios (fig. 1)26. Observando los episodios en que el alivio del dolor es clínicamente significativo (≥ 2 puntos en la escala numérica), el 33% lo obtuvo en 10min y siguió aumentando a lo largo de la hora. En el 90% de los tratados con FINP no hubo que recurrir a rescates adicionales, ni tampoco en el 80% de los tratados con placebo en la hora siguiente al inicio del DIO.
Tratamiento del dolor con fentanilo intranasal con pectina frente a placebo a lo largo de la primera hora. Tomada de Portenoy et al26.
La satisfacción global, la aceptabilidad y la comodidad de uso resultaron favorables al medicamento. Los acontecimientos adversos fueron pocos, locales, transitorios y sin patrón dependiente de la dosis. La exploración nasal tampoco reveló acontecimientos mencionables.
También se ha comparado la eficacia del FINP frente a MOLR en un estudio multicéntrico, aleatorizado, controlado, doble ciego, simulado y cruzado (CP044)27. Tras la titulación se evaluaron 84 pacientes de los 110 que comenzaron esa fase. Se trataron 10 episodios de DIO, 5 con FINP y otros 5 con MOLR (en total 372 episodios con FINP y 368 con MOLR). El objetivo primario era evaluar la respuesta analgésica a los 15min. Los secundarios eran detectar el inicio de alivio del dolor y el tiempo en alcanzar el alivio clínicamente relevante. Además se estudió la tolerancia y la seguridad de los medicamentos ensayados. Respecto al objetivo principal, a lo largo de los primeros 15min el FINP mostró mejores resultados, así como el inicio de alivio del dolor, que comenzó a ser notable a los 5min, y el tiempo en que apareció el alivio relevante, que sucedió a los 10min. En la eficacia analgésica al transcurrir el tiempo, las diferencias, con ser favorables al FINP, tendieron a estrecharse, lo que indica el inicio de acción más retrasado de la MOLR y refuerza la idea de que los opioides orales de liberación rápida llegan tarde al alivio del DIO.
No hubo diferencias notables en la aparición de efectos adversos; el FINP fue, como se esperaba, localmente bien tolerado. Posteriormente, Davies et al28 hicieron un análisis de este mismo estudio. En relación con la buena tolerancia sistémica y nasal reconocieron que más del 80% de los pacientes estuvo satisfecho con el FINP y lo asumieron como fácil de aplicar. Los enfermos no mencionaron efectos adversos nasales, ni moderados ni graves. Sobre la eficacia, solo el 3% de quienes recibieron el FINP precisaron rescate con su opioide de liberación rápida oral.
A largo plazo se ha estudiado PecFent® en un ensayo multicéntrico, prospectivo y abierto (CP045) para testar su seguridad y tolerabilidad29. Se incluyeron 403 pacientes (entre ellos los de los estudios CP043 y CP044), junto a otros nuevos reclutados que fueron titulados. Trescientos cincuenta y seis pacientes se incorporaron a la fase de tratamiento de 16 semanas con seguimiento ambulatorio. Se trataron más de 42.000 episodios de DIO con buenos resultados. En el 90% de los pacientes tras la titulación no hubo que incrementar la dosis posteriormente y, además, en el 94% de los episodios, de 42.227 episodios tratados, se alcanzó control suficiente y no se necesitó rescate adicional.
Entre los acontecimientos adversos se encontraron los propios de los opioides, como mareos, vómitos, estreñimiento y somnolencia, más frecuentes con las dosis de 400 y 800 μg, aunque no más graves. En la valoración clínica y analítica, los pacientes no mostraron deterioro atribuible al FINP, los efectos adversos locales fueron muy leves y transitorios, y la exploración nasal especializada no mostró alteraciones destacables.
Durante el estudio fallecieron 80 enfermos; de ellos solo en 2 casos se entendió la muerte como posiblemente y remotamente relacionada con el fármaco en estudio, el resto fue por complicaciones y progresión de su tumor.
Al ser preguntados, más de un 90% de los pacientes refieren estar satisfechos o muy satisfechos con el tratamiento30. Cuando se opina sobre la sencillez y seguridad de uso del FINP, la mayoría también es abrumadora y se va incrementando con el paso de las semanas de estudio, lo que muestra la consistencia de la aceptación y tolerabilidad del FINP a largo plazo.
Continuando el estudio CP045, con nuevos pacientes reclutados, se llega a la evaluación a muy largo plazo, hasta 44 meses31 (media por enfermo de 325 días con una desviación estándar de 354 días). Es importante, ya que la supervivencia en pacientes con cáncer tiende a aumentar, y es necesario el control de síntomas a más largo plazo. Ciento setenta y un enfermos, analizables 163. Más de 150.000 dosis de FINP (64.000 de 800μg). Muestra la tolerabilidad que mejora la calidad de vida y facilita la adherencia al tratamiento de los enfermos. No evalúa eficacia, pero esta puede inferirse del escaso número de enfermos que abandonan por falta de eficacia (2,3%) y de las pocas ocasiones en que la dosis de FINP se modifica (30%).
Fentanilo intranasal con pectina en diversas circunstancias. PreferenciasEn el alivio del DIO hay circunstancias que exigen un medicamento particularmente rápido y eficaz (p. ej., en el DIO de pacientes en tratamiento activo con radioterapia [RDT]). Este tratamiento exige inmovilización forzada, uso de máscaras faciales y sujeción a la mesa de tratamiento, en períodos de pocosminutos (que es lo que tarda la RDT en administrarse). Por ello, que el FNL TM elegido sea muy rápido (permitiendo la administración dentro de los 5-10min previos a la entrada en la sala de tratamiento) y que se elimine pronto, evitando secundarismos, es importante (p. ej., en el regreso al domicilio tras una sesión de RDT).
Se ha descrito el uso del FINP en varias neoplasias dolorosas sometidas a RDT32 como: cáncer lingual, rectal, pancreático o metástasis óseas dolorosas. Estos casos representan un ejemplo de DIO incidental predecible. La evaluación de la eficacia analgésica es muy buena, también la tolerabilidad. El adecuado manejo del DIO en relación con la RDT facilita la adherencia a este tratamiento, a veces rechazado por enfermos con dolor intenso deficientemente aliviado en las sesiones de tratamiento.
En relación con el dolor inducido por terapéutica antitumoral es conocida la mucositis posquimioterapia y post-RDT. En el cáncer de cabeza y cuello, la quimiorradioterapia combinada mejora la supervivencia y el control local, pero a costa de una elevada toxicidad, fundamentalmente mucositis, en un grupo de enfermos donde además la xerostomía es casi la norma. La mucositis grave compromete la deglución, la ingesta de líquidos y sólidos y el habla; tiene alto riesgo de complicaciones infecciosas; condiciona la calidad de vida y la misma adherencia y continuidad del tratamiento antitumoral. La disfagia y la odinofagia también son ejemplos de dolor incidental predecible por el acto deglutorio.
En un estudio prospectivo33 con 17 pacientes con cáncer de cabeza y cuello y mucositis grado 1, 2 y 3, tras la titulación se evaluó la eficacia analgésica a los 10, 20, 30 y 40min, así como el tiempo transcurrido hasta el máximo alivio. La reducción media de la intensidad del dolor fue de 3,1 puntos (rango, 1,2-5,8) sobre una media de dolor basal de 6,7 puntos. No hubo efectos adversos destacables. Aunque el número de pacientes fue bajo, no es un estudio controlado y no se incluyeron enfermos con tumores nasosinusales radiados (las fosas nasales raramente se incluyen en el volumen radiado en tumores de cabeza y cuello), es una buena instantánea desde un punto de vista práctico de lo que puede aportar específicamente el FINP en tumores de cabeza y cuello.
Dada la falta de comparaciones directas entre los distintos FNL TM, es difícil disponer de datos con evidencia contrastada que guíen a ciencia cierta al médico a la hora de elegir un producto sobre otro. Hay algunos trabajos de revisión17,34,35, metaanálisis36, una revisión Cochrane actualizada a 20132 y algún estudio que intentan responder a esta cuestión37.
Todos los estudios que evalúan los FNL TM lo hacen a los 15, 30 y 60min. Los ensayos con CBF, FINA y FINP lo hacen a los 5 y 10min.
Todos los FNL TM menos CFOT inician la analgesia desde los 10min, y todos lo hacen desde los 15min. Los más precoces, con inicio de la analgesia a los 5min, son los FNL IN.
MOLR muestra eficacia desde los 30min (y parece claro que no está indicada en el DIO espontáneo ni en el incidental impredecible, aunque cuenta con cierto aval de uso, razonable aun sin evidencias directas, desde las recomendaciones de la EAPC de 201238 en el DIO incidental predecible). En la revisión Cochrane de 2013, en 2 estudios con 308 pacientes, MOLR resulta un comparador inferior frente al FNL TM.
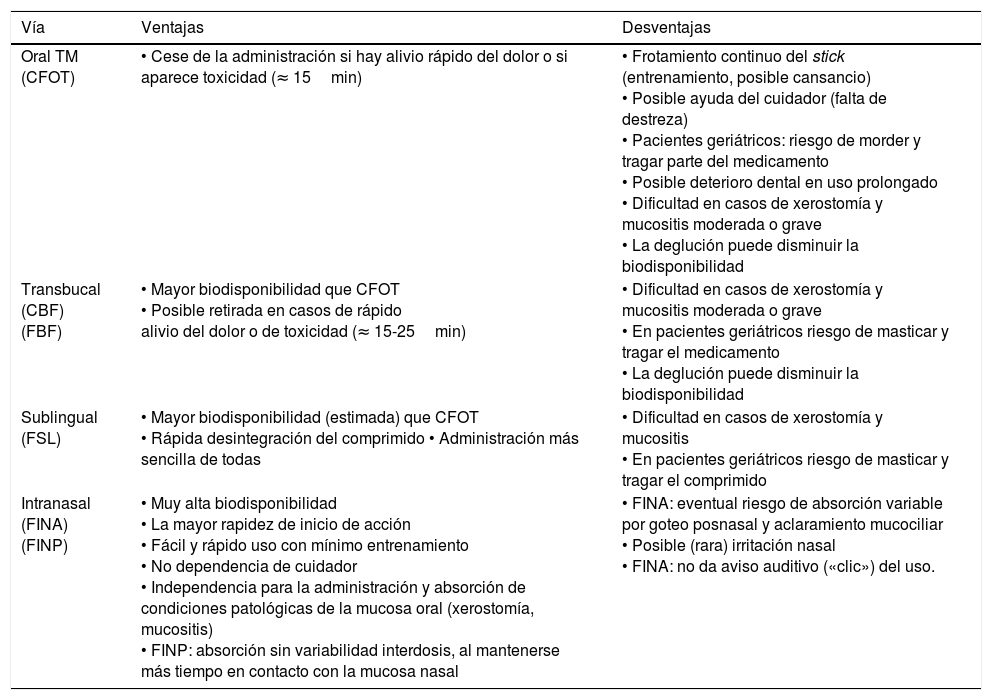
Los efectos adversos debidos al FNL TM son pocos, transitorios y bien tolerados, incluso pueden quedar enmascarados por el opioide basal. Los locales son de escasa entidad e insuficientes para malograr la buena aceptación por parte de los enfermos. Tampoco hay muchas referencias directas en la bibliografía que estudien las preferencias de los enfermos por un FNL TM concreto. Por estas razones se comprende que haya cierta indefinición sobre qué fármaco es mejor, qué vía es de elección y para qué enfermos. Smith37 sugiere considerar las ventajas y desventajas de cada vía y luego las características y preferencias de los enfermos (tabla 2).
Potenciales ventajas y desventajas de las distintas vías de administración para el tratamiento del dolor irruptivo oncológico.
| Vía | Ventajas | Desventajas |
|---|---|---|
| Oral TM (CFOT) | • Cese de la administración si hay alivio rápido del dolor o si aparece toxicidad (≈ 15min) | • Frotamiento continuo del stick (entrenamiento, posible cansancio) • Posible ayuda del cuidador (falta de destreza) • Pacientes geriátricos: riesgo de morder y tragar parte del medicamento • Posible deterioro dental en uso prolongado • Dificultad en casos de xerostomía y mucositis moderada o grave • La deglución puede disminuir la biodisponibilidad |
| Transbucal (CBF) (FBF) | • Mayor biodisponibilidad que CFOT • Posible retirada en casos de rápido alivio del dolor o de toxicidad (≈ 15-25min) | • Dificultad en casos de xerostomía y mucositis moderada o grave • En pacientes geriátricos riesgo de masticar y tragar el medicamento • La deglución puede disminuir la biodisponibilidad |
| Sublingual (FSL) | • Mayor biodisponibilidad (estimada) que CFOT • Rápida desintegración del comprimido • Administración más sencilla de todas | • Dificultad en casos de xerostomía y mucositis • En pacientes geriátricos riesgo de masticar y tragar el comprimido |
| Intranasal (FINA) (FINP) | • Muy alta biodisponibilidad • La mayor rapidez de inicio de acción • Fácil y rápido uso con mínimo entrenamiento • No dependencia de cuidador • Independencia para la administración y absorción de condiciones patológicas de la mucosa oral (xerostomía, mucositis) • FINP: absorción sin variabilidad interdosis, al mantenerse más tiempo en contacto con la mucosa nasal | • FINA: eventual riesgo de absorción variable por goteo posnasal y aclaramiento mucociliar • Posible (rara) irritación nasal • FINA: no da aviso auditivo («clic») del uso. |
CBF: comprimido bucal de fentanilo; CFOT: citrato de fentanilo oral transmucoso; FBF: film bucal de fentanilo; FINP: fentanilo intranasal con pectina; FINA: fentanilo intranasal en solución acuosa; FSL: fentanilo sublingual.
Modificada de referencia 37.
Respecto a la vía de administración que preferirían los enfermos en el tratamiento del DIO, apunta que globalmente prefieren la vía oral (97%), seguida de la sublingual (63%) y la nasal (50%). Para un DIO grave, las preferencias son de un 88, 75 y 68%, respectivamente, resultados que parecen estar basados en la experiencia previa con medicamentos. La vía oral es universal, la sublingual y la nasal intuitivamente se asumen como muy sencillas. Otros estudios ofrecen un orden de preferencia similar. Es razonable concluir, como en cada FNL TM se ha comprobado, que las rutas transmucosas son bien aceptadas.
Otro aspecto a considerar en el uso de los FNL TM es la satisfacción del enfermo con el medicamento —importante, ya que se relaciona con la adherencia al tratamiento—; en cada FNL TM se ha evaluado y hay un estudio que realiza un metaanálisis sobre el FINP39, que lo revisa específicamente a través de 2 preguntas: ¿cuán satisfecho se encuentra con la rapidez del alivio del dolor con el espray nasal? y ¿cuán satisfecho se encuentra globalmente con el espray que ha usado para mitigar su dolor? Se comparan las respuestas frente a FINP, MOLR y placebo con una escala de 4 puntos (desde 1=no satisfacción, hasta 4=muy satisfecho).
Desde los estudios CP043 y CP044 se incluyen 155 pacientes; 831 episodios de DIO tratados con FINP, 368 con MOLR y 200 con placebo. Se evalúa la satisfacción en la población agrupada y separada según el medicamento usado, desde los 5 a los 60min. Los mejores resultados se obtienen para el FINP desde los 5min. Las puntuaciones son tanto más altas y con mayor número de episodios de dolor mitigados cuanto más cercana es la medición al tiempo de inicio del DIO, con una media de 3,1 puntos (satisfecho) y por encima de las puntuaciones de MOLR y placebo. Al pasar el tiempo es menor la satisfacción; es decir, al pasar losminutos quedan menos episodios de dolor que aliviar con rapidez y globalmente y, por tanto, para evaluar críticamente.
Se ha comentado que la ausencia de comparaciones «head to head» entre los distintos FNL TM es un handicap para conocer la efectividad real de cada uno de ellos y definir su lugar en la terapéutica.
Hay un pequeño estudio, de muy reciente aparición, que compara los 2 FNL IN40. Aleatorizado, abierto y cruzado, con 69 pacientes y 188 episodios de DIO tratados comparando eficacia analgésica (escala numérica de 11 puntos) y secundarismos (escala cualitativa de 4 puntos) a los 5, 10 y 20min. Se pide opinión sobre qué preparado se prefiere. Sin titulación previa y con dosis de los FNL IN proporcionales al opioide basal.
Dado que la Cmax y el Tmax del FINP son menores que los del FINA se consideró que en la dosificación de forma proporcional la equivalencia sería: para 60 mg de MFN diaria o equivalente se utilizarían 50 μg de FINA y 100 μg de FINP; para dosis de opioide de mantenimiento más alta, la dosificación de los FNL IN se incrementaría proporcionalmente. La intensidad del dolor en T5, 10 y 20min se refleja en la tabla 3. Globalmente, a los 20min la intensidad del dolor remanente es del 50%. La suma de las diferencias de la intensidad del dolor a los 20min (SPID20) fue de 6,7 con FINA y de 7,5 con FINP (no significativo). Tampoco hay diferencias en la intensidad del dolor al necesitar una dosis más alta de los FNL IN.
Mejoría en la intensidad del dolor entre fentanilo intranasal en solución acuosa (FINA) y fentanilo intranasal con pectina (FINP).
| Episodios de DIO | T 0min | T 5min | T 10min | T 20min |
|---|---|---|---|---|
| FINP (n=97) | 6,8 (0,98) | 5,6 (1,1)a,b | 4,4 (1,43)a | 3 (1,71)a,c |
| FINA (n=91) | 6,8 (0,83) | 5,8 (1,03)a | 4,6 (1,36)a | 3,4 (1,51)a |
DIO: dolor irruptivo oncológico.
A los 5min la mejoría de la intensidad del dolor es significativa para FINP (p=0,016).
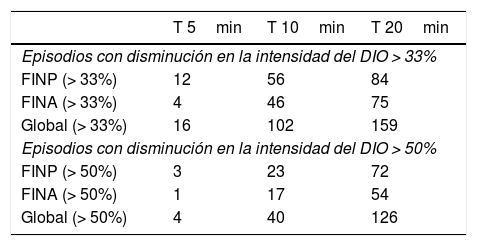
El número de episodios que con ambos FNL IN se aliviaron en más de un 33 y un 50% sobre la escala numérica de 11 puntos se muestra en la tabla 4.
Episodios de dolor aliviados en más de un 33 y un 50% con los fentanilos intranasales.
| T 5min | T 10min | T 20min | |
|---|---|---|---|
| Episodios con disminución en la intensidad del DIO > 33% | |||
| FINP (> 33%) | 12 | 56 | 84 |
| FINA (> 33%) | 4 | 46 | 75 |
| Global (> 33%) | 16 | 102 | 159 |
| Episodios con disminución en la intensidad del DIO > 50% | |||
| FINP (> 50%) | 3 | 23 | 72 |
| FINA (> 50%) | 1 | 17 | 54 |
| Global (> 50%) | 4 | 40 | 126 |
DIO: dolor irruptivo oncológico; FINP: fentanilo intranasal con pectina; FINA: fentanilo intranasal en solución acuosa.
A los 10min el alivio > 33% se consigue en el 57% de los episodios tratados con FINP (56 de 97 episodios) y en el 50% de los episodios tratados con FINA (46 de 91 episodios).
El alivio > 50% es del 23 y el 18%, respectivamente, a los 10min.
La tasa de efectos adversos no mostró diferencias entre FINA y FINP, y fueron leves. Tampoco los enfermos (42 de ellos) manifestaron preferencia por ninguno de los FNL IN, aunque 7 prefirieron el FINP y 3 el FINA. Seis enfermos con FINA y 7 con FINP precisaron un rescate con MFN i.v. a los 20min.
En la discusión llama la atención que el FINP con un menor Tmax y una menor Cmax presente un inicio de acción similar, y aun algo mejor respecto a FINA (p=0,016). Los autores comentan que, dadas las diferencias farmacocinéticas entre preparados, es posible que la dosis doble de FINP frente a FINA pueda ser algo desproporcionada, y que un exceso relativo de FINP genere unos resultados mejores de lo esperado a tenor de su farmacocinética.
Concluyen que FINP y FINA son eficaces y bien tolerados, con eficacia analgésica significativa dentro de los 5-10min y con una excelente eficacia global al disminuir al 50% la intensidad del dolor a los 20min (FINP frente a FINA, con p=0,043). El estudio es criticable, pese a su interés como comparación directa, por la falta de cegamiento y el escaso número de pacientes y episodios de DIO tratados.
Hay que destacar que la dosis de los FNL IN se obtiene desde un cálculo proporcional respecto a la analgesia opioide-basal y no desde la titulación individualizada. Es una nueva aproximación al manejo del DIO con los FNL TM que puede ser una alternativa para el futuro inmediato, aunque aún hay poca evidencia sobre el particular.
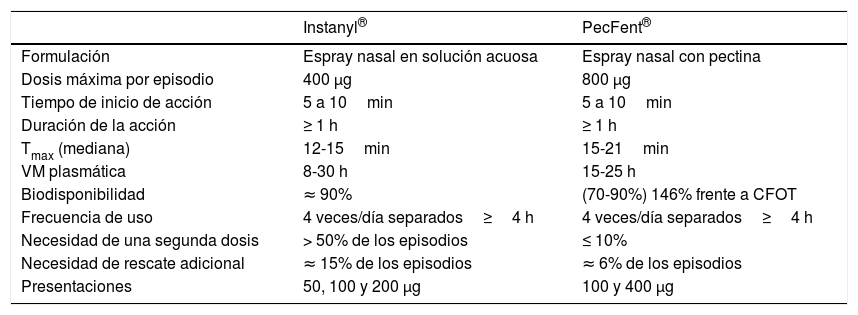
Las características de los FNL IN disponibles se resumen en la tabla 5.
Características de los fentanilos intranasales.
| Instanyl® | PecFent® | |
|---|---|---|
| Formulación | Espray nasal en solución acuosa | Espray nasal con pectina |
| Dosis máxima por episodio | 400 μg | 800 μg |
| Tiempo de inicio de acción | 5 a 10min | 5 a 10min |
| Duración de la acción | ≥ 1 h | ≥ 1 h |
| Tmax (mediana) | 12-15min | 15-21min |
| VM plasmática | 8-30 h | 15-25 h |
| Biodisponibilidad | ≈ 90% | (70-90%) 146% frente a CFOT |
| Frecuencia de uso | 4 veces/día separados≥4 h | 4 veces/día separados≥4 h |
| Necesidad de una segunda dosis | > 50% de los episodios | ≤ 10% |
| Necesidad de rescate adicional | ≈ 15% de los episodios | ≈ 6% de los episodios |
| Presentaciones | 50, 100 y 200 μg | 100 y 400 μg |
CFOT: citrato de fentanilo oral transmucoso; Tmax: tiempo máximo; VM: vida media.
Modificada de referencias 17 y 34.
En comunicaciones anecdóticas se ha descrito el uso de FNL IN para el alivio de la disnea de pacientes con patologías tumorales y no malignas. Eficaz en 1-4min sin deterioro de la función pulmonar (se recomienda titulación para este uso). Frente a la disnea se han ensayado el CFOT y también el FNL nebulizado. El alivio de la disnea probablemente sea una prometedora indicación para el FNL IN, aunque no hay estudios controlados sobre el particular41.
También se utiliza por los equipos paramédicos en Australia antes del traslado al hospital. A veces, la MFN i.v. podría suponer un retraso en el traslado de enfermos urgentes. El FNL IN es una opción, que no necesita de personal especializado, válida para el alivio rápido del dolor42.
Equivalencia entre fentanilo intranasal en solución acuosa y fentanilo intranasal con pectinaLa Agencia Española de Medicamentos y Productos Sanitarios ha publicado una alerta sobre la posible confusión en la prescripción y dispensación de PecFent® e Instanyl® 100 μg/pulverización. Los 2 comparten la misma indicación, la misma forma farmacéutica y el mismo principio activo. Pero hay diferencias sustanciales en el perfil farmacocinético, que resultan en diferencias relevantes en la tasa y grado de absorción. No deben ser sustituidos entre sí de forma incontrolada, por riesgo de obtener tanto un pico mayor de absorción con más efectos adversos como, por el contrario, un pico menor de absorción con la falta de eficacia analgésica. Para sustituir un medicamento por otro no se debe intercambiar dosis por dosis, sino que debe titularse nuevamente43.
Conflicto de interesesEl autor ha impartido charlas formativas y ha participado en recogida de experiencias de casos clínicos, a veces con remuneración, para los laboratorios Ferrer, Prostrakan y Mundipharma. Ha realizado asesoría y trabajo de revisión remunerado para el laboratorio Archimedes.