El derrame pleural maligno es una patología frecuente en los pacientes con cáncer, y por tanto en los servicios de cuidados paliativos. Esta complicación se asocia tanto a los tumores pulmonares primarios como a los metastásicos, y suele plantear problemas relevantes a la hora de tomar decisiones terapéuticas.
Presentamos un caso clínico de un enfermo diagnosticado de carcinoma epidermoide de pulmón y derrame pleural secundario, en quien se realizó tratamiento domiciliario por expreso deseo del paciente. Tras valorar las distintas opciones, se decidió la colocación de un tubo tunelado permanente para drenaje pleural, cuyo manejo domiciliario resultó sencillo y eficaz. El paciente mantuvo el dispositivo funcionante hasta su fallecimiento, con buen control de los síntomas.
El derrame pleural maligno requiere un manejo individualizado y una adecuada gestión de las diversas modalidades terapéuticas disponibles. En determinados casos, el empleo de un tubo tunelado permanente puede aportar claros beneficios terapéuticos y mejorar la calidad de vida de los enfermos.
Malignant pleural effusion (MPE) is a frequent disorder in patients with cancer and thus often seen in Palliative Care Units. MPE is associated with both primary lung cancer and metastatic tumours and will be a significant complication in making decisions about patients.
We report a case of a patient with squamous cell lung cancer associated with a newly diagnosed malignant pleural effusion. At the express wish of the patient on regular at-home-treatment and assessing the therapeutic options for treatment, it was decided to place permanent tunnelled pleural drainage catheter, which was easily performed by the palliative care team at home. The patient had a functionally operating pleural drainage with good control of symptoms until his death at home.
MPE requires an individualised approach and a suitable management of the available therapeutic possibilities. In selected patients, like ours, the use of a permanent tunnelled drainage catheter can bring clear therapeutic advantages and an increase in patient quality of life
La neoplasia constituye la causa más frecuente de derrame pleural en aquellos sujetos en los que se realiza toracocentesis; concretamente el 36% tienen etiología maligna1,2. Las neoplasias primarias de pulmón en el hombre, que en la actualidad son la causa principal de muerte por cáncer3, y el cáncer de mama en la mujer justifican más de la mitad de los derrames pleurales malignos. Le siguen en frecuencia el linfoma y el cáncer de ovario, mientras que en el 8% o más no se llega a identificar el tumor primario2. Por lo tanto, la gran mayoría de los derrames pleurales malignos representan metástasis de un tumor primitivo extrapleural y menos de un 2%, con alguna variación geográfica, se originan en la pleura. El término «paraneoplásico» se refiere a derrames pleurales que no son resultado directo de la afectación neoplásica de la pleura pero sí se relacionan con el tumor primario (atelectasia, síndrome de la vena cava superior, etc.).
La presencia de derrame pleural maligno conlleva un mal pronóstico, ya que representa un estadio tumoral avanzado (IIIb o IV) y constituye una complicación relevante en la toma de decisiones sobre los pacientes.
La selección de las diferentes modalidades terapéuticas tiene que estar basada en la mejor estrategia para cada paciente4, teniendo en cuenta los siguientes factores:
- a)
Pronóstico. La supervivencia media de un paciente tras el diagnóstico de derrame maligno es de 4 meses5, aunque existen casos de supervivencia prolongada, fundamentalmente los que son candidatos a terapia sistémica (secundarias a neoplasias de ovario, mama, linfoma)6. Si la supervivencia esperada es inferior se pueden manejar con otros procedimientos, como las toracocentesis evacuadoras y/o pleurodesis (con talco o doxiciclina)7-9. En los casos de mayor expectativa de vida, consideraremos procedimientos más invasivos.
- b)
Velocidad de acumulación. La estrategia será adecuada a la velocidad de formación del derrame, ya que si fuera lenta podrían evitarse las toracocentesis evacuadoras o bien realizarse estas de modo reiterado con demoras incluso de semanas. Nos plantearíamos la pleurodesis química, o drenajes torácicos permanentes, en el caso de que la velocidad de formación fuera mayor, lo cual conlleva la presencia de disnea, síntoma más invalidante y relevante del derrame pleural.
- c)
Situación basal del paciente, determinada por su funcionalidad cotidiana que es concretada por el índice de Karnofsky, considerando el tratamiento farmacológico con morfina a dosis bajas una alternativa razonable para pacientes con situación basal más adversa.
- d)
Consentimiento o decisión expresa de los pacientes, previa explicación detallada de los procedimientos posibles y sus alternativas. Este último aspecto evidencia que las diferentes posibilidades técnicas existentes entre los diferentes servicios de cuidados paliativos determinan las posibilidades de actuación ante la presencia de casos concretos.
Atendiendo a todos estos factores, podemos realizar una adecuada gestión6,10 o actuación frente a los derrames malignos, que puede resumirse así:
- •
Paciente asintomático: sin tratamiento, actitud vigilante.
- •
Derrame pleural leve o de crecimiento lento: tratamiento farmacológico de la disnea y toracocentesis evacuadoras.
- •
Derrame pleural rápidamente recidivante: colocación de drenajes torácicos con posterior pleurodesis, bien con doxiciclina7,8 o bien con talco9, que es utilizado con mayor frecuencia.
- •
Persistencia del derrame: drenajes torácicos estándar11 o bien catéteres pleurales tunelados12-15, que añaden varias ventajas sobre los tradicionales, como es su corta estancia hospitalaria, menos complicaciones y permanencia a largo plazo.
Otros procedimientos invasivos, como la pleurectomía parietal16,17 o la derivación pleuroperitoneal18,19, serían opciones terapéuticas en casos de fallo de los procedimientos anteriores, pero en general no son aplicables a nuestros pacientes por su alta morbilidad y mortalidad.
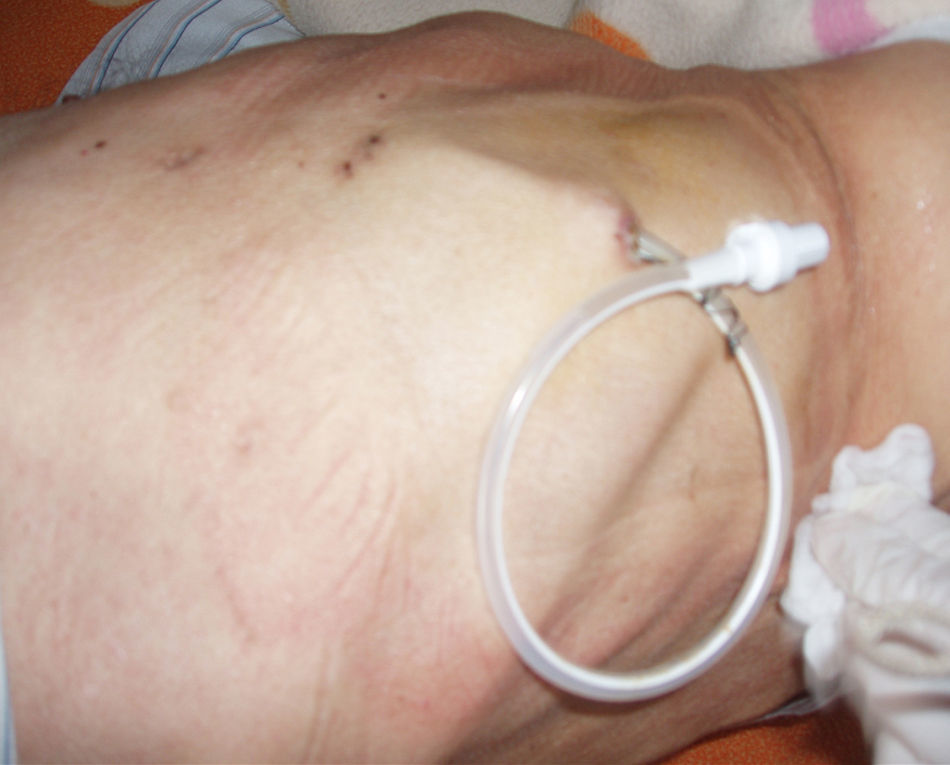
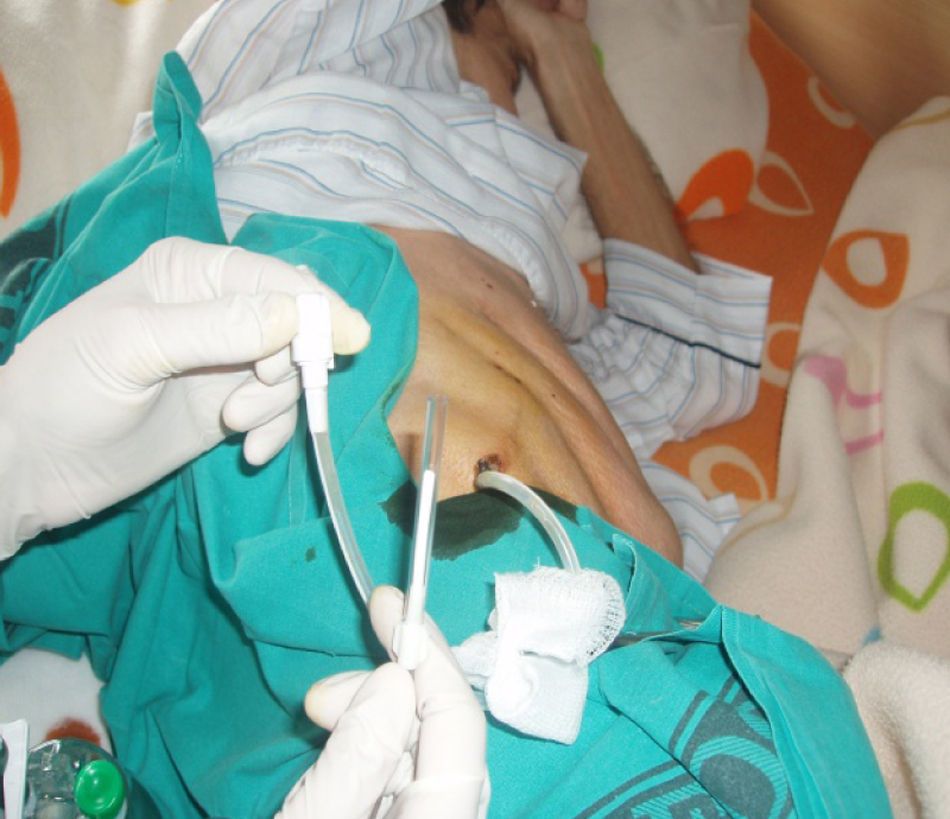
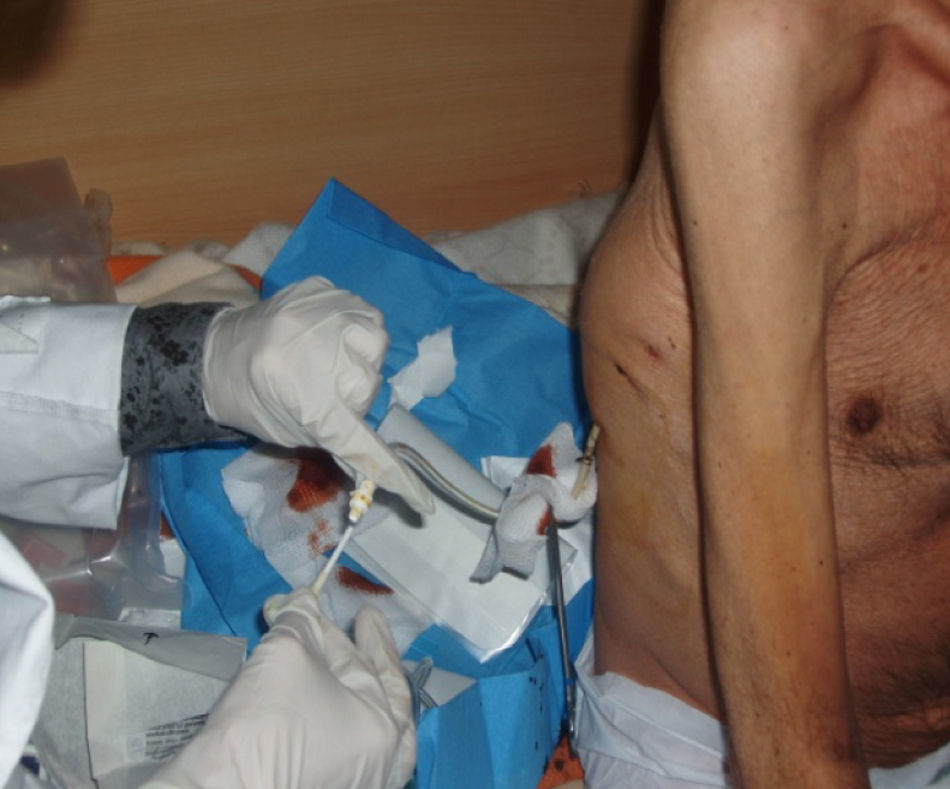
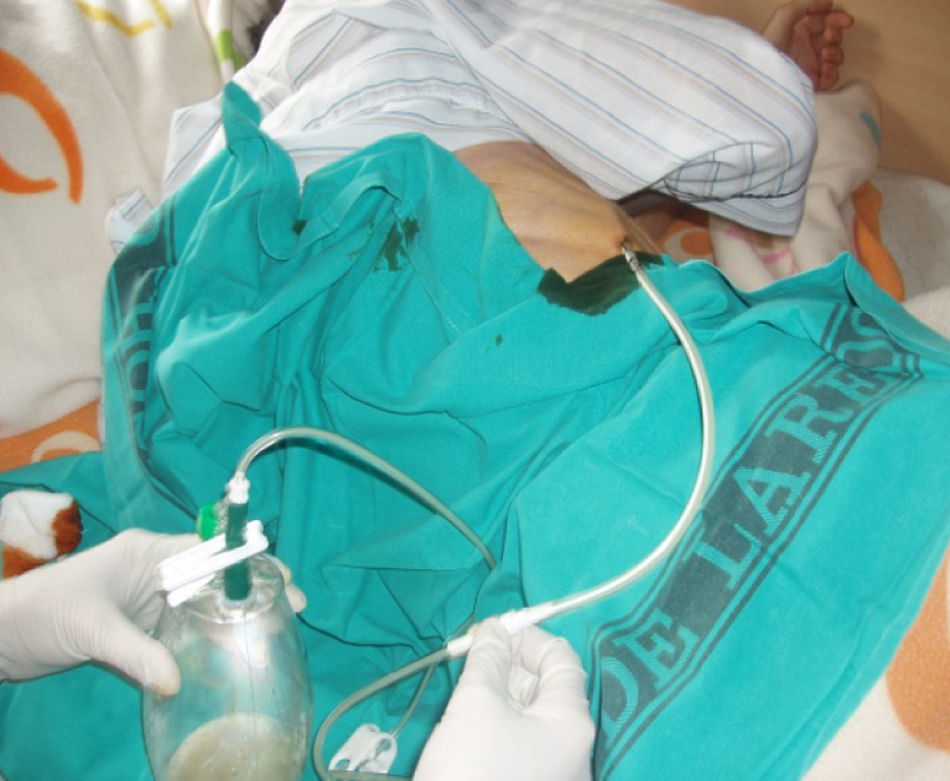
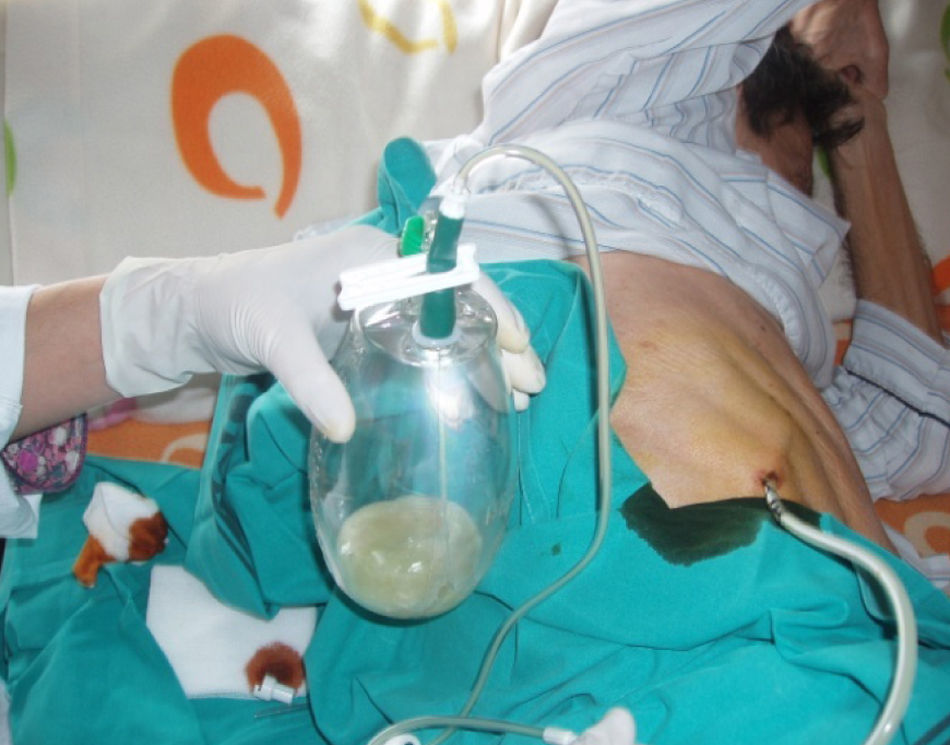
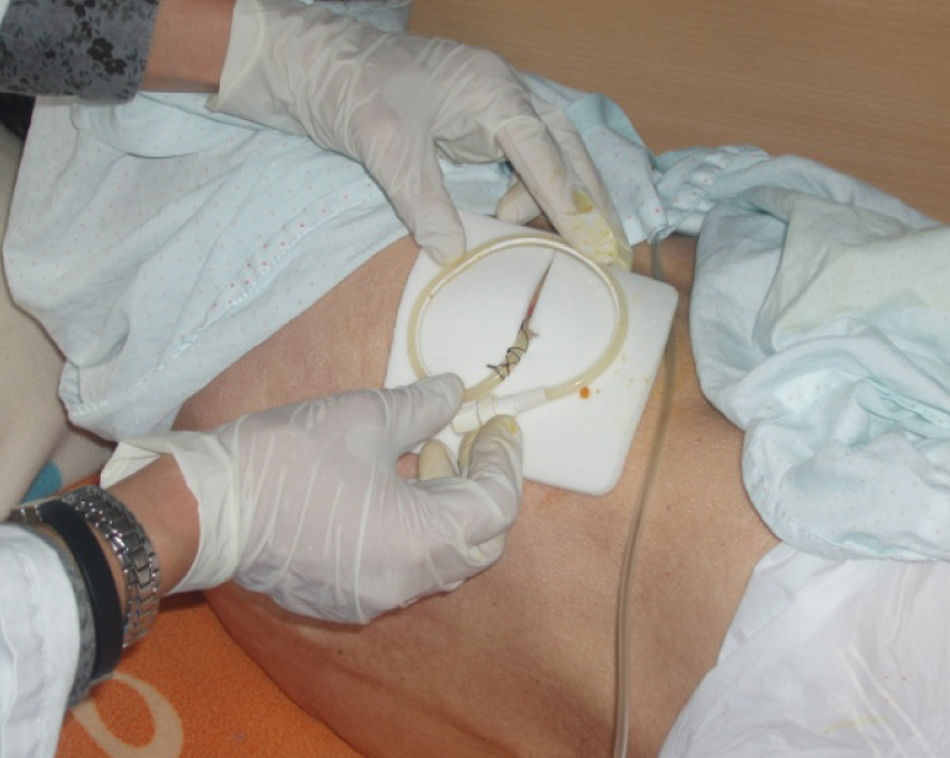
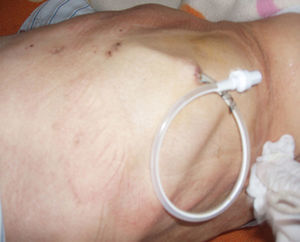
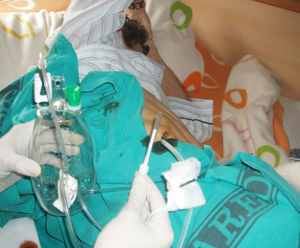
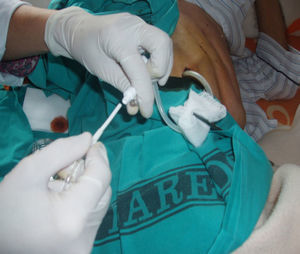
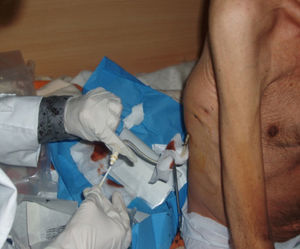
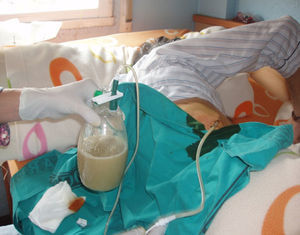
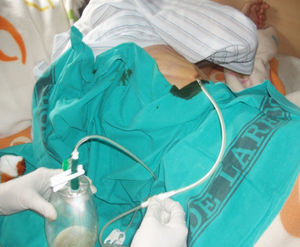
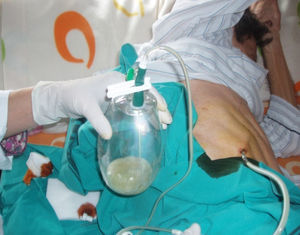
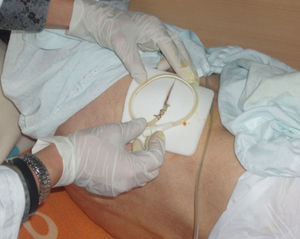
La técnica del catéter tunelado consiste en la colocación de un catéter tipo Pleurx©, específicamente diseñado para el tratamiento del derrame pleural maligno. Se trata de un catéter flexible de silicona de 66cm de longitud. La porción distal se introduce en la cavidad pleural y otro tramo del catéter se tuneliza (fig. 1) a través del tejido subcutáneo, la parte proximal queda expuesta al exterior a cierta distancia (5-7cm) y termina en una válvula de seguridad (fig. 2), que sólo se abre cuando se introduce en ella un dilatador conectado por un tubo de plástico (figs. 3-5) y drena a una botella de vacío específica que tiene una capacidad de 600ml (figs. 6 y 7). El catéter se fija con puntos de sutura dérmicos, aunque la fibrosis del trayecto subcutáneo suele impedir el desplazamiento del catéter. Puede permanecer durante meses, provocar pleurodesis espontánea y también es posible administrar agentes esclerosantes. Las complicaciones son escasas. En menos del 20% se produce obstrucción del drenaje, que puede ser por oclusión del catéter o por multiloculación del espacio pleural, situaciones que obligan a su retirada o a su sustitución4.
Cuando nos enfrentamos a casos complejos, como es el de la presencia de disnea asociada a un derrame pleural maligno, debemos tener en cuenta múltiples variables a la hora de elaborar la mejor estrategia posible para cada paciente. En el caso presentado se analizan los factores que condicionan la decisión terapéutica adoptada, y se orienta la forma de gestionar la coordinación de recursos para mantener dicho tratamiento en el domicilio del paciente.
Caso clínicoVarón de 53 años que ingresa por cuadro de 2 meses de evolución de astenia con pérdida no cuantificada de peso, tos de predominio nocturno con expectoración mucosa y ocasionalmente hemoptoica, y disnea progresiva hasta hacerse de mínimos esfuerzos.
Entre sus antecedentes personales destacaban: fumador de 30-40paquetes año y bebedor de más de 80g de etanol/día, episodio de arritmia cardiaca por fibrilación auricular sin cardiopatía estructural. Situación emocional inestable por sus hábitos tóxicos activos y una separación conyugal reciente: vivía en la casa materna con problemas de aceptación del resto de la familia.
En la exploración física destacaba una presión arterial de 120/75 mmHg; frecuencia cardiaca de 140/min; saturación del 91%; índice de masa corporal de 19, e índice de Karnofsky de 60.
No se palpaban adenopatías. Presentaba roncus bilaterales y ausencia del murmullo vesicular en ambas bases (de predominio en la derecha, 2/3 inferior). Hepatomegalia dura, lisa, de 4 traveses.
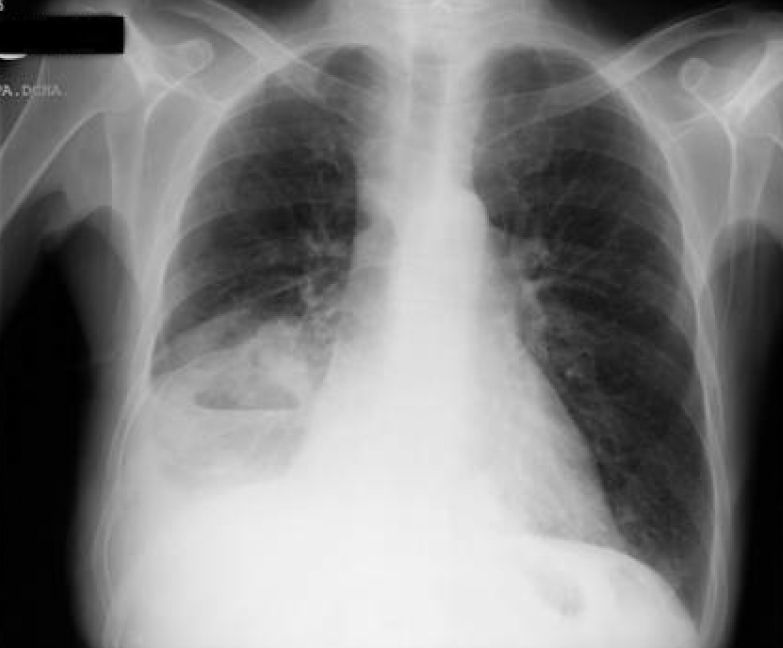
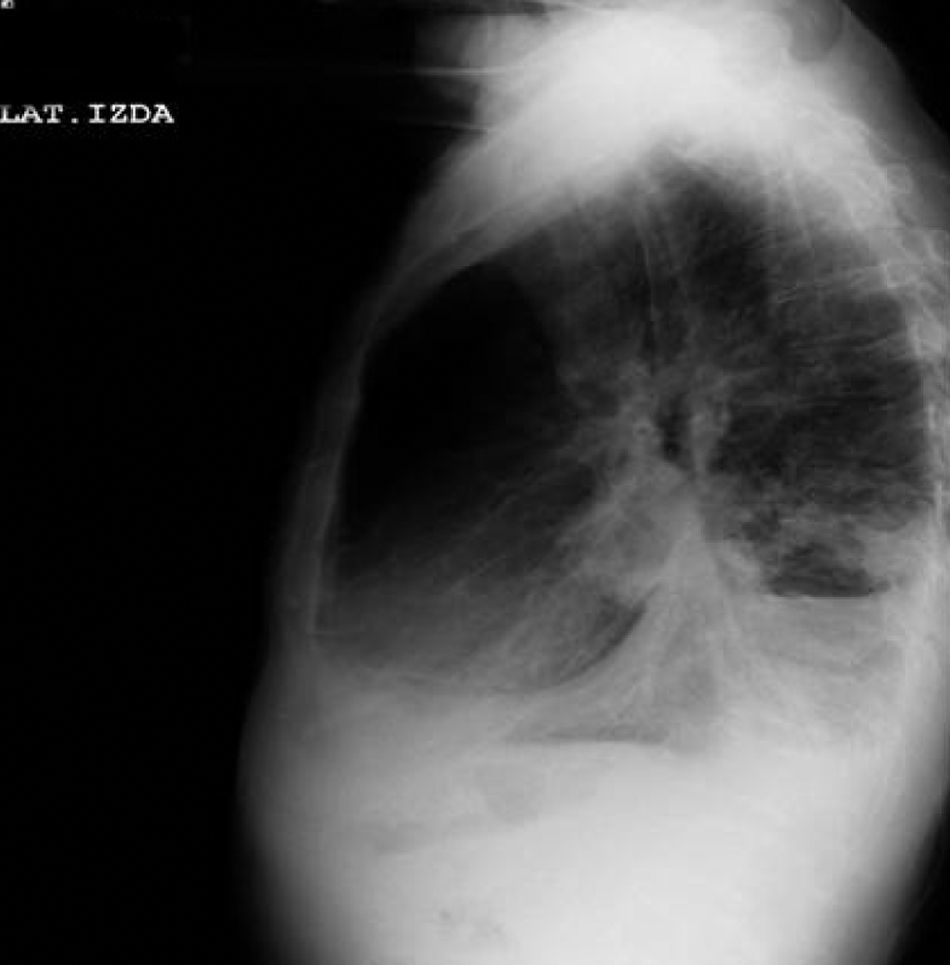
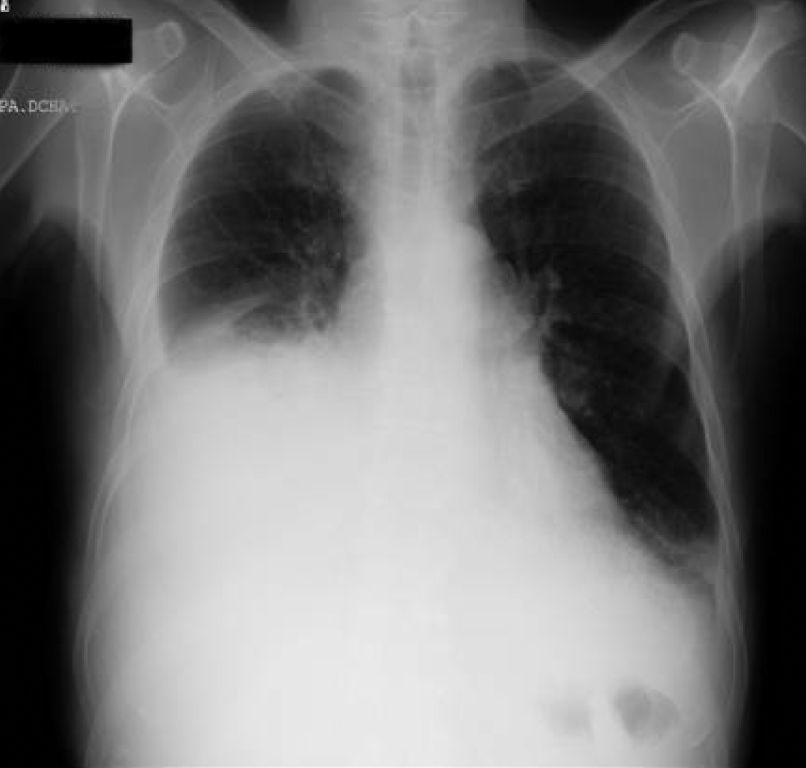
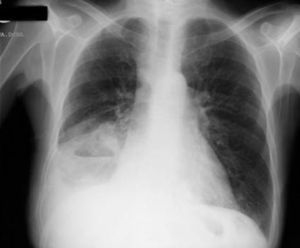
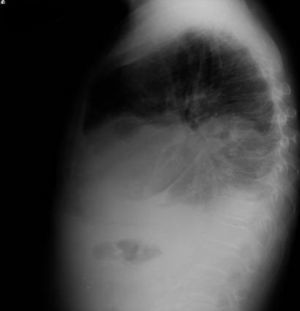
Tras la anamnesis y la exploración física se procedió a la realización del estudio diagnóstico complementario, que incluyó la radiografía de tórax, en la que se objetivó un derrame pleural derecho que enmascaraba una masa cavitada en el lóbulo medio derecho (figs. 8 y 9); toracocentesis diagnóstica/evacuadora, tomografía axial computarizada (TAC) en la que se objetivan múltiples adenopatías mediastínicas e hiliares bilaterales con masa cavitada en el lóbulo inferior derecho, derrame pleural bilateral y metástasis pulmonares bilaterales; la broncoscopia demostró una lesión verrugosa de unos 15mm que estenosaba la salida del lóbulo medio derecho y el lóbulo inferior derecho con mucosa infiltrada de la que se toman biopsias. Fue dado de alta con el diagnóstico de tumor pulmonar de células no pequeñas (carcinoma epidermoide) estadio IV, pendiente de valoración por el servicio de oncología.
El paciente era conocedor de toda la información acerca de su diagnóstico, y no tanto del pronóstico, dado que no mostraba ningún interés por su conocimiento. El apoyo familiar, muy escaso al principio del ingreso, fue reconducido con posterioridad ante el conocimiento real de su estado.
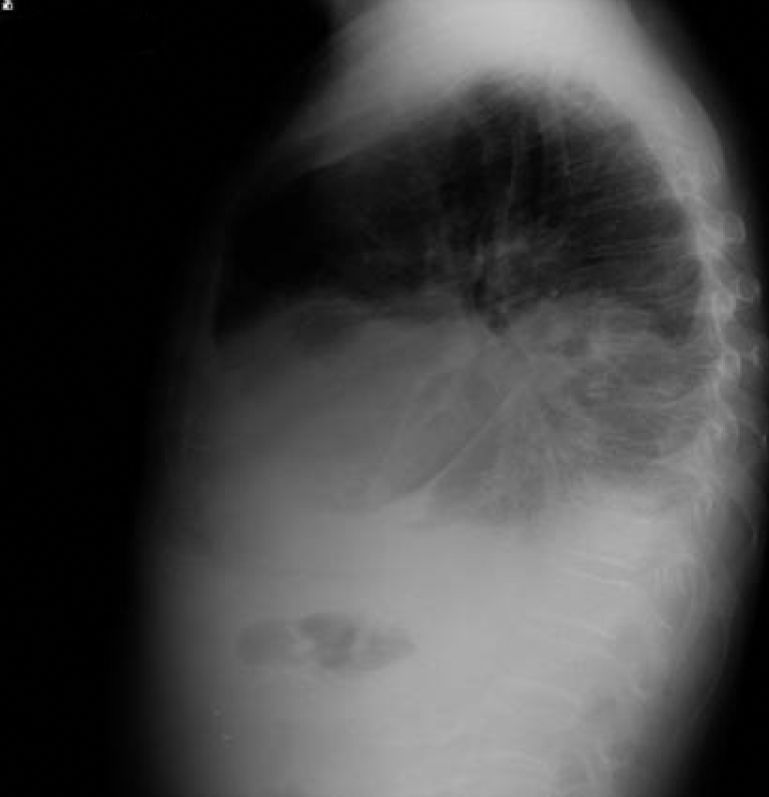
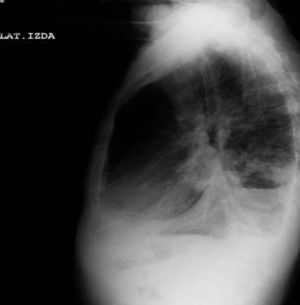
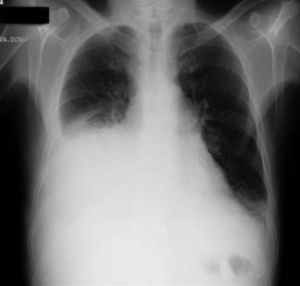
Dos días más tarde volvió al hospital por disnea grado III/IV, dolor torácico de características pleuríticas e insuficiencia respiratoria parcial grave. Se objetivó nuevamente la presencia de derrame pleural derecho y un pequeño derrame izquierdo (figs. 10 y 11), precisando un reingreso.
Inicialmente se procedió a drenaje pleural mediante tubo de tórax conectado a Pleur-Evac, y se pautó tratamiento antibiótico empírico, dadas las actuales características del líquido pleural (pH: 7,10; células: 9.600 [predominio PMN]; glucosa: 49; proteínas totales: 2,98; LDH: 502 [relación S/L: 1,19]; cultivo del líquido: estreptococo salivarius). Paralelamente, presentó varias complicaciones durante su estancia, en concreto una suboclusión intestinal secundaria a fecaloma resuelta médicamente y una descompensación de la fibrilación auricular con respuestas ventriculares rápidas que precisó combinación de antiarrítmicos (digoxina 0,25mg/día/24h y verapamilo 180mg/12h).
Tras valorarse la nueva situación del paciente y para decidir la indicación terapéutica se consideraron los siguientes factores: estadio IV o enfermedad extendida, edad, índice de Karnofsky: 30-40, rapidez de acumulación de líquido pleural (que condicionaba disnea progresiva). Por deseo expreso de tratamiento domiciliario, tras comentar el caso con el servicio de neumología del hospital se procedió a la colocación de un tubo de drenaje permanente (tunelado) para poder evacuar el derrame ambulatoriamente.
Tras la colocación de dicho sistema (fig. 1) se procedió al alta a las 24h de su implantación.
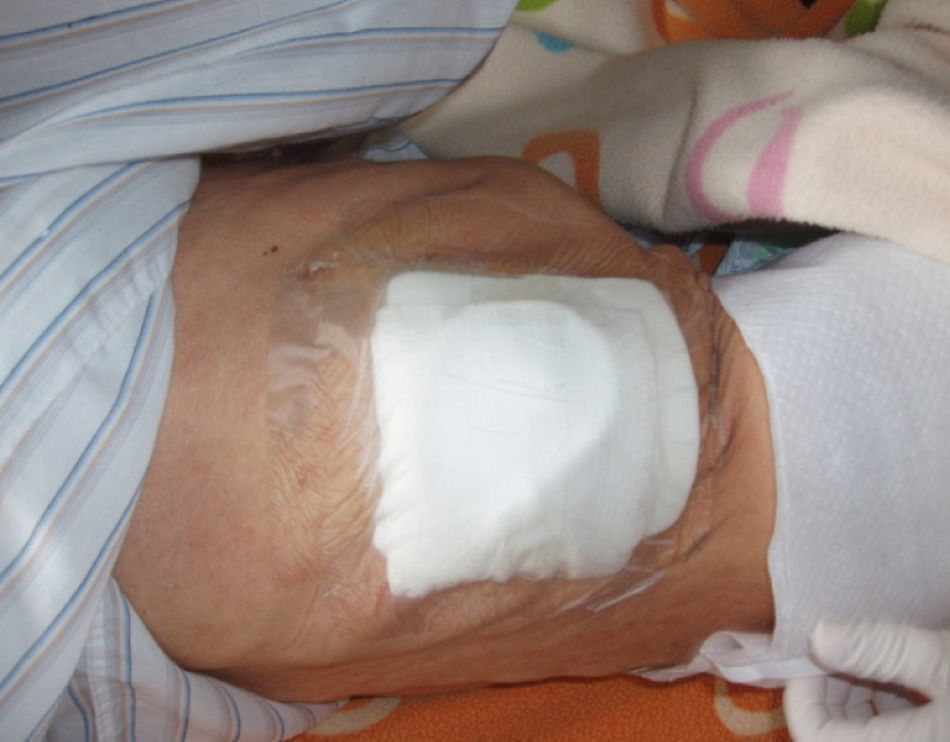
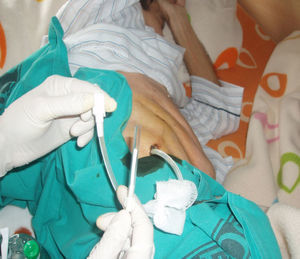
En nuestro caso, la posibilidad de seguimiento por parte del equipo en el domicilio, con la participación conjunta de atención primaria, nos permitió un mejor control de la situación, fundamentalmente en lo referido a la esterilidad y el manejo del drenaje y al seguimiento de la medicación antibiótica específica (ciprofloxacino, 750mg/12h, más clindamicina, 300mg/6h), además del apoyo psicológico y emocional en cada visita (figs. 3, 12 y 6).
Inicialmente mantuvimos visitas cada 4 días, para continuar con una periodicidad semanal, llegándose a demorar la visita cada 10 días en el último mes.
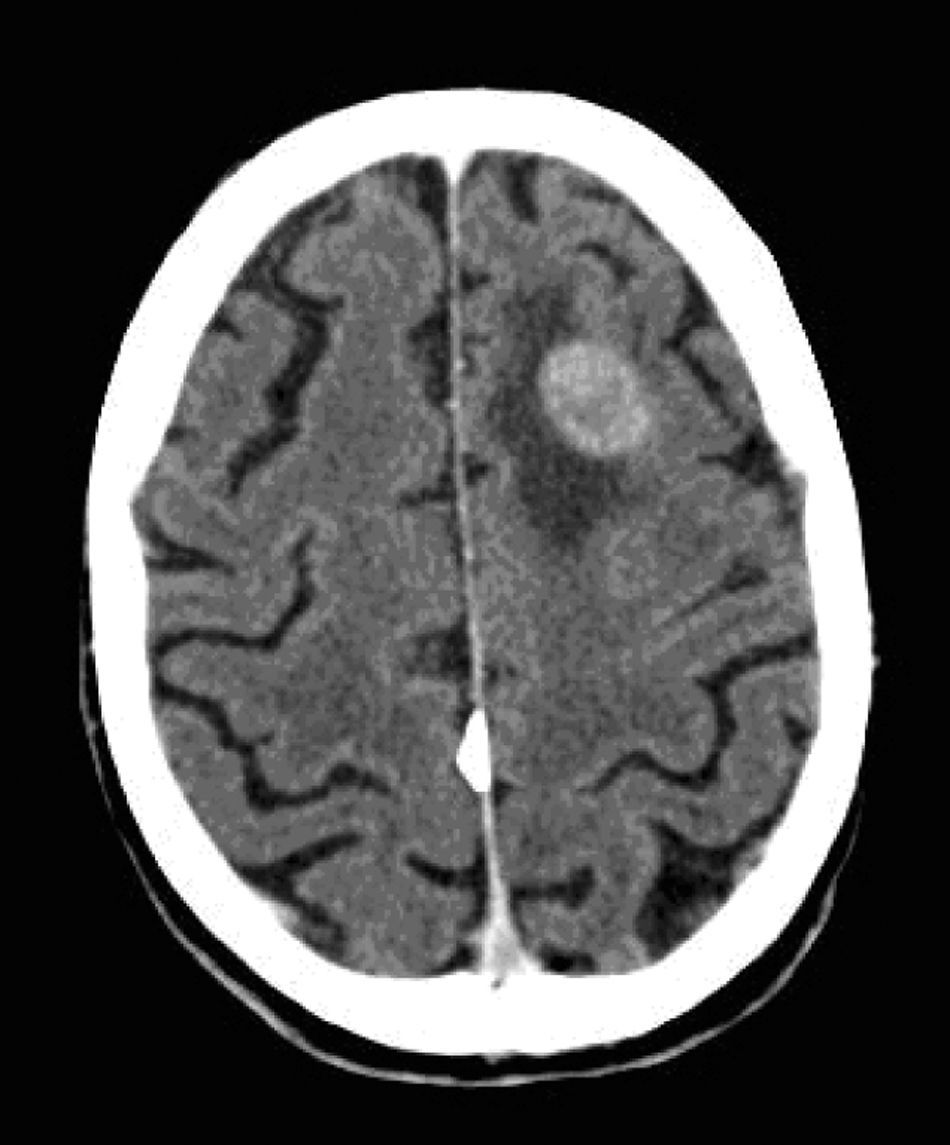
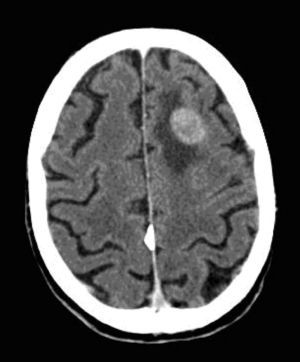
Casi 3 meses después del alta hospitalaria, el paciente ingresó por cuadro confusional agudo severo, secundario a una crisis convulsiva tónico-clónica. Se solicitó la realización de TAC craneal (fig. 13), que confirmó la sospecha clínica de metástasis cerebral.
Se añadió a su medicación habitual tratamiento esteroideo a altas dosis (dexametasona, 1 ampolla/6h, seguida de pauta descendente oral), anticonvulsivantes (difenilhidantoína en perfusión y después oral, 100mg/8h), omeprazol (40mg/día), asociado a digoxina (un comprimido/día), verapamilo (Manidon®, 180/12h) y MST 5mg/12h, consiguiendo un control sintomático que permitió de nuevo el alta al domicilio para seguimiento ambulatorio.
El paciente mantuvo el drenaje pleural en buen estado hasta su fallecimiento, en el domicilio, con buen control de la disnea, como consecuencia de la rápida evolución cerebral metastásica. Permanencia total del catéter: 3 meses.
DiscusiónEn nuestro caso, la decisión de colocar el catéter de drenaje tunelado estuvo determinada por el pronóstico, la rápida velocidad de acumulación que condicionaba la gravedad de la disnea, la presencia de empiema, la situación basal y el deseo expreso del paciente de tratamiento domiciliario, teniendo en cuenta las grandes dificultades técnicas de su realización, dado que al ser un hospital comarcal no tenemos servicio de cirugía torácia. Fue realizado por dos especialistas en neumología junto con nuestro equipo, en la planta de medicina interna y con sedación superficial (morfina, media ampolla, y midazolam, 1,5mg, intravenosos).
El principal problema lo encontramos en la introducción del drenaje en el espacio pleural, momento en que el canal de inserción pleural quedó expuesto al aire, con la posible entrada en dicho espacio, lo cual se resolvió con la aspiración y drenaje inicial de 1.000ml de líquido.
Otros problemas que surgieron fueron dolor torácico las primeras 24h, y ya en el domicilio presentó prurito intenso con reacción cutánea que obligó a sustituir el parche cutáneo de sujeción (figs. 14 y 15) por un parche de Mepilex© border; la sobreinfección de los puntos cutáneos obligó a suturar de nuevo en distintas localizaciones.
La evolución del paciente con el catéter fue favorable, con mejora de la disnea y de la funcionalidad, lo que le permitió la deambulación; se logró la permanencia del drenaje, sin complicaciones determinantes, hasta el fallecimiento.
El contexto social —madre obesa con elefantiasis en miembros inferiores que le impedía salir del domicilio desde hacía más de un año, vivienda de cuatro pisos sin condiciones higiénicas adecuadas, reconducir la conducta del resto de hermanos que tuvieron que organizarse en los cuidados diarios y la dependencia emocional que desarrolló con el equipo— exigía la colaboración de los distintos niveles asistenciales, fundamentalmente con atención primaria y trabajador social. En otro contexto, el procedimiento de drenaje podría realizarse por un familiar especialmente adiestrado, dado que el sistema Pleurx© está diseñado para poder realizarse en el domicilio por personal no sanitario.
Afortunadamente, a pesar de la gravedad y de la complejidad de estos casos, la mayor parte de los derrames pleurales en nuestros pacientes no precisan medidas invasivas, y la disnea mejora con morfina oral de liberación prolongada a dosis bajas.
Por tanto, concluimos que el abordaje del derrame pleural maligno requiere la adecuada selección de las diferentes modalidades terapéuticas, utilizando medidas farmacológicas para pacientes con peor pronóstico de vida y realizando una gestión razonable de los métodos invasivos en la toma de decisiones de pacientes con mayor expectativa de vida.