Introducción
El cáncer cérvico-uterino (CACU) es una de las principales neoplasias malignas que afecta a las mujeres en el mundo y en nuestro país es el cáncer más frecuente en el sexo femenino.1 Desde hace varias décadas se ha reconocido su asociación epidemiológica con el hecho de tener múltiples parejas sexuales, así como con el inicio temprano de la actividad sexual, lo que ya sugería una etiología transmisible; recientemente se ha demostrado su relación con la presencia del virus del papiloma humano (VPH), en el tejido neoplásico.2
Historia
Las verrugas o papilomas cutáneos han sido reconocidos desde la antigüedad y se presentan en prácticamente todas las especies de vertebrados. Desde la primera década del siglo XX se estableció la etiología viral de las verrugas humanas mediante la inoculación con extractos de tejido condilomatoso libres de células, lo que demostró en forma experimental la naturaleza transmisible de esta infección.3 En 1933, Shope aisló el primer papillomavirus en los conejos cola de algodón4 y posteriormente en estos mismos animales se provocaron carcinomas escamosos aplicando alquitrán de hulla como promotor tumoral de los papilomas.5-7
En 1956 Koss y Durfee acuñaron el término atipia coilocitótica para describir los cambios de las células escamosas anormales caracterizadas por grandes vacuolas perinucleares (coilocitos) que se encontraban en citología cervical de pacientes con displasia y carcinoma invasor.8 En 1976 Meisels y Fortín9 y en 1977 Purola y Savia10 propusieron que las células del condiloma acuminado que por ultraestructura contenían partículas virales compatibles con VPH eran idénticas a los coilocitos descritos por Koss y Durfee.
Desde 1977, Zur Hausen sugirió que podía existir asociación entre VPH y cáncer cervical.2 En la misma década de los setentas se describieron los modelos de carcinogénesis inducida por virus en humanos en pacientes con carcinomas escamosos cutáneos originados en epidermodisplasia verruciforme, enfermedad causada por un tipo de VPH.11,12
Finalmente, con el advenimiento de la biología molecular fue posible la caracterización molecular de este virus.13-15
Biología del VPH
Anteriormente, los papilomavirus pertenecían, junto con los poliomavirus, a la familia Papovaviridae; sin embargo, con la posterior secuenciación de los genomas de los papilomavirus se observó que aunque tienen una organización genética semejante, su transcripción es diferente: unidireccional en los papilomavirus y bidireccional en los poliomavirus, por lo que el Comité Internacional de Taxonomía de los virus decidió que los papilomavirus fueran una familia diferente, denominada Papillomaviridae.16-18
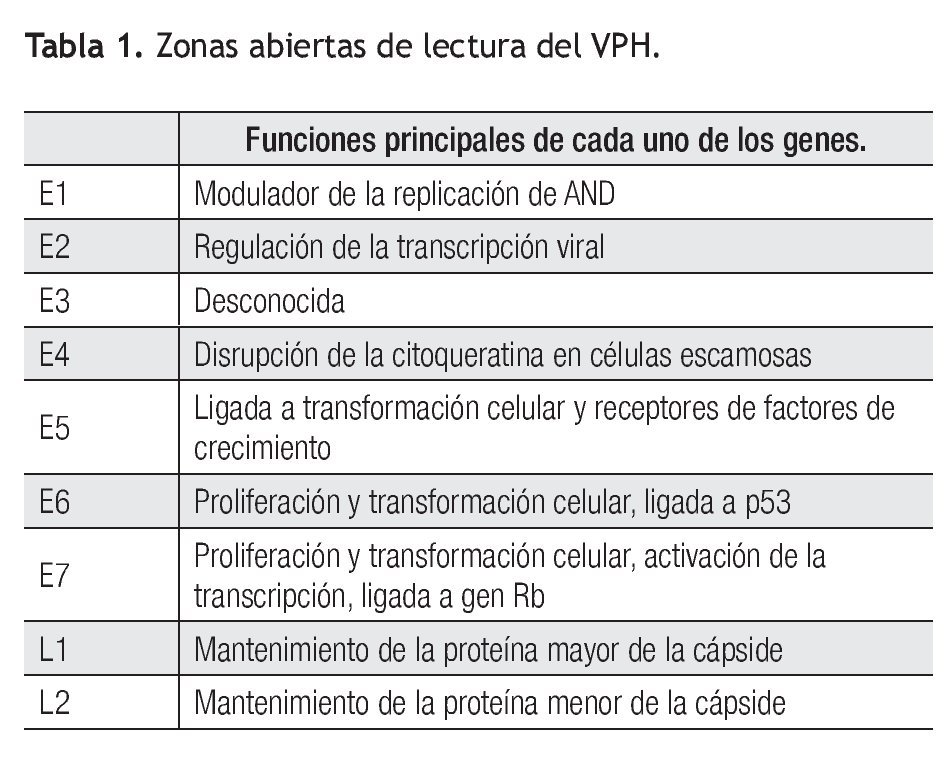
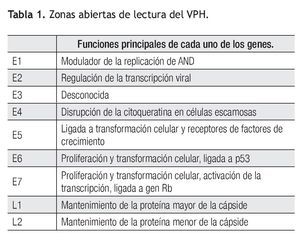
Esta familia infecta los epitelios de mamíferos y otras especies vertebradas. El VPH pertenece a cinco de 18 géneros de la familia Papillomaviridae: alfa, beta, gamma, mu y nu.16 Los papilomavirus se caracterizan por ser pequeños virus no envueltos que miden entre 45 mm a 55 nm de diámetro, con una cápside icosaédrica de proteína. Su genoma de ácido desoxirribonucléico (ADN) circular de doble cadena de aproximadamente 8,000 pares de bases de longitud, contiene nueve o 10 regiones codificantes, denominadas zonas abiertas de lectura (ORFs por sus siglas en inglés). Dichas ORFs son secuencias de nucleótidos que codifican proteínas no estructurales (enzimas) involucradas en la regulación de las funciones virales, así como proteínas estructurales involucradas en la producción de las diferentes partículas del virus. Aquellas que codifican proteínas no estructurales son conocidas como genes de expresión temprana o E ("early") y las que codifican proteínas estructurales se denominan genes de expresión tardía o L ("late"), de acuerdo a si son expresados antes o después de la síntesis del ADN destinado a ser ensamblado en las partículas de progenie viral. En el VPH, siete u ocho de las regiones ORFs codifican para genes tempranos y únicamente dos para genes tardíos. Contiene además una región no codificante, conocida como región larga de control o región reguladora principal, cuyas secuencias se encargan de la regulación de la expresión de todos sus genes, tanto de las regiones temprana como tardía (Tabla 1).16
Se ha identificado la expresión de más de veinte secuencias de ARN mensajero, la mayoría en una forma específica a tipo celular y diferenciación. Los productos de los genes E6 y E7 han sido los más estudiados a causa de su interacción con los genes supresores p53 y Rb y su papel en la transformación celular, se denominan oncogenes o genes transformantes, mientras que los genes denominados L1 y L2 codifican para las proteínas de la cápside (Tabla 1).19,20
Infecciones por VPH
El primer paso en una infección con el VPH es la adhesión de viriones intactos a células de un epitelio escamoso a partir de lo cual pueden ocurrir dos tipos de infecciones: productivas o latentes.
En las infecciones productivas o activas, la replicación viral se lleva a cabo principalmente en células escamosas ya diferenciadas, esto es, en las capas intermedia y superficial del epitelio escamoso, en donde ocurre una intensa actividad de replicación del ADN viral, con producción de proteínas de la cápside y ensamblaje de nuevos viriones, los cuales producen cambios celulares característicos sobre las células infectadas. En un estudio citológico el efecto citopático observado incluye acantosis, vacuolización citoplásmica prominente, atipia nuclear y binucleación.
En la infección de tipo latente, la infección ocurre predominantemente en células inmaduras (células basales o células metaplásicas) del epitelio escamoso. El ADN viral permanece dentro de la célula en forma circular libre (forma episomal) sin replicarse. No hay cambios morfológicos identificables en la citología, por lo que la detección viral en este tipo de infecciones solo puede hacerse por métodos moleculares.
Clasificación clínico-patológica del VPH
En la actualidad, se han descrito más de 100 tipos de VPH cuyas manifestaciones clínicas incluyen un amplio espectro de lesiones proliferativas en la piel y las mucosas oral, laríngea y del tracto anogenital.16-18 Al menos veinte de los anteriores muestran tropismo por el tracto anogenital.21
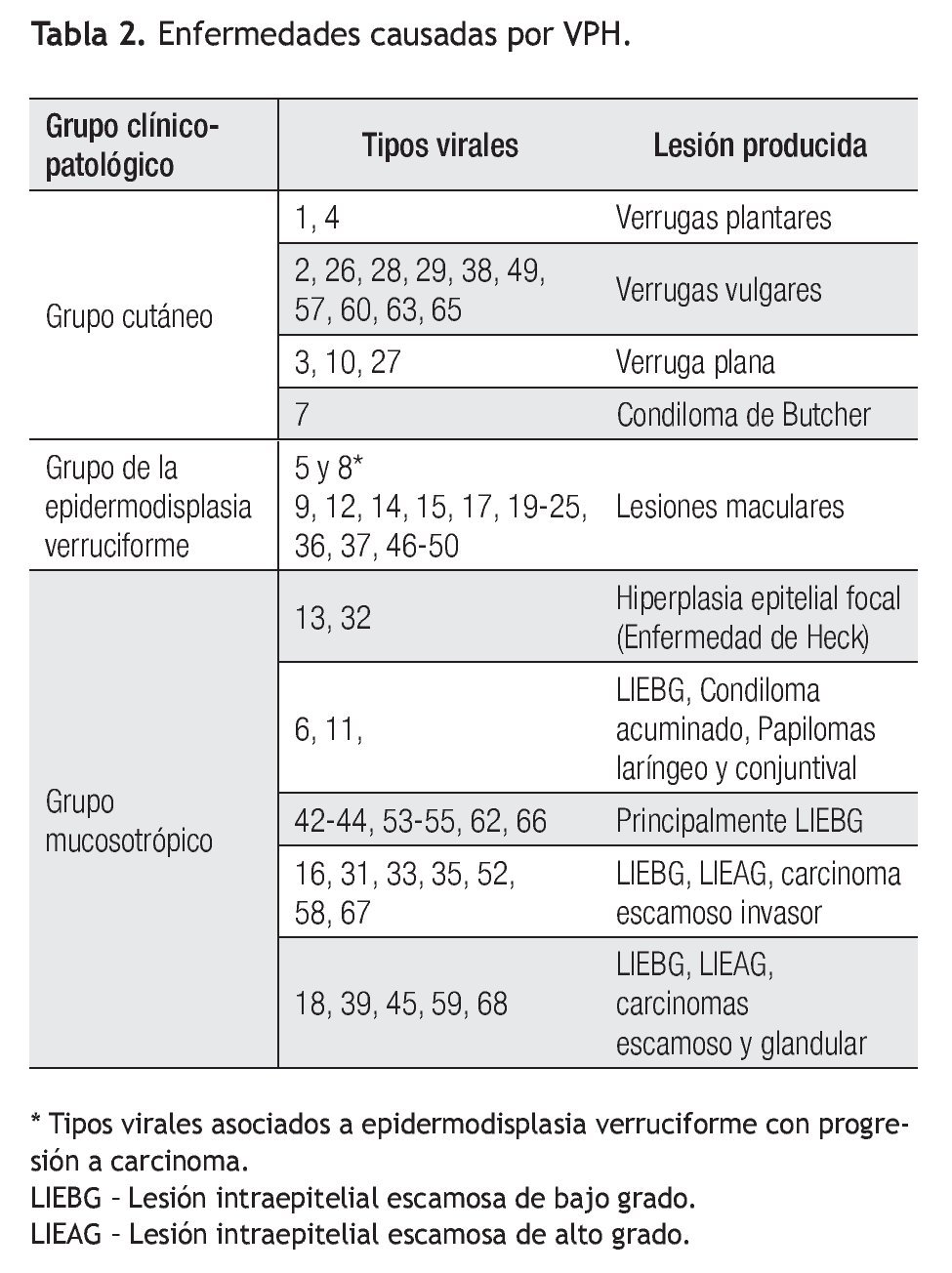
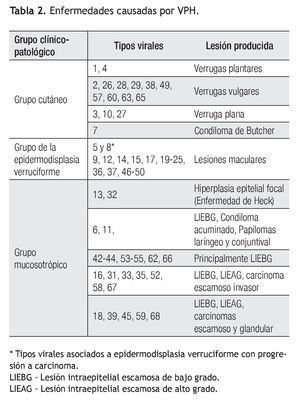
De acuerdo al tropismo tisular y las diferentes manifestaciones clínicas del VPH, se han constituido tres grupos clínico-patológicos: cutáneo, mucoso y el grupo de la epidermodisplasia verruciforme, como se describen en la Tabla 2.15,20,22
De gran interés es el grupo con afinidad hacia las mucosas, cuyo riesgo de progresión a cáncer constituye dos grupos: un grupo de riesgo bajo o no oncogénico que incluye los tipos virales 6, 11, 42, 43 y 44 cuyas principales manifestaciones clínicas son los condilomas acuminados y lesión intraepitelial escamosa de bajo grado (LIEBG).23 En contraste, los virus de riesgo alto u oncogénicos, que incluyen los tipos 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 67 y 68, se asocian a todo el espectro de lesiones intraepiteliales invasoras, tanto del epitelio escamoso como glandular.20,24,25 Los tipos seis y 11, del grupo de bajo riesgo y los tipos oncogénicos 16 y 18, representan dos terceras partes de todos los tipos de VPH asociados a neoplasias anogenitales.
La prevalencia de la infección por VPH es muy variable en diferentes poblaciones, pues el resultado depende de muchas variables que incluyen la sensibilidad de la prueba utilizada, estilo de vida (factores de riesgo) del grupo estudiado, la presencia o ausencia de manifestaciones clínicas y otros factores. La prevalencia en población general de 14 a 59 años en Estados Unidos se ha informado en 26.8%, el grupo de edad más afectado es el de entre 20 y 24 años de edad con una prevalencia de 44.8%.26
Existen evidencias epidemiológicas y moleculares de la estrecha relación del VPH en el desarrollo del carcinoma cervical y sus precursores. Se ha demostrado que más del 90% de los carcinomas cervicouterinos contienen ADN de algún tipo de VPH.27-32 Se estima que aproximadamente 1% de la población mundial padece de verrugas genitales y que 4% de todas las mujeres tienen lesiones intraepiteliales en el cérvix, en mujeres jóvenes esta cifra es aún mayor.28-31 Se ha calculado en forma conservadora la prevalencia del VPH en la población general de los EUA en 15 a 20%,20,33,34 esta cifra aumenta sorprendentemente en cohortes de mujeres jóvenes estudiadas con reacción en cadena de la polimerasa (PCR) con valores que alcanzan hasta el 46%.35,36 En un estudio realizado en jóvenes universitarios mexicanos con dos o más parejas sexuales, Sánchez-Alemán y colaboradores reportaron una prevalencia de VPH del 14.4%.37 El curso de la infección depende principalmente del tipo de VPH, así como de la edad de adquisición y del estado inmune de la paciente. Las mujeres menores de 35 años son más susceptibles de adquirir infecciones genitales con virus oncogénicos que en la mayoría de los casos desaparecen; en cambio, en las mujeres mayores de 35 años es más común la persistencia de la lesión con cambios clínicos y morfológicos y con mayor riesgo de progresión neoplásica.25,31-33,38
El modelo de carcinogénesis inducida por el virus del papiloma humano, se ha podido establecer con base en evidencias epidemiológicas y moleculares.
Los productos génicos del VPH controlan estrechamente la red de oncogenes y antioncogenes celulares que regulan la proliferación celular y la síntesis de ADN.20
El virus infecta tanto las células basales como las parabasales o las células de reserva, las cuales tienen la capacidad de dividirse y diferenciarse a epitelio escamoso, glandular o neuroendocrino. En el caso de las células con diferenciación escamosa la maduración ocurre a través del engrosamiento del epitelio, con cambios moleculares previos a las alteraciones morfológicas. Si estas células son infectadas por el VPH pueden ocurrir diferentes secuencias de eventos.
El evento más común cuando las células basales morfológicamente normales son infectadas por el VPH, es que las mismas células inhiban la expresión de los genes virales permitiendo la diferenciación celular a expensas de la pérdida de su capacidad de dividirse. A ésta expresión se le denomina "productiva" y afecta las células que inician su diferenciación escamosa, en quienes las regiones tempranas del virus permiten la expresión de todos los genes virales con producción de viriones completos (episomal) justo debajo de la superficie. Morfológicamente, esta lesión se identifica como una lesión de bajo grado con células que muestran atipa coilocítotica, las cuales usualmente regresan o se mantienen igual por largo tiempo. En las lesiones de bajo grado y en la mayoría de las de alto grado el VPH es episomal y el gen E2 se encuentra intacto.37-43 Por otra parte, las lesiones de alto grado se encuentran asociadas a la infección por tipos de VPH de riesgo alto, aunque no exclusivamente.
Los responsables de la pérdida del control de la proliferación celular son los genes virales transformantes E6/E7. Estudios realizados en cultivo de células han demostrado que los genes transformantes E6/E7 son complementarios y cuando sólo uno se expresa, su poder transformante es muy débil. Estos genes se expresan con mayor frecuencia en los tipos virales de riesgo alto como 16 y 18 y su expresión no se observa en los de riesgo bajo como seis y 11.44-49
Si se toma en cuenta la baja frecuencia de las lesiones de alto grado en comparación con las de bajo grado, podría concluirse que sólo en la minoría de los casos el efecto que producen los genes E6/E7 es eficiente para producir un fenotipo inmortal o transformado.50
La sobreexpresión de los genes transformantes puede ser consecuencia de la pérdida del gen viral E2, cuya función es la producción de proteínas reguladoras de la transcripción de las regiones tempranas del virus, que a su vez reprimen la transcripción de los genes E6/E7. En las lesiones de bajo grado y en la mayor parte de las de alto grado el VPH se encuentra en su forma episomal y el E2 está intacto. Sin embargo, en más del 90% de los carcinomas el VPH está integrado en el ADN de la célula huésped, la integración interrumpe los sitios de lectura de los genes E2/E1 pero deja intactos E6/E7, liberándolos de la regulación y permitiendo su expresión. Cuando la expresión de estos genes ocurre en la población de células que aún pueden dividirse, da como consecuencia el inicio de la proliferación celular a través del epitelio, que se traduce en una maduración escamosa desorganizada, con sobrecrecimiento de células basales. Estos cambios son interpretados morfológicamente como una lesión epitelial de alto grado.
Couturier y colaboradores han encontrado secuencias integradas de VPH cerca de los oncogenes c-myc, n-myc y c-Ha-ras del genoma humano,51 la interrupción de la secuencia reguladora de estos oncogenes podría liberar la expresión de las proteínas E6/E7.
Por otra parte, la oncoproteína E6 del VPH 16 se une a la p53 y esta unión produce la degradación de la proteína p53, proteína que es un importante represor o controlador del crecimiento y diferenciación celular en parte por estimulación de las proteínas p21 y p16,52-54 y la proteína E7 parece impedir la regulación del crecimiento celular mediante una unión competitiva con la ciclina A1, la proteína p107 y con la proteína del retinoblastoma (pRb), que regulan la progresión de las células desde la fase G1 a la fase S.52 Esto causa una importante pérdida del control de la proliferación celular y da como resultado una proliferación no controlada. En neoplasias malignas, como el melanoma, o el linfoma cutáneo de células de tipo micosis fungoides que no contienen VPH se han encontrado mutaciones puntuales en la p53 y en el gen Rb.53
Factores adicionales asociados a CACU
La secuencia de los eventos anteriormente descritos es insuficiente para explicar los escasos casos en los que el genoma del VPH no se encuentra integrado al genoma celular y seguramente tiene relación con otros factores de riesgo como el tabaquismo, otros virus, mutaciones genéticas al azar, entre otros. Estos factores actúan como inductores de inestabilidad cromosómica con desarrollo de aneuploidia en el sitio específico en el que el VPH se integra al genoma, con pérdida de los signos que regulan la expresión de E6/E7. Por otra parte las células basales derivadas de la sobreexpresión de E6/E7 tienen mayor predisposición a la adquisición de errores genéticos adicionales, como las mutaciones puntuales. Probablemente los mutágenos externos o la predisposición genética del huésped promueven el desarrollo de un fenotipo maligno.20
La inmunología también contribuye para explicar el carcinoma de cérvix como un proceso multifactorial. Una supresión inmunológica selectiva permite el desarrollo de neoplasias, tanto por predisposición a la infección con virus oncogénicos como por el escape de las células neoplásicas a los mecanismos reguladores del huésped. Esto queda demostrado por la evidencia epidemiológica de que la infección crónica por VPH es más frecuente en individuos inmunosuprimidos y que los condilomas que desarrollan tienden a ser más grandes, multicéntricos y refractarios a tratamiento.55 Por otra parte, ciertos agentes terapéuticos como la azatioprina, los corticoesteroides y los agentes alquilantes potencian aún más el compromiso del sistema inmune. Al respecto se ha visto que las pacientes con trasplante renal tienen un incremento en el riesgo relativo para desarrollar cáncer de cérvix (5.4 veces más que la población general). Estudios publicados en pacientes con SIDA han demostrado un aumento en la frecuencia de lesiones intraepiteliales; Sun y colaboradores en un estudio realizado en Nueva York, encontraron que 56% de las pacientes seropositivas para VIH tenían infección por VPH, contra 31% de las seronegativas, con una prevalencia acumulada de 83% y 62% respectivamente, por otra parte la persistencia de las lesiones intraepiteliales fue de 24% en el primer grupo y de 4% en el segundo.56 El tipo de VPH asociado con mayor frecuencia, fue el 16. En una población de pacientes con artritis reumatoide (AR) también se corroboró esta asociación, tal como lo revela el estudio de Flores y colaboradores,57 realizado en el Hospital Universitario Dr. José Eleuterio González, quienes demostraron que las pacientes con artritis reumatoide (AR) tenían mayor frecuencia en la infección por VPH, en comparación con población pareada sin AR (48% vs. 22% en población sana). En la población con AR, los tipos de VPH prevalentes fueron el 59 y 83.57
Por otra parte, Delmas y colaboradores demostraron que la prevalencia y la incidencia de lesiones intraepiteliales en las pacientes con VIH es dos veces mayor en las pacientes que tenían cuentas de linfocitos CD4+ menores a 2 x 108 y que además no respondían al tratamiento cuando no habían sido tratadas previamente con antiretrovirales.58,59
En 1988 se implementó el Sistema Bethesda, el cual se utiliza para clasificar las diversas características reportadas en la citología del cérvix uterino. Esta clasificación ubica las lesiones intraepiteliales del cérvix uterino: lesiones de bajo grado y de alto grado, según su riesgo para el desarrollo de carcinoma invasor del cérvix; de esto se considera que desde el punto de vista morfológico, la mayor importancia radica en identificar las lesiones mediante los criterios establecidos, como bajo grado (displasia leve y condiloma), y alto grado (displasia moderada, severa y carcinoma in situ) y que no existe evidencia justificada para intentar clasificar las lesiones en todo el espectro de las displasias.60
Por otra parte es importante interrelacionar cambios morfológicos que ocurren en el epitelio y que observamos con microscopía convencional con los cambios moleculares que han sufrido las células infectadas, ejemplo de esto son:
Crecimiento nuclear e hipercromasia como resultado directo de la síntesis del ADN del huésped, mediada por la activación de los genes virales E6/E7.
Aumento en la relación núcleo-citoplasma a causa de una síntesis anormal del ADN del huésped mediada por E6/E7.
Halos perinucleares producidos por una forma anormal de citoqueratina regulada por la expresión del gen E4 del VPH.
El proceso de la integración y expresión de los oncogenes virales puede darse también en forma incompleta, entonces las células provenientes de la superficie tendrían un crecimiento nuclear menos importante y que pueden ser el equivalente de las células escamosas atípicas de significado no determinado, denominadas como ASCUS por sus siglas en inglés. Por lo contrario, si el proceso se desarrolla en forma completa, las células del epitelio escamoso son identificadas morfológicamente como lesión de bajo grado.20 A pesar de que los citopatólogos diferencian morfológicamente la lesión por VPH de la displasia leve, esto sólo representa una variación temporal dentro del ciclo de vida de las lesiones de bajo grado.
El modelo de neoplasia cervical escamosa no explica del todo la secuencia de eventos de las neoplasias glandulares y neuroendocrinas dentro del epitelio, ya que las células de reserva destinadas a una diferenciación glandular pierden el ambiente apropiado para la diferenciación escamosa y no pueden producir viriones y el ciclo de vida del virus requiere de dicha diferenciación; la infección viral en células destinadas a la diferenciación glandular debe sufrir un proceso abortivo o ser latente en células endocervicales morfológicamente normales, ya que estas células no son permisivas para la replicación viral.61 Esto podría explicar en parte que las lesiones glandulares sean menos frecuentes que las escamosas. El VPH 18 parece tener más éxito en inducir cambios glandulares que otros tipos de VPH, probablemente porque tiene mayor facilidad para integrarse en el genoma humano y también porque parece tener mayor predisposición a integrarse a células que van a diferenciarse hacia otro tipo de epitelio.59,60,62,63
Según Riethdorf la proteína p16, que normalmente funciona como un supresor tumoral asociado a la quinasa dependiente de ciclina, se encuentra aumentada en las lesiones glandulares y escamosas malignas o premalignas y no en las lesiones glandulares benignas, por una relación con la producción de las oncoproteínas virales E6/ E7 del VPH 16, de tal manera que la proteína p16 pudiera ser utilizada como un marcador en las técnicas de inmunohistoquímica para diferenciar lesiones glandulares malignas de lesiones glandulares que semejan esta lesión como la metaplasia tubárica, la hiperplasia microglandular y la endometriosis.64
Diagnóstico de la infección por VPH por medio de la tecnología del ADN
Las características histológicas sugestivas de infección por VPH son un predictor extremadamente pobre de la detección de ADN.65
Los miembros de la familia VPH no se pueden cultivar in vitro; por lo tanto la detección de VPH depende estrictamente de análisis moleculares de la secuencia de ADN del virus.66 Las pruebas para el diagnóstico de VPH de alto riesgo se han propuesto como métodos de estratificación de mujeres con anormalidades de leve a limítrofe hallados en los frotis de Papanicolaou en programas de tamizaje convencionales67,68 y como suplemento o posible reemplazo de la citología como prueba primaria de tamizaje.68,69
Existen varias técnicas moleculares suficientemente sensibles y confiables para la detección del VPH, tales como la hibridación in situ, que implica el empleo de sondas para detectar secuencias específicas de ADN,70 además de la visualización de los núcleos teñidos infectados por el VPH, bajo visión microscópica. Desafortunadamente, este último método es relativamente inexacto y ha sido superado por métodos biológicos moleculares, tales como la reacción en cadena de la polimerasa, el Southern Blot y la captura de híbridos.71
Metodología de las pruebas de detección de VPH
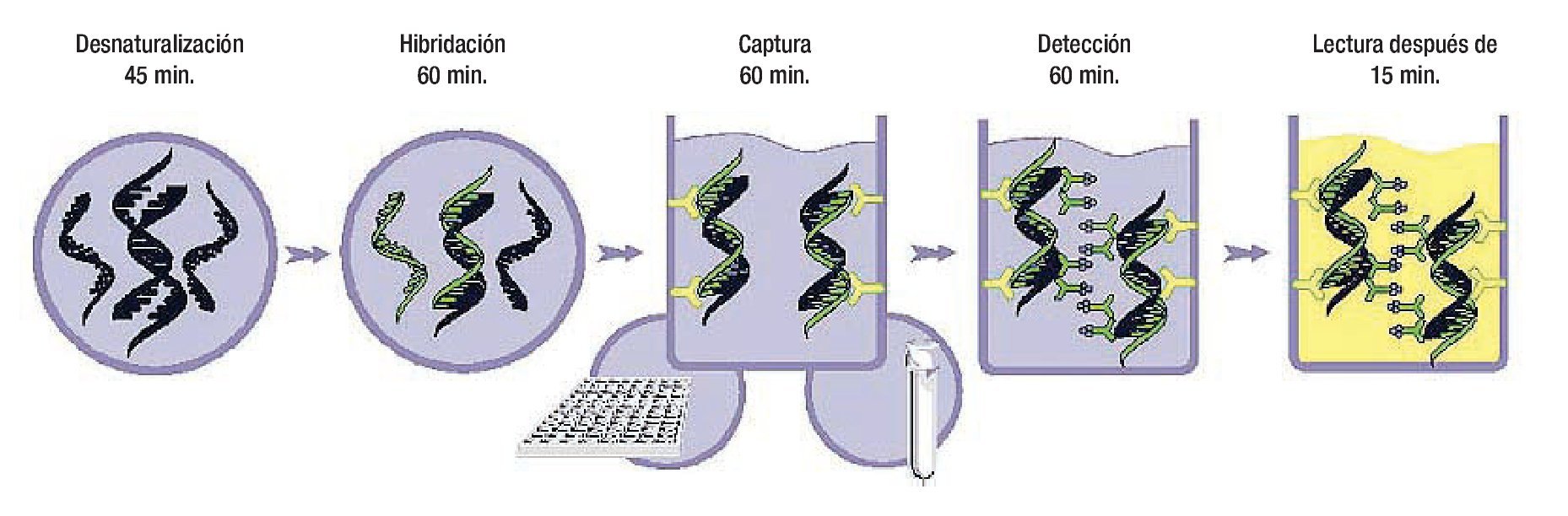
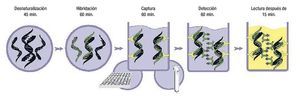
Hay esencialmente tres tipos de métodos de hibridación de ácidos nucléicos usados para detectar el VPH: las sondas directas de ácidos nucléicos (Southern Blot), métodos de amplificación de blanco (reacción en cadena de la polimerasa) y la amplificación de la señal de hibridación (Captura de híbridos). Tales métodos diagnósticos se explican detalladamente en otras obras.69-78 La captura de híbridos (Figura 1) es un método altamente específico para el diagnóstico de infección por VPH tanto de alto como de bajo riesgo, y ha sido utilizado como método de tamizaje en poblaciones de bajo y alto riesgo, además como método de control en estudios de vacunas contra la infección del VPH.79-83
Figura 1. Fases de la Captura de Híbridos 2. De izquierda a derecha: Desnaturalización del ADN, Hibridación, Captura, y Amplificación del ADN.
En nuestro medio se han puesto en práctica métodos como la PCR con el fin de determinar la prevalencia de infección por VPH de bajo y alto riesgo en diversas poblaciones. Ramírez Aguilera y colaboradores informaron que la prevalencia de infección por VPH fue de 4.39%, en un grupo de pacientes clínicamente sanas y con resultado de citología cervical normal. En el subgrupo de pacientes positivas, se encontró que en 0.55% el tipo de VPH detectado fue 58 y 0.55% fue tipo 66, los cuales son tipos virales de alto riesgo.84
Conclusiones
El virus de papiloma humano tiene un tropismo por los epitelios y algunos tipos son potencialmente carcinogénicos. La infección por el virus del papiloma humano, es un importante problema de salud pública en nuestro país, para el cual se ha identificado a la población con claros factores de riesgo hacia quienes se dirigen todos los esfuerzos de prevención y diagnóstico temprano. Sin embargo, existe una gran cantidad de mujeres, la mayoría de ellas asintomáticas, que al no reconocerse en riesgo quedan desprotegidas de los programas preventivos. Es necesario intensificar las campañas de educación y los estudios de tamizaje en estos grupos de pacientes de aparente bajo riesgo, con el fin de hacer diagnósticos tempranos, tratamientos menos agresivos y más efectivos.
Correspondencia: Dr. David de la Fuente Villarreal.
Av. Madero y Dr. Aguirre Pequeño s/n, Col. Mitras Centro, Monterrey, N.L. México. C.P. 64460.
Teléfono: (+52 81) 8347 7790.
Correo electrónico:drdelafuentev@gmail.com
Recibido: marzo, 2010.
Aceptado: septiembre, 2010