La leucemia granulocítica crónica (LGC) es muy poco frecuente en la edad pediátrica, representa menos del 4% de los casos de leucemia en niños. Se produce por un translocación entre los cromosomas 9 y 22, formando el gen de fusión BCR-ABL. El tratamiento actual se basa en el uso en inhibidores de tirosin-quinasa (ITK), inicialmente con la administración de imatinib. Sin embargo, en los pacientes que no responden a éste, se sugiere utilizar un inhibidor de segunda línea como el dasatinib y/o el nilotinib. Presentamos el caso de una paciente pediátrica con LGC, que mostró una excelente respuesta al uso de dasatinib, después de una respuesta poco favorable a imatinib. Actualmente se encuentra con respuesta molecular completa, y sin efectos adversos al dasatinib.
Chronic granulocytic leukemia (CML) is very rare in children, less than 4% of cases of leukemia in children. It is caused by a translocation between chromosomes nine and 22 forming the fusion gene BCR-ABL. Current treatment is based on the use of tyro-sine kinase inhibitors (TKIs), initially with the administration of imatinib, however in patients who do not respond to it, is suggested to use an inhibitor such as second-line dasatinib and / or the nilotinib. We report a pediatric patient with CML showed an excellent response to the use of dasatinib after an unfavorable response to encounters imatinib. Currently meets complete molecular response and no adverse effects to dasatinib.
Introducción
La leucemia granulocítica crónica (LGC) afecta de una a dos personas por cada 100 000, principalmente adultos, siendo responsable del 7% a 20% de los casos de leucemia. En niños es poco frecuente, representando menos de 4% de todos los casos de leucemia, lo que equivale a 1.7 casos por cada millón en menores de 20 años.1,2 Es aún más rara en menores de cuatro años, con sólo dos casos publicados en la literatura médica.
La LGC es un proceso mieloproliferativo clonal de la célula madre pluripotencial, que provoca una producción excesiva de granulocitos y elevación en sangre periférica de las células de la serie mieloide en distintos grados de maduración, no parece haber predisposición étnica o genética.3
Se caracteriza por la translocación 9;22, que se expresa como t(9;22)(q34;q11),4 esto significa que una sección del cromosoma 9 y una sección del cromosoma 22, se rompe e intercambian lugares formándose así el gen de fusión BCR-ABL, dicha translocación recibe el nombre de cromosoma Filadelfia, recordando a la ciudad donde fue descrito.
La activación de múltiples vías de señales de transducción en las células con el gen BCR-ABL favorece el incremento de la proliferación celular, interfiere en la apoptosis y perturba la interacción con la matriz extracelular y el estroma. Por lo cual, dicho gen resulta responsable de la patogénesis de la enfermedad, por otro lado, la actividad de la enzima tirosin-quinasa constitutivamente activada es esencial en la capacidad de transformación hematopoyética.5
Esta enfermedad básicamente se caracteriza por tres fases: crónica, acelerada y blástica. El tratamiento convencional mejora la calidad de vida de los pacientes, sin embargo el trasplante de precursores hematopoyéticos se considera la única modalidad terapéutica con potencial curativo de la enfermedad, esto para quienes cuenten con un familiar HLA compatible. La sobrevida global con el trasplante de precursores hematopoyéticos, previo a la era de los inhibidores, varía entre el 65% a 85%.6-8
El tratamiento de elección tanto para niños como para adultos, cuando un trasplante no puede ser realizado, se basa en el uso de inhibidores de la tirosin-quinasa (ITK). El imatinib es utilizado como medicamento de primera línea, el dasatinib y el nilotinib se recomiendan en pacientes que no responden al imatinib o muestran toxicidad a este medicamento.
Presentamos el caso de una niña con diagnóstico de LGC que respondió favorablemente al dasatinib como tratamiento de segunda línea, actualmente se encuentra con repuesta molecular completa, y sin efectos adversos.
Presentación del caso
Paciente femenina de seis años de edad, con antecedente de artritis séptica de cadera y rodilla izquierda al año de edad. Es admitida al Hospital Universitario "Dr. José Eleuterio González", Monterrey, N.L., México, en julio del 2008, por presentar dolor de rodilla izquierda de tres semanas de evolución, sin presentar mejoría con tratamiento a base de antiinflamatorios indicados por el médico de primer contacto. A la exploración física, se presentaba afebril, y con dolor a la palpación de muslo y rodilla izquierda, con alteración de la marcha y acortamiento de miembro inferior izquierda de 4 cm. Los estudios de laboratorio mostraron una hemoglobina de 9.8g/dL, plaquetas de 325x109/L y leucocitos de 205 x 109/uL con 56% de segmentados, 18% bandas, 14% linfocitos, 2% mielocitos y 4% de mieloblastos. Se inicia tratamiento con hidroxiurea a 50 mg/Kg/día, aumentándose a 75 mg/Kg/día después del tercer día. Se realizó la determinación de BCR-ABL por FISH, encontrando 68.5% de núcleos positivos para la translocación con lo que se estableció el diagnóstico de LGC. Al cuarto día de estancia hospitalaria se inicia tratamiento con imatinib 100 mg diarios aumentándose durante el primer mes a 300 mg (600 mg/m2/día). Presentó respuesta hematológica completa al mes del diagnóstico y molecular mayor hasta los 11 meses. La paciente continuaba con la presencia del gen anormal con un resultado de PCR en tiempo real con 1.5% y 1% en marzo y junio del 2009, respectivamente, por lo que se decide incrementar la dosis de imatinib a 400 mg por día. En junio del 2010 se descontinúa imatinib y se inicia dasatinib a la dosis de 85 mg/ m2/día, obteniendo una disminución del gen anormal determinado por PCR en tiempo real de 0.062%, a los seis meses de iniciada su administración en diciembre 2010 (Figura 1). Posteriormente, a los 11 meses de inicio de dasatinib, presentó respuesta molecular completa (Figura 2). Actualmente continúa con respuesta completa, y sin presentar efectos secundarios.
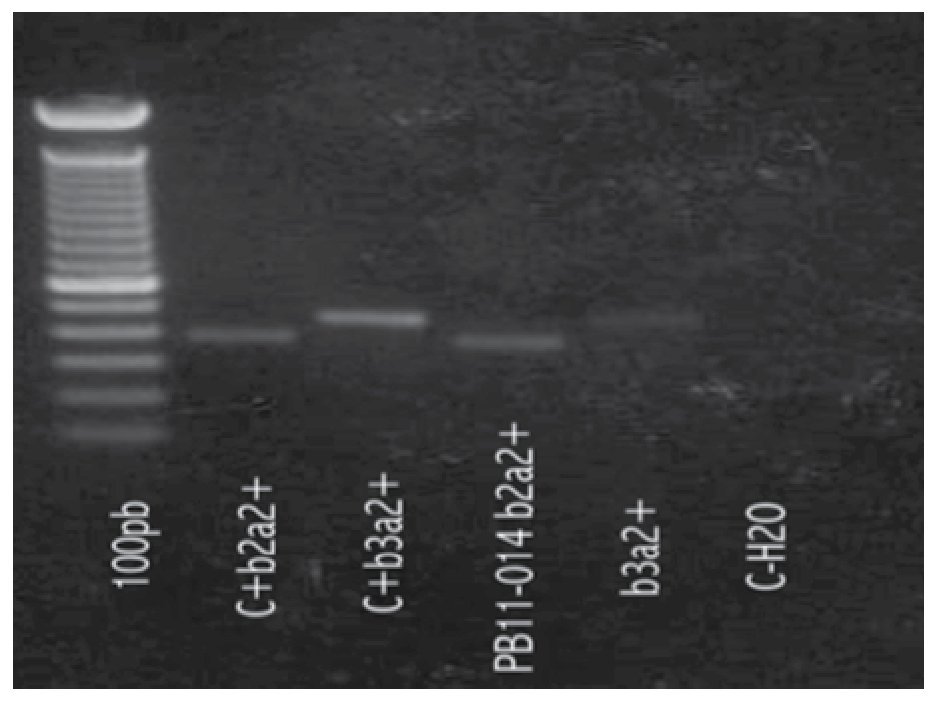
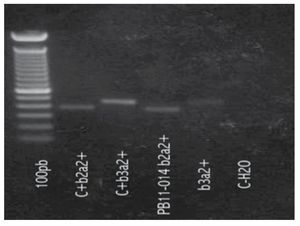
Figura 1. Se realiza estudio molecular del gen de fusión BCR/ABL de la t(9;22) en RNA extraído de muestra de sangre periférica. Las reacciones de amplificación fueron positivas en 0.062% de copias del gen de fusión.
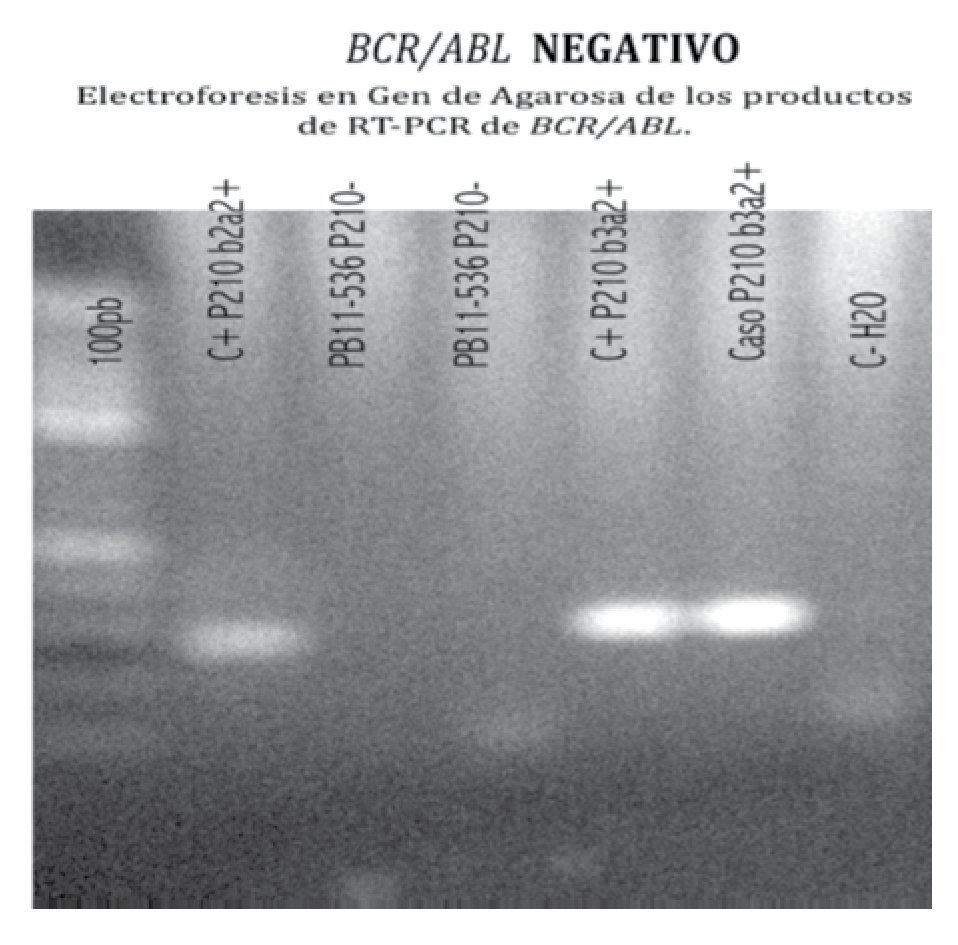
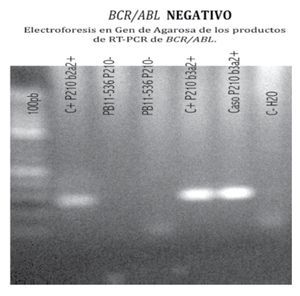
Figura 2. Estudio molecular del gen de fusión BCR/ABL de la t(9;22) en RNA extraído de muestra de sangre periférica. Transformado a ADN copia y amplificado por RT-PCR múltiple, anidado y en tiempo real; por duplicado. Las reacciones de amplificación fueron negativas para los transcritos b2a2 y b3a2 de P210BCR/ABL.
Discusión
Las opciones que actualmente existen para tratar a los pacientes con LGC incluyen al alotrasplante, ITK, hidroxiurea, interferon a y busulfán. En países desarrollados se ha disminuido la necesidad del trasplante, y por lo tanto sus comorbilidades. Esto como resultado de la utilización de medicamentos como imatinib, con el cual se han obtenido respuestas citogenéticas de hasta el 80%, y sobrevida del 90%. Otros inhibidores como dasatinib y nilotinib son más potentes, y tienden a sustituir al imatinib. Sin embargo, en países en vías de desarrollo como el nuestro, todavía no se obtiene la modalidad que se presenta en otros países, ya que el costo de los diferentes inhibidores, sobrepasa el costo actual del trasplante con el "método mexicano",9 que es de 18 000 dólares.10 Este se basa en un régimen de acondicionamiento no-ablativo y ambulatorio, que si se compara con la dosis diaria de 400 mg de imatinib, cubriríamos con ese dinero, los primeros 200 días de tratamiento solamente.
Nuestro caso plantea un reto en el manejo y toma de decisiones, ya que por un lado existe evidencia al menos en adultos, de que los ITK de segunda generación como el dasatinib, constituyen una opción de tratamiento que incluso puede ser considerada como terapia de primer línea.11,12 En nuestro paciente se consideró inicialmente al trasplante, como la primera opción de tratamiento, en vista de ser éste la única terapia potencialmente curativa.10,13 Sin embargo, al no contar con un donador compatible, tomamos la decisión de iniciar manejo con imatinib y posteriormente con dasatinib, como ya fue comentado. Por otra parte, no existen datos suficientes para sostener la utilización del dasatinib en niños como primera opción, tampoco está definido cuando debe ser el momento para suspenderlo. Entre los efectos secundarios del dasatinb, se refiere una asociación entre dasatinib y el riesgo de derrame pleural, con el nilotinib existe el riesgo de prolongación del segmento QT y de muerte súbita. Por otro lado, Shima y colaboradores observaron un retraso en el crecimiento en los pacientes prepuberales, hasta en el 73% con el uso de imatinib.13-17 En nuestro paciente no ocurrieron hasta el momento efectos indeseables con ninguno de los dos ITK utilizados, sin embargo, aún se debe continuar la vigilancia de su aparición por más tiempo.
Actualmente, nuestra paciente continúa en tratamiento con la dosis de dasatinib de 85 mg/m2/día.13 Ella continua en control en nuestra consulta sin problemas clínicos relevantes, vigilando la aparición de efectos adversos y en espera de definir el momento de suspensión del medicamento. Esto basado en la posibilidad de una curación definitiva, o en su defecto, explorar la posibilidad de un trasplante con células de cordón o con un donador haploidéntico.
Recibido: Febrero 2012. Aceptado: Mayo 2012
Correspondencia:
Dra. Iliana Aracely Hernández Juárez.
Av. Madero y Gonzalitos S/N, Colonia Mitras Centro,
C.P. 64460. Monterrey, N.L., México.
Teléfono: 8333 8111, 8333 8112.
Correo electrónico: iliar_740@hotmail.com.