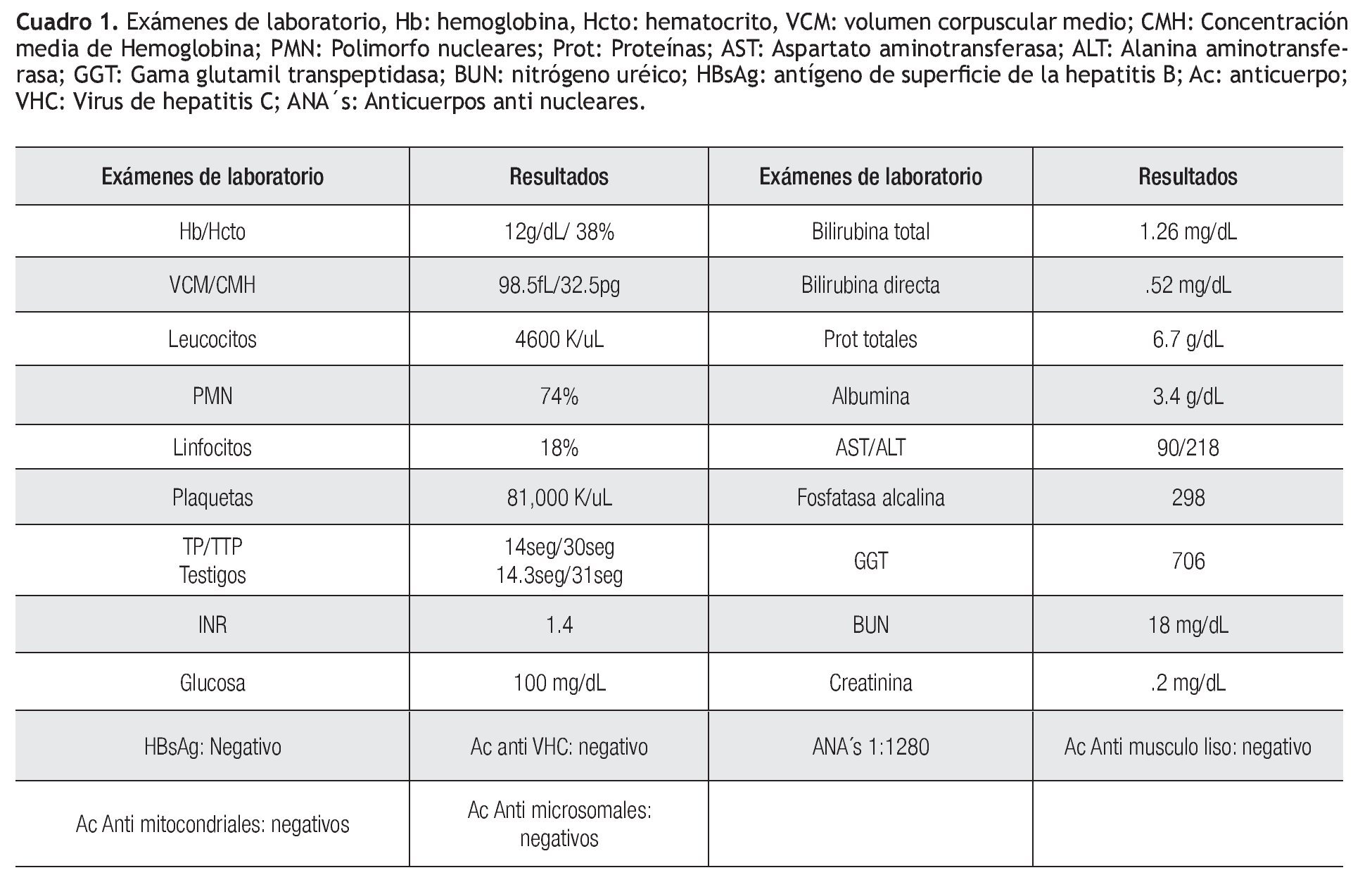
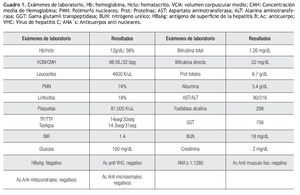
Se trata de una mujer de 45 años de edad, sin antecedentes de importancia. Acude a la consulta de gastroenterología referida del servicio de hematología donde era evaluada por síndrome anémico: astenia, adinamia, palidez de tegumentos, de un año de evolución; en su primera consulta la paciente presentaba a la exploración física esplenomegalia y los siguientes resultados de laboratorio: anemia normocítica, normocrómica; pruebas de funcionamiento hepático(PFH) con transaminasas cuatro veces por arriba de lo normal e hiperglobulinemia (Cuadro 1). Además, ecografía abdominal con datos de hipertensión portal (ascitis y esplenomegalia).
Dr. Herrera: ¿Cuál sería su abordaje para investigar la causa de la anemia de esta paciente?
Dr. Herrera: En el abordaje de los pacientes que cursan con anemia y hepatopatía crónica, la investigación se debe enfocar, de acuerdo a su patogénesis en: producción inadecuada eritrocitaria, perdidas eritocitaria por hemorragia, hemólisis y por último secuestro esplénico (hiperesplenismo). Se debe tener siempre en mente el abordaje general de las anemias, este puede ser: morfológico; esta clasificación se establece de acuerdo al volumen corpuscular medio (VCM) y a la concentración media de hemoglobina (HCM) y las divide en: microcítica hipocrómica, normocítica normocrómica, macrocítica. Otro parámetro que es de utilidad para diferenciar la causa de anemia es valorar la respuesta de la médula ósea a la misma, la respuesta las clasifica en regenerativas y arregenerativas. El abordaje de la anemia normocítica, normocrómica se debe hacer con base en los índices de producción de reticulocitos (IPR), lo cual apoya el ejercicio de clasificar las anemias en dos grandes grupos: a) IPR altos: comprende las anemia por perdidas crónicas de sangre y las anemias hemolíticas; b) IPR bajos o normales; en los que la realización de aspirado de medula ósea es el pilar para distinguir entre las posibles causas; en este grupo se dividen en: aspirado de medula ósea (AMO) normal, asociados con la anemia por enfermedad crónica o deficiencia vitamínica (folatos, cobalamina) y AMO hipo celular; asociados con anemia aplásica y síndromes mielodisplásicos.1
Dr. Herrera: En este caso en particular la paciente cursa con una bicitopenia (anemia normocítica normocrómica y trombocitopenia), la cual puede tener un origen multifactorial, sin embargo la enfermedad crónica es mi primer diagnostico y esta misma se puede explicar desde cuatro puntos de vista en el contexto de este tipo de pacientes: a)acortamiento de la vida media de eritrocito, b)perdida de la capacidad de eritropoyesis eficaz por la medula ósea, c)presencia de un aporte deficiente de hierro a la medula ósea, d)baja producción y poca respuesta a la eritropoyetina a nivel medular. La segunda posibilidad que esta contribuyendo con la sintomatología de la pacientes es la debida a la hipertensión portal (anemia por hiperesplenismo) que se asocia con trombocitopenia y algunas veces puede cursar con pancitopenia.
En las consultas subsecuentes en nuestro servicio, se descartaron las causas virales mediante la realización de anticuerpos para antígeno de superficie de hepatitis B y anticuerpos anti-hepatitis C, además se le solicitó una ecografía Doppler hepática, que informó: porta y venas supra-hepáticas permeables, con lo que las causas vasculares se descartaron. Se solicitaron estudios inmunológicos por la alta sospecha del involucro autoinmune en la patogénesis de la hepatopatía de la paciente, con los siguientes resultados: anticuerpos antinucleares (ANA`s) por Hep2 positivos, con titulo de 1:1280, anticuerpos anti mitocondriales (AAM), anti músculo liso (AML) y anti microsomales negativos.
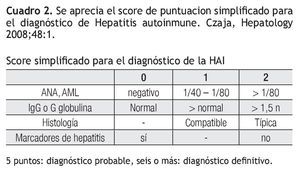
Dr. Maldonado-Garza: ¿Cómo se realiza el diagnóstico de hepatitis autoinmune (HAI) y qué criterios aplica usted?
Dr. Maldonado: El diagnóstico de hepatitis autoinmune se establece por la exclusión de otras enfermedades crónicas del hígado. Se ha clasificado en tres tipos, según los criterios internacionales simplificados de HAI, los cuales son divididos con base en la presencia de la elevación de alanino-aminotransferasa (ALT), hiper-gammaglobulinemia, ANA´s, AML, AAM, Anti Liver Kidney (ALK) y anti microsomales, como se muestra en la Cuadro 2. De acuerdo con el puntaje resultante, se puede establecer diagnostico como: probable, definitivo o se excluye.2 Por orden de prevalencia, la HAI tipo I es la más frecuente y posee ciertas características clínicas que la hace diferente a los demás tipos. Se presentan en 78% de los casos en género femenino, la incidencia de esta patología tiene dos picos: en la infancia y en la edad adulta; los anticuerpos que se asocian en la mayor parte de las veces son ANA´s o AML. Estos últimos son los más específicos para la enfermedad, además de estar acompañado en casi la mitad de la veces por otra patología autoinmune (CUCI y tiroiditis autoinmune).
Dr. Maldonado: En el caso de nuestra paciente, según los criterios internacionales simplificados, se obtienen seis puntos; haciendo un diagnostico definitivo, y según la serología con ANA´s positivos, el ser mujer y estar en este rango de edad, la clasifica con hepatitis autoinmune tipo I.
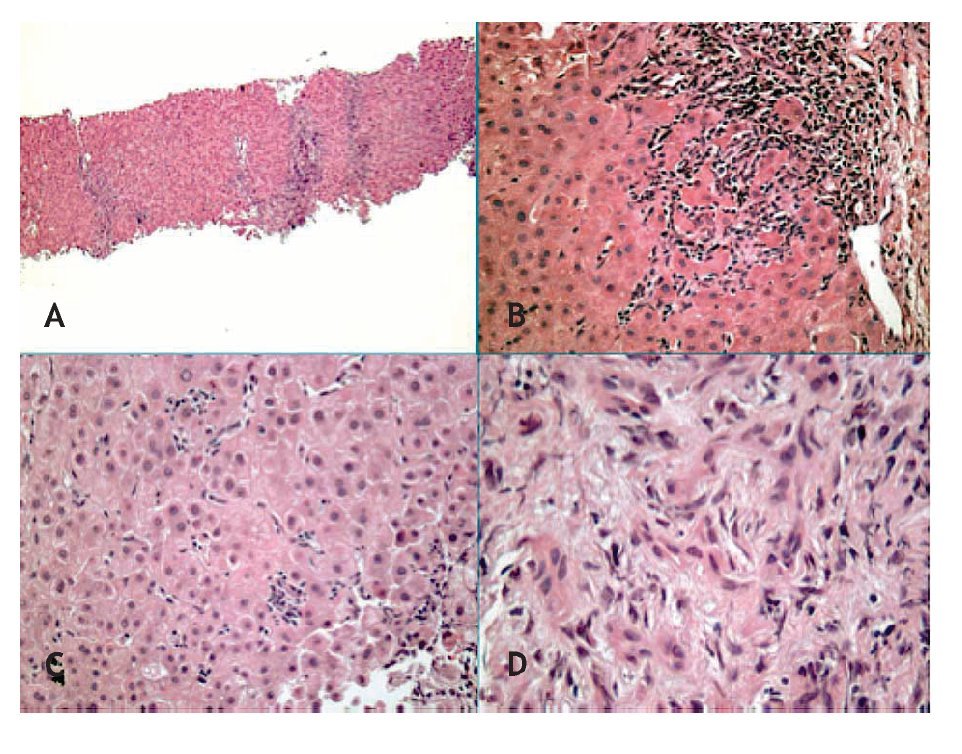
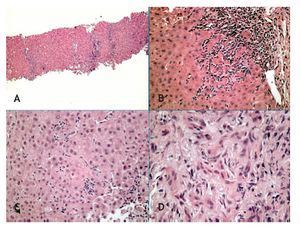
A la paciente se le realizó una biopsia hepática vía transyugular, como se observa en la Figura 1.
Figura 1. Tinción en HYE. A) 50 aumentos. Microfotografía Panorámica de biopsia hepática transyugular con presencia de septos fibroso. B) 200 aumentos. Hepatitis de interfase, caracterizada por infiltrado linfocítico portal con afección a la placa limitante de hepatocitos. C) 200 aumentos. Focos microscópicos de Hepatitis lobular. D) 400 aumentos. Proliferación de conductillos entre el estroma de la triada porta. Cortesia Dra. Gabriela Alarcon Galván. Servicio de Anatomía patológica. Hospital Universitario Dr. José E. González.
Dra. Alarcón: ¿Cómo se interpretan los resultados de esta biopsia y cuál es la utilidad de la misma en el diagnóstico de HAI?
Dra. Alarcón: La utilidad de la biopsia hepática en lesiones no neoplásicas se centra en cinco puntos básicos: a) permite el confirmación (no el diagnóstico) de la etiología sospechada; b) la graduación (en una escala numérica) de la actividad inflamatoria y del estadio de fibrosis en el que se encuentra; c) descarta o reconoce otras etiologías evidentes al examen microscópico como la hemocromatosis, deficiencia de β-1antitripsina, Wilson; d) la coexistencia de otra enfermedad hepática, (cirrosis biliar primaria, colangitis esclerosante) como síndromes de sobre-posición e)el monitoreo de la respuesta terapéutica.
Conocer la indicación y sustentación de la biopsia, es de suma importancia para la elaboración de un reporte adecuado. Contar con la información clínica, los resultados de laboratorio y el diagnóstico clínico mejorará el análisis y la comprensión de la misma. En este paciente se encontraron hallazgos histológicos compatibles con una hepatitis autoinmune. ¿Qué significa esto? De acuerdo con los criterios diagnósticos simplificados establecidos por el grupo internacional de la HAI en el 2008,3 las categorías histológicas se dividen en típica, atípica y compatible. La imagen histológica típica es cuando se localiza hepatitis de interfase, emperipolesis y formación de rosetas; deben estar presentes los tres parámetros juntos y evidentes;4 la imagen compatible corresponde a una hepatitis crónica con infiltración linfocítica que podría corresponder a hepatitis autoinmune o a cualquier otra etiología y la atípica cuando sugiere otra enfermedad, como siderosis, granulomas, esteatohepatitis, depósitos de cobre. Proveer una escala numérica de evaluación dentro del reporte patológico también es de utilidad para el médico tratante, ya que traduce la imagen observada por el patólogo en una idea objetiva del estado de la enfermedad. Los dos sistemas de evaluación más utilizados para este fin son el sistema francés Metavir5 y el sistema americano de Is-hack;6,7 éstos pueden ser utilizados en cualquier caso de hepatitis crónica y no son exclusivos de la hepatitis autoinmune. Ambos sistemas otorgan una estimación del grado de actividad o inflamación, (Metavir 0 a 3 puntos y Ishack 0 a 18 puntos) y de cronicidad o fibrosis (Metavir 0 a 4 puntos e Ishack 0 a 6 puntos). El mayor puntaje de fibrosis corresponde al estadio final de la enfermedad hepática: la cirrosis. Otros hallazgos típicamente descritos para la hepatitis autoinmune son la presencia de abundantes células plasmáticas, observadas en 66% de los pacientes, degeneración globoide y cuerpos apoptóticos en 39% de los pacientes.7-9 En los casos de curso clínico agresivo, se observa hepatitis panlobular y necrosis en puente; incluso necrosis masiva.10,11 A pesar de que la colangitis puede observarse en 8% de los casos de hepatitis autoinmune, generalmente se asocia a otros diagnósticos o sugiere un síndrome de sobre-posición, lo cual es de suma importancia para el clínico, en función del pronóstico y la respuesta al tratamiento, ya que estos síndromes tienen un comportamiento más agresivo y una mayor resistencia al los tratamientos de primera línea en comparación con la HAI.12
Dra. Alarcón: Mi diagnóstico histopatológico es: Hepatitis de interfase leve, con proliferación de conductillos y septos fibrosos con puentes ocasionales. Escala de Ishack A:7 F:4. Escala de Metavir: A:2, F:3.
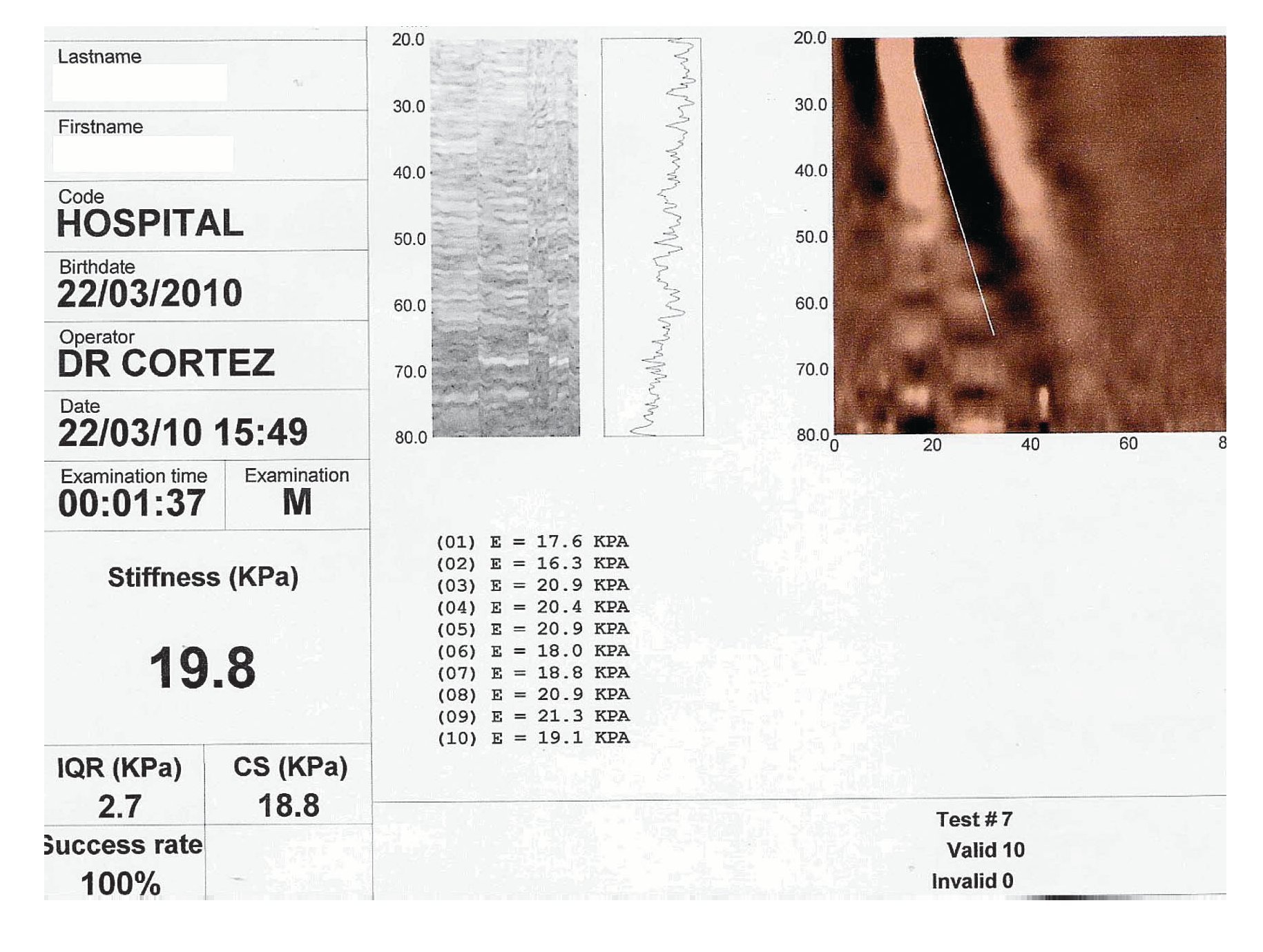
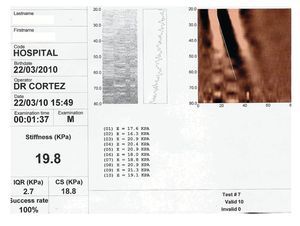
Como parte de la valoración de la hepatopatía crónica se realizó elastograma (Fibroscan) hepático como se observa en la Figura 2.
Figura 2. Los hallazgos encontrados mediante el estudio Fibroscan son compatibles con un etapa histológica en la escala de Metavir F4, obsérvese el valor en KPA; Kilopascales. Cortesía Dr. Carlos Cortez Hernández. Servicio de Gastroenterología. Hospital Universitario Dr. Jose E. González.
Dr. Cortez: ¿Cuál es la correlación de la elastografia transitoria y la biopsia hepática en el grado de fibrosis hepática en esta paciente?
Dr. Cortez: La elastografía transitoria (Fibroscan) es un método rápido y no invasivo para evaluar la fibrosis hepática a través de la rigidez hepática (RH). Las mediciones de RH se pueden realizarse sistemáticamente en más del 95% de los pacientes, pero es limitado en aquellos con obesidad severa y ascitis. RH se ha estudiado principalmente ha en pacientes con hepatitis viral, pero también enfermedad hepática alcohólica. La elastografía ha demostrado estar asociada con el grado de fibrosis hepática en todos estos pacientes, los valores de corte que se han definido para permitir el diagnóstico de fibrosis avanzada es de (F3/F4) según la escala histológica Metavir. A pesar de cierta variabilidad, los valores de corte de 8.0 y 12.5 KPa son ampliamente aceptados para identificar a pacientes con F3 y F4 fibrosis, respectivamente.13
Dr. Cortez: en nuestro paciente se obtuvo en ocho mediciones un promedio de 22.5 KPa, lo que correlaciona con el resultado de la biopsia, en un valor de F3 por la escala de Metavir, sin embargo la utilidad del Fibroscan sigue siendo limitada, ya que la biopsia hepática permite estimar adicionalmente el grado de actividad así como la posibilidad de algún diagnóstico alterno, lo que tiene implicaciones pronosticas y sobre la decisión del tratamiento. Por lo cual los resultados de Fibroscan en la actualidad se deber interpretar con reserva, siempre aunado de la buena historia clínica, estudios de laboratorio y considéralo como un estudio complementario a la biopsia hepática.
Una vez establecido el diagnostico de HAI, se decide iniciar la tratamiento farmacológico.
Dr. Villarreal Galván: ¿Cuál es la terapia farmacológica de primera elección para hepatitis autoinmune?
Dr. Villarreal: la decisión del inicio del tratamiento de HAI la podemos definir de acuerdo a los paramentos de laboratorio y a los hallazgos histopatológicos. El inicio de tratamiento se considera obligatorio para todos los pacientes en que los niveles séricos de (AST) o de alanina aminotransferasa (ALT) se reporten 10 veces por arriba del límite normal, o la presencia de la elevación en las transaminasas de cinco veces por arriba de lo normal, aunado con la elevación de la gammaglobulina dos veces del límite normal. Los criterios histopatológicos para el inicio del tratamiento médico son la presencia de necrosis y hepatitis de interfase marcada en la biopsia. La terapia estándar es a base de esteroides e inmunosupresores (azatioprina) siendo eficaz en más de 80%. Las otras opciones que se tienen como terapia de segunda línea son mofetilo micofenolato, tacrolimus y la ciclosporina, sin embargo su eficacia es variable y pocos estudios los avalan.14
Dr. Villarreal: Decidimos iniciar la terapia farmacológica con base en azatioprina, 75 mg al día, prednisona 40 mg al día, ya que nuestra paciente cumplió con los criterios para el inicio de tratamiento, el cual, tiene un buen rango de respuesta, induciendo remisión en 80% de los casos HAI tipo I.
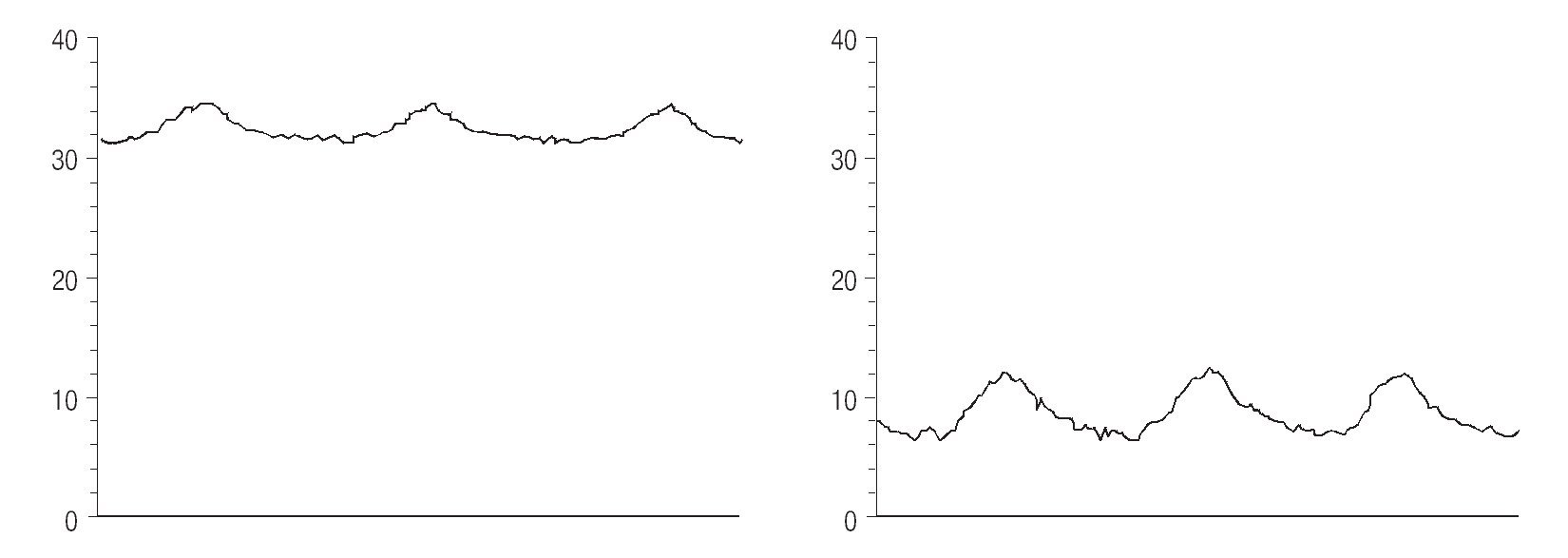
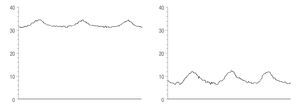
Durante la toma de biopsia por vía transyugular se realizo además un cateterismo hepático y se midió el gradiente de presión portal, como se observa en la (Figura 3)
Figura 3. Cateterismo hepático. En la gráfica superior se observa en la línea el valor de la presión en cuña con un valor de 30.5 mmHg, y en la gráfica inferior, se observa el valor de la presión no acuñada, en 8 mmHg, lo que da un valor de GPPH de 22.5 mmHg. Cortesia: Dr. Carlos Cortez Henández. Servicio de Gastroenterología. Hospital Universitario Dr. Jose E. González.
Dr. Cortez: ¿Cuál es la utilidad del gradiente de presión portal hepática (GPPH)?
Dr. Cortez: la medición del gradiente de presión portal hepática (GPPH), nos ayuda en el diagnostico de hipertensión portal en etapas tempranas, inclusive en ausencia de datos clínicos de las misma (varices, ascitis, esplenomegalia). El diagnostico de hipertensión portal se establece cuando el GPPH es mayor de 5 mmHg, pero es clínicamente significativa cuando el GPPH es mayor de 10 mm Hg siendo en este grupo de pacientes en los cuales se incrementa el riesgo de sangrado variceal, el cual es directamente proporcional al gradiente de presión. La mayor parte de los pacientes los cuales acuden con hemorragia digestiva de origen variceal al medirse GPPH dentro de las primeras 24 horas de su ingreso se obtiene gradientes por arriba 20 mm Hg lo cual es considerado un factor independiente de mal pronóstico a corto y largo plazo. La meta de la reducción de la presión portal es GPPH a un valor inferior a 12 mmHg o una reducción de más de 20% del valor de referencia del basal. Está reducción de gradiente se asocia con un disminución del riesgo de hemorragia y con una disminución en la morbi-mortalidad.15
Dr. Cortez: en nuestra paciente se obtuvo un GPVH de 19.1 mmHg, por lo cual se clasifica como de alto riesgo para el desarrollo de varices esofágicas, así como para presentar sangrado de tubo digestivo variceal; por lo ya mencionado, es de suma importancia la el uso de β-bloqueadores, los cuales pueden ayudar a reducir la presión portal y así alcanzar la meta GPVH de 12 mmHg o la disminución de 20% de la basal.
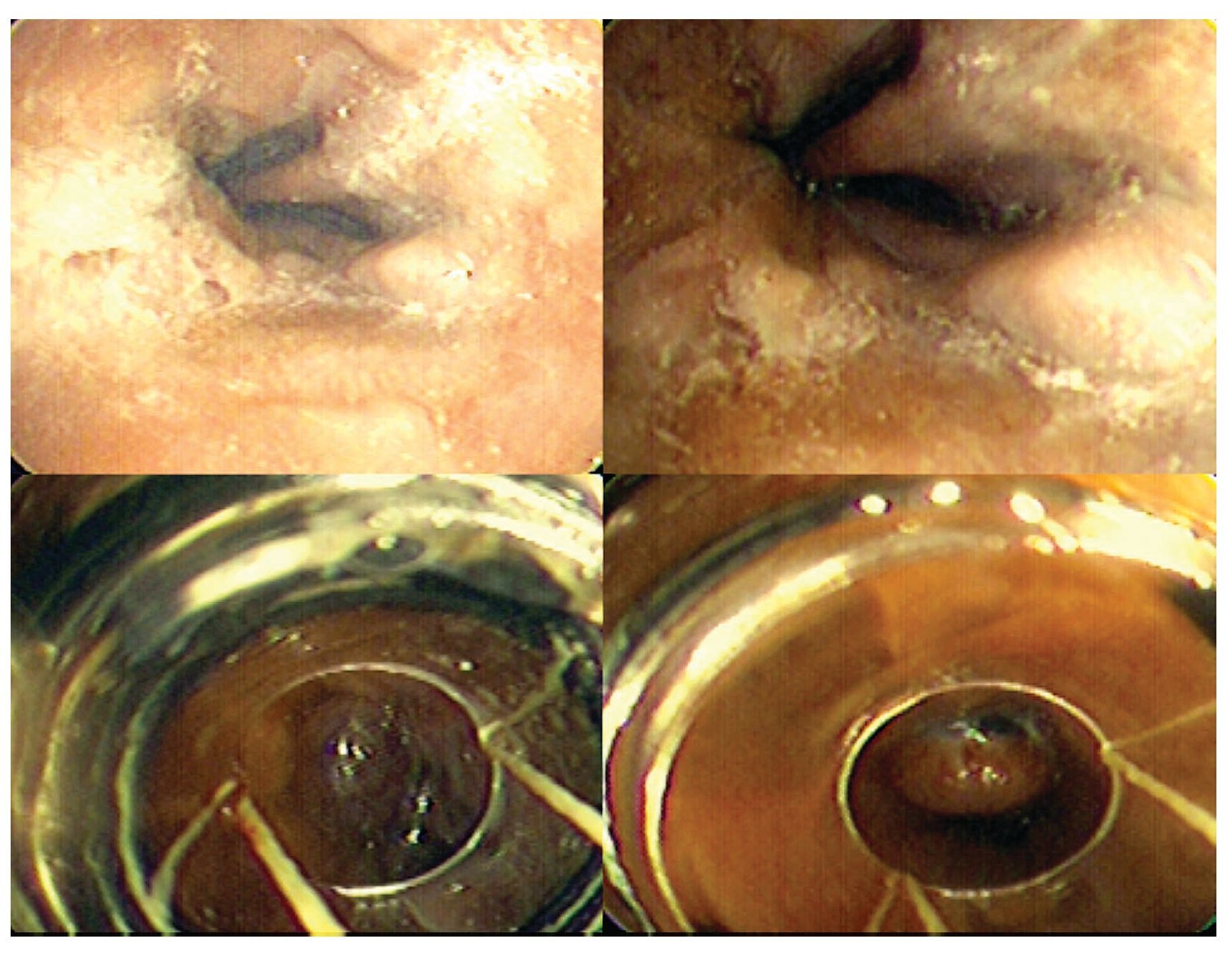
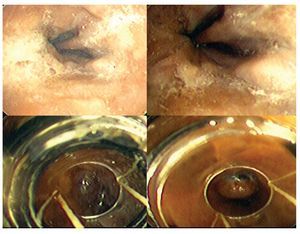
Durante el seguimiento ambulatorio de gastroenterología, se le realizó una endoscopia superior, encontrando varices esofágicas grandes, las cuales fueron ligadas. Varices esófago-gástricas tipo I de Sarín, así como gastropatía hipertensiva leve; como se observa en la Figura 4.
Figura 4. Endoscopia superior. Se aprecian las imágenes de las varices esofágicas grandes en las dos imagenes superiores y en las dos inferiores la colocación de bandas elásticas.
Dr. Martínez-Vázquez: ¿En este paciente cual es la mejor estrategia para prevenir el primer evento de sangrado variceal?
Dr. Martínez-Vázquez: La ruptura de varices esofágica es la causa de 70% de los episodios de sangrado de tubo digestivo de pacientes con hipertensión portal. Para la prevención del sangrado variceal se utilizan dos estrategias: farmacológica y endoscópica. El uso de β-bloquedores todavía se considera la terapia de elección para profilaxis de sangrado variceal; para el monitoreo del efecto del β-bloqueador se ha propuesto la medición de la presión portal. En pacientes con un GPPH de 10 mmHg, este es suficiente para el desarrollo de várices esofágicas o ascitis y de 12 mmHg como riesgo independiente de sangrado variceal. De la misma forma, en pacientes que se logra un descenso en el GPPH mayor de 20% el riesgo de sangrado variceal en los siguientes tres años, es menor de 10%. El β-bloquedor reduce el riesgo de primer sangrado de 25% a 15% en un periodo de dos años. En cuanto a la terapia endoscópica, la ligadura se ha convertido en la terapia de elección para varices esofágicas, porque oblitera más rápido y se asocia con menos efectos adversos que la escleroterapia. Actualmente es punto de discusión la comparación de ligadura variceal y β-bloqueo como profilaxis de primer episodio de sangrado, por lo que en lugares donde esté disponible la medición de presión portal es factible predecir quien responderá y quien no, dado que al utilizar beta-bloqueadores la frecuencia cardiaca no correlaciona con respuesta al tratamiento farmacológico, es decir disminución de la presión portal. Existe evidencia que sugiere que la ligadura es superior al beta-bloqueo previniendo el primer episodio de sangrado, pero no se traduce en mejoría de la sobrevida, además la ligadura se relaciona con sangrado iatrógeno, por lo que el β-bloquedor se considera la terapia de elección y se reserva la ligadura para los intolerantes o en quienes existe contraindicación para el fármaco.
Dr. Martínez-Vázquez: La prevención primaria de elección son los β-bloqueadores; sin embargo se puede utilizar la ligadura endoscópica en ciertas condiciones. En este caso, se inició con propranolol a 60 mg/día, la cual puede considerarse como una dosis baja; no obstante, la tolerancia fue inadecuada y con el antecedente de un GPPH de 22.5 mm/hg así como el hallazgo de varices grandes, decidimos realizar la ligadura como forma de profilaxis primaria de sangrado.
Correspondencia: Dr. Francisco Javier Bosques Padilla. Servicio de Gastroenterología, Departamento de Medicina Interna. Hospital Universitario Dr. José E. González. Gonzalitos y Madero S/N Edificio Barragán Segundo Piso. Teléfono: (81) 8333 3664.
Correo electrónico: fbosques58@hotmail.com
Recibido: Abril 2010.
Aceptado: Abril, 2010