La principal meta en el trasplante renal es lograr la mayor y mejor sobrevida del injerto y del paciente, en parte optimizando la tolerancia inmunológica del injerto. El rechazo agudo disminuye la sobrevida del injerto. El objetivo de esta revisión es realizar una aproximación clínica al diagnóstico de rechazo agudo, los principales cambios de la clasificación y sus alternativas terapéuticas.
El diagnóstico de daño renal agudo en el trasplante renal resulta un desafío, dada la variabilidad de la creatinina sérica relacionada con la titulación de fármacos inmunosupresores y el estado de volemia. La creatinina sérica es un marcador poco sensible y específico de rechazo agudo.
El diagnóstico de rechazo se realiza utilizando los criterios de Banff. Los criterios para el rechazo mediado por células T no ha tenido cambios significativos en los últimos 10 años. Sin embargo, la categoría de rechazo mediado por anticuerpos se modificó en 2013 agregando el rechazo mediado por anticuerpos C4d negativo. Para el diagnóstico de rechazo mediado por anticuerpos se requieren 3 pilares en forma concomitante: lesiones histológicas, evidencia de interacción anticuerpos-endotelio y anticuerpos donante específico.
La evidencia científica para el tratamiento del rechazo es escasa. El tratamiento del rechazo celular no ha cambiado en las últimas décadas y se realiza basándose en corticoides y/o timoglobulina. El tratamiento del rechazo mediado por anticuerpos se basa en la remoción de anticuerpos por inmunoadsorción o recambios plasmáticos terapéuticos, con gran variabilidad entre los grupos en cuanto a tratamientos complementarios (esteroides, gammaglobulina polivalente humana, bortezomib, rituximab o eculizumab) a fin de detener su producción.
The main aim of renal transplantation is to achieve the longest patient and graft survival, in part by optimising immunological tolerance of the graft. Acute rejection decreases graft survival in the long term. The aim of this review is to describe the diagnosis criteria for acute rejection, the new classification tools, and its therapeutic alternatives.
The diagnosis of acute kidney injury (AKI) in renal transplantation is a challenge, given the variability of serum creatinine results related to the titration of immunosuppressive drugs and the volume status. Serum creatinine as a biomarker of acute rejection has a low sensitivity and specificity.
The diagnosis of rejection is made using the Banff criteria. The criteria for T-cell mediated rejection have not changed significantly in the past 10 years. However, the category of antibody-mediated rejection was modified in 2013 by adding rejection mediated by C4d-negative antibodies. For the diagnosis of antibody-mediated rejection, 3 main factors are required concomitantly: histological lesions, evidence of antibody-endothelium interaction, and specific donor antibodies.
The quality of the evidence for the different options available for rejection treatment is low. The treatment of cellular rejection has not changed in the last decades and is based on corticosteroids and / or thymoglobulin. Treatment of antibody-mediated rejection is based on the removal of antibodies by immunoadsorption or plasmapheresis, with great variability between transplant centres in terms of complementary treatments (steroids, polyvalent human gammaglobulin, bortezomib, rituximab and/or eculizumab) in order to prevent their production.
En América Latina el número de trasplantes renales continúa en aumento con una tasa creciente1. La principal meta a largo plazo en el trasplante renal es lograr la tolerancia inmunológica del injerto. A pesar de los avances en investigación, el trasplante sigue requiriendo del uso de medicación inmunosupresora para evitar el rechazo, con el consiguiente aumento de los efectos adversos. El rechazo es una de las complicaciones más temidas en el trasplante. La incidencia global es del 5% al 10%, aunque puede tener una incidencia mayor, en torno de 35%, en el grupo de alto riesgo inmunológico, de prevalencia creciente2,3.
El rechazo es gatillado por la presentación de aloantígenos al sistema inmune del receptor, con el consiguiente daño inmunomediado. El diagnóstico de rechazo agudo es de sospecha clínica y confirmación histológica. La sospecha clínica puede estar dada por un episodio de injuria renal aguda (IRA) sin claro factor identificable, o la falta de recuperación de la función renal luego de corregidos otros factores. En el rechazo subclínico la IRA está ausente y el diagnóstico se realiza por biopsias de protocolo o seguimiento4–6.
Se ha clasificado el rechazo según las características histológicas y con un correlato patogénico en rechazo celular y humoral. El rechazo celular ha disminuido su incidencia luego de la introducción de tacrolimus y micofenolato. Sin embargo, la supervivencia de los injertos no ha cambiado en los últimos 20 años, siendo la principal causa de pérdida de los injertos el rechazo humoral crónico7,8. Algunos sostienen una visión unicista, en la que ambas formas son un extremo en la escala de un mismo proceso, pero probablemente sean posibles múltiples situaciones intermedias9.
El objetivo de esta revisión es realizar una aproximación clínica al diagnóstico de rechazo agudo, los principales cambios de la clasificación y sus alternativas terapéuticas.
Diagnóstico diferencial de injuria renal aguda en el trasplanteEl rechazo agudo se manifiesta por cambios en la creatinina sérica frecuentemente asintomáticos. En casos severos se observa hematuria, oliguria, hipertensión arterial, dolor y aumento del tamaño del injerto renal10,11.
El diagnóstico de IRA en el trasplante renal resulta un desafío, dada la variabilidad frecuente de la creatinina sérica, vinculada a la titulación de fármacos inmunosupresores y el estado de volemia. No existe un criterio diagnóstico específico para el diagnóstico de IRA en el trasplante renal, RIFLE y AKIN no han sido validados en trasplante11. Trabajos retrospectivos utilizando dichos criterios muestran que los episodios de IRA se asocian a una peor sobrevida del injerto12,13.
Los trasplantados renales son susceptibles a desarrollar IRA dado que la «reserva» funcional renal se encuentra disminuida. La capacidad de respuesta está alterada por la reducción de la masa renal y el uso de inhibidores de la calcineurina14.
En el manejo clínico se acepta que con un ascenso de la creatinina mayor de 0,3mg/dl y/o una caída del filtrado glomerular de 15% se requiere una exploración de las posibles etiologías10. Si no se encuentra una causa clara se debe proceder rápidamente a la biopsia renal, dado que el diagnóstico y tratamiento precoz del rechazo mejora el pronóstico. En la tabla 1 se resume las principales causas de IRA. Las etiologías varían de frecuencia según el momento del trasplante. La incidencia de rechazo agudo es mayor en los primeros 6 meses, mientras que el rechazo crónico aumenta luego del año, en especial en el subgrupo de alto riesgo inmunológico10.
Principales causas de injuria renal aguda en el trasplante renal
| Principales causas de injuria renal aguda en el trasplante renal | ||
|---|---|---|
| Prerrenal | Renal | Posrenal |
| Alteración de la hemodinamia intrarrenal: AINE IECA/ARA II Hipercalcemia Hipovolemia Diarrea Vómitos Poliuria Baja ingesta hídrica Estenosis de la arteria renal | Vascular Trombosis de arteria renal o vena renala Microangiopatía trombótica Injuria renal aguda isquémicaa Inhibidores de la calcineurina Inmunológicas: Rechazo agudo celular/humoralb Rechazo crónicoc Recurrencia de la enfermedad de basec Glomerulopatía de novo Infecciosa Infección urinaria Nefropatía BKb,c Injuria tóxica: Anfotericina B, aminoglucósidos, otros antibióticos, contraste, Inhibidores de la calcineurina Nefritis tubulointersiticial aguda inmunoalérgica | Compresión extrínseca de uréter Linfocelea,b Urinomaa,b Hematomaa,b Abscesoa,b Estenosis ureteralb Litiasis/coágulos Hipertrofia prostática Otras |
AINE: antiinflamatorios no esteroideos; ARA II: antagonista de los receptores de angiotensina II; IECA: inhibidores de la enzima conversora de angiotensina II.
El diagnóstico de rechazo es histológico, utilizando los criterios de Banff. Dicha clasificación se revisa cada 2 años, la última actualización se realizó en 2015 y se celebró en marzo 2017 una nueva reunión15. La ventaja de utilizar la clasificación de Banff es su correlato patogénico y pronóstico. Es así que la clasificación de rechazo con un criterio temporal en hiperagudo, agudo y crónico se ha sustituido por la clasificación de Banff16–18.
La biopsia renal debe realizarse ecoguiada en tiempo real, se considera una muestra como adecuada cuando contiene al menos 10 glomérulos y al menos 2 arterias, mientras que el requerimiento mínimo son 7 glomérulos y una arteria19. Se deben realizar todas las técnicas con microscopia óptica, inmunofluorescencia para Ig y complemento, C4d ya sea por inmunofluorescencia o inmunohistoquímica y microscopia electrónica. Se reconocen 2 categorías histológicas en Banff: el rechazo mediado por células y el rechazo mediado por anticuerpos, agregando el término rechazo mixto cuando coexisten ambos20–22.
Rechazo mediado por células TEl rechazo mediado por células T se caracteriza por infiltración fundamentalmente de macrófagos y linfocitos en el túbulo-intersticio. Según la clasificación de Banff las principales lesiones diagnósticas de rechazo agudo mediado por células T incluyen la inflamación intersticial (i), la tubulitis (t) y la arteritis de la íntima (v), cuya definición se realizó de forma arbitraria y por consenso en 1997, como se observa en la tabla 2. Dentro de la categoría de rechazo mediado por células T encontramos el rechazo agudo y crónico16,19,21,23. La clasificación de rechazo mediado por células no ha tenido cambios significativos en los últimos 10 años16–19,21,23,24.
Principales lesiones diagnósticas de rechazo agudo celular y categorías de la clasificación de rechazo mediado por células T
| Principales lesiones diagnósticas de rechazo agudo celular | |
|---|---|
| Inflamación intersticial (i): % de inflamación en regiones no escleróticas | 0:<10 |
| 1: 10-25 | |
| 2: 26-50 | |
| 3: >50 | |
| Tubulitis (t): células mononucleadas por túbulo | 0: 0 |
| 1: 1-4 | |
| 2: 5-10 | |
| 3: >10 | |
| Arteritis de la íntima (v): % de la luz con inflamación | 0: 0 |
| 1: <25 | |
| 2: ≥25 | |
| 3: Transmural o necrosis | |
| Categorías de la clasificación de rechazo mediado por células T | ||
|---|---|---|
Categorías de rechazo mediado por células T agudo | IA | Inflamación intersticial (>25% en áreas no escleróticas i2 o i3) con tubulitis moderada (t2) |
| IB | Inflamación intersticial (>25% en áreas no escleróticas i2 o i3) con tubulitis severa (t3) | |
| IIA | Leve a moderada arteritis intimal (v1) con o sin inflamación intersticial y tubulitis | |
| IIB | Arteritis severa intimal >25% del área luminal con o sin inflamación intersticial y tubulitis | |
| III | Arteritis transmural y/o necrosis de la media con infiltrado linfoplasmocitario | |
| Cambios borderline | Cualquier nivel de tubulitis con infiltrado entre 10 a 25% o cualquier infiltrado con tubulitis de una a 4 células que no llegan al diagnóstico de rechazo | |
| Rechazo mediado por células T crónico | Arteriopatía crónica del injerto (fibrosis intimal arterial con infiltración mononuclear y formación de neoíntima) estas lesiones se pueden observar en el rechazo mediado por células T y anticuerpos (Banff 2007 y 2015) | |
| Consignar: inflamación en áreas de esclerosis: i-IFTA | Se recomienda valorar no solo la inflamación intersticial en las áreas no escleróticas. Se debe cuantificar la inflamación en las áreas escleróticas (Banff 2015) | |
El hallazgo más usual es el infiltrado túbulo-intersticial de linfocitos T y macrófagos, y en menor número de linfocitos B, células plasmáticas y eosinófilos, edema intersticial e infiltración de túbulos produciendo tubulitis25. El principal diagnóstico diferencial del infiltrado túbulo intersticial es la nefropatía por polioma virus25. El infiltrado túbulo intersticial es indistinguible uno de otro. Diferenciar entre ambas entidades es importante, dado que el tratamiento requerido para ambos es esencialmente opuesto. De ahí la importancia de contar con técnicas para el diagnóstico de BK virus como el PCR para BK virus y la tinción para proteínas virales como el SV4016,19.
La arteritis intimal es una lesión que se vincula a rechazo mediado por células T y ha captado la atención en los últimos años. En un estudio de Lefaucher et al. encontraron que la arteritis intimal se asocia a la presencia de anticuerpos donante específico, con un pronóstico peor que el rechazo mediado por anticuerpos26. Aunque en Banff 2013 se aceptó la arteritis como una lesión que puede estar presente en el rechazo mediado por anticuerpos, no se quitó de la categoría de rechazo mediado por células T16,17. Es una lesión rara (menos del 8%), el pronóstico es malo según algunos estudios, aunque no todos han demostrado mal pronóstico27.
Además, Banff desde 2015 reconoce la inflamación intersticial en áreas escleróticas como un factor pronóstico que debe ser cuantificado, que no se ha incluido en la categorización16. Históricamente, la inflamación intersticial en áreas de fibrosis no había sido incluida en la clasificación de rechazo mediado por células T, por considerarse parte de la respuesta inflamatoria inespecífica similar a la observada en los riñones nativos. Sin embargo, estudios recientes muestran que la inflamación en áreas de fibrosis se asocia a mal pronóstico y a la producción de anticuerpos donante específico de novo, por lo que puede ser considerada una respuesta aloinmune al injerto4,28. Es así, que en Banff 2015 se recomienda consignarlo en los informes de las biopsias como de valor pronóstico, aunque no se incluya en los criterios de rechazo16.
Cambios limítrofes (borderline según Banff)Los cambios borderline se diagnostican cuando la inflamación intersticial y/o tubulitis son de grado leve y no alcanzan el umbral para el diagnóstico de rechazo (t1,t2,t3, inflamación intersticial)16. Estas son sospechosas de rechazo agudo pero no específico y pueden observarse en otras condiciones. La razón de incorporar la categoría borderline al diagnóstico de rechazo es que el rechazo es un proceso que se desarrolla gradualmente; y en aquellos centros donde se realizan biopsias de protocolo antes de los cambios clínicos pueden identificarse este tipo de lesiones19.
El uso de plataformas modernas (transcriptómica) permite conocer el fenotipo molecular de las biopsias y ser una herramienta complementaria en los casos borderline con transcritos de células T16,29.
Rechazo mediado por anticuerposExisten 3 categorías de cambios mediados por anticuerpos: C4d sin rechazo, rechazo mediado por anticuerpos agudo y rechazo mediado por anticuerpos crónico17,21.
Diagnóstico de rechazo agudo/activo mediado por anticuerposPara realizar diagnóstico de rechazo agudo/activo mediado por anticuerpos se requieren los siguientes 3 pilares en forma concomitante, como se ve en la tabla 3. En caso de presentar 2 de 3 pilares se clasifica como sospecha de rechazo agudo mediado por anticuerpos21.
Clasificación de rechazo agudo mediado por anticuerpos según Banff 2013
| Lesiones histológicas (una o más) | Daño tubular agudo (NTA sin otra causa que lo explique) Inflamación de la microcirculación (capilaritis y/o glomerulitis) cpt1-3/g1-3) Arteritis (v>0) Microangiopatía trombótica (sin otra causa que lo explique) |
| Evidencia latente de interacción entre anticuerpos endotelio (una o más) | C4d 2(+) lineal en más del 25% en IF y de cualquier intensidad en IHQ Inflamación moderada de la microvasculatura, capilaritis más glomerulitis moderadas o graves ENDAT‘S, marcadores de incremento en la expresión de genes endoteliales |
| Evidencia serológica | Anticuerpos anti HLA Anticuerpos no HLA |
Fuente: Solez y Racusen21.
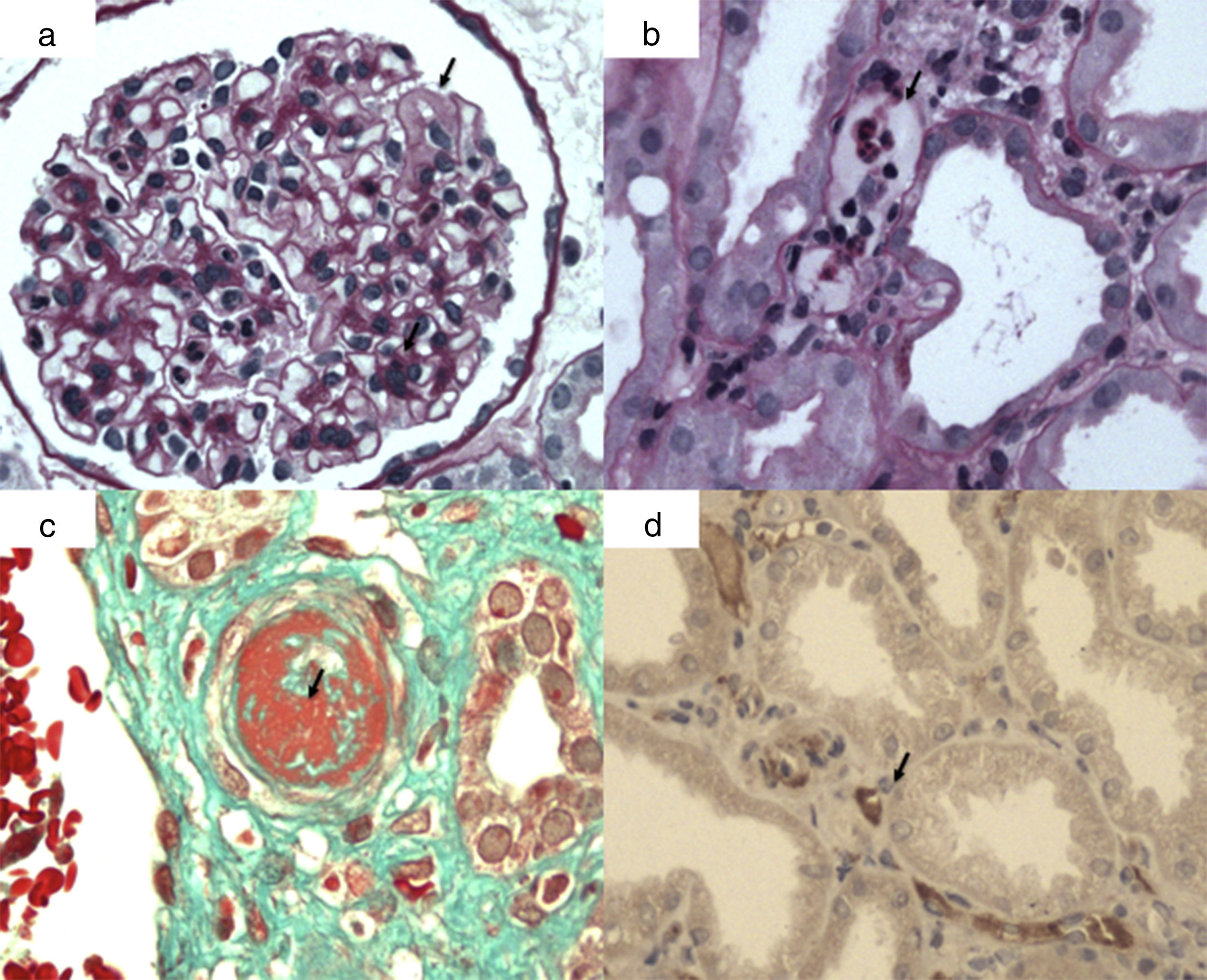
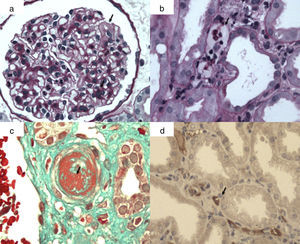
La lesión histológica fundamental es la inflamación de la microcirculación manifestada por glomerulitis (g), capilaritis peritubular (ptc) y microangiopatía trombótica (fig. 1). También puede observarse frecuentemente necrosis tubular aguda y más raramente arteritis intimal.
Lesiones histológicas de rechazo mediado por anticuerpos agudo/activo. a) Glomerulitis: células mononucleadas y polimorfonucleares en capilares glomerulares y edema capilar (flecha); b) capilaritis peritubular (flecha): células mononucleares y polimorfonucleares en capilares peritubulares por técnica de PAS; c) microngiopatía trombótica: trombosis arteriolar (flecha) (técnica tricrómicro de Masson); d) C4d positivo en capilares peritubulares (flecha). Inmunohistoquímica (inmunoperoxidasa).
La glomerulitis es la oclusión completa o parcial de al menos un capilar glomerular por infiltración de leucocitos y/o tumefacción de las células endoteliales, y se representa como g y se gradúa de 0 a 3 (tabla 4). La capilaritis peritubular se define por la presencia de células inflamatorias en más del 10% de los capilares peritubulares corticales, se representa como ptg y se gradúa de 0 a 3, como se ve en la tabla 4. La microangiopatía trombótica se manifiesta como trombos intracapilares, edema endotelial, ensanchamiento subendotelial, glomérulos isquémicos y mesangiólisis25.
Gradación de las principales lesiones histológicas asociadas al rechazo mediado por anticuerpos
| Clasificación de la glomerulitis: oclusión completa o parcial de uno o más capilares glomerulares por infiltración de leucocitos y tumefacción de las células endoteliales | |
|---|---|
| go | Sin glomerulitis |
| g1 | Glomerulitis menos del 25% de los glomérulos |
| g2 | Glomerulitis en el 25% a 75% de los glomérulos |
| g3 | Glomerulitis en más del 75% de los glomérulos |
| Clasificación de la arteritis intimal: % de la luz con inflamación | |
| vo | Sin arteritis intimal |
| v1 | Leve a moderada arteritis intimal al menos en un área de sección de una arteria |
| v2 | Severa arteritis intimal, con al menos 25% del área perdida, en al menos un área de sección transversal de la arteria |
| v3 | Arteritis transmural y/o cambios fibrinoides arteriales y necrosis de la muscular media, con infiltrado linfocítico en el vaso |
| Clasificación de la capilaritis peritubular: células inflamatorias en más del 10% de los capilares peritubulares | |
| ptc 0 | Menos del 10% de los capilares peritubulares (CPT) con inflamación con 1 a 3 leucocitos |
| ptc 1 | Más 10% de los capilares peritubulares (CPT) con capilaritis, con 3 o 4 células inflamatorias luminales |
| ptc 2 | Más 10% de los capilares peritubulares (CPT) con capilaritis, con 5 a 10 células inflamatorias luminales |
| ptc 3 | Más 10% de los capilares peritubulares (CPT) con capilaritis, con más de 10 células inflamatorias luminales |
| Clasificación de la glomerulopatía del trasplante | |
| cg 0 | No dobles contornos ni en la microscopia electrónica, ni en la óptica |
| cg 1 | cg1a: no dobles contornos en la microscopía óptica Microscopia electrónica con dobles contornos (incompletos o circunferenciales) en al menos 3 capilares glomerulares con edema endotelial y/o aumento del espacio electrón lúcido subendotelial |
| cg1b: uno o más capilares glomerulares con doble contorno en la MBG en uno o más glomérulos no escleróticos por microscopia óptica (que implica menos del 25% de bucles capilares periféricos) | |
| cg 2 | Dobles contornos que afectan entre el 26% y el 50% de la asas capilares en los glomérulos más afectados no escleróticos |
| cg 3 | Dobles contornos que afectan a más del 50% de las asas capilares en los glomérulos más afectados no escleróticos |
Fuente: tomada de Solez y Racusen21.
Es el segundo pilar diagnóstico e incluye la presencia de C4d en capilares peritubulares, la inflamación microvascular moderada dada por la suma de glomerulitis y capilaritis con una puntuación mayor a 2 (g + cpt ≥ 2) y la expresión aumentada de transcritos de activación endotelial u otro marcador de activación endotelial. La presencia de cualquiera de ellos es válida como criterio diagnóstico16.
El C4d se reconoció históricamente como característico del rechazo mediado por anticuerpos, es un producto clivado de la activación de la fracción C4 del complemento y no tiene acción biológica conocida. Puede ser activado por la vía clásica y de las lectinas y sirve como huella del conflicto antígeno-anticuerpo en la superficie del endotelio30. En Banff 2013 se establece como equivalente al C4d la presencia de inflamación de la microcirculación moderada (g+ptg>2) y se añadió una nueva categoría que es el rechazo mediado por anticuerpos C4d negativo. Este cambio permitió aumentar el diagnóstico positivo de rechazo mediado por anticuerpos y disminuir la sospecha del mismo23,31.
En 2013 también se agrega como equivalente al C4d el análisis de transcritos de ARN mensajero provenientes del daño endotelial (endothelial associated transcripts), que se alteran en el rechazo mediado por anticuerpos y tienen una huella característica32,33.
Anticuerpos donante específicoLos anticuerpos donante específico (ADE) pueden estar dirigidos contra moléculas HLA o no HLA del endotelio. Los anticuerpos HLA donante específico constituyen el 90% de los ADE responsables de los rechazos mediados por anticuerpos34. Estos deben ser determinados en el momento del diagnóstico. Los ADE pueden estar dirigidos contra moléculas de HLA clase i(A, B y C) o HLA de clase ii(DP, DQ y DR). La descripción de las diferencias entre ADE pre formados y generados de novo excede los objetivos de esta revisión y se puede consultar en la revisión de Zhang34.
La tecnología para la detección de anticuerpos HLA ha avanzado desde la citotoxicidad dependiente de anticuerpos hasta el LUMINEX o ensayos de fase sólida. La documentación de ADE debe hacerse utilizando métodos validados. Para los anticuerpos contra HLA idealmente debería ser un ensayo en fase sólida o LUMINEX21. La determinación de anticuerpos no HLA no ha sido validada en la clínica, pueden estar dirigidos contra la cadena A relacionado con la clase i complejo mayor de histocompatibilidad anticuerpo de laMICA y el receptor de la angiotensina tipo 135,36.
La presencia de ADE se asocia a mal pronóstico de los injertos, al desarrollo de rechazo mediado por anticuerpos subclínico, agudo y crónico35,37,38. Sin embargo, no todos los ADE producen daño al injerto34. ¿Cómo mejorar la capacidad de predicción de daño al injerto de los ADE? El uso de la medida del mean fluorescent intensity (MFI) o intensidad de fluorescencia media por el LUMINEX se ha postulado como medida de fuerza o títulos de los anticuerpos. Sin embargo, la relación entre el título de anticuerpos y la intensidad de fluorescencia no es lineal; por lo que dicho ensayo no es considerado cuantitativo, sino que es un ensayo cualitativo y a lo sumo semicuantitativo. Hay pacientes con elevados MFI que no desarrollan rechazo agudo mediado por anticuerpos y viceversa.
La tecnología LUMINEX nos permite identificar los pacientes en riesgo, pero tiene algunas desventajas. En primer lugar, la falta de estandarización de la técnica, lo que determina que cada centro deba establecer su punto de corte de MFI. En segundo lugar, los falsos negativos por la presencia de inhibidores en el suero, por el llamado «efecto prozona». Tambur et al. demostraron que este efecto puede observarse en presencia de múltiples ADE, y cuando se realizan diluciones de la muestra este efecto se revierte y se puede demostrar la presencia de los ADE el suero. En tercer lugar, no todos los ADE identificados tienen significado patológico38,39. También existen variaciones en concentración de antígenos entre las marcas de reactivos. Finalmente, la concentración de algunos antígenos en las esferas es muy escasa, derivando en un MFI bajo, teniendo sin embargo un efecto patogénico38,39.
Recientemente se introdujeron ensayos de fase sólida por LUMINEX para detectar anticuerpos capaces de fijar el C1q. Esta modificación mejoró la capacidad de predicción para el rechazo mediado por anticuerpos39–42. Por último, la determinación del subtipo de IgG también mejora la predicción, ya que aquellos con mayor capacidad de fijar complemento (IgG3) se asocian a mayor riesgo de rechazo.
Fenotipos de rechazo mediado por anticuerpos agudo/activoEs así que según la clínica, la histología y la determinación de anticuerpos se reconocen 2 fenotipos de rechazo agudo:
- •
El fenotipo 1/rechazo precoz: ocurre en pacientes sensibilizados, durante los primeros 3 meses postrasplante, generalmente C4d positivo y responde al tratamiento, aunque aumenta la probabilidad de rechazo humoral crónico. Este tipo de rechazo se puede prevenir con la adecuada selección de los donantes evitando el trasplante con anticuerpos donante específico.
- •
El fenotipo 2/rechazo tardío: ocurre generalmente luego del primer año, en pacientes sin ADE pretrasplante y generación de ADE anti-HLA de novo, usualmente es C4d negativo y está asociado a la no adherencia al tratamiento farmacológico, con peor respuesta al tratamiento43.
Este rechazo hace referencia al hallazgo en las biopsias de seguimiento de la histología característica de rechazo agudo, en ausencia de disfunción del injerto. El conocimiento de sus mecanismos y el posible tratamiento es objeto de estudio en la actualidad.
Rechazo mediado por anticuerpos crónico activoEl rechazo mediado por anticuerpos crónico constituye una de las causas principales de pérdida de los injertos, y se asocia a mal pronóstico44,45. La característica que permite el diagnóstico es el hallazgo histológico de la glomerulopatía del trasplante (GT)46. La GT se diagnostica en etapas avanzadas por microscopia óptica por la aparición de dobles contornos y expansión de la matriz mesangial. Los cambios leves en la microscopia de luz están asociados con cambios avanzados en microscopia electrónica (ME) y mal pronóstico47. Los cambios preceden a cualquier manifestación clínica48. En la microscopia electrónica se aprecia la multilaminación de la membrana basal capilar y/o engrosamiento y duplicación de la membrana basal glomerular46.
Desde el punto de vista clínico cursa en 2 etapas. Una etapa subclínica sin alteraciones en la función renal ni proteinuria, cuyo único hallazgo es la GT en las biopsias de protocolo. En etapas precoces (dentro del primer año postrasplante) pueden existir evidencias de la GT en la ME con multilaminación de los capilares peritubulares, sin cambios en la microscopia óptica46,47. Una segunda etapa clínica, caracterizada por disfunción crónica del injerto, con proteinuria e hipertensión arterial. Cuando está presente se asocia a mal pronóstico, y lleva a la pérdida del injerto en un corto periodo49,50.
Los pacientes con rechazo crónico pueden asociar elementos de daño activo en la microcirculación mediada por anticuerpos, conocido como rechazo crónico activo.
El rechazo crónico activo se define por la presencia concomitante de:
- •
Evidencia histológica de daño tisular crónico como:
- •
Glomerulopatía del trasplante (cg>0), si no hay microangiopatía crónica.
- •
Delaminación severa de la membrana basal de los capilares peritubulares (en la microscopia electrónica (>7 capas en un capilar peritubular cortical y >5 en 2 capilares adicionales, evitando cortes tangenciales).
- •
Fibrosis de la íntima arterial de inicio reciente, descartando otras causas; los leucocitos dentro de la íntima esclerótica apoyan el diagnóstico de rechazo mediado por anticuerpos crónico (excluido el rechazo mediado por células previo).
- •
- •
Evidencia de interacción de anticuerpos (actual o reciente) dado por cualquiera de los siguientes:
- •
C4d en los capilares peritubulares.
- •
Inflamación de la microcirculación moderada: (g+ptg>2).
- •
Marcadores moleculares (endothelial-associated transcripts).
- •
- •
Evidencia de anticuerpos donantes específico (HLA y no HLA)21.
La mejor estrategia para el manejo del rechazo es su prevención, que se debe realizar desde la procuración de órganos. Evitar en lo posible el trasplante en pacientes con anticuerpos donante específico preformados, mantener una inmunosupresión adecuada, oportuna y eficaz. Existen grupos de pacientes de mayor riesgo para rechazo y en ellos se propone el uso de inmunosupresores en la inducción y no minimizar los de mantenimiento51. La inmunosupresión combinada con tacrolimus y micofenolato se ha asociado a menor riesgo de rechazo52–54.
En el seguimiento de los pacientes trasplantados no existe una herramienta capaz de medir el grado de inmunosupresión, ni su relación de eficacia con la reactividad inmune del paciente. Entre las herramientas en estudio se encuentra el alloreactive T-cell interferon-gamma enzymelinked, que mide el número de las células T memoria alorreactivas. Recientemente Crespo et al. demostraron la utilidad del alloreactive T-cell interferon-gamma enzymelinked en predecir el rechazo agudo celular y la producción de anticuerpos donante específico55. También se encuentran en fase de estudio otros biomarcadores como: CXCL-9, CXCL-10 y subpoblaciones celulares para predecir el riesgo de rechazo y pérdida del injerto.
TratamientoLos distintos centros de trasplante utilizan diversos esquemas terapéuticos del rechazo agudo. La información disponible para tomar decisiones se basa en estudios con números bajos de pacientes, no aleatorizados y en algunos casos análisis retrospectivos. La evaluación de los distintos tratamientos se ve dificultada por los cambios en los criterios de diagnóstico de rechazo, que hacen que se comparen grupos heterogéneos de pacientes31.
Frente a cualquier tipo de rechazo se debe pensar que la inmunosupresión es inadecuada. Esta puede ser inadecuada por: minimización por parte el equipo médico, ser insuficiente frente a una mayor reactividad de la respuesta inmune del paciente, o insuficiente por la no adherencia del paciente. Los niveles plasmáticos de tacrolimus<5ng/ml y el uso de dosis de micofenolato<500mg/día se han asociado a mayor riesgo de rechazo54,56. Por tanto, frente a un episodio de rechazo se debe aumentar la inmunosupresión. En caso de recibir ciclosporina se plantea sustituir por tacrolimus alcanzando niveles próximos a 10ng/ml. En caso de recibir azatioprina se plantea cambiar por micofenolato a dosis adecuadas de 2g para evitar la recurrencia del rechazo, así como reintroducir los corticoides si no los recibía52.
En la actualidad no existe un patrón oro para la monitorización de la adherencia de la medicación inmunosupresora de los pacientes. Se cuenta con cuestionarios estructurados, recuento de pastillas y monitorización electrónica de los frascos que contienen la medicación.
Tratamiento del rechazo mediado por células TEl tratamiento recomendado de primera línea es el uso de metilprednisolona. Las dosis utilizadas varían entre 250mg hasta 1g. Su uso previo a la biopsia puede disminuir el infiltrado celular en los cortes histológicos. Dicho tratamiento se basó en la necesidad de un tratamiento etiopatogénico frente a un evento inmunológico, y si bien no hay ensayos clínicos que lo confirmen, ha demostrado su eficacia desde hace más de 40 años57–59.
El 60-70% de los rechazos responden al uso de esteroides, con descenso de la creatinina entre los días 3 y 7, con una media de 5 días. Se recomienda para catalogar un rechazo mediado por células como corticorresistente esperar 5 días y determinar si la creatininemia retorna a niveles basales ±20%57,58. El descenso de los corticoides se realizará rápidamente a la dosis previa57,58.
En el rechazo resistente a los corticoides y en los casos de rechazo severo (1B) se recomienda el uso de anticuerpos policlonales anti-linfocito T y descartar la presencia de una nefropatía por poliomavirus de no haberse realizado previamente57. La dosis recomendada de timoglobulina es: 1 a 1,5mg/k/día (dosis acumulada máxima total 6-10mg/kg), con una duración del tratamiento de 7 a 14 días por vía endovenosa57. Las principales complicaciones de este tratamiento son linfopenia y trombocitopenia, infecciones oportunistas y la aparición de linfomas a largo plazo. Por tanto, se recomienda profilaxis para citomegalovirus, Pneumocistis jiroveci y hongos60.
En caso de no respuesta al tratamiento es conveniente realizar un nuevo estudio histológico para descartar un rechazo mediado por anticuerpos añadido, ya que el rechazo celular es un factor de riesgo para el rechazo humoral posterior61.
Tratamiento de rechazo agudo mediado por anticuerposEl tratamiento del rechazo mediado por anticuerpos agudo se basa en la remoción de los anticuerpos circulantes, inhibición de los anticuerpos residuales, disminución de la formación de los mismos, minimizar la alorrespuesta y la activación terminal del complemento.
En las Guías KDIGO 2009 se sugiere el tratamiento del rechazo humoral agudo con metilprednisolona, recambio plasmático terapéutico e inmunoglobulinas polivalentes endovenosas62. En la tabla 5 se resumen los principales mecanismos por los cuales actúan dichos fármacos.
Mecanismos fisiopatológicos de los principales fármacos utilizados en el tratamiento del rechazo mediado por anticuerpos
| Mecanismos fisiopatológicos de los principales fármacos utilizados en el tratamiento del rechazo mediado por anticuerpos | |
|---|---|
| Eliminación de anticuerpos circulantes | Recambios plasmáticos terapéuticos Inmunoadsorción |
| Inhibición de anticuerpos residuales | Inmunoglobulinas intravenosas Micofenolato mofetil |
| Supresión de la producción de anticuerpos o depleción de linfocitos B | Corticoides Rituximab Timoglobulina Esplenectomía |
| Apoptosis/depleción de las células plasmáticas | Bortezomib |
| Inhibición de la etapa terminal del complemento | Eculizumab |
La evidencia en el tratamiento del rechazo mediado por anticuerpos también es escasa63. El uso de remoción de anticuerpos se basa en un trabajo de Bohming y ensayo clínico aleatorizado y prospectivo donde analizaron la eficacia del uso versus no uso de inmunoadsorción. Se incluyeron 5 pacientes en cada rama y se suspendió el ensayo, dado que se observó recuperación de la función en todos los pacientes del grupo con inmunoadsorción, sin recuperación en el grupo sin tratamiento64,65. En la última década aumentó la utilización de tratamientos dirigidos a la remoción de anticuerpos como el recambio plasmático terapéutico, considerándose al momento actual el tratamiento de elección, si bien no hay estudios aleatorizados adicionales en este sentido66,67. La dosis objetivo del recambio plasmático terapéutico no está determinada; nuestro grupo, como demostraron diversos estudios, tiene como objetivo un recambio plasmático total de 200 a 250ml/kg, un recambio de 1 a 1,5 volemias plasmáticas por procedimiento65. Se utiliza como fluido de reposición albúmina al 4% y suero fisiológico según la tolerancia. Se pueden realizar en días alternos en combinación con inmunoglobulina endovenosa polivalente de reposición (10mg/kg)65.
La mayoría de los esquemas terapéuticos asocian dosis elevadas de inmunoglobulinas como tratamiento inmunomodulador adyuvante al final de los recambios plasmáticos terapéuticos68,69.
El uso de inmunoglobulinas a dosis elevadas (1-2g/kg) se basó en su inicio en el uso de las mismas en enfermedades reumatológicas para inmunomodulación. Los efectos postulados de la IgIV en el sistema inmune incluyen la neutralización de anticuerpos y citoquinas, depleción de neutrófilos y eosinófilos, eliminación de anafilatoxinas tales como C3a y C5a, bloqueo de los receptores celulares, downregulation de activación de Fcγ receptores, reducción de la vida media de anticuerpos por la competencia con anticuerpos patológicos para la unión a los receptores70,71.
La glucosilación del fragmento Fc parece ser crucial para la eficacia de IVIG, solo una minoría de la IgG sérica total tiene residuos de ácido siálico, lo que explica que sean necesarias altas dosis de IgIV para la eficacia terapéutica. Si bien hay muchos grupos que la incluyen en sus protocolos terapéuticos, no hay ensayos clínicos controlados en rechazo humoral agudo71. Casadei et al. demostraron en 2001 en un ensayo clínico controlado su utilidad previamente en el rechazo celular corticorresistente70.
El rituximab, anticuerpo monoclonal dirigido a las células CD20 positivas, por su mecanismo de acción, aparece como un tratamiento prometedor en el rechazo mediado por anticuerpos. Recientemente, Sautenet et al. reportan los resultados de RITUX ERAH, un ensayo prospectivo, aleatorizado, doble ciego, controlado, multicéntrico de fase iii que compara el tratamiento con rituximab versus placebo en el tratamiento del rechazo agudo precoz68. A todos los pacientes se les realizó tratamiento estándar con recambios plasmáticos terapéuticos 200ml/kg, IgIV 10mg/kg luego de cada procedimiento como reposición y 2 dosis al finalizar los recambios plasmáticos (2g/kg). En ambos grupos disminuyó la proteinuria y la creatininemia luego del tratamiento inicial. Sin embargo, el uso de rituxumab a una dosis de 375mg/m2 no determinó cambios en la creatinina sérica ni en la proteinuria al año. El grupo de rituximab presentó al año menor score de inflamación microvascular, de fibrosis intersticial y de atrofia tubular. Una de las críticas más relevante del estudio es que el número de pacientes reclutados fue mucho menor al estimado para una potencia del 80%. Por tanto, podrían haber existido diferencias entre los grupos que hayan pasado desapercibidas por el bajo número de pacientes. Por último, a destacar del grupo rituximab fue la mayor incidencia de infecciones oportunistas (herpes, BK virus, citomegalovirus, etc.)68. Dado que en algunos estudios el uso de rituximab se asoció a riesgo aumentado de neumonía por Pneumocystis jiroveci, se recomienda la profilaxis con TMP SMX por un año72.
Se han propuesto otros tratamientos con bortezomib, eculizumab (anticuerpo monoclonal dirigido contra C5a, inhibidor de la etapa terminal de la cascada de complemento), anticuerpo monoclonal antiC1q y esplenectomía, aunque con escasa evidencia73–75.
Tratamiento de rechazo agudo mediado por anticuerpos subclínicoHasta el momento actual la evidencia que sostiene el tratamiento del rechazo humoral subclínico es baja, y se basa en un estudio de Orandi et al., de casos y controles, que evidenció una mejor sobrevida renal en los pacientes que recibieron tratamiento en función de recambios plasmáticos terapéuticos y ocasionalmente con rituximab y/o eculizumab5.
PronósticoEl pronóstico del rechazo mediado por células depende de su severidad y respuesta al tratamiento. El que responde parece no tener impacto en la sobrevida del injerto, mientras que el rechazo celular tardío y el asociado a arteritis son los que conllevan peor pronóstico76. Además, el rechazo celular se asocia a la formación de anticuerpos donante específico en un 15% de los casos y al desarrollo rechazo humoral subsiguiente35,61,77,78.
El rechazo agudo mediado por anticuerpos aumenta el riesgo de rechazo humoral crónico y disminuye la sobrevida del injerto35,61,77,78.
El tratamiento del rechazo determina una mayor carga de inmunosupresión que aumenta el riesgo de los efectos adversos, como infecciones y neoplasias. Por tanto, parece claro que el mejor tratamiento del rechazo es prevenir su aparición, evitando cuando sea posible el trasplante en presencia de anticuerpos donante específico y optimizando la inmunosupresión.
Conflicto de interesesNo.
Agradecemos a todos los pacientes que se asisten en la Unidad de trasplante del Centro de Nefrología, así como a todo su equipo asistencial.