El desarrollo de biomarcadores en sangre para detectar la enfermedad de Alzheimer (EA) representa uno de los avances recientes más significativos y algunos ya están disponibles para la práctica clínica. Por ello, el Grupo de Estudio de Conducta y Demencias de la Sociedad Española de Neurología ha formado un grupo de trabajo para revisar su estado actual y elaborar recomendaciones de consenso para su implementación clínica.
DesarrolloEste documento fue elaborado por neurólogos/as del Grupo de Estudio de Conducta y Demencias de la Sociedad Española de Neurología en dos fases. Primero, un grupo coordinador definió las líneas básicas del documento, acordó recomendaciones iniciales basadas en una revisión bibliográfica y redactó un borrador. Posteriormente, la propuesta fue revisada por todo el grupo de trabajo, se consideraron todos los comentarios y el grupo coordinador ajustó las recomendaciones hasta lograr un acuerdo entre los participantes.
ConclusionesEl documento de consenso subraya la importancia del diagnóstico temprano de la EA. Recomienda interpretar los biomarcadores en sangre en el contexto clínico del paciente, no de forma aislada. Las unidades especializadas pueden empezar a emplearlos, pero esto debe acompañarse de investigación continua. Se requieren más datos para su uso en neurología general y atención primaria. No se recomienda su uso en personas asintomáticas, en cribados poblacionales o como pruebas directas al consumidor. Los sistemas públicos de salud deben facilitar su implementación, mediante la correspondiente financiación, para garantizar un acceso equitativo. Este documento debe entenderse como un marco inicial sujeto a actualizaciones periódicas según surjan nuevos datos.
The development of blood biomarkers for detecting Alzheimer's disease (AD) represents one of the most significant recent advances, and some are already available for clinical practice. Therefore, the Grupo de Estudio de Conducta y Demencias de la Sociedad Española de Neurología has formed a working group to review the current status and develop consensus recommendations for their clinical implementation.
DevelopmentThis document was prepared by neurologists from the Grupo de Estudio de Conducta y Demencias de la Sociedad Española de Neurología in two phases. First, a coordinating group defined the basic guidelines of the document, agreed on initial recommendations based on a literature review, and drafted a preliminary version. Subsequently, the proposal was reviewed by the entire working group, all comments were considered, and the coordinating group adjusted the recommendations until consensus was achieved among the participants.
ConclusionsThe consensus document highlights the importance of early diagnosis of AD. It recommends interpreting blood biomarkers in the patient's clinical context, not in isolation. Specialized units can start using them, but this should be accompanied by ongoing research. More data are needed for their use in general neurology and primary care. Their use is not recommended in asymptomatic individuals, population screenings, or as direct-to-consumer tests. Public health systems should facilitate their implementation through appropriate funding to ensure equitable access. This document should be understood as an initial framework subject to periodic updates as new data emerge.
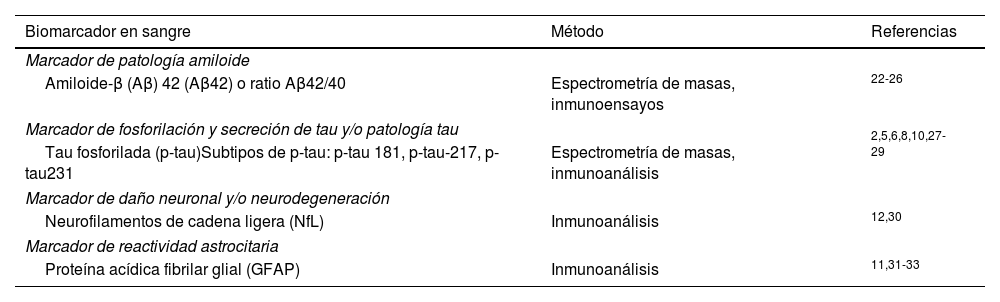
El desarrollo de biomarcadores en sangre para detectar la enfermedad de Alzheimer (EA) representa uno de los avances recientes más significativos. Se han validado analítica y clínicamente múltiples biomarcadores en sangre (tabla 1)1-12, muchos de los cuales se han utilizado en investigación, ensayos clínicos y algunos ya están disponibles comercialmente. Ante la oportunidad y el desafío que plantean, el Grupo de Estudio de Conducta y Demencias de la Sociedad Española de Neurología propone este documento de posición como un marco inicial para el uso de biomarcadores en sangre en la práctica clínica, sujeto a actualizaciones periódicas según aparezcan nuevos datos.
Principales biomarcadores de EA en sangre
| Biomarcador en sangre | Método | Referencias |
|---|---|---|
| Marcador de patología amiloide | ||
| Amiloide-β (Aβ) 42 (Aβ42) o ratio Aβ42/40 | Espectrometría de masas, inmunoensayos | 22-26 |
| Marcador de fosforilación y secreción de tau y/o patología tau | ||
| Tau fosforilada (p-tau)Subtipos de p-tau: p-tau 181, p-tau-217, p-tau231 | Espectrometría de masas, inmunoanálisis | 2,5,6,8,10,27-29 |
| Marcador de daño neuronal y/o neurodegeneración | ||
| Neurofilamentos de cadena ligera (NfL) | Inmunoanálisis | 12,30 |
| Marcador de reactividad astrocitaria | ||
| Proteína acídica fibrilar glial (GFAP) | Inmunoanálisis | 11,31-33 |
La demencia afecta a aproximadamente unas 900.000 personas en España, siendo la EA la causa más frecuente13. La progresiva implementación de biomarcadores ha permitido que en la actualidad podamos realizar un diagnóstico biológico, detectando la patología subyacente, es decir, el depósito de las proteínas amiloide-β (Aβ) y Tau14. Aunque los biomarcadores de referencia, como el estudio del líquido cefalorraquídeo (LCR) o la tomografía por emisión de positrones (PET) con radiotrazadores de Aβ son seguros y fiables, su limitada disponibilidad, su invasividad o su elevado coste plantean desafíos de accesibilidad. Los biomarcadores en sangre ofrecen una alternativa valiosa al ser mínimamente invasivos, económicamente asequibles y escalables, favoreciendo la equidad en el acceso a estos avances.
El diagnóstico etiológico de la EA tiene beneficios sustanciales para los pacientes y sus allegados15. Actualmente es posible realizar un diagnóstico preciso y precoz (antes de la fase de demencia), lo que permite el inicio temprano de tratamientos específicos, el acceso a medidas de apoyo social y económico y una planificación futura adecuada. Considerando, además, la posible disponibilidad futura de fármacos modificadores de la enfermedad16-18, como las terapias anti-amiloide, la confirmación biológica de la EA mediante biomarcadores se vuelve imprescindible para su implementación efectiva19. Recientemente, los biomarcadores en sangre se han incluido en los nuevos criterios para el diagnóstico de la EA20.
En este artículo, revisaremos brevemente el estado actual de los biomarcadores en sangre, abordaremos los requisitos mínimos necesarios para su aplicación en la práctica clínica, exploraremos sus posibles contextos de uso y discutiremos consideraciones éticas. Concluiremos presentando unas recomendaciones generales para su implementación clínica. Aunque es importante tener en cuenta que los biomarcadores pueden ser utilizados con otros objetivos (tabla suplementaria 1), nuestro foco es su potencial aplicación en el proceso diagnóstico del paciente.
El estado actual de los biomarcadores de EA en sangreLa aparición de nuevas técnicas analíticas de alta sensibilidad ha permitido detectar en la sangre proteínas provenientes del sistema nervioso central a concentraciones femtomolares. Entre estas técnicas destacan los ensayos de matriz de molécula única (Simoa, en sus siglas en inglés) o los ensayos basados en electroquimioluminiscencia (ECL). Además de los inmunoensayos, se han desarrollado métodos de inmunoprecipitación acoplada a la espectrometría de masas que han mostrado un rendimiento diagnóstico comparable al estudio del LCR y a la PET de amiloide, las pruebas de referencia actualmente21.
Los principales biomarcadores de la EA en sangre pueden ser clasificados (tabla 1) en: biomarcadores de patología amiloide (Aβ42 y ratio Aβ42/40), patología tau (p-tau181, p-tau217 y p-tau231), reactividad astrocitaria (GFAP) y daño neuronal y axonal (NfL).
Péptidos Aβ en sangreEn la actualidad existen diversas técnicas para determinar los niveles de péptidos Aβ en sangre, que incluyen espectrometría de masas22-24 o inmunoensayos automatizados25,26. Varios estudios han demostrado que los niveles de Aβ42 en sangre, y más específicamente la ratio Aβ42/Aβ40, correlacionan inversamente con los resultados de la PET de amiloide, y son capaces de distinguir entre pacientes con y sin depósitos de amiloide. Un estudio comparativo entre ocho ensayos diferentes de Aβ42/40 en sangre, utilizando como pruebas de referencia el estudio de LCR y la PET de amiloide, reveló que las mediciones mediante técnicas de espectrometría de masas alcanzaban valores de área bajo la curva (AUC, en sus siglas en inglés) en el análisis ROC (Receiver operating characteristic, en sus siglas en inglés) superiores a los obtenidos con diversos inmunoensayos34. La capacidad de discriminación mejora en algunos inmunoensayos si se tiene en cuenta el genotipo APOE ɛ424,35.
A pesar de los prometedores resultados de estos biomarcadores, es importante considerar algunas limitaciones. La diferencia en los niveles de Aβ en sangre entre individuos con PET amiloide positivo y negativo es modesta, con una reducción del 8% al 15%. Esta reducción es significativamente menor que la observada en el LCR, que varía entre el 40% y el 60%36,37. Esto es especialmente relevante al evaluar la robustez técnica de un ensayo. Para una clasificación de pacientes consistente y de utilidad clínica, un biomarcador debe tener un cambio porcentual mayor que el error analítico total. Además, las mediciones de Aβ en sangre son más sensibles que otros biomarcadores a las variaciones en las condiciones preanalíticas y al efecto de algunos fármacos38,39. Por otro lado, la correlación entre los diferentes ensayos no es muy alta, lo que sugiere que cada ensayo posiblemente detecta formas diferentes de Aβ. Finalmente, se ha observado que un aumento en la permeabilidad de la barrera hematoencefálica puede modificar la correlación entre las mediciones en sangre y LCR de los péptidos Aβ40.
Proteína tau fosforilada (p-tau)La medición de las proteínas tau fosforiladas (p-tau) en sangre es el biomarcador más prometedor en la EA. Las proteínas p-tau en la sangre representan una fracción reducida, aproximadamente el 5%, en comparación con los niveles presentes en el LCR, lo que ha dificultado enormemente su cuantificación hasta la llegada de métodos ultrasensibles. Durante muchos años se utilizaron ensayos diseñados para el LCR que se dirigían a la región media de tau. Sin embargo, hoy sabemos que los fragmentos de tau más abundantes en la sangre son los N-terminales. El desarrollo de ensayos dirigidos a esta región N-terminal ha permitido medir de manera más precisa estas proteínas en la sangre27,41.
Las medidas plasmáticas de tau fosforilada en la treonina181 (T181; p-tau181)2,5,6,27, 217 (T217; p-tau217)8,28 o 231 (T231; p-tau231)10,29 tienen un alto rendimiento diagnóstico para diferenciar la EA de otras enfermedades neurodegenerativas, incluso en la fase de deterioro cognitivo leve. Estos resultados han sido validados en estudios neuropatológicos post mortem, el patrón oro42. En algunos casos, el rendimiento de los biomarcadores plasmáticos de p-tau es comparable o apenas marginalmente inferior al rendimiento de los biomarcadores de LCR o la PET de amiloide7,21,43. Asimismo, al igual que con el Aβ en sangre, existen técnicas de espectrometría de masas e inmunoanálisis para detectar p-tau, ambas con un alto rendimiento diagnóstico43. Los primeros biomarcadores en sangre se dirigían, al igual que en los ensayos del LCR, a la fosforilación T181, con excelentes resultados2,5,6,27. Estudios posteriores han indicado que los ensayos dirigidos a la fosforilación T217 tienen, en general, una mayor exactitud diagnóstica4,8,28. Además, p-tau217 aumenta a medida que avanza la enfermedad44, y algunos datos indican que podría también tener cierta utilidad en la valoración de la respuesta al tratamiento anti-amiloide; sin embargo, faltan más datos para confirmar esta posible utilidad45. Algunos ensayos de p-tau217 ya están disponibles comercialmente y han comenzado a probarse en la práctica clínica diaria4,7,43.
Un caso especial es el de p-tau231, que aumenta de forma muy temprana en personas cognitivamente sanas con cambios sutiles en los niveles de Aβ en LCR, incluso antes de que existan claros signos de depósito amiloide en la PET10,29,44,46. Por lo tanto, p-tau231 es un biomarcador que podría ser utilizado para detectar a personas con alto riesgo de padecer deterioro cognitivo ligado a la EA e iniciar medidas preventivas en este grupo. Es importante destacar que tanto p-tau181 como p-tau217 y p-tau231 aumentan antes de que exista evidencia de depósito de tau en la PET de tau, lo que sugiere que reflejan cambios en los niveles de tau soluble en respuesta a la patología amiloide. En cambio, se han desarrollado recientemente algunos nuevos biomarcadores, como NTA-tau47, p-tau20548 o p-tau21249, que aumentan más tarde en el continuo de la enfermedad y que reflejan el depósito de tau insoluble. Finalmente, debemos señalar que la medida de tau total (t-tau) en sangre tiene poca capacidad discriminativa en comparación con p-tau, probablemente debido a la existencia de una fuente periférica de tau. Para evitar este problema se ha desarrollado un ensayo de tau derivada del cerebro (en sus siglas en inglés, Brain-derived tau, BD-tau), que es específico para el sistema nervioso central y que puede considerarse como un marcador de neurodegeneración50.
Cadenas ligeras de neurofilamentos (NfL)Los niveles de NfL son indicadores de daño neuronal y axonal y se incrementan, en mayor o menor medida, en la mayoría de las enfermedades neurológicas, tanto en el LCR como en sangre. Las NfL en sangre están especialmente aumentadas en las enfermedades priónicas, la demencia frontotemporal, la esclerosis lateral amiotrófica y las taupatías 4R12. Los niveles de NfL en sangre correlacionan muy bien con las medidas en LCR, a diferencia de las medidas de tau total, que son menos robustas y están sujetas a varios factores confusores, debido a la expresión periférica de la misma. Las NfL no son marcadores específicos de la EA, pero indican el grado de neurodegeneración que ocurre en esta enfermedad. De hecho, las NfL se consideran parte de la «N» (neurodegeneración) de la clasificación ATN de la EA51. Actualmente, la cuantificación de NfL en sangre también se utiliza en otras enfermedades neurológicas, como la esclerosis múltiple, como biomarcador de respuesta al tratamiento52. Los niveles de NfL aumentan con la edad, por lo que es necesario aplicar diferentes puntos de corte según la edad53,54.
GFAPLa proteína acídica fibrilar glial (GFAP) es un biomarcador de reactividad astrocitaria y sus niveles empiezan a aumentar en fase preclínicas de la EA y continúan aumentando en las fases sintomáticas11,31-33. Sorprendentemente, y a diferencia de otros biomarcadores, la magnitud del aumento de GFAP en sangre es mayor que el que ocurre en LCR. Además, la capacidad de GFAP en plasma para detectar EA es mayor que la del LCR11. En cualquier caso, la GFAP no es específica de la EA y aumenta en otras enfermedades neurodegenerativas, como en la enfermedad de Creutzfeldt-Jakob, la demencia por cuerpos de Lewy o en algunas formas de demencia frontotemporal55,56. A pesar de esto, estudios recientes en cohortes clinicopatológicas muestran que la determinación de GFAP en suero es útil para diferenciar la EA de otras demencias, incluso en fases avanzadas57.
Requisitos mínimos aceptables de los biomarcadores en sangre para su uso en la práctica clínicaPara la adecuada implementación en la práctica clínica de los biomarcadores en sangre, es fundamental establecer unos requisitos mínimos aceptables que aborden tanto aspectos técnicos como clínicos. Es importante definir estos requisitos de manera anticipada ante el continuo desarrollo de nuevos ensayos. La financiación por parte del Sistema Nacional de Salud (SNS) es un importante requisito para que se pueda llegar a usarlo en la práctica clínica, teniendo en cuenta que la técnica tiene que ser validada de forma local, en la mayoría de los casos.
Requisitos técnicosEl primer paso para evaluar un biomarcador es su validación analítica, en la que un ensayo demuestra ser fiable para su uso previsto. En primer lugar, el ensayo debe demostrar que mide específicamente el analito de interés. Además, se deben evaluar parámetros como su precisión, sensibilidad, rango dinámico y robustez. Por otro lado, se debe determinar qué factores pre-analíticos asociados a la obtención, procesamiento y almacenamiento de la muestra antes del análisis pueden influir en las medidas del biomarcador. Actualmente ya existen recomendaciones internacionales para minimizar el impacto de estos factores en los resultados58, y se han desarrollado procedimientos normalizados de trabajo basados en evidencias empíricas. Aunque la mayoría de los biomarcadores se pueden medir de forma fiable en suero, la mayor parte de los estudios se han hecho en plasma (en concreto, en plasma EDTA) y, por lo tanto, es la matriz más recomendable.
La utilización de ensayos automatizados, tal y como se demostró previamente con el análisis del LCR, ayuda a asegurar la reproducibilidad de los resultados. También es necesario que los fabricantes aseguren que sus ensayos son consistentes a través de diferentes lotes. Se está trabajando con organismos como la Federación Internacional de Química Clínica y Medicina de Laboratorio (IFCC) y el Comité de Trazabilidad en Medicina de Laboratorio (JCTLM) para desarrollar materiales y métodos de referencia certificados que permitan estandarizar los ensayos59. Esta estandarización será esencial para comparar resultados entre estudios y establecer límites y puntos de corte globales. Sin embargo, hasta entonces, los resultados de los biomarcadores en sangre deberán ser interpretados y verificados localmente, ya que serán específicos para cada ensayo y cada laboratorio60. Asimismo, se deberá llevar a cabo un seguimiento del rendimiento del ensayo para garantizar la vigencia de los puntos de corte. Algunos programas de control de calidad, como el Alzheimer's Association QC Program61, ya han incluido los biomarcadores en sangre con mayor potencial con el fin de monitorizar la variabilidad analítica de dichos marcadores entre laboratorios y en el tiempo.
Requisitos clínicosUna vez establecida la validez técnica de los biomarcadores en sangre, debe llevarse a cabo su validación clínica mediante estudios en cohortes representativas de la población a las que se pretende aplicar. No son suficientes estudios comparando un grupo de casos (pacientes con EA) con un grupo de controles sanos. Se debe disponer de estudios con pacientes sintomáticos que reflejen la práctica clínica diaria, con diferentes grados de deterioro cognitivo, presentación clínica y comorbilidades, en los que la EA esté entre los diagnósticos diferenciales. Los biomarcadores en sangre deben demostrar una buena concordancia con el patrón oro (la neuropatología) o, en su ausencia, los biomarcadores establecidos y aprobados para su uso asistencial, es decir el estudio del LCR o la PET de amiloide60.
La robustez clínica implica también la capacidad de los biomarcadores en sangre para proporcionar resultados consistentes y fiables en diferentes contextos clínicos y diferentes poblaciones. La evaluación de la robustez debe abordar la variabilidad asociada con la edad, el sexo y el género, el grupo étnico, el índice de masa corporal, los estilos de vida, las variaciones genéticas, determinadas comorbilidades (en especial, variaciones en la función renal) o el uso de fármacos que han demostrado tener cierto impacto en los resultados de algunos biomarcadores en sangre59,60,62. Resulta esencial entender los factores asociados a la heterogeneidad de las medidas y que afectan a su interpretación, lo que es especialmente significativo a la hora de desarrollar rangos de normalidad. Los estudios en biomarcadores suelen hacerse inicialmente en cohortes de investigación que no siempre representan a la población en la que el biomarcador va a aplicarse, que suele ser mucho más heterogénea. Así, son necesarios estudios en poblaciones más diversas.
Los ensayos se suelen evaluar con análisis ROC y calculando un AUC, evaluación que se debe completar con el cálculo de la sensibilidad y la especificidad (ver glosario en la tabla suplementaria 2). Existe una gran variedad de resultados publicados de los ensayos, incluso cuando se mide un mismo analito, ya que pueden existir diferencias entre plataformas. Cabe recordar que la sensibilidad y especificidad de los dos ensayos de LCR aprobados por la Food and Drug Administration (FDA) son del 88-92% y del 84-93%, respectivamente, utilizando la PET de amiloide como prueba de referencia63,64. Sería razonable requerir un rendimiento diagnóstico similar a un biomarcador de sangre.
Desarrollo de los biomarcadoresEl desarrollo de biomarcadores diagnósticos se divide en cinco fases65-67. Tras los estudios exploratorios iniciales (fase1) es necesario desarrollar y validar clínicamente los ensayos (fase2). En la fase3 se estudia el uso de biomarcadores en cohortes retrospectivas y longitudinales para definir criterios de positividad y negatividad. Las últimas fases permiten validar prospectivamente los biomarcadores en el entorno de la práctica clínica habitual (fase4) y analizar su implementación clínica e impacto en la toma de decisiones (fase5). Para algunos biomarcadores de sangre (Aβ, p-tau) ya se han completado en gran medida las fases1 a3 y están en marcha estudios que permitirán completar las fases4 y566,67.
Contextos de usoVía clínica actual del paciente con síntomas cognitivos. Necesidades no cubiertasAunque existen variaciones entre centros y comunidades autónomas, el proceso asistencial del paciente con síntomas cognitivos se suele iniciar en atención primaria, donde el paciente o sus allegados expresan preocupaciones sobre problemas cognitivos y/o conductuales. En esta fase, se llevan a cabo las primeras pruebas de cribado cognitivo y se investigan posibles causas reversibles del deterioro cognitivo. Si se considera necesario, se deriva al paciente a la atención especializada. En este nivel, se realizan una evaluación neuropsicológica, pruebas de neuroimagen y, cuando está indicado y es factible, análisis de LCR, PET con distintos radiotrazadores y/o estudios genéticos, con el objetivo de alcanzar un diagnóstico etiológico. Es importante destacar que aunque estas pruebas están disponibles en todas las comunidades autónomas, su uso varía significativamente, con rangos de utilización del 20-90% de los pacientes elegibles según una encuesta de la SEN68. Esta disparidad, junto con la escasez de neurólogos/as especialistas en deterioro cognitivo, conlleva retrasos diagnósticos significativos y, por lo tanto, una atención subóptima. Ante la potencial introducción de tratamientos modificadores de la enfermedad, los biomarcadores en sangre pueden jugar un papel decisivo para aumentar el porcentaje de pacientes con un diagnóstico etiológico y ayudar a que el acceso a estos nuevos tratamientos sea equitativo.
Seguidamente discutiremos los diferentes posibles contextos de uso de los biomarcadores en sangre. En la implementación clínica de un biomarcador se deben valorar los valores predictivos positivos y negativos, es decir la probabilidad de que, dado un resultado positivo o negativo, respectivamente, un paciente tenga EA o no (ver glosario en la tabla suplementaria 2). Estos parámetros no solo dependen de las características del ensayo sino también de la prevalencia de la enfermedad a estudio, que será diferente en una unidad especializada, en consultas de neurología general, en atención primaria o en la población general.
Uso en unidades especializadasEn las unidades especializadas se atiende a una población con una alta prevalencia de EA y en la que los biomarcadores en sangre han sido ya estudiados con resultados muy prometedores. En concreto, algunos biomarcadores en sangre, como el p-tau217 medido por espectrometría de masas, han demostrado ser incluso equivalentes a las pruebas de LCR aprobados por la FDA para detectar patología amiloide con PET21. Sin embargo, las técnicas de espectrometría de masas no están disponibles en la mayoría de los centros, ni probablemente lo estarán a medio plazo. Algunos inmunoanálisis para medir p-tau217 ya están disponibles y también han demostrado un excelente rendimiento para la detección de la EA, incluidas cohortes españolas4,7. De tal forma que se ha propuesto que estos ensayos podrían sustituir el análisis de LCR o la PET de amiloide. No obstante, estos datos provienen de estudios retrospectivos en cohortes clínicas de investigación, por lo que hace falta confirmarlos en estudios prospectivos con puntos de corte previamente establecidos y en poblaciones más heterogéneas.
Teniendo en cuenta estos elementos, y a pesar de los resultados prometedores de los biomarcadores en sangre, desde el grupo proponemos una implementación progresiva y por fases, comenzando por las unidades especializadas, y no recomendaríamos, en este momento, que sustituyan por completo el análisis de LCR o la PET de amiloide. En una primera fase, los biomarcadores en sangre servirían como un complemento de las pruebas de referencia. En una fase posterior, y con suficiente evidencia acumulada en el uso de los biomarcadores en sangre en la práctica clínica diaria, se podría considerar que sustituyeran al análisis de LCR y la PET amiloide en algunos contextos específicos.
En esta primera fase de aplicación en unidades especializadas habría varias aproximaciones aceptables, dependiendo de los puntos de corte a utilizar. Una primera aproximación consistiría en usar dos puntos de corte, calculados como aquellos puntos con una alta especificidad (90, 95 o 97,5%) y una alta sensibilidad (90, 95 o 97,5%), respectivamente69. Así, los pacientes quedarían clasificados en tres categorías según el nivel de biomarcador: una categoría superior con alto valor predictivo positivo (donde se minimizan los falsos positivos), una categoría intermedia y una categoría inferior con alto valor predictivo negativo (donde se minimizan los falsos negativos). Solo en la franja intermedia sería necesario realizar un análisis de LCR o una PET de amiloide, con un considerable ahorro económico. Si no fuera posible realizar análisis de LCR o PET de amiloide (porque exista una contraindicación o no estén disponibles), estos pacientes deberían ser reevaluados a lo largo del tiempo considerando, incluso, la repetición del biomarcador en sangre.
Alternativamente, se podría utilizar un solo punto de corte, pero siempre interpretando con precaución el resultado en función de la probabilidad pre-test de EA. Por un lado, se podría emplear un punto de corte con alta sensibilidad en una población con baja probabilidad pre-test de EA (por ejemplo, en pacientes jóvenes o con presentaciones atípicas para EA), exclusivamente con el fin de descartar la EA. En este contexto, si la prueba arrojara un resultado negativo, resultaría razonable descartar la presencia de EA. En caso de ser positiva, se debería continuar el estudio del paciente. Por otro lado, se podría emplear un punto de corte con alta especificidad en una población con alta probabilidad pre-test de EA (por ejemplo, en pacientes de mayor edad, con antecedentes familiares positivos o con presentaciones típicas) con el propósito de confirmar el diagnóstico. En este segundo contexto, un resultado positivo confirmaría la sospecha clínica de EA y se podría iniciar el tratamiento específico sin más demora. Por el contrario, un resultado negativo no descartaría el diagnóstico de EA y requeriría más estudios, incluyendo, si se considerara necesario, el análisis de LCR o la PET amiloide. Esta última estrategia también podría ser útil en pacientes en lo que la punción lumbar o la PET amiloide estuvieran contraindicadas o no fueran posibles.
Este grupo de trabajo recomienda que, por disponibilidad y experiencia atesorada, las unidades especializadas son el entorno ideal para iniciar el uso clínico de estos biomarcadores. El uso de uno o dos puntos de corte quedaría a criterio de los diferentes centros.
Uso en las consultas de neurología generalEn nuestro país, los pacientes con deterioro cognitivo son frecuentemente evaluados en consultas de neurología general. A día de hoy, tanto el grado de experiencia clínica, como el uso de biomarcadores diagnósticos, el acceso a pruebas cognitivas o la prevalencia de EA en estos entornos, son muy desiguales. Sin duda, creemos que es prioritario el desarrollo de unidades especializadas en toda la geografía de nuestro país que incorporen los nuevos avances, como los biomarcadores en sangre.
Para poder utilizar los biomarcadores en sangre en una consulta de neurología general debería ser necesario que se dieran una serie de condiciones: que existiera conocimiento por el equipo médico de la interpretación de los resultados y sus posibles variables de confusión, que se supiera cómo comunicar de forma correcta los resultados y que hubiera un procedimiento normalizado de trabajo por parte del laboratorio y una validación de los puntos de corte. La mayoría de los estudios sobre biomarcadores en sangre se han realizado en unidades especializadas; por tanto, es aún necesario ampliar este conocimiento en consultas no especializadas.
En un futuro, y utilizando las aproximaciones antes descritas, un resultado con alto valor predictivo negativo podría ser suficiente en la consulta de neurología general para excluir EA. Cabe destacar que descartar EA no significa descartar otras enfermedades neurológicas u otras causas de deterioro cognitivo y que, por lo tanto, en muchos casos el estudio del paciente debería proseguir. Asimismo, un resultado con alto valor predictivo positivo podría confirmar la EA y facilitar el inicio del tratamiento indicado. Sin embargo, creemos que esta consulta general debe tener acceso a estudios etiológicos y tener la capacidad de derivación a una unidad especializada. Este último punto es especialmente crítico si en un futuro se dispone de tratamientos modificadores de la enfermedad, donde aconsejamos confirmar el diagnóstico de EA con las pruebas de referencia actuales. En conclusión, la recomendación sería que el uso de biomarcadores en sangre en la consulta de neurología general quedase restringida a aquellos escenarios de colaboración estrecha con unidades especializadas de referencia para su progresiva implementación.
Uso en atención primariaLa atención primaria es un entorno con una prevalencia de EA y otras demencias más baja respecto a las unidades especializadas o las consultas de neurología general, por lo que los biomarcadores tendrían un mayor valor predictivo negativo. Mientras que un resultado negativo podría descartar EA, los sujetos con un resultado positivo deberían ser derivados a unidades especializadas para completar el estudio y confirmar el diagnóstico de EA. Esto agilizaría el manejo clínico, derivándose de forma preferencial los casos con alta probabilidad de EA, un hecho relevante en entornos con recursos especializados limitados. En un potencial contexto con tratamientos modificadores de la enfermedad, esta misma aproximación podría agilizar la detección de posibles pacientes candidatos y, lo que también es importante, promover la equidad en su acceso. Una vez más, se debe recordar que un resultado negativo de un biomarcador de sangre no excluye otras enfermedades diferentes de la EA y que, por lo tanto, el estudio del paciente y, si aplica, su derivación a unidades especializadas, deben continuar.
Sin embargo, creemos que a día de hoy no existen aún suficientes datos sobre el uso de biomarcadores en sangre en atención primaria como para recomendar su empleo en este contexto. Se necesita más experiencia de uso clínico real en estos entornos, así como el desarrollo de guías clínicas y la formación específica del personal de atención primaria.
Estudios poblacionales y en población asintomáticaAun siendo la EA una enfermedad muy común, la prevalencia poblacional es obviamente menor que la que se pueda encontrar en una consulta médica. Para realizar un cribado poblacional sería necesario disponer de pruebas muy sensibles y específicas, de bajo coste y amplia disponibilidad y, sobre todo, disponer de un tratamiento modificador de enfermedad que pudiera emplearse para los casos con resultados positivos. Además, se debe considerar el impacto psicológico y sobre la vida de la persona del hecho de comunicar un resultado positivo. A día de hoy no se reúnen estos requisitos, por lo que no recomendamos el uso de biomarcadores en sangre para cribados poblacionales ni en población asintomática, excepto si se realiza en un contexto de investigación.
No obstante, sería de interés iniciar un debate sobre esta cuestión. Los resultados recientes de algunos fármacos anti-amiloide, que muestran que el estadio de la enfermedad modula la respuesta al fármaco, hacen concebible el uso futuro de fármacos en fases preclínicas. Para entonces, tendrían que estar disponibles a nivel nacional las infraestructuras necesarias para cribar, identificar y tratar un número elevado de sujetos con alto riesgo de EA. Cabe también recordar que algunas intervenciones no farmacológicas multimodales han demostrado efectividad en la prevención de la demencia70.
Ensayos clínicos: reclutamiento y monitorización de la respuesta al tratamientoUn problema relevante que limita y ralentiza el reclutamiento en los ensayos clínicos con fármacos modificadores de la EA es el alto porcentaje de fallos de cribado debido a la ausencia de depósito de amiloide cerebral (el 30-40% en fase prodrómica y de demencia leve y hasta el 80-90% en fase preclínica)71. Actualmente, la mayoría de los ensayos clínicos en EA requieren de confirmación etiológica con estudio de LCR y/o PET de amiloide. Los biomarcadores en sangre podrían reducir significativamente los fallos de cribado y el número de punciones lumbares y PET necesarias, lo que abarataría y aceleraría el proceso de aprobación de nuevos tratamientos.
Otro aspecto crucial es la monitorización de la respuesta al tratamiento. Por su naturaleza, los biomarcadores en sangre son ideales para mediciones repetidas y algunos de ellos, como p-tau217, ya han sido utilizados como biomarcadores farmacodinámicos en ensayos clínicos16,45. Sin embargo, aún se necesitan más datos para que p-tau217 pueda ser utilizada como marcador subrogado de la PET de amiloide para monitorizar la carga de amiloide en los ensayos clínicos.
Consideraciones éticas. Información al paciente y a sus allegadosEn el uso de biomarcadores en sangre, como en cualquier otra prueba en desarrollo, es fundamental que tanto los pacientes como sus allegados conozcan las limitaciones de la prueba y su interpretación, tanto antes como después de realizarla. Dada la potencial relevancia del resultado, es fundamental que los pacientes puedan decidir de forma autónoma si desean o no someterse a la prueba. El lenguaje de comunicación, tanto a la persona a la que se le hará la prueba como en los medios de comunicación generalistas, es fundamental para que los conceptos se interpreten adecuadamente. Es relevante considerar que el término «diagnóstico precoz» que los profesionales utilizamos en este contexto es diferente de lo que interpreta con frecuencia la población general. Debemos hacer un esfuerzo para que quede claro a todos los niveles que, con un diagnóstico precoz, nos referimos a los sujetos que ya están experimentando síntomas, y no al uso de biomarcadores en sangre para predecir el riesgo futuro de desarrollar la EA en un sujeto sin síntomas, indicación para la que en la actualidad no recomendamos su uso. Otra confusión relevante en la interpretación de los resultados de los biomarcadores que se ha de clarificar es que estos biomarcadores, en la actualidad, no proporcionan ni una estadificación de la gravedad de la enfermedad ni permiten realizar un pronóstico. Aunque aún no sucede en nuestro medio, pero sí en otros países como Estados Unidos, determinadas compañías ofrecen resultados de biomarcadores en sangre de forma directa al consumidor. Actualmente consideramos que esta práctica resulta inaceptable en nuestro medio, porque estaría fuera de su uso recomendado, tanto con respecto al perfil de paciente (no se tiene en cuenta la presencia o ausencia de síntomas u otros factores que pudieran interferir con los resultados), como con respecto al contexto de uso (fuera de su prescripción e interpretación por expertos).
Perspectivas futuras y recomendacionesActualmente, algunos biomarcadores en sangre han avanzado más allá de las fases1-3 de su desarrollo y han demostrado un excelente rendimiento diagnóstico en cohortes retrospectivas. Actualmente debemos iniciar las fases4 y5, en las que evaluaremos su uso en nuestra práctica clínica habitual, con nuestros pacientes habituales, y determinaremos el impacto de su empleo sobre el paciente y sus allegados. En este sentido, creemos que existen suficientes evidencias para que las unidades especializadas comiencen a utilizar los biomarcadores en sangre sin más demora y evalúen su rendimiento e impacto (tabla 2). Con la adquisición de esta evidencia científica en la población española, creemos que el uso de los biomarcadores en sangre se podrá extender a las consultas de neurología general, en colaboración con unidades especializadas, en un plazo razonable. Sin embargo, su aplicación en atención primaria o en cribados poblacionales aún requiere de más estudios.
Recomendaciones del grupo
| 1. Se recomienda promover los estudios de biomarcadores en sangre para el diagnóstico de EA. El diagnóstico etiológico temprano de la EA es fundamental para iniciar un tratamiento adecuado de forma precoz, así como para brindar a los pacientes y sus allegados la mejor información y atención posible2. Antes de su utilización en la práctica clínica, los biomarcadores en sangre deben demostrar una alta concordancia con las pruebas de referencia actuales, es decir, el estudio del LCR y la PET de amiloide, o los estudios neuropatológicos. Las características de las cohortes de estudio deben ser comparables a las de la población en la que se van a utilizar3. Los biomarcadores en sangre deben interpretarse siempre en su contexto clínico, después de una adecuada anamnesis, exploración neurológica y cognitiva, y tras haber descartado causas reversibles de deterioro cognitivo. No deben emplearse como prueba aislada4. Los biomarcadores en sangre que señalan la presencia de patología amiloide y/o tau (como Aβ42, Aβ42/40 o diversas formas de p-tau) son los más adecuados para la detección de la patología tipo Alzheimer. Dentro de ellos, la p-tau217 muestra los resultados más prometedores y, medida con inmunoanálisis automatizados, es la más factible de realizar en la práctica clínica diaria y la más fácilmente escalable5. Recomendamos una incorporación progresiva de los biomarcadores en sangre en la práctica clínica y desaconsejamos, en este momento, que estos sustituyan al análisis de LCR o a la PET de amiloide, que continúan siendo las pruebas de referencia6. Hay suficientes evidencias para que las unidades especializadas empiecen a emplear los biomarcadores en sangre sin más demora. Sin embargo, esta adopción debe ir de la mano de una investigación y control de calidad constante que evalúe sus puntos de corte locales, su uso en la práctica clínica habitual y su impacto sobre los pacientes, los familiares y el sistema de salud7. Se requieren más datos, formación e infraestructura adecuada para el uso de los biomarcadores en sangre en las consultas de neurología general y en atención primaria8. Desaconsejamos, a día de hoy, el uso de los biomarcadores en sangre en personas asintomáticas y como método de cribado poblacional, excepto en el contexto exclusivo de la investigación9. Desaconsejamos su uso como pruebas directas al consumidor. Un biomarcador siempre debe ser prescrito, interpretado y comunicado al paciente por un profesional sanitario con la adecuada formación10. Los sistemas públicos de salud deben liderar y guiar la implementación de los biomarcadores en sangre y otros avances en la EA, mediante la inclusión de los biomarcadores en sangre en la cartera de servicios del SNS, y así asegurar la equidad en su acceso |
Aunque la implementación clínica podría convertirse en una realidad a corto o medio plazo, nos enfrentamos a desafíos significativos. En primer lugar, la determinación y la interpretación de los puntos de corte son aspectos críticos. En segundo lugar, es fundamental comprender todos los factores individuales que podrían influir en las mediciones de los biomarcadores y en su rendimiento diagnóstico. Es necesario llevar a cabo estudios que abarquen la diversidad de las poblaciones a las que atendemos. Además, debemos considerar la interpretación de los resultados en presencia de múltiples patologías, ya que los estudios neuropatológicos indican que la mayoría de pacientes con EA también tienen otras patologías. Aún carecemos de biomarcadores en sangre fiables para muchas otras enfermedades neurodegenerativas. Aunque en este artículo nos hemos centrado en el valor diagnóstico de los biomarcadores en sangre, un biomarcador puede también proporcionar información pronóstica y/o predictiva, para lo cual se necesitarán estudios longitudinales (tabla suplementaria 1). Por último, es imprescindible recordar lo obvio: un biomarcador debe ser siempre considerado en su contexto clínico, y en ningún caso debe sustituir al juicio clínico.
Las ventajas de los biomarcadores en sangre, en comparación con el estudio del LCR o la PET amiloide, son evidentes: son percibidos como más aceptables y seguros por los pacientes y los profesionales sanitarios (aunque recordamos la alta seguridad de la punción lumbar y la PET), requieren menos personal especializado, lo que los hace más accesibles para la población, no tienen contraindicaciones y pueden facilitar el diagnóstico en poblaciones menos representadas, promoviendo así la equidad en el acceso a la atención sanitaria. Con el fin de garantizar esta equidad, creemos que los sistemas de salud públicos deben desempeñar un papel fundamental para garantizar el acceso de toda la población a los nuevos avances. Para evitar la dependencia de ayudas externas, la financiación por parte del SNS es un importante requisito para que se pueda llegar a usarlo en la práctica clínica (tabla 2).
FinanciaciónEl presente trabajo no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Contribución de los autoresTodos los autores han hecho contribuciones sustanciales a la concepción del manuscrito, el borrador del artículo y su revisión de contenido intelectual, y la aprobación definitiva de la versión que se presenta.
Conflicto de interesesAGM ha ofrecido conferencias en simposios patrocinados por TEVA, Almirall y Lilly y ha recibido financiación del Instituto de Salud CarlosIII (ISCIII), European Union (ESF+), and FEDER de acuerdo a O.A., M.P. de 13 de diciembre de 2023 a través de un contrato Juan Rodes (JR23/00005).
AV ha recibido pagos personales por participar en eventos educativos por parte de Schwabe, Alter, KRKA, Kern Pharma, Esteve y Neuraxpharm y en comités asesores de Eisai.
CA ha recibido una beca de investigación de la Susan and Charles Berhoff Foundation. Ha ofrecido conferencias en simposios patrocinados por Hoffman-La Roche LTD y Nutricia, cuyo pago fue realizado a la institución (Ace Alzheimer Center Barcelona). Ha recibido financiación para asistir a conferencias internacionales por parte de Biogen Inc. y Nutricia, cuyo pago también fue realizado a la institución (Ace Alzheimer Center Barcelona). Ha recibido pagos personales por ofrecer conferencias en simposios patrocinados por F. Hoffman-La Roche LTD, Nutricia, Schwabe Farma Ibérica S.A.U. y Zambon. Es miembro de la junta directiva de la Lewy Body Dementia Association y del comité científico de Lewy Body España ad honorem.
GAF ha ofrecido conferencias en actividades formativas patrocinadas por GE HealthCare, Fujirebio. Ha participado en comité asesor de GE HealthCare.
MS-C ha ofrecido conferencias en simposios patrocinados por Almirall, Eli Lilly, Novo Nordisk, Roche Diagnostics y Roche Farma. Ha desempeñado funciones de consultor y ha participado en comités asesores para Eli Lilly, Grifols and Roche Diagnostics. Se le otorgó un proyecto financiado y es investigador de un ensayo clínico por Roche Diagnostics International Ltd. Ha recibido apoyo en especie para investigaciones de ADx Neurosciences, Alamar Biosciences, Avid Radiopharmaceuticals, Eli Lilly, Fujirebio, Janssen Research & Development y Roche Diagnostics. Todos los pagos fueron realizados a la institución (BBRC).
NR-E ha ofrecido conferencias en simposios patrocinados por Almirall y Roche Farma y es investigador de un estudio observacional financiado por Roche Farma.
EM-R ha recibido pagos personales por charlas patrocinadas por KRKA farmacéutica S.L.
RS-V ha recibido pagos personales por participar en eventos educativos por parte de Roche Diagnostics, Lilly, Neuraxpharm, y en comités asesores de Eli Lilly, Pfizer, Wave Pharmaceuticals.
El resto de autores declaran no tener ningún conflicto de intereses relativo al presente documento.
Coordinadores: Marc Suárez-Calvet, Carla Abdelnour, Daniel Alcolea, Maite Mendióroz-Iriarte, Mircea Balasa, Estrella Morenas-Rodríguez, Albert Puig-Pijoan, Pascual Sánchez-Juan, Alberto Villarejo, Raquel Sánchez-Valle.
Participantes en el grupo de trabajo:
Lourdes Álvarez-Sánchez, Grup d’Investigació en Malaltia d’Alzheimer, Institut d’Investigació Sanitària La Fe, València, España.
Guillermo Amer Ferrer, Servei de Neurologia, Hospital Universitari Son Espases, Palma de Mallorca, España; Institut d’Investigació Sanitaria Illes Balears (IdISBa), Palma de Mallorca, España.
Miquel Baquero, Grup d’Investigació en Malaltia d’Alzheimer, Institut d’Investigació Sanitària La Fe; Servei de Neurologia, Hospital Universitari i Politècnic La Fe, València, España.
Lina Carazo-Barrios, Complejo Hospitalario de Jaén, Jaén, España.
Ignacio Casado Naranjo, Servicio de Neurología, Hospital Universitario de Cáceres, España; CIBERNED, Centro de Investigación Biomédica en Red del Área de Enfermedades Neurodegenerativas, Instituto de Salud CarlosIII; Instituto Universitario de Investigación Biosanitaria de Extremadura INUBE.
Marta Fernández-Matarrubia, Servicio de Neurología, Hospital Universitario Marqués de Valdecilla, Santander, España; Instituto de Investigación Marqués de Valdecilla (IDIVAL), Santander, España; CIBERNED, Centro de Investigación Biomédica en Red sobre Enfermedades Neurodegenerativas, Instituto de Salud CarlosIII (ISCIII), Madrid, España.
Guillermo García-Ribas, Servicio de Neurología, Hospital Universitario Ramón y Cajal, Madrid, España.
Francisco Javier Garzón Maldonado, Departamento de Neurología, Hospital Universitario Virgen de la Victoria, Málaga, España; Instituto de Investigación Biomédica de Málaga y Plataforma en Nanomedicina-IBIMA Plataforma BIONAND, Málaga, España.
Carmen Gasca Salas, HM CINAC (Centro Integral de Neurociencias Abarca Campal), Hospital Universitario HM Puerta del Sur, HM Hospitales, Madrid, España; Instituto de Investigación Sanitaria HM Hospitales, Madrid, España; CIBERNED, Centro de Investigación Biomédica en Red del Área de Enfermedades Neurodegenerativas, Instituto de Salud CarlosIII, España.
Jordi Gascon Bayarri, Servei de Neurologia, Hospital Universitari de Bellvitge, Hospitalet de Llobregat, Barcelona, España.
María José Gil-Moreno, Departamento de Neurología, Hospital Clínico San Carlos, Madrid, España; Instituto de Investigación Sanitaria San Carlos (IdISCC), Universidad Complutense de Madrid, Madrid, España.
Alicia González-Martínez, Servicios de Neurología e Inmunología, Hospital Universitario de la Princesa e Instituto de Investigación Sanitaria Princesa (IIS-Princesa), Madrid, España.
Adolfo Jiménez-Huete, Departamento de Neurología, Clínica Universidad de Navarra, Madrid, España.
Dolores López Villegas, Unitat de Trastorns Cognitius i Psicogeriatria, Centre Dr. Emili Mira, Institut de Salut Mental, Hospital del Mar, Barcelona, España; Hospital del Mar Research Institute, Barcelona, España.
Juan Marín Muñoz, Unidad de Demencias, Neurología, HCU Virgen de la Arrixaca, Murcia, España.
Jordi A. Matías-Guiu, Departamento de Neurología, Hospital Clínico San Carlos, Madrid, España; Instituto de Investigación Sanitaria San Carlos (IdISCC), Universidad Complutense de Madrid, Madrid, España.
Francisco Javier Olazarán Rodríguez, Servicio de Neurología, Hospital General Universitario Gregorio Marañón, Madrid, España; Unidad de Trastornos de la Memoria HM, Madrid, España; Dirección Científica, Fundación Maria Wolff, Madrid, España.
Natalia Pérez Carmona, Unidad de Neurología de la Conducta y Demencia, Hospital San Vicente del Raspeig, Alicante, España.
Gerard Piñol Ripoll, Unitat de Trastorns Cognitius, Cognition and Behavior Study Group, Hospital Universitari Santa Maria, IRB Lleida, Lleida, España.
Mario Riverol, Departamento de Neurología, Clínica Universidad de Navarra, Pamplona, España; Instituto de Investigación Sanitaria de Navarra (IdiSNA), Recinto del Hospital Universitario de Navarra, Pamplona, España.
Norberto Rodríguez Espinosa, Servicio de Neurología, Hospital Universitario Nuestra Señora de Candelaria, Santa Cruz de Tenerife, Tenerife, España; Universidad de La Laguna, San Cristóbal de La Laguna/Santa Cruz de Tenerife, Tenerife, España.
José Antonio Rojo Aladro, Servicio Neurología, Hospital Universitario de Canarias. Tenerife, España.
Sara Rubio Guerra, Servei de Neurologia, Hospital de la Santa Creu i Sant Pau, Barcelona, España; Institut d’Investigacions Biomèdiques Sant Pau, Hospital de Sant Pau, Universitat Autònoma de Barcelona, Barcelona, España; CIBERNED, Centro de Investigación Biomédica en Red del Área de Enfermedades Neurodegenerativas, Instituto de Salud CarlosIII, España.
Domingo Sánchez Ruiz, EAIA Benito Menni Sant Boi, Barcelona, España.
Antonio Sánchez-Soblechero, Servicio de Neurología, Hospital General Universitario Gregorio Marañón, Madrid, España; Instituto de Investigación Sanitaria Gregorio Marañón (IiSGM), Madrid, España.
Alba Vieira Campos, Servicio de Neurología, Hospital Universitario de La Princesa, Madrid, España.