La valoración de las actividades de la vida diaria (AVD) se considera esencial en la evaluación del deterioro cognitivo leve (DCL), la demencia y para su correcto diagnóstico diferencial. Existen muchas escalas para la valoración funcional de estas entidades, aunque no están exentas de inconvenientes. La escala de las AVD del Test Barcelona fue publicada en el 2019 con el objetivo de disponer de un instrumento retrogenético que pudiera sortear la mayoría de los problemas con los que se encuentran sus antecesoras.
MétodoSe realizó un estudio para evaluar las propiedades de esta escala. Se evaluó una muestra total de 68 sujetos (controles sanos, pacientes con DCL tipo amnésico y pacientes con demencia tipo Alzheimer) estratificados según la Escala de Deterioro Cognitivo Global -Global Deterioration Scale- completada con la Escala del Estado Funcional -Functional Assessment Staging- (GDS-FAST). Se estudiaron las puntuaciones de cada grupo en la escala, así como en otras pruebas cognitivas, para obtener los descriptivos y los índices de consistencia interna, validez concurrente y capacidad discriminativa.
ResultadosLas medias de la escala diferían significativamente entre todos los grupos de estratificación. Se obtuvo un alto índice de consistencia interna (α de Cronbach de 0,975), excelente validez concurrente (ρ de Spearman de 0,95) y muy buena capacidad discriminativa, especialmente entre los grupos GDS-FAST 3 y 4, y los grupos GDS-FAST 4 y 5.
ConclusionesLa escala de AVD del Test Barcelona permite evaluar adecuadamente el nivel funcional retrogenético de los pacientes y discriminar entre las diferentes fases del GDS-FAST, situándose como una escala muy completa y útil en nuestro medio sociocultural.
The assessment of activities of daily living (ADL) is considered essential in the evaluation of mild cognitive impairment (MCI), dementia and for its correct differential diagnosis. There are many scales for the functional assessment of these entities, although they are not exempt from drawbacks. The Barcelona Test ADL scale was published in 2019 with the aim of having a retrogenetic instrument that could overcome most of the problems encountered by its predecessors.
MethodA study was carried out to evaluate the properties of this scale. A total sample of 68 subjects (healthy controls, patients with amnestic-type MCI, and patients with Alzheimer's-type dementia) stratified according to the Global Cognitive Impairment Scale -Global Deterioration Scale- completed with the Functional Assessment Staging- Scale (GDS-FAST). The scores of each group on the scale, as well as on other cognitive tests, were studied to obtain the descriptive and internal consistency, concurrent validity, and discriminative capacity indices.
ResultsThe scale means differed significantly between all stratification groups. A high internal consistency index was obtained (Cronbach's α 0.975), excellent concurrent validity (Spearman's ρ of 0.95) and very good discriminative capacity, especially between the GDS-FAST 3 and 4 groups, and the GDS-FAST 4 and 5 groups.
ConclusionsThe Barcelona Test ADL scale allows adequately evaluating the retrogenetic functional level of patients and discriminating between the different phases of the GDS-FAST, positioning itself as a very complete and useful scale in our sociocultural environment.
La demencia puede definirse como la condición clínica de deterioro cognitivo, que afecta no solo a la cognición sino también a las emociones y la conducta. Este deterioro ocurre de manera progresiva, interfiriendo en las actividades de la vida diaria (AVD) de la persona1,2.
El tipo más prevalente de demencia en personas de más de 65 años es la enfermedad de Alzheimer (EA)3. En la actualidad el diagnóstico de la EA se establece por criterios biológicos4–6. Los déficits en las AVD se consideran componentes integrales de las demencias, considerándose las medidas en las AVD como uno de los marcadores más robustos para observar el curso clínico de la EA7.
Dentro del concepto de deterioro cognitivo leve (DCL), aunque es una entidad heterogénea, está ampliamente aceptado el subtipo amnésico (DCL-A) como pródromo de la EA. En el DCL los pacientes tienen dificultades cognitivas y funcionales sutiles8, es decir, más dificultades para llevar a cabo las tareas más complejas.
Hace décadas que el modelo retrogenético o retrogénesis, inicialmente planteado por Ajuriaguerra y su escuela9, entendido como el proceso por el cual los mecanismos degenerativos revierten el orden de adquisición del desarrollo normal, adquirió notable importancia en el estudio de las demencias y de la EA en particular10, especialmente en lo que concierne a su progresión y también al tratamiento y cuidado no farmacológico. La EA es el paradigma de enfermedad retrogenética, pero este proceso es aplicable en mayor o menor medida a muchas enfermedades que cursan con demencia11,12.
Tal como ya se ha dicho, la evaluación de las AVD se considera esencial en el estudio clínico de la demencia13. Existen muchas escalas para evaluar las habilidades funcionales en la demencia14–16, cada una está más o menos enfocada a evaluar las AVD avanzadas (p.ej. deporte, ocio), instrumentales (p. ej. comprar, cocinar, utilizar el dinero) o básicas (p. ej. comer, andar). Algunas de las escalas utilizadas tienen dificultades en diferenciar los sujetos sanos de los sujetos con un DCL, como son las escalas de Lawton y Brody, también conocida como Philadelphia Geriatric Center-Instrumental Activities Daily Living (PGC-IADL) y que valora actividades intrumentales17, la de Blessed, Blessed Dementia Rating Scale (BDRS), que valora actividades básicas e instrumentales, además de cambios en la conducta y personalidad18, la Interview for Deterioration in Daily life inDementia (IDDD), que valora cuidado personal y actividades complejas, además de que distingue la iniciativa para llevar a cabo una acción de la realización de la acción19, y la Alzheimer's Disease Functional Assessment and Change Scale (ADFACS), que valora actividades básicas e instrumentales15,16. Otro problema es la inclusión de ítems fuertemente influenciados por el sexo, e incluso cómo valorar los ítems que la persona no ha realizado nunca20.
Los cambios en las AVD se han definido como multicausales, considerándose que los déficits cognitivos solo supondrían un tercio de su varianza21, convirtiéndose la evaluación de las AVD en esencial y cada vez más importante en los ensayos clínicos22.
Con el objetivo de avanzar en la evaluación de las AVD, superando las dificultades de escalas actuales e intentando optimizar su evaluación, la segunda edición del Test Barcelona (TB) incluye una nueva escala de AVD (AVD-TB)23.
La escala AVD-TB se construyó desde el enfoque retrogenético, con el objetivo de poder relacionar la funcionalidad con los rendimientos cognitivos de los sujetos en todo el espectro de la EA. La escala originariamente se desarrolló y ensayó entre los años 2012-2018, después de una revisión de las escalas presentes en la literatura e intentando redefinir mejor los ítems para organizarlos dentro del modelo retrogenético, de tal manera que fuera posible clasificar a los pacientes en todas las fases de la escala GDS15,16,24, con ítems clave que permitieran diferenciar claramente entre diferentes fases de la enfermedad y que fuera relativamente breve7.
El presente estudio tiene por objetivo valorar la aplicabilidad, consistencia interna, la validez concurrente y discriminativa de la escala AVD-TB en una muestra de población española mayor de 65 años, voluntarios sanos, pacientes con DCL-A y pacientes con demencia tipo Alzheimer (DTA).
Material y métodosSujetosEl estudio se llevó a cabo en el departamento de neuropsicología de la Fundación Sociosanitaria y Social de Santa Tecla (Tarragona, España), y en la Asociación de Alzheimer y otros Trastornos Neurocognitivos de Reus y Baix Camp (Reus, España) y siguiendo las recomendaciones éticas internacionales para la investigación y los ensayos clínicos con humanos, contenidas en la Declaración de Helsinki del año 1964 y sus posteriores modificaciones. El estudio fue aprobado por el Comité Ético de Investigación con medicamentos (CEIm) del Instituto de Investigación Sanitaria Pere Virgili (Ref. CEIm: 185/2017). Todos los participantes fueron informados sobre el estudio y se obtuvo su consentimiento por escrito.
Se reclutaron sujetos de las siguientes fuentes: a) consulta del departamento de neuropsicología de la Fundación Sociosanitaria y Social de Santa Tecla, reclutados consecutiva y accidentalmente de pacientes que acudían a primeras visitas o seguimientos; b) pacientes que acudían a los talleres de estimulación en el Instituto Lerin Neurocognitive de la Asociación de Alzheimer y otros Trastornos Neurocognitivos de Reus y Baix Camp; c) cónyuges de los pacientes reclutados y conocidos de las evaluadoras. El reclutamiento se estratificó siguiendo criterios GDS25, definiéndose 5 grupos: GDS 1-2, GDS 3 (DCL-A), GDS 4 (DTA leve), GDS 5 (DTA moderada) y GDS 6 (DTA moderada-grave). Todos los participantes eran de etnia caucásica, escolarizados en España, con independencia de su lengua materna en el caso de bilingües. Se incluyeron 68 sujetos.
Los sujetos fueron seleccionados según los criterios de inclusión y exclusión siguientes:
Criterios de inclusión: (1) firma del documento de consentimiento informado; (2) edad igual o superior a 65 años (en el grupo GDS 3 también, aunque se diagnostican muchos casos en edades inferiores, se pretendía evitar posteriores diferencias entre grupos en la variable edad); (3) audición, visión y condiciones físicas adecuadas para realizar las evaluaciones; (4) asegurar mínima capacidad de lectura y escritura; (5) valor del Mini Mental State Examination (MMSE) igual o superior a 25 con los criterios de corrección NORMACODEM26 para GDS 1-2, superior a 24 para GDS 3, igual o inferior a 27 para los grupos GDS 4-6; (6) estado médico y farmacológico estable durante los 3 meses previos al comienzo del estudio; (7) ausencia de anomalías clínicamente significativas en la historia clínica y, para los grupos GDS 4-6, también la presencia de un familiar cuidador disponible en el momento de la visita de evaluación; (7) para GDS 3, diagnóstico de DCL-A de acuerdo con los criterios IPA-WHO27 y para los grupos GDS 4-6 diagnóstico de EA probable de acuerdo con los criterios DSM-IV13 y NINCDS-ADRDA28.
En todos los grupos se consideraron los siguientes criterios de exclusión: (1) falta de voluntad o incapacidad para colaborar adecuadamente en el estudio; (2) cualquier patología del sistema nervioso que pudiese afectar a la cognición, en el caso de GDS 3, diferente del DCL y ausencia de anosognosia y en GDS 4-6, diferente de la DTA; (3) episodio depresivo mayor o trastorno distímico según criterios DSM-IV13; (4) hipotiroidismo; (5) deficiencia de vitamina B12 en los 12 meses anteriores al estudio; (6) enfermedad cardiovascular significativa o inestable; (7) diabetes insulinodependiente; (8) enfermedad o insuficiencia renal; (9) enfermedad o insuficiencia hepática; (10) infección por VIH conocida; (11) historia o presencia de abuso de alcohol u otras drogas en los 24 meses anteriores al estudio.
Medidas neuropsicológicas y funcionalesComo medidas de selección se utilizaron los diagnósticos clínicos (médicos) realizados por los neurólogos referentes y los siguientes test:
- •
Mini Mental State Examination (MMSE): El MMSE es una prueba de cribado que permite evaluar diferentes funciones cognitivas: orientación, memoria, atención, lenguaje y praxis29. En este estudio se utilizó la versión española validada por Blesa et al.26. Se tuvo en cuenta la puntuación total, que puede ser de 0 a 30, así como la puntuación ajustada sociodemográficamente, según la validación española26 (se demostró que, ajustando por edad y escolaridad, y con un punto de corte de 25, el instrumento aumentaba su especificidad, sin disminuir en sensibilidad).
- •
Escala de Deterioro Global (Global Deterioration Scale [GDS])25: La GDS es una escala que clasifica retrogenéticamente las diferentes fases el deterioro de la DTA, desde la normalidad hasta la demencia más grave. Para este estudio la escala GDS se consideró «criterio oro» de clasificación y estratificación de la muestra.
- •
Escala del Estado Funcional (Functional Assessment Staging [FAST])30: La FAST se utiliza como complemento de la escala GDS, aportando puntos críticos de cada fase para el presente estudio.
Escala de Actividades de la Vida Diaria del Test Barcelona (AVD-TB)23: Es una escala heteroaplicada donde se valoran por un lado las AVD avanzadas e instrumentales complejas (parte I) y por otro las AVD instrumentales semicomplejas y las básicas (parte II). Las puntuaciones de cada ítem son las siguientes: «0», normal, no existen problemas; «1», alguna vez tiene dificultades; «2», a menudo, frecuentemente tiene dificultades; «3», siempre tiene dificultades; «4», no lo hace, totalmente incapaz. Además, los ítems pueden puntuarse como «nunca lo ha hecho» o «no lo sé» y en estos casos la puntuación se transformará a numérica calculando la media aritmética de los ítems sí respondidos y redondeando al siguiente entero por exceso.
La parte I consta de 15 ítems, que se relacionan básicamente con los GDS 1 a 4 y en los que las puntuaciones que se pueden obtener van de 0 a 60 (a menos puntuación, más independencia) y la parte II consta de 10 ítems relacionados con los GDS 5 a 7 en los que la puntuación va de 0 a 4023 (tabla 1). Para el presente estudio se han tenido en cuenta las puntuaciones de la parte I, II y la total.
Variables de la Escala de Valoración Funcional del Test Barcelona (AVD-TB)
| Ítems | Parte I. AVD avanzadas e instrumentales complejas | AVD evaluada | GDS-FAST |
|---|---|---|---|
| 1 | Desplazamiento a un lugar poco familiar (con medio de transporte o a pie) | Av | 3 |
| 2 | Participación en actividades sociales complejas y de ocio | Av | 3 |
| 3 | Programación y realización de viajes y excursiones | Av | 3 |
| 4 | Manejo de asuntos financieros | Av | 4 |
| 5 | Realización de las actividades habituales (en casa o en el trabajo) | I | 4 |
| 6 | Recuerdo de hechos recientes en general | I | 3 |
| 7 | Preparación de comidas con cierta complejidad | I | 4 |
| 8 | Uso del teléfono o electrodomésticos en general | I | 4 |
| 9 | Cuidado de sí mismo (salud, medicaciones) | I | 4 |
| 10 | Resolución y decisión sobre cosas de forma organizada | I | 4 |
| 11 | Aprendizaje, en general, de nuevas cosas | I | 4 |
| 12 | Recuerdo de hechos de los últimos meses | I | 4 |
| 13 | Compras sin cometer fallos | I | 4 |
| 14 | Uso del dinero y pagos adecuados | I | 4 |
| 15 | Comunicación y comprensión verbal adecuadas | I | 4 |
| Ítems | Parte II. Instrumentales semicomplejas y básicas | ||
|---|---|---|---|
| 1 | Selección adecuada de la ropa | I | 5 |
| 2 | Orientación en el propio domicilio habitual | B | 6 |
| 3 | Vestirse o desnudarse adecuadamente sin ayuda | B | 6a |
| 4 | Bañarse solo | B | 6b |
| 5 | Aseo personal (lavarse, peinarse, etc.) | B | 6c |
| 6 | Uso del retrete (WC) | B | 6c |
| 7 | Comer adecuadamente con cubiertos | B | 6d |
| 8 | Controlar la orina | B | 6d |
| 9 | Controlar la defecación | B | 6e |
| 10 | Caminar y desplazarse de un sitio a otro | B | 7 |
Av: AVD avanzada; I: AVD instrumental; B: AVD básica; GDS-FAST: Global Deterioration Scale-Functional Assessment Staging.
Como instrumentos de validación concurrente se administraron los siguientes:
Funcionales
- •
Blessed Dementia Rating Scale (BDRS)18,31: La BDRS permite evaluar la capacidad funcional del paciente con demencia. Se estructura en 3 apartados que evalúan, respectivamente: cambios en la ejecución de las AVD (puntuación de 0 al 8), cambios en los hábitos (puntuación de 0 al 9) y cambios en la personalidad-conducta (puntuación de 0 a 11). En este estudio se consideraron los resultados en los 3 apartados por separado y la suma total.
Cognitivos
- •
Memory Impairment Screen (MIS): El MIS32 es una prueba breve de memoria verbal basada en el principio de aprendizaje controlado postulado por el autor33,34. El MIS fue validado en población española en el año 200535. En este estudio se tuvo en cuenta la puntuación total, del 0 al 8, así como una puntuación ajustada por edad y escolaridad35.
- •
Span verbal: La tarea consiste en repetir secuencias cada vez mayores de dígitos en sentido directo y luego inverso. Se utilizó la versión española del test que incluye el Test Barcelona 2 (TB2) que implica que solo se realiza la administración de los dos intentos para cada span si hay error en el primer intento23. Se puntuó el último ítem realizado correctamente que equivale al span. El rango de puntuaciones era de 0 a 9 para los dígitos directos y de 0 a 8 para los inversos.
- •
Orientación en tiempo, espacio y persona del Test Barcelona 2 (TB2)23: El subtest de orientación en tiempo del TB2 permite evaluar, en un rango del 0 al 70, la orientación espacial y la orientación en persona; se puntúan ambas de 0 al 25. Para el presente estudio se tuvieron en cuenta los valores finales de cada una de las tres puntuaciones en orientación.
- •
Fluencia semántica (animales en 60s): La fluencia semántica valora la habilidad del paciente en producir palabras dentro de una categoría semántica ofrecida por el evaluador36. En este estudio se concedieron 60s para la respuesta, dándose las instrucciones descritas en el manual del TB2. Solo contabilizaron el número de respuestas correctas; las intrusiones o repeticiones no se tuvieron en cuenta37.
- •
Fluencia fonémica o formal (palabras iniciadas por el sonido P en 60s): La fluencia fonémica o formal valora la habilidad del paciente en generar palabras iniciadas por un sonido específico23. En este estudio se concedieron 60s para la respuesta, dándose las instrucciones descritas en el manual del TB2. Solo contabilizaron el número de respuestas correctas; las intrusiones o repeticiones no se tuvieron en cuenta37.
Con el objetivo de obtener uniformidad en todas las evaluaciones se siguieron ciertos procedimientos y métodos, así como los mismos criterios diagnósticos. Las dos evaluadoras eran psicólogas con experiencia en administración de test diagnóstico neuropsicológico, que habían recibido entrenamiento en común para la administración del método de evaluación. Los test se administraron de acuerdo a los procedimientos estándar descritos en los manuales correspondientes. Los sujetos fueron estudiados en una sola sesión de aproximadamente 30 minutos, por este orden: se firmaba el consentimiento informado, se recogían los datos sociodemográficos y se administraban las pruebas neuropsicológicas/funcionales, siempre en el mismo orden: BDRS; AVD-TB; MMSE; Orientación en tiempo, espacio y persona del TB2; MIS; Span verbal (como interferencia del MIS); Fluencia semántica y fonémica. Las mismas evaluadoras fueron las encargadas de la puntuación de todos los test administrados.
Análisis estadísticoEl presente trabajo es un estudio descriptivo transversal de un grupo control y diferentes grupos con diversos grados de deterioro cognitivo. El tamaño de la muestra (mínimo 11 sujetos por grupo) se determinó teniendo en cuenta una diferencia entre medias a detectar de 10 puntos, presuponiendo una desviación estándar de 8 puntos en los grupos y un máximo de pérdidas del 1%, para la obtención de un índice de significación del 5% y una potencia estadística del 80%.
El análisis estadístico realizado consistió en extraer los descriptivos de las variables sociodemográficas de toda la muestra y los descriptivos de todas las variables estudiadas para cada grupo. Se realizaron pruebas de normalidad (Shapiro-Wilk). Para las variables paramétricas se realizaron análisis de varianza (ANOVA) para probar si existían diferencias entre grupos y pruebas post-hoc (Tuckey) para explorar qué grupos diferían entre sí. Para el análisis de las variables no paramétricas se realizaron pruebas específicas, para probar si existían diferencias se utilizó la prueba de Kruskal-Wallis y para explorar qué grupos diferían entre sí se utilizó la prueba Mann-Whitney con la corrección de Bonferroni, en función del número de comparaciones realizadas en cada caso. También se realizaron correlaciones de Spearman para explorar la posible influencia del sexo de los sujetos con las puntuaciones de los ítems de la escala AVD-TB. Se estableció un nivel de significación de 0,05. Se calculó el índice de Cronbach para obtener el índice de consistencia interna y el coeficiente de correlación de Spearman para calcular la validez concurrente entre la escala y las escalas/test MMSE, BDRS, MIS, Span verbal, Orientación y Fluencia semántica y fonémica. Para determinar los valores diagnósticos se llevaron a cabo análisis de sensibilidad, especificidad y curvas ROC. Se determinaron los mejores puntos de corte con respecto a los sujetos control y DCL-A (GDS 1-2 y GDS 3), entre DCL-A y DTA leve (GDS 3 y GDS 4), entre DTA leve y DTA moderada (GDS 4 y GDS 5) y entre DTA moderada y DTA moderada-grave (GDS 5 y GDS 6), (índice de Youden). El paquete estadístico utilizado fue SPSS v.15.0.
ResultadosLa edad media y los años de escolaridad para la muestra total y los diferentes grupos se muestran en la tabla 2.
Características sociodemográficas de la muestra total y por grupos (según GDS)
| Total | GDS 1-2 | GDS 3 | GDS 4 | GDS 5 | GDS 6 | |
|---|---|---|---|---|---|---|
| Edad (años) | 78±7,35 | 73,7±5,7a | 76,4±8,5ab | 78,9±4,5ab | 82,3±7,2b | 81,4±7,7b |
| Escolaridad (años) | 8,53±5,21 | 11,1±4,4 | 11,1±5,2 | 6,5±4,1 | 5,9±6,1 | 7,0±4,4 |
| N (tamaño de la muestra/grupo) | 68 | 16 | 14 | 13 | 11 | 14 |
Los datos por grupo se muestran en M±DE.
Cuando los grupos son diferentes significativamente en esa variable, al p<0,05 (Tuckey), no comparten superíndices (a,b).
Se obtuvo un índice de Cronbach para la escala AVD-TB, teniendo en cuenta todos los ítems, de 0,975.
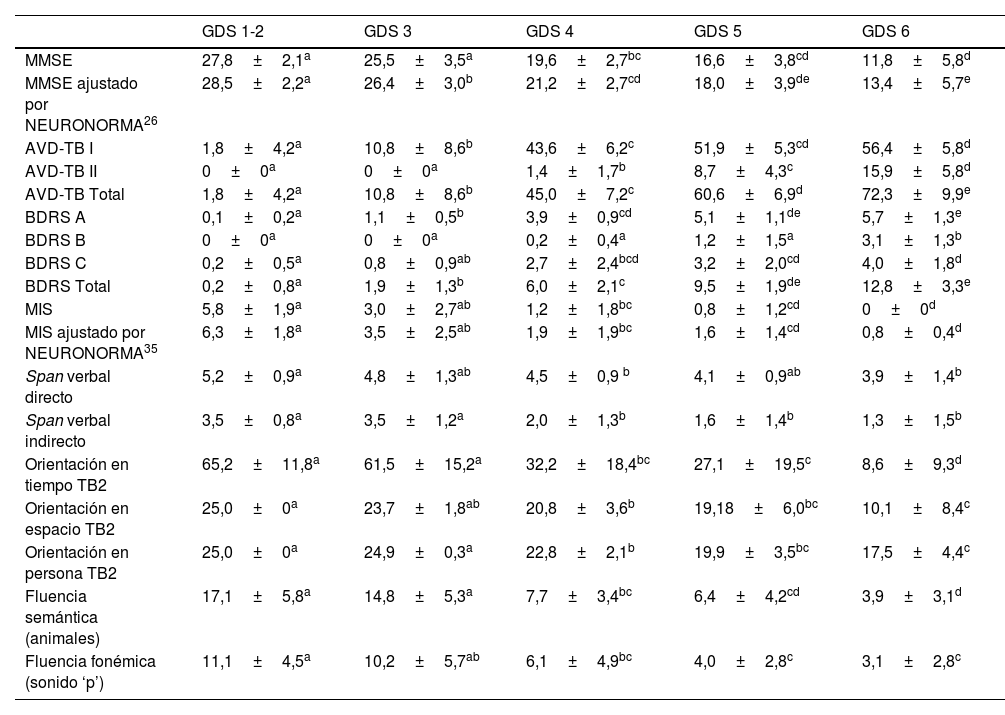
En la tabla 3 se muestran todas las puntuaciones (medias y desviaciones típicas) en los test/escalas administrados según grupo de GDS. Las diferencias estadísticamente significativas existentes entre grupos también se muestran en la tabla 3.
Puntuaciones en los test/escalas según grupo de GDS
| GDS 1-2 | GDS 3 | GDS 4 | GDS 5 | GDS 6 | |
|---|---|---|---|---|---|
| MMSE | 27,8±2,1a | 25,5±3,5a | 19,6±2,7bc | 16,6±3,8cd | 11,8±5,8d |
| MMSE ajustado por NEURONORMA26 | 28,5±2,2a | 26,4±3,0b | 21,2±2,7cd | 18,0±3,9de | 13,4±5,7e |
| AVD-TB I | 1,8±4,2a | 10,8±8,6b | 43,6±6,2c | 51,9±5,3cd | 56,4±5,8d |
| AVD-TB II | 0±0a | 0±0a | 1,4±1,7b | 8,7±4,3c | 15,9±5,8d |
| AVD-TB Total | 1,8±4,2a | 10,8±8,6b | 45,0±7,2c | 60,6±6,9d | 72,3±9,9e |
| BDRS A | 0,1±0,2a | 1,1±0,5b | 3,9±0,9cd | 5,1±1,1de | 5,7±1,3e |
| BDRS B | 0±0a | 0±0a | 0,2±0,4a | 1,2±1,5a | 3,1±1,3b |
| BDRS C | 0,2±0,5a | 0,8±0,9ab | 2,7±2,4bcd | 3,2±2,0cd | 4,0±1,8d |
| BDRS Total | 0,2±0,8a | 1,9±1,3b | 6,0±2,1c | 9,5±1,9de | 12,8±3,3e |
| MIS | 5,8±1,9a | 3,0±2,7ab | 1,2±1,8bc | 0,8±1,2cd | 0±0d |
| MIS ajustado por NEURONORMA35 | 6,3±1,8a | 3,5±2,5ab | 1,9±1,9bc | 1,6±1,4cd | 0,8±0,4d |
| Span verbal directo | 5,2±0,9a | 4,8±1,3ab | 4,5±0,9 b | 4,1±0,9ab | 3,9±1,4b |
| Span verbal indirecto | 3,5±0,8a | 3,5±1,2a | 2,0±1,3b | 1,6±1,4b | 1,3±1,5b |
| Orientación en tiempo TB2 | 65,2±11,8a | 61,5±15,2a | 32,2±18,4bc | 27,1±19,5c | 8,6±9,3d |
| Orientación en espacio TB2 | 25,0±0a | 23,7±1,8ab | 20,8±3,6b | 19,18±6,0bc | 10,1±8,4c |
| Orientación en persona TB2 | 25,0±0a | 24,9±0,3a | 22,8±2,1b | 19,9±3,5bc | 17,5±4,4c |
| Fluencia semántica (animales) | 17,1±5,8a | 14,8±5,3a | 7,7±3,4bc | 6,4±4,2cd | 3,9±3,1d |
| Fluencia fonémica (sonido ‘p’) | 11,1±4,5a | 10,2±5,7ab | 6,1±4,9bc | 4,0±2,8c | 3,1±2,8c |
AVD-TB: Escala de Actividades de la Vida Diaria del Test Barcelona; BDRS: Blessed Dementia Rating Scale; MIS: Memory Impairment Screen; MMSE: Mini Mental State Examination.
Los datos por grupo se muestran en M±DE.
En todas las variables existen diferencias significativas entre grupos al p<0,001 (ANOVA o Kruskall-Wallis).
Cuando los grupos son diferentes significativamente en esa variable al p<0,05 (Tuckey o U-Mann-Whitney con corrección de Bonferroni para comparaciones múltiples) no comparten superíndices (a,b,c,d,e).¡
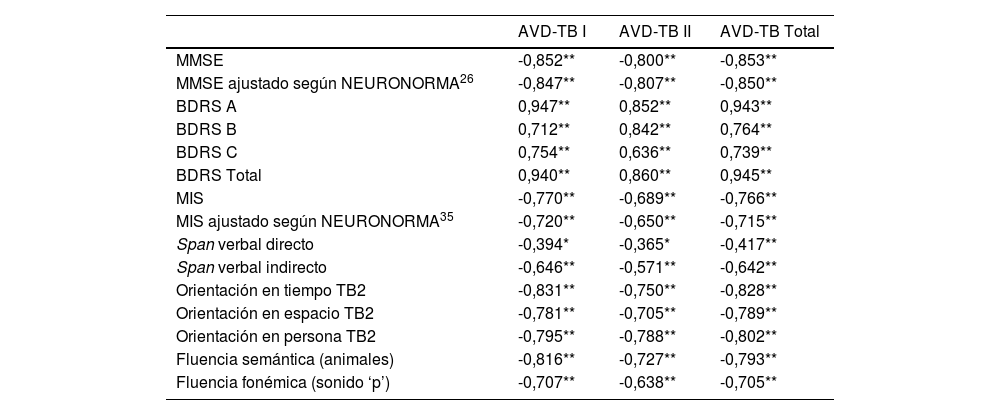
Los índices de las correlaciones existentes entre las diferentes puntuaciones de la escala AVD-TB (parte I, II y total) y los test/escalas administrados se muestran en la tabla 4. Todas las correlaciones resultaron significativas. La variable sexo correlacionó significativamente con dos ítems de la parte II de la escala: dificultades para comer (ρ=-0,255; α=0,036) y problemas para controlar la defecación (ρ=-0,242; α=0,047).
Correlaciones de la Escala AVD-TB con los test/escalas administrados
| AVD-TB I | AVD-TB II | AVD-TB Total | |
|---|---|---|---|
| MMSE | -0,852** | -0,800** | -0,853** |
| MMSE ajustado según NEURONORMA26 | -0,847** | -0,807** | -0,850** |
| BDRS A | 0,947** | 0,852** | 0,943** |
| BDRS B | 0,712** | 0,842** | 0,764** |
| BDRS C | 0,754** | 0,636** | 0,739** |
| BDRS Total | 0,940** | 0,860** | 0,945** |
| MIS | -0,770** | -0,689** | -0,766** |
| MIS ajustado según NEURONORMA35 | -0,720** | -0,650** | -0,715** |
| Span verbal directo | -0,394* | -0,365* | -0,417** |
| Span verbal indirecto | -0,646** | -0,571** | -0,642** |
| Orientación en tiempo TB2 | -0,831** | -0,750** | -0,828** |
| Orientación en espacio TB2 | -0,781** | -0,705** | -0,789** |
| Orientación en persona TB2 | -0,795** | -0,788** | -0,802** |
| Fluencia semántica (animales) | -0,816** | -0,727** | -0,793** |
| Fluencia fonémica (sonido ‘p’) | -0,707** | -0,638** | -0,705** |
AVD-TB: Escala de Actividades de la Vida Diaria del Test Barcelona; BDRS: Blessed Dementia Rating Scale18,31; MIS: Memory Impairment Screen; MMSE: Mini Mental State Examination.
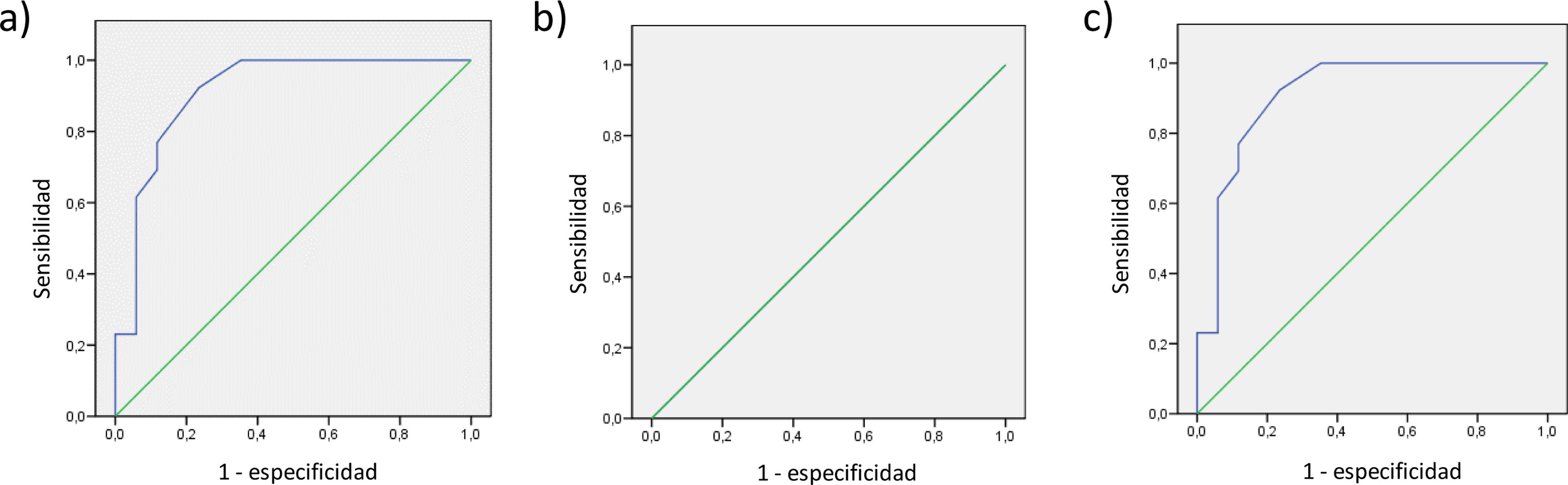
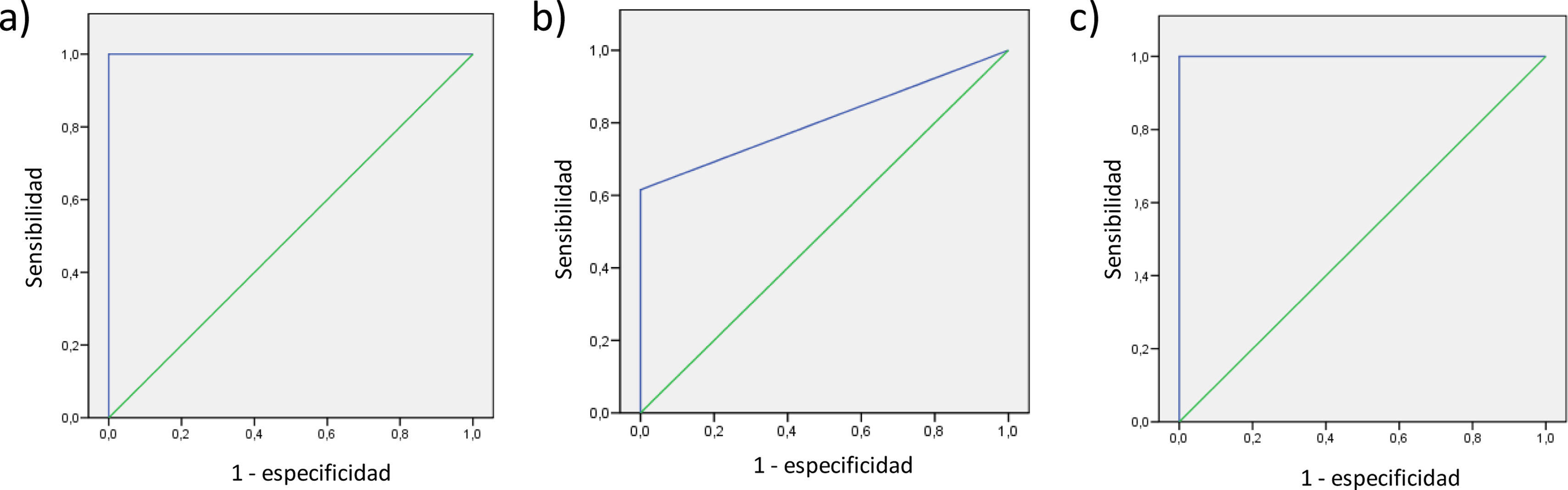
El área debajo la curva para la discriminación entre sujetos control (GDS 1-2) y DCL-A (GDS 3) fue de 0,912; 0,5 y 0,912 para la parte I, parte II y total de la escala AVD-TB, respectivamente (fig. 1). El área debajo la curva para la discriminación entre sujetos con DCL-A (GDS 3) y DTA leve (GDS 4) fue de 1; 0,808 y 1; para la parte I, II y total de la escala, respectivamente (fig. 2). El área debajo de la curva obtenida para la discriminación de DTA-leve (GDS 4) y DTA-moderada (GDS 5) fue de 0,832; 0,979 y 0,934, en las partes I, II y total de la escala, respectivamente. Y, por último, los índices para la discriminación entre DTA-moderada (GDS 5) y DTA-moderada-grave (GDS 6) fue de 0,825; 0,831; 0,893, en las partes I, II y total de la escala, respectivamente.
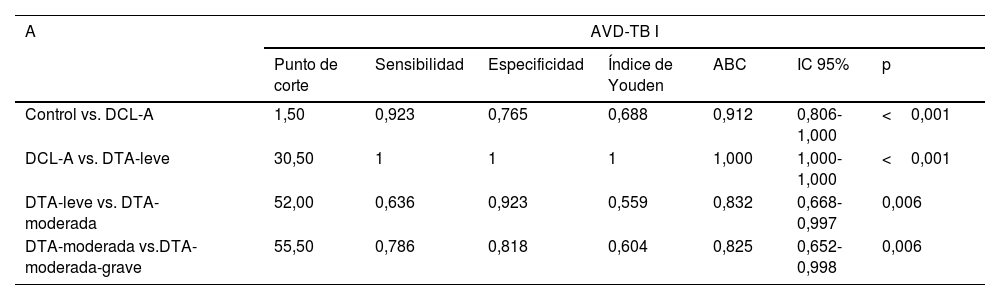
Los mejores puntos de corte obtenidos para la escala AVD-TB (partes I y II y puntuación total) para discriminar entre sujetos control y DCL-A, DCL-A y DTA-leve, DTA-leve y DTA-moderada y DTA moderada y DTA-moderada-grave, seleccionados según el índice de Youden se muestran en la tabla 5, con sus correspondientes valores de sensibilidad y especificidad.
Puntos de corte para la escala AVD-TB: parte I (A), parte II (B) y total de la escala (C)
| A | AVD-TB I | ||||||
|---|---|---|---|---|---|---|---|
| Punto de corte | Sensibilidad | Especificidad | Índice de Youden | ABC | IC 95% | p | |
| Control vs. DCL-A | 1,50 | 0,923 | 0,765 | 0,688 | 0,912 | 0,806-1,000 | <0,001 |
| DCL-A vs. DTA-leve | 30,50 | 1 | 1 | 1 | 1,000 | 1,000-1,000 | <0,001 |
| DTA-leve vs. DTA-moderada | 52,00 | 0,636 | 0,923 | 0,559 | 0,832 | 0,668-0,997 | 0,006 |
| DTA-moderada vs.DTA-moderada-grave | 55,50 | 0,786 | 0,818 | 0,604 | 0,825 | 0,652-0,998 | 0,006 |
| B | AVD-TB II | ||||||
|---|---|---|---|---|---|---|---|
| Punto de corte | Sensibilidad | Especificidad | Índice de Youden | ABC | IC 95% | p | |
| Control vs. DCL-A | - | - | - | - | 0,500 | 0,288-0,712 | 1 |
| DCL-A vs. DTA-leve | 0,50 | 0,615 | 1 | 0,615 | 0,808 | 0,629-0,986 | 0,008 |
| DTA-leve vs. DTA-moderada | 3,50 | 1 | 0,923 | 0,923 | 0,979 | 0,931-1,000 | <0,001 |
| DTA-moderada vs.DTA-moderada-grave | 10,50 | 0,786 | 0,818 | 0,604 | 0,831 | 0,670-0,993 | 0,005 |
| C | AVD-TB Total | ||||||
|---|---|---|---|---|---|---|---|
| Punto de corte | Sensibilidad | Especificidad | Índice de Youden | ABC | IC 95% | p | |
| Control vs. DCL-A | 1,50 | 0,923 | 0,765 | 0,688 | 0,912 | 0,806-1,000 | <0,001 |
| DCL-A vs. DTA-leve | 30,50 | 1 | 1 | 1 | 1,000 | 1,000-1,000 | <0,001 |
| DTA-leve vs. DTA-moderada | 55,00 | 0,818 | 0,923 | 0,741 | 0,934 | 0,838-1,000 | <0,001 |
| DTA-moderada vs. DTA-moderada-grave | 65,50 | 0,857 | 0,818 | 0,675 | 0,893 | 0,749-1,000 | 0,001 |
ABC: valor del área bajo la curva; AVD-TB: Escala de Actividades de la Vida Diaria del Test Barcelona; Control: sujetos control (GDS 1-2); DCL-A: déficit cognitivo leve amnésico (GDS 3); DTA-leve: demencia tipo Alzheimer en estadio leve (GDS 4); DTA-moderada: demencia tipo Alzheimer en estadio moderado (GDS 5); DTA-moderada-grave: demencia tipo Alzheimer en estadio moderado-grave (GDS 6); IC 95%: intervalo de confianza al 95%; p: valor de significación asintótica.
La escala AVD-TB fue inicialmente esbozada en 2012, para disponer de una escala propia, creada desde el modelo retrogenético y que permitiese diferenciar y relacionar el nivel funcional de los pacientes con su rendimiento cognitivo23. Con el objetivo de estudiar la consistencia interna y validez concurrente de esta nueva escala se administró en una muestra de voluntarios.
La muestra, que se estratificó siguiendo los niveles de la escala GDS, no difería en ninguna de las variables sociodemográficas estudiadas excepto en la edad de los sujetos (el grupo GDS 1-2 era diferente en esta variable respecto a los grupos GDS 5 y 6). En el presente estudio se observó, como era esperable, que a medida que aumentaba el GDS la edad también lo hacía; este hallazgo no aparece reflejado en muchos de los estudios donde se utiliza el GDS para estratificar grupos (habitualmente porque estos análisis no aparecen); aunque sí se ha encontrado esta relación, a mayor GDS mayor edad de la muestra, en algunos estudios con mayores muestras de sujetos15,38 y, de hecho, si las demencias evolucionan, es lógico pensar que a más edad más avanzada es la fase de la demencia.
No se observaron relaciones entre el sexo de los sujetos y las puntuaciones de la parte I en la escala AVD-TB, pareciendo no existir ítems sexo-dependientes al menos en la evaluación de las AVD avanzadas e instrumentales complejas. En este sentido, el presente instrumento excluye uno de los inconvenientes de la mayoría de escalas20,39. Esto se consiguió incluyendo suficientes ejemplos de las diferentes actividades típicamente realizadas por cada uno de los sexos (p.ej. en aficiones, se incluye «baile, jugar a cartas, cine, jardinería») y en el caso de que la actividad no disponga de actividades paralelas en el sexo opuesto, que se pueda puntuar como «nunca lo ha hecho» computando como la media del resto de ítems sí contestados.
El valor de consistencia interna observada en este estudio para la escala fue de 0,975 (α de Cronbach), un alto grado de consistencia interna entre los ítems de la escala (>0,95 nivel alto)40, por encima de escalas validadas en nuestro contexto, como la ADLQ-SV (Activities of daily living questionnaire, versión española) con un valor de 0,8841 o la ADFACS (Alzheimer's disease functional assessment and change scale, versión española) con un 0,9516, aunque ligeramente por debajo de la B-ADL (Bayer-Activities of Daily Living Scale), con un 0,98424.
Los grupos control y DCL-A diferían significativamente en las puntuaciones de MMSE ajustado, BDRS (parte A y puntuación total), y la escala AVD-TB. Estos resultados indican que las puntuaciones de la escala AVD-TB difieren entre sujetos sanos y pacientes con DCL-A, especialmente en la parte I de la escala, en la que se valoran las actividades avanzadas e instrumentales complejas de la vida diaria. En este sentido, los presentes resultados van en la misma dirección que los de otros autores que ya apuntaron a que los pacientes con DCL sí presentan alteraciones en algunas AVD instrumentales pero no en las AVD básicas42, siendo la escala AVD-TB sensible para detectar estas diferencias. Los pacientes con DCL, aunque son independientes funcionalmente, tienen más dificultades para llevar a cabo las tareas más complejas, es decir, les puede requerir más tiempo y esfuerzo realizar tareas como manejar asuntos financieros o planificar viajes, por ejemplo. También se observaron diferentes puntuaciones entre el grupo DCL-A y el grupo DTA-leve en la escala BDRS (parte A y total), MMSE, orientación en tiempo, fluencia semántica y en todas las puntuaciones de la escala AVD-TB (parte I, II y puntuación total). Entre los grupos DTA-leve y DTA-moderada solo difirieron las puntuaciones del BDRS (total) y las de la escala AVD-TB (parte II y total), siendo estas pruebas las únicas de todas las administradas que alcanzaron a detectar diferencias entre estos grupos. Así pues, entre todos los test/escalas aplicadas, la única que fue capaz de diferenciar entre todos los grupos fue la escala AVD-TB (índice total). La escala AVD-TB, como un conjunto, es útil para todos los estadios de la enfermedad, a diferencia de la mayoría de escalas funcionales que acostumbran a ser solo sensibles en fases tempranas o avanzadas16.
Se obtuvieron correlaciones estadísticamente significativas entre la escala AVD-TB y todos los test/escalas administradas (tabla 4). Así, en términos de validez concurrente, la escala AVD-TB presenta fuertes correlaciones (mayor del 0,9) con la escala funcional más ampliamente utilizada en nuestro contexto como es la BDRS, así como una correlación estrecha con el MMSE. Estos datos confirman que la escala AVD-TB cumple con el objetivo por el que se creó, valorar de manera fiel el funcionamiento funcional y cognitivo de los sujetos23. La escala BDRS se ha utilizado en una amplia clase de estudios, demostrando capacidad de detección y de gradación (hasta cierto punto)31 y el MMSE es el instrumento breve más ampliamente utilizado para valorar el deterioro cognitivo y, aunque siendo un clásico, aún se sigue utilizando hoy en día, siendo esencial para establecer puntos de comparación en grados similares de afectación14. El hecho de que la escala AVD-TB obtenga fuertes correlaciones con el test cognitivo MMSE apoya la afirmación de Gold43, que para una ejecución correcta de las AVD instrumentales se necesita un amplio rango de procesos cognitivos íntegros.
El punto de corte de la escala AVD-TB para discriminar entre sujetos sanos y DCL-A, puntuación en el total de la escala, fue de 1,50 (con una sensibilidad de 0,92 y una especificidad de 0,76), representando una capacidad discriminativa discreta. Este resultado puede ser debido a la dificultad en captar las alteraciones sutiles, incluso con la parte I de la escala AVD-TB, que aparecen en los pacientes con DCL. Estos pacientes se mantienen independientes y las dificultades o la normalidad en realizar tareas complejas pueden ser una apreciación subjetiva. Los valores de la escala AVD-TB entre estos grupos, controles y DCL-A, son próximas y, además, la media de estos grupos tiene alta desviación estándar. Esta heterogeneidad dentro de los grupos controles y pacientes DCL-A podría enmascarar las diferencias en la escala entre estos dos grupos. En este sentido sería necesario explorar los resultados de esta escala en muestras mayores para confirmar esta hipótesis. Teniendo esto en cuenta no es de extrañar que esta sea una de las dificultades evidenciadas en los estudios de validación de otras escalas funcionales16.
El punto de corte para discriminar entre los grupos de pacientes DCL-A y DTA-leve fue de 30,50 (con una sensibilidad de 1 y especificidad de 1). Este punto de corte tiene una excelente capacidad discriminativa entre estos dos grupos, siendo la parte I la parte clave de la escala para esta capacidad discriminativa. Finalmente, para discriminar entre los grupos de pacientes DTA leve y DTA-moderada es más útil observar las puntuaciones de la parte II de la escala, ya que el punto de corte en la parte II de 3,5 permite discriminar con una alta sensibilidad y especificidad (1 de sensibilidad y 0,92 de especificidad). Para diferenciar entre los grupos de pacientes DTA-moderada y DTA-moderada-grave la puntuación de la escala total nos aporta el mejor índice de Youden para el punto de corte 65,50 (con 0,857 de sensibilidad y 0,818 de especificidad).
Estos puntos de corte permiten diferenciar no solo entre los casos leves de la DTA15,24, siendo una escala mucho más breve que otras escalas de similares características desde el modelo retrogenético7.
Cabe destacar algunas limitaciones del presente estudio como son el tamaño de la muestra, el hecho de que los diagnósticos utilizados son diagnósticos eminentemente clínicos, a falta de datos biológicos confirmatorios y el hecho de que no se realizaron estudios de fiabilidad test-retest ni estudios interevaluador, considerándose estas limitaciones como orientaciones de futuras investigaciones.
ConclusionesLa valoración del estado funcional de los pacientes con demencia es de suma importancia ya que permite capturar, indirectamente, los aspectos cognitivos y físicos de la enfermedad44. Las escalas funcionales a menudo se aplican una vez el déficit cognitivo ya ha sido detectado y la DTA ya ha sido diagnosticada, aunque algunos autores llegan a evidenciar que los déficits a nivel cognitivo y de memoria en particular podrían aparecer después de los funcionales45, demostrando la gran importancia del estado funcional y de instrumentos válidos para su valoración.
La escala AVD-TB ha mostrado una buena fiabilidad clasificatoria, permitiendo diferenciar entre pacientes con DCL-A y DTA-leve, con un punto de corte de 30,50 de gran utilidad clínica. La parte II de la escala AVD-TB permite diferenciar entre DTA-leve y DTA-moderada con un punto de corte de 3,50 en esa subescala. La escala AVD-TB ha mostrado una alta consistencia interna y validez concurrente al estar altamente correlacionada con otras pruebas funcionales y cognitivas, resultando una buena herramienta para la evaluación funcional, ayudando a entender mejor la DTA para su evaluación y tratamiento.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNinguno.
A Neus Rivera por su ayuda logística, a Gonzalo Sánchez-Benavides por sus consejos estadísticos y a todos los voluntarios por su participación desinteresada.