La deshidratación en pacientes con ictus isquémico agudo (IIA) se relaciona con un mal pronóstico. Nuestro objetivo es investigar si la deshidratación se asocia con la circulación colateral (CC) y el pronóstico funcional en pacientes con IIA tratados mediante trombectomía mecánica (TM).
MétodoEstudio prospectivo multicéntrico de pacientes con IIA de circulación anterior tratados con TM (enero 2020-junio 2021). La deshidratación se evaluó con dos fórmulas: osmolaridad plasmática y relación urea/creatinina (U/C). La CC se cuantificó con un software automatizado (Brainomix Ltd.) en la angiotomografía computarizada basal. La medida de resultado principal fue la asociación entre CC (expresada numéricamente como el porcentaje de diferencia entre hemisferios) y deshidratación (osmolaridad ≥295mmol/L, U/C ≥80). Las medidas secundarias incluyeron la discapacidad al alta y a los tres meses, evaluadas mediante la escala de Rankin modificada (mal pronóstico: 3-6). Se realizaron análisis multivariables de regresión logística y ordinal.
ResultadosSe incluyeron 260 pacientes. El 65,8% presentaron deshidratación según la osmolaridad y el 2,9% según U/C. No hubo asociación entre CC y deshidratación [71% en deshidratados vs. 73% en no deshidratados; p=0,875]. Un 64,3% de los pacientes deshidratados frente a un 46,7% de los no deshidratados tuvieron un mal pronóstico al alta (p=0,026). En el análisis de regresión logística multivariable, la deshidratación fue un predictor independiente de mal pronóstico al alta (OR 2,50; p=0,011) y a los tres meses (OR 2,27; p=0,046).
ConclusionesLa deshidratación al ingreso se asocia a un mal pronóstico en los pacientes con IIA tratados con TM, pero no se relaciona con la CC.
Dehydration in patients with acute ischemic stroke (AIS) is associated with poor outcome. Our aim is to investigate whether dehydration is associated with collateral circulation (CC) and functional outcome in patients with AIS treated with mechanical thrombectomy (MT).
MethodProspective multicenter study of patients with anterior circulation AIS treated with MT (January 2020–June 2021). Dehydration was assessed with two formulas: plasma osmolarity and urea/creatinine (U/C) ratio. CC was quantified with an automated software (Brainomix Ltd.) on baseline computed tomography angiography. The primary outcome was the association between CC (expressed numerically as the percentage of change between hemispheres) and dehydration (osmolarity ≥295mmol/L, U/C ≥80). Secondary outcomes included disability at discharge and at three months of follow-up, assessed using the modified Rankin scale (poor outcome: 3–6). Multivariable logistic and ordinal regression analyses were performed.
ResultsTwo hundred sixty patients were included. 65.8% were dehydrated according to osmolarity and 2.9% according to U/C. There was no association between CC score and dehydration [71% in dehydrated vs 73% in non-dehydrated; p=0.875]. 64.3% of dehydrated patients vs. 46.7% of non-dehydrated patients had a poor outcome at discharge (p=0.026). In multivariable logistic regression analysis, dehydration was an independent predictor of poor outcome at discharge (OR 2.50; p=0.011) and at three months of follow-up (OR 2.27; p=0.046).
ConclusionsDehydration on admission is associated with poor outcome in patients with AIS treated with MT, but it is not related to CC.
El déficit de agua corporal total, habitualmente denominado deshidratación, es una condición frecuente en los pacientes hospitalizados y se ha asociado de forma consistente con una mayor morbimortalidad1,2.
La deshidratación es común en los pacientes con ictus isquémico agudo (IIA), con una frecuencia muy variable que oscila entre un 8,9-70%3,4, probablemente debido a las diversas técnicas utilizadas para su detección y los distintos umbrales establecidos para su diagnóstico. La deshidratación en el IIA se ha asociado a un mayor deterioro neurológico5, una mayor mortalidad y un peor pronóstico funcional3,4,6–9. Sin embargo, ningún estudio ha analizado previamente si el impacto de la deshidratación persiste en pacientes con IIA tratados con trombectomía mecánica (TM).
Los efectos deletéreos de la deshidratación en el pronóstico del ictus se han atribuido, por un lado, a un mayor riesgo de complicaciones secundarias (infecciones, trombosis venosa profunda o delirio) y, por otro lado, al aumento de la viscosidad sanguínea y al descenso del volumen intravascular, los cuales conducen a la hemoconcentración y la reducción del flujo sanguíneo cerebral4,7. Teniendo en cuenta este mecanismo fisiopatológico, se ha supuesto teóricamente que la deshidratación disminuiría la circulación colateral (CC)7,10.
Al mantener la perfusión en el área de penumbra isquémica y mejorar las tasas de recanalización, una buena CC contribuye a una menor mortalidad y un mejor pronóstico funcional en los pacientes tratados con TM10,11. El grado de CC es muy variable entre los pacientes con un IIA. El envejecimiento, los niveles de creatinina elevados y la hiperglucemia, todos ellos asociados con la deshidratación, se han relacionado también con una peor CC12,13, lo que sugiere una posible relación entre la deshidratación y la CC.
El objetivo de este estudio es investigar la relación entre la deshidratación y la CC en pacientes con IIA de circulación anterior que han sido tratados con TM. La hipótesis del trabajo es que los pacientes deshidratados tendrán una peor CC, y este hecho conducirá a un peor pronóstico funcional. Dado que el estado de hidratación es un factor fácilmente modificable, podría tratarse de un nuevo objetivo terapéutico para mejorar y mantener la CC en la fase aguda del de ictus.
Material y métodosDiseño del estudioSe trata de un estudio observacional, prospectivo y multicéntrico de pacientes con IIA en la circulación anterior tratados con TM (subestudio del proyecto COLISEUM -PI19/00859-, subvencionado por el Instituto de Salud Carlos III). Se reclutaron pacientes de seis hospitales españoles terciarios de ictus, entre enero de 2020 y junio de 2021. El estudio fue aprobado por el Comité de Ética de cada centro participante. Los pacientes o sus representantes legales dieron su consentimiento por escrito para participar.
Población del estudioLos criterios de inclusión fueron: 1) edad ≥18 años; 2) IIA secundario a oclusión en la arteria cerebral media, segmentos M1 y M2, o en la arteria carótida interna terminal, con o sin oclusión extracraneal, demostrada por angiotomografía computarizada (TC); 3) angio-TC realizada dentro de las primeras 24 horas tras el inicio del ictus (incluidos los ictus del despertar); 4) puntuación previa en la escala de Rankin modificada (mRS) de 0 a 2; 5) tratamiento con TM; y 6) consentimiento escrito para participar firmado por el paciente o un representante legal.
Los criterios de exclusión fueron: 1) pacientes con resultados de laboratorio no disponibles a su llegada; y 2) imposibilidad para evaluar el estado de la CC debido a artefactos de movimiento o cualquier otro problema técnico que imposibilitara su evaluación.
Se recogieron las siguientes variables al ingreso: variables demográficas (edad y sexo), factores de riesgo vascular (hipertensión, diabetes mellitus, dislipemia, ictus previo, fibrilación auricular), variables terapéuticas (medicaciones previas –antiagregantes, anticoagulantes y diuréticos-, terapia de reperfusión del ictus –TM directa o fibrinólisis y TM combinadas–), variables métricas (tiempo hasta el ingreso, tiempo puerta-punción) y etiología del ictus (según los criterios del Trial of Org 10172 in Acute Stroke Treatment [TOAST]14). Los datos de laboratorio se obtuvieron de la analítica de sangre al ingreso en urgencias. El estado funcional previo y la gravedad del ictus fueron evaluados en el momento del ingreso por neurólogos certificados mediante la escala mRS y la escala National Institute of Health Stroke Scale (NIHSS), respectivamente.
Durante el seguimiento, se recogieron las siguientes variables de resultado: hemorragia intracerebral sintomática (definida como un empeoramiento neurológico de cuatro puntos o más en la NIHSS asociado a una hemorragia intracraneal), puntuación de la NIHSS y de la mRS al alta y a los tres meses después de una entrevista presencial realizada por investigadores locales que no conocían el estado de hidratación o de la CC.
Evaluación de la deshidrataciónLa deshidratació se evaluó mediante dos fórmulas diferentes a partir de las muestras de sangre obtenidas al ingreso.
- 1.
Osmolaridad plasmática (Osm). Se calculó siguiendo la fórmula de Khajuria y Krahn15, como se recomienda en una reciente declaración de consenso multidisciplinar sobre deshidratación1.
pOsm=1,86 x ([Na+] + [K+]) + 1,15 x [glucosa] + [urea] + 14 (todo en mmol/L)
Los sujetos con una Osm ≥ 295mmol/L fueron clasificados como deshidratados.
- 2.
Relación urea/creatinina (U/C). Los pacientes con una U/C ≥ 80 fueron clasificados como deshidratados, tal y como se ha refrendado en otros trabajos1,3,6.
La angio-TC se adquirió de forma monofásica. La TC basal, angio-TC, TC de perfusión (en algunos pacientes) y la angiografía convencional fueron evaluadas por neurorradiólogos locales ciegos al estado de hidratación.
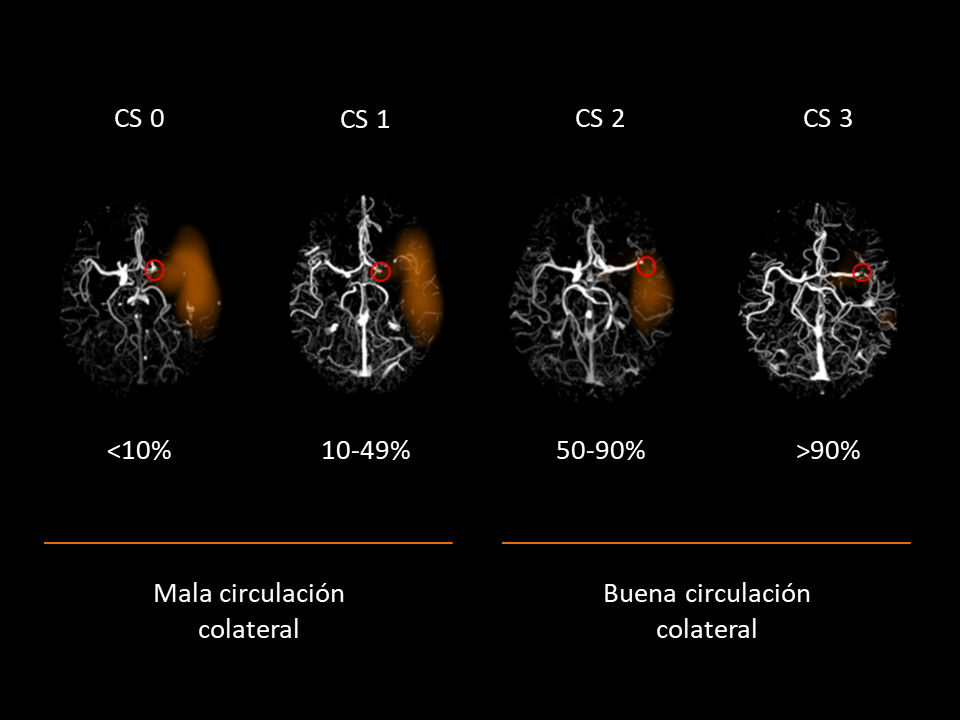
El grado de CC en el territorio de la arteria cerebral media se cuantificó mediante un software automatizado dentro del e-STROKE SUITE (Brainomix Ltd., Oxford, United Kingdom). La puntuación de la colateralidad resultante se basa en la variación de CC entre el hemisferio cerebral afecto y el hemisferio no afecto. Comprende una puntuación numérica de 0 a 100%. La puntuación de las colaterales también se clasifica en cuatro grupos, de 0 a 3. Cuando se dicotomiza, los grupos 0 y 1 se consideran como una mala CC, y los grupos 2 y 3 como una buena CC (fig. 1).
Otras variables radiológicas recogidas fueron: Alberta Stroke Protocol Programme Early CT Score (ASPECTS), arteria ocluida en la angio-TC, volumen del core isquémico (definido como un flujo sanguíneo cerebral relativo <30% del tejido normal en la TC-perfusión), mismatch ratio (definido como la relación entre el tejido hipoperfundido –tejido con un tiempo máximo >6 segundos– y el volumen del core) y la puntuación de la escala Thrombolysis In Cerebral Infarction (TICI).
ResultadosLa medida de resultado principal fue la CC medida en la angio-TC basal y expresada numéricamente como el porcentaje de cambio entre los hemisferios afecto y no afecto (0-100%). Las medidas de resultado secundarias incluyeron la CC dicotomizada: mala CC (grupos 0-1) o buena CC (grupos 2-3); la discapacidad al alta y a los tres meses de seguimiento (mal pronóstico si mRS 3-6).
Análisis estadísticoLas variables descriptivas continuas se presentaron como medias y desviaciones estándar (DE) o medianas y rango intercuartílico (RIQ) si no tenían una distribución normal. Las variables categóricas se expresaron como recuentos y porcentajes. Las diferencias en el porcentaje de CC entre los pacientes deshidratados y los no deshidratados se compararon mediante la prueba t de Student. Las diferencias en la distribución categórica de CC entre los grupos se estudiaron mediante la prueba de la χ2.
Para estudiar la medida de resultado secundaria, se dicotomizó el pronóstico funcional en: buen pronóstico (mRS 0-2) o mal pronóstico (mRS 3-6) y se estudió la asociación entre las variables y la probabilidad de presentar un mal pronóstico funcional al alta y a los tres meses de seguimiento. Se realizaron análisis univariables entre grupos mediante la prueba de la t de Student o la prueba de la suma de rangos de Wilcoxon (cuando se requería una prueba no paramétrica) para las variables continuas, y la prueba de la χ2 para las variables categóricas. A continuación, se realizó un análisis de regresión logística multivariable para predecir el mal pronóstico funcional mediante un modelo de regresión por pasos hacia atrás (stepwise backward regression model) a partir de un modelo inicial que incluía todas las variables que mostraban una tendencia a la significación (p<0,1).
También se llevó a cabo un shift analysis utilizando la prueba de suma de rangos de Wilcoxon no apareada para demostrar las diferencias en la distribución de la puntuación mRS al alta y a los tres meses de seguimiento entre los pacientes deshidratados y los no deshidratados. Se calculó la common odds ratio (OR) de empeorar 1 punto en la mRS con la presencia de deshidratación. A continuación, se realizó un análisis de regresión ordinal multivariable utilizando el mismo enfoque que en el análisis de regresión logística anterior.
Los modelos multivariables se ajustaron a los posibles factores de confusión. Un efecto de confusión se definió como un cambio absoluto>10% en los coeficientes de regresión al introducir la variable en el modelo.
La significación estadística para todos los análisis se fijó en 0,05 (a dos bandas). Todos los análisis se realizaron con Stata v.15 (Texas, EE. UU.).
ResultadosSe reclutaron 301 pacientes con un IIA debido a una oclusión de gran vaso en la circulación anterior, 260 de los cuales fueron tratados con TM. Pudimos evaluar la deshidratación en 181 pacientes a través de la Osm y en 208 a través de la relación U/C (véase la figura suplementaria 1. Diagrama de flujo).
Influencia de la deshidratación (evaluada mediante la osmolaridad plasmática) en la circulación colateral y el pronóstico
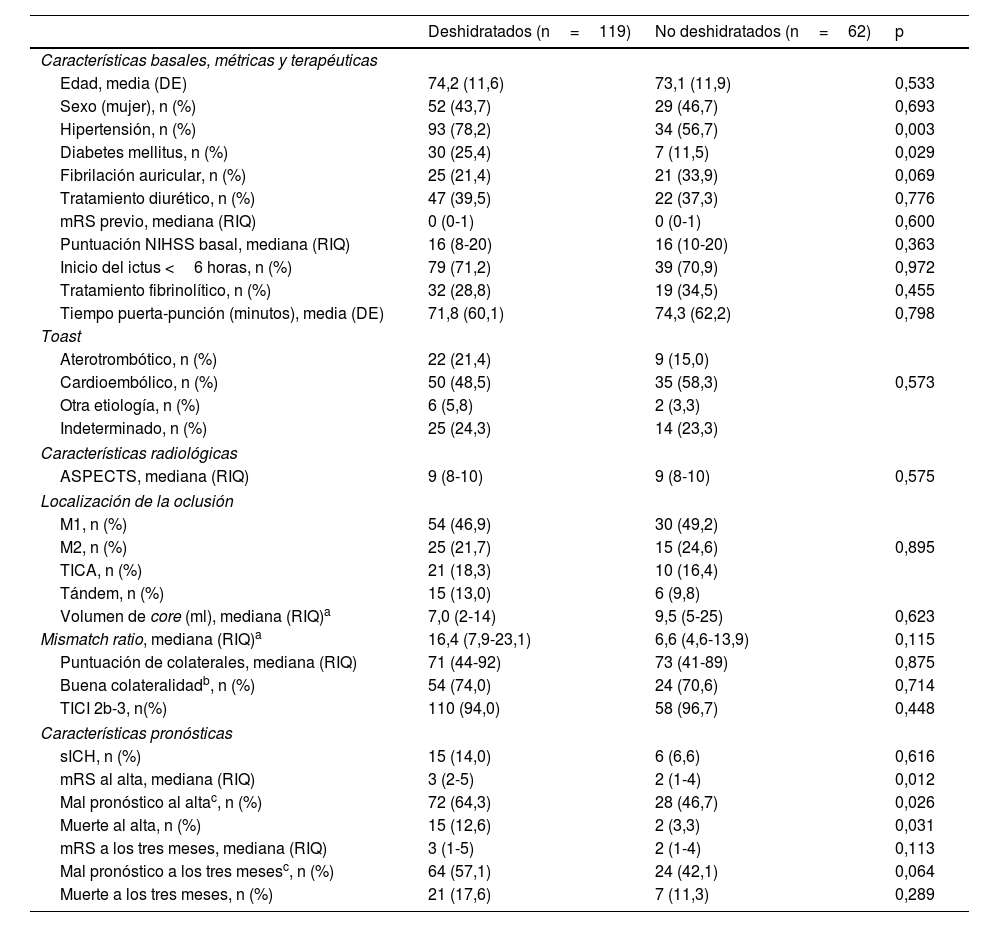
Ciento diecinueve pacientes (65,8%) cumplieron criterios de deshidratación al ingreso. Su edad media fue de 74,2 años (DE 11,6) y 52 (43,7%) eran mujeres. Las características basales, métricas, radiológicas, terapéuticas y pronósticas de los pacientes según su estado de hidratación se muestran en la tabla 1.
Variables asociadas a la deshidratación (deshidratados si la osmolaridad plasmática ≥295 mmol/L)
| Deshidratados (n=119) | No deshidratados (n=62) | p | |
|---|---|---|---|
| Características basales, métricas y terapéuticas | |||
| Edad, media (DE) | 74,2 (11,6) | 73,1 (11,9) | 0,533 |
| Sexo (mujer), n (%) | 52 (43,7) | 29 (46,7) | 0,693 |
| Hipertensión, n (%) | 93 (78,2) | 34 (56,7) | 0,003 |
| Diabetes mellitus, n (%) | 30 (25,4) | 7 (11,5) | 0,029 |
| Fibrilación auricular, n (%) | 25 (21,4) | 21 (33,9) | 0,069 |
| Tratamiento diurético, n (%) | 47 (39,5) | 22 (37,3) | 0,776 |
| mRS previo, mediana (RIQ) | 0 (0-1) | 0 (0-1) | 0,600 |
| Puntuación NIHSS basal, mediana (RIQ) | 16 (8-20) | 16 (10-20) | 0,363 |
| Inicio del ictus <6 horas, n (%) | 79 (71,2) | 39 (70,9) | 0,972 |
| Tratamiento fibrinolítico, n (%) | 32 (28,8) | 19 (34,5) | 0,455 |
| Tiempo puerta-punción (minutos), media (DE) | 71,8 (60,1) | 74,3 (62,2) | 0,798 |
| Toast | |||
| Aterotrombótico, n (%) | 22 (21,4) | 9 (15,0) | |
| Cardioembólico, n (%) | 50 (48,5) | 35 (58,3) | 0,573 |
| Otra etiología, n (%) | 6 (5,8) | 2 (3,3) | |
| Indeterminado, n (%) | 25 (24,3) | 14 (23,3) | |
| Características radiológicas | |||
| ASPECTS, mediana (RIQ) | 9 (8-10) | 9 (8-10) | 0,575 |
| Localización de la oclusión | |||
| M1, n (%) | 54 (46,9) | 30 (49,2) | |
| M2, n (%) | 25 (21,7) | 15 (24,6) | 0,895 |
| TICA, n (%) | 21 (18,3) | 10 (16,4) | |
| Tándem, n (%) | 15 (13,0) | 6 (9,8) | |
| Volumen de core (ml), mediana (RIQ)a | 7,0 (2-14) | 9,5 (5-25) | 0,623 |
| Mismatch ratio, mediana (RIQ)a | 16,4 (7,9-23,1) | 6,6 (4,6-13,9) | 0,115 |
| Puntuación de colaterales, mediana (RIQ) | 71 (44-92) | 73 (41-89) | 0,875 |
| Buena colateralidadb, n (%) | 54 (74,0) | 24 (70,6) | 0,714 |
| TICI 2b-3, n(%) | 110 (94,0) | 58 (96,7) | 0,448 |
| Características pronósticas | |||
| sICH, n (%) | 15 (14,0) | 6 (6,6) | 0,616 |
| mRS al alta, mediana (RIQ) | 3 (2-5) | 2 (1-4) | 0,012 |
| Mal pronóstico al altac, n (%) | 72 (64,3) | 28 (46,7) | 0,026 |
| Muerte al alta, n (%) | 15 (12,6) | 2 (3,3) | 0,031 |
| mRS a los tres meses, mediana (RIQ) | 3 (1-5) | 2 (1-4) | 0,113 |
| Mal pronóstico a los tres mesesc, n (%) | 64 (57,1) | 24 (42,1) | 0,064 |
| Muerte a los tres meses, n (%) | 21 (17,6) | 7 (11,3) | 0,289 |
Mal pronóstico si mRS 3-6.
ASPECTS: Alberta Stroke Protocol Programme Early CT Score; DE: desviación estándar; mRS: modified Rankin Scale; n: número; NIHSS: National Institutes of Health Stroke Scale; RIQ: rango intercuartílico; sICH: hemorragia intracranial sintomática;TICA: arteria carótida interna terminal; TICI: Thrombolysis In Cerebral Infarction; TOAST: Trial of Org 10172 in Acute Stroke Treatment.
La evaluación de la CC se encontraba disponible en 107 pacientes. La mediana de la puntuación numérica de la CC fue del 71% en el grupo de pacientes deshidratados frente al 73% en el grupo de pacientes no deshidratados (p=0,875). La proporción de pacientes con una buena colateralidad (grupos 2 y 3) fue similar entre los pacientes deshidratados y los no deshidratados (74,0% vs. 70,6%, p=0,714). Asimismo, el 26,0% frente al 23,5% presentaron un grado de colateralidad excelente (grupo 3) respectivamente (p=0,782).
Tampoco hubo diferencias significativas en los parámetros de perfusión cerebral (core isquémico o mismatch ratio).
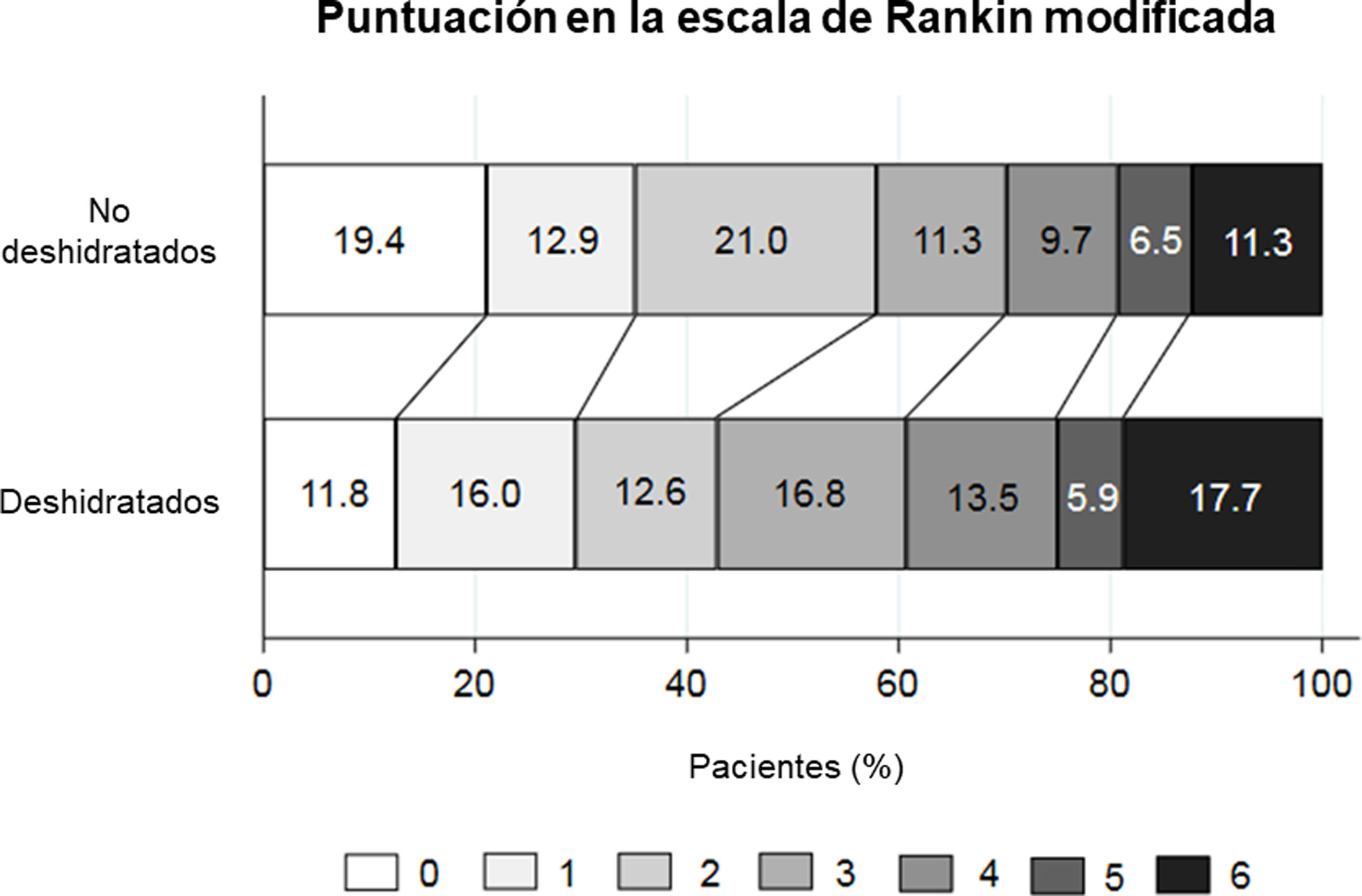
Deshidratación y pronósticoDisponíamos de la puntuación mRS al alta en 172 pacientes. En el análisis dicotomizado, el 64,3% de los pacientes deshidratados frente al 46,7% de los no deshidratados presentaron un mal pronóstico al alta (p=0,026).
La comparación entre los pacientes que presentaron un buen pronóstico frente a un mal pronóstico al alta se detalla en la tabla suplementaria 1.
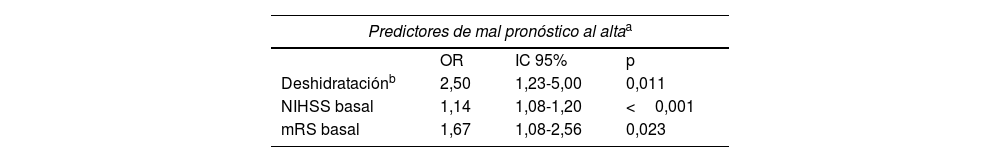
En el análisis de regresión logística multivariable, la deshidratación se asoció significativamente con un mal pronóstico al alta con una OR de 2,5 (p=0,011) (tabla 2). En el shift analysis, los pacientes deshidratados mostraron una peor puntuación mRS al alta en comparación con los no deshidratados (mediana de 3 vs. 2; p=0,012). En el análisis de regresión logística ordinal multivariable ajustado por la puntuación mRS y NIHSS basal, la common OR de empeorar 1 punto en la mRS al alta para los pacientes deshidratados fue de 2,27 (p=0,005).
Análisis de regresión logística multivariable sobre predictores de mal pronóstico (mRS 3-6)
| Predictores de mal pronóstico al altaa | |||
|---|---|---|---|
| OR | IC 95% | p | |
| Deshidrataciónb | 2,50 | 1,23-5,00 | 0,011 |
| NIHSS basal | 1,14 | 1,08-1,20 | <0,001 |
| mRS basal | 1,67 | 1,08-2,56 | 0,023 |
| Predictores de mal pronóstico a los tres meses de seguimientoc | |||
|---|---|---|---|
| OR | IC 95% | p | |
| Deshidrataciónb | 2,27 | 1,02-5,00 | 0,046 |
| NIHSS basal | 1,16 | 1,09-1,25 | <0,001 |
| mRS basal | 2,56 | 1,56-4,35 | <0,001 |
| sICH | 16,67 | 3,03-100 | 0,001 |
Resultados de un modelo de selección por pasos hacia atrás a partir de un modelo inicial que incluye todas las variables que muestran una tendencia (p<0,1) en el análisis bivariante y, a continuación, se eliminan las variables que muestran un valor p>0,1 en cada iteración.
Tras un ajuste adicional por hipertensión y diabetes (variables no equilibradas entre los grupos) la deshidratación persistió asociada a la probabilidad de obtener un resultado desfavorable al alta con una OR=2,63, IC 95% 1,27-5,55; p=0,010.
Tras un ajuste adicional para la hipertensión y la diabetes (variables no equilibradas entre los grupos) se observó una fuerte tendencia estadística para la asociación entre la deshidratación y la probabilidad de lograr un resultado desfavorable a los tres meses de seguimiento (OR=2,22; IC del 95%: 0,96-5,26; p=0,063).IC: intervalo de confianza; mRS: modified Rankin Scale; NIHSS: National Institutes of Health Stroke Scale; OR: odds ratio; sICH: hemorragia intracraneal sintomática.
A los tres meses de seguimiento, la deshidratación siguió asociada de forma independiente a un mal pronóstico en el análisis de regresión logística multivariable, con una OR de 2,27 (p=0,046) (tabla 2). Los pacientes deshidratados también mostraron una tendencia hacia un peor pronóstico funcional en el shift analysis (mediana de la puntuación mRS 3 vs. 2, p=0,113), sin alcanzar la significación estadística (fig. 2).
Influencia de la deshidratación (evaluada mediante la relación U/C) en la circulación colateral y el pronóstico.
Seis pacientes (2,9%) cumplieron criterios de deshidratación. Su edad media fue de 75,3 (DE 7,3) y 3 (50,0%) eran mujeres.
Deshidratación y circulación colateralLa mediana de la puntuación de la CC fue de 64% (RIQ 37-94) en el grupo de pacientes deshidratados y del 72% (RIQ 43-91) en el grupo de no deshidratados (p=0,897). Tampoco hubo diferencias estadísticamente significativas entre pacientes deshidratados y no deshidratados en relación con una buena o excelente colateralidad.
Deshidratación y pronósticoLa mediana de la puntuación mRS al alta en los pacientes deshidratados fue de 5 (4-5) frente a 3 (1-4) en los no deshidratados (p=0,144) y de 5 (1-5) frente a 2 (1-4) a los tres meses (p=0,324). Solo uno de los pacientes deshidratados tuvo un buen pronóstico al alta. Sin embargo, no hubo una asociación significativa entre la deshidratación y la puntuación mRS al alta o a los tres meses en el shift analysis.
DiscusiónEn este estudio prospectivo y multicéntrico, se confirmó la asociación de la deshidratación con un mal pronóstico funcional en los pacientes con IIA de la circulación anterior tratados con TM. Los pacientes deshidratados mostraron 2,5 veces más posibilidades de tener un mal pronóstico al alta y esta asociación continuó siendo significativa a los tres meses de seguimiento. Sin embargo, el peor pronóstico en los pacientes deshidratados no se asoció con una peor CC.
Utilizando la fórmula de la Osm, el 65,8% de los pacientes con ictus tratados con TM cumplieron criterios de deshidratación; en cambio, mediante la relación U/C se detectó deshidratación únicamente en el 2,9%. La proporción de pacientes deshidratados mediante la fórmula de la Osm en este estudio es comparable con los resultados de los estudios previos sobre la frecuencia de deshidratación en pacientes con ictus (que oscila entre el 8,9 y el 70%), en los que la deshidratación se evaluó a través de distintas técnicas y utilizando diferentes umbrales diagnósticos, con grados de precisión muy variables3,4. Un reciente consenso multidisciplinar1 ha determinado que la Osm es el principal parámetro homeostático para medir el estado de hidratación. Sin embargo, la U/C y el cociente nitrógeno ureico (BUN)/creatinina en sangre han sido los marcadores de laboratorio más utilizados en los estudios previos y solo cuatro de ellos han evaluado la deshidratación en pacientes con ictus a través de la Osm9,16–18. La relación U/C no es un marcador específico del estado de hidratación y puede verse aumentada en estados hipercatabólicos (sepsis, cirugía mayor), ingesta elevada de proteínas, hemorragia digestiva alta o tras la administración de corticosteroides1. Por todo ello, la evaluación de la deshidratación mediante la U/C resulta imprecisa y, por lo tanto, los resultados del presente trabajo basados en la Osm, reflejan una información más concisa sobre la frecuencia de la deshidratación al ingreso en los pacientes con IIA tratados con TM. El elevado porcentaje de pacientes deshidratados podría justificarse por la edad avanzada de la muestra, el extenso uso de tratamientos diuréticos y la alta tasa de pacientes diabéticos.
En el actual estudio, el grado de colateralidad no mostró ninguna correlación con la deshidratación. En un estudio anterior, unicéntrico y retrospectivo, en el que participaron 87 pacientes con ictus y oclusión vascular en el segmento M1 de la arteria cerebral media, se encontró una asociación inversa entre la deshidratación y la CC19. A diferencia del presente estudio, en el trabajo de Chang et al., la deshidratación se midió en los pacientes a su llegada, sin embargo, el desarrollo de la CC se evaluó al tercer día del inicio del ictus en las oclusiones de M1 persistentes. Además, se excluyeron los sujetos tratados con terapia de reperfusión y la deshidratación se determinó mediante el cociente BUN/creatinina. Así pues, la diferencia temporal entre la evaluación de ambas variables podría cuestionar su asociación. La CC en el contexto de un IIA se encarga de mantener la perfusión en el área de penumbra isquémica, lo que preserva temporalmente la integridad celular10. Es por ello que el mayor impacto de la CC corresponde a la fase aguda del ictus y una asociación teórica con la deshidratación debería evaluarse en ese momento.
La influencia negativa de la deshidratación en el pronóstico funcional y la mortalidad del ictus ha sido ampliamente demostrada en estudios previos, incluso en pacientes que han recibido terapia de reperfusión fibrinolítica20. Sin embargo, ningún estudio previo había analizado la asociación entre la deshidratación y el pronóstico en pacientes con IIA tratados con TM. Los resultados del trabajo actual mostraron una asociación más sólida con la deshidratación y el pronóstico al alta que a los tres meses. Estos resultados son coherentes con estudios anteriores9, que sugieren una influencia de la deshidratación en la mortalidad a corto plazo, que no se observa en el seguimiento a un año. Dicha asociación podría explicarse por su relación con las complicaciones intrahospitalarias y la mayor duración de la estancia media hospitalaria8.
Los mecanismos que subyacen al efecto de la deshidratación sobre el pronóstico del ictus se han atribuido también a la hiperviscosidad y al menor flujo sanguíneo cerebral7. En el presente estudio, no se encontró una asociación entre la deshidratación y el flujo colateral medido en la angio-TC basal. Una posible explicación es que la eficacia de la CC en la perfusión tisular no solo depende de la circulación macrovascular, sino también de la microvascular10. Aunque la angio-TC se ha utilizado ampliamente para evaluar la colateralidad (principalmente debido a su amplia disponibilidad) y ha demostrado repetidamente una asociación entre la CC y el pronóstico11,21, es una técnica incapaz de evaluar la CC microvascular. Por lo tanto, una hipótesis podría ser que el efecto de la deshidratación en el flujo sanguíneo cerebral se debe a su papel en la microcirculación y, por ello, no puede evaluarse con técnicas como la angio-TC. Siguiendo esta hipótesis, se llevó a cabo una comparación del volumen del core del infarto y del mismatch ratio entre pacientes deshidratados y no deshidratados, pero no se encontraron diferencias. No obstante, la TC de perfusión solo estaba disponible en un pequeño subgrupo de pacientes (n=50).
El principal punto fuerte del actual estudio es su diseño multicéntrico y prospectivo, con un análisis de la deshidratación y la CC ciegos y realizados de forma centralizada. Sin embargo, tiene varias limitaciones. En primer lugar, aunque la Osm es el biomarcador recomendado para evaluar la deshidratación, se midió mediante una fórmula y no directamente. No obstante, la fórmula seleccionada para medir la Osm, ha mostrado una sensibilidad del 85% y una especificidad del 59%22. En segundo lugar, la CC se evaluó mediante la angio-TC basal, que no se considera el método de imagen más preciso y no puede evaluar la circulación microvascular. Sin embargo, la CC se midió con un programa informático automatizado y validado (Brainomix Ltd.) que ha demostrado una excelente sensibilidad y especificidad23. En tercer lugar, no se recopiló la ingesta de líquidos ni el estado de hidratación durante el ingreso hospitalario, lo que pudo haber variado durante la estancia hospitalaria y haber condicionado el pronóstico3,17. Por último, no se reportaron las complicaciones secundarias asociadas a la deshidratación que también podrían haber tenido un papel en el pronóstico, como las infecciones o la trombosis venosa profunda.
Los resultados actuales reafirman la importancia de la deshidratación como factor de riesgo modificable para el pronóstico de los pacientes con ictus. Pese a ello, la influencia de la terapia de hidratación en el IIA no está establecida. El tratamiento de hidratación con solución salina después de un IIA en pacientes deshidratados, diagnosticados mediante la relación BUN/creatinina, se ha asociado significativamente con un menor deterioro neurológico precoz24, una menor tasa de infección y una menor estancia hospitalaria25. Sin embargo, cuando se evaluó su papel en el pronóstico, solo mostró una tendencia hacia un mejor pronóstico en los pacientes con ictus lacunares en comparación con controles históricos26. Por lo tanto, se necesitan más estudios, probablemente con una selección más precisa de los biomarcadores de deshidratación, para determinar el papel de la terapia de hidratación en los pacientes con ictus.
En conclusión, los resultados actuales sugieren que la deshidratación al ingreso es un factor de riesgo frecuente que se asocia a un peor pronóstico funcional en los pacientes con IIA tratados con TM y que esta asociación no está relacionada con la CC.
Aprobación éticaEl comité de ética del Hospital de la Santa Creu i Sant Pau revisó y aprobó este estudio (IIBSP-COL-2019-120).
Financiación- -
Redes de Investigación Con Objetivos de Resultados en Salud (RICORS) RD21/0006/0006, FEDER (Fondo Europeo de Desarollo Regional) y beca PI19/00859, Instituto de Salud Carlos III, Ministerio de Ciencia e Innovación (Gobierno de España).
- -
Marina Guasch-Jiménez (CM20/00056) y Daniel Guisado-Alonso (CM18/00065) recibieron una beca de investigación Río Hortega del Instituto de Salud Carlos III, Ministerio de Ciencia e Innovación (Gobierno de España).