La cirugía funcional constituye una alternativa terapéutica para los pacientes con enfermedad de Parkinson (EP). Es conocido que tanto la subtalamotomía como la palidotomía bilaterales provocan complicaciones neurológicas, por lo que en las técnicas ablativas no resulta recomendable el abordaje bilateral del GPi en la EP y se sugiere tener precaución con la indicación de la subtalamotomía bilateral. Nuestro grupo ha perfeccionado la técnica quirúrgica para la ablación del núcleo subtalámico buscando disminuir la aparición de las discinesias inducidas por la cirugía y obtener mejor efecto terapéutico, por lo que el abordaje del NST en un segundo tiempo quirúrgico en el hemisferio opuesto al que se realizó previamente la palidotomía, evitaría las complicaciones derivadas de la palidotomía bilateral y puede ser una alternativa segura para los pacientes aun cuando estos presenten cuadros de discinesias. Nos propusimos evaluar el efecto y la seguridad de la combinación de la lesión del GPi y del NST en hemisferios cerebrales opuestos en pacientes con EP.
MétodoSe realizó un estudio retrospectivo que incluyó a todos los pacientes operados en el CIREN en un periodo de 22 años, a los que se les realizó una palidotomía contralateral al hemicuerpo más afectado; seguida de una subtalamotomía del hemisferio opuesto en un segundo tiempo quirúrgico. El efecto sobre la condición neurológica fue evaluado mediante la sección III de la escala de MDS-UPDRS. Se evaluó la seguridad según escala de efectos adversos y escala de Clavien y Dindo.
ResultadosAmbas intervenciones quirúrgicas tuvieron un impacto positivo en el tratamiento farmacológico de los pacientes reduciéndose significativamente las dosis de L-dopa. Se observó una mejoría significativa en la condición motora de los pacientes con relación a las discinesias, así como a la rigidez, la bradicinesia y el temblor.
ConclusionesLa combinación palidotomía/subtalamotomía mostró ser una alternativa efectiva para el tratamiento de la EP complicada, capaz de permitir un mejor control motor y una reducción de la dosis de L-dopa con una baja tasa de complicaciones; permitiendo además evitar las complicaciones derivadas de la palidotomía y de la subtalamotomía bilaterales, demostrando ser una alternativa segura para los pacientes aun cuando estos presenten cuadros de discinesias.
Functional neurosurgery constitutes a therapeutic alternative for patients with Parkinson's disease (PD). It is known that both bilateral subthalamotomy and bilateral pallidotomy cause neurological complications, so in ablative techniques a bilateral approach to the GPi is not recommended in PD and caution is suggested with the indication of bilateral subthalamotomy. Our group has refined the surgical technique for the ablation of the subthalamic nucleus seeking to reduce the appearance of dyskinesias induced by surgery and obtain a better therapeutic effect, so the approach to the NST in a second surgical procedure in the opposite hemisphere to the one performed previously pallidotomy, would avoid the complications derived from bilateral pallidotomy and can be a safe alternative for patients even when they present symptoms of dyskinesias. We set out to evaluate the effect and safety of the combination of GPi and NST lesion in opposite cerebral hemispheres in PD patients.
MethodA retrospective study was carried out that included all patients operated on at the CIREN in a period of 22 years, who underwent a pallidotomy contralateral to the most affected hemibody; followed by a subthalamotomy of the opposite hemisphere in a second surgical procedure. The effect on the neurological condition was evaluated using section III of the MDS-UPDRS scale. Safety was evaluated according to the adverse effects scale and the Clavien and Dindo scale.
ResultsBoth surgical interventions had a positive impact on the patients’ pharmacological treatment, significantly reducing the doses of L-dopa. A significant improvement was observed in the motor condition of the patients in relation to dyskinesias, as well as rigidity, bradykinesia and tremor.
ConclusionsThe pallidotomy/Subthalamotomy combination showed to be an effective alternative for the treatment of complicated PD, capable of allowing better motor control and a reduction in the dose of L-Dopa with a low rate of complications; It also allows to avoid complications derived from bilateral pallidotomy and subthalamotomy, proving to be a safe alternative for patients even when they present symptoms of dyskinesias.
La enfermedad de Parkinson (EP) es la segunda enfermedad neurodegenerativa más prevalente en el mundo después de la enfermedad de Alzheimer1-3. Se caracteriza por manifestaciones no motoras4,5 y motoras de comienzo unilateral, que evoluciona de forma bilateral y asimétrica, con un mayor deterioro en el lado del comienzo6,7. En los estadios tempranos de la enfermedad, sus síntomas y signos son en gran medida aliviados por la levodopa (L-DOPA), la cual constituye el tratamiento sintomático más eficaz8,9. Sin embargo, con el uso prolongado de este medicamento aparecen complicaciones motoras como fluctuaciones y discinesias; alteraciones de la marcha, de la postura y del equilibrio que reducen drásticamente la calidad de vida de los pacientes10-13.
La cirugía funcional constituye actualmente una alternativa para pacientes con EP y una herramienta imprescindible para el control de las complicaciones motoras que no responden adecuadamente a los tratamientos farmacológicos14,15.
La progresión bilateral de los síntomas y signos motores justifica la necesidad de abordar ambos hemisferios. En la actualidad, la estimulación cerebral profunda constituye la técnica quirúrgica de preferencia, ya que puede realizarse con seguridad de forma bilateral en un solo tiempo quirúrgico, asociándose con una mejoría motora significativamente mayor que la obtenida con las intervenciones unilaterales16-20. Sin embargo, está limitada a países con accesos a esta tecnología y no está exenta de limitaciones en relación con su alto costo, complejidad y presencia de complicaciones propias del implante de los electrodos,21 por lo que en la actualidad las técnicas ablativas continúan siendo una alternativa para el tratamiento de esta afección22.
Durante los últimos años, el NST y el GPi han sido las 2dianas quirúrgicas elegidas para mejorar la condición motora de los pacientes con EP avanzada23,24. En la selección del blanco quirúrgico se debe tener en cuenta los síntomas predominantes en el enfermo y el hemicuerpo de mayor afección (que generalmente coincide con el lado de comienzo de la enfermedad). Con frecuencia aparece reportado en la literatura el empleo de la subtalamotomía en pacientes en los que predomina un cuadro rígido-acinético25,26; sin embargo, la mayoría de los autores son cautelosos al emplear esta técnica en pacientes con grados severos de discinesias27-29. Por otro lado, el GPi se ha abordado en la primera cirugía en pacientes con complicaciones motoras secundarias a la medicación dopaminérgica como son las discinesias30,31.
Tanto la subtalamotomía bilateral como la colocación de estimuladores cerebrales profundos en el NST de ambos hemisferios ha sido empleada con relativo éxito en pacientes con EP32,33. No obstante, existen reportes en la literatura que muestran la aparición de complicaciones relacionadas con la subtalamotomía bilateral26,34, como lo es la posibilidad de desarrollar discinesias o hemicorea balismo en la segunda cirugía, incluso se reportan trastornos del habla (volumen)35,36 y de las funciones cognitivas aunque con baja incidencia37. Por otro lado, es conocido que la palidotomía bilateral provoca severas complicaciones relacionadas fundamentalmente con el habla y con funciones cognitivas38,39. Esto ha propiciado que en las técnicas ablativas, el abordaje bilateral del GPi se ha descartado en la EP y se prefiera para el tratamiento de la distonía, corea y de otras discinesias40-43.
Considerando estas 2observaciones, no resulta recomendable en la EP la realización de la palidotomía bilateral y se sugiere tener precaución con la indicación de la subtalamotomía bilateral. Nuestro grupo ha trabajado en el perfeccionamiento de la cirugía funcional, refinando la técnica quirúrgica para la ablación del núcleo subtalámico, persiguiendo mejor efecto terapéutico y la disminución de la aparición de las discinesias inducidas por la cirugía44,45. De tal manera, que el abordaje del NST en un segundo tiempo quirúrgico en el hemisferio opuesto al que se realizó previamente la palidotomía, evitaría las complicaciones derivadas de la palidotomía bilateral y puede ser una alternativa segura para los pacientes aun cuando estos presenten cuadros de discinesias. Basado en los argumentos anteriores surgió la idea de este trabajo donde se evaluó el efecto terapéutico y la seguridad de la combinación de la palidotomía-subtalamotomía en hemisferios cerebrales opuestos, partiendo de que no hay evidencia científica al respecto.
Pacientes y métodoSe realizó un estudio retrospectivo, descriptivo-correlacional con diseño longitudinal. El universo del estudio estuvo constituido por todos los pacientes con diagnóstico de EP idiopática según el Banco de Cerebros del Reino Unido46, a los que se les realizó una palidotomía de un hemisferio en un primer tiempo quirúrgico y una subtalamotomía del hemisferio opuesto en una segunda cirugía, en el Servicio de Neurocirugía del CIREN en un periodo de 22 años.
Criterios de inclusión
- 1.
Pacientes con diagnóstico de EP idiopática según criterios del Banco de Cerebros del Reino Unido tratados mediante cirugía funcional bilateral.
- 2.
Pacientes con palidotomía de un hemisferio y subtalamotomía del hemisferio opuesto, realizadas en diferentes tiempos quirúrgicos, en el Servicio de Neurocirugía del CIREN.
Criterios de exclusión
- 1.
Pacientes que presenten, además, otra cirugía relacionada con la ablación de ganglios basales, por ejemplo, talamotomía VIM.
- 2.
Pacientes a los que se le realizó la subtalamotomía en el primer tiempo quirúrgico.
Se colocó el marco estereotáctico (ESTEREOFLEX, Tecnosuma, La Habana, Cuba) bajo condiciones de antisepsia y anestesia local, logrando el máximo paralelismo posible entre el plano del marco estereotáctico y el plano intercomisural (comisura anterior y comisura posterior). Esto se logró posicionando el marco perpendicular al plano medio-sagital y evitando la inclinación coronal del marco al igual que se intenta lograr una inclinación sagital del anillo correspondiente a un ángulo de entre 10 y 15° entre este y la línea imaginaria órbito-meatal.
Se tomaron imágenes estereotácticas de tomografía axial computarizada (TAC) después de fijar el localizador estereotáctico sobre el marco y acoplar el mismo a la mesa del tomógrafo. Se realizaron cortes tomográficos axiales de 1 mm, previa administración intravenosa de contraste iodado. Las imágenes de TAC fueron tomadas en cortes axiales, perpendiculares a la camilla, sin inclinación del gantry, cortes de 1mm de espesor sin solapamiento entre imágenes, FOV de 250mm y matriz de 512×512. Los equipos empleados fueron SOMATON Sensationcardiac 64 y SOMATON Definition 128 (Siemens, Erlangen, Alemania). Las imágenes se exportaron a una computadora personal ubicada en el salón de operaciones.
Para la planificación de coordenadas y trayectorias hacia el blanco se utilizó el sistema de planificación STASSIS (CIREN, La Habana, Cuba)47,48. Se identificaron la comisura anterior (CA) y posterior (CP) y se ubicó el plano anatómico que correspondió con la mejor definición de ambas. De no coincidir estas en el mismo corte axial se reconstruyeron las imágenes. Una vez que los puntos CA y CP fueron localizados y marcados, se añadieron los cortes digitalizados del atlas estereotáctico de Schaltenbrand and Wahren (SW) a las imágenes de TAC, escalados tras ajuste automático en relación con la distancia intercomisural del paciente, definiéndose entonces el borde de los ventrículos, el tálamo-capsular y el pálido-capsular.
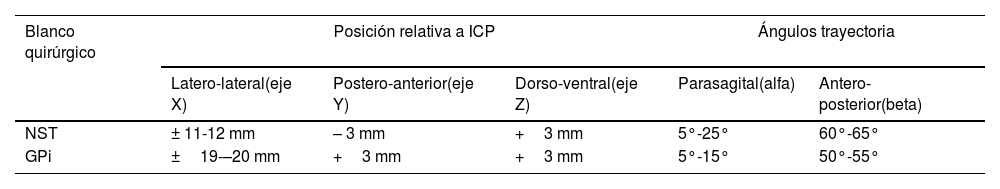
La localización del blanco quirúrgico y de la trayectoria hacia él se realizó según lo establecido en la tabla 1. La posición del blanco se estableció relativo al punto medio intercomisural (ICP). Los 2grados de libertad para definir la trayectoria se consideró (alfa) respecto al plano medio sagital (evitando el sistema ventricular) y (beta) ángulo anteroposterior respecto al plano horizontal intercomisural. Las coordenadas iniciales para identificar la región del NST fueron partiendo de ICP, 3mm posterior, 3mm inferior y de 11 a 12mm lateral. Las trayectorias con el semimicroelectrodo se planificaron y realizaron con un ángulo parasagital (alfa) de 5 a 25 grados45 y un ángulo de 60 a 65 grados en dirección anteroposterior (beta) con respecto al plano CA-CP.49
La localización del blanco por registro multiunitario se realizó introduciendo la cánula con semimicroelectrodo bipolar concéntrico (UK 100 Unique Medical Co. Ltd, Tokyo, Japón; Ø 0,4mm e impedancia 100 KΩ o equivalente). La actividad neuronal multiunitaria se registró y visualizó con la ayuda del programa informático para registro y procesamiento digital NDRS (Neurosurgical Deep Recording System, CIREN, La Habana, Cuba)50,51. Se avanzó cuidadosamente bajo visión y audición de la actividad eléctrica multiunitaria desde un punto 20mm superior al blanco teórico e intentando reconocer con ayuda del micromanipulador las diferentes estructuras antes de su arribo al blanco. Se realizaron subsecuentes trayectos para establecer los límites entre sustancia gris y sustancia blanca y definir además la representación somatotópica del blanco seleccionado.
Identificación del GPiEl avance en cada trayectoria de registro se realizó cada 1mm en la vecindad del blanco y terminó cuando se identificó el tracto óptico o se alcanzó 5mm por debajo del núcleo. Se realizaron desplazamientos en el diámetro apropiado desde el resultado del primer trayecto hasta encontrar la secuencia de estructuras presentes (pálido lateral, pálido medial, SN parte reticulata o tracto óptico). A partir de ese momento el desplazamiento fue postero-lateral o antero-medial de 45° respecto a la línea media hasta que se logró localizar la porción más posterior y lateral del núcleo. La estimulación eléctrica en algunos de los trayectos en la mitad inferior del núcleo pálido medial permitió evaluar la distancia a la cápsula interna. Durante el registro multiunitario, la identificación del GPi se efectuó con base en la actividad eléctrica, considerando las variaciones de amplitud, lo que permitió la identificación de estructuras adyacentes congruentes con la trayectoria según el ángulo de acceso al blanco.
MicroestimulaciónEfectuada con el mismo electrodo de registro y se utilizó para la identificación de las vías motoras provenientes de corteza cerebral.
MacroestimulaciónSe realiza con equipo generador de lesiones ELECKTA y con electrodos de punta activa de 4mm. Los parámetros utilizados fueron de 60Hz con ancho de pulso de 0,5ms en modo corriente controlada (mA) aumentando de forma creciente y manual desde los 0mA hasta un máximo de 5mA o hasta obtener efectos adversos. Se considera como umbral de seguridad a una estimulación de 2mA o mayor, por debajo de los cuales se reevaluó la localización de la lesión.
Lesión del área localizada y seleccionadaLas coordenadas finales para la definición del área de lesión se basaron fundamentalmente en los hallazgos neurofisiológicos con mínimas correcciones ante efectos que sugieran proximidad a la cápsula interna por estimulación.
Identificación del NSTEl avance en cada trayectoria de registro, se realizó cada 1mm en la proximidad del blanco y terminó cuando se sobrepasó el incremento de la actividad multiunitaria que regresó al nivel de los registros de sustancia blanca o se observó una caída de la actividad eléctrica integrada de 2/3 del máximo del núcleo. Se realizaron desplazamientos anteriores o posteriores buscando el borde anterior y posterior del núcleo en su eje antero-posterior y, con base en los mejores registros, nos desplazarnos a 45° hacia el extremo lateral y posterior del núcleo. Se realizó estimulación eléctrica en este trayecto desde un punto ubicado en la mitad superior del núcleo; esta estimulación es muy importante para el cálculo de la distancia a las fibras motoras provenientes de corteza motora. Durante el registro multiunitario la identificación del NST se efectuó con base en los siguientes parámetros:
- -
Actividad eléctrica aumentada, caracterizada por una gran amplitud de descarga, siempre mayor a la actividad talámica y la sustancia negra parte reticulata.
- -
Registro secuencial de las siguientes estructuras según avanza el electrodo: tálamo anterior o corona radiada, zona incierta, NST, SN parte reticulata o sustancia blanca.
- -
Las variaciones de amplitud de las descargas tanto como la distancia en milímetro de la actividad eléctrica integrada, fueron factores determinantes del límite de la estructura.
Efectuada con el mismo electrodo de registro siendo utilizada para la identificación de las vías motoras provenientes de la corteza cerebral.
MacroestimulaciónSe realizó con equipo generador de lesiones ELECKTA y con electrodos de punta activa de 2mm. Los parámetros utilizados fueron de 60Hz con ancho de pulso de 0,5ms en modo corriente controlada (mA) aumentando de forma creciente y manual desde los 0mA hasta un máximo de 5mA o hasta obtener efectos adversos. Se consideró como umbral de seguridad a una estimulación de 2mA o mayor, por debajo de los cuáles se reevaluó la localización de la lesión.
Lesión del área localizada y seleccionadaLas coordenadas finales para la definición del área de lesión se basaron fundamentalmente, en los hallazgos neurofisiológicos con mínimas correcciones ante efectos que sugieran proximidad a la cápsula interna por estimulación.
Lesión del GPiSe completaron 2lesiones por radiofrecuencia con electrodo de 1,1mm de diámetro y 4mm de punta activa; a fin de cubrir en la medida de lo posible, los puntos de mayor actividad eléctrica. La primera lesión fue la más posterior y lateral comenzando en el borde inferior del núcleo y a 1,5 o 2mm del tracto óptico. La segunda lesión se realizó a 2,5mm anterior y 2,5mm medial de la primera lesión, con igual estrategia de ubicación. Ambas quedaron ubicadas en la región ventral del núcleo. La temperatura máxima fue de 70 u 80 °C. Se llegó a 80 grados cuando con 70 grados no se alcanzó el efecto terapéutico deseado.
Lesión del NSTSe completaron 2lesiones por radiofrecuencia con electrodo de 1,1mm de diámetro y 2mm de punta activa, a fin de cubrir en la medida de lo posible los puntos de mayor actividad eléctrica, de manera que queden de la mitad del núcleo hacia arriba y sobresaliendo del núcleo entre 0,5 y 1mm en la dirección del trayecto de lesión. La primera lesión fue la más postero-lateral y la segunda a 2mm anterior y 2mm medial respecto a la primera. La temperatura máxima fue de 70 u 80 °C. Se llegó a 80 grados cuando con 70 grados no se alcanzó el efecto terapéutico deseado.
Este procedimiento se llevó a cabo bajo estricto control clínico, con el paciente despierto, evaluando permanentemente respuestas positivas, tomando como base la rigidez, así como efectos adversos, principalmente motores. Al término de la lesión se cerró por planos cuidando la hemostasia.
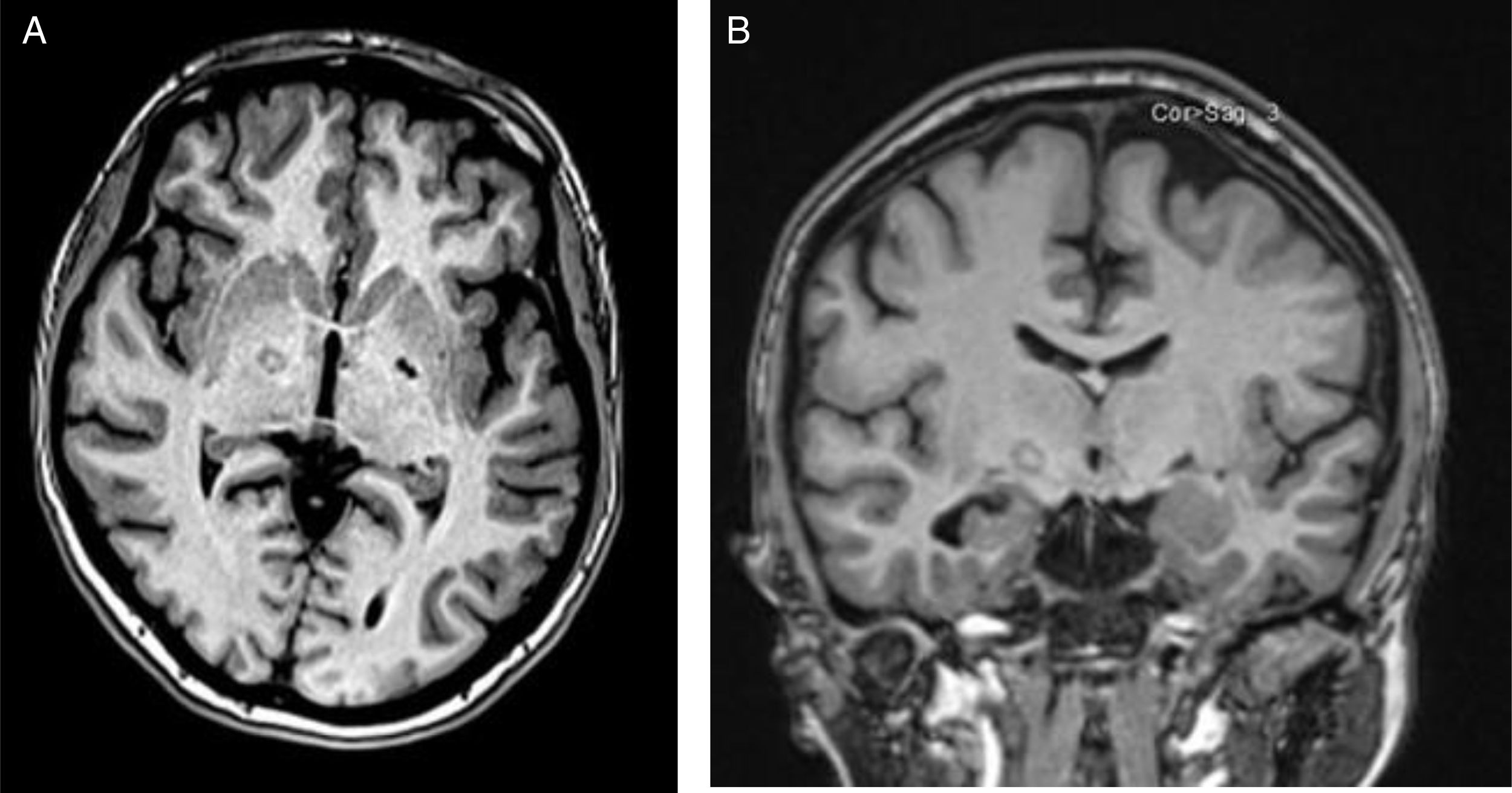
A todos los pacientes se les realizó estudio de evaluación posquirúrgica de RM, las cuáles fueron tomadas en equipo de 1.5 T Siemens (resonancia magnética Magneton Aera de 1.5 T, Siemens, Alemania) (fig. 1).
- -
Intensidad de los síntomas motores del paciente evaluados mediante la sección III de la escala MDS-UPDRS52.
- -
Identificar las complicaciones funcionales inmediatas relacionadas con la lesión de los núcleos.
- -
Identificar las complicaciones quirúrgicas que se pueden presentar desde la colocación del marco estereotáctico, durante y después de la cirugía relacionadas con la misma53.
Los resultados de todas las evaluaciones clínicas e instrumentales realizadas se recogieron a partir del Programa NDRS, programa de planificación STASSIS y las historias clínicas y se trasladaron a una base de datos integrada, diseñada para el análisis estadístico.
Métodos de procesamiento y análisis de la informaciónSe realizó análisis descriptivo de cada una de las variables que forman parte de las escalas de evaluación para cada una de las variables respuesta y su comportamiento en cada uno de los pacientes atendiendo a los factores de interés formados.
Para evaluar el efecto de la intervención sobre la condición neurológica de estos fue estimado el porcentaje de mejoría.
Las comparaciones de variables antes y después del proceder quirúrgico se realizaron mediante: test de Student, mientras que para las correlaciones se empleó el test de Spearman.
Consideraciones éticasDebido a las características de la investigación, no fue necesario el consentimiento informado por escrito de los familiares y pacientes, ya que se trata de un estudio retrospectivo, cuya información se toma a partir de datos recolectados de la historia clínica del paciente, que no afecta la privacidad de los individuos. No obstante, los pacientes dieron su consentimiento para el tratamiento quirúrgico en cada ocasión de forma independiente. Los resultados se presentan de manera resumida con todos los casos incluidos.
ResultadosEn un periodo de 22 años fueron intervenidos quirúrgicamente con una palidotomía de un hemisferio y una subtalamotomía del hemisferio opuesto un total de 45 pacientes. De estos solo 19 pacientes cumplieron con los criterios de inclusión de este estudio. Todos los pacientes incluidos eran portadores de EP idiopática según los criterios del Banco de Cerebros del Reino Unido, con respuesta positiva a la levodopa y que mostraban complicaciones motoras, de manera que del total de pacientes intervenidos en el CIREN durante el período evaluado fueron retirados del estudio 24, en los que no fue posible encontrar toda la información requerida de las historias clínicas o aquellos a los que se le realizó una subtalamotomía en el primer tiempo quirúrgico.
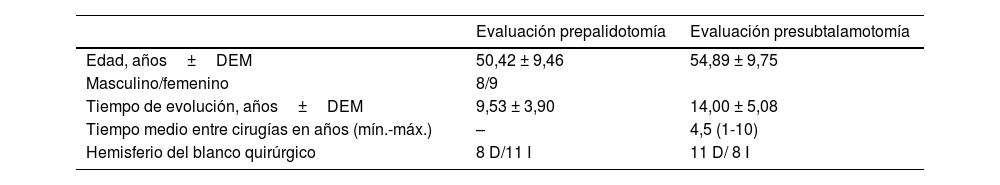
La edad promedio de los pacientes previa a la palidotomía fue de 50 años. El paciente operado más joven tenía 32 años y los más longevos 67 años. No se observó predominio de un sexo sobre otro, siendo solamente de uno la diferencia entre mujeres y hombres. En los pacientes operados predominó el lado derecho como el hemicuerpo de inicio de los síntomas de la enfermedad y el más afectado en el momento de la cirugía. En consonancia con lo anterior se realizaron 11intervenciones en el GPi izquierdo y 8en el derecho. El tiempo entre una cirugía y la otra tuvo una media de 4,5 años siendo un año lo más pronto y 10 años el máximo de tiempo (tabla 2).
Características demográficas y de evolución de la enfermedad previa a cada intervención quirúrgica
| Evaluación prepalidotomía | Evaluación presubtalamotomía | |
|---|---|---|
| Edad, años±DEM | 50,42 ± 9,46 | 54,89 ± 9,75 |
| Masculino/femenino | 8/9 | |
| Tiempo de evolución, años±DEM | 9,53 ± 3,90 | 14,00 ± 5,08 |
| Tiempo medio entre cirugías en años (mín.-máx.) | – | 4,5 (1-10) |
| Hemisferio del blanco quirúrgico | 8 D/11 I | 11 D/ 8 I |
D: derecho; DEM: desviación estándar de la media; I: izquierdo.
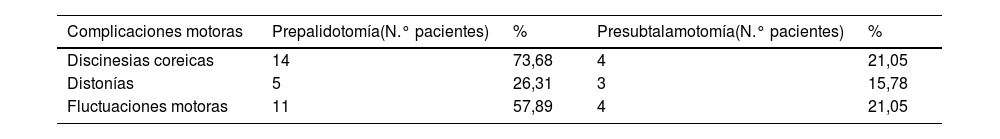
Todos los pacientes tratados mediante palidotomía/subtalamotomía eran portadores de una EP avanzada con deterioro en su condición neurológica, evidenciada por valores elevados de puntuación en la escala MDS-UPDRS motor aplicada a los pacientes en estado off y por la presencia de complicaciones motoras. Los valores medios de la sección III de la escala MDS-UPDRS, previos a la palidotomía, fueron de 55,78 puntos (min. 26-máx. 74) dados por los signos cardinales de la enfermedad, más acentuado en el hemicuerpo de inicio de los síntomas y se observó la presencia de discinesias coreicas de moderadas a severas y fluctuaciones motoras como elementos dominantes en el cuadro clínico en un gran porcentaje de los pacientes (tabla 3).
Complicaciones motoras presentes en el cuadro clínico de los pacientes
| Complicaciones motoras | Prepalidotomía(N.° pacientes) | % | Presubtalamotomía(N.° pacientes) | % |
|---|---|---|---|---|
| Discinesias coreicas | 14 | 73,68 | 4 | 21,05 |
| Distonías | 5 | 26,31 | 3 | 15,78 |
| Fluctuaciones motoras | 11 | 57,89 | 4 | 21,05 |
Fuente: planilla de recogida de datos.
Por otra parte, posterior a la palidotomía y previo a la segunda cirugía (subtalamotomía), los pacientes mostraban un predominio de la rigidez y la bradicinesia dentro de los signos cardinales de la enfermedad (64,70% de la muestra). En este momento estos pacientes mostraban, además, un deterioro de su condición neurológica y complicaciones motoras (discinesias, distonías y fluctuaciones motoras), más evidentes en el hemicuerpo ipsolateral a la palidotomía.
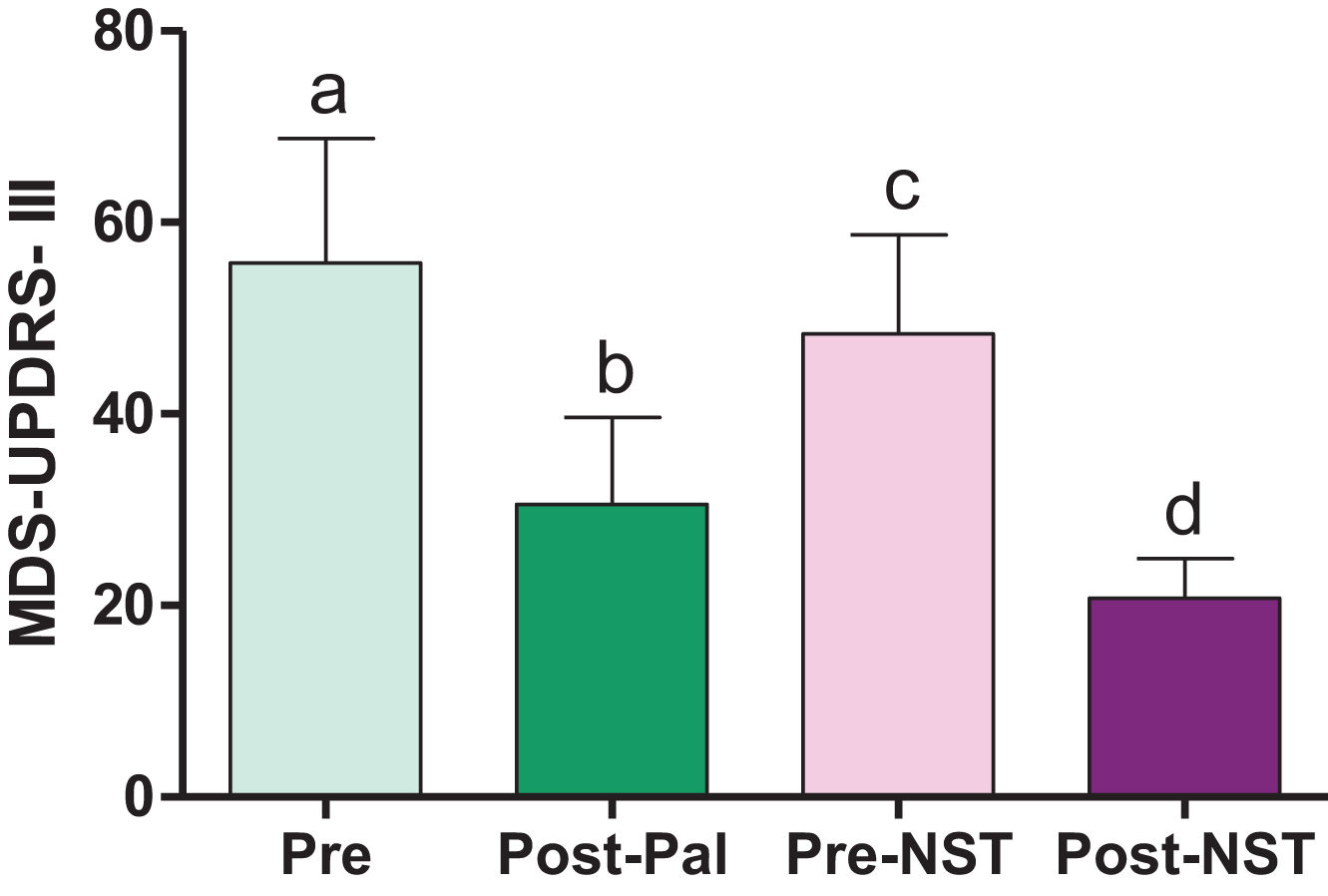
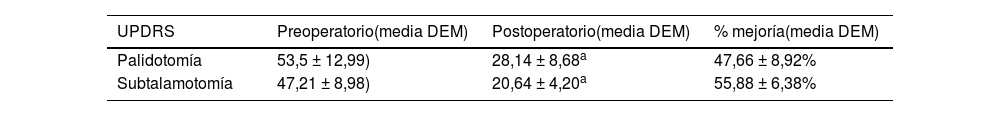
Efecto de la cirugía sobre la conducta motoraLa condición neurológica motora de los pacientes fue evaluada mediante el empleo de la escala MDS-UPDRS-sección III. Tanto la ubicación de una lesión por termocoagulación en el GPi (palidotomía) como en el NST (subtalamotomía), provocó cambios significativos en el desempeño motor de los pacientes (tabla 4) (fig. 2).
Modificaciones de la condición motora de los pacientes inducida por la cirugía
| UPDRS | Preoperatorio(media DEM) | Postoperatorio(media DEM) | % mejoría(media DEM) |
|---|---|---|---|
| Palidotomía | 53,5 ± 12,99) | 28,14 ± 8,68a | 47,66 ± 8,92% |
| Subtalamotomía | 47,21 ± 8,98) | 20,64 ± 4,20a | 55,88 ± 6,38% |
p <0,0001. Prueba t para muestras dependientes.
Evaluación de la conducta motora antes y después de las cirugías. Las barras muestran los valores medios de las escalas MDS-UPDRS Sección III en los diferentes momentos en que fue evaluada. Las letras muestran la presencia de diferencias significativas, prueba de Wilcoxon para muestras pareadas. a vs. b: p=0,000132; c vs. d: p=0,000132; b vs. c: p=0,000132, a vs. c: p=0,004970.
Posterior a la palidotomía, se observó una mejoría significativa en la condición motora de los pacientes (fig. 2) y una disminución en la presencia y severidad de las discinesias en el 100% de los pacientes.
Sin embargo, evolutivamente se observó un deterioro en la condición motora neurológica de estos pacientes. Aunque en la evaluación presubtalamotomía se observó que los pacientes mantienen valores en la escala MDS-UPDRS motora significativamente menores, respecto a la evaluación prepalidotomía (p=0,004970, T=21,00000); estos valores son significativamente mayores que los encontrados inmediatamente después de la primera intervención (palidotomía) (p=0,000132, T=0,00000) (fig. 2).
Al realizar la segunda intervención (subtalamotomía), se observó una mejoría significativa de la capacidad motora de los pacientes mayor a la obtenida después de la primera intervención (fig. 2).
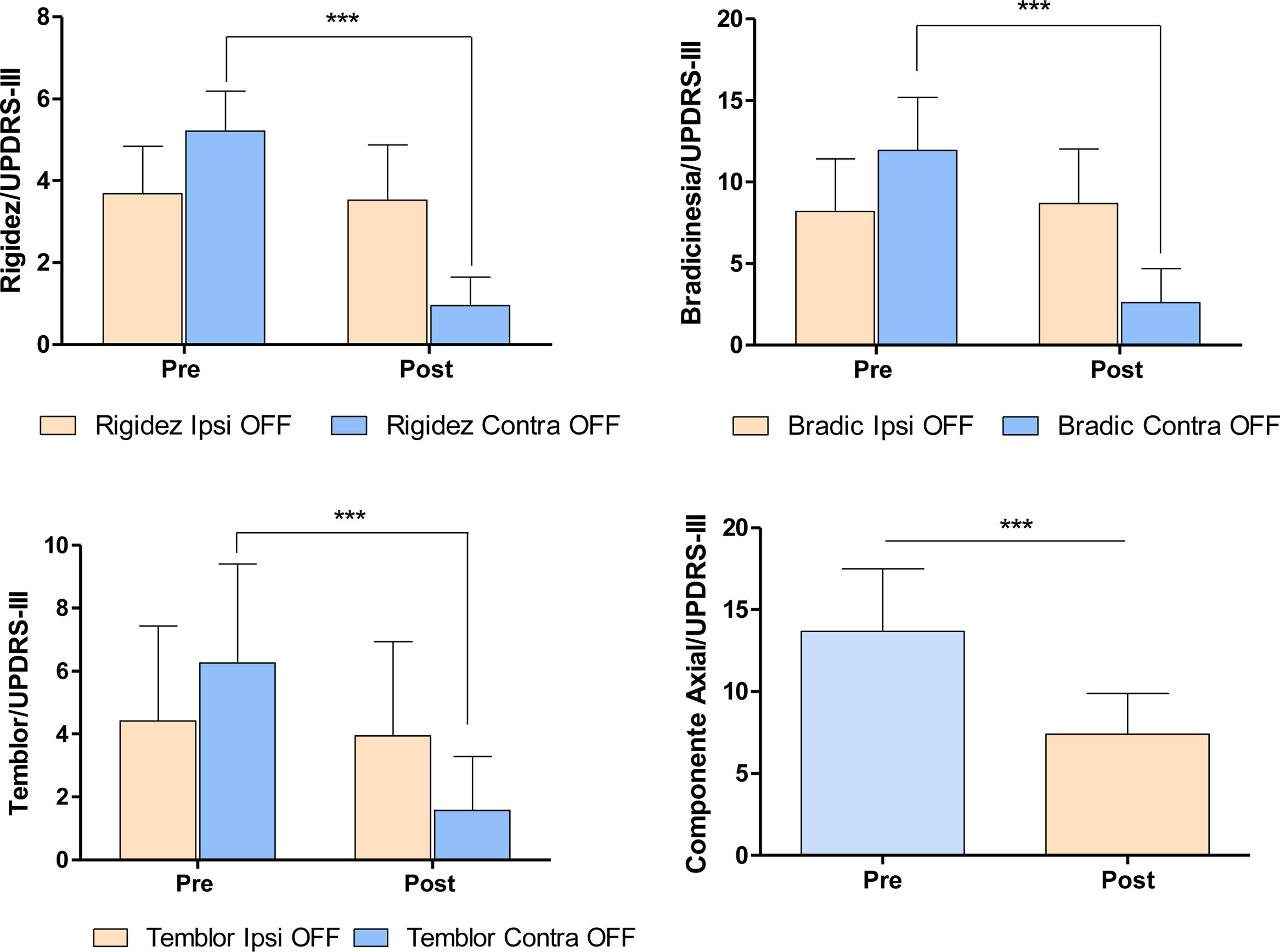
La palidotomía (primera intervención) se realizó en el hemisferio contralateral al hemicuerpo más afectado. En el momento prequirúrgico los pacientes mostraban rigidez y bradicinesia significativamente mayor en un hemicuerpo que en otro (prueba U de Mann-Whitney: rigidez: U=67,0/p=0,0009; bradicinesias: U=72,0/ p=0,0015). Posterior a la palidotomía se observó una mejoría significativa en los síntomas motores de los pacientes en el hemicuerpo contralateral a la lesión (prueba de Wilcoxon para muestras pareadas: rigidez: Z=3,823/p=0,0001; bradicinesias: Z=3,723/p=0,0001; temblor: Z=3,516/p=0,0004; síntomas axiales: Z=3,823/p=0,0001) (fig. 3).
Modificación de los signos cardinales de la EP pospalidotomía. Los gráficos muestran el efecto de la palidotomía sobre los signos cardinales de la enfermedad en ambos hemicuerpos, medidos según la escala de MDS-UPDRS III. Prueba U de Mann-Whitney y prueba de Wilcoxon para muestras pareadas p> 0,001.
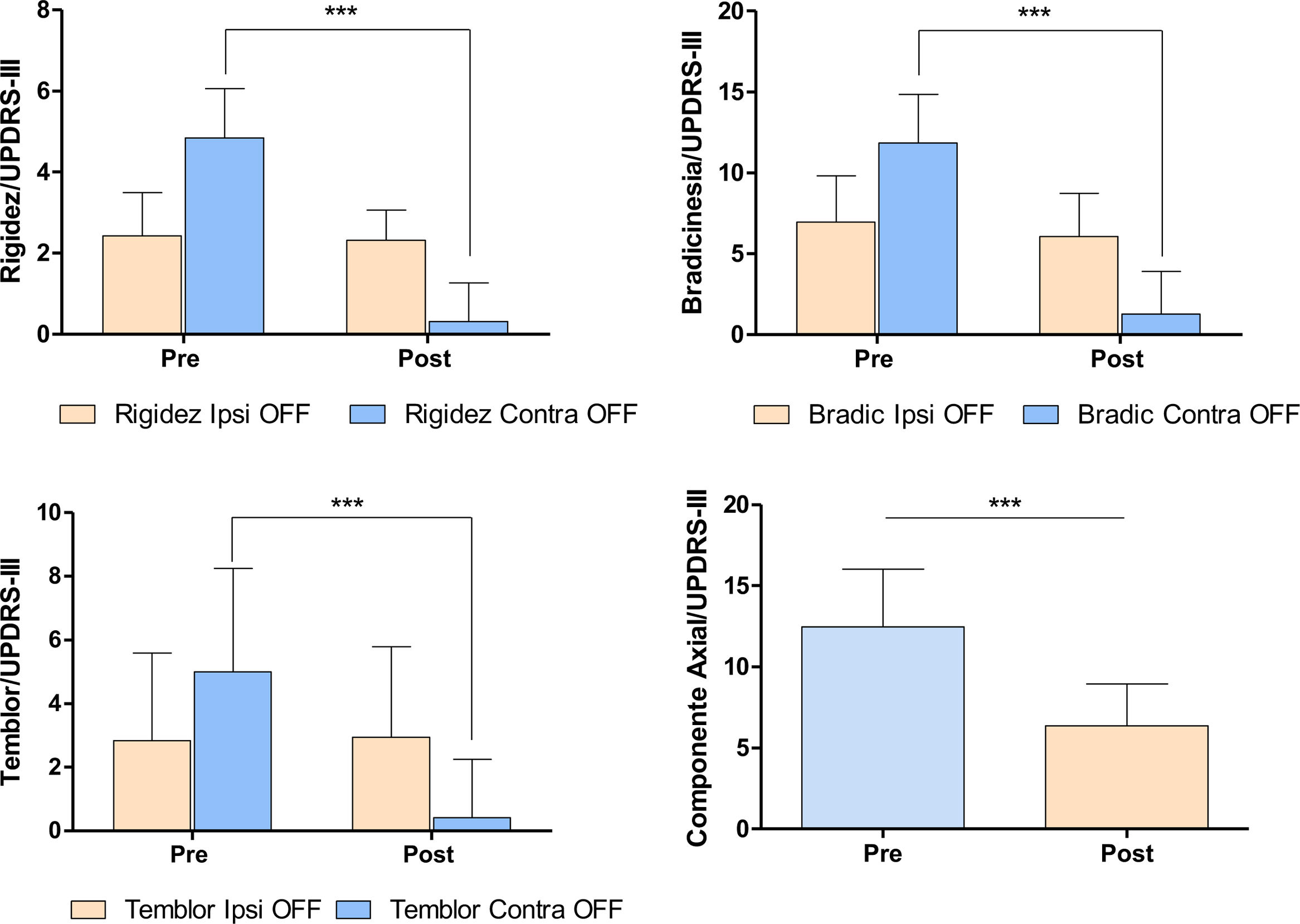
La subtalamotomía se realizó en el hemisferio contrario a la palidotomía; este es un dato importante a la hora de observar e interpretar las figuras. Aunque, como consecuencia de la evolución de la enfermedad, los pacientes mostraron un deterioro de su condición motora en relación con el momento pospalidotomía, el hemicuerpo contralateral a esta continuaba con rigidez, bradicinesia y temblor significativamente menor que el hemicuerpo contrario (prueba U de Mann Whitney: rigidez: U=34,0/p=0,00001; bradicinesias: U=48,5/p=0,0001; temblor: U=110,0/p=0,039). Posterior a la subtalamotomía se observó una mejoría significativa de la condición motora de los pacientes con un impacto mayor en el hemicuerpo contralateral al hemisferio lesionado (prueba de Wilcoxon para muestras pareadas: rigidez: Z=3,823/p=0,0001; bradicinesias: Z=3,823/p=0,0001; temblor: Z=3,295/p=0,0009; componente axial: Z=3,823/p=0,000132) (fig. 4).
Modificación de los signos cardinales de la EP post-subtalamotomía. Los gráficos muestran el efecto de la subtalamotomía sobre los signos cardinales de la enfermedad en ambos hemicuerpos, medidos según la escala de MDS-UPDRS III. Prueba U de Mann Whitney y Prueba Wilcoxon para muestras pareadas p> 0,001.
La subtalamotomía, a diferencia de la palidotomía, indujo una mejoría significativa de la bradicinesia en el hemicuerpo ipsolateral a la lesión (prueba de Wilcoxon para muestras pareadas, bradicinesias: Z=2,022/p=0,04).
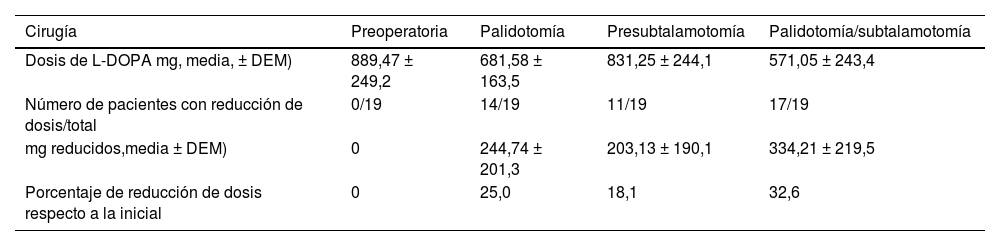
Efectos de cirugía sobre los requerimientos diarios de L-DOPAAmbas intervenciones quirúrgicas tuvieron un impacto positivo en el tratamiento farmacológico de los pacientes. La realización de la primera cirugía (palidotomía) condicionó una mejoría clínica de los pacientes que trajo aparejado una disminución significativa (p=0,003360, t=3,376767) en los requerimientos diarios de levodopa. En 14 de los 19 pacientes fue posible disminuir el consumo de la medicación dopaminérgica. Aunque el tiempo entre ambas intervenciones quirúrgicas fue variable y en el momento de la segunda intervención (subtalamotomía) los pacientes consumían dosis menores de L-DOPA en relación con la primera evaluación (tabla 5), hay un incremento significativo en el consumo de L-DOPA con relación a la evaluación un año posterior a la palidotomía (p=0,045951, t=–2,14385). Una vez que ambos hemisferios fueron operados, en 17 de estos pacientes, fue posible reducir la dosis de L-DOPA administrada (88,24%). Posterior a la subtalamotomía, no solo se modificó la dosis de L-DOPA en un mayor número de pacientes, sino que la reducción en los miligramos diarios por pacientes fue mayor en relación con el estado pospalidotomía (tabla 5).
Modificación en las dosis de L-DOPA posterior a las intervenciones quirúrgicas
| Cirugía | Preoperatoria | Palidotomía | Presubtalamotomía | Palidotomía/subtalamotomía |
|---|---|---|---|---|
| Dosis de L-DOPA mg, media, ± DEM) | 889,47 ± 249,2 | 681,58 ± 163,5 | 831,25 ± 244,1 | 571,05 ± 243,4 |
| Número de pacientes con reducción de dosis/total | 0/19 | 14/19 | 11/19 | 17/19 |
| mg reducidos,media ± DEM) | 0 | 244,74 ± 201,3 | 203,13 ± 190,1 | 334,21 ± 219,5 |
| Porcentaje de reducción de dosis respecto a la inicial | 0 | 25,0 | 18,1 | 32,6 |
Fuente: planilla de recogida de datos.
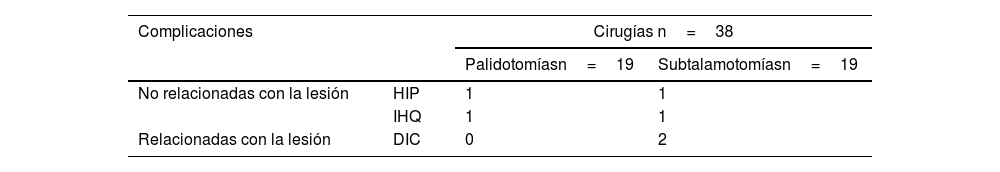
Fueron realizadas un total de 38 intervenciones quirúrgicas en 19 pacientes (19 palidotomías y 19 subtalamotomías). Solo en 2pacientes se presentaron complicaciones quirúrgicas con peligro para la vida (no relacionadas con la lesión ablativa) correspondiente con hemorragias intraparenquimatosas (HIP) (5,26%) de un total de 38 cirugías. Mientras que en otros 2pacientes se presentaron infecciones de la herida quirúrgica (5,26%) para un total de complicaciones quirúrgicas (no relacionadas con la lesión ablativa) de un 10,52% del total (tabla 6).
Complicaciones quirúrgicas
| Complicaciones | Cirugías n=38 | ||
|---|---|---|---|
| Palidotomíasn=19 | Subtalamotomíasn=19 | ||
| No relacionadas con la lesión | HIP | 1 | 1 |
| IHQ | 1 | 1 | |
| Relacionadas con la lesión | DIC | 0 | 2 |
DIC: discinesias inducidas por la cirugía; HIP: hematoma intraparenquimatoso; IHQ: infección de la herida quirúrgica.
Fuente: planilla de recogida de datos
Adicionalmente, en 2pacientes se reportaron complicaciones relacionadas con la lesión ablativa. Estos pacientes presentaron discinesias inducidas por la subtalamotomía. Las discinesias fueron ligeras y transitorias; en ambos pacientes desaparecieron en los 2primeros meses posteriores a la cirugía.
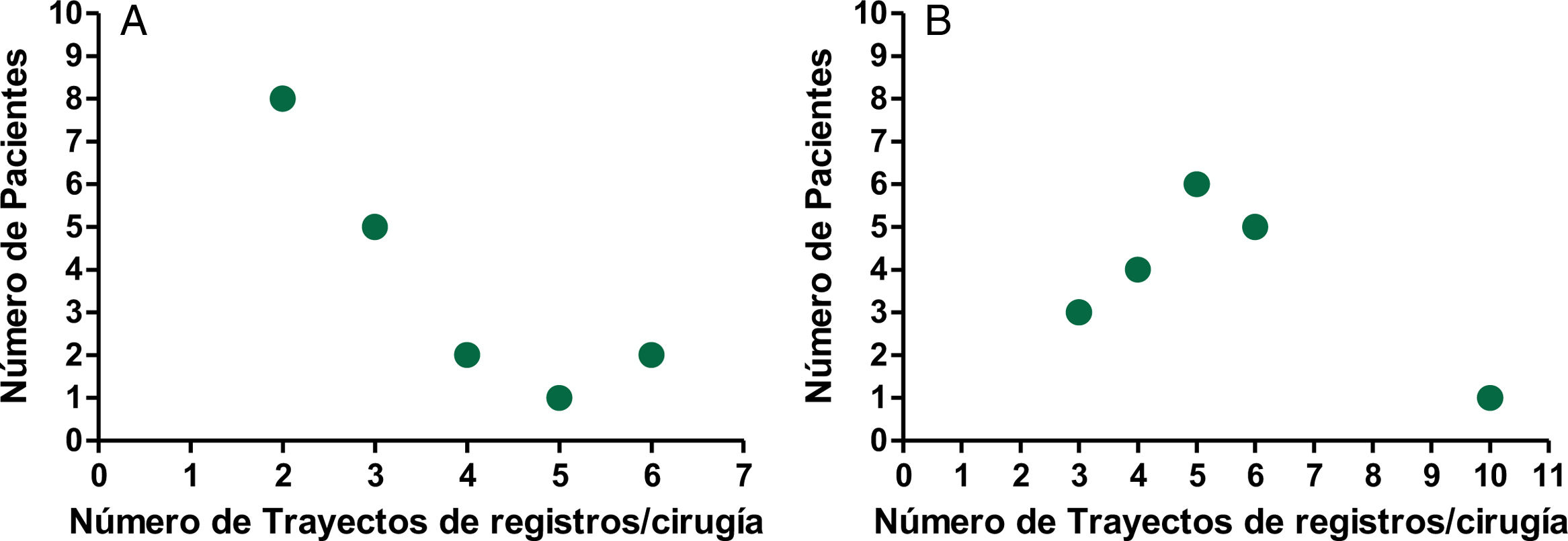
La figura 5 (A y B) muestra el número de registros cerebrales profundos realizados durante las intervenciones quirúrgicas para localizar el núcleo diana y la zona de lesión dentro de él. La figura 5A muestra los registros durante la palidotomía, mientras que en la figura 5B se muestran los de la subtalamotomía. La localización del núcleo subtalámico y la región donde colocar la lesión dentro de él, requirió de una mayor cantidad de registros para su identificación, con una media de 5,06 trayectos de registros.
Es válido señalar que los pacientes en los que se produjo una HIP como complicación quirúrgica, se correspondieron con pacientes en los que fue necesario realizar varios registros de actividad eléctrica profunda, como parte del proceder. En el caso del paciente que presentó la HIP en la palidotomía, se llevaron a cabo 5trayectos de registro y en el paciente durante la subtalamotomía, seis.
DiscusiónCaracterísticas demográficas de la muestraHoy en día no existe consenso absoluto sobre el momento adecuado para la cirugía en la EP. El tratamiento quirúrgico está indicado en pacientes con estadios avanzados de la enfermedad, en los que aparecen complicaciones motoras y la pérdida de respuesta al tratamiento farmacológico11,54-56. Está reportado que después de 5 años de tratamiento con L-DOPA aparecen múltiples complicaciones motoras de difícil control a pesar del mejor ajuste terapéutico posible11,57-59. Los pacientes incluidos en este estudio mostraron una edad promedio de 50 años en la evaluación previa a la primera cirugía con 9 años aproximadamente de evolución de la enfermedad desde el diagnóstico. Las series reportadas, de pacientes tratados mediante tratamiento quirúrgico, muestran gran diversidad en las edades de estos y varias reportan edades más avanzadas de los pacientes al momento de la intervención quirúrgica44,59,60. Sin embargo, el tiempo de evolución de la enfermedad previo a la intervención es muy similar en la mayoría de los reportes, donde hay coincidencia en un tiempo entre 5 y 10 años28,61,62. Sin duda, esto está muy relacionado con el hecho de que después de 5años de tratamiento farmacológico comienzan a aparecer las complicaciones y el control del paciente se vuelve más difícil.
Existe consenso en que la EP es más frecuente en el género masculino y así lo refieren varios autores en sus publicaciones3,63,64. Sin embargo, en este trabajo no hubo diferencias significativas respecto al género siendo solo de uno la diferencia entre mujeres y hombres, lo cual es congruente con reportes anteriores26,65. El lado que se abordó con más frecuencia en la primera cirugía fue el izquierdo, lo cual indica que el hemicuerpo más afectado era el derecho.
Signos y complicaciones motoras dominantes en las evaluaciones prequirúrgicasAunque la EP tiene un comienzo unilateral y un curso asimétrico, su naturaleza progresiva hace que se afecten los 2hemisferios y consecuentemente ambos hemicuerpos. Esta característica justifica que cuando se aplica una opción de tratamiento quirúrgico usualmente se requiera del abordaje bilateral. En este trabajo se recogen resultados del abordaje de ambos hemisferios a partir de la aplicación de una palidotomía seguida de una subtalamotomía.
Todos los pacientes intervenidos eran portadores de una enfermedad avanzada de difícil control con presencia de complicaciones motoras. El GPi fue el núcleo que primero se abordó, teniendo en cuenta la alta incidencia de discinesias y posturas distónicas en los pacientes. Existen reportes de mejoría de las discinesias con la palidotomía por lo que muchos grupos prefieren el abordaje de este núcleo en estos tipos de pacientes11,65-68. Con la progresión de la enfermedad aparece un deterioro de la condición motora, que es más evidente en el hemicuerpo no operado. La indicación de cirugía bilateral está avalada por esa razón, lo cual es una práctica frecuente y depende de la evolución de cada paciente. En los pacientes incluidos en este estudio se realizó una subtalamotomía como segunda cirugía. La selección del NST como blanco quirúrgico no solo estuvo encaminado a mejorar la clínica del paciente sino, además, a evitar las complicaciones de la palidotomía bilateral38,69,70. Son severos los efectos adversos que se reportan en la palidotomía bilateral, siendo los trastornos del habla y la esfera cognitiva los más afectados, por lo que no es recomendado el abordaje bilateral al GPi en pacientes con EP.
Conducta motoraTodos los pacientes incluidos en el estudio presentaban al momento de su intervención, bajo el mejor tratamiento farmacológico disponible, discinesias o fluctuaciones motoras. La intensidad de la enfermedad, medida por la escala de incapacidad funcional diseñada por Hoehn y Yahr71 estaba en estadio II y III (5 y 14 pacientes, respectivamente), lo que significa que todos eran pacientes con manifestaciones bilaterales, compromiso axial y deterioro de la respuesta de recuperación postural. Tras ambas intervenciones es evidente la mejoría de manera significativa tanto del punto de vista motor como de la calidad de vida de los pacientes.
El mayor beneficio de la palidotomía es la eliminación de las discinesias contralaterales inducidas por la levodopa, con alguna mejoría sobre las homolaterales60. Ha sido demostrado en estudios previos que la lesión ablativa del GPi mejora la bradicinesia y la rigidez en gran medida y el temblor en menor grado. En este estudio se observó que la palidotomía logró eliminar las discinesias inducidas por la medicación dopaminérgica en el 100% de los pacientes que las presentaban; así como la mejoría de los otros signos parkinsonianos. La rigidez y la bradicinesia fueron los signos que más se modificaron, aunque el temblor también disminuyó. Resultados similares han sido publicados por otros grupos27,60,72.
El efecto beneficioso de la palidotomía se mantuvo durante un período mayor que un año, hasta 10 años posteriores en un paciente. Sin embargo, la progresión de la enfermedad condujo a un aumento de la discapacidad tanto en condición OFF como en ON. Esto resultó evidente en la evaluación previa a la segunda intervención (subtalamotomía), donde se constató un aumento en la puntuación en la escala de MDS-UPDRS, si bien su mayor contribución provino del hemicuerpo no tratado y de la actividad motora axial. Existen autores que reportan resultados similares en estudios de seguimiento postoperatorio durante 5 años55,61.
Posterior a la subtalamotomía, los pacientes mostraron un mayor beneficio en los síntomas y signos parkinsonianos. Se encontró una mejoría del temblor, tono muscular, bradicinesia, así como de la marcha, la postura, la estabilidad postural y el lenguaje. Los resultados motores obtenidos en nuestra serie son congruentes con otras publicaciones que evalúan a corto plazo métodos ablativos27,60,63,73-80. Álvarez et al. reportaron que, posterior a la subtalamotomía, la rigidez y la bradicinesia son los síntomas donde se observa una respuesta mayor y sostenida, teniendo el temblor una evolución variable al considerar seguimiento más allá de los 36 meses81.
En el presente estudio se apreció que al realizar la subtalamotomía, la mejoría motora de los pacientes fue significativamente mayor respecto a la vista luego de la primera cirugía. Esto está relacionado con el efecto terapéutico bilateral que se logra con esta segunda intervención.
Efectos sobre los requerimientos diarios de L-DOPALos datos clínicos obtenidos en distintos estudios han mostrado una reducción significativa de medicación posterior a la subtalamotomía, no siendo así después de una palidotomía56,81. Sin embargo, en el 70,6% de los pacientes de esta serie se logró reducir la medicación dopaminérgica, en los primeros 6 meses posterior a la palidotomía. No hemos encontrado evidencias en la literatura de reportes similares posterior al abordaje del GPi56. No obstante, con la evolución de la enfermedad y con el tiempo transcurrido entre los procedimientos que en algunos casos llegó a ser hasta de 10 años, hubo pacientes en los que fue necesario el aumento de la dosis de levodopa de manera paulatina antes de la segunda cirugía.
A diferencia de los resultados con palidotomía, está reportado que la estimulación bilateral del NST mejora todos los síntomas cardinales de la EP y en más del 50% de los pacientes es posible reducir la medicación56,82. Tolosa et al. reportan una reducción de la medicación superior al 75%. 83 Nuestros resultados son congruentes con estos reportes, en el 88,2% de los pacientes fue posible reducir la dosis de levodopa, una vez realizada la subtalamotomía. Por otro lado, la reducción posterior a la subtalamotomía fue superior a la que se realizó después de la palidotomía. Aun cuando el impacto de la subtalamotomía sobre la medicación dopaminérgica está bien documentado, el hecho de que esta cirugía fuese la segunda (completa la intervención de ambos hemisferios) puede estar desempeñando un papel en la reducción de las dosis de levodopa en los pacientes. En nuestro criterio, esto constituye una expresión de buen efecto terapéutico de la combinación palidotomía/subtalamotomía.
ComplicacionesHay reportes de efectos adversos motores y psiquiátricos severos en pacientes en los que se realizó palidotomía bilateral como: disfagia, disartria y alteraciones cognitivas, entre otros38,39,56,69. También se describen complicaciones, no tan severas, relacionadas con la subtalamotomía bilateral como: desarrollo de discinesias o hemicorea balismo; incluso se reportan trastornos del lenguaje (hipofonía) y de las funciones cognitivas, aunque con baja incidencia26,34,56.
La combinación palidotomía-subtalamotomía evaluada en este estudio resultó una alternativa terapéutica segura. Las complicaciones relacionadas con la lesión ablativa fueron mínimas, solo 2pacientes presentaron discinesias leves inducidas por la subtalamotomía. No obstante, estos movimientos desaparecieron al mes de la cirugía en ambos casos. Ningún paciente desarrolló discinesias moderadas-severas. Esto pudiera estar relacionado, entre otras causas, con la disfunción transitoria de un volumen mayor de núcleo que el volumen lesionado. Durante los primeros 3meses posteriores a una cirugía ablativa puede existir edema perilesional asociado a las lesiones por radiofrecuencia, que incida en el efecto funcional de estas. Varios autores han reportado que esta pudiera ser una de las causas de la presencia de discinesias transitorias posterior al abordaje del NST25,84,85.
La presencia de discinesias inducidas por subtalamotomía ha sido observada tanto en modelos animales de parkinsonismo inducido en monos como en humanos, donde se describieron como impredecibles y pudieran no ser explicadas solamente por el tamaño de las lesiones25,85. La localización intranuclear de la lesión pudiera ser una de las causas. En un análisis retrospectivo, en pacientes tratados mediante cirugía de los ganglios basales (tálamo o región subtalámica), se demostró en casos donde las discinesias fueron una manifestación importante, que las lesiones no eran solo intranucleares, mostrándose en imágenes postoperatorias de RM la lesión en el NST y que se extendía dorsalmente hacia el tálamo anterior, ventralmente hacia la sustancia negra y dorsocaudalmente a través de la zona incierta hasta la rama anterior de la cápsula interna28. Por otra parte, ha sido reportado por varios autores que la presencia de discinesias importantes o balismos, posterior a una subtalamotomía, se corresponden con lesiones mayores de un 20% del volumen nuclear o destruir un volumen nuclear mayor del 60%34,44,86.
No obstante, la incidencia de discinesias tras la subtalamotomía en este estudio fue baja. Las coordenadas de lesión seleccionadas se corresponden con la región dorsolateral del núcleo e incluye la zona incierta44,45. Rodríguez Rojas et al.44 publicaron en 2018 «Subthalamotomy for Parkinson's disease: Clinical outcome and topography of lesions», donde plantean que la subtalamotomía es una alternativa eficaz para el tratamiento de la EP y que, sin embargo, la incertidumbre sobre la ubicación óptima de la lesión y la posibilidad de inducir hemicorea-balismo han limitado su aplicación. Evaluaron la correlación entre la topografía de las lesiones por radiofrecuencia del NST con la mejoría motora y la aparición de hemicorea-balismo. Los pacientes fueron evaluados preoperatoria y posoperatoriamente, utilizando la puntuación motora de la escala unificada de valoración de la enfermedad de Parkinson (UPDRS), RM y tractografía. Como resultado del estudio se observó que las lesiones que se extendían dorsalmente más allá del NST mostraron menor probabilidad de causar hemicorea-balismo que aquellas ubicadas completamente dentro del núcleo. Los hallazgos de la tractografía indican que la interrupción de las fibras palidotalámicas probablemente determina una baja probabilidad de hemicorea-balismo postoperatorio, llegándose a la conclusión de que la topografía de la lesión es un factor importante en el efecto antiparkinsoniano de la subtalamotomía en pacientes con EP y que las lesiones que incluían al NST motor y a las fibras palidotalámicas indujeron una mejora motora significativa y una baja incidencia de hemicorea-balismo. Se reporta la estimulación de la zona incierta por otros autores, con buenos resultados en la EP87,88.
Dentro de las complicaciones quirúrgicas (no relacionadas con la lesión ablativa) 2pacientes desarrollaron hemorragias intraparenquimatosas. A pesar de haber sido hemorragias de pequeño volumen, su localización en el área de los ganglios basales la convierte en una complicación grave con peligro para la vida, grado IV, según la escala de Clavien y Dindo53. La complicación más grave de la cirugía estereotáctica, en general, es la hemorragia cerebral21,44,53,86,89, si bien la incidencia de hemorragias sintomáticas es menor del 2% de los casos, existe una amplia variación de aparición de la misma que varía entre el 0-34%60. No existe consenso en la literatura en la relación entre el número de microrregistros y la aparición de hemorragias. No obstante, hoy en día, se intenta realizar el menor número de registros siempre que sea posible. Aunque los datos muestran una baja incidencia de hemorragias, parece que la realización de 5o más trayectos de registros aumenta la probabilidad de sangrado. Esto enfatiza la importancia de una adecuada planificación preoperatoria para disminuir la tasa de hemorragias. La adecuada selección del punto de entrada, visualizando los vasos de mayor calibre, alejándose de ellos y evitando los ventrículos laterales y surcos cerebrales, constituyen las principales recomendaciones que aparecen en la literatura45,90,91.
Existieron, además, 2pacientes que presentaron infección de la herida quirúrgica, los cuales requirieron tratamiento con antibióticos por vía oral durante 7 días. Si revisamos los diferentes autores, la tasa de infección en la literatura oscila entre un 1,2-15,2%. Esta variación se debe, en gran parte, al criterio empleado para definir la misma60. Muchos son los factores que contribuyen a la infección de la herida quirúrgica: la duración de la intervención, el número de personal que participan en la cirugía e incluso la inmunocompetencia del paciente.
En esta serie todos los pacientes se recuperaron con un 0% de mortalidad. La morbilidad fue mínima. En el caso de los pacientes que presentaron hemorragias como complicación grave, uno cursó asintomático y al alta hospitalaria se observaba una imagen en resolución en la TAC y el otro paciente requirió de un ciclo de rehabilitación neurorrestaurativa logrando una independencia funcional de 90 puntos según la escala de Karnofsky92.
La mayoría de los efectos adversos encontrados en este estudio se clasifican como moderados según la severidad, ya que interfirieron parcialmente en la vida diaria del paciente y requirieron tratamiento médico. Solo uno se clasifica como severo, correspondiente con el paciente que presentó hemorragia intracerebral sintomática, pues requirió de cuidados especiales en una Unidad de Cuidados Intensivos durante una semana. Según la causalidad todas las complicaciones tienen una causalidad definitiva.
Se realizó una comparación entre las complicaciones quirúrgicas de la palidotomía y la subtalamotomía donde no se encontraron diferencias significativas. En nuestro criterio, este resultado responde a la estrategia de planificación empleada por el equipo quirúrgico en ambas cirugías. El empleo de un programa automatizado para la planificación que toma en cuenta imágenes de atlas estereotáctico y de TAC contrastada del paciente, posibilita ajustar los ángulos de entrada y las coordenadas evitando los grandes vasos y los ventrículos laterales45.
En estos pacientes no aparecieron complicaciones relacionadas con el lenguaje ni de otra índole, como las reportadas en la palidotomía y la subtalamotomía bilateral12,26,39,93,94.
ConclusionesLa combinación palidotomía/subtalamotomía mostró ser una alternativa efectiva para el tratamiento de la EP complicada, capaz de permitir un mejor control motor y una reducción de la dosis de L-DOPA con una baja tasa de complicaciones, permitiendo además evitar las complicaciones derivadas de la palidotomía y de la subtalamotomía bilaterales, demostrando ser una alternativa segura para los pacientes aun cuando estos presenten cuadros de discinesias.
Limitaciones del estudio y recomendacionesSe recomienda un estudio prospectivo en donde el tiempo transcurrido entre las cirugías sea homogéneo, así como que la verificación del volumen y localización de las lesiones se realice además con el uso de la tractografía en la RM, aspectos que se consideran las principales limitaciones de este estudio, fundamentalmente por tratarse de una investigación de carácter retrospectivo.
AutoríaContribuciones de los autores: Nelson Ernesto Quintanal Cordero (NEQC) presentó la idea original; NEQC, Raisa Braña Miranda (RBM), Nancy Pavón Fuentes (NPF) e Ivón Pedroso Ibáñez (IPI) diseñaron el estudio y analizaron los resultados; NEQC y RBM redactaron el artículo. NEQC, RBM e IPI participaron en la evaluación pre y posquirúrgica de los pacientes. Todos los autores participaron en la mayoría de las intervenciones quirúrgicas desde su área de especialización. Todos los autores han leído y aprobado la versión final.
Durante todo el proceso de investigación, redacción, revisión y aprobación del documento final, la afiliación institucional de todos los autores fue el Centro Internacional de Restauración Neurológica (CIREN), La Habana, Cuba.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.