El efecto de la infección por SARS-CoV-2 en los pacientes con esclerosis múltiple (EM) y la influencia de los tratamientos modificadores de la enfermedad (TME) es desconocida. Hasta el momento no se ha observado que los pacientes con EM tengan mayor riesgo de infección por COVID-19, ni peor curso evolutivo de la misma.
MétodosEstudio descriptivo de pacientes con EM e infección por SARS-CoV-2 diagnosticada mediante PCR. Hemos analizado variables demográficas, clínicas, de laboratorio y de tratamiento en nuestra muestra. Se ha determinado la presencia de anticuerpos frente a SARS-CoV-2 en estos pacientes.
ResultadosLa forma de esclerosis múltiple remitente recurrente (EMRR) fue la más frecuente en lo pacientes con EM e infección por COVID-19. El 10,2% presentó una evolución desfavorable, relacionada con una mayor edad y una Expanded Disability Status Scale (EDSS) más elevada. La seroprevalencia de anticuerpos frente a SARS-CoV-2 en nuestro estudio ha sido del 83,3%. El desarrollo de anticuerpos no está relacionado con el TME, la presencia de linfopenia u otros factores analizados.
ConclusionesLa incidencia de COVID-19 ha sido ligeramente inferior a la de la población general de nuestra provincia. La evolución desfavorable se ha relacionado con una mayor edad y una puntuación elevada en la EDSS. El TME y la linfopenia no se han relacionado con el curso de la infección por COVID-19. La seroprevalencia es similar a la encontrada en población general con PCR positiva, sin poder determinar la influencia de los distintos TME.
The effect of SARS-CoV-2 infection in patients with multiple sclerosis (MS) and the influence of disease-modifying therapies (DMT) for MS on COVID-19 are unknown. To date, patients with MS have not been shown to present greater risk of COVID-19 or more severe progression of the disease.
MethodsWe performed a descriptive study of patients with MS presenting SARS-CoV-2 infection diagnosed with PCR. We analysed demographic, clinical, laboratory, and treatment variables in our sample. Presence of antibodies against the virus was also determined.
ResultsRelapsing-remitting MS (RRMS) was the most frequent form of MS in our sample. Prognosis was unfavourable in 10.2% of patients, and was associated with older age and higher scores on the Expanded Disability Status Scale (EDSS). Seroprevalence of antibodies against SARS-CoV-2 was 83.3% in our sample. Development of antibodies was not associated with DMT, lymphocytopaenia, or any of the other variables analysed.
ConclusionsThe incidence of COVID-19 was slightly lower in our sample than in the general population in our province. Unfavourable prognosis was associated with older age and higher EDSS scores. DMT and lymphocytopaenia did not influence the clinical course of COVID-19. Seroprevalence of antibodies against the virus in our sample was similar to that reported for the general population with positive PCR results for the virus; the influence of specific DMTs could not be determined.
El virus del síndrome respiratorio severo 2 o SARS-CoV-2, es un coronavirus identificado por primera vez en 2019. Es el causante de la llamada infección por COVID-19, y se ha propagado rápidamente alrededor del mundo, declarándose en situación de pandemia por la organización mundial de la salud en marzo del 2020. Durante este tiempo ha causado una gran morbimortalidad, siendo a fecha de 31 de diciembre del 2020 el número total de infectados en España de 1.928.265 y número total de fallecidos de 50.8371.
La influencia de la infección por COVID-19 en pacientes con esclerosis múltiple (EM) es desconocida. Los tratamientos modificadores de la enfermedad (TME) podrían tener un efecto inmunosupresor y dificultar una respuesta inmune eficaz frente al virus2. Además, es conocido el aumento de las infecciones como efecto secundario en los distintos ensayos clínicos con TME y algunos de ellos producen linfopenia que ha sido un factor de mal pronóstico en pacientes con COVID-193,4. A pesar de esto, hasta el momento no se ha encontrado relación entre los TME y una peor evolución clínica5,6. Por otro lado, existe la posibilidad de un empeoramiento de la EM con relación al proceso infeccioso sistémico. En este sentido, las recaídas de la enfermedad en los pacientes infectados por COVID-19 es variable, desde un 4,3%7, hasta del 21%8, sin datos disponibles de la discapacidad en estos pacientes a largo plazo.
En la población general, algunos de los factores relacionados con la mayor mortalidad por COVID-19 son: la edad, ser varón, comorbilidades como la enfermedad renal crónica (ERC), enfermedad pulmonar obstructiva crónica (EPOC) o enfermedad cerebrovascular, y hallazgos en laboratorio como la leucocitosis o linfopenia9. La edad, la existencia de comorbilidades o ser varón son factores de mal pronóstico en pacientes con EM que presentan infección COVID-19, similares a los de la población general. Además, el tener una mayor puntuación en la Expanded Disability Status Scale (EDSS), presentarse con formas progresivas5,10, precisar un apoyo para la deambulación11 y la obesidad se asocian a una peor evolución.
En nuestro estudio analizamos las características demográficas, clínicas, de laboratorio y de tratamiento en los pacientes con EM que han tenido infección por SARS-CoV-2. Hemos determinado la seroprevalencia y las variables que podrían asociarse con el desarrollo de anticuerpos IgG.
Pacientes y métodosEstudio observacional, descriptivo, de pacientes con EM (síndrome clínico aislado [SCA], esclerosis múltiple remitente recurrente [EMRR], esclerosis múltiple secundaria progresiva [EMSP] y esclerosis múltiple primaria progresiva [EMPP]) que han tenido infección por SARS-CoV-2 confirmada por PCR. Se incluyeron pacientes de la consulta de enfermedades desmielinizantes del Hospital Universitario Clínico San Cecilio (HUCSC) de Granada desde el inicio de la pandemia hasta el 31 de diciembre de 2020.
Los datos demográficos, clínicos y analíticos se han obtenido mediante revisión de la historia clínica y entrevista telefónica. Las variables recogidas han sido: edad, sexo, tipo de EM, tiempo evolución en meses, TME actual, EDSS basal, recuento linfocitario previo a la infección, comorbilidades (diabetes mellitus [DM], hipertensión arterial [HTA], obesidad, asma, EPOC, cardiopatía isquémica, ictus, enfermedad hepática crónica, ERC) e institucionalización. En relación a la infección por COVID-19 se han registrado los síntomas, tratamiento recibido, hospitalización/ingreso en la UCI, presencia de síntomas sugestivos de brote, la presencia de anticuerpos IgG frente a SARS-CoV-2 y fecha de la realización.
Los datos se han recopilado y tratado de forma anónima. Se realizó estudio estadístico descriptivo para las variables demográficas y clínicas de los pacientes con EM y de la infección por COVID-19, así como de los resultados serológicos. Se compararon dichas variables agrupando a los pacientes según el tipo de EM y la gravedad de la evolución de la enfermedad por COVID-19. Para la comparación de variables cualitativas se ha empleado el test exacto de Fischer y para la comparación de variables cuantitativas no paramétricas el test de la U de Mann-Whitney. Se empleó el programa estadístico R Comander versión: 3.6.2 de 2019. Se solicitó la aprobación por parte del comité ético del HUCSC de Granada.
ResultadosDe los 475 pacientes con EM incluidos en nuestra base de datos del HUCSC de Granada, 28 pacientes han sido diagnosticados por PCR de infección por el virus SARS-CoV-2 desde marzo del 2020 a diciembre del 2020, lo que supone un 5,89% de los pacientes con EM. La edad media fue de 49,1±16,1 años. Un 64,3% fueron mujeres con una edad media de 47,6±14,9 años y un 35,7% fueron varones con una edad media de 51,8±18,6 años. En nuestra serie, 5 pacientes (17,8%) estaban institucionalizados en residencias por motivos de discapacidad en relación a su EM.
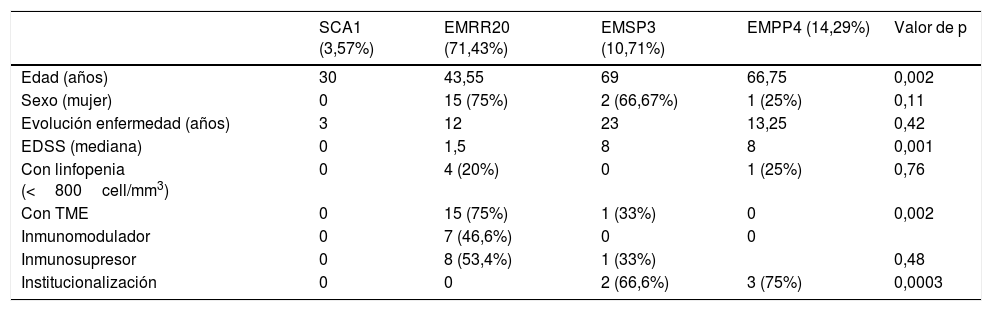
En la tabla 1 se presentan las características demográficas, clínicas y analíticas de los pacientes con EM, de acuerdo con la forma clínica de EM. No hay diferencia significativa entre los grupos, salvo en una mayor edad media y mayor EDSS en las formas progresivas. El número de pacientes con TME también difieren, siendo las formas RR las que presentan un mayor porcentaje de tratamiento.
Características demográficas, clínicas y analíticas de los pacientes con EM e infección por SARS-CoV-2
| SCA1 (3,57%) | EMRR20 (71,43%) | EMSP3 (10,71%) | EMPP4 (14,29%) | Valor de p | |
|---|---|---|---|---|---|
| Edad (años) | 30 | 43,55 | 69 | 66,75 | 0,002 |
| Sexo (mujer) | 0 | 15 (75%) | 2 (66,67%) | 1 (25%) | 0,11 |
| Evolución enfermedad (años) | 3 | 12 | 23 | 13,25 | 0,42 |
| EDSS (mediana) | 0 | 1,5 | 8 | 8 | 0,001 |
| Con linfopenia (<800cell/mm3) | 0 | 4 (20%) | 0 | 1 (25%) | 0,76 |
| Con TME | 0 | 15 (75%) | 1 (33%) | 0 | 0,002 |
| Inmunomodulador | 0 | 7 (46,6%) | 0 | 0 | |
| Inmunosupresor | 0 | 8 (53,4%) | 1 (33%) | 0,48 | |
| Institucionalización | 0 | 0 | 2 (66,6%) | 3 (75%) | 0,0003 |
EDSS: Expanded Disability Status Scale; EM: esclerosis múltiple; EMPP: esclerosis múltiple primaria progresiva; EMRR: esclerosis múltiple remitente recurrente; EMSP: esclerosis múltiple secundaria progresiva; TME: tratamientos modificadores de la enfermedad.
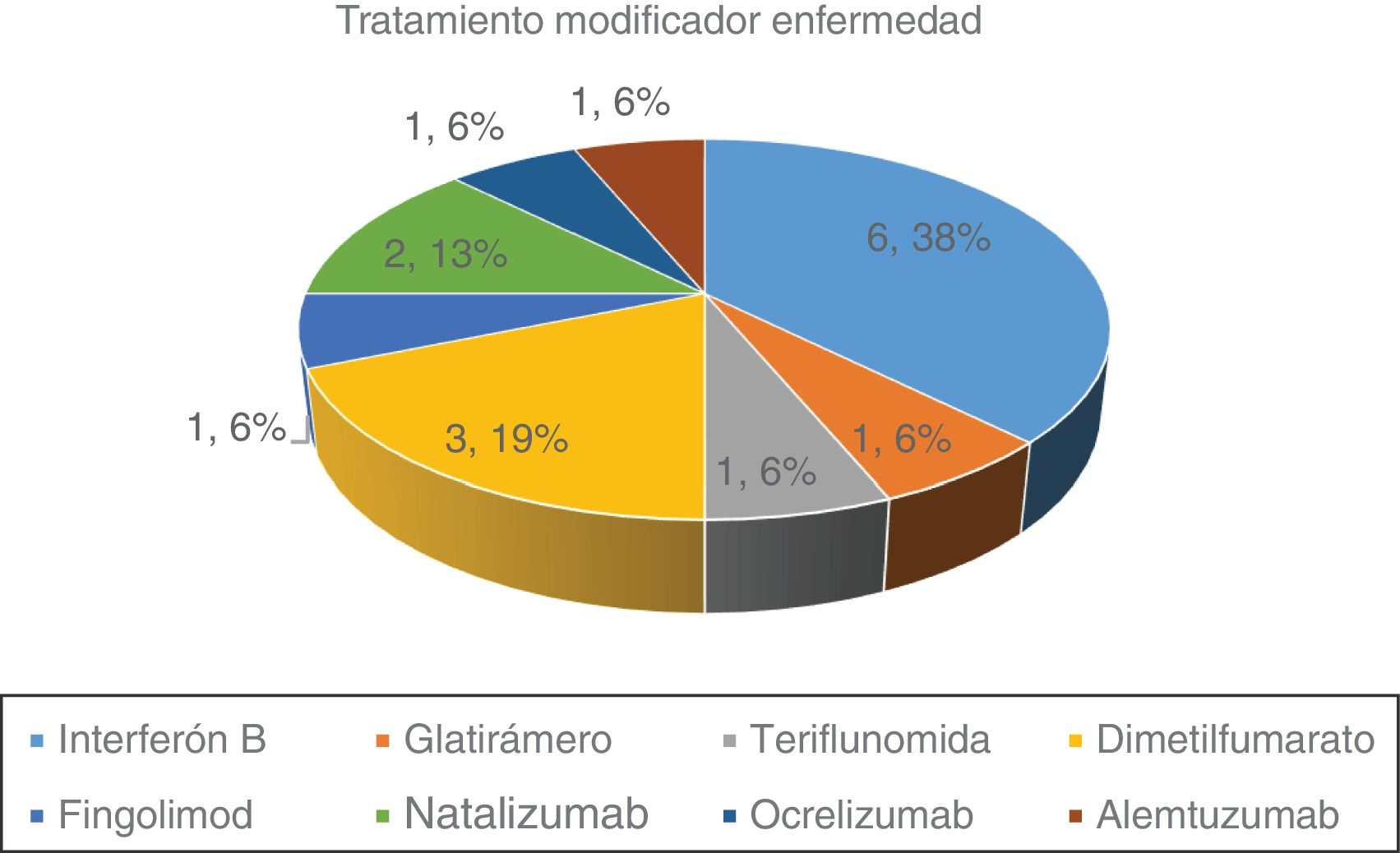
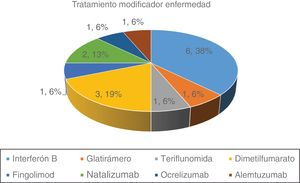
En la figura 1 se representan la distribución de los distintos TME de nuestra serie. Un 57,1% recibían tratamiento en el momento de la infección por SARS-CoV-2. De los 16 pacientes tratados 11 (68,7%) recibían tratamiento considerado de primera línea y 5 (31,3%) eran tratamientos de segunda línea.
La comorbilidad más frecuente en nuestra serie es la obesidad con 8 pacientes (28,6%), seguida del tabaquismo activo con 7 pacientes (25%), 6 con HTA (21,43%), 3 con DM (10%), 2 con asma (7,1%) y uno con enfermedad cardiovascular (3,6%). No existen diferencias significativas entre la comorbilidad y la forma de EM, salvo la DM que fue menos frecuente en el grupo con EMRR (p>0,017).
El recuento linfocitario previo a la infección por SARS-CoV-2 fue normal en 23 (82,1%) de los pacientes. El 27,9% restante tenían linfopenia, siendo de grado 1 en un paciente (3,6%), grado 2 en un paciente (3,6%) y grado 3 en 3 pacientes (10,7%). No hubo diferencias significativas según la forma de EM y la linfopenia previa. La media de linfocitos fue de 1.540/mm3 para los tratados con interferón beta, 1.930/mm3 para acetato de glatiramero, 2.350/mm3 para teriflunomida, 1.340/mm3 para dimetilfumarato, 450/mm3 para fingolimod, 4.030/mm3 para natalizumab, 1.190/mm3 para ocrelizumab y 43/mm3 para alemtuzumab.
La sintomatología que han presentado los pacientes ha sido similar a la reportada previamente en otras series. En un 7,1% (2 pacientes) la infección fue asintomática. Uno fue un varón de 65 años con forma progresiva sin tratamiento e institucionalizado, al que se realizó PCR por contacto estrecho con paciente PCR positiva. El otro paciente fue un varón de 21 años de edad con una oftalmoplejía internuclear que precisó ingreso hospitalario y en este contexto se realizó la PCR. En la tabla 2 se recogen los síntomas referidos a la infección por COVID-19. No hemos encontrado diferencias significativas entre los síntomas de infección por SARS-CoV-2 y las formas de EM. Los pacientes con anosmia/ageusia presentaron una edad media menor: 35,8 vs. 52,7 años (p=0,02). El 89,3% presentaron una buena evolución. Solo 3 (10,7%) tuvieron una evolución desfavorable y precisaron ingreso en el hospital por el síndrome de liberación de citoquinas y la necesidad de tratamiento con oxigenoterapia. Respecto al tratamiento para la infección por COVID-19, 5 (17,85%) de los pacientes se trataron con corticoides, bien en su forma de bolos de metilprednisolona (MP), bien con dexametasona oral. Ninguno requirió ingreso en la UCI y un paciente (3,6%) falleció por las complicaciones derivadas de la infección. Únicamente un paciente (3,6%), asintomático desde el punto de vista de la infección por COVID-19, presentó síntomas compatibles con brote. Mejoró tras la administración de MP y pauta descendente posterior de prednisona oral.
Síntomas referidos durante la fase aguda de la infección por COVID-19
| Síntomas de COVID-19 | |
| Tos; n (%) | 15 (53,57) |
| Fiebre; n (%) | 15 (53,57) |
| Síndrome gripal; n (%) | 13 (46,42) |
| Mialgias; n (%) | 9 (32,14) |
| Cefalea; n (%) | 8 (28,57) |
| Anosmia/ageusia; n (%) | 6 (21,42) |
| Disnea; n (%) | 5 (17,85) |
| Odinofagia; n (%) | 3 (10,71) |
| Sin síntomas; n (%) | 2 (7,14) |
| Diarrea; n (%) | 1 (3,57) |
| Confusión; n (%) | 1 (3,57) |
| Neumonía; n (%) | 1 (3,57) |
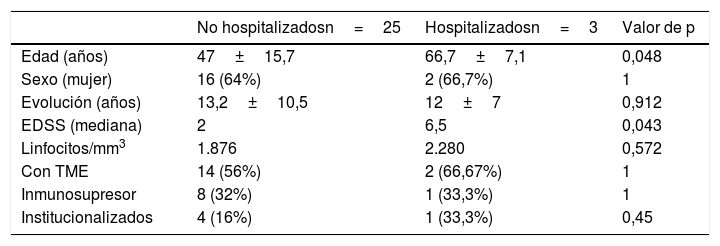
En la tabla 3 se presentan las características demográficas y clínicas de los pacientes con una forma grave de presentación de la infección que requirieron ingreso frente a formas más leves. No hubo diferencias significativas entre los pacientes graves frente a los leves, siendo mayor la edad en el grupo de pacientes hospitalizados, así como una mayor discapacidad con una mediana de la EDSS de 6,5. No hubo diferencias significativas entre los síntomas de inicio de la infección por COVID-19 y la gravedad de la enfermedad, ni en relación con los TME que recibían en el momento de la infección. Tampoco hubo diferencia en nuestra serie entre la evolución y la presencia de comorbilidades.
Características demográficas y clínicas de los pacientes con una forma grave de infección por COVID-19
| No hospitalizadosn=25 | Hospitalizadosn=3 | Valor de p | |
|---|---|---|---|
| Edad (años) | 47±15,7 | 66,7±7,1 | 0,048 |
| Sexo (mujer) | 16 (64%) | 2 (66,7%) | 1 |
| Evolución (años) | 13,2±10,5 | 12±7 | 0,912 |
| EDSS (mediana) | 2 | 6,5 | 0,043 |
| Linfocitos/mm3 | 1.876 | 2.280 | 0,572 |
| Con TME | 14 (56%) | 2 (66,67%) | 1 |
| Inmunosupresor | 8 (32%) | 1 (33,3%) | 1 |
| Institucionalizados | 4 (16%) | 1 (33,3%) | 0,45 |
EDSS: Expanded Disability Status Scale; TME: tratamientos modificadores de la enfermedad.
La seroprevalencia se analizó en 24 pacientes (un 85,7% de la serie). Se han obtenido anticuerpos IgG positivos frente a SARS-CoV-2 en 21 pacientes (83,3%), con resultado negativo en 4 pacientes (16,7%). La determinación de anticuerpos se realizó entre 1-8 meses tras la primera PCR positiva, con una mediana de 2 meses. La distribución por intervalos para los que presentaron positividad fue entre 1-2 meses: 11 pacientes, entre 3 y 6 meses: 7 pacientes y más de 6 meses 3 pacientes. De los pacientes negativos, uno de ellos no tenía TME, los otros tres estaban en tratamiento con ocrelizumab, fingolimod y dimetilfumarato. La seropositividad en nuestra muestra no se relacionó con el empleo de TME, el tipo de TME ni con los niveles de linfocitos. No existe relación entre la determinación anticuerpos IgG SARS-CoV-2 y las variables demográficas, clínicas y de tratamiento analizadas en nuestro trabajo.
DiscusiónEntre los pacientes con EM la incidencia de infección por COVID-19 ha sido del 5,9%, ligeramente inferior al 6,3% de la incidencia en población general registrada en Granada13. En comparación con la serie del centro de esclerosis múltiple de Cataluña (Cemcat) con EM y COVID-19 esta cifra también es menor7. Esto podría relacionarse con el hecho de que únicamente hemos incluido pacientes con diagnóstico confirmado mediante PCR, y no se han incluido pacientes con sospecha por clínica y/o radiología compatible.
Atendiendo al tipo de EM, la forma EMRR ha sido la más frecuente. Los pacientes con formas progresivas tienen una mayor edad y una EDSS más elevada. Las comorbilidades más frecuentes han sido la obesidad, la HTA y el tabaquismo activo. En la serie francesa el porcentaje de comorbilidades fue inferior12, mientras que en el registro del centro de EM de Nueva York la frecuencia fue similar de obesidad, DM y HTA8.
Considerando la hospitalización o ingreso en la UCI como formas graves y el resto como leves o moderadas, solo 3 de los pacientes han tenido un curso evolutivo grave de la infección. Esto supone una tasa de hospitalización del 10.7%, la mitad de otras series7,8,10,14, pero superior al 8,3% de hospitalizaciones por COVID-19 en población general en nuestra provincia13. Al igual que en otros registros hemos observado que los pacientes con formas graves tienen una EDSS más elevada y una mayor edad7,8,10. No hemos encontrado relación entre la presencia de comorbilidades y la gravedad de la infección por COVID, probablemente relacionado con el tamaño reducido de la muestra y el bajo porcentaje de hospitalizados.
A pesar de la influencia en la inmunidad de los TME parece que estos no infieren un mayor riesgo de contagio de COVID-19 ni un peor curso evolutivo de la infección15–17, incluso en pacientes con linfopenia7. Los datos obtenidos en nuestra serie son similares a los publicados, sin relación entre una infección con curso más grave y el uso de TME18 o linfopenia7. El 57% de nuestros pacientes estaba en tratamiento con TME. De los tratados, solo 2 de ellos precisaron hospitalización y ninguno tenía linfopenia. Hubo un único fallecimiento, de un paciente sin TME y recuento linfocitario previo dentro de límites normales. El hecho de que los TME no influyan negativamente en el curso de la infección por COVID-19 podría justificarse en parte por su mecanismo de acción19. Los casos más graves de COVID-19 son aquellos que desarrollan un síndrome de distrés respiratorio mediado en parte por una respuesta hiperinmune. En esta se produce un exceso de liberación de componentes proinflamatorios, o tormenta de citoquinas, que conlleva una deplección de células T, inflamación y daño pulmonar20. Teniendo en cuenta los efectos a nivel del sistema inmune de los distintos tratamientos, se ha sugerido que algunos TME pudieran evitar o mitigar dicha respuesta proinflamatoria en relación a la infección por COVID-195,21,22.
Es una cuestión de especial interés por las implicaciones a nivel epidemiológico y en la planificación de vacunación de los pacientes con EM, cómo los TME pueden afectar al desarrollo de anticuerpos frente a SARS-CoV-2. La seroprevalencia descrita en pacientes con EM asintomáticos es parecida a población general con similar grado de exposición23. Hasta el momento disponemos de escasos datos sobre el porcentaje de pacientes con EM que son capaces de desarrollar anticuerpos frente a SARS-CoV-2 tras la infección, y si esta capacidad está influida de manera particular por los TME. En el registro realizado en el Cemcat, el 45,6% de los pacientes presentaban serología positiva a SARS-CoV-2. De los pacientes, aquellos en tratamiento con anti-CD20 fueron los que desarrollaron anticuerpos con menor frecuencia7. En nuestros pacientes el 83,3% presentó positividad de anticuerpos frente a SARS-CoV-2. Este porcentaje es bastante superior al encontrado en el registro de Cemcat, pero similar al 88,6-91% obtenido en población general con PCR positiva24. No hay diferencias significativas de seropositividad entre pacientes con o sin TME, ni con la presencia de linfopenia u otros variables como la edad. La diferencia de nuestros resultados con los publicados anteriormente puede estar justificada por la inclusión de pacientes únicamente PCR positiva, y por el tiempo de latencia variable entre PCR-positiva y determinación de anticuerpos.
Las principales limitaciones de nuestro estudio serían el ser un estudio transversal observacional en el que se han recogido solo los casos confirmados por PCR. El tiempo en el que se han determinación los anticuerpos IgG SARS-CoV-2 no ha sido homogéneo ni tenemos controles evolutivos a medio plazo. Solo el 57% de nuestros pacientes recibían tratamiento en el momento de la infección COVID-19, por lo que no podemos enunciar conclusiones determinantes de la influencia del tratamiento y la seroprevalencia.
Está por determinar la influencia de los distintos TME en el desarrollo de anticuerpos y si estos permanecen estables en el tiempo. Se necesitan estudios más amplios de seroprevalencia entre los pacientes con EM e infección por COVID-19.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesRaquel Piñar Morales ha recibido honorarios como ponente de Almirall, Biogen, Merck, Novartis, Roche y Sanofi-Aventis. Francisco J. Barrero Hernández ha recibido honorarios como consultor o ponente de Almirall, Biogen, Merck, Novartis, Roche, Sanofi y TEVA.