Las alteraciones cognitivas son uno de los síntomas más comunes, insidiosos e incapacitantes de síndrome post-COVID-19 (PC-19), las cuales se han correlacionado con daño en diferentes estructuras cerebrales.
ObjetivoDescribir alteraciones cognitivas PC-19 e identificar variables asociadas y comparar el impacto de la ventilación mecánica en los resultados cognitivos y de neuroimagen.
MétodosCohorte de personas sobrevivientes de COVID-19, evaluados después de 12 semanas del egreso hospitalario, con pruebas neuropsicológicas (PNP) y resonancia magnética de cráneo. Se clasificaron en dos grupos: los que requirieron ventilación mecánica invasiva (VMI) y los que tuvieron ventilación mecánica no invasiva (VMno-I).
ResultadosSesenta pacientes completaron el estudio: 41 tuvieron VMI y 19 VMno-I; edad promedio, 57,11 años. El 66% obtuvo puntaje menor a 26 puntos en MoCA y el 83,3% refirió fallos de memoria en la vida cotidiana (FMVC). El 85% presentó alteraciones en al menos una PNP. Al comparar los resultados por grupos solo se observó diferencia significativa en el puntaje total del test de MoCA (p=0,045) y en FMVC (p=0,032). Al comparar los resultados cognitivos con los de imagen en toda la muestra se observó relación significativa entre la prueba de denominación de Boston (−0,287; p=0,035), la evocación de la figura de Rey (−0,324; p=0,017) con atrofia parietal, fluidez verbal fonológica con atrofia frontal (−0,276; p=0,042). La prueba HVLT (ensayo de aprendizaje) se relacionó con hiperintensidad en hipocampo (−0,266; p=0,050) e hiperintensidad en cíngulo (0,311; p=0,021). La prueba TMT-B se relacionó con hiperintensidad en sustancia blanca (0,345; p=0,010). La presencia de mal pronóstico funcional se correlacionó con ansiedad (p<0,001), depresión (p<0,001), niveles elevados de dímeroD (p=0,002) y aumento en los días de intubación (p=0,005).
ConclusiónNuestro estudio sugiere que existen quejas subjetivas y alteraciones cognitivas en funciones ejecutivas, atención y memoria en pacientes que tuvieron infección moderada-grave por COVID-19, independientemente de emplear VMI invasivo o no durante el manejo de su padecimiento. Encontramos lesiones de sustancia blanca y atrofia cerebral en regiones frontales y parietales que se asocian a déficits cognitivos. Nuestros hallazgos destacan la necesidad clínica de programas longitudinales capaces de evaluar el impacto real de la infección por SARS-CoV-2 en el sistema nervioso central, manifestadas en el área cognitiva y emocional.
Cognitive impairments are one of the most common, insidious, and disabling symptoms of post-COVID-19 syndrome (PC-19), which have been correlated with damage to different brain structures.
ObjectiveTo describe cognitive impairments in PC-19, identify associated variables, and compare the impact of mechanical ventilation on cognitive and neuroimaging outcomes.
MethodsA cohort of COVID-19 survivors was evaluated with neuropsychological tests (NPT) and cranial magnetic resonance imaging (MRI) 12 weeks after hospital discharge. Patients were classified into two groups based on whether they required invasive mechanical ventilation (IMV) or non-invasive mechanical ventilation (NIMV).
ResultsSixty patients completed the study, 41 received IMV and 19 NIMV, with an average age of 57.11 years. 66% scored below 26 points on the MoCA test and 83.3% reported everyday memory failures (EMF). 85% showed impairments in at least one NPT. When comparing results between groups, significant differences were observed in the total MoCA test score (p=0,045) and EMF (p=0,032). Significant relationships were observed between the Boston Naming Test (−.287; P=.035), the Rey Figure Recall Test (−.324; P=.017) with parietal atrophy, as well as phonological verbal fluency with frontal atrophy (−.276; P=.042). The HVLT (learning trial) test was related to hippocampal hyperintensity (−.266; P=.050) and cingulate hyperintensity (.311; P=.021). The TMT-B test was related to white matter hyperintensity (.345; P=.010). The presence of poor functional prognosis was correlated with anxiety (P<.001), depression (P<.001), elevated D-dimer levels (P=.002) and the increase in days of intubation (P=.005).
ConclusionOur study suggests that COVID-19 survivors who had moderate-to-severe infection experience subjective complaints and cognitive impairments in executive function, attention, and memory, regardless of whether invasive mechanical ventilation was used during treatment. We found white matter lesions and cerebral atrophy in frontal and parietal regions that were associated with cognitive deficits. Our findings highlight the clinical need for longitudinal programs capable of evaluating the real impact of SARS-CoV-2 infection on the central nervous system, particularly in the cognitive and emotional domains.
El virus SARS-CoV-2 se expandió rápidamente a nivel mundial, declarándose pandemia por la OMS en marzo de 2020, generando hasta el momento alrededor de 6.548.492 muertes en todo el mundo. México ha sido uno de los países más afectados, con 7.576.730 casos confirmados y 333.764 defunciones hasta abril de 20231. Se han descrito síntomas que persisten después de la infección, a los cuales en conjunto se denominó síndrome post-COVID-19 (PC-19). Se estima que aproximadamente hasta el 85% de los pacientes hospitalizados graves y 35% de los pacientes asintomáticos refieren síntomas persistentes después de las 12 semanas de la infección aguda2,3.
Las alteraciones cognitivas son uno de los síntomas más comunes, insidiosos e incapacitantes del PC-19, con impacto en la calidad de vida y la funcionalidad a largo plazo. La mayoría de los estudios han reportado alteraciones en funciones ejecutivas, atención4, memoria5, lenguaje6 y funciones visuoespaciales7, en pacientes hospitalizados y no hospitalizados; estas manifestaciones cognitivas también se han asociado con síntomas de ansiedad y depresión8.
Asimismo, se han correlacionado con alteraciones en diferentes estructuras cerebrales. Delorme et al.9 mostraron en pacientes PC-19 hipometabolismo frontal y cerebeloso, con predominio en alteración del lóbulo frontal. Por otro lado, Díez-Cirarda et al.10 reportan pérdida del volumen de la materia gris cortical e hipoconectividad entre regiones hipocampales derecha e izquierda.
Diferentes estudios de metaanálisis reportan que el 53% de los casos de pacientes con PC-19 presentan alteraciones en imágenes de resonancia magnética (IRM) y el 23% en tomografía de cráneo, caracterizados por hiperintensidades en sustancia blanca, o hipodensidades en sustancia blanca cerebral anterior y posterior. Se han observados algunos cambios en la corteza insular, regiones subinsulares, giro cingular, pedúnculo cerebral, cápsula interna, tálamos, mesencéfalo, puente, giro parahipocampal, ganglios de la base, esplenio del cuerpo calloso y bulbos olfatorios11. Andriuta et al.12 reportan, en pacientes con COVID agudo y PC-19, correlaciones con alteraciones cognitivas, principalmente en funciones ejecutivas, lenguaje y compromiso en áreas cerebrales de hemisferio derecho.
Se desconoce la duración y la asociación de dichas alteraciones con procesos degenerativos o si estos procesos son desencadenantes de los trastornos cognitivos que presentan los pacientes13.
Existen variables que contribuyen en el declive o la exacerbación del deterioro cognitivo en personas con PC-19, como la fatiga, la hipoxemia, la presencia de delirium, la severidad de la enfermedad, entre otros factores14-16. Zhou et al.17 evaluaron el impacto de la COVID-19 sobre la función cognitiva en personas recuperadas y su relación con perfiles inflamatorios, observando que existen alteraciones cognitivas principalmente en atención y memoria en pacientes recuperados de COVID-19, y posiblemente estén relacionados con procesos inflamatorios subyacentes.
Se ha reportado que recibir apoyo mecánico ventilatorio durante la estancia hospitalaria sugiere que la gravedad de la enfermedad tiene impacto importante en la presencia de síntomas; sin embargo, existen pocos estudios en donde se evalúe la persistencia de los síntomas en pacientes con COVID-19 grave, más concretamente en aquellos que necesitaron ventilación mecánica invasiva (VMI)18. Los pacientes críticos con COVID-19 pueden estar predispuestos a tener una mayor prevalencia de síntomas, como deterioro cognitivo y alteraciones neuropsiquiátricas19. En contraste, pacientes que no requirieron VMI (VMno-I) pueden desarrollar mayores síntomas depresivos atribuidos a estar expuestos a gran estrés debido a la falta de contacto con familiares, así como a estar conscientes de la situación crítica del momento20.
Para este estudio, a una cohorte de personas sobrevivientes de COVID-19 que requirieron hospitalización se les realizó valoración clínica neurológica, medición de marcadores de inflamación, se aplicaron pruebas neuropsicológicas, valoraciones de funcionalidad y neuropsiquiátricas, y estudios de imagen cerebral, con el objetivo de describir alteraciones cognitivas PC-19, e identificar variables asociadas. Posteriormente, como objetivo secundario, se realizó una división de los pacientes en dos grupos, para comparar el impacto de la ventilación mecánica en los resultados cognitivos y de neuroimagen.
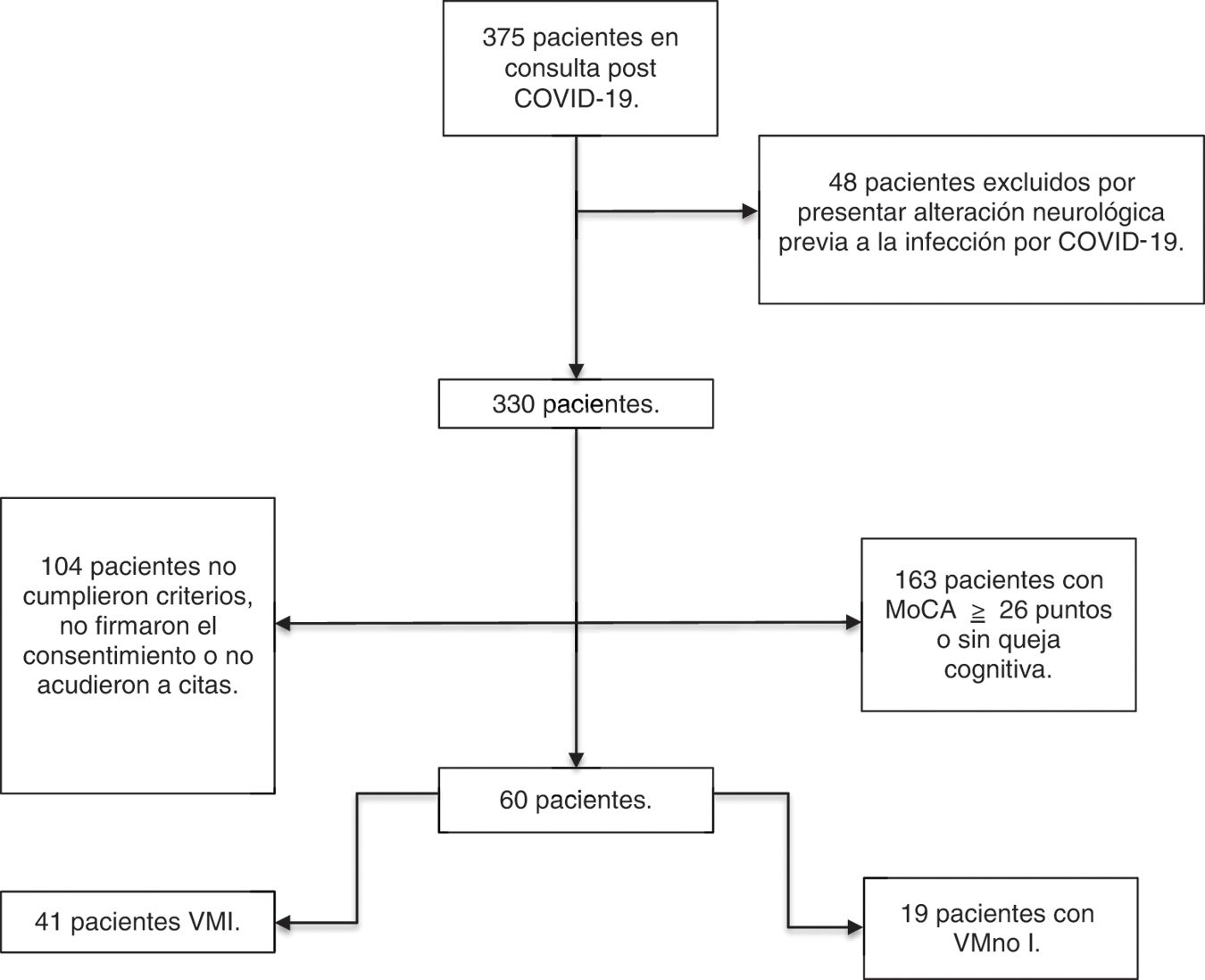
Material y métodosSe evaluó prospectivamente una cohorte de 375 personas sobrevivientes de la infección por SARS-CoV-2 de la consulta de PC-19 del Instituto Nacional de Enfermedades Respiratorias (INER), a 12 semanas del egreso hospitalario, en el periodo de diciembre de 2020 a abril de 2021.
Se evaluaron pacientes mayores de 18 años de edad, dados de alta hospitalaria con diagnóstico de enfermedad COVID-19, confirmada con prueba para PCR (hisopado orofaríngeo), quienes ingresaron bajo criterios de infección moderada y/o severa por SARS-CoV-2 según los criterios de la OMS, definida como enfermedad moderada: presencia de signos clínicos de neumonía: fiebre, tos, disnea y/o taquicardia, sin signos de neumonía severa y en particular con saturación de oxígeno (SaO2) ≥90% al aire ambiente; o enfermedad severa: saturación de oxígeno SpO2 <90%, relación entre la presión arterial parcial de oxígeno y la fracción de oxígeno inspirado (PaO2/FiO2) <300mmHg, frecuencia respiratoria >30 respiraciones/minuto21.
Con el fin de describir las alteraciones cognitivas PC-19 en la evaluación del seguimiento de esta cohorte, se establecieron varios criterios de inclusión: 1.Personas que obtuvieran puntajes en rangos menor a 26 puntos en el test de MoCA22. 2.Que reportaran quejas cognitivas subjetivas, independientemente del puntaje obtenido en el MoCA. 3.Que cumplieran con los criterios para el síndrome post-COVID-19; que los síntomas cognitivos se desarrollaran durante el periodo de la infección por SARS-CoV-2 y que persistieran después de 12 semanas23. Criterios de exclusión: involucro cognitivo previo a la infección por SARS-CoV-2, discapacidad intelectual, motora o sensorial, preexistencia de enfermedad neurológica o psiquiátrica.
De acuerdo a dichos criterios se seleccionó un grupo de 60 personas (fig. 1), quienes fueron referidas al Instituto Nacional de Neurología y Neurocirugía Manuel Velasco Suárez (INNNMVS), en donde se realizó una batería de pruebas neuropsicológicas extensa y estudio de imagen de resonancia magnética de cráneo (IRM). Este grupo seleccionado de pacientes tuvo en promedio 122 días (R=99-210; DE=21,25) del inicio de los síntomas de la infección al momento de la evaluación cognitiva y de neuroimagen.
Todos los pacientes firmaron un consentimiento informado obtenido de acuerdo a los principios de declaración de Helsinki. El protocolo fue aprobado por el Comité de Bioética del INER C48-20 y del INNNMVS 06-21.
Estudios de laboratorioLos siguientes marcadores inflamatorios fueron obtenidos en todos los pacientes al ingreso al hospital y posterior a 3 meses del egreso hospitalario: dímeroD, proteínaC reactiva, leucocitos, linfocitos totales, plaquetas, glucosa, urea, creatinina, fibrinógeno, creatina-fosfocinasa (CPK) y lactato deshidrogenasa (LDH).
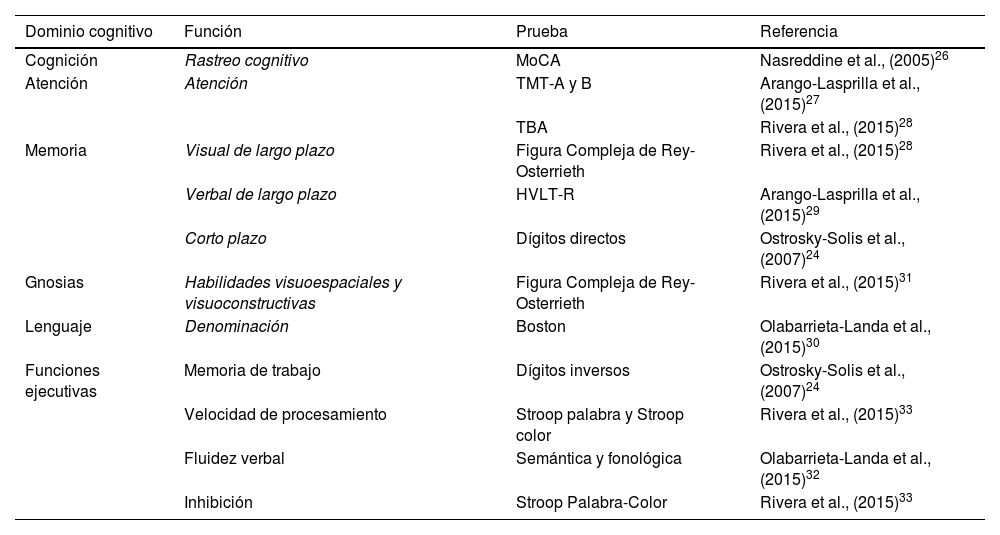
Valoración neuropsicológicaPara la valoración cognitiva extensa se utilizaron diversas pruebas neuropsicológicas (PNP) estandarizadas en población mexicana de acuerdo a la edad y el nivel de escolaridad24 (tabla 1).
Instrumentos de evaluación cognitiva
| Dominio cognitivo | Función | Prueba | Referencia |
|---|---|---|---|
| Cognición | Rastreo cognitivo | MoCA | Nasreddine et al., (2005)26 |
| Atención | Atención | TMT-A y B | Arango-Lasprilla et al., (2015)27 |
| TBA | Rivera et al., (2015)28 | ||
| Memoria | Visual de largo plazo | Figura Compleja de Rey-Osterrieth | Rivera et al., (2015)28 |
| Verbal de largo plazo | HVLT-R | Arango-Lasprilla et al., (2015)29 | |
| Corto plazo | Dígitos directos | Ostrosky-Solis et al., (2007)24 | |
| Gnosias | Habilidades visuoespaciales y visuoconstructivas | Figura Compleja de Rey-Osterrieth | Rivera et al., (2015)31 |
| Lenguaje | Denominación | Boston | Olabarrieta-Landa et al., (2015)30 |
| Funciones ejecutivas | Memoria de trabajo | Dígitos inversos | Ostrosky-Solis et al., (2007)24 |
| Velocidad de procesamiento | Stroop palabra y Stroop color | Rivera et al., (2015)33 | |
| Fluidez verbal | Semántica y fonológica | Olabarrieta-Landa et al., (2015)32 | |
| Inhibición | Stroop Palabra-Color | Rivera et al., (2015)33 |
HVLT-R: Test de Aprendizaje Verbal de Hopkins; MoCA: Evaluación Cognitiva de Montreal; STROOP: Prueba de STROOP color-palabra; TBA: Test Breve de Atención; TMT-A: Trail Making Test parte A; TMT-B: Trail Making Test parte B.
Para establecer el criterio de normalidad y afectación en las pruebas cognitivas se utilizaron puntuacionesZ, determinando alteración cognitiva nivel bajo Z <−1, y nivel muy bajo Z <−2 desviaciones estándar, lo cual equivale a un rango percentil del 1 al 25%, de acuerdo a los datos normativos para población mexicana24,25.
Se utilizó un cuestionario de Fallas de memoria en la vida cotidiana (FMVC) para valorar alteración subjetiva de memoria34. Así mismo, se valoraron síntomas psiquiátricos utilizando la escala de ansiedad y depresión hospitalaria35, y un cuestionario de salud del paciente PHQ-936.
Estudio de imagenSe realizaron estudios de imagen a través de una resonancia magnética de encéfalo (IRM) en un resonador SIEMENS MAGNETOM Skyra 3T. Las secuencias utilizadas y sus parámetros fueron los siguientes: T1FOV (field of view) 250mm, grosor de corte 1,00mm, TR 2200ms, TE 2,45ms; FLAIR FOV 240mm, grosor de corte 0,9mm, TR 5000ms, TE 387ms; T2 FOV 256mm, grosor de corte 1,00mm, TR 3200ms, TE 409ms; DWI FOV 220mm, grosor de corte 2,2mm, TR 5000ms, TE 102,00ms.
Las IRM fueron evaluadas por dos médicos neurorradiólogos con amplia experiencia. Para las lesiones de sustancia blanca se utilizó la escala semicuantitativa de calificación visual FAZEKAS, evaluada en las imágenes ponderadas en T2 y Fluid Attenuated Inversion Recovery (FLAIR). La escala consiste en identificar la distribución de lesiones hiperintensas de sustancia blanca (LSB) en diferentes regiones cerebrales, generalmente atribuidas a la enfermedad de vasos pequeños. Esta escala utiliza cuatro grados de puntuación: 0 (sin lesiones de sustancia blanca), 1 (LSB múltiples puntiformes aisladas), 2 (LSB con tendencia a confluir) o 3 (LSB en grandes áreas confluentes)37.
Para evaluar la pérdida de volumen cerebral, las regiones cerebrales fueron divididas en: frontal, temporal, parietal y generalizada. Para asignarles grado de severidad se utilizaron los sistemas de calificación cualitativa desarrollados para evaluar la atrofia cerebral, utilizados especialmente en el contexto de enfermedades neurodegenerativas. Los sistemas utilizados fueron la escala de atrofia generalizada (atrofia cortical global [Pesquier]), la escala de atrofia parietal posterior (Koedam) y la escala de atrofia medial temporal (Scheltens), según fuera el caso para dar la puntuación de 0 (ausente), 1 (leve), 2 (moderada) y 3 (severa)38. A su vez, la pérdida de volumen fue subdividida en los tipos cortical, subcortical y cortico-subcortical.
Ambos neurorradiólogos individualmente, pero en forma simultánea, revisaron todas las imágenes cerebrales basándose en las escalas definidas en la literatura para asignar grado de severidad tanto a las lesiones de sustancia blanca como a la pérdida de volumen cerebral; en caso de desacuerdo, se discutió para llegar a un consenso antes de emitir una calificación conjunta.
Manejo de datos y análisis estadísticoSe utilizó el programa estadístico SPSS versión 22, el análisis descriptivo de las variables se analizó de acuerdo con su distribución en frecuencias y porcentajes o medias y desviación estándar. Se valoró la normalidad de los datos mediante la prueba de Kolmogorov-Smirnov y se aplicó estadística paramétrica o no paramétrica dependiendo de la normalidad obtenida.
Se dividió a los pacientes en dos grupos: un grupo incluyó a personas que requirieron ventilación mecánica invasiva (VMI) y el segundo grupo quienes requirieron ventilación mecánica no invasiva (VMno-I). Se obtuvieron los porcentajes de déficit en cada prueba neuropsicológica por grupo, analizados a partir de puntuaciones estándar del país. Se realizó un análisis bivariado entre los grupos con las variables demográficas, clínicas, cognitivas e imagenológicas, usando prueba de chi cuadrado y Fisher para variables categóricas, y prueba t de Student y/o U de Mann-Whitney para las variables continuas. Se realizaron correlaciones mediante rho-Spearman en tres bloques: 1)valoración neuropsicológica con los estudios de laboratorio; 2)valoración neuropsicológica con las pruebas de imagen, y 3)valoración neuropsicológica con síntomas neuropsiquiátricos. Por último, se realizó un análisis de correlación parcial, con la intención de conocer la relación entre la ejecución cognitiva y resultados de imagen, controlada por grupo (VMI, VMno-I). Los datos se consideraron significativos cuando α <0,05.
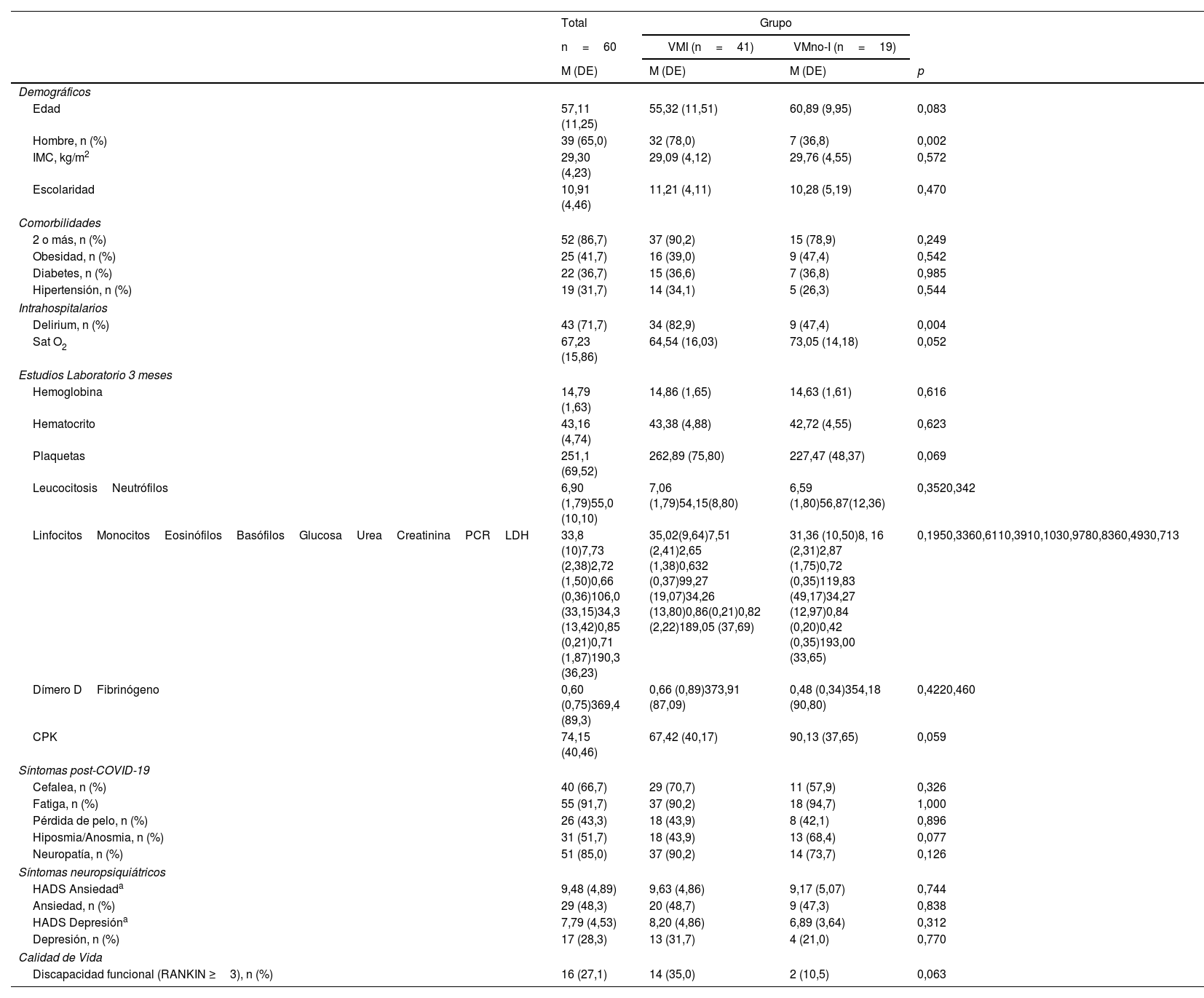
ResultadosLas características de la muestra de 60 personas seleccionadas para realizar estudio IRM cerebral y valoración neuropsicológica fueron: edad promedio 57,11 años, 65% hombres, escolaridad promedio 10,91 años. El 41,7% presentó obesidad, diabetes el 36,7%, hipertensión el 31,7%, y el índice de masa corporal promedio fue de 29,30kg/m2.
El 71,7% presentó delirium durante la estancia hospitalaria, y el 86,7%, dos o más comorbilidades clínicas. Como síntomas más frecuentes PC-19 encontramos que el 91,7% de los pacientes presentó fatiga y el 85,0%, neuropatía (tabla 2).
Características de la población estudiada. Comparación entre grupos
| Total | Grupo | |||
|---|---|---|---|---|
| n=60 | VMI (n=41) | VMno-I (n=19) | ||
| M (DE) | M (DE) | M (DE) | p | |
| Demográficos | ||||
| Edad | 57,11 (11,25) | 55,32 (11,51) | 60,89 (9,95) | 0,083 |
| Hombre, n (%) | 39 (65,0) | 32 (78,0) | 7 (36,8) | 0,002 |
| IMC, kg/m2 | 29,30 (4,23) | 29,09 (4,12) | 29,76 (4,55) | 0,572 |
| Escolaridad | 10,91 (4,46) | 11,21 (4,11) | 10,28 (5,19) | 0,470 |
| Comorbilidades | ||||
| 2 o más, n (%) | 52 (86,7) | 37 (90,2) | 15 (78,9) | 0,249 |
| Obesidad, n (%) | 25 (41,7) | 16 (39,0) | 9 (47,4) | 0,542 |
| Diabetes, n (%) | 22 (36,7) | 15 (36,6) | 7 (36,8) | 0,985 |
| Hipertensión, n (%) | 19 (31,7) | 14 (34,1) | 5 (26,3) | 0,544 |
| Intrahospitalarios | ||||
| Delirium, n (%) | 43 (71,7) | 34 (82,9) | 9 (47,4) | 0,004 |
| Sat O2 | 67,23 (15,86) | 64,54 (16,03) | 73,05 (14,18) | 0,052 |
| Estudios Laboratorio 3 meses | ||||
| Hemoglobina | 14,79 (1,63) | 14,86 (1,65) | 14,63 (1,61) | 0,616 |
| Hematocrito | 43,16 (4,74) | 43,38 (4,88) | 42,72 (4,55) | 0,623 |
| Plaquetas | 251,1 (69,52) | 262,89 (75,80) | 227,47 (48,37) | 0,069 |
| LeucocitosisNeutrófilos | 6,90 (1,79)55,0 (10,10) | 7,06 (1,79)54,15(8,80) | 6,59 (1,80)56,87(12,36) | 0,3520,342 |
| LinfocitosMonocitosEosinófilosBasófilosGlucosaUreaCreatininaPCRLDH | 33,8 (10)7,73 (2,38)2,72 (1,50)0,66 (0,36)106,0 (33,15)34,3 (13,42)0,85 (0,21)0,71 (1,87)190,3 (36,23) | 35,02(9,64)7,51 (2,41)2,65 (1,38)0,632 (0,37)99,27 (19,07)34,26 (13,80)0,86(0,21)0,82 (2,22)189,05 (37,69) | 31,36 (10,50)8, 16 (2,31)2,87 (1,75)0,72 (0,35)119,83 (49,17)34,27 (12,97)0,84 (0,20)0,42 (0,35)193,00 (33,65) | 0,1950,3360,6110,3910,1030,9780,8360,4930,713 |
| Dímero DFibrinógeno | 0,60 (0,75)369,4 (89,3) | 0,66 (0,89)373,91 (87,09) | 0,48 (0,34)354,18 (90,80) | 0,4220,460 |
| CPK | 74,15 (40,46) | 67,42 (40,17) | 90,13 (37,65) | 0,059 |
| Síntomas post-COVID-19 | ||||
| Cefalea, n (%) | 40 (66,7) | 29 (70,7) | 11 (57,9) | 0,326 |
| Fatiga, n (%) | 55 (91,7) | 37 (90,2) | 18 (94,7) | 1,000 |
| Pérdida de pelo, n (%) | 26 (43,3) | 18 (43,9) | 8 (42,1) | 0,896 |
| Hiposmia/Anosmia, n (%) | 31 (51,7) | 18 (43,9) | 13 (68,4) | 0,077 |
| Neuropatía, n (%) | 51 (85,0) | 37 (90,2) | 14 (73,7) | 0,126 |
| Síntomas neuropsiquiátricos | ||||
| HADS Ansiedada | 9,48 (4,89) | 9,63 (4,86) | 9,17 (5,07) | 0,744 |
| Ansiedad, n (%) | 29 (48,3) | 20 (48,7) | 9 (47,3) | 0,838 |
| HADS Depresióna | 7,79 (4,53) | 8,20 (4,86) | 6,89 (3,64) | 0,312 |
| Depresión, n (%) | 17 (28,3) | 13 (31,7) | 4 (21,0) | 0,770 |
| Calidad de Vida | ||||
| Discapacidad funcional (RANKIN ≥3), n (%) | 16 (27,1) | 14 (35,0) | 2 (10,5) | 0,063 |
CPK: creatin fosfoquinasa; HADS: Escala de Ansiedad y Depresión hospitalaria; IMC: índice de masa corporal; LDH: lactato deshidrogenasa; MoCA: Evaluación Cognitiva de Montreal; PCR: proteína C reactiva; RANKIN: Escala de Rankin; Sat O2: saturación de oxígeno; VMI: apoyo mecánico ventilatorio invasivo; VMno-I: ventilación mecánica no invasiva.
El 66% de la muestra obtuvo puntaje menor a 26 puntos en la prueba de MoCA y el 83,3% refirió quejas cognitivas, principalmente de atención y memoria.
Respecto a los resultados en la evaluación neuropsicológica extensa, el 85% de las personas presentó alteraciones en al menos una PNP. Las alteraciones en funciones ejecutivas fueron las de mayor frecuencia, el 78,3% presentó alteración en al menos una de estas pruebas y el 35%, alteraciones en al menos tres de ellas.
Comparación por grupos (VMI versus VMno-I)En cuanto a los resultados de estudios de laboratorio, no se observó significancia estadística entre grupos. Algunos valores promedio totales obtenidos fueron: leucocitos 6,90/mm3, linfocitos 33,81%, proteínaC reactiva 0,71mg/dl, dímeroD 0,60mg/l y CPK 74,15U/l.
Se observó mayor presencia de delirium en el grupo que requirió ventilación mecánica invasiva (VMI), a diferencia del grupo VMno-I (82,9% versus 47,4%; p=0,004) (tabla 2).
En cuanto a variables neuropsiquiátricas, no hubo diferencias entre grupos en sintomatología de depresión ni de ansiedad. Se observa en la tabla 2 que el grupo de VMI obtuvo un puntaje de 8,20 en la escala de depresión, versus el grupo VMno-I, que obtuvo un 6,89, sin ser una diferencia estadísticamente significativa (t=1,02; p=0,312). La ansiedad fue similar entre grupos: VMI obtuvo 9,63 versus VMno-I 9,17 (t=328; p=0,744).
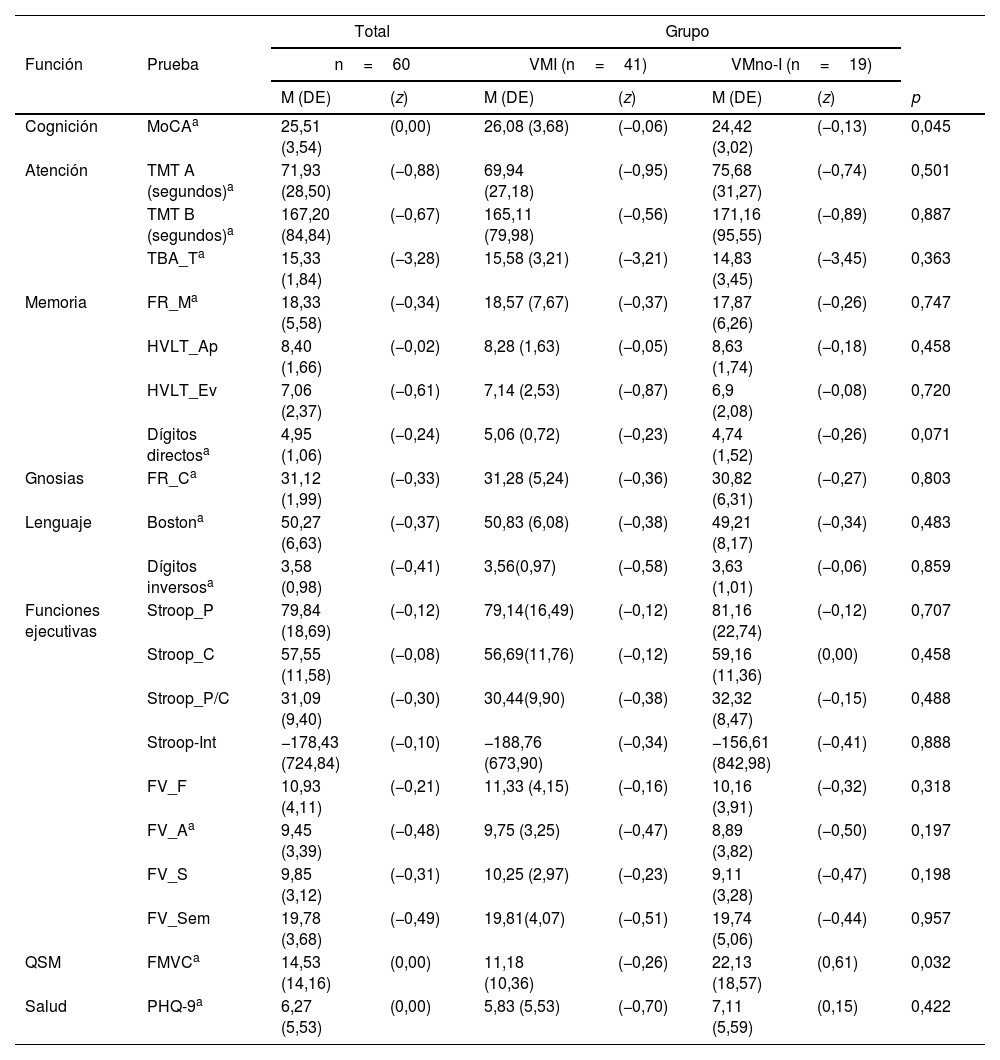
Al comparar las puntuaciones obtenidas en las valoraciones cognitivas por grupos, solo se observó diferencia estadísticamente significativa en el puntaje total del test de MoCA (p=0,045) y en los resultados de la escala FMVC, en donde el grupo VMno-I obtuvo mayor puntaje (22,13 promedio) en comparación con el grupo VMI (11,18 promedio) (p=0,032). Las puntuaciones en las demás pruebas no fueron significativamente diferentes entre grupos (tabla 3).
Resultados de la valoración neuropsicológica. Comparación entre grupos
| Total | Grupo | |||||||
|---|---|---|---|---|---|---|---|---|
| Función | Prueba | n=60 | VMI (n=41) | VMno-I (n=19) | ||||
| M (DE) | (z) | M (DE) | (z) | M (DE) | (z) | p | ||
| Cognición | MoCAa | 25,51 (3,54) | (0,00) | 26,08 (3,68) | (−0,06) | 24,42 (3,02) | (−0,13) | 0,045 |
| Atención | TMT A (segundos)a | 71,93 (28,50) | (−0,88) | 69,94 (27,18) | (−0,95) | 75,68 (31,27) | (−0,74) | 0,501 |
| TMT B (segundos)a | 167,20 (84,84) | (−0,67) | 165,11 (79,98) | (−0,56) | 171,16 (95,55) | (−0,89) | 0,887 | |
| TBA_Ta | 15,33 (1,84) | (−3,28) | 15,58 (3,21) | (−3,21) | 14,83 (3,45) | (−3,45) | 0,363 | |
| Memoria | FR_Ma | 18,33 (5,58) | (−0,34) | 18,57 (7,67) | (−0,37) | 17,87 (6,26) | (−0,26) | 0,747 |
| HVLT_Ap | 8,40 (1,66) | (−0,02) | 8,28 (1,63) | (−0,05) | 8,63 (1,74) | (−0,18) | 0,458 | |
| HVLT_Ev | 7,06 (2,37) | (−0,61) | 7,14 (2,53) | (−0,87) | 6,9 (2,08) | (−0,08) | 0,720 | |
| Dígitos directosa | 4,95 (1,06) | (−0,24) | 5,06 (0,72) | (−0,23) | 4,74 (1,52) | (−0,26) | 0,071 | |
| Gnosias | FR_Ca | 31,12 (1,99) | (−0,33) | 31,28 (5,24) | (−0,36) | 30,82 (6,31) | (−0,27) | 0,803 |
| Lenguaje | Bostona | 50,27 (6,63) | (−0,37) | 50,83 (6,08) | (−0,38) | 49,21 (8,17) | (−0,34) | 0,483 |
| Dígitos inversosa | 3,58 (0,98) | (−0,41) | 3,56(0,97) | (−0,58) | 3,63 (1,01) | (−0,06) | 0,859 | |
| Funciones ejecutivas | Stroop_P | 79,84 (18,69) | (−0,12) | 79,14(16,49) | (−0,12) | 81,16 (22,74) | (−0,12) | 0,707 |
| Stroop_C | 57,55 (11,58) | (−0,08) | 56,69(11,76) | (−0,12) | 59,16 (11,36) | (0,00) | 0,458 | |
| Stroop_P/C | 31,09 (9,40) | (−0,30) | 30,44(9,90) | (−0,38) | 32,32 (8,47) | (−0,15) | 0,488 | |
| Stroop-Int | −178,43 (724,84) | (−0,10) | −188,76 (673,90) | (−0,34) | −156,61 (842,98) | (−0,41) | 0,888 | |
| FV_F | 10,93 (4,11) | (−0,21) | 11,33 (4,15) | (−0,16) | 10,16 (3,91) | (−0,32) | 0,318 | |
| FV_Aa | 9,45 (3,39) | (−0,48) | 9,75 (3,25) | (−0,47) | 8,89 (3,82) | (−0,50) | 0,197 | |
| FV_S | 9,85 (3,12) | (−0,31) | 10,25 (2,97) | (−0,23) | 9,11 (3,28) | (−0,47) | 0,198 | |
| FV_Sem | 19,78 (3,68) | (−0,49) | 19,81(4,07) | (−0,51) | 19,74 (5,06) | (−0,44) | 0,957 | |
| QSM | FMVCa | 14,53 (14,16) | (0,00) | 11,18 (10,36) | (−0,26) | 22,13 (18,57) | (0,61) | 0,032 |
| Salud | PHQ-9a | 6,27 (5,53) | (0,00) | 5,83 (5,53) | (−0,70) | 7,11 (5,59) | (0,15) | 0,422 |
Boston: Prueba de denominación de Boston; D_Dir: Dígitos directos; D_Inv: Dígitos inversos; FMVC: fallas de memoria en la vida cotidiana; FR_C: Figura de Rey Copia; FR_M: Figura de Rey Memoria; FV_A: Fluidez Verbal palabras con A; FV_F: Fluidez Verbal palabras con F; FV_S: Fluidez Verbal palabras con S; FV_Sem: Fluidez Verbal Semántica; HVLT_Ap: Test de aprendizaje verbal de Hopkins aprendizaje; HVLT_Ev: Test de aprendizaje verbal de Hopkins evocación; MoCA: Evaluación cognitiva de Montreal; PHQ-9: Cuestionario de salud del paciente; QSM: Queja Subjetiva de Memoria; Stroop_C: Prueba de Stroop Color; Stroop_Int: Prueba de Stroop Interferencia; Stroop_P: Prueba de Stroop Palabras; Stroop_P/C: Prueba de Stroop Palabra/Color; TBA_T: Test Breve de Atención puntuación total; TMT-A: Trail Making Test parte A; TMT-B: Trail Making Test parte B; VMI: apoyo mecánico ventilatorio invasivo; VMno-I: ventilación mecánica no invasiva.
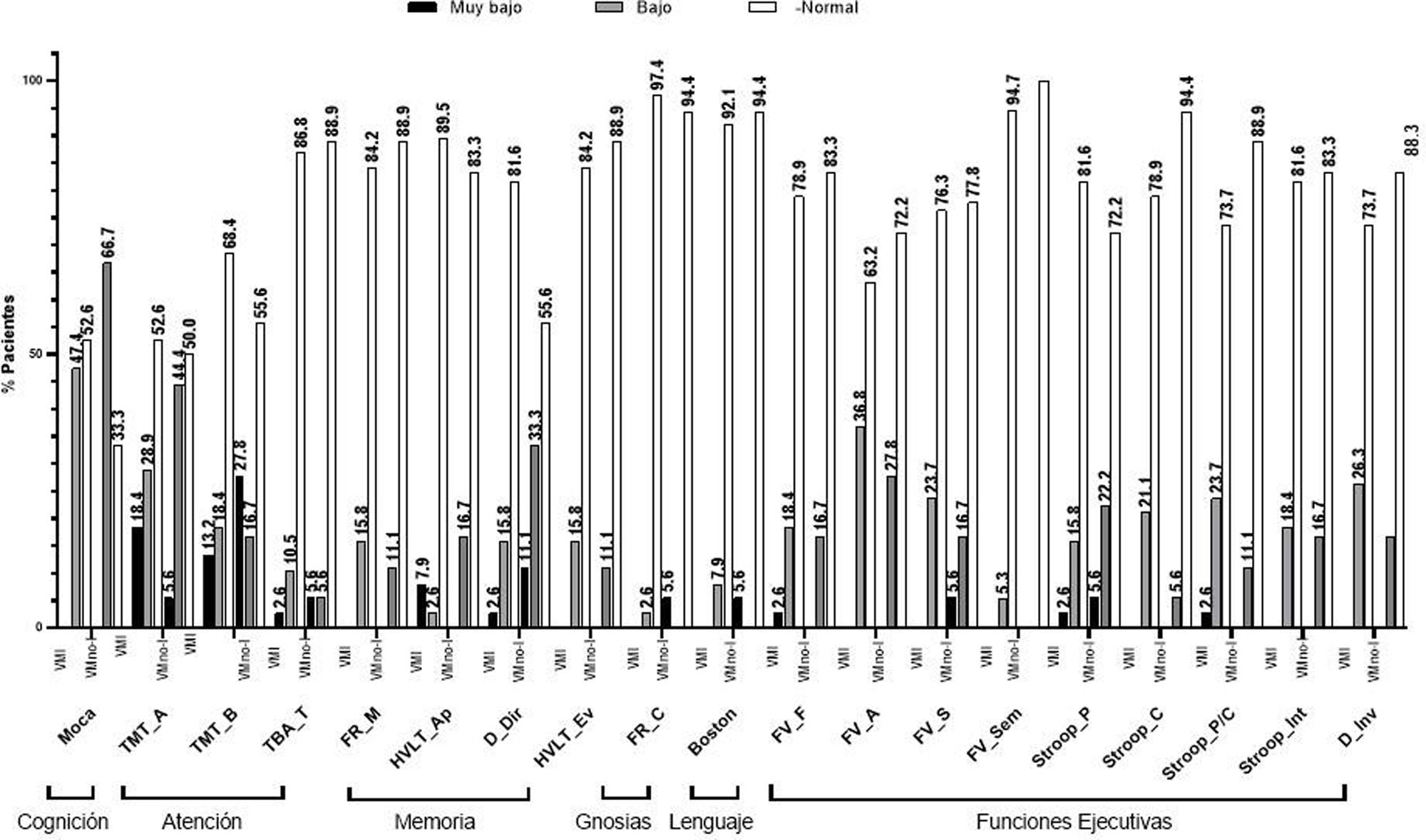
Utilizando baremos para población mexicana, observamos que varias de las puntuaciones en las PNP estuvieron por debajo del punto de corte. En el grupo VMI, el 18,4% en el TMT-A, en el test de MoCA el 47,4%, y en tareas de FV-fonológica el 36,8%. Respecto al grupo VMno-I, el 27,8% puntuó por debajo del punto de corte en la prueba TMT-B, en el TMT-A el 44,4%, y el 66,7% en el test de MoCA (fig. 2).
Porcentaje de desempeño en la valoración neuropsicológica por prueba.Boston: Prueba de denominación de Boston; D_Dir: Dígitos directos; D_Inv: Dígitos inversos; FR_C: Figura de Rey Copia; FR_M: Figura de Rey Memoria; FV_A: Fluidez Verbal palabras con A; FV_F: Fluidez Verbal palabras con F; FV_S: Fluidez Verbal palabras con S; FV_Sem: Fluidez Verbal Semántica; HVLT_Ap: Test de aprendizaje verbal de Hopkins aprendizaje; HVLT_Ev: Test de aprendizaje verbal de Hopkins evocación; MoCA: evaluación cognitiva de Montreal; Stroop_C: Prueba de Stroop Color; Stroop_Int: Prueba de Stroop Interferencia; Stroop_P/C: Prueba de Stroop Palabra/Color; Stroop_P: Prueba de Stroop Palabras; TBA_T: Test Breve de Atención puntuación total; TMT-A: Trail Making Test parte A; TMT-B: Trail Making Test parte B.
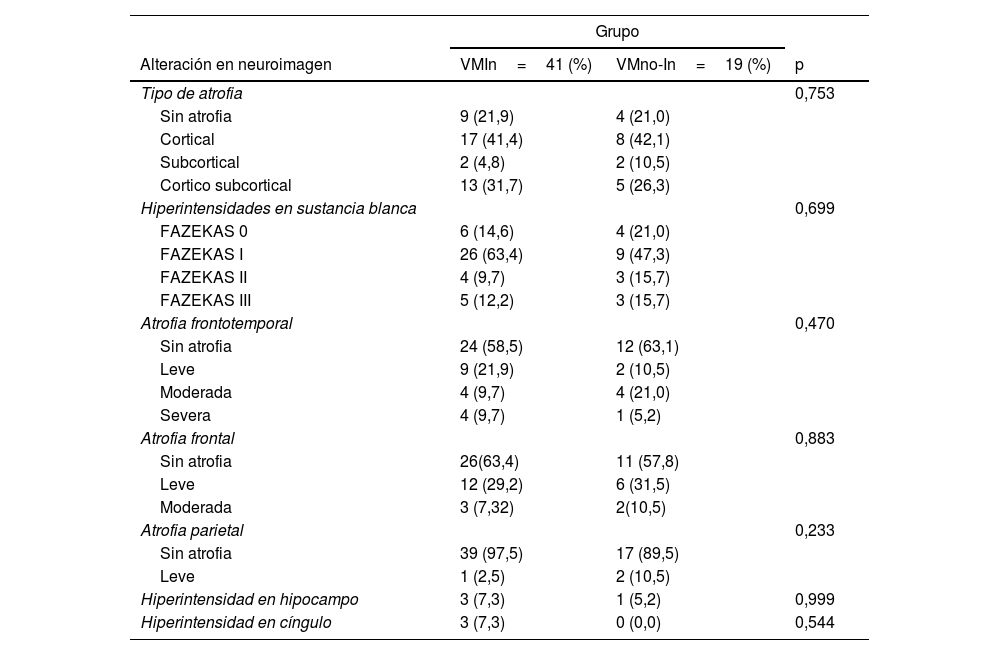
En la tabla 4 se muestran los resultados de la IRM. Se observaron lesiones hiperintensas en sustancia blanca subcortical FAZEKASI en 35 pacientes, el 63,4% del grupo VMI y el 47,3% del grupo VMno-I; FAZEKASII en el 9,7% de los pacientes del VMI y el 15,7% del grupo VMno-I, y FAZEKASIII con predominio en el grupo VMno-I (15,7% de los pacientes) versus 12,2% del grupo VMI. Cabe destacar que ninguna comparación entre grupos fue significativa.
Comparación entre grupos de acuerdo al tipo de alteración en neuroimagen
| Grupo | |||
|---|---|---|---|
| Alteración en neuroimagen | VMIn=41 (%) | VMno-In=19 (%) | p |
| Tipo de atrofia | 0,753 | ||
| Sin atrofia | 9 (21,9) | 4 (21,0) | |
| Cortical | 17 (41,4) | 8 (42,1) | |
| Subcortical | 2 (4,8) | 2 (10,5) | |
| Cortico subcortical | 13 (31,7) | 5 (26,3) | |
| Hiperintensidades en sustancia blanca | 0,699 | ||
| FAZEKAS 0 | 6 (14,6) | 4 (21,0) | |
| FAZEKAS I | 26 (63,4) | 9 (47,3) | |
| FAZEKAS II | 4 (9,7) | 3 (15,7) | |
| FAZEKAS III | 5 (12,2) | 3 (15,7) | |
| Atrofia frontotemporal | 0,470 | ||
| Sin atrofia | 24 (58,5) | 12 (63,1) | |
| Leve | 9 (21,9) | 2 (10,5) | |
| Moderada | 4 (9,7) | 4 (21,0) | |
| Severa | 4 (9,7) | 1 (5,2) | |
| Atrofia frontal | 0,883 | ||
| Sin atrofia | 26(63,4) | 11 (57,8) | |
| Leve | 12 (29,2) | 6 (31,5) | |
| Moderada | 3 (7,32) | 2(10,5) | |
| Atrofia parietal | 0,233 | ||
| Sin atrofia | 39 (97,5) | 17 (89,5) | |
| Leve | 1 (2,5) | 2 (10,5) | |
| Hiperintensidad en hipocampo | 3 (7,3) | 1 (5,2) | 0,999 |
| Hiperintensidad en cíngulo | 3 (7,3) | 0 (0,0) | 0,544 |
VMI: apoyo mecánico ventilatorio invasivo; VMno-I: ventilación mecánica no invasiva.
El mayor tipo de atrofia fue a nivel cortical, presente en 25 pacientes (41,4% VMI y 42,1% en aquellos con VMno-I), seguido del tipo córtico-subcortical en 18 pacientes (31,7% con VMI versus 26,3% VM no-I) y subcortical en 4 pacientes (VMI 4,8% y VMno-I 10,5%).
La atrofia frontotemporal fue la más observada en 24 pacientes: 17 del grupo VMI (41,3%) en comparación con 7 del grupo VMno-I (36,7%), seguida de la región frontal en 15 pacientes en el grupo VMI (36,5%) versus 8 pacientes del grupo VMno-I (42,0%).
Solo se observaron lesiones hiperintensas en la región hipocampal en 4 pacientes, siendo más frecuente en los pacientes del grupo VMI (7,3%) (tabla 4).
Correlaciones rho-SpearmanEn las comparaciones entre resultados neuropsicológicos y resultados de estudios de laboratorio se observaron relaciones significativas entre glucosa con la prueba HVLT_Ev (−0,278; p=0,049). La Urea con Stroop_int (0,323; p=0,018), HVLT_ap (−0,278; p=0,043) y HVLT_Ev (−0,359; p=0,008). En cuanto al LDH, mostró relación con las pruebas HVLT_Ev (−0,285; p=0,043) y TBA_T −0,358; p=0,010) (tabla S1).
En lo referente a resultados en las pruebas neuropsicológica con resultados de imagen, se observaron relaciones entre el tipo de atrofia con las pruebas FV_F (−0,277; p=0,041), FV_A (−0,315; p=0,019). Las hiperintensidades en sustancia blanca con las pruebas FV_F (−0,280; p=0,038), FV_S (−0,329; p=0,014). La atrofia parietal con las pruebas Boston (−0,296; p=0,028), Stroop_C (−0,283; p=0,036), TMT_B (−0,273; p=0,044), FR_M (−0,336; p=0,012). La hiperintensidad en hipocampo con HVLT_Ap (−0,371; p=0,005). Por último, la hiperintensidad en cíngulo con HVLT_Ap (−0,308; p=0,022) (tabla S2).
En cuanto a resultados neuropsicológicos con síntomas neuropsiquiátricos, se muestran relaciones entre FMVC con las FE_BE (0,319; p=0,035). El PHQ-9 con las pruebas Stroop_int (−0,315; p=0,018), D_inv (−0,331; p=0,013) (tabla S3).
Las relaciones observadas en los resultados de la valoración neuropsicológica con resultados de laboratorio, imagen y síntomas neuropsiquiátricos son significativas pero bajas; todas las correlaciones observadas se muestran en el material suplementario (tablas S1, S2, S3).
Correlación parcial entre resultados cognitivos e imagenSe observó una relación inversa y significativa entre la prueba de Boston (−0,287; p=0,035), la evocación de la figura de Rey (−0,324; p=0,017) y atrofia parietal, al igual que fluidez verbal fonológica con atrofia frontal (−0,276; p=0,042). La prueba HVLT (ensayo de aprendizaje) se relacionó con hiperintensidad en hipocampo (−0,266; p=0,050) e hiperintensidad en cíngulo (0,311; p=0,021). La prueba TMT-B se relacionó en forma directa con hiperintensidad en sustancia blanca (0,345; p=0,010).
Resultados comparativos con estado funcionalEl estado funcional fue medido por la escala de RANKIN; se consideró mal pronóstico funcional un RANKIN >3. En la tabla 2 se observa que el 27,1% del total de pacientes tuvo mal pronóstico funcional: el 35% del grupo VMI versus el 10,5% del grupo VMno-I.
La presencia de mal pronóstico funcional se correlacionó con ansiedad (p<0,001), depresión (p<0,001), niveles elevados de dímeroD (p=0,002) y el aumento en los días de intubación (p=0,005).
Otras variables relacionadas al mal pronóstico funcional en personas que requirieron VMI fueron la persistencia de neumonía a los 3meses y la neuropatía del paciente crítico (p=0,030). No se encontraron correlaciones entre estado funcional (RANKIN) y resultados de las pruebas cognitivas.
DiscusiónEl presente es un estudio pionero en México, representativo de las dos primeras olas de infección por COVID-19 en pacientes con sintomatología moderada y grave, a quienes, a los tres meses de egreso hospitalario, se les realizó una valoración clínica neurológica, evaluación neuropsicológica y estudio con IRM.
Existen diversas investigaciones que se han enfocado en la relación entre los síntomas cognitivos y el deterioro a nivel cerebral; sin embargo, son escasos los trabajos que se centran en el estudio de pacientes PC-19 hospitalizados10. Este es uno de los pocos estudios que describen la asociación entre las alteraciones cognitivas y las lesiones cerebrales en pacientes PC-19 que requirieron hospitalización y apoyo de ventilación mecánica, invasiva y no invasiva.
De acuerdo con los resultados obtenidos con la prueba de MoCA, encontramos que el 66% de los pacientes evaluados presentó alteraciones cognitivas PC-19, lo cual concuerda con estudios que reportan que, posterior a cursar con un síndrome de dificultad respiratoria aguda (SDRA), existe un porcentaje alto (70% al 100%) de pacientes que experimentan deficiencias cognitivas al egreso hospitalario, las cuales persisten a largo plazo hasta en un 50% de los casos39,40.
Teniendo en cuenta los resultados de la valoración cognitiva extensa, observamos que el 85% de las personas puntuaron por debajo de la media poblacional, de acuerdo con datos normativos, en al menos una prueba, principalmente en aquellas que evalúan procesos atencionales y ejecutivos. Estos hallazgos son similares al estudio reportado por Voruz et al.41, quienes argumentan que las formas moderadas y graves de COVID-19 causan mayores déficits neuropsicológicos a largo plazo que los que se encontrarían en una población normativa, reforzando la hipótesis de los efectos a largo plazo del SARS-CoV-2 en la función cognitiva, independientemente de la gravedad de la infección inicial.
Como se mencionó anteriormente, todos los pacientes incluidos en este estudio presentaron sintomatología moderada-grave, requiriendo hospitalización y ventilación mecánica, y aunque no contamos con un grupo con sintomatología leve, se corroboran alteraciones cognitivas post COVID-19 tres meses después del egreso hospitalario. Se ha reportado un peor perfil cognitivo en pacientes hospitalizados en comparación con no-hospitalizados, caracterizado por alteraciones en áreas de atención y memoria de trabajo, velocidad de procesamiento, memoria, lenguaje y habilidades visuoespaciales10. Badenoch et al.42 reportan deterioro cognitivo, ansiedad, síntomas postraumáticos y depresión como síntomas comunes en los primeros seis meses posterior a la infección por COVID-19. Se ha sugerido que las alteraciones de los pacientes PC-19 se caracterizan por tener un proceso dinámico10 y multifactorial40, lo cual puede mediar la severidad de los síntomas.
Encontramos que el 35% de los pacientes obtuvo puntajes por debajo del promedio de la media, en al menos tres de las tareas relacionadas con funciones ejecutivas. Mazza et al.43 encontraron alteraciones en las funciones ejecutivas, en la mitad de los pacientes con PC-19 después de tres meses de la hospitalización: el 30% presentó bajo rendimiento en las pruebas que evalúan procesamiento de la información, fluidez verbal y memoria de trabajo. Almeria et al.8 reportaron manifestaciones neurológicas frecuentes en pacientes PC-19, incluido el deterioro cognitivo: puntajes bajos en pruebas de memoria, atención y funciones ejecutivas, lo cual concuerda con nuestros resultados, ya que, además de encontrar alteraciones en funciones ejecutivas, encontramos alteraciones en tareas que evalúan áreas como memoria (HVLT) y atención (TMT A y B).
Las alteraciones cognitivas en nuestra población no mostraron asociación con factores clínicos o biomarcadores de laboratorio, y las correlaciones significativas fueron bajas. Similar a lo reportado por García-Sánchez et al.44, quienes muestran que los déficits atencionales y ejecutivos encontrados en pacientes con quejas cognitivas subjetivas posteriores a COVID-19 no estaban relacionados en gran medida con factores clínicos como la hospitalización, la duración de la enfermedad, los biomarcadores o las medidas afectivas45.
Existen pocos estudios que comparen sintomatología cognitiva de pacientes que requirieron VMI versus los que no necesitaron VMI (VMno-I); el estudio realizado por Alemanno et al.46 reporta puntajes más altos en las subpruebas del MoCA que evalúan funciones visuoespaciales, ejecutivas, memoria a corto plazo, abstracción y orientación, en el grupo de pacientes que requirieron VMI. Al igual que dicho estudio, observamos que los pacientes del grupo VMI presentaron una mejor ejecución en la prueba de MoCA en comparación con el grupo VMno-I. Como menciona Alemanno et al.46, estos datos son inesperados, ya que muestran que los pacientes que se sometieron a ventilación invasiva, es decir, pacientes en el estado clínico más crítico, fueron pacientes con el estado cognitivo menos comprometido. Sin embargo, al evaluar en forma más dirigida el deterioro cognitivo a través de una evaluación extensa y con pruebas específica para cada función, no se observan diferencias significativas en el desempeño en las PNP entre grupos. Cabe destacar que en estos autores no realizaron pruebas neuropsicológicas dirigidas a evaluar los diferentes dominios de manera específica.
En Latinoamérica se han realizado estudios enfocados en evaluar el deterioro cognitivo PC-19. Del Brutto et al.47, en un estudio de cohorte, compararon la ejecución cognitiva pre y pospandémicas de individuos tanto seropositivos y seronegativos, reportando el 20% de deterioro cognitivo en pacientes de COVID-19 versus solo el 2% en los del grupo seronegativo; en este caso también la evaluación se basó en la escala de MoCA y no en pruebas neuropsicológicas específicas para valorar diferentes funciones cognitivas.
En lo referente a la escala de fallos de memoria en la vida cotidiana (FMVC), observamos que el grupo VMno-I obtuvo puntaje alto en comparación con los VMI. Podríamos relacionar estos resultados con la conciencia del entorno que vivieron los pacientes del grupo VMno-I durante su hospitalización, en comparación con los pacientes que requirieron VMI, quienes fueron sedados, y esto les permitió evitar el estrés de la situación durante su hospitalización. Estos resultados son consistentes en la literatura con datos similares entre grupos48. Maydych49 sugiere que el estrés agudo y crónico estaría asociado con un aumento de los mecanismos de inflamación y un mayor procesamiento atencional de la información negativa. Ambos fenómenos son predictivos de los síntomas de depresión, que, a su vez, aumentan la reactividad inflamatoria y cognitiva al estrés.
En relación con la imagen cerebral, encontramos lesiones hiperintensas de sustancia blanca, así como atrofia cerebral, muy similar a lo ya documentado en otros estudios en individuos PC-19 en comparación con grupos controles50.
Se ha descrito la relación entre alteraciones en sustancia blanca en diferentes regiones cerebrales, como región frontal superior, postcentral, cíngulo, tracto corticoespinal, fascículo longitudinal inferior, cápsula interna y segmento posterior del fascículo arqueado de lado derecho con fallas ejecutivas, lenguaje y velocidad de procesamiento6.
Igualmente, encontramos correlación entre atrofia cerebral y funciones cognitivas, reportamos correlación de atrofia a nivel frontal con funciones ejecutivas (fluidez verbal fonológica), así como correlación entre atrofia parietal con la prueba que evalúa gnosias visuales y memoria, así como hiperintensidad en hipocampo e hiperintensidad en cíngulo con la prueba que evalúa aprendizaje. La hiperintensidad en sustancia blanca se relacionó con pruebas de atención. De forma similar, el estudio de Douaud et al.51 menciona un mayor grado de pérdida de volumen en pacientes hospitalizados, destacando atrofia frontoparietal y temporal, así como fallas en pruebas que evalúan la función ejecutiva y la atención. Otro estudio que apoya los resultados obtenidos es el realizado por Diez-Cirarda et al.10, en donde reportan relación entre pérdida de volumen hipocampal, subtemporales y cerebelar anterior, con déficits en pruebas que evalúan memoria, atención y velocidad de procesamiento.
Es importante destacar que, al hacer el análisis de comparación por grupos, de acuerdo a la ventilación mecánica requerida por los pacientes, observamos que los grupos no son significativamente diferentes en cuanto al perfil cognitivo y a los hallazgos de IRM. El involucro de diferentes regiones y el fallo en distintas funciones que muestra este y los diversos estudios citados sugieren la existencia de múltiples sistemas y mecanismos implicados en la generación del déficit cognitivo10.
En la mayoría de las series de casos de deterioro cognitivo PC-19 descritos hasta fecha, los métodos de evaluación cognitiva son variables y pueden ir desde una encuesta hasta una evaluación telefónica, por lo que es difícil determinar la prevalencia real del deterioro cognitivo post-COVID en esta población. Es importante enfatizar en la utilización de una evaluación neuropsicológica extensa que nos permita identificar el perfil cognitivo de los pacientes y describir los síntomas persistentes PC-19, ya que es un aspecto relevante para identificar el desarrollo posterior de deterioro cognitivo mayor; un posible fenómeno que está implicado es la neurodegeneración como un estado inflamatorio crónico, causado por la posibilidad de que la infección por SARS-CoV-2 pueda acelerar o desencadenar en el futuro el desarrollo de enfermedades neurodegenerativas, lo que aún no ha sido demostrado.
Nuestro estudio tiene limitaciones. Primero, se trata de una muestra pequeña y de pacientes que requirieron hospitalización, es decir, no se incluyeron pacientes con infección leve ni grupo control. Segundo, nuestra muestra proviene de un hospital de tercer nivel de atención, que ha sido el principal centro de referencia de pacientes con enfermedad severa durante la pandemia en la Ciudad de México, por lo que no se tiene el acceso fácil a pacientes con sintomatología leve, que nos permitiría hacer otro tipo de análisis de acuerdo a la gravedad de la enfermedad. Como tercera limitación, se sabe que el delirium es más frecuente en pacientes que requirieron ventilación mecánica invasiva, y que su origen es multifactorial; sin embargo, no analizamos los demás factores que influyen en la presencia del mismo.
Este estudio se basa en la valoración estructurada cara a cara, con una exploración neurológica completa, incluyendo estudios de laboratorio, evaluación neuropsicológica extensa con pruebas validadas en nuestro país y escalas de funcionalidad y neuropsiquiátricas, lo que permite una búsqueda sistemática de anomalías objetivas residuales después de la COVID-19.
ConclusiónNuestro estudio sugiere que existen alteraciones cognitivas en pacientes que tuvieron infección moderada-grave por COVID-19 tres meses después del egreso hospitalario, principalmente en funciones ejecutivas, atención y memoria. Encontramos lesiones de sustancia blanca y atrofia cerebral en regiones frontales y parietales que se asocian a déficits cognitivos. Estos resultados son independientes del mecanismo ventilatorio requerido por los pacientes VMI o VMno-I.
Nuestros hallazgos destacan la necesidad clínica de programas longitudinales capaces de evaluar el impacto real de la infección por SARS-CoV-2 en el sistema nervioso central, manifestadas en el área cognitiva y emocional.
FinanciaciónEsta investigación no recibió ningún apoyo específico o financiamiento del sector público, comercial o sin fines de lucro.
Conflicto de interesesLos autores niegan conflicto de intereses de cualquier tipo.