La Guía para el manejo del dolor en neurorrehabilitación del daño cerebral sobrevenido (DCS) de personas adultas de la Sociedad Española de Neurorrehabilitación (SENR) está basada en la revisión y análisis de la bibliografía disponible sobre el tema. Estableciéndose recomendaciones según el nivel de evidencia que ofrecen los estudios revisados.
DesarrolloLa metodología seguida por la SENR para la elaboración de la presente guía se basa en el análisis de las guías de prácticas clínicas nacionales e internacionales de los últimos siete años, llevado a cabo en función de las consideraciones del manejo que dicta la evidencia para las clases de dolor habituales en la población de personas que han sufrido un DCS.
ConclusionesEl dolor es un síntoma habitual en personas que han sufrido daño cerebral teniendo un impacto negativo en la calidad de vida y en la adherencia al proceso rehabilitador. A la hora de clasificar el tipo de dolor según las características etiológicas, para optimizar el tipo de abordaje terapéutico, se suele hablar de dolor nociceptivo y dolor neuropático, aunque con frecuencia el dolor en estos pacientes presenta características «mixtas». El tipo de dolor más habitual es el nociceptivo frente al neuropático. Los cuadros sindrómicos dolorosos que aparecen con más frecuencia en esta población son la cefalea, el hombro doloroso del hemipléjico (HDH) y el dolor central posictus (DCPI). Al ser el dolor una experiencia subjetiva, las personas con afectación del nivel de consciencia, alteraciones cognitivas severas y/o problemas severos de lenguaje pueden tener muchas dificultades o ser incapaces de comunicarlo. Es importante, por tanto, una adecuada anamnesis y exploración física dirigida, así como el uso de escalas específicas para su correcto diagnóstico. Finalmente, muchos de los fármacos utilizados para su manejo tienen un efecto negativo en la rehabilitación, afectando a procesos cognitivos, y/o empeorando otros síntomas neurológicos. Este hecho, junto a la circunstancia de que muchas veces se trate de personas con otras patologías y polimedicadas, hace que el abordaje del dolor deba ser especialmente meticuloso y desde un enfoque multidisciplinar.
We present the guidelines for pain management in neurorehabilitation of brain injury in adults of the Spanish Society of Neurorehabilitation based on the review and analysis of the available literature on the subject. We establish recommendations according to the level of evidence offered by the reviewed studies.
DevelopmentThe methodology followed by the Spanish Society of Neurorehabilitation for the elaboration of the present guide is based on the analysis of the national and international clinical practice guidelines of the last seven years, carried out according to the management considerations dictated by the evidence for the usual types of pain in the population of people who have suffered an acquired brain injury.
ConclusionsPain is a common symptom in patients who have suffered brain damage, having a negative impact on quality of life and adherence to the rehabilitation process. When classifying the type of pain according to etiological characteristics, in order to optimize the type of therapeutic approach, we usually refer to pain as nociceptive, and neuropathic pain, although pain in such patients often has “mixed” characteristics. The most common type of pain is nociceptive ahead of neuropathic. The most common pain syndromes in this population are headache, hemiplegic shoulder pain and poststroke central pain. As pain is a subjective experience, people with impaired level of consciousness, severe cognitive impairment and/or severe language problems may have greater difficulty or even being unable to communicate it. An adequate clinical history and a directed physical examination, as well as the use of specific scales for its correct diagnosis are therefore important. Finally, many of the drugs used for its management have a negative impact on rehabilitation, affecting cognitive processes, and/or worsening other neurological symptoms. Furthermore, these patients often have several comorbidities and are frequently on several drugs which means that the approach to pain management must be carefully elaborated by a multidisciplinary team approach.
Recientemente, la Asociación Internacional para el Estudio del Dolor (IASP) ha reformulado la última definición de dolor previamente establecida en el año 1979, describiéndola en el 2020 como: «Una experiencia sensorial y emocional desagradable asociada o similar a la asociada con daño tisular real o potencial»1. Este mismo grupo de expertos de la IASP pone en relieve varios puntos de interés en su última publicación, como las diferencias entre los conceptos de dolor y nocicepción, por ejemplo. Subrayan también el hecho de que el dolor es siempre una experiencia personal influenciada en mayor o menor grado por factores biológicos, psicológicos y sociales, por lo que toda manifestación debe ser respetada. Por otra parte, se recuerda que, si bien el dolor cumple una función adaptativa, puede tener efectos adversos sobre la función y el bienestar social y psicológico. Otro aspecto histórico reciente es el hecho de que la Organización Mundial de la Salud (OMS) en su nueva clasificación internacional de enfermedades (CIE-11) de mayo del 2019 haya dividido los tipos de «dolor crónico», en cuanto a su intensidad, alteraciones orgánicas e impacto en el aspecto cognitivo y funcional de la persona afectada. Estas pinceladas acerca de la revisión de conceptos en el campo del dolor nos dan una idea de la importancia que toma la atención del mismo como síntoma complejo en distintas áreas de la medicina, incluyendo la neurorrehabilitación.
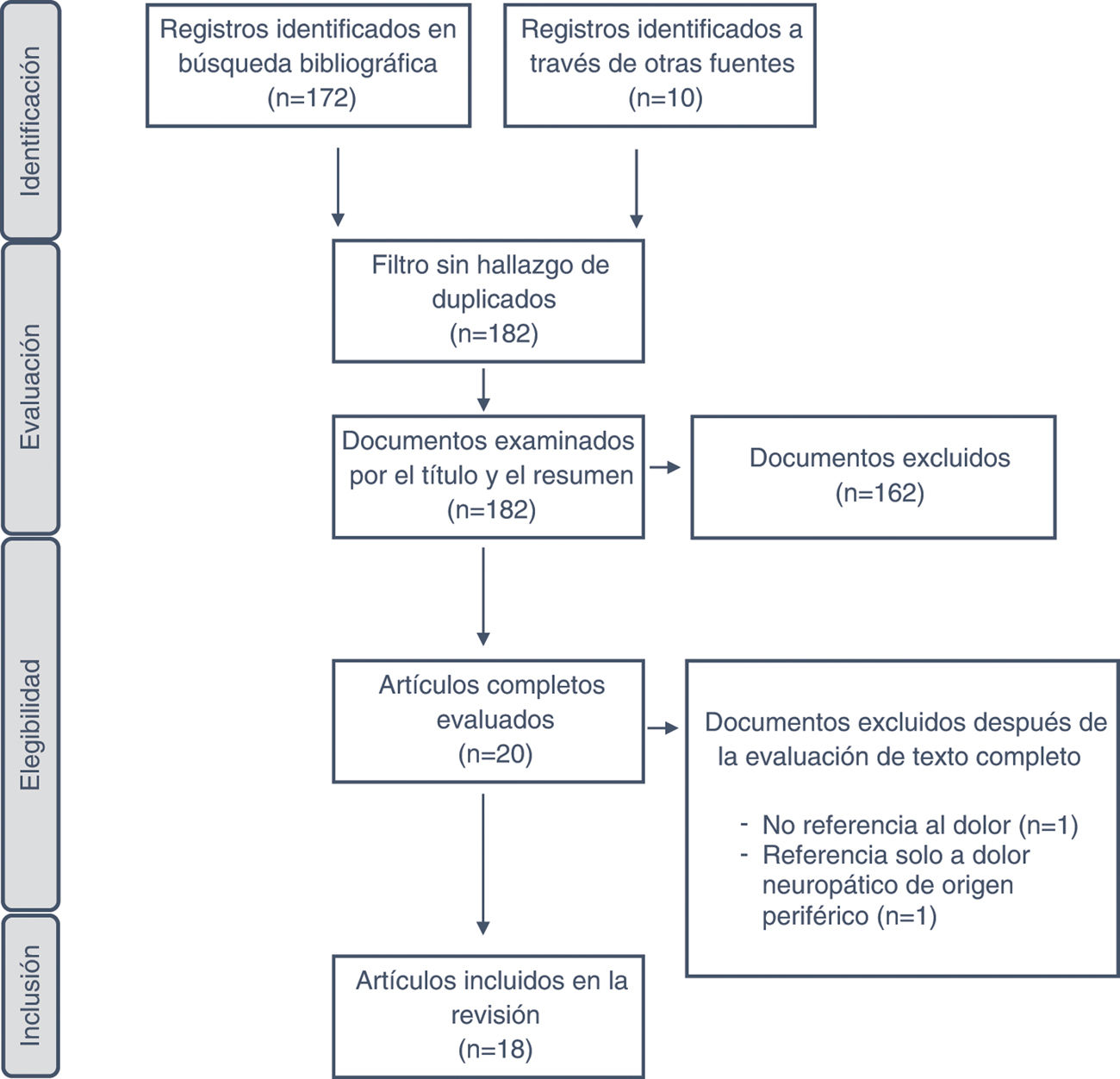
Teniendo en cuenta la frecuencia y el impacto del dolor en los pacientes con daño cerebral sobrevenido (DCS), el presente estudio pretende guiar la práctica clínica en el manejo del dolor, en sus distintas expresiones, en el paciente con DCS que se encuentra en proceso de neurorrehabilitación. Esto de acuerdo con el mejor y más reciente grado de evidencia disponible hasta hoy en día en personas adultas (> 16 años) tras sufrir un ictus (isquémico o hemorrágico) o traumatismo craneoencefálico (TCE) moderado-severo. El objetivo de los autores a instancias de las indicaciones de la Sociedad Española de Neurorrehabilitación (SENR), no es otro que el tratar de mejorar la calidad de atención y cuidados que se proporcionan a estos pacientes. Para ello, los autores, han revisado y extraído la información y el grado de evidencia referente al diagnóstico y tratamiento de los distintos tipos de dolor expresados en el proceso neurorrehabilitador del DCS, a partir de las guías de práctica clínica (GPC) y documentos de consenso de diferentes entidades nacionales e internacionales publicados entre el 2013 y 2020 (fig. 1).
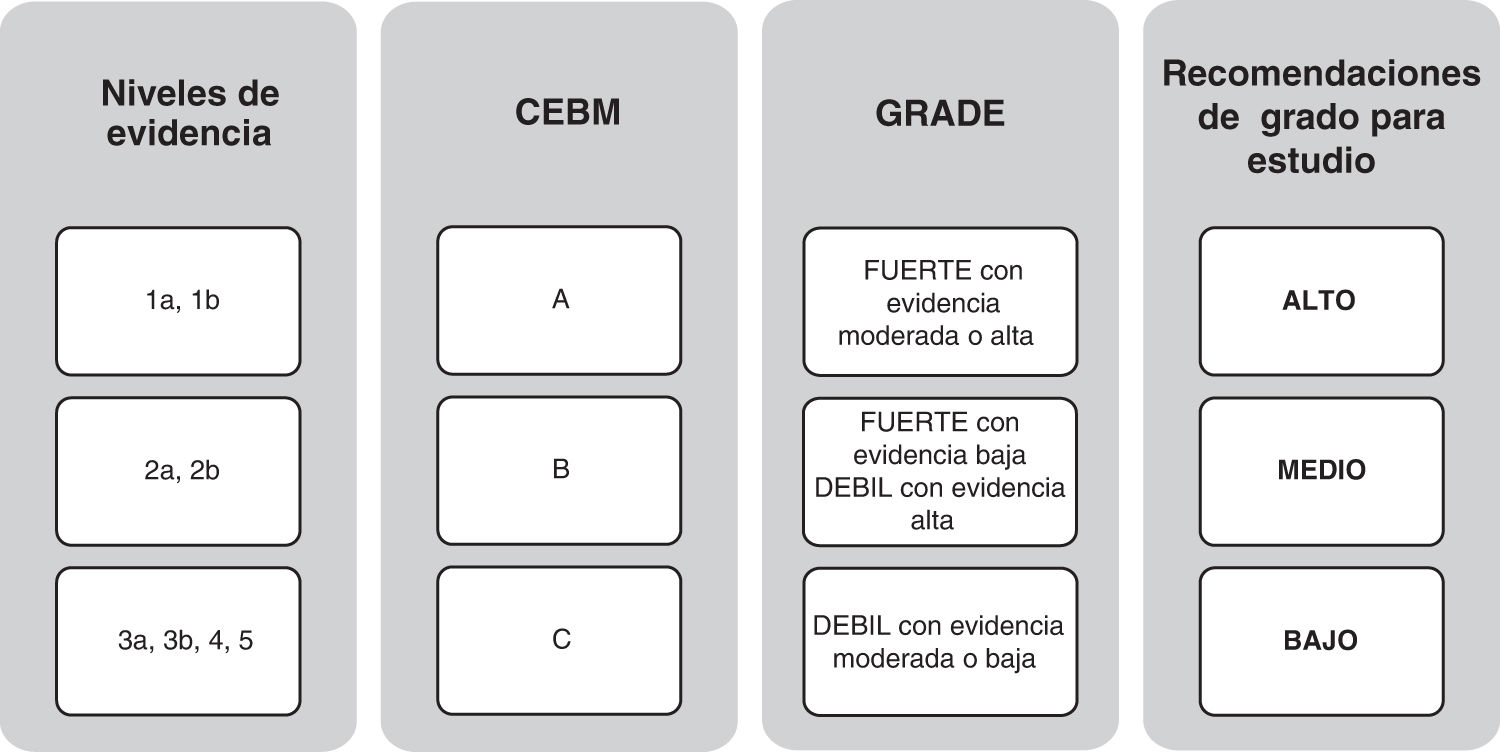
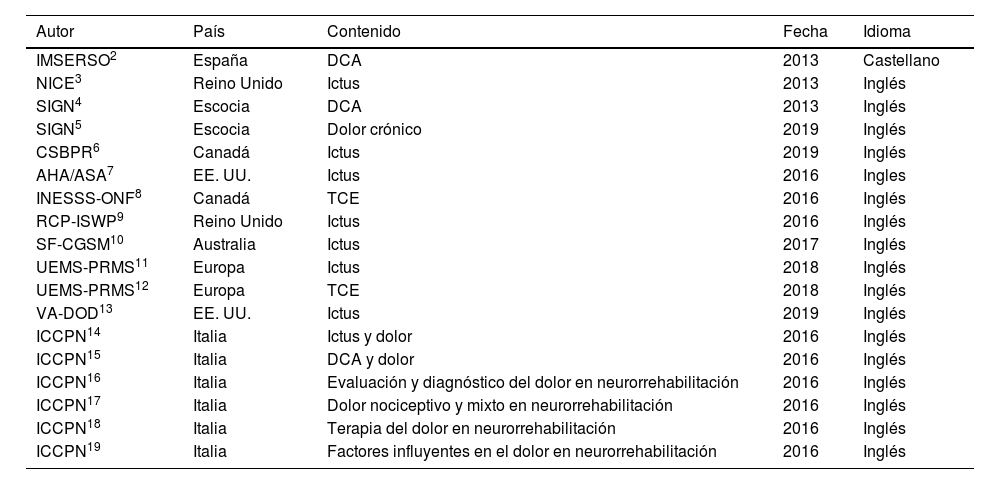
Al final del proceso, 18 GPC fueron incluidas en la revisión sistemática2–19. En la tabla 1 se muestra una síntesis de los 18 programas de intervención que cumplían los criterios de inclusión determinados para esta revisión, destacando los aspectos más relevantes de cada uno de ellos. La figura 2 muestra el grado de recomendación o evidencia de cada afirmación.
Guías incluidas en el estudio
| Autor | País | Contenido | Fecha | Idioma |
|---|---|---|---|---|
| IMSERSO2 | España | DCA | 2013 | Castellano |
| NICE3 | Reino Unido | Ictus | 2013 | Inglés |
| SIGN4 | Escocia | DCA | 2013 | Inglés |
| SIGN5 | Escocia | Dolor crónico | 2019 | Inglés |
| CSBPR6 | Canadá | Ictus | 2019 | Inglés |
| AHA/ASA7 | EE. UU. | Ictus | 2016 | Ingles |
| INESSS-ONF8 | Canadá | TCE | 2016 | Inglés |
| RCP-ISWP9 | Reino Unido | Ictus | 2016 | Inglés |
| SF-CGSM10 | Australia | Ictus | 2017 | Inglés |
| UEMS-PRMS11 | Europa | Ictus | 2018 | Inglés |
| UEMS-PRMS12 | Europa | TCE | 2018 | Inglés |
| VA-DOD13 | EE. UU. | Ictus | 2019 | Inglés |
| ICCPN14 | Italia | Ictus y dolor | 2016 | Inglés |
| ICCPN15 | Italia | DCA y dolor | 2016 | Inglés |
| ICCPN16 | Italia | Evaluación y diagnóstico del dolor en neurorrehabilitación | 2016 | Inglés |
| ICCPN17 | Italia | Dolor nociceptivo y mixto en neurorrehabilitación | 2016 | Inglés |
| ICCPN18 | Italia | Terapia del dolor en neurorrehabilitación | 2016 | Inglés |
| ICCPN19 | Italia | Factores influyentes en el dolor en neurorrehabilitación | 2016 | Inglés |
Autor: autor, sociedad o autoridad responsable de la edición de la guía (referencia). País: lugar geográfico basado en el país o región de origen.
Contenido: población a la que hace referencia las recomendaciones del documento.
Fecha: año de publicación de la última actualización del documento.
IMSERSO: Instituto de Migraciones y Servicios Sociales-Fundación Reintegra; NICE: National Institute for Health and Care Excellence; SIGN: Scottish Intercollegiate Guidelines Network; CSBPR: Canadian Stroke Best Practice Recommendations:Stroke Rehabilitation Practice Guidelines; AHA/ASA: American Heart Association-American Stroke Association; INESS-ONF: Institute National D́excellence en Santé et en Services Sociaux – Ontario Neurotrauma Foundation; RCP-ISWP: Royal College of Physicians: Intercollegiate Stroke Working Party. SF-CGSM: Stroke Foundation - Clinical Guidelines for Stroke Management; UEMS-PRMS: European Union of Medical Specialists-Physical and Rehabilitation Medicine Section; VA-DOD: Clinical Practice Guidelines for the management of Stroke Rehabilitation. Department of Veterans Affairs- Department of Defense; ICCPN: The Italian Consensus Conference on Pain in Neurorehabilitation; TCE: traumatismo craneoencefálico; DCA: daño cerebral adquirido.
El cerebro controla todas las funciones vitales, desde las más básicas (respiración, presión arterial, frecuencia cardiaca etc.), hasta las más sofisticadas (creación artística, abstracción, emociones, entre otras). Esta gran implicación funcional ocasiona que el DCS pueda afectar a estructuras cerebrales que dan lugar a alteraciones de muy diversa índole. El tipo de DCS más prevalente en la actualidad es el ictus, seguido por el TCE y otros menos frecuentes serían las secuelas posquirúrgicas del tumor cerebral, así como las encefalitis y encefalopatías de diferente etiología. El dolor es una experiencia subjetiva, y las personas con DCS con afectación del nivel de consciencia, alteraciones cognitivas severas y/o problemas severos de comunicación, pueden tener muchas dificultades o ser incapaces de comunicar sus sensaciones o experiencias dolorosas20,21. De acuerdo con IASP, la incapacidad verbal para comunicarse no implica la imposibilidad de sentir dolor, y en estos casos se necesita una adecuada valoración y un tratamiento del dolor apropiado. La interpretación basada en signos indirectos supone un riesgo de infravalorar o sobrevalorar la presencia de dolor, y es poco ético aplicar estímulos que resulten nociceptivos a personas que no pueden dar su consentimiento para ello. Por ello, los instrumentos para evaluar el dolor en sujetos que no son capaces de comunicarse verbalmente están basados en signos conductuales, como localización del dolor, inquietud, agitación, movimientos específicos, expresiones faciales y reacciones emocionales (muecas, llanto, lamento, etc.). Para evaluar el dolor en pacientes en estado alterado de la consciencia o con demencia avanzada, se emplean habitualmente escalas como la «Nociception Coma Scale» o la «Nociception Coma Scale-Revised» y la «Pain Assessment in Advanced Dementia» (PAINAD), respectivamente15. El dolor es un problema frecuente tras el ictus (19-74%). Suele presentarse más en la etapa subaguda (42,7%) y crónica (31,9%), que en la etapa aguda (14,1%)14, puede afectar negativamente a la calidad de vida del paciente22 y puede presentarse con distintas características etiológicas, incluyendo dolor de tipo neuropático, dolor de perfil musculoesquelético (incluyendo la espasticidad) o dolor mixto. También puede ser debido a un problema preexistente no directamente relacionado con el ictus17. Se han identificado ciertas variables como factores de riesgo independientes para el desarrollo de dolor tras un ictus, que incluyen el sexo femenino, la presencia de espasticidad, la presencia de depresión, la presencia y severidad de paresia en el miembro superior, la lesión isquémica, o algunas condiciones preexistentes (p. ej., alcohol, consumo de estatinas, enfermedad vascular periférica). Hay controversia respecto al papel de la edad, con alguna evidencia que apunta a edades más tempranas, y otros datos que sugieren una mayor tendencia en pacientes mayores16. Respecto al dolor en DCS por TCE, cabe reseñar que en la fase aguda y primera etapa de la rehabilitación, el dolor nociceptivo puede aparecer frecuentemente como consecuencia de lesiones asociadas en el contexto de politraumatismo (como pueden ser fracturas óseas, lesiones toracoabdominales o lesiones dérmicas), y/o de heridas quirúrgicas o intervenciones terapéuticas invasivas (traqueostomías, catéter venoso central, sonda nasogástrica, gastrostomías, sondaje vesical, entre otros). En la etapa subaguda y crónica, las causas y características del dolor frecuentemente son mixtas: entre nociceptivas y neuropáticas, como las ocasionadas por espasticidad difusa, limitación articular, úlceras de decúbito, lesiones de nervios periféricos, paraosteoartropatías, infecciones urinarias, respiratorias, estreñimiento, cefalea postraumática, polineuropatía del enfermo crítico, lesiones encefálicas directas, dolor neuropático central (DNC) y/o síndromes postalámicos15. En varios casos de dolor tras DCS por TCE no se ha encontrado relación con ningún factor preexistente y se ha considerado que el propio mecanismo lesional del TCE desencadena la activación de una serie de circuitos implicados en el mecanismo de provocación de dolor23. Un síntoma secundario al DCS que frecuentemente se asocia al dolor es la espasticidad. La fisiopatología de la espasticidad es similar en el ictus, el TCE y otras etiologías del DCS: la lesión de la motoneurona superior y su control descendente sobre las conexiones medulares reflejas hacia la motoneurona periférica. La espasticidad afecta la biomecánica de fuerzas en extremidades y tronco derivando en posturas anómalas con una progresiva pérdida de rango de movimiento. Los espasmos dolorosos y posturas distónicas pueden estar igualmente presente en algunos de estos pacientes14. Así pues, la espasticidad puede ser dolorosa per se y también provocar condiciones que resultan dolorosas. A la vez, el dolor actúa muchas veces como espina irritativa aumentando la espasticidad presente. El manejo del dolor asociado a espasticidad requiere una aproximación multidisciplinar, que puede estar centrada en el abordaje de la espasticidad y/o en el del dolor14,16. El dolor es, por tanto, un síntoma habitual en el proceso de la neurorrehabilitación con una influencia negativa en la adherencia al proceso rehabilitador y la consecución de resultados. En líneas generales, el dolor afecta negativamente a la calidad de vida del sujeto tras el daño cerebral, y al tratamiento rehabilitador, en aproximadamente un 25% de los pacientes16. Por otro lado, muchos de los fármacos utilizados para su control tienen un efecto deletéreo en el proceso de recuperación, afectando procesos cognitivos, y/o empeorando otros síntomas neurológicos. Por ello, tratar el dolor durante la neurorrehabilitación supone un reto para lograr un adecuado uso de estrategias efectivas apoyadas en herramientas farmacológicas y no farmacológicas16,18. Para ello, es fundamental un diagnóstico adecuado de las distintas expresiones de dolor en estas patologías y reconocer su aparición para abordarlas y/o prevenir su aparición en cada etapa de la rehabilitación del DCS. Si bien existe la controversia de si un mismo mecanismo dañino puede desencadenar mecanismos fisiopatológicos que asocien el dolor nociceptivo al neuropático («dolor mixto»), una separación objetiva de estos dos tipos de dolor en las guías clínicas resulta útil para optimizar estrategias terapéuticas y minimizar efectos no deseados16. La tabla 2 recoge las recomendaciones generales acerca del dolor en el DCS y su correspondiente grado de evidencia en las principales guías revisadas para la elaboración del presente documento.
- -
Recomendaciones SENR
- 1.
Emplear las herramientas diagnósticas adecuadas (escalas clínicas) según el tipo de lesión y el nivel de consciencia.
- 2.
Realizar una anamnesis detallada para recoger los antecedentes patológicos premórbidos; y en concreto, la presencia, características y tratamiento de dolor previo al daño cerebral.
- 3.
Llevar a cabo una adecuada exploración neurológica.
- 4.
Manejar el dolor del paciente con DCS desde un enfoque interdisciplinar especializado.
- 5.
Indicar y prescribir las distintas herramientas terapéuticas destinadas a abordar el dolor, según el nivel de evidencia y el tipo de dolor.
- 1.
Recomendaciones del dolor general y de tipo nociceptivo en el Daño Cerebral Sobrevenido
| Recomendación | Grado de evidencia |
|---|---|
| Se deben emplear «la escala analógica visual», «la escala numérica» y el «neuropathic pain symtomps inventory» para evaluar la intensidad del dolor y su respuesta a los tratamientos. | NIVEL ALTOA (ICCPN) |
| La infiltración con toxina botulínica es un tratamiento de primera línea para la espasticidad acompañada de dolor, como terapia aislada o combinada con rehabilitación. | NIVEL ALTOA (ICCPN) |
| Las ortesis (férulas) de mano y muñeca como parte de la práctica rutinaria no tienen eficacia en la función, dolor, o rango de movimiento. | NIVEL ALTOA (SF-CGSM) |
| Las intervenciones de «mindfulness», y en particular las terapias cognitivas basadas en «mindfulness» y las terapias encaminadas a reducir el estrés basadas en «mindfulness» se recomiendan para los síndromes de dolor crónico con una fisiopatología heterogénea.Ocurre lo mismo con la terapia cognitivo-conductual, individual o grupal, o administrada por ordenador. | NIVEL ALTOA (ICCPN)NIVEL MEDIOB (ICCPN) |
| La evidencia no apoya el uso de estimulación eléctrica transcutánea para el tratamiento del dolor en pacientes con alteraciones neurológicas, pero se puede considerar utilizar esta técnica como coadyuvante de la terapia farmacológica y el ejercicio.Otras técnicas de terapia física y ejercicio se pueden tener en cuenta en pacientes que reciban neurorrehabilitación, aunque la evidencia es todavía preliminar. | NIVEL ALTOA (ICCPN)NIVEL BAJOC (ICCPN)NIVEL BAJOD (ICCPN) |
| Se recomienda que en todas las personas con DCA que desarrollen espasticidad o acortamiento tendinoso, se eliminen los factores potencialmente desencadenantes de esto (dolor, infecciones, estreñimiento). | NIVEL MEDIOII (UEMS-PRM) |
| Se recomienda que los médicos especialistas monitoricen de forma estrecha y regular a las personas con ictus para identificar las complicaciones y condiciones secundarias como malnutrición, trombosis venosa profunda, úlceras por presión, disfunción de control vesical/intestinal, infecciones (sobre todo urinarias y respiratorias), depresión, HDH, dolor central, SDRC, espasticidad, contracturas, fatiga, caídas, osteoporosis y crisis epilépticas, que pueden empeorar o afectar el nivel de discapacidad inicial. | NIVEL BAJOIV (UEMS-PRM) |
| En todos los pacientes con TCE que están conscientes se deben evaluar específicamente las alteraciones habituales:Alteraciones motoras como debilidad, alteración del tono, alteraciones del equilibro y coordinación.Heridas o fracturas no diagnosticadas previamente.Dolor.Alteraciones bulbares que afecten al habla o a la deglución.Problemas para el control de esfínteres (vesical-rectal).Alteraciones cognitivas: atención, orientación y/o memoria.Problemas para regular la conducta, incluyendo potenciales aspectos conductuales/emocionales. | NIVEL BAJOC (INESS ONF) |
| Siempre se debe considerar la presencia de dolor cuando una persona con TCE presenta agitación o tiene problemas cognitivos/de comunicación, inquietud psicomotora no verbal, o empeoramiento de la espasticidad, prestando especial atención a los signos no verbales de dolor (p. ej., muecas). | NIVEL BAJOC (INESS ONF) |
| Se recomienda la valoración del dolor con la escala visual analógica del 0 al 10. | NIVEL BAJOC (Va/DoD) |
| Se recomienda un plan de abordaje del dolor que incluya valoración de: la probable etiología (musculoesquelético o neuropático), localización del dolor, calidad, cantidad, duración, intensidad, y factores que empeoran o alivian. | NIVEL BAJOC (Va/DoD) |
| En pacientes con ictus y otros trastornos asociados a espasticidad, se debe evaluar el impacto del dolor en la calidad de vida y los resultados de la rehabilitación. | NIVEL BAJOC (ICCPN) |
| Los síndromes de dolor musculoesquelético pueden responder a la corrección de la condición subyacente, como disminuir la espasticidad, o prevenir o corregir la subluxación de hombro. | NIVEL BAJOEvidencia Insuficiente (Va/DoD) |
| Los programas de rehabilitación para individuos con TCE deben incluir protocolos de abordaje del dolor que incluyan:Mecanismos periódicos de revisión y ajusteMétodos de manejo, apoyo y alivio del dolor ajustados a las necesidades de cada individuo.Formación de profesionales de la salud y de cuidadores acerca del manejo adecuado de los miembros superiores paréticos durante las transferencias, y acerca de la hipersensibilidad y el dolor neuropático. | NIVEL BAJOC (INESS ONF) |
| Se recomienda que el clínico especialista ajuste el tratamiento diana al tipo de dolor. | NIVEL BAJOC (Va/DoD) |
| Los AINE pueden ser útiles para tratar el dolor musculoesquelético. | NIVEL BAJOEvidencia Insuficiente (Va/DoD) |
| Los opiáceos o cualquier medicación que pueda afectar cognitivamente debe usarse con precaución. | NIVEL BAJOEvidencia Insuficiente (Va/DoD) |
| Se recomienda emplear dosis bajas de analgésicos de acción central, puesto que pueden causar confusión, deterioro de la ejecución cognitiva e interferir en el proceso de rehabilitación. | NIVEL BAJOC (Va/DoD) |
| Se recomienda considerar el equilibrio entre beneficios y posibles efectos adversos de medicamentos analgésicos en la capacidad del paciente de participar y beneficiarse de la rehabilitación. | NIVEL BAJOEvidencia Insuficiente (Va/DoD) |
| Cuando sea posible, utilizar el apoyo de la psicología clínica para abordar aspectos psicológicos del dolor y mejorar la adherencia al plan de tratamiento del dolor. | NIVEL BAJOC (Va/DoD) |
| Cuando sea apropiado, recurrir a terapias analgésicas no farmacológicas, como biofeedback, masaje, terapia de imaginería motora, y fisioterapia. | NIVEL BAJOC (Va/DoD) |
| La «Nociception Coma Scale Revised» (NCS-R) y la «Pain Assessment in Advanced Dementia Scale» (PAADS) son actualmente las escalas de referencia o «gold standard» para valorar el dolor en pacientes en estados de alteración de la consciencia (EAC) o con demencia, respectivamente. | NIVEL BAJOC (ICCPN) |
| Se recomienda administrar tratamiento analgésico a pacientes en estado de mínima conciencia y en estado vegetativo. | NIVEL BAJOD (ICCPN) |
| El sexo se debe considerar en neurorrehabilitación, pues juega un papel en la:Epidemiología.Resultado.En el abordaje del dolor. | NIVEL BAJOD (ICCPN)NIVEL BAJOC (ICCPN) |
| El tratamiento del dolor nociceptivo en las alteraciones del movimiento, esclerosis lateral amiotrófica, daño cerebral adquirido severo, alteraciones de la conciencia, demencias, procesos oncológicos y neuroinfecciosos, debe basarse en la Escalera Analgésica de la OMS. | NIVEL ALTOA (ICCPN) |
| Los analgésicos no opioides, los AINE, los inhibidores Cox-2 y los opiáceos se pueden usar para tratar el dolor nociceptivo en neurorrehabilitación | NIVEL ALTOA (ICCPN) |
TCE: traumatismo craneoencefálico; HDH: hombro doloroso del hemipléjico; SDRC: síndrome de dolor regional complejo; INESS-ONF: Institute National D́excellence en Santé et en Services Sociaux – Ontario Neurotrauma Foundation; SF-CGSM: Stroke Foundation - Clinical Guidelines for Stroke Management; UEMS-PRMS: European Union of Medical Specialists-Physical and Rehabilitation Medicine Section; VA-DOD: Clinical Practice Guidelines for the management of Stroke Rehabilitation. Department of Veterans Affairs- Department of Defense; ICCPN: The Italian Consensus Conference on Pain in Neurorehabilitation; AINE: antiinflamatorios no esteroideos; DCA: daño cerebral adquirido.
El dolor de origen nociceptivo es el causado por un estímulo doloroso sobre los nociceptores dentro de un tejido no neuronal y con un mecanismo de activación somatosensorial conservado. Dependiendo del lugar de origen, se divide en dolor somático y dolor visceral. El somático es el generado a partir de la activación de nociceptores ubicados en la piel y membranas mucosas (superficial); y en los huesos, ligamentos, tendones, músculos, fascias y vasos sanguíneos (profundo). Por otro lado, el dolor visceral, es el ocasionado por la activación de receptores a nivel de los órganos viscerales internos de nuestro cuerpo y está relacionado con el sistema autónomo o vegetativo. No existe una definición más específica de este tipo de dolor aplicable a la neurorrehabilitación16. El tipo de dolor tras el ictus más frecuente es el nociceptivo, frente al neuropático22. El dolor musculoesquelético más específico tras el ictus es el dolor de hombro17. El dolor nociceptivo tras el ictus puede derivar de una inmovilización prolongada y posturas anormales, que exacerban las condiciones musculoesqueléticas dolorosas previas, como la osteoartrosis. En la tabla 2 se recogen los aspectos relacionados con el abordaje del dolor nociceptivo en el DCS y su correspondiente grado de evidencia en las principales guías revisadas para la elaboración del presente documento.
CefaleaConceptoEl dolor de cabeza (cefalea) y otros dolores craneofaciales, tanto primarios como secundarios, son extremadamente frecuentes en la población en general, en condiciones de salud, o en el contexto de patologías diversas, como tras el DCS. Cuando hablamos de la cefalea en pacientes con DCS, habitualmente nos referimos al tipo de cefalea secundario (al daño ocurrido), pero no debemos olvidar que las personas pueden presentar ya un antecedente de cefalea de tipo primario. La Sociedad Internacional de Cefaleas (IHS) en su última revisión de clasificación internacional de cefaleas (ICHD-3) las divide en: 1) primarias, 2) secundarias y 3) otras neuralgias, dolor facial primario o central y otras cefaleas17,24. La cefalea es un síntoma diana en el caso del ictus hemorrágico (34-65%), o en el caso de otras patologías vasculares asociadas como la trombosis de seno venosos (80-90%), la disección de arterias cervicales (55-100%), el síndrome de vasoconstricción reversible (95-100%) y la vasculitis; pero también se puede observar hasta en un 6 a 44% de ictus isquémicos25,26. Se ha descrito que su presentación como primer episodio de cefalea, en una persona tras haber sufrido un ictus isquémico es un indicador de cefalea persistente hasta seis meses luego del ictus25 en el 23% de casos26. Su expresión, en el ictus, se puede dar en la etapa subaguda a crónica de la lesión cerebral, consecuencia del daño de los centros superiores de neuromodulación del dolor. También puede aparecer de forma secundaria al uso de medicación (p. ej., por abuso de algunos analgésicos, o como efecto secundario de algunos neurolépticos), siendo más frecuente en la etapa aguda (5,3%), para ir disminuyendo su presentación para la etapa subaguda (1,8%) y crónica14. En el caso del TCE, la cefalea postraumática es el tipo de dolor secundario más frecuente y es más habitual en TCE leves (90%) (incluso dentro del conocido síndrome posconmocional), que en los TCE moderados o severos (71%)27–32. Suele presentarse en la etapa aguda, hasta los siete días tras el daño. Sin embargo, en un porcentaje de pacientes (33-58%) puede continuar hasta después de los tres meses (incluso años en un 15%) de la lesión, con carácter crónico, afectando de manera importante la calidad de vida de la persona24,28,29,31,33. Aproximadamente el 90% de pacientes con un tumor cerebral requieren craneotomías para la extirpación del tumor, con el objetivo de mejorar la supervivencia. Este procedimiento, además de poder generar dolor durante el proceso, ocasiona frecuentemente un cuadro de cefalea poscraneotomía (50-96%). Esta se atribuye a la disección muscular, la generación de inflamación de los restos óseos producidos durante la cirugía, la tracción dural, la pérdida de líquido cefalorraquídeo (LCR) y la lesión directa sobre los nervios supracraneales34. Este síntoma es por lo general inadecuadamente tratado, muchas veces debido a la preocupación por enmascarar cambios neurológicos en el paciente con los analgésicos, sobre todo durante la estancia en Unidades de Neurocríticos. En muchas ocasiones esta cefalea puede cronificarse (56%)34,35. Al igual que en la craneotomía requerida en algunos pacientes con TCE, el procedimiento quirúrgico y el dolor secundario se asocia a una mayor estancia hospitalaria y a un impacto negativo en la recuperación cognitiva y funcional35. Para el adecuado manejo del paciente con cefalea secundaria al DCS, se deben tener en cuenta distintos aspectos de su fisiopatología, prevención, evaluación, diagnóstico y tratamiento.
Etiología y fisiopatologíaLos tipos de cefalea y dolor craneofacial presentes en el paciente en neurorrehabilitación tras DCS suelen ser de tipo tensional y migrañoso, siendo menos frecuente, y dependiendo del tipo de lesión, el dolor craneocervical, el neurálgico facial y orofacial, el trigeminal específico, el temporomandibular, el síndrome de boca urente, y otros17,24. En el ictus isquémico, la presentación de cefalea de tipo tensional es la más frecuente (50-80%), mientras que la de tipo migrañoso es menos recurrente (alrededor de 30%, según el estudio)25,26. En el ictus hemorrágico, la aparición de cefalea suele ser previa a otros signos de focalidad, se suele presentar con características «tipo trueno», y ser de intensidad moderada a severa26. En el caso del TCE, la cefalea más frecuente es la de tipo migrañoso (23-49%), pero de forma característica, suele responder peor al tratamiento antimigrañoso, por lo que se propone que su fisiopatología no involucraría las mismas estructuras y mecanismos que en la migraña primaria27–29,33. Otros tipos de cefalea menos frecuentes tras el TCE serían la neuralgia occipital (siendo común la neuralgia del nervio occipital mayor), el dolor cervicogénico, la neuralgia trigeminal (sobre todo, la supra e infraorbitaria), las disestesias locales a causa de laceraciones de tejido extracraneal, o los dolores no específicos en relación con los sangrados intracraneales asociados29,30,32. La fisiopatología de la cefalea posictus aún no está del todo determinada. Se considera que probablemente existe relación con la patogénesis vascular de la migraña primaria (a pesar de sus diferentes formas de expresión), con una activación mecánica o química de aferencias trigémino-vasculares, con una inflamación meníngea, con mecanismos físicos, con eventos neuroeléctricos de despolarización equívoca, con el efecto de derivados proinflamatorios del proceso de coagulación y/o mecanismos serotoninérgicos, entre otros25,26.
En el caso de la cefalea postraumática, la fisiopatología en la etapa aguda estaría probablemente relacionada directamente con los distintos daños de tipo nociceptivo somático y visceral expresados a partir de las lesiones tisulares de la energía desencadenante. Estas serían lesiones tanto en el sistema de protección extracraneal como intracraneal (lesiones en el tejido dérmico y subdérmico, muscular, óseo, meníngeo), lesiones cervicales asociadas, aquellas como consecuencia de intervenciones neuroquirúrgicas (p. ej., el drenaje de un hematoma epidural en un momento más agudo, o en uno más tardío, como en el abordaje de una hidrocefalia secundaria)24,27,30. También se debe tener en cuenta la fisiopatología de otras lesiones asociadas que pueden provocar dolor, como es el caso de la disección de arterias cervicales, la trombosis venosa, la pérdida de LCR por fístulas tras fracturas craneales con hipotensión intracraneal, o el edema por inflamación con la consecuente hipertensión intracraneal28. En el caso de la colocación de drenajes quirúrgicos, o en el de las cirugías de tumores cerebrales, hay que tener en cuenta los mecanismos nociceptivos de la manipulación de tejidos durante la neurocirugía. En la etapa crónica, la fisiopatología involucraría los cambios directos e indirectos por el daño neuronal, tanto periféricos como centrales de las vías sensitivas ascendentes, y de distintos centros de control y modulación descendentes del dolor, donde además existirían mecanismos de neuroinflamación, neurodegeneración, hormonales y epigenéticos involucrados. Muchos de estos centros pueden, a su vez, estar afectados con comorbilidades tras el DCS, como la depresión, la fatiga o los trastornos del sueño, por lo que se piensa que puedan compartir un origen fisiopatológico25–27,30,32,33.
PrevenciónComo se ha dicho previamente, el médico debe conocer en el paciente con DCS la posible presencia de cefalea primaria previa, asociada a la presentación de una nueva cefalea secundaria tras el daño. En el caso de la cefalea posterior a ictus isquémico, la localización encefálica dependiente de circulación posterior, el antecedente de algún tipo de cefalea primaria (20%) y el sexo femenino son factores asociados a una mayor probabilidad de presentar cefalea. En cuanto a la edad, algunos estudios relacionan una mayor aparición de cefalea tras el ictus en pacientes menores de 50 años, mientras que no parece existir una relación con la severidad propia del ictus25,26,36. Una revisión sistemática evidenció que la prevalencia era mayor en la población europea y norteamericana que en la asiática o de oriente medio25. En el caso de la cefalea tras un ictus hemorrágico, los factores de riesgo asociados son la edad joven, el sexo femenino, el volumen del hematoma y la localización cerebelosa o lobular26. Por otro lado, en el caso de la cefalea persistente, incluso de años, tras el ictus, se identifica con otros factores relacionados: el uso de antidepresivos, la ausencia de fibrilación auricular y la localización encefálica derecha de la lesión26. En el caso del dolor de características migrañosas, ya sea primario o secundario, deben tomarse en cuenta los factores intrínsecos, como los hormonales en el caso de la mujer en edad de concebir24 o los relacionados con el daño del eje hipotálamo hipofisiario como consecuencia del DCS. La localización de la lesión encefálica en el DCS también debe ser tenida en cuenta, en relación con la posibilidad de afectar los centros responsables en la fisiopatología del dolor. Por ejemplo, en el caso del ictus, se ha identificado que los infartos que involucran la región insular y la corteza somatosensorial, parietal y temporal media, están relacionados con la aparición de cefalea. Las lesiones a nivel cortical también parece que están más relacionadas con este tipo de dolor que las subcorticales o profundas25. En el ictus isquémico, por otro lado, la etiología del evento vascular también influiría en la prevalencia de cefalea. El origen cardioembólico (9-39%), o afectación de gran arteria (15-41%), estaría más relacionado a la presentación de cefalea, que las lesiones de pequeño vaso (13-33%) o ictus lacunares o accidente isquémico transitorio (AIT) (16-36%)25,26. En el caso de la cefalea tras TCE se ha evidenciado que la presentación entre las tres horas a los siete días del daño, la cefalea de tipo migrañoso y el sexo femenino se asocian a una recuperación más lenta de la sintomatología. Determinadas condiciones genéticas, la presencia de historia de cefalea preexistente y una edad temprana serían también factores de riesgo para la presencia de cefalea tras TCE, incluso un TCE leve30,32,33. Del mismo modo, en un estudio de cefalea tras TCE en deportistas, la presentación de otros síntomas posconmocionales asociados (como mareo, vértigo, ansiedad, amnesia temprana de lo ocurrido o alteración del nivel de consciencia), una edad temprana y el sexo femenino se asociaban a la presencia y persistencia de cefalea, así como a una recuperación lenta27,29,30,32. En cuanto a la cefalea poscraneotomía, se desconoce si la edad o el sexo influirían en la presentación e intensidad del dolor, con estudios contradictorios. Por otro lado, sí parece existir menos dolor en pacientes a los que se les realiza una craneotomía frontal, así como aquellos que reciben bloqueos nerviosos previos a la cirugía. Y, por lo general, se relaciona mayor frecuencia de presentación e intensidad de la cefalea en relación con la prolongación de la cirugía34,35. Además, en la etapa posquirúrgica inmediata, es importante tener en cuenta el manejo de los síntomas asociados como el mareo, la fatiga, náuseas y vómitos, depresión respiratoria, estreñimiento o cambios en la presión arterial, entre otros, que influirían en el riesgo de incrementar el sangrado intracraneal, dolor y agitación asociada35. Del mismo modo, se deben identificar otros factores precipitantes de dolor, como son los trastornos anímico-emocionales (depresión, ansiedad, síndrome postraumático), la fatiga y trastornos del sueño, que suelen presentarse de forma asociada durante el proceso de neurorrehabilitación de la persona afectada17,24,26,27,30,32,35,37. Por último, muchos de los pacientes que sufren DCS suelen presentar pérdida de control funcional del movimiento, con tendencia a un mal control postural y la presencia de nuevos dolores musculoesqueléticos que pueden contribuir a la presentación de cefalea secundaria24. Por otro lado, los mismos antecedentes patológicos previos al DCS (alcoholismo, tabaquismo, diabetes, arteriopatías periféricas, etc.), influyen sobre la presencia de dolor, y al mismo tiempo, al requerir mucha medicación por dicha pluripatología con riesgo aumentado de efectos secundarios, pueden favorecer la presencia de cefalea26,36. Sin embargo, se busca siempre la analgesia multimodal teniendo en cuenta los sinergismos en el tratamiento agudo a fin de evitar los posibles efectos adversos al reducir sus dosis38,39.
- -
Recomendaciones SENR
- 1.
Tener en cuenta que en el ictus y el TCE, la edad temprana, el sexo femenino y la cefalea primaria previa son factores de riesgo no modificables en la aparición de cefalea post DCS.
- 2.
En el ictus, se consideran además factores predisponentes: la localización dependiente de la circulación posterior, la afectación de gran vaso en el ictus isquémico y el tamaño del hematoma en el ictus hemorrágico.
- 3.
En el TCE, una mayor cantidad de síntomas posconmocionales asociados estaría relacionada con la presentación de la cefalea tras TCE.
- 4.
En la cefalea poscraneotomía, la mayor duración del procedimiento quirúrgico, en relación con su complejidad, está relacionada con un mayor riesgo de presentación de cefalea.
- 5.
En todos estos tipos de cefalea post DCS, los trastornos anímicos y del sueño, la fatiga y las alteraciones posturales y musculoesqueléticas inmediatas y subagudas como consecuencia de las secuelas motoras son factores de riesgo modificables para tener en cuenta.
- 1.
Para el estudio diagnóstico de las cefaleas en esta población se recomienda el uso de las guías diagnósticas de la IHS, como herramienta «gold standard» para su clasificación (ICHD-3)17,26,28,31. En muchas ocasiones, se requiere experiencia y destreza para su diagnóstico y para identificar los síntomas secundarios al daño cerebral que pueden impedir una adecuada obtención de información del paciente, como pueden ser la disminución del estado de consciencia, una afasia o disartria severa, el síndrome de negligencia o cuadros neurodegenerativos previos; e incluso la presencia de otros cuadros como la fatiga o trastornos del ánimo, que pueden enmascarar la presencia de cefalea36. Es importante catalogar el momento de presentación de la cefalea en relación con el DCS. Por ejemplo, en el caso del ictus, distintos estudios consideran la cefalea asociada al ictus isquémico, cuando esta se presenta de manera simultánea a la clínica del ictus o en una ventana de tiempo de 24 a 72 horas antes o después del evento; si bien otros estudios consideran hasta siete días25,28. Los criterios de la clasificación ICHD-3 reflejan la relación temporal con otros síntomas o clínica del ictus y hablan de cefalea centinela en el caso de presentarse 72 horas antes de los síntomas, de cefalea posictus de características agudas cuando se resuelve en los tres primeros meses tras el daño, y persistente en el caso de prolongarse más de tres meses tras el ictus isquémico y otras alteraciones cerebrovasculares a nivel craneocervical a excepción de la trombosis venosa cerebral26. En el caso de la cefalea tras TCE es importante identificarla como de nueva aparición, o como un empeoramiento de una cefalea preexistente, y que aparece durante los primeros siete días tras el daño cerebral. Igualmente, los criterios de la clasificación ICHD-3 la suelen clasificar como aguda (< 3 meses) o persistente (> 3 meses). Asimismo, se puede subdividir dependiendo de la severidad del TCE (leve, moderado o severo). En relación con el nivel de consciencia y con la discontinuación de medicación (que pueda enmascarar el dolor), se requiere un periodo de ventana de hasta siete días tras el daño cerebral para su identificación27,28. Del mismo modo, se debe realizar una adecuada anamnesis y exploración para identificar el tipo de cefalea o dolor facial. En el caso del TCE, se recomienda un adecuado examen de la columna cervical, así como del área occipital y musculatura asociada27. Se debe considerar el uso de pruebas diagnósticas, como estudios de imagen, para descartar posibles complicaciones secundarias al daño que puedan explicar la cefalea, como el caso de la pérdida de LCR por fisuras o fracturas craneales27,30. Una vez identificado el tipo de dolor, la graduación del nivel de este (tanto al inicio, como en respuesta al abordaje empleado) se puede llevar a cabo a través de la escala visual analógica (EVA) y la escala de graduación numérica, de manera periódica por el equipo neurorrehabilitador26,35. La cefalea tensional posictus suele describirse como de intensidad leve a moderada26. En el caso de tratarse de una cefalea de perfil migrañoso, la puntuación de la valoración de disfuncionalidad de la migraña (MIDAS) puede ser una herramienta adecuada para identificar características relacionadas; si bien, al igual que en otros tipos de dolor, sería recomendable utilizar otras herramientas para medir los factores asociados como trastornos del ánimo, calidad de sueño, etc17. Es igualmente importante catalogar la duración (aguda o crónica) y su intensidad en el tiempo28. Los diarios de cefalea son de utilidad para recoger información periódica de la frecuencia, duración, síntomas premonitorios o acompañantes y la eficacia del tratamiento indicado a largo plazo17,24. Por ejemplo, se considera que la cefalea persistente posictus suele ser de mayor frecuencia diaria y severidad que la cefalea aguda posictus, que suele ser de intensidad leve a moderada y de frecuencia baja que además disminuye en el tiempo26. La revisión periódica de todo tipo de dolor secundario, incluso en la etapa de seguimiento crónico tras el alta de la unidad de neurorrehabilitación está justificada36. Por otro lado, es habitual el sobreuso de medicación analgésica (antinflamatorios no esteroideos [AINE] ≥ 15 días al mes, triptanes >2 veces por semana, opioides ≥ 8 días al mes), que es otro factor predisponente para la aparición paradójica de la cefalea (19-42%)26,27,29,30. La tabla 3 recoge el único aspecto relacionado con la evaluación y diagnóstico de la cefalea en el DCS y su correspondiente grado de evidencia en las principales guías revisadas para la elaboración del presente documento.
- -
Recomendaciones SENR
- 1.
Usar las guías diagnósticas de la IHS para la clasificación de los tipos de dolor secundarios.
- 2.
Poseer experiencia y emplear las herramientas diagnósticas, exploración física y pruebas complementarias precisas para identificar el tipo y momento de presentación de la cefalea, diferenciando, por ejemplo, entre aguda y persistente.
- 3.
Considerar el uso de herramientas de graduación, como la EVA y la escala numérica del dolor; y de seguimiento, como los diarios de cefalea, para garantizar el adecuado manejo de esta, evitando el sobreuso de medicación analgésica.
- 1.
Recomendaciones en la cefalea secundaria al daño cerebral sobrevenido
| Recomendación | Grado de evidencia |
|---|---|
| Evaluación y diagnóstico | |
| Se deben utilizar las guías diagnósticas de la Sociedad Internacional de Cefaleas (ICH) para la clasificación de los distintos subtipos de dolor cefálico y craneofacial. | NIVEL MEDIOB (ICCPN) |
| Tratamiento | |
| Se recomienda emplear como referencia la Guía de la Federación Europea de Sociedades Neurológicas para el tratamiento de neuralgias como la trigeminal. | NIVEL ALTOA (ICCPN) |
| La infiltración de toxina botulínica tipo A es efectiva para el tratamiento de la neuralgia trigeminal idiopática. | NIVEL MEDIOB (ICCPN) |
| Podemos considerar la terapia cognitivo-conductual para disminuir los síntomas en sujetos con cefalea tras TCE. | NIVEL MEDIOB (CSBPR) |
| Podemos considerar el «biofeedback» para disminuir los síntomas en sujetos con cefalea tras TCE. | NIVEL MEDIOB (CSBPR) |
ICCPN: The Italian Consensus Conference on Pain in Neurorehabilitation; CSBPR: Canadian Stroke Best Practice Recommendations: Stroke Rehabilitation Practice Guidelines; TCE: traumatismo craneoencefálico.
Cabe destacar que una serie de estudios determina que el paciente con cefalea posictus, la causa más habitual de DCS, suele requerir más analgesia que aquellos con otros tipos de dolor tras un ictus (32 vs. 17%)26. Este hecho subraya la importancia que implica el tratamiento en este tipo de dolor. Del mismo modo, el manejo temprano del mismo involucra una disminución en la evolución a cefalea persistente en un futuro32,35. No existen hasta la fecha guías clínicas específicas para el tratamiento farmacológico de la cefalea tras DCS25,26,35. En primer lugar, en la etapa hiperaguda tras el DCS, para prevenir la aparición de cefalea tras la craniectomía (si es el caso), se deben tener en cuenta abordajes como el uso preventivo de bloqueos nerviosos durante incisiones en el procedimiento quirúrgico; el uso de AINE, paracetamol o metamizol intravenosos en el momento del cierre de la herida quirúrgica; o el uso de dexmedetomidina como infusión intraoperatoria o en el periodo postoperatorio inmediato. Es necesario tener experiencia en la identificación y el manejo de la cefalea en el paciente sedado o con disminución de consciencia durante su estancia en las Unidades de Neurocríticos, sin generar un uso excesivo de opioides, e identificando bajo monitorización los efectos secundarios de otros analgésicos32,34. Para el tratamiento farmacológico de la cefalea de perfil tensional, migrañoso, o de otros tipos, que se presenta tras un DCS, se recomienda seguir las líneas de las guías de la Federación Europea de Sociedades Neurológicas y el Manual de Práctica Clínica en Cefalea, Recomendaciones Diagnóstico-Terapéuticas de la Sociedad Española de Neurología 202030,33,40. Por lo general, una cefalea de presentación aguda suele controlarse con analgésicos simples o de primera línea. Sin embargo, una cefalea persistente o crónica, requiere un manejo más complejo, que además debe ajustarse de manera individualizada, en relación con posibles comorbilidades y patologías previas que presente cada paciente26,31. Es útil conocer el perfil tensional o migrañoso de la cefalea para llevar a cabo los tratamientos sintomáticos más adecuados, teniendo en cuenta el DCS. Por ejemplo, en el caso de la cefalea posictus de perfil migrañoso, no se podrían utilizar triptanes o dihidroergotamina en relación con el riesgo cardiovascular que implican; o en el caso de la cefalea tras TCE, el uso de medicación para la ansiedad, el insomnio o relajantes musculares, puede afectar a la recuperación de síntomas cognitivos asociados26,27,32. En cuanto al tratamiento farmacológico local, el uso de la infiltración de toxina botulínica tipo A, al igual que en las cefaleas primarias, ha demostrado utilidad en la cefalea crónica diaria y la migraña cronificada, no siendo el caso en la cervicogénica24,29. El bloqueo nervioso con anestésicos locales ha demostrado utilidad, solo o combinado con corticoides, en neuralgias puntuales o como preventivo en el caso de cefalea migrañosa29. La combinación del tratamiento farmacológico con terapias no farmacológicas es más efectiva para el manejo del dolor tras DCS que el uso de ambos por separado31,32. Como parte del abordaje no farmacológico, el tratamiento de estimulación osteopática tiene cierto grado de evidencia, seguida de la quiropraxia24. El tratamiento no farmacológico incluye también la terapia manual, que es un abordaje físico utilizado por profesionales sanitarios para manejar desórdenes musculoesqueléticos y dolor. Esta terapia incluye la práctica de masaje, la punción seca, la movilización de tejidos blandos, el manejo miofascial o la manipulación espinal, entre otras. Existen distintos estudios publicados que documentan la utilidad, junto con la terapia farmacológica, de terapias de meditación, reducción del estrés basado en mindfulness, terapia cognitivo-conductual, terapia de aceptación y compromiso, otras terapias psicológicas de biofeedback, terapias de relajación, hipnosis, terapia de desensibilización y reprocesamiento de movimiento ocular y yoga para el dolor posictus y tras TCE, y en concreto, para cefaleas primarias referidas por el paciente durante la rehabilitación de su DCS. Presentan más estudios con nivel de evidencia la terapia cognitivo-conductual, la terapia de aceptación y compromiso y biofeedback (nivel de recomendación A)24,26,27,29,31. En caso de presentar dolor oromandibular, es útil descartar otras etiologías, como alteraciones periodontales, afectaciones vasculares, lesiones de la articulación temporomandibular o neoplasias en el caso de dolor persistente o cronificado. Descartadas estas etiologías, no existe una guía específica para el dolor oromandibular tras DCS. En el caso de las neuralgias, fundamentalmente la trigeminal, son de utilidad las guías como la de la Federación Europea de Sociedades Neurológicas. En general, dentro del abordaje farmacológico se recomienda el tratamiento oral con antiepilépticos como la carbamazepina y la oxcarbamazepina; y la infiltración de toxina botulínica tipo A, con respuesta positiva de hasta un 85%. Otros tratamientos tópicos, como los parches de lidocaína al 5% y capsaicina al 8%, tienen un papel en reducir el dolor neuropático general, pero sin evidencia determinante para el dolor neuropático orofacial o trigeminal. Como tratamientos invasivos, se considera la rizólisis con glicerol y la termocoagulación con radiofrecuencia percutánea, ya sea continua o a pulsos (siendo mejor mixta). Esta se considera de utilidad, pero con niveles bajos de evidencia, cuando existe refractariedad a terapias previas. En el caso de la neuralgia glosofaríngea, el tratamiento farmacológico para el dolor neuropático tendría menos efectividad que el intervencionista, a diferencia que en la trigeminal17. La tabla 3 recoge los aspectos relacionados con el tratamiento de la cefalea y otros dolores craneofaciales en el DCS y su correspondiente grado de evidencia en las principales guías revisadas para la elaboración del presente documento.
- -
Recomendaciones SENR
- 1.
Apoyarse en los algoritmos de tratamiento recogidos en la Guía de la Federación Europea de Sociedades Neurológicas, y en el Manual de Práctica Clínica en Cefalea, Recomendaciones Diagnóstico-Terapéuticas de la Sociedad Española de Neurología 2020, teniendo en cuenta la particularidad de los antecedentes patológicos y comorbilidades presentes en el paciente con DCS.
- 2.
Uso combinado de tratamiento farmacológico y no farmacológicos (p. ej., terapia cognitivo-conductual).
- 3.
En los casos de cefalea de presentación persistente a crónica, la toxina botulínica tipo A y los bloqueos nerviosos tienen una utilidad preventiva.
- 4.
En el caso de neuralgias faciales y orofaciales, considerar los procedimientos invasivos si la cefalea es refractaria a herramientas farmacológicas sistémicas o locales.
- 1.
El dolor en el hombro del hemicuerpo parético tras un ictus es frecuente y puede tener una repercusión importante en varios aspectos de la funcionalidad y del tratamiento rehabilitador del paciente. Muchas veces se usa el término «hombro doloroso del hemipléjico» (HDH) para englobar las múltiples patologías que subyacen y provocan dolor en el hombro en los pacientes con hemiparesia. Se considera que el dolor de hombro puede condicionar de forma significativa la participación del paciente en las actividades de rehabilitación, contribuir a una peor recuperación funcional y entorpecer la recuperación del movimiento y de la función, y se relaciona con la disminución del rango articular pasivo16,41,42. El HDH se asocia asimismo a una peor calidad de vida, una mayor tasa de depresión, estancias hospitalarias más prolongadas y a una menor probabilidad de volver a una vida autónoma al alta16,41–43. La incidencia que recogen las distintas publicaciones de dolor de hombro tras ictus (HDH) varía entre un 1 y un 84% en los diferentes estudios publicados41. Este rango tan amplio probablemente responde a la heterogeneidad en los estudios en cuanto al tiempo desde el ictus, a los instrumentos de medida, las dificultades en la comunicación y/o las diferentes formas de manifestaciones clínicas que aparecen tras un ictus en cada persona41. Hay consenso en que la incidencia y la severidad del HDH tiende a aumentar con el tiempo14,41,42. Varios estudios prospectivos recogen una incidencia aproximada de dolor de hombro en un 33% de los pacientes en los primeros meses tras el ictus, y el 65% de estos pacientes continúan con este dolor varios meses después43. Otros autores describen que hasta el 72% de los pacientes adultos refieren al menos un episodio de dolor de hombro en el primer año tras el ictus16. Un estudio publicado en 2019 identifica el HDH en el 35% de los pacientes de su muestra a las 72 horas tras el ictus42. Algunos de los factores clínicos que se han considerado de riesgo, o predictores de la aparición de hombro doloroso, son: la edad, la alteración sensitiva táctil y propioceptiva, la aparición de dolor a la movilización pasiva a las dos semanas tras el ictus, la reducción de la abducción pasiva y rotación externa del hombro, el desequilibrio muscular en la región periescapular, el aumento del tono en músculos bíceps y supraespinoso, la presencia de síndrome de heminegligencia y la hemiplejía izquierda7,16,22,42,43. Varios autores consideran que la severidad de la paresia y la puntuación inicial en la escala NIHSS (National Institute of Health Stroke Score) son de los predictores más relevantes para la aparición de dolor de hombro41–43. Respecto a la presencia de subluxación de hombro, la relación directa entre esta y el HDH es controvertida, y mientras algunos estudios determinan que la presencia de subluxación es un predictor de HDH, otros no encuentran correlación significativa9,41–43. Probablemente esto puede ser en parte atribuible a las diferencias metodológicas entre los estudios42,43. La patogénesis del HDH probablemente es multifactorial16,41, incluyendo factores neurológicos y mecánicos42,43. La etiología o etiologías subyacentes a este dolor incluyen patologías como la capsulitis adhesiva, la subluxación glenohumeral, la lesión del manguito de los rotadores, el síndrome hombro-mano y otros. La sensibilización central se ha asociado también a este tipo de dolor41.
PrevenciónLos expertos consideran que la prevención del HDH es un objetivo importante y se debe priorizar desde el primer día tras el ictus, como parte de la rehabilitación3. Para prevenir la aparición de HDH, algunas intervenciones que se plantean son: identificar su presencia desde fases agudas mediante una exploración dirigida, utilizar técnicas de «strapping» (técnica de contención elástica), estimulación eléctrica muscular (aunque estas técnicas se usan sobre todo en la prevención y tratamiento de la subluxación de hombro concretamente), vigilar el posicionamiento del miembro superior afecto, promover el adecuado mantenimiento de rangos de movilización del hombro, proporcionar información al paciente o cuidadores para prevenir dolor o traumatismo en el hombro si tienen riesgo de desarrollar HDH, u orientar el entrenamiento de recuperación del movimiento o función3,7,10,42. Varios autores señalan que se debe reducir el riesgo de HDH en personas con perdida funcional en el brazo tras un ictus mediante el posicionamiento cuidadoso del brazo, sosteniendo el peso del mismo, pero evitando el uso de cabestrillos y poleas9. No obstante, los métodos de prevención del HDH no están firmemente consensuados, posiblemente en relación con la multitud de causas que subyacen al HDH3. Hay autores que señalan que, si el dolor de hombro se trata o se previene de forma eficaz, no interferirá en los ejercicios de rehabilitación del miembro superior22. La tabla 4 recoge los aspectos relacionados a la prevención de la omalgia en el DCS y su correspondiente grado de evidencia en las principales guías revisadas para la elaboración del presente documento.
- -
Recomendaciones SENR
- 1.
Se debe formar al personal sanitario, a las familias y a los pacientes, para que protejan, posicionen y manejen adecuadamente el brazo afecto.
- 2.
Se aconseja considerar el uso de técnicas de «strapping», la electroestimulación muscular y/o el uso de dispositivo de apoyo del brazo, como bandejas y media bandejas, reposabrazos, o almohadones en la silla de ruedas.
- 3.
Se desaconseja el uso de poleas. No se recomienda tampoco el uso de cabestrillos (excepto durante la fase flácida). No se debe movilizar pasivamente el brazo más allá de 90° de flexión o abducción, sin fijar adecuadamente la escápula.
- 1.
Recomendaciones en la omalgia secundaria al daño cerebral sobrevenido
| Recomendación | Grado de evidencia |
|---|---|
| Prevención | |
| Ictus | |
| No se deben usar poleas. | NIVEL ALTOA (CSBPR) |
| Se debe educar adecuadamente al personal sanitario, a las familias y a los pacientes para que protejan, posicionen y manejen adecuadamente el brazo afecto.a) Por ejemplo, posicionando o sujetando cuidadosamente el brazo durante las transferencias; evitando tirar del brazo. | NIVEL ALTOA (CSBPR)NIVEL BAJO C (CSBPR) |
| En pacientes con brazo flácido (p. ej.: Chedoke-McMaster Stroke Assessment Impairment Inventory <3) se debe considerar la estimulación muscular eléctrica. | NIVEL MEDIOB (CSBPR) |
| No se debe movilizar pasivamente el brazo más allá de 90° de flexión o abducción, a no ser que la escápula esté rotada en dirección superior y el húmero esté rotado lateralmente. | NIVEL MEDIOB (CSBPR) |
| Se debe controlar y mantener la movilidad del hombro durante la rehabilitación. | NIVEL MEDIOB (Va/DoD) |
| Las estrategias de protección articular se deben aplicar durante la fase temprana o fláccida de la recuperación, para prevenir o minimizar el HDH o lesión del hombro.Incluyen:1) Posicionamiento y soporte del brazo durante el reposo.2) Protección y soporte del brazo durante el movimiento funcional; evitar estirar el brazo afecto.3) Protección y soporte del brazo mientras está en la silla de ruedas, por ejemplo, mediante bandeja/media bandejas, reposabrazos, o almohadón.4) Se debe desaconsejar el uso de cabestrillos, a excepción de la fase flácida, puesto que puede condicionar la utilización de ese brazo, limitar el braceo, favorecer las contracturas, y afectar a la imagen corporal. | NIVEL MEDIOB (CSBPR)NIVEL BAJOC (CSBPR)NIVEL BAJOC (CSBPR)NIVEL BAJOC (CSBPR) |
| Es razonable considerar el uso de dispositivos de apoyo y cabestrillos para la subluxación de hombro. | NIVEL BAJOC (AHA-ASA) |
| Se recomienda que las estrategias de protección articular, como el posicionamiento adecuado, soporte y manejo correcto, se apliquen durante la fase flácida y temprana de la recuperación para prevenir o minimizar el dolor de hombro y la subluxación. | NIVEL BAJOIV (UEMS-PRM) |
| Evaluación y diagnóstico | |
| Ictus | |
| Se puede considerar la ecografía para el diagnóstico de lesión en partes blandas. | NIVEL MEDIOB (AHA-ASA) |
| Puede ser útil la valoración clínica que incluya la valoración musculoesquelética, grado de espasticidad, cambios sensitivos regionales y diagnóstico de subluxación. | NIVEL BAJOC (AHA-ASA) |
| El diagnóstico del HDH podría incluir la valoración de: tono, movimiento activo, los cambios de longitud en tejidos blandos, el alineamiento del complejo articular del hombro, la postura del tronco, el nivel de dolor, los cambios ortopédicos en el hombro, el impacto del dolor en la salud física y emocional. | NIVEL BAJO C (CSBPR) |
| Se debe indagar sobre la presencia de hombro doloroso en pacientes con paresia severa, diabetes, y hemiplejia izquierda. | NIVEL BAJOC (ICCPN) |
| Tratamiento | |
| Ictus | |
| Se puede considerar la estimulación eléctrica neuromuscular (de superficie o intramuscular) para el hombro doloroso. | NIVEL ALTOA (AHA-ASA) |
| En los pacientes con ictus y hombro doloroso se debe considerar el tratamiento de electroestimulación intramuscular. | NIVEL ALTOA (IMSERSO) |
| Las inyecciones con toxina botulínica pueden ser útiles para disminuir la hipertonía severa en músculos del hombro pléjico. | NIVEL ALTOA (AHA-ASA) |
| Para el tratamiento del dolor del HDH se recomienda el uso de tratamiento combinado de aromaterapia y acupresión. | NIVEL ALTOA (IMSERSO) |
| El «taping» del HDH ha demostrado reducir el dolor. | NIVEL ALTOA (CSBPR) |
| En los pacientes con hombro doloroso espástico se recomienda el tratamiento con infiltración de toxina botulínica del pectoral mayor. | NIVEL ALTOA (IMSERSO) |
| Para el tratamiento del dolor del HDH se recomienda el uso de terapia con movimientos pasivo-continuo del hombro. | NIVEL ALTOA (IMSERSO) |
| Es razonable el empleo de fármacos analgésicos neuromoduladores para abordar el HDH en pacientes con signos clínicos de dolor neuropático, manifestados como cambios sensitivos en la zona del hombro, alodinia o hiperpatía. | NIVEL ALTOA (AHA-ASA) |
| Para el tratamiento del dolor de hombro del hemipléjico:Las infiltraciones intraarticulares con corticoides están indicadas, pero su efecto es de corta duración.La toxina botulínica está indicada.La acupuntura puede ser útil. | NIVEL ALTOA (ICCPN)NIVEL MEDIOB (ICCPN)NIVEL MEDIOB (ICCPN) |
| Considerar el uso de agentes orales como tizanidina o baclofeno para tratar la espasticidad, especialmente si se asocia a dolor, poca higiene cutánea, o disminución de la función. La tizanidina se debe usar específicamente en pacientes crónicos tras ictus. | NIVEL MEDIOB (Va/DoD) |
| Se puede reducir la subluxación y disminuir el dolor con el uso de estimulación eléctrica funcional en la articulación del hombro. | NIVEL MEDIOB (Va/DoD) |
| Se recomienda la toxina botulínica, sola o asociada a medicación oral, en pacientes con espasticidad focal sintomática que sea dolorosa, limite la función, disminuya la capacidad de participar en rehabilitación, condicione el posicionamiento adecuado o el cuidado de la piel. | NIVEL MEDIOB (Va/DoD) |
| La infiltración con toxina botulínica en los músculos subescapular y pectoral del hombro se puede usar para tratar el HDH que se considere asociado a espasticidad. | NIVEL MEDIOB (CSBPR) |
| El bloqueo del nervio supraescapular se puede considerar un tratamiento coadyuvante para el HDH. | NIVEL MEDIOB (AHA-ASA) |
| La utilidad de las infiltraciones subacromiales o glenohumerales de corticoesteroides en pacientes con inflamación en estas zonas es incierta. | NIVEL MEDIOB (AHA-ASA) |
| Las infiltraciones subacromiales con corticoesteroides se pueden emplear cuando se considere el dolor del hombro hemipléjico relacionado con lesión o inflamación de la zona subacromial (manguito de los rotadores o bursa). | NIVEL MEDIOB (CSBPR) |
| La utilidad de la acupuntura como tratamiento coadyuvante para el HDH es incierta. | NIVEL MEDIOB (AHA-ASA) |
| Para el tratamiento del dolor del HDH se recomienda la punción seca en puntos desencadenantes. | NIVEL MEDIOB (IMSERSO) |
| El tratamiento del HDH relacionado con la limitación del rango de movilidad articular puede incluir: estiramientos suaves y técnicas de movilización, y típicamente implica aumentar la rotación externa y la abducción.Se debe aumentar progresivamente el rango de movimiento activo, al tiempo que el realineamiento articular, y el fortalecimiento de los músculos debilitados del hombro. | NIVEL MEDIOB (CSBPR) |
| En pacientes tras ictus con dolor de hombro, el «strapping» se puede emplear para disminuir el dolor. | NIVEL BAJOC (SF-CGSM) |
| Se recomienda la educación/formación de familiares (p. ej., rango de movimiento, posicionamiento, etc.); en particular en el momento antes del alta o ante cambios en el cuidado/asistencia. | NIVEL BAJOC (AHA-ASA) |
| En pacientes tras ictus con dolor de hombro y espasticidad de miembro superior, la toxina botulínica A se puede usar para reducir el dolor. | NIVEL BAJOC (SF-CGSM) |
| Se recomienda que el abordaje del HDH, después de una valoración exhaustiva de las causas subyacentes, pueda incluir la inyección de corticoesteroides en espacio subacromial o glenohumeral, el bloqueo del nervio supraescapular, la estimulación eléctrica de músculos del hombro, la infiltración de toxina botulínica en músculos subescapular y/o pectoral, la ortesis de hombro, el uso de antiinflamatorios orales, masaje, técnicas de movilización suave de la musculatura del hombro, y la acupuntura. | NIVEL BAJOIV (UEMS-PRM) |
| En pacientes tras ictus con dolor de hombro, las inyecciones (ya sean de corticoides en espacio subacromial, o de metilprednisolona y bupivacaina para al bloqueo del n. supraescapular), se pueden emplear para disminuir el dolor. | NIVEL BAJOC (SF-CGSM) |
| En pacientes tras ictus con dolor de hombro, la estimulación eléctrica no se recomienda para disminuir el dolor. | NIVEL BAJOC(SF-CGSM) |
| La tenotomía quirúrgica del pectoral mayor, latissimus dorsi, teres major o subescapular, se puede considerar en pacientes con hemiplejia severa y restricción del rango de hombro. | NIVEL BAJOC (AHA-ASA) |
CSBPR: Canadian Stroke Best Practice Recommendations: Stroke Rehabilitation Practice Guidelines; AHA/ASA: American Heart Association-American Stroke Association; UEMS-PRMS: European Union of Medical Specialists-Physical and Rehabilitation Medicine Section; VA-DOD: Clinical Practice Guidelines for the management of Stroke Rehabilitation. Department of Veterans Affairs- Department of Defense; ICCPN: The Italian Consensus Conference on Pain in Neurorehabilitation; HDH: hombro doloroso del hemipléjico.
Para detectar la presencia de omalgia y tratar de determinar la severidad del dolor, se emplean escalas de perfil subjetivo, como la escala visual analógica en disposición vertical (EVA vertical) (para evitar la confusión en pacientes con síndrome de heminegligencia); el Rithchie Articular Index (RIA); la escala numérica (NRS), el cuestionario de dolor de hombro ShoulderQ y otros41–43. También es frecuente el uso de maniobras de exploración para determinar el compromiso subacromial, como el test de Neer, y/o la palpación de puntos dolorosos o de la congruencia glenohumeral41,42. En general, se debe preguntar regularmente acerca de la presencia de dolor en el hombro en pacientes con debilidad en el brazo tras un ictus9. Tanto la EVA vertical como el RIA se consideran herramientas de medida válidas y fiables para determinar el dolor de hombro tras el ictus41. Cabe señalar, no obstante, que la fiabilidad del uso de la EVA en pacientes tras el ictus se ha cuestionado, por ser poco adecuada para captar las complejidades que puede implicar el síntoma de dolor43. En relación con la alteración estructural de las partes blandas y mecánica de la articulación del hombro, un estudio evidenció que un tercio de los pacientes tras un ictus presentaban alteraciones en la ecografía del hombro hemipléjico en la etapa aguda que incluían signos de inflamación en la bursa subacromial y tendón del bíceps, tendinopatía del bíceps y manguito rotador. La presentación de dichas alteraciones se asociaba con la presencia de omalgia secundaria, pero no con la severidad de tal7. La tabla 4 recoge los aspectos relacionados con la evaluación y diagnóstico de la omalgia en el DCS y su correspondiente grado de evidencia en las principales guías revisadas para la elaboración del presente documento.
- -
Recomendaciones SENR
- 1.
Preguntar regularmente si hay dolor en el hombro a los pacientes con factores de riesgo de HDH.
- 2.
Emplear cuestionarios y escalas validadas para la valoración del dolor y/o realizar maniobras de exploración específicas para el hombro.
- 3.
Considerar la ecografía como técnica complementaria para el diagnóstico de lesión en partes blandas.
- 1.
Es necesario establecer un diagnóstico etiológico preciso para prescribir un tratamiento lo más dirigido y eficaz posible, y la severidad del dolor debe ser evaluada mediante escalas de dolor validadas9,43. El manejo terapéutico habitual incluye AINE, analgésicos, masoterapia, strapping, cabestrillos, electroterapia, vibroterapia, ejercicios específicos, bloqueos nerviosos, infiltraciones intraarticulares con corticoides y/o toxina botulínica; sin que haya consenso en qué tratamiento es mejor3,9,22,43. El tratamiento del HDH es el área donde probablemente se han publicado más estudios dentro del abordaje del dolor en DCS, analizando distintas técnicas de abordaje, incluyendo aquellas rehabilitadoras convencionales (técnicas neurofisiológicas y robóticas), farmacoterapia sistémica y local (infiltraciones intraarticulares o peritendinosas) y/o de medicina alternativa (acupresión o acupuntura, por ejemplo)7. En algunas circunstancias de dolor de hombro cronificado y de difícil control, se valora la opción del uso de opioides sistémicos, según las recomendaciones del control de dolor crónico no oncológico de las guías de los Centros para el Control y Prevención de Enfermedades de EE. UU. (CDC), teniendo en cuenta siempre el uso de la menor dosis efectiva, así como los riesgos y beneficios e interacción con otros medicamentos en el ascenso progresivo, según los casos individualizados44. Encontramos estudios que avalan el uso de técnicas como la estimulación eléctrica intramuscular, punción seca, «taping», ejercicios específicos de movilización pasiva, acupresión, toxina botulínica y corticoides; o que nombran técnicas que consideran de no utilidad, como la inmovilización mediante vendaje del HDH, o los programas de estiramientos estáticos del hombro2. La tabla 4 recoge los aspectos relacionados al tratamiento de la omalgia en el DCS y su correspondiente grado de evidencia en las principales guías revisadas para la elaboración del presente documento.
- -
Recomendaciones SENR
- 1.
Identificar la etiología o etiologías concretas que provocan el HDH y la severidad de este, y en función de ello, seleccionar la o las herramientas terapéuticas más adecuadas en cada caso.
- 2.
Considerar las infiltraciones intraarticulares con corticoides, potencialmente útiles, fundamentalmente en casos en que subyace la artritis en el hombro como causa principal del dolor. Generalmente su efecto es de corta duración.
- 3.
Considerar la infiltración con toxina botulínica en los músculos subescapular y pectoral, sobre todo en el HDH que se considere asociado a espasticidad.
- 4.
Emplear fármacos analgésicos neuromoduladores para abordar el HDH en pacientes con signos clínicos de dolor neuropático.
- 5.
Considerar la estimulación eléctrica neuromuscular (de superficie o intramuscular).
- 6.
Asociar técnicas de terapia con movimientos pasivo-continuos del hombro.
- 7.
Valorar el uso de «taping», que facilite la sujeción de la musculatura del hombro pléjico.
- 1.
Además de la cefalea y la omalgia, existen otras manifestaciones de dolor de tipo nociceptivo o mixto en el paciente con DCS, que generalmente son menos frecuentes, pero que en ocasiones aparecen durante el proceso de neurorrehabilitación. Algunos cuadros relativamente frecuentes son la lumbalgia, la gonalgia mecánica (habitualmente relacionada con la hiperextensión de la rodilla durante la fase de carga de la marcha), el dolor posquirúrgico, el síndrome miofascial doloroso, el dolor asociado a la aparición de osificaciones paraarticulares (OPA) y/o el dolor pélvico crónico17,26. En el caso del paciente tras un ictus, el dolor musculoesquelético se observa hasta en un cuarto de supervivientes. Un estudio italiano multicéntrico definió una prevalencia general de 24,6%, con una prevalencia del 37,3% en la etapa subaguda, y de 28,5% en la etapa crónica14. Muchas de las alteraciones que causan dolor musculoesquelético tras DCS pueden ser condiciones previas a la patología neurológica actual del paciente en neurorrehabilitación (como los trastornos osteoarticulares degenerativos), ser consecuencia directa del mismo daño neurológico (como en el caso de politraumatismos como parte de la etiología del TCE), o aparecer secundariamente a la cirugía realizada tras un politraumatismo. Sea cual sea el origen, se deben tener en cuenta para su adecuado manejo farmacológico y no farmacológico, y evitar que resulten en una mala adherencia a la terapia rehabilitadora. Algunos cuadros de dolor musculoesquelético pueden tener mecanismos fisiopatológicos que combinen un origen o patrón inflamatorio nociceptivo, neuropático periférico y de disfunción central. Es el caso, por ejemplo, del dolor lumbar crónico (más de tres meses de evolución), que se cataloga como de origen «mixto», con un 50-70% de componente nociceptivo (afectación osteofacetaria, discal y ligamentaria) y un 5-15% de componente neuropático (radiculopatía compresiva y no compresiva relacionada al proceso inflamatorio)17. Esto ocurriría igualmente en el caso del dolor pélvico crónico y otras condiciones nociceptivas viscerales con factores neuropáticos asociados, que en su etapa crónica pueden derivar en una disfunción de la percepción central y relacionarse con un abanico de síndromes dolorosos complejos, como la fibromialgia17. Alguna publicación refiere que existe una relación habitual entre el ictus y la condrocalcinosis, en la que, debido al depósito de pirofosfato cálcico en las uniones cartilaginosas de las articulaciones, aparecen crisis de dolor agudo días después del ictus, con reacciones inflamatorias en articulaciones como la rodilla y la mano en el área hemipléjica, apareciendo de forma más crónica en pacientes adultos mayores36. En cuanto a la prevención de la aparición de este tipo de manifestaciones dolorosas, se pueden tener en cuenta algunos factores de riesgo propios de estos cuadros, como la obesidad (índice de masa corporal [IMC]> 30), la edad (con frecuencia a partir de la tercera década de la vida e incremento con la edad), así como factores genéticos, hereditarios y ocupacionales previos de la persona, que influirían en la aparición de dolor tras DCS y en su cronicidad. El evitar los factores modificables por parte del equipo terapéutico es de utilidad para evitar su cronicidad una vez descubierto el dolor17. En la evaluación de estos otros tipos de dolor en el paciente con DCS es importante valorar los síntomas y signos asociados que pudieran determinar otra etiología del dolor, por ejemplo, a través de pruebas complementarias (laboratorio, imagen, etc.), sobre todo cuando la presentación del dolor es crónica (mayor a tres meses). Las herramientas de graduación del dolor en su diagnóstico inicial y en el seguimiento, como la EVA, generalmente en su disposición vertical (EVA vertical), son también de utilidad para el adecuado seguimiento en el manejo de estos otros tipos de dolor nociceptivo. Para estudiar el impacto funcional asociado a estos, existen escalas clínicas globales, como el Índice de Discapacidad del Dolor; o escalas específicas, para cuadros concretos, como el Índice de Discapacidad de Oswestry y el Cuestionario de Discapacidad de Roland Morris, para el dolor lumbar17. En cuanto al manejo terapéutico, va a depender del tipo de dolor, y de si este es agudo o crónico. En el caso del dolor agudo, probablemente bastará con tratamiento sintomático, consejos médicos y medidas de prevención. El dolor subagudo a crónico, teniendo en cuenta las circunstancias condicionantes mencionadas previamente, y en el contexto de un manejo dentro de un equipo interdisciplinar, se abordará con tratamientos farmacológicos (indicados según el perfil del dolor), técnicas de terapia física y/o abordaje psicológico17. En el caso del tratamiento sintomático, de primera línea tenemos el paracetamol, y de segunda línea los AINE. El tramadol y otros opiáceos pueden ser una tercera línea terapéutica, siempre valorando el riesgo/beneficio del tratamiento con opioides en estos pacientes. En el caso del dolor crónico, el uso de fármacos típicos en el abordaje del dolor neuropático (como antidepresivos tricíclicos, inhibidores de la recaptación de serotonina y noradrenalina [IRSN], antiepilépticos específicos), las infiltraciones locales de anestésicos, corticoides y/o toxina botulínica, y otras herramientas de estimulación eléctrica, deben ser empleadas según se indica en las guías específicas para cada tipo de dolor, y teniendo siempre en cuenta las características individuales de cada paciente.
- -
Recomendaciones SENR
- 1.
El dolor nociceptivo más frecuente tras el DCS, aparte de la cefalea y el HDH, es el de origen osteoarticular y en especial la lumbalgia baja.
- 2.
Estos cuadros de dolor pueden aparecer como consecuencia del DCS; en relación con la presencia de antecedentes de riesgo en el paciente (edad, peso, factores genéticos y ambientales); y/o vinculados con el proceso de rehabilitación.
- 3.
En el diagnóstico y seguimiento son útiles herramientas como la EVA y de graduación numérica, y escalas de valoración de discapacidad genéricas y específicas.
- 4.
El tratamiento debe incluir medidas farmacológicas y no farmacológicas, como técnicas fisioterápicas y abordajes psicológicos. En el plano farmacológico, se debe seguir el escalonamiento propio del dolor nociceptivo indicado en las guías específicas para cada tipo de dolor.
- 1.
El dolor neuropático se define como un fenómeno de disfunción del sistema nervioso, en particular del sistema somatosensorial, como resultado de la lesión, enfermedad o alteración de este, comprometiendo a fibras mielínicas A-beta, A-delta, fibras amielínicas C y neuronas centrales45. Puede desencadenarse por un deterioro producido en la esfera del sistema nervioso periférico (SNP) o por afectación directa del sistema nervioso central (SNC), como consecuencia de un amplio abanico de etiologías. Se enmarca en cuadros sindrómicos muy diversos, con una discrepancia entre los signos objetivos de daño tisular, su magnitud clínica y la discapacidad funcional que produce, lo que en ocasiones puede motivar su infradiagnóstico o bien dificultar su abordaje terapéutico. Su definición clásica en el año 1994 por la IASP es de «dolor causado o iniciado por una lesión primaria o disfunción en el sistema nervioso». En relación con la escasa especificidad de esta definición para explicar la fisiopatología en otros procesos neurológicos, la 2010 IAPS Special Interest Group on Neurophatic Pain (NeuPSIG) propuso en el 2008 la definición de: «dolor que aparece como consecuencia directa de la lesión o enfermedad que afecta al sistema somatosensorial». En el 2011 el comité taxonómico de la IASP amplió la definición a «dolor causado por lesión o enfermedad en el sistema nervioso somatosensorial». Estas últimas dos definiciones se ajustan mejor al estudio del dolor neuropático en la neurorrehabilitación16. Las alteraciones del SNP, que a veces se presentan asociadas al paciente con DCS, pueden degenerar en dolor neuropático. Es el caso de las plexopatías, radiculopatías y mononeuropatías. Estas pueden presentarse en nuestro paciente como una condición previa (p. ej., la relacionada con diabetes mellitus), o como consecuencia directa del politraumatismo (p. ej., en los TCE, en la etapa aguda y subaguda del ingreso hospitalario). Este tipo de dolor genera una discapacidad y alteración de la calidad de vida, que condiciona la adecuada adherencia a la terapia neurorrehabilitadora. En la presente guía nos centramos en el dolor neuropático de origen central al referirnos exclusivamente al dolor como consecuencia del DCS, recomendando la lectura de guías como la del Italian Consensus Conference on Pain in Neurorehabilitation (ICCPN) sobre el manejo del dolor neuropático de origen periférico, que comparte principios de manejo del dolor neuropático de origen central, que revisamos a continuación46. Existe en el DCS la posibilidad de lesión directa sobre el sistema somatosensorial y sobre regiones involucradas en la percepción y modulación eferente del dolor; lo que ocasiona con frecuencia la expresión de dolor neuropático como síntoma. Un problema específico en neurorrehabilitación es que los déficits cognitivos, lingüísticos y las alteraciones de consciencia que ocurren en pacientes con ictus, TCE o enfermedades neurodegenerativas, pueden impedir que se realice una historia clínica detallada, como se requiere en los dos primeros pasos del «Neuropathic Pain Grading System».
Dolor neuropático centralConceptoSe puede definir al DNC como el síndrome doloroso sobrevenido por una lesión aguda en alguna estructura del SNC, gestado por una respuesta secundariamente modificada de los múltiples mecanismos estructurales de modulación, distorsionados por el daño47. Este dolor no cumple una función protectora y no tiene rentabilidad biológica. Por el contrario, genera la inadaptación y la percepción anormal de los impulsos dolorosos y no dolorosos, ocasionando varios desórdenes de las funciones del SNC. El ictus es una de las causas de dolor central más habituales. Usualmente este tipo de dolor es conocido en el ictus por su síndrome de dolor posdaño talámico (síndrome Déjerine Roussy). Otras patologías del SNC que pueden desencadenar este dolor central serían las lesiones medulares, la esclerosis múltiple y la enfermedad de Parkinson, con una prevalencia superior al 7-10%, inicialmente calculada en términos generales, para la prevalencia global del DNC48. Además de las referidas, aquellas patologías del SNC con menor proporción de presentación de dolor central serían el TCE y medular, lesiones secundarias a intervenciones neuroquirúrgicas, tumores del SNC y malformaciones arteriovenosas, infecciones encefálicas y medulares, enfermedades autoinmunes con expresión inflamatoria del SNC y epilepsia. En España, la prevalencia del DNC sería del 2,4%49. La incidencia del dolor central posictus (DCPI) es incierta, con estimaciones que varían entre el 5 y el 46% de personas con ictus, siendo frecuentemente infradiagnosticado. Se atribuye esta variabilidad en la incidencia a la heterogeneidad etiológica, las localizaciones de la lesión, el diseño del estudio y el momento desde el accidente50. El DCPI suele iniciarse días después de la lesión, siendo la mayoría sintomático al primer mes7. En aproximadamente un 25% de casos puede aparecer en la etapa aguda o subaguda tras un ictus, sin embargo, lo usual, es su desarrollo a los tres a seis meses tras la lesión14. Estudios prospectivos, revelan que el 2,7% de los pacientes que sufrieron un ictus padecieron DCPI transcurrido un año, y que otro 25% lo sufre dentro de los primeros seis meses, tras un infarto en el tronco cerebral51. El inicio tardío del fenómeno doloroso induce a pensar que es más producto de la reorganización de circuitos neuronales, que por la lesión misma. Este tipo de dolor se asocia más frecuentemente a lesiones del núcleo ventro-caudal del tálamo a partir de lesiones en el territorio de la arteria talámica geniculada, y a lesiones de tronco de encéfalo (región lateral del bulbo como por ejemplo en el caso del síndrome de Wallenberg)16. Las lesiones en el área opercular-insular y perisilviana posterior, también pueden producirlo52. El puente, localizaciones supratentoriales y prácticamente cualquier territorio que involucre las vías del dolor ascendente y descendente pueden estar comprometidos53, con prevalencias distintas para cada una de las localizaciones, según los diferentes estudios. Es importante destacar que no existe relación del cuadro de dolor central con el tipo de ictus (en el caso del DCPI) o con el tamaño de la lesión, sino con la localización de esta. Se manifiesta pues, con o sin otras alteraciones sensitivas acompañantes, en la zona corporal concerniente al territorio cerebral afectado. El dolor central puede que se combine, y en ocasiones se confunda, con la espasticidad dolorosa. Es diferente al dolor musculoesquelético9. Es descrito por los pacientes como una pérdida de sensibilidad normal asociada a un dolor tipo urente o punzante, implicando frecuentemente la presencia de alodinia y disestesias desencadenadas por la estimulación táctil, el frío o el movimiento en la zona afectada. Suele ser continuo o intermitente, y puede empeorar con el calor, el frío o el estrés emocional16. El DCPI puede condicionar seriamente la capacidad de una persona para realizar las actividades básicas de la vida diaria (ABVD), interferir con el sueño, afectar al estado de ánimo, desencadenar alteraciones psiquiátricas con pensamientos suicidas incluso (suponiendo la presencia de DCPI un riesgo de suicidio tres veces mayor al del ictus en ausencia de DCPI) y disminuir la calidad de vida16.
Etiología y fisiopatologíaLa fisiopatología del dolor neuropático de origen central se explica bajo tres teorías:
- -
Teoría de desinhibición central. Plantea una pérdida apoptótica selectiva en la actividad de la vía del ácido gamma aminobutírico (GABA) secundaria a la lesión talámica del núcleo ventral posterolateral, que resulta en una desinhibición del tracto espinotalámico.
- -
Teoría del desbalance central. Considera que el dolor es producido por lesiones que activan en mayor medida la ínsula y el tracto espinotalámico (vía lateral), que la corteza cingular anterior y lemnisco medio (vía medial)47,53–55 a partir del mal procesamiento de señales por interrupción de circuitos específicos, y como respuesta de la mala adaptación al daño cerebral por parte del sistema inmune.
- -
Teoría de sensibilización central. Sostiene que el dolor es producido por la hiperexcitabilidad del tálamo y la corteza, con una mayor activación de los receptores N-metil-D-aspartato (NMDA) y los canales de calcio; ya que el DNC puede ser regulado por antagonistas del receptor NMDA, bloqueadores de los canales de calcio, sodio y agonistas GABA47,54.
La prevención del DNC es un proceso largo. Es necesario un enfoque multidimensional, individualizado e integral, basado en el conocimiento de las características etiopatogénicas del síndrome doloroso, sus manifestaciones clínicas, la presencia de enfermedades concomitantes, los posibles efectos secundarios y complicaciones surgidas de alguna técnica invasiva o quirúrgica puntual realizada, además del uso complejo de la farmacoterapia.
- -
Recomendaciones SENR
- 1.
Conocer las manifestaciones del dolor neuropático y estar atentos a la aparición del mismo, sobre todo a partir del primer mes tras el DCS.
- 2.
Considerar las comorbilidades previas y posteriores al DCS y el efecto secundario de un tratamiento farmacológico o técnica invasiva o quirúrgica puntual, como posibles desencadenantes en la aparición de dolor neuropático.
- 1.
Como se ha plasmado previamente, la clínica del DNC es heterogénea y puede transformarse con el paso del tiempo. Algunos pacientes con DCPI se quejan de dolor inducido o agravado por factores como la estimulación táctil, los cambios de temperatura (especialmente el frío) y el estrés emocional53. El dolor más frecuente es el desencadenado por el movimiento, caracterizado por la sensación de tensión, presión y ardor en la piel. En ocasiones, el dolor puede ser paroxístico, descrito como puñaladas, disparos o lancinante. No siempre los pacientes pueden describir completa y correctamente su dolor. En este caso, el médico debe ayudarles a encontrar los términos que describan más detalladamente el dolor: quemante, punzante, opresivo, palpitante, cortante, sordo, eléctrico, entumecedor, entre otros, y aunque no son patognomónicos, deben ser considerados dentro de la sospecha clínica de DNC. El dolor es moderado-intenso, por lo habitual expresado de 3 hasta 8 en la EVA; con una localización difusa o abarcando áreas somáticas extensas. Generalmente, la circunscripción dolorosa concierne a las estructuras cerebrales afectadas, pero no en todos los casos se encuentra esta correlación56. En un estudio reciente, el orden de frecuencia de las localizaciones somáticas más comunes del dolor fue: extremidades superiores, extremidades inferiores, región craneofacial, dolor simultáneo en extremidades superiores e inferiores o dolor en toda la mitad contralateral del cuerpo57. Se describen también áreas mixtas de hipoestesia e hiperestesia en regiones afectadas por el dolor, como prueba patente de las diversas anomalías sensoriales que se agregan al DCPI. En este sentido, los fenómenos positivos sensitivos como alodinia, hiperalgesia, parestesias y disestesias se han reportado hasta en el 85% de los pacientes con DNC. Los criterios diagnósticos para el dolor neuropático de origen central se basarían en los propuestos por Klit et al.54, que, aunque inicialmente fueron planteados para el DCPI, son extrapolables para el DNC en general. Y, por otro lado, los criterios de clasificación de dolor neuropático de Treede58. Estos son los que, a lo largo del tiempo, se han determinado como los más reconocidos y convenientes para la práctica clínica y de investigación.
Criterios diagnósticos de DCPI de Klit et al.54Criterios principales
- -
Dolor en un área del cuerpo correspondiente a la lesión del SNC.
- -
Historia sugestiva de ictus previo e inicio del dolor después o durante el episodio ictal.
- -
Confirmación de la lesión en el SNC por imagen o signos sensoriales negativos o positivos circunscritos al área del cuerpo correspondiente a la lesión.
- -
Otras causas excluidas o poco probables.
Criterios que apoyan el diagnóstico
- -
Ausencia de relación con el movimiento, inflamación o daño del tejido local en la zona de dolor.
- -
Cualidad de quemante, frío, eléctrico, punzante u opresivo; aunque cualquier descripción es válida.
- -
Alodinia o disestesia al tacto o frío.
Denota dolor neuropático definitivo si cumple los cuatro criterios, probable si son los primeros dos, más el tercero o el cuarto, y posible si los primeros dos, sin evidencia confirmatoria para el tercero o cuarto.
- -
Dolor dentro de una distribución neuroanatómicamente plausible: dolor unilateral en cuerpo y/o cara o unilateral en una parte del cuerpo con compromiso contralateral de la cara.
- -
Historia que sugiera una lesión relevante o enfermedad que afecte el sistema somatosensorial, ya sea periférico o central. Esta además debe cumplir una relación típica temporal.
- -
Demostración de una distribución neuroanatómicamente plausible a través de una prueba confirmatoria.
- -
Signos sugerentes de lesión relevante o enfermedad por prueba confirmatoria: esta prueba dependerá del tipo de lesión o patología causal.
La tabla 5 recoge los aspectos relacionados a la evaluación y diagnóstico del DNC en el DCS y su correspondiente grado de evidencia en las principales Guías revisadas para la elaboración del presente documento.
- -
Recomendaciones SENR
- 1.
Realizar una anamnesis dirigida, en referencia a las características del dolor neuropático y efectuar una adecuada exploración neurológica, y llevar a cabo las pruebas auxiliares pertinentes para encontrar una relación congruente con el daño y las características del dolor referido por el paciente.
- 2.
Tener en cuenta la relación de la clínica con las áreas neuroanatómicas especialmente descritas como involucradas con la aparición del DNC.
- 1.
Recomendaciones en el dolor neuropático central secundario al daño cerebral sobrevenido
| Recomendación | Grado de evidencia |
|---|---|
| Evaluación y diagnóstico | |
| Ictus | |
| Siempre que sea posible, se debe emplear el NGS58 para el diagnóstico de dolor neuropático tras ictus. Se pueden emplear herramientas de screening o cuestionarios cuando no se puede aplicar el NGS, pero no deben reemplazar la evaluación clínica y el sistema de graduación para el diagnóstico del dolor neuropático. | NIVEL MEDIOB (ICCPN) |
| Debe indagarse acerca de la presencia de DCPI en pacientes con ictus, especialmente tras lesiones en el territorio de la arteria tálamo-geniculada, en la zona límite del núcleo ventral posterior y el núcleo pulvinar, el bulbo lateral, y la ínsula. | NIVEL MEDIOB (ICCPN) |
| En pacientes con ictus, se deben emplear el NGS, y las indicaciones de la «Reflex Sympathetic Dystrophy Syndrome Association», para el diagnóstico de DCPI y SDRC respectivamente. | NIVEL MEDIOB (ICCPN) |
| El diagnóstico de DCPI debe estar basado en criterios diagnósticos establecidos después de excluir otras causas de dolor. | NIVEL BAJOC (AHA-ASA) |
| Tratamiento* | |
| Ictus | |
| En cuanto a dolor neuropático en general, las GP indican que:a) 1ª línea: los antidepresivos tricíclicos, inhibidores selectivos de la recaptación de serotonina (ISRS), pregabalina, y gabapentina.b) 2ª línea: parches de lidocaína al 5%, parches capsaicina 8%, tramadol.c) 3ª línea: opiáceos fuertes, toxina botulínica.Pero sólo una minoría de pacientes responden a tratamiento farmacológico. | NIVEL ALTOA (ICCPN) |
| Para el tratamiento del DCPI: La amitriptilina y la lamotrigina están indicadas como primera elección, con un escalado lento en el caso de la lamotrigina. Y la duloxetina, pregabalina y gabapentina son elección de segunda línea. No se indica el levetiracetam. Ni la naloxona. En casos refractarios se pueden considerar los opiáceos, la EMTr, o la estimulación de la corteza motora. | NIVEL MEDIOB (ICCPN)NIVEL BAJOC (ICCPN)NIVEL MEDIOB (ICCPN)NIVEL ALTOA (ICCPN) |
| En cuanto a dolor neuropático en general, se debe considerar la terapia combinada con pregabalina/gabapentina+opioides/ADT/duloxetina para disminuir los efectos secundarios. | NIVEL MEDIOB (ICCPN) |
| La estimulación de la corteza cerebral motora puede ser un abordaje razonable para el DCPI intratables, no respondedores a otros tratamientos, en personas seleccionadas. | NIVEL MEDIOB (AHA-ASA) |
| La estimulación cerebral profunda no se ha establecido como un tratamiento eficaz. | NIVEL MEDIOB (AHA-ASA) |
| La amitriptilina y la lamotrigina son opciones farmacológicas de primera línea razonables. | NIVEL MEDIOB (AHA-ASA) |
| La pregabalina, gabapentina, carbamazepina o la fenitoína, se pueden considerar como tratamientos de segunda línea. | NIVEL MEDIOB (AHA-ASA) |
| Los pacientes con DCPI persistente deben recibir tratamiento oral -prueba a dosis bajas- de analgésicos de acción central. | NIVEL BAJOC (CSBPR) |
| Como primera línea deben recibir antiepilépticos (tipo pregabalina o gabapentina). | NIVEL BAJOC (CSBPR) |
| Como segunda línea deben recibir antidepresivos tricíclicos (p.ej. amitriptilina) o ISRS y duales (en particular, la duloxetina). | NIVEL BAJOC (CSBPR) |
| Si no responde a los fármacos de primera o segunda línea, el tratamiento puede incluir opiáceos o tramadol. Se recomienda tener precaución con el uso de opiáceos por el riesgo de dependencia física que presentan. | NIVEL BAJOC (CSBPR) |
| Podemos considerar la pregabalina para disminuir el DNC provocado por lesiones en el cerebro o la médula espinal. | NIVEL BAJOC (INESS-ONF) |
| El manejo interprofesional del dolor probablemente es útil asociado a farmacoterapia. | NIVEL BAJOC (AHA-ASA) |
| Se recomienda un programa de manejo interdisciplinario del dolor que incluya farmacoterapia y ejercicio físico; pueda considerar el apoyo psicosocial, y se pueda probar la estimulación de la corteza motora en DCPI. | NIVEL BAJOIV (UEMS-PRM) |
| Las medidas estandarizadas pueden ser útiles para monitorizar la respuesta al tratamiento. | NIVEL BAJOC (AHA-ASA) |
| Para el abordaje del DCPI se debe implementar una aproximación individualizada por parte de un equipo interdisciplinar que incluya profesionales de la salud con experiencia en salud mental y en el manejo del DCPI. | NIVEL BAJOC (CSBPR) |
El único medicamento con aprobación en ficha técnica para su uso en dolor neuropático de origen central en la actualidad es la pregabalina. Sin embargo, basándose en la experiencia de los autores, y según las sugerencias de las referencias utilizadas, podemos ofrecer el uso igualmente de estas recomendaciones (con niveles de evidencia) para el tratamiento del dolor neuropático en general.
CSBPR: Canadian Stroke Best Practice Recommendations: Stroke Rehabilitation Practice Guidelines; AHA/ASA: American Heart Association-American Stroke Association; ICCPN: The Italian Consensus Conference on Pain in Neurorehabilitation; INESS-ONF: Institute National D́excellence en Santé et en Services Sociaux – Ontario Neurotrauma Foundation; SF-CGSM: Stroke Foundation - Clinical Guidelines for Stroke Management; UEMS-PRMS: European Union of Medical Specialists-Physical and Rehabilitation Medicine Section; NGS: Neurophatic pain grading system; DCPI: incidencia del dolor central posictus; SDRC: síndrome del dolor regional complejo; GP: práctica clínica; DNC: dolor neropático central.
Existe evidencia limitada en cuanto a la eficacia de tratamientos tanto farmacológicos como no farmacológicos para el manejo del DNC. Una opción razonable sería la combinación de ambos, incluido un soporte psicológico asociado7. Cabe destacar que es la pregabalina, el único fármaco a fecha de hoy que tiene indicación en ficha técnica para el control de dolor neuropático de origen central. Sin embargo, en términos generales, se puede inferir que la terapia farmacológica para el dolor neuropático de origen central incluye las mismas clases de medicamentos utilizados para tratar el dolor neuropático periférico. Se destacan, como guías referenciales de terapia farmacológica del dolor neuropático, las propuestas por las recomendaciones Grading of Recommendations (GRADE) y la Guía de la Federación Europea de Sociedades Neurológicas para el tratamiento del dolor neuropático(EFNS Guidelines on Pharmacological Treatment of Neuropathic Pain). Las técnicas no invasivas de neuromodulación van cobrando interés en el manejo de este tipo de dolor como herramientas terapéuticas coadyuvantes al tratamiento farmacológico y físico. Las personas que han sufrido un ictus recalcan la importancia de la educación a familiares y cuidadores en el conocimiento y manejo del DCPI. También las personas con ictus requieren educación en DCPI para que se puedan revisar a sí mismos y reconocer síntomas potenciales16. La tabla 5 recoge los aspectos relacionados al tratamiento del DNC en el DCS y su correspondiente grado de evidencia en las principales guías revisadas para la elaboración del presente documento.
- -
Recomendaciones SENR
- 1.
Extrapolar las recomendaciones dirigidas a abordar el DCPI, cualquiera que sea la etiología del DNC.
- 2.
Individualizar la elección del tratamiento para el dolor neuropático, de acuerdo con el paciente, su tipo de DCS, las comorbilidades y medicamentos de base, así como los efectos secundarios que puedan aparecer.
- 3.
Buscar la combinación más adecuada de terapia farmacológica y no farmacológica.
- 4.
El tratamiento farmacológico inicial debe ser con amitriptilina (antidepresivo tricíclico) o lamotrigina (fármaco antiepiléptico), e ir escalonado (buscando la dosis mínima eficaz), asociándolos o cambiando a fármacos de segunda línea (otros fármacos antiepilépticos [FAE] y/o antidepresivos).
- 5.
Evitar en la medida de lo posible los efectos secundarios que amenacen la adecuada adherencia a la terapia neurorrehabilitadora.
- 6.
Tener precaución con el uso de los opioides, por sus efectos adversos en los síntomas neurológicos y cognitivos del paciente, además de la dependencia que pueden generar.
- 7.
Considerar las terapias neuromoduladoras no invasivas como adyuvante cuando las terapias farmacológicas iniciales no han dado resultados.
- 8.
Realizar un trabajo en equipo interdisciplinario dentro de la atención del DNC, donde además se cuente con la participación del mismo paciente, sus familiares y cuidador.
- 1.
El síndrome de dolor regional complejo (SDRC) es un cuadro clínico doloroso con signos y síntomas variados, que puede resultar difícil de identificar en ocasiones. Se clasifica dentro del dolor neuropático y puede afectar a una o más extremidades59. Se caracteriza por la combinación de dolor urente, hiperestesia y/o hiperalgesia, alteraciones seudomotoras, disminución del rango de movimientos, desmineralización ósea parcheada y cambios vasomotores, que incluyen edema, alteraciones en la temperatura y en la coloración de la piel59–62. La Reflex Sympathetic Dystrophy Syndrome Association identifica tres tipos de SDRC: tipo I (o lo que algunos denominan distrofia simpático refleja), que es el cuadro de SDRC que aparece sin una lesión nerviosa significativa; el tipo II (antes conocido como causalgia), en el que encontramos evidencia clínica o electrofisiológica de lesión nerviosa; y tipo III, en el que los síntomas no satisfacen totalmente los criterios del tipo I ni del tipo II63. Tras un ictus, un cuadro doloroso que aparece con cierta frecuencia es el SDRC I en el miembro superior hemiparético, que corresponde a lo que habitualmente se denomina síndrome hombro mano (SHM)64. Suele presentarse en una sola extremidad, pero en ocasiones puede extenderse a otra60. La incidencia tras el ictus registrada en la literatura varía ampliamente y encontramos rangos entre un 1,5 a un 61%62,63; lo cual probablemente refleja la falta de uniformidad en los criterios diagnósticos y la elevada frecuencia en la que aparecen los signos considerados típicos de SDRC I en sujetos hemiparéticos no afectos de SHM. Varios autores señalan que el SDRC en hemipléjicos, o SHM, puede limitar de forma importante la rehabilitación, dificultar las ABVD, condicionar una pérdida de la funcionalidad del miembro superior afectado, provocar depresión y una peor calidad de vida19,59,65–67. Otros remarcan, no obstante, que los datos acerca del impacto del SDRC en la recuperación funcional y en la rehabilitación son todavía escasos y que faltan estudios más amplios63.
Etiología y fisiopatologíaNo se conocen con precisión la etiología ni la fisiopatología del SHM. Sí que se sabe que algunos factores implicados en la patogénesis del SDRC incluyen determinadas condiciones biomecánicas o microtraumatismos63, procesos de inflamación neurógena, sensibilización nociceptiva, alteraciones vasomotoras, factores genéticos, neuroplasticidad cerebral maladaptativa, factores psicológicos y/o hiperactividad del sistema nervioso autónomo simpático59,61,65–67. Se subraya sobre todo el papel de los mecanismos centrales que pueden ocasionar plasticidad cerebral maladaptativa en los sistemas simpáticos, sensitivos y motores59. Por otra parte, en relación con los procesos inflamatorios implicados, se ha demostrado que la inflamación neurógena en SDRC está desencadenada por neuropéptidos como la sustancia P, el neuropéptido Y, la proteína vasoactiva intestinal y bradicinina65. En el caso de SDRC I tras el ictus, un estudio apoyado en gammagrafía ósea y ecografía de hombro sugiere que unos desencadenantes claves en la aparición del SHM pueden ser el hombro congelado y la lesión de partes blandas en la muñeca, posiblemente relacionados con procesos degenerativos previos al ictus, movimientos de tracción sobre el miembro débil y movilizaciones pasivas de hombro64. Se ha detectado también una correlación positiva entre el SHM y la presencia de espasticidad, subluxación glenohumeral, el grado de paresia y la limitación de los rangos articulares66. De hecho, la debilidad, espasticidad, déficits sensitivos y coma se han propuesto como factores predictores de SDRC63. Cabe señalar que no todos los estudios están de acuerdo con algunas de estas correlaciones y consideran, por ejemplo, que la relación entre SHM y subluxación y entre SHM y espasticidad es controvertida67.
PrevenciónLa prevención de la aparición del SHM resulta difícil, ya que se trata de un fenómeno multifactorial. En general, las recomendaciones van encaminadas a evitar o minimizar el riesgo de lesiones microscópicas de partes blandas en el miembro superior; por ejemplo, limitando los rangos de movilizaciones pasivas o activas a rangos de no dolor, evitando que el propio paciente se movilice los dedos, empleando dispositivos o maniobras de recentraje glenohumeral. Un protocolo estricto de prevención de la subluxación del hombro, de evitación de posturas y posicionamientos dolorosos del hombro y de los traumatismos, redujo la incidencia de SDRC61. A nivel farmacológico, la administración de calcitonina profiláctica también mostró ser útil en un grupo de pacientes posictus61. La tabla 6 recoge el único aspecto relacionado a la prevención del SDRC en el DCS y su correspondiente grado de evidencia en las principales guías revisadas para la elaboración del presente documento.
- -
Recomendaciones SENR
- 1.
Establecer pautas para minimizar el riesgo de provocar microlesiones alrededor de la articulación glenohumeral durante las movilizaciones pasivas o activas.
- 2.
Ejercicios específicos de movilización llevados a cabo por un profesional.
- 3.
Se recomienda mantener las maniobras en rangos de movimientos de no dolor, siempre y cuando el paciente nos pueda comunicar dicha sensación.
- 1.
Recomendaciones en el síndrome de dolor regional complejo secundario al daño cerebral sobrevenido
| Recomendación | Grado de evidencia |
|---|---|
| Prevención | |
| Los ejercicios de movilización activa, activo-asistida, o pasiva, se pueden usar para prevenir el SDRC. | NIVEL BAJO C (CSBPR) |
| Evaluación y diagnóstico | |
| En pacientes con ictus, se debe emplear el NGS, y las indicaciones de la «Reflex Sympathetic Dystrophy Syndrome Association», para el diagnóstico de DCPI y SDRC, respectivamente. | NIVEL MEDIOB (ICCPN) |
| El diagnóstico del SDRC debe basarse en hallazgos clínicos, incluyendo dolor e hipersensibilidad/hiperalgesia en articulaciones metacarpofalángicas e interfalángicas, y puede asociar edema en el dorso de los dedos, cambios tróficos de la piel, hiperestesia y rango articular limitado. | NIVEL BAJO C (CSBPR) |
| Tratamiento | |
| Una pauta inicial de corticoesteroides orales, empezando con 30-50 mg/día durante 3-5 días y descenso progresivo de dosis durante 1-2 semanas, puede usarse para reducir hinchazón y dolor. | NIVEL MEDIOB (CSBPR) |
| Respecto a la terapia con espejo: dos estudios incluyen sujetos con dolor regional complejo y encuentran resultados positivos en cuanto a la disminución del dolor. | NIVEL BAJO C (SF-CGSM) |
CSBPR: Canadian Stroke Best Practice Recommendations: Stroke Rehabilitation Practice Guidelines; ICCPN: The Italian Consensus Conference on Pain in Neurorehabilitation; SF-CGSM: Stroke Foundation - Clinical Guidelines for Stroke Management; DCPI: incidencia del dolor central posictus; SDRC: síndrome del dolor regional complejo
El diagnóstico precoz y un abordaje multidisciplinar y temprano son esenciales para el manejo adecuado del SDRC65,67.
Diagnóstico clínicoEl diagnóstico del SDRC es fundamentalmente clínico, basado en signos y síntomas. Sabemos que se trata de un cuadro de dolor neuropático con manifestaciones autonómicas; pudiendo el dolor asociar alodinia, hiperalgesia, edema, alteraciones térmicas y de coloración en la piel, disfunción motora o disminución del rango de movimiento59,63,67. Cuando específicamente nos referimos al SDRC tipo I tras el ictus, es característico que el dolor se manifieste simultáneamente en la mano y en el hombro del brazo afecto, con el codo relativamente libre de dolor (SHM)64. Existen varias clasificaciones y tablas de criterios para intentar filiar el SDRC. Los criterios de la IASP se propusieron en 1994 para el diagnóstico del SDRC. Se utilizan como referente con frecuencia, aunque han sido criticados por algunos por falta de especificidad y de validez interna67. Para identificar con más precisión a los pacientes hemiparéticos afectos de SHM, han aparecido distintos criterios, como los de Budapest, desarrollados al incorporar supuestos más rigurosos para aumentar la especificidad en el diagnóstico del SDRC tipo I. No obstante, existe controversia también en cuanto a su sensibilidad e indicación en SHM67. En pacientes con ictus, el diagnóstico clínico de SDRC tipo I puede resultar complicado porque muchos de los signos propios del SHM coinciden con los de la hemiparesia. Por ejemplo, el dolor del HDH es muy frecuente tras el ictus, y puede deberse a distintas causas, no únicamente a SHM. A grandes rasgos, podemos señalar que el SHM suele aparecer entre dos y tres meses tras la lesión, muy raramente a partir del año62, mientras que el hombro doloroso relacionado con la debilidad y las alteraciones del tono en la hemiparesia suele ser más precoz y aparecer a lo largo de las primeras ocho semanas. Por otra parte, hay que señalar que el edema aislado distal en la mano es mucho más frecuente que el SHM y se relaciona principalmente con la inmovilidad y con la posición en declive. El edema que puede aparecer en las fases iniciales de SHM, que no es una linfedema, responde peor a la elevación del miembro y al drenaje. Al igual que en el SDRC, en general, tras un ictus también se habla de tres estadios evolutivos del SHM: fase 1 (aguda-hiperémica), fase 2 (distrófica-isquémica) y fase 3 (atrófica). La respuesta inflamatoria parece desempeñar un papel relevante en las primeras fases, con signos clínicos que incluyen edema/hinchazón, dolor y calor65.
Exploraciones complementariasAunque el diagnóstico es eminentemente clínico, en ocasiones se emplean distintas técnicas de exploración complementaria de forma adicional, bien sea con el objetivo de aumentar la sensibilidad o la especificidad en las sospechas clínicas, descartar procesos similares, etc. Mediante una analítica sanguínea, por ejemplo, podemos descartar procesos reumáticos que tengan marcadores específicos; y, por otra parte, en pacientes con SDRC se han detectado elevación de citocinas consideradas como marcadores de inflamación (factor de necrosis tumoral [TNF] alfa, interleucina [IL]-6, triptasa)65,66. Se emplea con cierta frecuencia la gammagrafía ósea de tres fases. Una radiografía simple puede revelar el clásico patrón de osteoporosis moteada; la densitometría ósea puede evidenciar disminución de la densidad mineral ósea en sujetos con SHM. También se ha empleado la termografía digital por infrarrojos67, entre otros. La tabla 6 recoge los aspectos relacionados a la evaluación y diagnóstico del SDRC en el DCS y su correspondiente grado de evidencia en las principales guías revisadas para la elaboración del presente documento.
- -
Recomendaciones SENR
- 1.
Hay que considerar que el diagnóstico del SDRC es fundamentalmente clínico, basado en los signos y síntomas reconocibles.
- 2.
Sospechar ante un cuadro de dolor neuropático con manifestaciones autonómicas, con síntomas como alodinia, hiperalgesia, disfunción motora, edema y/o cambios en la temperatura y coloración de la piel.
- 3.
Sospechar ante un paciente hemipléjico en el que los síntomas se localizan en el hombro y mano del hemicuerpo afecto (SHM); aparecen a partir de los dos a tres meses tras el daño; y no responden adecuadamente al drenaje y manejo postural.
- 1.
Existe un amplio abanico de opciones terapéuticas encaminadas a abordar el SDRC posictus, aunque no existe evidencia suficiente para apoyar una técnica, protocolo terapéutico o grupo de técnicas, como el más indicado en todas las fases y en todos los pacientes con este. De hecho, ni siquiera encontramos protocolos consensuados por la mayor parte de la comunidad científica para el SDRC en general59,65. Los abordajes que se han ensayado y se emplean habitualmente en SDRC I (incluyendo SDRC posictus) son:
- -
Corticoesteroides orales. Se ha demostrado que reducen el dolor, edema y otros aspectos en SDRC en general, probablemente en relación con sus efectos antiinflamatorios y/o inmunomoduladores. En SHM se ha descrito su eficacia en pautas cortas, de dos semanas; y en pautas más largas, de dos meses, con dosis decrecientes66.
- -
Analgésicos o antiinflamatorios tópicos.
- -
FAE. Gabapentina o carbamazepina, estudiados en SDRC no tras ictus61.
- -
Antagonistas del receptor NMDA, memantina o ketamina. Estudiados en SDRC en general, no tras ictus61.
- -
Vitamina C. Hay estudios que proponen que la vitamina C se debe incluir como parte del tratamiento del SDRC, ya que parece ser que los antioxidantes aumentan los efectos beneficiosos del ejercicio aeróbico65.
- -
Bifosfonatos (orales e intravenosos). Tienen una función analgésica en enfermedades relacionadas con el hueso, así como en aquellas que no afectan al sistema osteoarticular, posiblemente a través de la inhibición de producción de citocinas, de neuropéptidos, del transporte de iones de calcio y otros63. También tienen una función antiresortiva ósea, que puede prevenir la osteoporosis inducida por la hiperactividad osteoclástica y la inmovilidad en SDRC63. El pamidronato intravenoso ha demostrado una eficacia igual a la corticoterapia oral en SDRC en cuanto al control del dolor, pero no en la reducción del edema63.
- -
Ejercicio aeróbico (centrado en el miembro superior). Probablemente beneficioso en relación con los beneficios del ejercicio aeróbico en general, como son los efectos antiinflamatorios, hormonales y antioxidantes, sobre el sistema nervioso autónomo y sobre el sistema inmune, asociados al ejercicio65. En SDRC I, el ejercicio aeróbico puede contribuir a mejorar la recuperación sensoriomotora, favorecer la neuroplasticidad y el aprendizaje motor65.
- -
Técnicas de fisioterapia y terapia ocupacional. Movilizaciones, terapias de compresión, ferulización/ortesis, masoterapia, baños de contraste, electroterapia, termoterapia, entre otros.
- -
Terapia con espejo59,61. La terapia con espejo puede tener resultados positivos en negligencia y dolor al aplicar en sujetos con síndrome de heminegligencia y SDRC, respectivamente10.
- -
Acupuntura. La electroacupuntura y acupuntura manual tradicional china asociada a la rehabilitación puede mejorar los resultados clínicos (dolor y función motora) en pacientes con SDRC leve. Esta evidencia se clasificó como «baja» por la clasificación GRADE60.
- -
Bloqueos simpáticos. Habitualmente mediante infiltración con anestésico local. Se han utilizado bastante para el SDRC en general en el pasado, actualmente existe cierta controversia en cuanto a su eficacia61–63.
- -
Radiofrecuencia de las raíces posteriores, con pulsos cortos aplicados a los nervios. Probablemente es una alternativa terapéutica más segura que la neurolisis por radiofracuencia62.
- -
Neuroestimulación invasiva. En el dolor crónico por SDRC, refractario a otros tratamientos, se ha empleado también la estimulación medular a nivel de cordones posteriores, así como más recientemente, a nivel de raíces dorsales con resultados beneficiosos y prometedores a fecha de hoy62,68.
La tabla 6 recoge los aspectos relacionados al tratamiento del SDRC en el DCS y su correspondiente grado de evidencia en las principales guías revisadas para la elaboración del presente documento.
- -
Recomendaciones SENR
- 1.
A nivel farmacológico: los corticoides y bajo criterios individuales para cada paciente, los bifosfonatos y FAE.
- 2.
A nivel no farmacológico: la terapia con espejo, la terapia ocupacional y técnicas de fisioterapia específicas. Así como, valorar en casos individualizados, técnicas invasivas con equipos especializados.
- 1.
Este trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.