El objetivo del estudio fue estimar el impacto presupuestario asociado a la incorporación de alemtuzumab para pacientes adultos con esclerosis múltiple recaída remisión (EMRR) en Argentina, desde la perspectiva de la seguridad social.
MétodosSe utilizó un modelo del impacto presupuestario. Se consideró un horizonte temporal de 3años. La población objetivo se determinó en base a datos de prevalencia e incidencia de EMRR publicados en Argentina. Como comparadores se tuvieron en cuenta todas las opciones de tratamiento para EMRR utilizadas en Argentina. Se consideraron los costos de los tratamientos farmacológicos, de administración y de monitoreo. Para los medicamentos se consideró el precio de salida de laboratorio (PSL), que se estimó en base a información del Manual Farmacéutico (AlfaBeta). Los costos de administración y monitoreo se obtuvieron de nomencladores nacionales de la seguridad social. Las participaciones del mercado y su evolución se elaboraron en base a opinión de expertos locales e investigaciones de mercado. Los resultados se reportan en términos de impacto presupuestario anual, porcentual y acumulado total.
ResultadosIncorporar alemtuzumab como opción terapéutica mostró un impacto presupuestario de $1.393 millones (2,98%), $92 millones (0,19%) y −$1.858 millones (−3,9%) en los años 1 a 3, respectivamente. El resultado considera una tasa de retratamiento con alemtuzumab del 98% para el segundo año y del 26% para el tercer año. El impacto presupuestario acumulado en 3años es de un ahorro de $373 millones (−0,73% respecto del escenario sin alemtuzumab).
ConclusiónEl estudio demuestra que, de acuerdo con los supuestos considerados, el impacto presupuestario acumulado en 3años de incorporar alemtuzumab como opción terapéutica para pacientes adultos con EMRR en Argentina sería costo ahorrador.
The objective of the study was to estimate the budget impact of incorporating alemtuzumab to treat adult patients with relapsing-remitting multiple sclerosis (RRMS) in Argentina, from the perspective of social security.
MethodsA budget impact model was used. A time horizon of 3years was considered. The target population was determined based on RRMS prevalence and incidence data published in Argentina. All treatment options for RRMS used in Argentina were considered as comparators. The costs of pharmacological treatments, administration and monitoring were used. For medicines, the laboratory starting price (PSL) was estimated based on information from the Pharmaceutical Manual (AlfaBeta). Administration and monitoring costs were obtained from national Social Security. Market shares and their evolution were prepared based on the opinion of local experts and market research. The results are reported in terms of annual, percentage and total cumulative budget impact.
ResultsIncorporating alemtuzumab as a therapeutic option showed a budget impact of $1,393 million (2.98%), $92 million (0.19%) and −$1,858 million (−3.9%), in years 1 to 3, respectively. The result considers a retreatment rate with alemtuzumab of 98% for the second year and 26% for the third year. The cumulative budget impact over 3years showed a savings of $373 million (−0.73% compared to the scenario without alemtuzumab).
ConclusionThe study shows that, according to the assumptions considered, the cumulative budget impact in 3years of incorporating alemtuzumab as a therapeutic option for adult patients with RRMS in Argentina would be cost-saving.
La esclerosis múltiple (EM) es una enfermedad inflamatoria inmunomediada, desmielinizante y neurodegenerativa del sistema nervioso central1,2. A nivel mundial, es uno de los trastornos neurológicos más comunes y una de las principales causas de discapacidad en los adultos jóvenes1,2.
Alemtuzumab es un anticuerpo monoclonal humanizado derivado de ADN recombinante dirigido contra la glucoproteína de superficie celular CD 52 de 21-28kD, que ha demostrado una alta eficacia y efectividad para el tratamiento de la EM a recaída remisión (EMRR)3-6.
Aunque la EM muestre una baja prevalencia en Argentina, el gasto monetario que representa para el sistema de salud es significativo7-12. Así mismo, la decisión de incluir un tratamiento en un plan de atención médica requiere, además de efectividad y seguridad, una evaluación del impacto de tal inclusión en el presupuesto, en este caso, para tratar a las personas con EMRR12-14.
En un medio como el argentino, donde el sistema de salud enfrenta graves restricciones financieras, la decisión de introducir medicamentos como alemtuzumab, y otros, debe considerar estudios de evaluación económica15,16. Por esta razón, a los efectos de generar información que apoye el proceso de toma de decisiones, hemos realizado un análisis del impacto presupuestario asociado a la incorporación de alemtuzumab para pacientes adultos con EMRR en Argentina, en un horizonte temporal de tres años desde la perspectiva de la seguridad social.
Materiales y métodosSe utilizó un modelo del impacto presupuestario desarrollado en MS Excel de acuerdo con las recomendaciones internacionales15,16, el cual se adaptó al contexto de Argentina. El modelo emplea una cadena de Markov de tiempo discreto para simular la progresión de la EMRR utilizando la Escala de Estado de Discapacidad Expandida (Expanded Disability Status Scale [EDSS]) de Kurtzke.
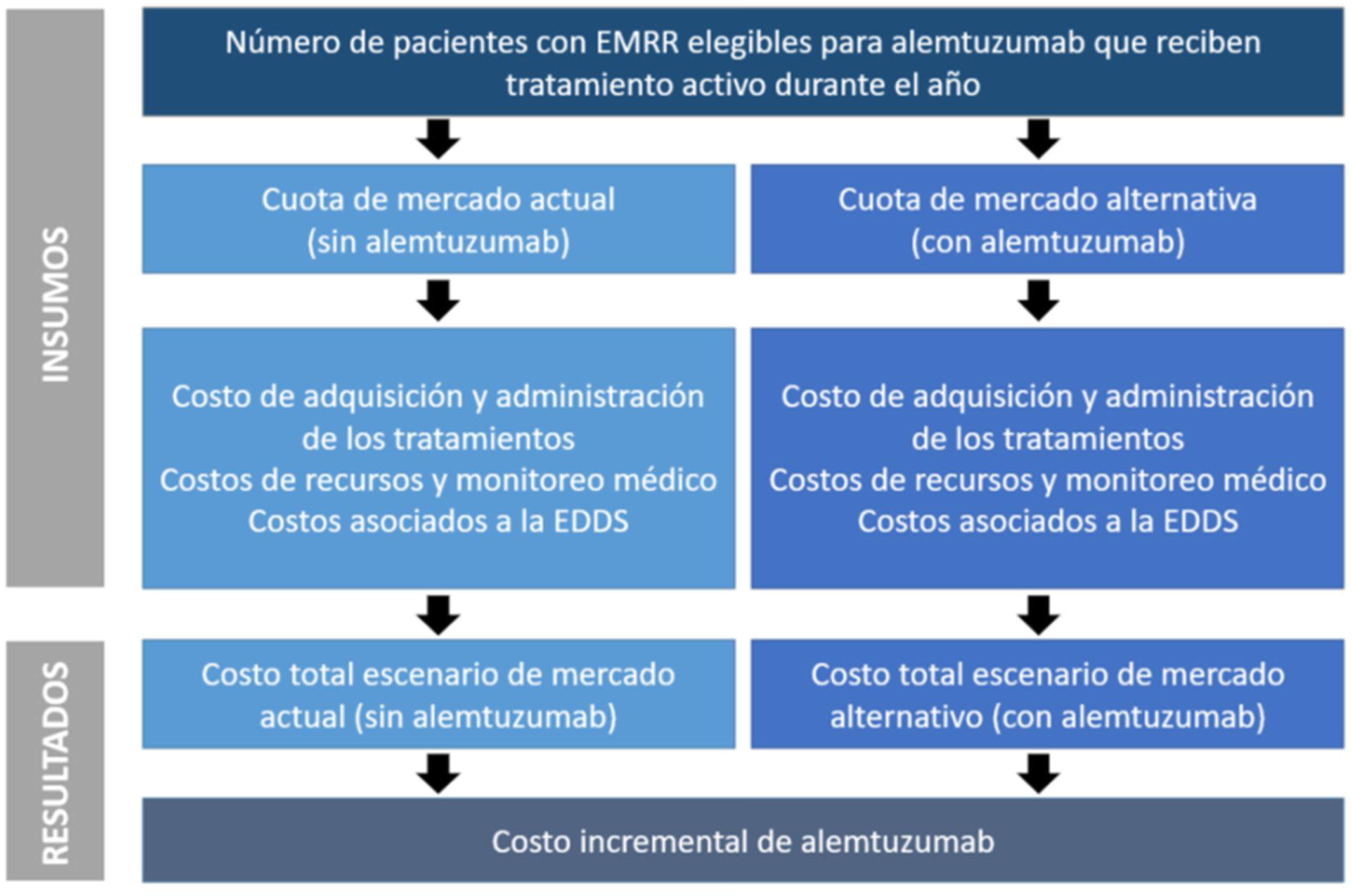
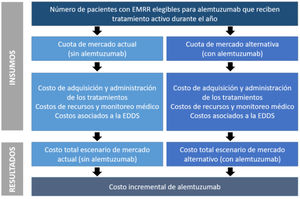
El funcionamiento del modelo se puede resumir en los siguientes pasos clave (fig. 1): a)estimación del total de pacientes con EMRR que son elegibles para alemtuzumab; b)determinación de la cuota de mercado de los tratamientos considerados, para cada año del horizonte temporal, contemplando un escenario sin y otro escenario con alemtuzumab como opción terapéutica; c)determinación de los costos anuales incurridos en cada escenario, los cuales se estiman considerando el costo de adquisición asociado a cada comparador por el número total de pacientes que se asume que reciben cada tratamiento en cada uno de los escenarios descriptos, basado en supuestos de participación de mercado, y d)el impacto presupuestario de la incorporación de alemtuzumab se determina comparando, en los escenarios con y sin alemtuzumab, los costos anuales totales proyectados.
El modelo captura la progresión natural de la enfermedad en términos de la progresión del paciente a través de los estados EDSS dentro de la fase EMRR, y la probabilidad de que los pacientes pasen de la fase EMRR a la EM secundaria-progresiva (EMSP). Los datos de la historia natural de la progresión de la EMRR se derivaron de la Base de Datos de Esclerosis Múltiple de la cohorte de British Columbia17, que se basa en pacientes no tratados con EM antes de la disponibilidad de las terapias modificadoras de la enfermedad. Esta única matriz de probabilidades de transición se aplica entonces para simular la progresión de la EMRR. La probabilidad de conversión de EMRR a EMSP se derivó de datos observacionales longitudinales del mundo real publicados sobre la progresión de la discapacidad18. Las probabilidades para cada estado de la EDSS se calcularon a partir de las tasas de riesgo.
Las probabilidades anuales asociadas a los eventos adversos (EA) de alemtuzumab y sus comparadores se obtuvieron de la literatura, considerando aquellos EA con una incidencia ≥5%. A efectos de modelización, las probabilidades de los EA del primer año se asumen para todos los años del horizonte temporal. La mortalidad asociada a la EMRR se obtiene aplicando los aumentos relativos de las tasas de mortalidad de los pacientes en diferentes estados de la EDSS a las tasas de mortalidad por todas las causas de la población general de Argentina. Para reflejar la mortalidad de la República Argentina se utilizó la tabla de mortalidad por sexo y edad, proyectada para el período 2020-2025, confeccionada por la ONU a partir de las estadísticas nacionales oficiales disponibles (censo 2010 y estadísticas vitales hasta 2015), y los multiplicadores de mortalidad por la gravedad de la enfermedad de la EM se basaron en la literatura publicada19.
En este análisis del impacto presupuestario se adoptó la perspectiva de la seguridad social (pagador) de Argentina y se consideró un horizonte temporal de tres años. La población objetivo consiste en pacientes adultos con diagnóstico de EMRR que son beneficiarios del sector de seguridad social del sistema de salud de Argentina. El número de pacientes con EMRR para cada año del modelo se estima utilizando datos de prevalencia e incidencia publicados9,20,21, asumiendo que el 100% de los casos diagnosticados reciben tratamiento, a partir del total de beneficiarios del sector de seguridad social del sistema de salud de Argentina, específicamente obras sociales nacionales y provinciales, sin considerar la Obra Social Nacional PAMI22-24.
Además del tratamiento con alemtuzumab se consideraron las siguientes opciones de tratamiento para los pacientes adultos con EMRR utilizados en el contexto de nuestro país: interferón-β-1a 30μg, interferón-β-1a 44μg, natalizumab, acetato de glatiramer, fingolimod, interferón-β-1b, dimetilfumarato, teriflunomida, peginterferón, ocrelizumab y cladribina.
Las participaciones del mercado y su evolución se elaboraron en base a la opinión de expertos locales e investigaciones de mercado (tabla 1). Para este punto se llevó adelante la encuesta sobre 30 expertos en el manejo de la enfermedad en Argentina que atienden tanto en el sector público como en el privado respecto a la utilización y la distribución de los tratamientos y su evolución en base a la progresión. Esos expertos fueron consultados respecto a la utilización de los tratamientos al inicio en pacientes naïve de tratamiento, en pacientes con falla a un tratamiento, en pacientes con falla a dos y en pacientes con falla a tres o más tratamientos para entender también la evolución de la utilización de los tratamientos. El número final porcentual de distribución de uso es un promedio ponderado entre las respuestas dadas por los profesionales de la utilización de los tratamientos a nivel país, independientemente del ámbito público o privado de desempeño, e involucra a la totalidad de los pacientes atendidos por cada profesional encuestado. Para el tratamiento con alemtuzumab se asumió, con un criterio conservador, que la tasa de retratamiento es del 98%, y del 26% para el segundo y tercer años, respectivamente5,25,26.
Distribución del mercado en pacientes con EMRR proyectado en los escenarios sin y con alemtuzumab
| Producto | Escenario | |||||
|---|---|---|---|---|---|---|
| Sin alemtuzumab | Con alemtuzumab | |||||
| 2022 | 2023 | 2024 | 2022 | 2023 | 2024 | |
| Interferón-β-1a 30 μg | 1,8% | 1,7% | 1,6% | 1,6% | 1,6% | 1,5% |
| Interferón-β-1a 44μg | 5,3% | 5,1% | 5,1% | 4,9% | 4,8% | 4,6% |
| Natalizumab | 10,6% | 10,3% | 11,1% | 9,9% | 9,5% | 10,2% |
| Glatiramer acetato | 14,7% | 14,3% | 13,4% | 13,7% | 13,3% | 12,3% |
| Fingolimod | 25,2% | 24,5% | 22,9% | 23,5% | 22,7% | 21,0% |
| Interferón-β-1b | 2,4% | 2,2% | 2,2% | 2,2% | 2,0% | 2,0% |
| Dimetilfumarato | 3,1% | 3,0% | 2,8% | 2,9% | 2,8% | 2,6% |
| Teriflunomida | 4,6% | 4,4% | 4,2% | 4,3% | 4,1% | 3,8% |
| Peginterferón | 2,8% | 2,7% | 2,7% | 2,6% | 2,5% | 2,4% |
| Ocrelizumab | 14,4% | 14,0% | 16,5% | 13,4% | 12,9% | 15,1% |
| Cladribina | 15,3% | 17,8% | 17,6% | 14,2% | 16,5% | 16,1% |
| Alemtuzumab (total) | − | − | − | 6,8% | 7,2% | 8,5% |
| AL (primer curso) | − | − | − | 6,8% | 0,6% | 1,4% |
| AL (segundo curso) | − | − | − | 0,0% | 6,6% | 0,6% |
| AL (tercer curso) | − | − | − | 0,0% | 0,0% | 1,7% |
| Libre Tx AL | − | − | − | 0,0% | 0,1% | 3,8% |
| Total | 100% | 100% | 100% | 100% | 100% | 100% |
AL: alemtuzumab; Tx: tratamiento.
Se incluyeron los costos de los tratamientos farmacológicos, el costo de administración de alemtuzumab y sus comparadores y los costos de monitoreo asociados a la EMRR. Para el costo de los medicamentos se consideró el precio de salida del laboratorio (PSL), el cual se estimó a partir del precio de venta al público (PVP) obtenido del vademécum del Grupo Alfa Beta (GAB) y del vademécum nacional de medicamentos de ANMAT27-29. Se consideró un escenario únicamente con medicamentos originales (caso base) y otro con todos los medicamentos disponibles, originales y copias (caso alternativo). El costo anual de los tratamientos se estimó en base a la dosis y el régimen de administración obtenidos de las indicaciones publicadas por ANMAT29 y validadas con médicos especialistas (tabla 2). El costo de los recursos utilizados en la administración de medicamentos intravenosos y en el monitoreo de la EMRR se obtuvo de nomencladores de instituciones de la seguridad social. Todos los costos fueron actualizados a febrero de 2022 y expresados en pesos argentinos.
Costo de los tratamientos considerados
| Producto | Dosis y régimen de administracióna | Costo promedio diario (PSL)aCaso base | Costo promedio diario (PSL)aCaso alternativo |
|---|---|---|---|
| Interferón-β-1a 30μg | 30μg 1 vez a la semana | $13.801,52 | $13.074,76 |
| Interferón-β-1a 44μg | Primeras dos semanas: 8,8μg 3 veces por semana. Segundas dos semanas: 22μg 3 veces por semana. De la quinta semana en adelante 44μg 3 veces por semana | $13.231,46 | $16.950,48 |
| Natalizumab | Una dosis de 300mg cada 4 semanas | $15.233,30 | $15.233,30 |
| Glatiramer acetato | Una jeringa precargada de 20mg al día | $11.904,32 | $9.975,87 |
| Fingolimod | Una cápsula de 0,5mg al día | $13.784,07 | $11.581,58 |
| Interferón-β-1b | Días: 1, 3 o 5, dosis de 62,5μg. Días: 7, 9 u 11, dosis de 125μg. Días: 13, 15 o 17, dosis: 187,5μg. Día ≥ 19, dosis: 250μg | $10.714,03 | $10.714,03 |
| Dimetilfumarato | Dosis de inicio: 120μg dos veces al día, durante los primeros 7 días. Dosis habitual: 240μg dos veces al día | $12.436,71 | $12.301,46 |
| Teriflunomida | Una dosis de 14mg una vez al día | $13.591,36 | $12.642,58 |
| Peginterferón | Administración inicial: una jeringa con 63μg (para el día 0) y una jeringa con 94μg (para el día 14)Dosis habitual: una inyección de 125μg cada 14 días | $13.777,50 | $13.777,50 |
| Ocrelizumab | Dosis inicial: una primera perfusión de 300μg, seguida de una segunda perfusión de 300μg dos semanas más tarde. Luego dosis únicas de 600mg en perfusión intravenosa, cada 6meses | $12.197,81 | $12.197,81 |
| Cladribina | Se administra por vía oral una dosis acumulada de 3,5mg/kg a lo largo de dos años, administrada en dos ciclos de 1,75mg/kg por año. Se asume una dosis de 10mg por día por 2semanas al año (14 comprimidos/año) | $13.057,69 | $13.057,69 |
| Alemtuzumab (primer año) | Dosis diaria de 12mg durante 5 días | $21.554,09 | $21.554,09 |
| Alemtuzumab (a partir del 2.o año) | Dosis diaria de 12mg durante tres días | $12.932,45 | $12.932,45 |
PSL: precio salida de laboratorio.
En base a lo descripto previamente, considerando una población de beneficiarios de obras sociales nacionales y provinciales (sin considerar PAMI) de 17.074.416, una prevalencia de 38,2 casos por 100.000 habitantes y una incidencia de 3casos por cada 100.000 personas/año, la población estimada de pacientes elegible para el análisis es de 7.035 para el primer año (año 2022), 7.175 para el año 2023 y 7.319 para el año 2024.
Resultados escenario baseEn la tabla 3 se presentan los resultados del caso base, los cuales se basan en los inputs del modelo y los supuestos de análisis descriptos previamente, considerando únicamente el costo de las drogas originales. El escenario sin alemtuzumab presenta resultados para el tratamiento de la EMRR de acuerdo con las opciones terapéuticas de drogas originales disponibles en el mercado, mientras que el escenario con alemtuzumab presenta resultados cuando se incluye una nueva opción de tratamiento (alemtuzumab). Por lo tanto, el nuevo escenario explora el impacto de agregar alemtuzumab para pacientes con EMRR.
Impacto presupuestario anual y acumulado (expresado en millones)
| Parámetros | 2022 | 2023 | 2024 | Acumulado total |
|---|---|---|---|---|
| Escenario sin alemtuzumab | ||||
| Costo de tratamiento | $33.400 | $33.679 | $33.878 | $100.958 |
| Costo de administración | $98 | $97 | $109 | $304 |
| Costo de monitoreo | $106 | $107 | $107 | $319 |
| Costo de la EDSS | $13.193 | $13.388 | $13.547 | $40.128 |
| Costo total | $46.798 | $47.270 | $47.642 | $141.709 |
| Escenario con alemtuzumab | ||||
| Costo de tratamiento | $34.773 | $33.755 | $32.010 | $100.538 |
| Costo de administración | $107 | $100 | $104 | $312 |
| Costo de monitoreo | $115 | $110 | $104 | $329 |
| Costo de la EDSS | $13.195 | $13.396 | $13.565 | $40.157 |
| Costo total | $48.190 | $47.362 | $45.784 | $141.336 |
| Impacto presupuestario (IP) | ||||
| Tratamiento | $1.373 | $76 | −$1.869 | −$420 |
| Administración | $9 | $4 | −$5 | $8 |
| Monitoreo | $9 | $3 | −$2 | $10 |
| EDSS | $2 | $9 | $18 | $29 |
| IP total | $1.393 | $92 | −$1.858 | −$373 |
| IP total (%) | 2,98% | 0,19% | −3,90% | −0,73% |
EDSS: Expanded Disability Status Scale.
En la tabla 3 se puede observar que en el primer año el impacto presupuestario es positivo respecto del escenario de referencia (sin alemtuzumab), con un incremento estimado del gasto del 2,98%. En el segundo año esa situación se empieza a revertir, alcanzando en el tercer año un impacto presupuestario negativo, es decir, costo ahorrador. En todos los años del horizonte temporal considerado el costo del tratamiento es el componente principal del costo total del tratamiento. El impacto presupuestario acumulado (considerando los tres años) es costo ahorrador en 373 millones de pesos, lo que representa un ahorro acumulado del 0,73% de gasto respecto del escenario actual. Este comportamiento se explica principalmente por la característica de la administración de alemtuzumab y su mecanismo de acción, reconstituyendo al sistema inmune sin necesitar ser mantenido de forma crónica mes a mes de forma indefinida, a diferencia del resto de los comparadores, excepto para cladribina, pero con una eficacia significativamente menor en este último caso y una expectativa de respuesta más allá de los cuatro años incierta.
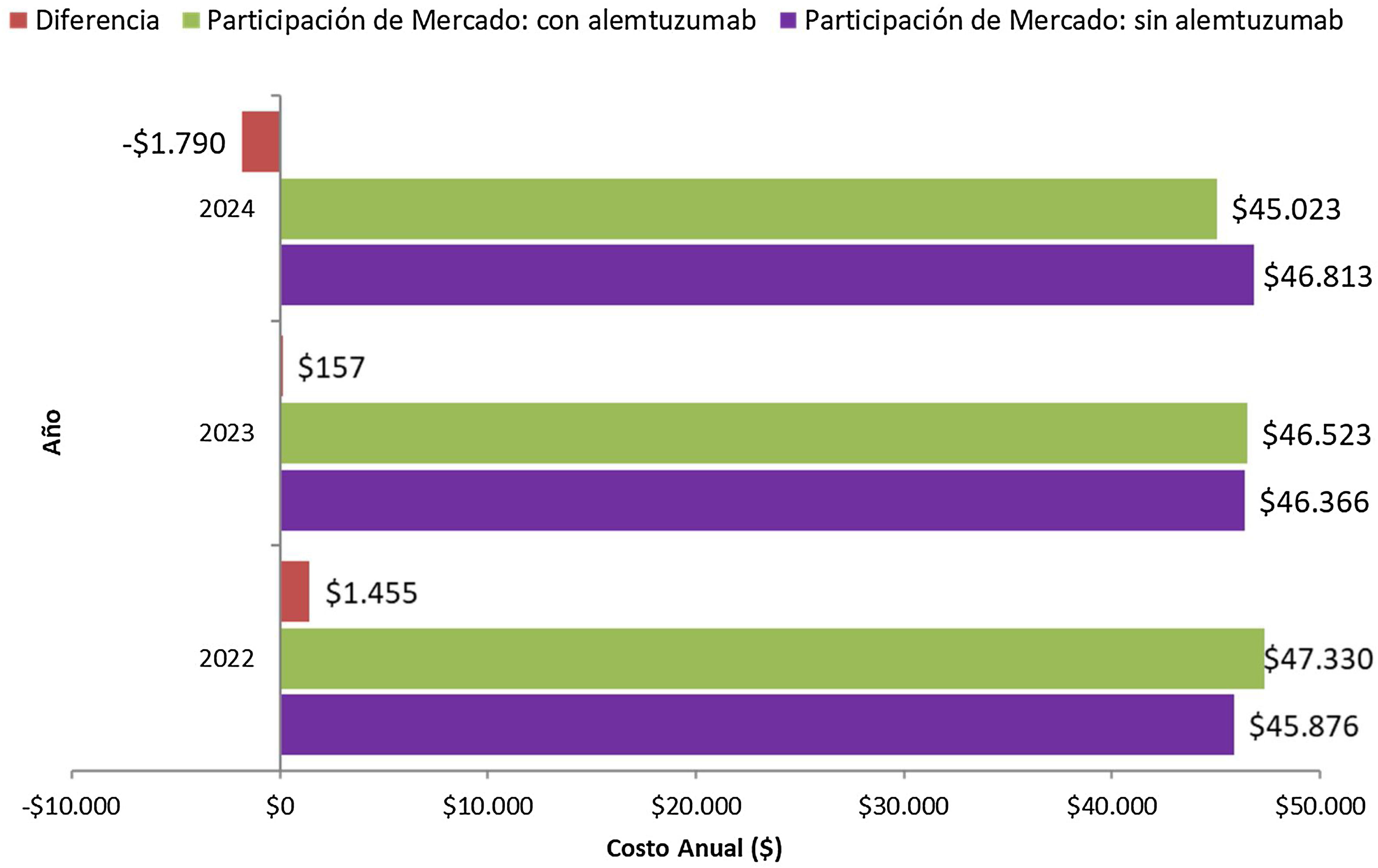
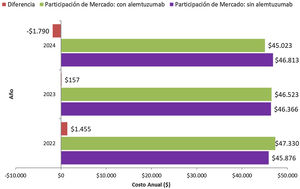
Resultados escenario alternativoLos resultados del escenario alternativo, los cuales se basan en los inputs del modelo y los supuestos de análisis descriptos previamente, considerando un promedio del costo de las todas las alternativas disponibles (originales y sus genéricos en los casos que corresponda), se presentan en la figura 2. En esta alternativa se puede observar que, al igual que en el caso base, en el primer año el impacto presupuestario es positivo respecto del escenario sin alemtuzumab, con un incremento estimado del gasto del 3,17%. En el segundo año esa situación se empieza a revertir, alcanzando en el tercer año un impacto presupuestario negativo, es decir, costo ahorrador. El impacto presupuestario acumulado (considerando los tres años) es costo ahorrador en 178 millones de pesos, lo que representa un ahorro del 0,31% de gasto respecto del escenario actual. Estos valores muestran la misma tendencia que en el caso base. Sin embargo, en esta situación el impacto presupuestario acumulado es menor porque en promedio los costos de los medicamentos comparadores son menores.
DiscusiónEl presente trabajo tuvo por objetivo estimar y describir el impacto presupuestario asociado a la incorporación de alemtuzumab para el tratamiento de EMRR en un horizonte temporal de tres años desde la perspectiva del subsector de la seguridad social en Argentina.
Al respecto, dados los supuestos sobre las cuotas de mercado consideradas en el modelo, la introducción de alemtuzumab en el caso base —considerando únicamente el costo de las drogas originales— generaría un impacto presupuestario total acumulado de −$373 millones durante el período de tres años, lo cual significa una disminución proyectada del gasto de −0,73% respecto del escenario sin alemtuzumab. De igual manera, en el caso alternativo —considerando el costo de las todas las alternativas disponibles (originales y sus genéricos en los casos que corresponda)— se obtienen resultados similares, con un impacto presupuestario total acumulado de −$178 millones durante el período de tres años (−0,31% del gasto respecto del escenario base).
El resultado observado en ambos casos se explica fundamentalmente por la variación en los gastos de adquisición de medicamentos, siendo muy pequeña la incidencia de otros conceptos. En este sentido, es relevante mencionar la dinámica del impacto presupuestario en cada uno de los años del horizonte temporal. Mientras que en el primer año el impacto presupuestario de incorporar alemtuzumab es positivo, en el segundo año el impacto presupuestario desciende significativamente y en el tercer año el resultado se revierte, mostrando un resultado costo ahorrador que termina por sobrecompensar el mayor gasto de los primeros años.
Este comportamiento en el tiempo se explica por las características de la administración de alemtuzumab respecto de sus comparadores. Las opciones terapéuticas consideradas como comparadores se administran de forma crónica, mientras que alemtuzumab se administra en el primer año y solo una proporción de pacientes requieren retratamiento en los años subsiguientes. Por lo tanto, si bien alemtuzumab implica un incremento significativo en el gasto del primer año de tratamiento, este es sobrecompensado con los ahorros futuros por el reemplazo del tratamiento. De esto deducimos que la tasa de retratamiento en los años subsiguientes es un elemento importante para justificar el resultado final presentado. Cabe mencionar que las tasas de retratamiento consideradas fueron del 98% para el segundo año y del 26% para el tercer año. Estas tasas son significativamente superiores a lo reportado en la literatura, lo cual justifica que nuestros resultados son conservadores y que tasas de retratamiento menores implicarán ahorros de costo mayores. Aunque no hay en Argentina estudios similares a lo abordado en este trabajo, nuestros resultados están en línea con los obtenidos por Pastor Quirós y Ugalde30 en Costa Rica. Dichos autores demuestran que la incorporación de alemtuzumab representa un ahorro presupuestario significativo a lo largo de un horizonte temporal de cinco años, y que los beneficios adicionales en la reducción de recaídas y un régimen de dosificación de corto plazo en la mayoría de los pacientes permite recomendar el uso racional y progresivo del producto en el contexto de Costa Rica, tanto clínica como económicamente.
Por otro lado, cabe mencionar que este estudio es el primero que utiliza un modelo económico parcial para aportar datos sobre el impacto presupuestario en Argentina del tratamiento de la EMRR, lo que debe animar a discusiones adicionales sobre este tema concreto.
Aunque nuestros resultados son claros y están en línea con la evidencia actual, deben considerarse con cautela, debido a que este estudio tiene algunas limitaciones. La primera es que, como todos los modelos de impacto presupuestario, este no deja de ser un modelo de proyección futura de uso de un medicamento, basado en asunciones múltiples y en la actitud esperada de los clínicos ante la introducción de alemtuzumab. Si dicha actitud difiere de la esperada, esto podría afectar la magnitud de los resultados (disminuyendo o aumentando el ahorro acumulado), pero no así la conclusión, ya que la misma se explica por las características de administración de las opciones terapéuticas. Otra limitación es que no se ha considerado el costo de los EA. No obstante, la incidencia de este concepto en el costo total es muy pequeña, y si bien el ahorro acumulado podría ser menor ante la introducción de alemtuzumab, no se revierten las conclusiones. Por otro lado, debido a la falta de valores reales de negociación de los financiadores, se ha utilizado como valor aproximado el precio de salida de laboratorio para determinar el costo de los distintos tratamientos. Dado que esto afecta por igual a todos los comparadores, consideramos que no modificaría de forma sustantiva los resultados del análisis.
En conclusión, bajo los supuestos presentados en este trabajo se puede afirmar que, desde la perspectiva de la seguridad social de Argentina, la incorporación de alemtuzumab representaría un ahorro presupuestario significativo a lo largo de los próximos tres años.
FinanciaciónEl estudio fue realizado con un grant irrestricto del laboratorio Sanofi-Genzyme.
Conflicto de interesesJIR ha recibido apoyo económico para la investigación y en concepto de disertaciones y asistencia a congresos educativos de las siguientes compañías: Bayer, Biogen, Sanofi-Genzyme, Merck, Novartis y Roche and Teva.
EC ha recibido apoyo económico para la investigación y en concepto de disertaciones y asistencia a congresos educativos de las siguientes compañías: Bayer, Biogen, Sanofi-Genzyme, Merck, Novartis y Roche and Teva.
LP ha recibido apoyo económico para la investigación y en concepto de disertaciones y asistencia a congresos educativos de las siguientes compañías: Bayer, Biogen, Sanofi-Genzyme, Merck, Novartis y Roche and Teva.
JFE ha recibido fondos de investigación y honorarios de consultoría de Boehringer Ingelheim, Roche, Bristol Myers Squibb, Sanofi y AbbVie.
CSV no tiene conflictos de intereses que declarar.