La trombólisis intravenosa constituye una terapia de eficacia demostrada para el tratamiento del accidente cerebrovascular isquémico (ACVi). Su complicación más temida es la hemorragia intracerebral (HIC).
ObjetivoEvaluar la utilidad del «HAT Score» para estimar el riesgo de HIC, HIC sintomática (HICs), hemorragia con desenlace fatal final (HDFF) y el pronóstico a 90 días en pacientes con ACVi que recibieron terapia trombolítica (TT) intravenosa.
Materiales y metodosSe aplicó el «HAT Score» a todos los pacientes mayores de 18 años con ACVi que recibieron TT entre el 01/01/2003 hasta el 01/05/2022. Evaluamos la capacidad predictiva de dicha escala mediante las curvas operador receptor (ROC). Se estimó la correlación entre los valores de «HAT Score» y la escala de Rankin modificada (mRS) a los 90 días.
ResultadosSe aplicó la escala a 92 pacientes. La mediana de edad fue de 75 años (CI: 62; CS: 82) y el 51,09% eran mujeres. Se observó un rendimiento de la curva ROC con un corte ≥3 puntos en «HAT Score» de 0,76 (IC del 95%: 0,64-0,88) para la predicción de HIC, de 0,74 (IC del 95%: 0,54-0,93) para HICs y de 0,93 (IC del 95%: 0,83-1) para HDFF. El «HAT Score» representó el 25,25% de la variabilidad explicada en la escala mRS a los 90 días.
ConclusiónEn nuestra población, el «HAT Score» predice de manera adecuada la tasa de cualquier HIC y el pronóstico a 90 días. Esto es de utilidad para identificar a los pacientes que tendrían un riesgo mayor y eventualmente desestimar la trombólisis.
Intravenous thrombolysis is a proven effective therapy for the treatment of ischemic stroke. Its most feared complication is intracranial hemorrhage (ICH).
ObjetiveTo evaluate the usefulness of the «HAT Score» for estimating the risk of ICH, symptomatic ICH (sICH), hemorrhage with final fatal outcome (HFFO) and 90-day prognosis in patients with ischemic stroke who received intravenous thrombolytic therapy (TT).
Materials and methodsThe «HAT Score» was applied to all patients over 18 years old with ischemic stroke who received TT, between 01/01/2003 and 05/01/2022. We evaluated the predictive capacity of this scale with receiver operator curve (ROC). We estimated the correlation between the «HAT Score» values and the modified Rankin scale (mRS) at 90 days.
ResultsThe «HAT Score» was applied to 92 patients. Median age was 75 years old (CI: 62; CS: 82) and 51.09% were women. We observed a ROC curve performance with a cutoff ≥3 points in «HAT Score» of 0.76 (95% CI, 0.64-0.88) for the prediction of ICH, of 0.74 (95% CI, 0.54-0.93) for sICH and 0.93 (95% CI, 0.83-1) for HFFO. The «HAT Score» represented 25.25% of the variability explained in the mRS scale at 90 days.
ConclusionIn our population, the «HAT Score» adequately predict the rate of any ICH and 90-day prognosis. It is a useful tool to identify patients who would be at higher risk and eventually discourage thrombolysis.
El accidente cerebrovascular (ACV) es una afección médica grave que pone en peligro la vida. Representa a nivel mundial la segunda causa más común de mortalidad y discapacidad1.
Existen 2 grandes categorías de ACV, isquémico y hemorrágico, presentando cada uno causas, cuadros clínicos, resultados y estrategias de tratamiento diferentes.
A nivel global el 62% de los ACV son de origen isquémico, siendo este porcentaje considerablemente mayor en países desarrollados, pudiendo alcanzar cifras de hasta el 87%2–4.
En el 2020 una de cada 6 muertes por enfermedad cardiovascular se debió a un ACV. Se estima que en los EE. UU. cada 40s una persona presenta un ACV, y cada 3,5min una fallece por esta causa5,6.
En nuestro país los datos epidemiológicos de la enfermedad cerebrovascular son escasos. En un estudio realizado en nuestro centro, la tasa bruta ajustada a la población nacional de ACV isquémico en mayores de 21 años fue de 43,2 (IC 95%: 42-44) por cada 100.000 habitantes/año7. En otro estudio realizado en la ciudad de Junín, provincia de Buenos Aires, se observó una prevalencia de ACV de 868 casos por cada 100.000 habitantes/año. En base a ello, se estimó una prevalencia global de 473 casos por cada 100.000 habitantes/año. Esta prevalencia aumenta con la edad8. Un estudio más reciente, realizado en la ciudad de Tandil, provincia de Buenos Aires, halló una incidencia para primer ACV isquémico estandarizado para la población argentina de 78,9 casos por cada 100.000 habitantes/año (56,1/100.000, extrapolado a la población mundial)9.
Un estudio epidemiológico (EstEPA) que es llevado a cabo en la ciudad de General Villegas, Buenos Aires, halló en sus primeros resultados una prevalencia del 2% de ACV en personas mayores de 40 años, siendo la cuarta causa de mortalidad en esta población (publicación pendiente).
La administración oportuna del activador tisular del plasminógeno (r-tPA) a pacientes apropiadamente seleccionados, constituye el principal tratamiento temprano en el ACV isquémico10. El objetivo inmediato de la terapia de reperfusión para el ACV isquémico agudo es restaurar el flujo sanguíneo a las regiones del cerebro que están isquémicas pero que aún no han sufrido un infarto. El objetivo a largo plazo es mejorar el resultado mediante la reducción de la discapacidad y la mortalidad relacionada con el ACV.
A pesar de lo descripto, el tratamiento específico del ACV isquémico con r-tPA en nuestro medio es muy bajo. En el registro ARENAS (Argentina, Registro Nacional de Stroke) se observó que en hospitales privados solo el 1,2% de los pacientes con ACV isquémico recibían tratamiento trombolítico. Esto es debido principalmente a que solo una pequeña proporción de pacientes accede en tiempo de ventana terapéutica a centros hospitalarios con capacidad de realizar trombólisis.
Por otro lado, la hemorragia intracerebral (HIC) es la complicación más temida de la realización de trombólisis intravenosa. En ensayos clínicos, las tasas de HIC sintomática fueron del 5 al 7%11,12.
En la actualidad existen diversas escalas para evaluar que pacientes tiene mayor riesgo de HIC posterior a la trombólisis intravenosa y predecir el pronóstico a largo plazo. Entre ellas se encuentra el «HAT Score» (por su acrónimo en inglés «Hemorrhage After Thrombolysis»)13, la cual es aludida en el ultimo consenso nacional sobre ACV isquémico agudo14.
Para el cálculo de la puntuación HAT se requieren las siguientes variables clínicas y de neuroimagen: NIHSS previo al tratamiento (menor a 15: 0 punto; 15-20: 1 punto; mayor a 20: 2 puntos), antecedentes de diabetes mellitus o glucosa sérica basal al ingreso mayor de 200mg/dl (1 punto si presenta alguna de estas 2 características, 0 punto si no presenta ninguna) y presencia de hipodensidad temprana visible en la tomografía computarizada (TC) cerebral inicial (ausencia de hipodensidad: 0 punto, hipodensidad menor de 1/3 del territorio de la arteria cerebral media: 1 punto; hipodensidad mayor o igual a 1/3 del territorio de la arteria cerebral media: 2 puntos). Luego se suman los puntajes individuales y se obtiene un resultado entre 0, riesgo mínimo y 5, riesgo máximo.
La finalidad del «HAT Score» es predecir, de manera rápida y fácil, el riesgo de cualquier hemorragia intracerebral después del r-tPA, incluidas las hemorragias intracerebrales sintomáticas y las hemorragias con desenlace fatal final, y evaluar el resultado funcional en el día 90 posterior a la trombólisis.
El objetivo de este trabajo es evaluar la aplicación del «HAT Score» publicado por Lou et al., para valorar su utilidad en predecir el riesgo de hemorragia intracerebral, hemorragia intracerebral sintomática, hemorragia con desenlace fatal final y pronóstico a 90 días, en los pacientes que presentaron ACV isquémico y recibieron r-tPA IV en el Hospital Privado de Comunidad, de la ciudad de Mar del Plata, Argentina.
Materiales y métodosEl presente estudio, de carácter observacional-retrospectivo, se realizó en el Hospital Privado de Comunidad de la ciudad de Mar del Plata, provincia de Buenos Aires, República Argentina.
Para el mismo se utilizó como población a todos los pacientes consecutivos, mayores de 18 años, desde el 1 de enero de 2003 hasta el 1 de mayo de 2022, que presentaron ACV isquémico agudo y se les realizó trombólisis intravenosa con r-tPA.
Los criterios de inclusión fueron:
- –
Uso de r-tPA en las primeras 3h de comenzado los síntomas.
- –
Cumplir con el protocolo de ensayo NINDS y las pautas de la American Stroke/Heart Association para realización de trombólisis IV15,16.
- –
Presentar TC de cráneo previo a la realización de trombólisis IV.
- –
Presentar TC de cráneo o resonancia magnética nuclear (RMN) de cráneo 24-48h posteriores a la trombólisis.
- –
Realización de neuroimagen (TC o RMN de cráneo) durante las primeras 72h posteriores a la trombólisis si existió un deterioro clínico.
Los criterios de exclusión fueron:
- –
Pacientes que recibieron tratamiento con r-tPA después de 3h de haber comenzado con los síntomas.
- –
Pacientes que se sometieron a una RMN de cráneo, pero no a una TC de cráneo antes del tratamiento con r-tPA.
- –
Pacientes que recibieron agentes antiplaquetarios o anticoagulantes antes de su TC o RMN de cráneo control 24-48h posterior a la trombólisis.
- –
Pacientes tratados con r-tPA intravenoso/intraarterial combinado o r-tPA intraarterial solo.
- –
Pacientes a los cuales se le realizó trombectomía mecánica simultánea o posterior a la administración de r-tPA.
- –
Pacientes en los cuales en la historia clínica no presenten los datos necesarios para calcular el «HAT Score».
El «HAT Score» se calculó retrospectivamente para cada paciente utilizando los datos recopilados en la historia clínica para las siguientes variables clínicas y de neuroimagen: NIHSS previo al tratamiento, antecedentes de diabetes mellitus, glucosa sérica basal y presencia de hipodensidad temprana visible en la TC cerebral inicial.
A su vez se analizaron las neuroimágenes (TC o RMN de cráneo) realizadas a las 24-48h posterior a las trombólisis (control), como así también aquellas realizadas durante las primeras 72h por deterioro clínico del paciente.
Se utilizó el informe oficial de neurorradiología para determinar la presencia y el alcance de la hipodensidad visible en la TC inicial de cráneo y la presencia o ausencia de HIC en las exploraciones de seguimiento.
Se definió hipodensidad en la TC de cráneo como área focal o difusa, que en la inspección visual es menor que la densidad de la sustancia blanca pero mayor que la densidad del LCR, excluyendo áreas de cambios isquémicos crónicos de la sustancia blanca o áreas consideradas crónicas o antiguas y artefactos13.
Las hemorragias en neuroimagen de seguimiento se definieron como hiperdensidad nueva (con respecto a la TC de ingreso) en la TC de cráneo o áreas de efecto de susceptibilidad (pérdida de señal, oscurecimiento) en imágenes T2* en la RMN de cráneo13.
Se definió sangrado cerebral asintomático a todo paciente que presente una imagen sugerente de HIC sin empeoramiento clínico (aumento NIHSS de 3 o menos puntos desde la evaluación inicial).
Sangrado cerebral sintomático se definió como la presencia de HIC en la TC o en la RMN de cráneo, asociada a un aumento de 4 puntos o más en la puntuación NIHSS con respecto a la evaluación inicial. En caso de duda con respecto a si el edema o la hemorragia era la principal patología causante del deterioro clínico, se asumió invariablemente una asociación de la hemorragia con el deterioro para no pasar por alto ningún caso de sangrado sintomático17.
Hemorragia con desenlace fatal final se definió a la muerte durante la hospitalización después del desarrollo de la HIC, tanto aquella provocada directamente por la HIC como indirectamente.
Hemorragia intracerebral se referirá a la suma de las hemorragias intracerebrales asintomáticas, las hemorragias intracerebrales sintomáticas y las hemorragias con desenlace fatal final.
Por otro lado, se evaluó el estado funcional de cada paciente a los 90 días del evento a través de la escala de Rankin modificada (mRS). Para esto se analizó en la historia clínica el control por consultorio a los 3-5 meses de presentado el ACV y se dividió a los pacientes en 3 categorías (de igual modo que el trabajo original de «HAT Score»13): Pronóstico excelente (mRS≤1), bueno (mRS≤2) y catastróficos (mRS≥5).
Toda la información requerida para este trabajo fue extraída de una base de datos electrónica que presenta nuestro servicio (servicio de neurología) con todos los pacientes a los cuales se les realizó tratamiento trobolítico. La información se obtiene partir de una historia clínica informatizada única para cada paciente. Todos los pacientes que reciben trombólisis son recibidos, evaluados y seguidos por el servicio de neurología, que presenta guardia activa las 24h del día, los 365 días del año, lo que permite que todos los pacientes trobolizados sean incorporados a la base de datos, sin omisión de ninguno de ellos.
Análisis estadísticoPara el análisis descriptivo se tuvieron en cuenta las medidas de tendencia central y de distribución de las variables de estudio, donde las de naturaleza cuantitativa se expresan mediante promedios y la desviación estándar para las que presentaron una distribución normal, y aquellas con distribución no normal mediante medianas con su rango intercuartílico respectivo. Las variables cualitativas se presentan en proporciones. En el análisis bivariado se emplea el test de Chi-cuadrado y la regresión logística binaria para las variables categóricas, la prueba t de Student para las variables cuantitativas con distribución normal, y la prueba de Mann-Whitney (no paramétrica) para las variables cuantitativas con distribución no normal, empleando nivel de significación estadística de p<0,05 e intervalos de confianza del 95%.
La eficacia de la escala se analizó mediante estadística de discriminación del área bajo la curva de las características operativas del receptor (ROC). Se describió cuán bien concuerda la escala HAT con los valores observados en nuestra población.
Se considera una predicción ideal a un área bajo la curva ROC de 1, mientras que una predicción no mejor que el azar se asocia con un valor de 0,5.
Se calculó la sensibilidad, la especificidad, el valor predictivo positivo, el valor predictivo negativo, los índices de eficiencia pronóstica (likelihood ratio [LR]), la precisión diagnóstica y el área bajo la curva ROC para los valores de corte de la escala.
Para evaluar la correlación entre los valores de la escala HAT y la puntuación en la escala Rankin modificada a los 90 días se realizó una regresión lineal simple.
Se utilizó para el análisis el programa estadístico Statsdirect y Stata.
PoblaciónEn el Hospital Privado de Comunidad de la ciudad de Mar del Plata, provincia de Buenos Aires, Argentina, se atiende una población cautiva de aproximadamente 60.912 individuos que pertenecen al Instituto Nacional de Servicios Sociales para jubilados y pensionados y a planes prepagos del hospital. Además, es centro de atención de diversas obras sociales.
La población cautiva se compone predominantemente de personas de tercera edad (>65 años) y todos los integrantes de esta se atienden de forma exclusiva en nuestra institución mediante un sistema de capitación (denominado población «cautiva»), tanto para las prácticas ambulatorias como para las de alta complejidad. Cada uno de los pacientes cuenta con una historia clínica computarizada única, con diagnósticos codificados. La capitación es un modo de financiamiento de prestaciones médicas según la cual una obra social paga un monto mensual fijo por paciente a una entidad prestadora de salud, a cambio de servicios previamente pactados. La cápita es el conjunto de personas incluidas en dicho contrato, beneficiarias de dichos servicios.
ResultadosSe incluyó en el estudio a 92 pacientes con ACV isquémico que recibieron terapia trombolítica con r-tPA IV.
Las características demográficas y basales de la población incluida en el análisis se presentan en la tabla 1.
Características demográficas en situación inicial y resultados al alta
| Edad (años), mediana (ci;cs) | 75 (62;82) |
| Sexo femenino, n (%) | 47 (51.09) |
| Antecedentes médicos, n (%) | |
| DBT | 19 (20,65) |
| HTA | 68 (73,91) |
| TBQ | 25 (27,17) |
| DLP | 62 (67,39) |
| IAM | 4 (4,35) |
| ACV previo | 7 (7,61) |
| AIT previo | 5 (5,43) |
| Medicación al ingreso, n (%) | |
| Antiagregación | 25 (27,17) |
| Anticoagulación | 4 (4,35) |
| Valor de glucemia mayor a 200mg/dl al ingreso, n (%) | 2 (2,17) |
| Puntuación NIHSS previo al tratamiento, n (%) | |
| <15 | 53 (57,61) |
| 15-20 | 20 (21,74) |
| >20 | 19 (20,65) |
| Presencia de hipodensidad en la TC de cráneo al ingreso, n (%) | |
| Sin hipodensidad | 71 (77,17) |
| Hipodensidad <a 1/3 del territorio de ACM | 14 (15,22) |
| Hipodensidad ≥ a 1/3 del territorio de ACM. | 7 (7,61) |
| Escala RANKIN modificada a los 3 meses | |
| Excelente (mRS≤1), n (%) | 29 (31,52) |
| Bueno (mRS≤2), n (%) | 41 (44,57) |
| Catastrófico (mRS≥5), n (%) | 21 (22,83) |
ACM: arteria cerebral media; ACV: accidente cerebrovascular; AIT: accidente isquémico transitorio; CI: cuartil inferior; CS: cuartil superior; DBT: diabetes mellitus; DLP: dislipemia; HTA: hipertensión arterial; IAM: infarto agudo de miocardio; mRS: escala de Rankin modificada; NIHSS: puntuación de la escala de accidente cerebrovascular de los Institutos Nacionales de Salud; TBQ: tabaquismo; TC: tomografía computarizada.
La mediana de edad fue 75 años (cuartil inferior [CI]: 62; cuartil superior [CS]: 82) y el 51,09% eran mujeres.
El 20,65% de los pacientes presentaba antecedentes de DBT y el 2,17% presentaba una glucemia basal al ingreso mayor a 200mg/dl.
La mediana de la puntuación NIHSS al ingreso fue de 14 (CI: 9; CS: 18,5). El 57,6% de los pacientes presentaba un NIHSS menor a 15, el 21,74% entre 15 y 20, y el 20,65% mayor o igual a 20.
Con respecto a la TC previa al tratamiento trombolítico, el 77,18% no presentaban hipodensidad, el 15,22% presentaba una hipodensidad menor a 1/3 del territorio de la arteria cerebral media, y un 7,6% presentaba hipodensidad mayor o igual a un 1/3 del territorio de la arteria cerebral media.
La mediana en la puntuación de la escala «HAT Score» previo al tratamiento fue de 1 (CI: 0; CS: 2).
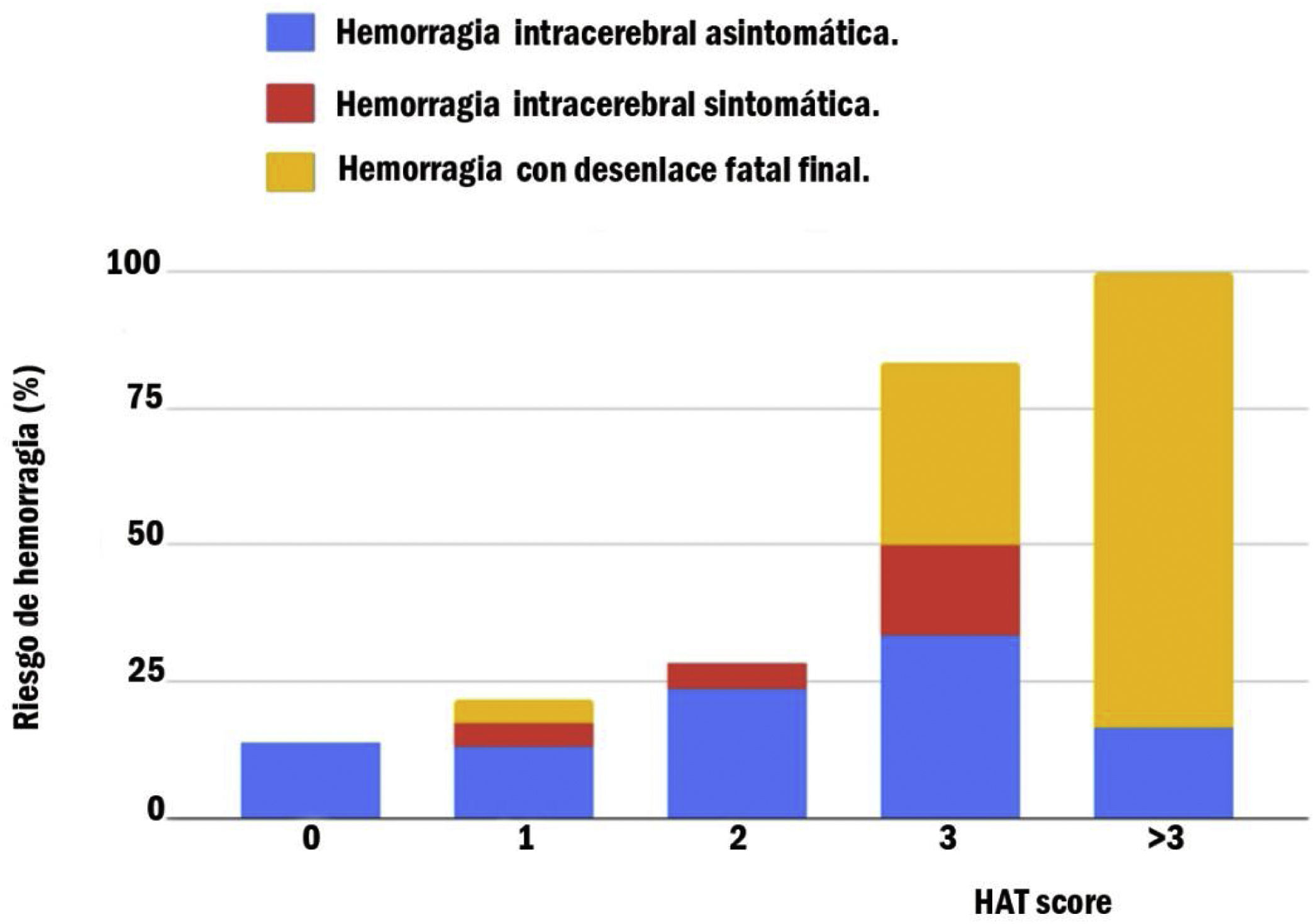
Posterior a la trombólisis con r-tPA el 29,34% de los pacientes presento HIC. De estos pacientes el 11,11% presentaron HIC sintomática (3,26% del total de pacientes) y el 29,63% hemorragia con desenlace fatal final (8,7% del total de pacientes) (tabla 2).
Hemorragia intracerebral posterior a tratamiento trombolítico con r-tPA
| HAT Score, n | ||||||
|---|---|---|---|---|---|---|
| Pacientes, n | 0 | 1 | 2 | 3 | >3 | |
| Todos los pacientes, n | 92 | 36 | 23 | 21 | 6 | 6 |
| Todas las hemorragias intracerebrales | 27 | 5 | 5 | 6 | 5 | 6 |
| Hemorragia intracerebral asintomática | 16 | 5 | 3 | 5 | 2 | 1 |
| Hemorragia intracerebral sintomática | 3 | 0 | 1 | 1 | 1 | 0 |
| Hemorragia con desenlace fatal final | 8 | 0 | 1 | 0 | 2 | 5 |
Al realizar el análisis de la curva ROC observamos un rendimiento de la escala «HAT Score» (con un valor de corte mayor o igual a 3 puntos) para evaluar la asociación con HIC de 0,76 (IC del 95%: 0,64-0,88) (fig. 1), con una sensibilidad del 40,74% (IC del 95%: 24,51-59,27), una especificidad del 98,46% (IC del 95%: 91,79-99,73), un valor predictivo positivo del 91,67% (IC del 95%: 64,61-98,51), un valor predictivo negativo del 91,67% (IC del 95%: 64,61-98,51), un índice de eficiencia pronóstica positivo (LR+) del 26,48% (IC del 95%: 2,88-243,6), un índice de eficiencia pronóstica negativo (LR−) del 0,60% (IC del 95%: 0,53-0,68) y una precisión diagnostica del 81,52% (IC del 95%: 72,39-88,13).
Para la evaluación del riesgo de HIC sintomática, observamos un rendimiento de la escala «HAT Score» (con un valor de corte mayor o igual a 3 puntos) en la curva ROC de 0,74 (IC del 95%: 0,54-0,93) (fig. 2), con una sensibilidad del 33,33% (IC del 95%: 6,15-79,23), una especificidad del 87,64% (IC del 95%: 79,21-92,96), un valor predictivo positivo del 8,33% (IC del 95%: 1,49-35,39), un valor predictivo negativo del 97,5% (IC del 95%: 91,34-99,31), un LR+ del 2,7% (IC del 95%: 0,05-162,4), un LR− del 0,76% (IC del 95%: 0,28-2,03) y una precisión diagnostica de 85,87% (IC del 95%: 77,31-91,55).
Por último observamos un rendimiento de la escala «HAT Score» (con un valor de corte mayor o igual a 3 puntos) para evaluar la asociación con hemorragia con desenlace fatal final de 0,93 (IC del 95%: 0,83-1) (fig. 3), con una sensibilidad del 87,5% (IC del 95%: 52,91-97,76), una especificidad del 94,05% (IC del 95%: 86,81-97,43), un valor predictivo positivo del 58,33% (IC del 95%: 31,95-80,67), un valor predictivo negativo del 98,75% (IC del 95%: 93,25-99,78), un LR+ del 14,7% (IC del 95%: 9,54-22,64), un LR− del 0,13% (IC del 95%: 0,02-0,95) y una precisión diagnostica del 93,48% (IC del 95%: 86,49-96,98) (tabla 3).
Escala «HAT SCORE» para predicción de hemorragia intracerebral, hemorragia intracerebral sintomática y hemorragia con desenlace fatal final, posterior a tratamiento trombolítico
| Aplicación | VE | S (%) | E (%) | VPP (%) | VPN (%) | LR+ (%) | LR− (%) | Precisión diagnóstica (%) | Curva ROC (%) |
|---|---|---|---|---|---|---|---|---|---|
| Hemorragia intracerebral | ≥3 | 40,74 (24,51-59,27) | 98,46 (91,79-99,73) | 91,67 (64,61-98,51) | 80 (69,95-87,3) | 26,84 (2,88-243,6) | 0,60 (0,53-0,68) | 81,52 (72,39-88,13) | 0,76 (0,64-0,88) |
| Hemorragia intracerebralSintomática | ≥3 | 33,33 (6,15-79,23) | 87,64 (79,21-92,96) | 8,33 (1,49-35,39) | 97,5 (91,34-99,31) | 2,7 (0,05-162,4) | 0,76 (0,28-2,03) | 85,87 (77,31-91,55) | 0,74 (0,54-0,93) |
| Hemorragia con desenlace fatal final | ≥3 | 87,5 (52,91-97,76) | 94,05 (86,81-97,43) | 58,33 (31,95-80,67) | 98,75 (93,25-99,78) | 14,7 (9,54-22,64) | 0,13 (0,02-0,95) | 93,48 (86,49-96,98) | 0,93 (0,83-1) |
Curva ROC: curva característica operativa del receptor; E: especificidad; LR: índice de eficiencia pronóstica (likelihood ratio); S: sensibilidad; VE: valor escala; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Como se muestra en la figura 4, el riesgo de HIC posterior a trombólisis con r-tPA aumentó con el incremento de la puntación en la escala «HAT Score». Para una puntación de «HAT Score» de 0, el riesgo de HIC sintomática o hemorragia con desenlace fatal final fue 0, mientras que, si la puntuación era mayor a 3, el riesgo de hemorragia con desenlace fatal final era de 83,33%.
En cuanto al pronóstico a los 90 días, el 31,52% presento un pronóstico excelente (mRS≤1), el 44,57% un pronóstico bueno (mRS≤2) y el 22,83% un pronóstico catastrófico (mRS≥5).
En la regresión lineal simple que correlaciona el puntaje de «HAT Score» como predictor del mRS a los 90 días, los resultados mostraron que hubo una relación estadísticamente significativa entre HAT y mRS a 90 días (t=5,10; p<0,0001) y el «HAT Score» representó el 25,25% de la variabilidad explicada en la escala mRS a los 90 días. Se encontró que la ecuación de regresión es: mRS previsto=1,91+0,006 (HAT).
Por último, se comparó de manera indirecta nuestra población con la población original utilizada para desarrollar el «HAT Score»13, no encontrándose diferencias estadísticamente significativas en sexo, edad, ni en ninguna de las variables utilizadas para calcular el «HAT Score» (antecedentes de diabetes, glucemia mayor a 200 al ingreso, NIHSS al ingreso e hipodensidad en tomografía de ingreso).
DiscusiónEn febrero del año 2008 Lou et al. publicaron «The HAT Score»13, una escala de clasificación para predecir el riesgo de hemorragia intracerebral y el pronóstico a 90 días, después del tratamiento trombolítico con r-tPA IV en pacientes con ACV isquémico agudo.
La escala es corta, rápida y sencilla de realizar. Incluye 4 variables que consisten en valor de glucemia al ingreso, antecedente de diabetes, presencia o ausencia de hipodensidad en TC inicial y valor de NIHSS previo al tratamiento. Todos estos elementos son parte de las evaluaciones clínicas de rutina, previa al tratamiento, en pacientes candidatos a r-tPA, que se pueden determinar fácil y rápidamente al lado de la cama. A cada variable se le suma un valor, luego se sumarán los puntajes individuales y se obtendrá un resultado entre 0, riesgo mínimo y 5, riesgo máximo. El objetivo de nuestro estudio fue aplicar dicha escala en nuestro medio, para evaluar si puede ser utilizada para predecir, de manera confiable, el riesgo de HIC, incluyendo HIC sintomáticas y hemorragias con desenlace fatal final, y el pronóstico a los 90 días medido a través de la escala de mRS.
Para ello evaluamos la aplicabilidad de la escala «HAT Score» mediante la discriminación del área bajo la curva ROC, en los pacientes que recibieron tratamiento trombolítico en el Hospital Privado de Comunidad de la ciudad de Mar del Plata.
Teniendo en cuenta el área bajo la curva, en nuestro medio, el «HAT Score» puede predecir razonablemente el riesgo de cualquier HIC, incluida la HIC sintomática y la hemorragia con desenlace fatal final.
En nuestra población, presentando un puntaje HAT de 0, el riesgo de HIC sintomática o hemorragia con desenlace fatal final fue de 0, mientras que, si presentaba un valor de HAT mayor a 3, el riesgo de hemorragia con desenlace fatal final fue del 83,33%.
La aplicación del «HAT Score» en nuestra población para la estimación de hemorragia con desenlace fatal final resultó de mayor utilidad en comparación con la obtenida en el estudio original «The HAT Score» (curva ROC: 0,93 [IC del 95%: 0,83-1] vs. 0,79 [IC del 95%: 0,70-0,88]). Se observo a su vez una mayor utilidad en nuestra población para predecir HIC post trombólisis (curva ROC 0,76 [IC del 95%: 0,64-0,88] vs. 0,72 [IC del 95%: 0,65-0,79]). Con respecto a HIC sintomática se obtuvo un rendimiento similar en ambas poblaciones (curva ROC: 0,74 [IC del 95%: 0,54-0,93] vs. 0,74 [IC del 95%: 0,63-0,84]).
En cuanto a la predicción del pronóstico a 90 días, la escala mostró una utilidad muy buena en nuestra población, representando el «HAT Score» el 25,25% de la variabilidad explicada en la escala mRS a los 90 días.
El «HAT Score» podría ser útil para identificar a los pacientes con alto o bajo riesgo de presentar HIC sintomática o hemorragia con desenlace fatal final, lo que permitiría un asesoramiento individualizado de pacientes y familiares para tomar una decisión informada sobre los riesgos potenciales de la trombólisis y el pronóstico a 90 días.
Según nuestros resultados, los pacientes con puntuación mayor a 3 tienden a tener tasas más altas de hemorragia con desenlace fatal final y resultados catastróficos a los 90 días. Por otro lado, la puntuación de 0 puede asegurar a los médicos, familiares y pacientes que el riesgo de HIC sintomática o hemorragia con desenlace fatal final es bajo y que el pronóstico a 90 días es óptimo, lo que podría estimular el tratamiento con r-tPA.
Es fundamental tener en cuenta que la puntuación HAT por sí sola no debe usarse para suspender el tratamiento si se considera apropiado. Es importante considerar que otras variables iniciales, como el tiempo desde que comienza el primer síntoma hasta que se inicia el tratamiento, puede modificar el grado de beneficio del r-tPA y su impacto sobre el resultado final, y dicha variable, entre otras, no se incorporan en el «HAT Score».
Si bien existen otras escalas para valorar el riesgo de HIC postrombólisis y el pronóstico alejado18-21, el «HAT Score» presenta como ventajas lo rápida y sencilla de realizar, sumado a su buena capacidad de predicción, lo que permite que médicos de guardia, especialistas o no en neurología, puedan realizarla y ayudar a la toma de decisiones.
Más allá de los resultados obtenidos, debemos mencionar algunas limitaciones. Entre ellas el bajo número de HIC sintomáticas encontradas, lo que aumenta el intervalo de confianza de este análisis.
Por otro lado debe tenerse en cuenta que la escala «HAT Score» original se validó en pacientes que recibieron r-tPA EV dentro de las primeras 3h, por lo que la aplicación que buscamos instrumentar también se restringió a este tipo de pacientes, quedando excluidos los pacientes que recibieron tratamiento entre 3 y 4,30h posteriores al inicio de los síntomas (ventana extendida), y aquellos que recibieron r-tPA intraarterial o a los cuales se les realizo trombectomía mecánica simultánea o posterior a la administración de r-tPA.
En conclusión, en nuestra población, la escala «HAT Score» puede predecir razonablemente la tasa de cualquier HIC y el resultado funcional en el día 90 después de la administración de r-tPA, demostrando un riesgo diferente para las diferentes categorías de la escala. Los resultados indican que en nuestro medio la escala sería de utilidad para ayudar a decidir sobre que pacientes tendrían mayor riesgo de HIC sintomática o hemorragia con desenlace fatal final y peor pronóstico a los 90 días y eventualmente desalentar la terapia trombolítica o, por el contrario, aquellos pacientes con bajo riesgo y buen pronóstico donde permitirá promover el tratamiento trombolítico. Se requieren estudios prospectivos con un número mayor de pacientes para la confirmación de estos hallazgos.
Consideraciones éticasEl presente estudio fue evaluado y aprobado por el Consejo Institucional de Revisión de Estudios de Investigación (CIREI) del Hospital Privado de Comunidad (HPC) de Mar del Plata.
FinanciaciónLos autores declaran no haber recibido financiación para la realización de este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Trabajo presentado en el 59° Congreso Argentino de Neurología, estando ternado como «Trabajo a Premio».